用于改善皮肤的组合物的制作方法
1.本发明涉及促进皮肤的胶原蛋白生成从而实现皮肤的改善的组合物。
背景技术:
2.缩醛磷脂为具有抗氧化作用的磷脂中的一种,是甘油磷脂之一。缩醛磷脂存在于哺乳动物的所有组织中,占人体的磷脂的约18%,已知在脑神经、心肌、骨骼肌、白细胞、精子中特别多。
3.已知该缩醛磷脂具有促进神经发生的作用、抑制由脂多糖(lps)导致的神经炎症的作用、抑制脑内淀粉样β(aβ)蛋白的蓄积的作用等,据称其在阿尔茨海默病、帕金森氏病、抑郁症、精神分裂症等脑神经病中具有效果。例如,在非专利文献1中,报道了在经口施予了来自扇贝的纯化缩醛磷脂的患者中改善轻度阿尔茨海默病的记忆功能。
4.另一方面,胶原蛋白为构成皮肤的真皮、骨等的蛋白质之一,占生物体的全部蛋白质的约30%。作为真皮的主成分的间质成分主要由i型及iii型胶原蛋白构成,尤其i型胶原蛋白为构成间质成分的主要的胶原纤维。
5.已知该胶原蛋白随着年龄增长而减少,成为肌肤的弹性、弹力丧失、皱纹、松弛的主要因素,因此,在美容业界等中,积极进行了用于保护、维持胶原蛋白的研究。
6.在如上所述的情况下,迄今为止几乎没有进行关于缩醛磷脂对皮肤的胶原蛋白的影响的研究。
7.现有技术文献
8.非专利文献
9.非专利文献1:fujino t.等人,“efficacy and blood plasmalogen changes by oral administration of plasmalogen in patients with mild alzheimer's disease and mild cognitive impairment:a multicenter,randomized,double-blind,placebo-controlled trial”ebiomedicine,[17](2017)199-205
技术实现要素:
[0010]
发明所要解决的课题
[0011]
本发明的课题在于提供具有优异的促进胶原蛋白生成的效果的组合物。
[0012]
用于解决课题的手段
[0013]
本技术的发明人为解决上述课题而进行了深入研究,结果发现,缩醛磷脂对促进胶原蛋白的生成发挥优异的效果,从而完成了本发明。具体而言,发现:缩醛磷脂促进作为构成真皮的主要细胞的人成纤维细胞、及人毛囊外根鞘细胞的ampk(amp-activated protein kinase,amp活化蛋白激酶)的磷酸化,促进有助于i型胶原蛋白(其占皮肤的胶原蛋白的90%并且存在于真皮组织中)的产生的col1a1(collagen type i alpha 1chain)的表达,并且抑制作为促进胶原蛋白降解的基因的mmp1的表达。
[0014]
即,本发明如下所述。
[0015]
[1]用于改善皮肤的组合物,其特征在于,含有缩醛磷脂。
[0016]
[2]用于改善皮肤的弹性的组合物,其特征在于,含有缩醛磷脂。
[0017]
[3]用于改善皮肤的皱纹的组合物,其特征在于,含有缩醛磷脂。
[0018]
[4]用于改善皮肤的松弛的组合物,其特征在于,含有缩醛磷脂。
[0019]
[5]用于促进胶原蛋白生成的组合物,其特征在于,含有缩醛磷脂。
[0020]
[6]如上述[1]~[5]中任一项所述的组合物,其特征在于,前述缩醛磷脂为从动物组织提取的缩醛磷脂。
[0021]
[7]如上述[6]所述的组合物,其特征在于,前述动物组织为选自贝类、海鞘及鸟类中的动物的组织。
[0022]
[8]如上述[6]或[7]所述的组合物,其特征在于,前述动物组织为扇贝类的组织。
[0023]
发明效果
[0024]
本发明的组合物具有优异的促进胶原蛋白生成的效果。
附图说明
[0025]
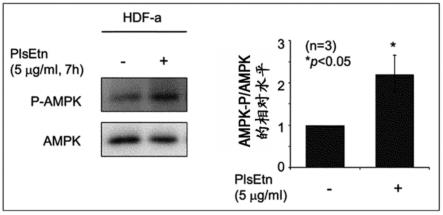
[图1]为示出由缩醛磷脂(plsetn)(5μg/ml,7小时)处理引起的、hdf-a细胞(人类成人成纤维细胞)中的ampk的磷酸化促进(相对于ampk而言的phospho-ampk的相对量)的结果的图。
[0026]
[图2]为示出由缩醛磷脂(plsetn)(5μg/ml,7小时)处理引起的、hhorsc细胞(人毛囊外根鞘细胞)中的ampk的磷酸化促进(相对于ampk而言的phospho-ampk的相对量)的结果的图。
[0027]
[图3]为示出由缩醛磷脂(plsetn)(0.5μg/ml,3小时)处理引起的、hdf-a细胞(人成纤维细胞)中的ampk的磷酸化促进(相对于ampk而言的phospho-ampk的相对量)的结果的图。
[0028]
[图4]为示出由从大豆提取的磷脂酰乙醇胺(ptdetn)(0.5μg/ml,3小时)处理引起的、hdf-a细胞(人成纤维细胞)中的ampk的磷酸化促进(相对于ampk而言的phospho-ampk的相对量)的结果的图。
[0029]
[图5]为示出经缩醛磷脂(plsetn)处理的hdf-a细胞内的缩醛磷脂含量随培养时间的变化的结果的图。
[0030]
[图6]为示出经缩醛磷脂(plsetn)处理的hdf-a细胞内的缩醛磷脂的按种类区分的含量(按构成缩醛磷脂的脂肪酸的种类区分的含量)随培养时间的变化的结果的图。
[0031]
[图7]为示出由缩醛磷脂(plsetn)处理引起的、hdf-a细胞的col1a1的mrna的表达结果的图。
[0032]
[图8]为示出由缩醛磷脂(plsetn)处理引起的、hdf-a细胞的作为促进胶原蛋白降解的基因的mmp1的mrna的表达结果的图。
[0033]
[图9]为示出由缩醛磷脂(plsetn)处理引起的、hdf-a细胞的col1a1的mrna的表达结果的图。
[0034]
[图10]为示出由缩醛磷脂(plsetn)处理引起的、小鼠皮肤中的col1a1的mrna的表达结果的图。
具体实施方式
[0035]
本发明的组合物的特征在于含有缩醛磷脂。
[0036]
本发明的组合物促进作为构成真皮的主要细胞的人成纤维细胞等的ampk的磷酸化,促进有助于i型胶原蛋白的产生的col1a1的表达,并且抑制作为促进胶原蛋白降解的基因的mmp1的表达,由此促进胶原蛋白的生成,能够实现因年龄增长、紫外线等的影响而劣化的皮肤状态的恢复、皮肤状态的维持。
[0037]
即,本发明的含有缩醛磷脂的组合物可以用作用于ampk活化的组合物、用于促进胶原蛋白生成的组合物、用于改善皮肤的组合物。此处,作为本发明中的皮肤改善,具体而言,可以举出皮肤的弹性(弹力)的降低抑制(维持)及/或提高、皮肤的皱纹的增加抑制及/或减少、皮肤的松弛的抑制及/或减少等。因此,本发明的组合物可以用作用于改善皮肤的弹性的组合物、用于改善皮肤的皱纹的组合物、用于改善皮肤的松弛的组合物。
[0038]
本发明中使用的缩醛磷脂为具有抗氧化作用的磷脂中的一种,是甘油磷脂之一。其为甘油磷脂中特有的亚类,以在甘油骨架的sn-1位具有乙烯醚键为表征,在许多哺乳类动物的组织的细胞膜中以高浓度被确认到。作为缩醛磷脂,优选在sn-2位具有脂肪酸酯键的缩醛磷脂。
[0039]
本发明中使用的缩醛磷脂只要是通常被分类为缩醛磷脂的物质,就没有特别限制,例如,可以举出胆碱型缩醛磷脂、乙醇胺型缩醛磷脂、肌醇型缩醛磷脂、丝氨酸型缩醛磷脂。它们之中,优选胆碱型缩醛磷脂、乙醇胺型缩醛磷脂,特别优选乙醇胺型缩醛磷脂。
[0040]
本发明的缩醛磷脂可以从动物组织提取。作为动物组织,只要为包含缩醛磷脂的动物组织,就没有特别限制,可以举出贝类、海鞘、海参、鲑鱼、秋刀鱼、鲣鱼等水生动物、鸟类等。它们之中,优选贝类、海鞘、鸟类,特别优选贝类。作为使用的部位,优选食用部位(可食部位)。这些动物组织可以为切断物,但从能够更高效地提取缩醛磷脂的方面考虑,优选使用粉碎物。
[0041]
作为贝类,可以例示扇贝类、贻贝、鲍鱼等食用的双壳贝、螺,特别优选扇贝类。扇贝类是属于扇贝科的食用的双壳贝,例如,可以举出属于mizuhopecten属、海扇(pecten)属的扇贝类。具体而言,可以举出在日本采收的虾夷扇贝(学名:mizuhopecten yessoensis)、在欧洲采收的欧洲大扇贝(学名:pectenmaximus(linnaeus))等。作为食用部位,可以举出贝柱、裙边等。
[0042]
海鞘是属于真海鞘科的食用的脊索动物,可以举出属于真海鞘属、红海鞘属的海鞘。具体而言,可以举出真海鞘(学名:halocynthia roretzi)、红海鞘(学名:halocynthia aurantium)等。作为食用部位,可以举出身体的部分(鳃囊)。
[0043]
鸟类只要是食用的鸟类,就没有特别限制,例如,可以举出鸡、乌鸡、鸭等。作为食用部位,优选富含缩醛磷脂的胸肉。
[0044]
缩醛磷脂的提取可以使用水、有机溶剂、含水有机溶剂来进行,优选并用酶处理。例如,可以举出乙醇提取法、己烷提取法,优选为乙醇提取法。
[0045]
作为乙醇提取法,只要为使用乙醇(包括含水乙醇)进行提取的方法,就没有特别限制,例如,可以举出日本特开2019-140919号公报、日本特开2018-130130号公报、日本再表2012-039472号公报、日本特开2010-065167号公报、日本特开2010-063406号公报等中记载的方法。
yessoensis)进行提取并利用hplc纯化而得到的乙醇胺型缩醛磷脂。
[0062]
[细胞培养]
[0063]
作为人成纤维细胞,使用human dermal fibroblasts-adult(hdf-a)细胞(#2320),作为人毛囊外根鞘细胞,使用human hair outer root sheath(hhorsc)细胞(#2420)。它们是从sciencell research laboratories购入的。hdf-a细胞在成纤维细胞培养基(fibroblast medium)(fm,#2301)中培养,hhorsc细胞在间充质干细胞培养基(mesenchymal stem cell medium)(mscm,#7501)中培养。任意的细胞均在实验中使用了传代次数10次以内的细胞。
[0064]
对于自前一天起培养的hdf-a细胞,在900μl的fm、与预先通过超声波处理将plsetn(0.5μg或5μg)悬浮于100μl的opti-mem
tm
减血清培养基(reduced serum medium)(themofisher,#22600050)中而得到的plsetn溶液的混合培养基中培养规定时间(3小时或7小时)。
[0065]
对于hhorsc细胞,除了使用mscm来代替fm以外,也同样地操作,在5μg/ml的plsetn的存在下培养7小时。
[0066]
另外,使用在不含plsetn的相同组成的培养基中进行了培养的细胞(hdf-a细胞及hhorsc细胞)作为对照。
[0067]
另外,除了使用从大豆提取的磷脂酰乙醇胺(ptdetn)来代替plsetn以外,同样地操作,在0.5μg/ml的ptdetn的存在下将hdf-a细胞培养3小时。
[0068]
将细胞用磷酸缓冲液(pbs)清洗并回收。在将经清洗的细胞于培养极低温冰箱中保存之后检测rna表达水平。
[0069]
[ampk的磷酸化分析]
[0070]
利用缓冲液a(0.25m蔗糖,10mm hepes-koh,ph 7.5,1mm edta,蛋白酶抑制剂混合物(protease inhibitor cocktail))回收hdf-a细胞,进行离心。将所得到的细胞悬浮于缓冲液a中,通过超声波处理使其破碎,进行蛋白质定量之后,用等量蛋白质进行电泳。接着,转印至pvdf膜,通过使用了phospho-ampkα(thr172)抗体(cell signaling technology,#2535s)和ampkα抗体(cell signaling technology,#58315)的western印迹法进行检测。信号利用multi gauge software version 3.0软件(fuji film)进行定量。通过将由phospho-ampkα(thr172)抗体得到的信号除以由ampkα抗体得到的信号而进行标准化。进一步地,将从未处理的细胞得到的值作为1,将进行了各处理的细胞中的信号强度以相对值表示。试验进行3次以上,用平均值和标准偏差表示。
[0071]
对hhorsc细胞也进行同样的分析。
[0072]
图1中示出在5μg/ml的plsetn的存在下培养了7小时的hdf-a细胞中的ampk的磷酸化促进效果(相对于ampk而言的phospho-ampk的相对量)的结果。图2中示出在5μg/ml的plsetn的存在下培养了7小时的hhorsc细胞中的ampk的磷酸化促进效果(相对于ampk而言的phospho-ampk的相对量)的结果。另外,图3中示出在0.5μg/ml的plsetn的存在下培养了3小时的hdf-a细胞中的ampk的磷酸化促进效果(相对于ampk而言的phospho-ampk的相对量)的结果。图4中示出在从大豆提取的0.5μg/ml的ptdetn的存在下培养了3小时的hdf-a细胞中的ampk的磷酸化促进效果(相对于ampk而言的phospho-ampk的相对量)的结果。
[0073]
如图1所示,在5μg/ml的plsetn的存在下培养了7小时的hdf-a细胞中,与在不存在
plsetn的条件下进行了培养的细胞相比,ampk的活化所必需的ampkα的磷酸化亢进。另外,如图2所示,在hhorsc细胞中也获得了与hdf-a细胞同样的结果。
[0074]
根据以上的结果,可认为plsetn对于包括hdf-a细胞、hhorsc细胞的多种细胞具有促进ampk的磷酸化的作用。
[0075]
另外,如图3所示,在0.5μg/ml的plsetn的存在下培养了3小时的hdf-a细胞中,确认到ampk的磷酸化的亢进,而如图4所示,在0.5μg/ml的ptdetn的存在下,未确认到ampk的磷酸化的亢进。
[0076]
[细胞内的plsetn含量的变化测定]
[0077]
对在plsetn的存在下进行了培养的hdf-a细胞内的缩醛磷脂含量及其种类进行确认。
[0078]
图5中示出hdf-a细胞内的缩醛磷脂含量随培养时间的测定结果。另外,图6中示出hdf-a细胞内的缩醛磷脂的按种类区分的含量(按构成缩醛磷脂的脂肪酸的种类区分的含量)随培养时间的测定结果。
[0079]
如图5及图6所示,在0.5μg/ml的plsetn的存在下进行了培养的情况下,hdf-a细胞的缩醛磷脂总量、以及具有c16:0、c18:0、或c18:1的脂肪族醇的缩醛磷脂量没有变化。
[0080]
根据以上的结果,可推测并非发生hdf-a细胞的plsetn的量或质的变化,而是plsetn针对未鉴定的受体作为配体发挥功能,促进ampk的磷酸化。
[0081]
[hdf-a细胞中的col1a1及mmp1的mrna定量]
[0082]
ampk(amp活化蛋白激酶)的磷酸化亢进会促进作为烟酰胺腺嘌呤二核苷酸(nad)的合成限速酶的烟酰胺磷酸核糖转移酶(nampt)依赖性的nad的合成。其结果是,可期待以nad为底物的nad依赖性去乙酰化酶(nad-dependent deacetylase sirtuin)-1(sirt1)的活化。因此,对编码sirt1依赖性的i型胶原蛋白的构成蛋白质之一的col1a1及编码作为胶原蛋白降解酶的基质金属蛋白酶-1的mmp1的基因表达进行检测。
[0083]
将hdf-a细胞如上述那样培养7小时,使用trizol提取rna。接着,使用primescript rt master mix制备1st strand cdna,使用tb green premix ex taq ii,利用mx3000p qpcr(stratagene),通过实时pcr检测靶标基因及内源性对照基因的mrna表达。试验进行3次以上。除了作为靶标基因的col1a1及mmp1以外,还选择18s核糖体rna(18s rrna)作为内源性对照基因。以下记载各基因的mrna检测用引物。
[0084]
col1a1 1184fw:5
’‑
gtgctaaaggtgccaatggt-3’,
[0085]
col1a1 1311rv:5
’‑
accaggttcaccgctgttac-3’,
[0086]
mmp1 141fw:5
’‑
tgggaggcaagttgaaaagc-3’,
[0087]
mmp1 275rv:5
’‑
catctgggctgcttcatcac-3’,
[0088]
18s rrna fw:5
’‑
agtccctgccctttgtacaca-3’,
[0089]
18s rrna rv:5
’‑
cgatccgagggcctcacta-3’[0090]
图7中示出hdf-a细胞的col1a1的mrna的表达结果。图8中示出hdf-a细胞的mmp1的mrna的表达结果。
[0091]
如图7及图8所示,与未添加plsetn的对照相比,在plsetn的存在下,促进了col1a1的表达,抑制了mmp1的表达。因此,可认为plsetn能够促进皮肤的胶原蛋白生成从而实现皮肤的改善。
[0092]
[hdf-a细胞中的col1a1的mrna定量]
[0093]
作为乙醇胺型缩醛磷脂(plsetn),使用与上文同样地从虾夷扇贝提取的乙醇胺型缩醛磷脂、和与虾夷扇贝同样地用乙醇从贻贝(学名:mytilus linnaeus)提取并利用hplc纯化而得到的乙醇胺型缩醛磷脂。
[0094]
hdf-a细胞的培养、rna的提取及实时pcr通过与上文同样的方法进行。
[0095]
图9中示出由来自虾夷扇贝及贻贝的plsetn引起的hdf-a细胞的col1a1的mrna的表达结果。在添加了从任意组织提取的plsetn的情况下,与未添加plsetn的对照相比,均促进了col1a1的表达。
[0096]
[小鼠皮肤中的col1a1的mrna定量]
[0097]
在涂布了缩醛磷脂的小鼠的皮肤中,对col1a1的表达进行检测。
[0098]
使用了7周龄的雄性c3h小鼠。对小鼠进行预饲养,在8周龄时,利用动物用剪毛器将背侧皮肤的体毛剃掉,利用脱毛膏进行脱毛。脱毛后,自48小时后开始涂布包含10mg/ml plsetn(来自虾夷扇贝)的70%etoh溶液。涂布的频率为5次/周并设定为4周,涂布量设定为20μl/cm2。另外,作为对照,以同样的频率及涂布量涂布不含缩醛磷脂的70%etoh溶液。对于各处理区,设定为小鼠各3只。
[0099]
经过4周后,利用剪刀将从涂布了对照溶液及10mg/ml plsetn的小鼠得到的涂布部位的皮肤切片制成小片,使用trizol提取rna。接着,使用primescript rt master mix制备1st strand cdna。然后,使用tb green premix ex taq ii,利用abi 7500(applied biosystems),通过实时pcr检测作为靶标基因的col1a1及作为内源性对照基因的gapdh的mrna表达。以下记载各基因的mrna检测用引物。
[0100]
mmcol1a1 2818fw:5
’‑
cctcagggtattgctggaca-3’,
[0101]
mmcol1a1 2930rv:5
’‑
gaaggaccttgtttgccagg-3’,
[0102]
mmgapdh qrtfw:5
’‑
tggtgaaggtcggtgtgaac-3’,
[0103]
mmgapdh qrtrv:5
’‑
caatgaaggggtcgttgatgg-3’[0104]
图10中示出小鼠的col1a1的mrna的表达结果。
[0105]
如图10所示,与未添加plsetn的对照相比,在plsetn的存在下,促进了col1a1的表达。因此,可认为plsetn能够促进皮肤的胶原蛋白生成从而实现皮肤的改善。
[0106]
[人皮肤中的缩醛磷脂的效果的验证]
[0107]
对由缩醛磷脂的经口摄取带来的、人皮肤中的效果进行验证。
[0108]
以担忧肌肤粗糙的20多岁~80多岁的9名女性为对象,使其以1天2粒~4粒的量摄取含有来自虾夷扇贝的缩醛磷脂(0.5mg)的片剂,关于相对于摄取前的肌肤症状而言的缩醛磷脂摄取后的变化,进行问卷调查。问卷调查通过下述的5级评价来进行。
[0109]
5分:变得相当好
[0110]
4分:稍微变好
[0111]
3分:无变化
[0112]
2分:稍微变差
[0113]
1分:变得相当差
[0114]
表1中示出与由缩醛磷脂的摄取引起的肌肤症状的变化有关的问卷调查结果。
[0115]
[表1]
[0116][0117]
※
上述以外的4名回答为“3分:无变化”[0118]
如表1所示,摄取了缩醛磷脂的受试者中,一半以上回答为“5分:变得相当好”或“4分:稍微变好”。另外,不存在回答为“2分:稍微变差”或“1分:变得相当差”的受试者。
[0119]
因此可知,通过经口摄取缩醛磷脂,能够实现皮肤的改善。
[0120]
实施例2
[0121]
[配合例1]
[0122]
通过以下所示的配合而制造化妆水(100g)。
[0123]
扇贝提取缩醛磷脂
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0.5mg
[0124]
甘油
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0.5mg
[0125]
纯化水
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
余量
[0126]
[配合例2]
[0127]
通过以下所示的配合而制造硬胶囊剂。
[0128][0129]
产业上的可利用性
[0130]
本发明的组合物可以以外用剂或经口剂的形式使用,在产业上有用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1