一种氯化血根碱在制备砷致肝损伤药物或保健品方面的应用的制作方法
1.本发明涉及药物应用领域,具体涉及一种氯化血根碱在制备砷致肝损伤药物或保健品方面的应用。
背景技术:
2.砷作为一种自然存在的环境毒物和致癌物,很容易通过食物、水和职业污染进入人类和动物体内,导致多器官系统损害。肝脏作为砷的主要代谢和解毒器官,在其代谢过程中可高浓度潴留,从而导致肝脏病变,如肝功能异常、肝肿大、肝纤维化、肝硬化甚至发生癌变等不同程度的肝脏疾病,成为砷致死的主要原因之一。研究发现氧化应激和脂质过氧化是砷引起肝脏损伤的致病因素,砷在肝脏代谢中可产生大量的自由基和非自由基产物,引起肝细胞膜发生脂质过氧化反应,使细胞膜和细胞器结构破坏,膜流动性失常;大量肝细胞内酶(alt、ast)释放入血,并可使清除自由基酶(sod、gpx)耗竭,肝细胞损伤进一步加重,谷胱甘肽(gsh)活力水平降低,丙二醛(mda水平增加),导致肝功能异常,脂肪代谢紊乱。抗氧化剂可以恢复失衡的氧化还原系统,保护细胞的形态及活性,降低细胞内活性氧的生成,恢复肝脏正常功能,是防治砷致肝损伤发生和发展的关键。
3.氯化血根碱(sanguinarine chloride,sc)是从传统草药白屈菜及博落回等罂粟科植物中发现的苯并菲啶类苄基四氢异喹啉生物碱。其在自然界中分布广泛,资源丰富,结构多样性并具有广谱的生物学活性。国内外药理研究表明,血根碱具有抗氧化、抗菌、抗炎和抗肿瘤等作用。戴波等人证明,sc治疗给药能明显改善模型小鼠的肝脏纤维病变;杨军等人发现sc对四氯化碳、半乳糖胺所致急性肝损伤模型,均有显著改善作用。但sc对亚砷酸钠(sodium arsenite,sa)导致的小鼠肝损伤是否有保护作用尚未见研究报道。现有技术中也未发现氯化血根碱具有防治砷致肝损伤的作用,也未发现本发明在防治砷致肝损伤的药品和保健品中的应用。
4.因此,研究一种可以降低砷毒性,并可对砷所致肝损伤有恢复作用的药物有着较大的社会效益及应用前景。
技术实现要素:
5.本发明的目的是提供一种氯化血根碱在制备砷致肝损伤药物或保健品方面的应用。
6.本发明所述的一种氯化血根碱在制备砷致肝损伤药物或保健品方面的应用。
7.优选的,本发明所述氯化血根碱在制备预防和治疗砷致肝损伤药物或保健品方面的应用。
8.本发明所述氯化血根碱在制备砷致肝损伤药物或保健品制剂方面的应用。
9.优选的,本发明所述氯化血根碱在制备预防和治疗砷致肝损伤药物或保健品制剂方面的应用。
10.本发明所述砷为亚砷酸钠。
11.本发明所述制剂为加入药学上可接受的辅料制备成药学上可接受的制剂。
12.本发明所述药学上可接受的制剂为固体制剂或液体制剂。
13.本发明所述固体制剂为颗粒剂、胶囊剂、片剂、丸剂。
14.本发明所述固体制剂为散剂、冻干粉针剂。
15.本发明所述液体制剂为注射制剂、口服液。
16.本发明所述的辅料没有限制,药学上能接受即可。
17.有益效果:
18.本发明与现有技术相比,具有以下有益效果:
19.现有技术存在的问题:
20.1.sc对亚砷酸钠(sodium arsenite,sa)导致的小鼠肝损伤的保护作用尚未见研究报道。
21.2.未发现氯化血根碱在防治砷或亚砷酸钠致肝损伤的药品和保健品中的应用。
22.本发明的有益效果:
23.本发明成功利用naaso2诱导小鼠发生肝损伤,研究结果发现,氯化血根碱显著缓解了naaso2导致的小鼠体重、sod、gsh下降,肝脏重量、谷丙转氨酶(alt)、谷草转氨酶(ast)、胆总红素(tbil)、mda上升,结果表明其对naaso2导致的肝损伤方面有潜在的应用价值,氯化血根碱可以在制备预防和治疗砷致肝损伤药物或保健品方面的应用,尤其是氯化血根碱可以在制备预防和治疗亚砷酸钠致肝损伤药物或保健品方面的应用。
附图说明
24.图1预防组小鼠肝组织病理形态学变化的显微图(he染色,
×
400)
25.a.空白组;b.模型组;c.双环醇组;d.谷胱甘肽组;e.低剂量组;f.中剂量组; g.高剂量组。
26.图2预防组小鼠肝组织病理形态学变化的显微图(he染色,
×
400)
27.a.空白组;b.模型组;c.双环醇组;d.谷胱甘肽组;e.低剂量组;f.中剂量组; g.高剂量组。
具体实施方式
28.下面通过具体实施例,对本发明的技术方案作进一步地具体说明。
29.实施例1
30.一、实验动物及材料
31.1.氯化血根碱:在发明的技术方案中,氯化血根碱,或sc,是指下列结构的化合物:
[0032][0033]
2.实验动物:成年雄性昆明小鼠,体重25~30g,许可证号:scxk(辽) 2020-0001,级别spf级,由辽宁省实验动物资源中心提供。
[0034]
实验试剂:亚砷酸钠购自美国sigma公司;丙氨酸氨基转移酶(alt)、天门冬氨基氨酸转移酶(ast)均购自雷杜生命科学股份有限公司;总胆红素(tbil) 测定试剂盒购自长春汇力生物技术有限公司;丙二醛(mda)、超氧化物歧化酶(sod)、谷胱甘肽过氧化物酶(gsh)测定试剂盒均购自南京建成生物工程研究所;苏木素-伊红(he)染液购自武汉塞维尔生物科技有限公司;4%多聚甲醛购自北京雷根生物技术有限公司。
[0035]
3.实验仪器:me204e型分析天平(瑞士mettler-toledo公司);chemray 800 型全自动生化分析仪(深圳雷社生命科技公司);mcr-88-8型台式微量冷冻离心机(新加坡esco);allegrax-15r型冷冻台式通用离心机(美国beckman公司);dw-hl340型超低温冰箱(中科美菱低温科技股份有限公司);kz-lll-fp 型高速低温组织研磨仪(武汉塞维尔生物科技有限公司);synergy-h4型多功能酶标仪(美国bio-tek公司);eclipse ts100-f型倒置生物显微镜;dmi8 型荧光倒置显微镜(德国leica公司)。
[0036]
二、实验方法
[0037]
1.分组及给药:正式实验前适应性喂养1周,将140只spf级雄性昆明小鼠随机等分为预防和治疗两个大组,每一大组均设立空白组(生理盐水),模型组(5mg/kg sa),阳性对照组(11.375mg/kg的双环醇和182mg/kg的谷胱甘肽), sc低、中、高剂量组(25、50、100mg/kg),共计7个小组;在预防组中,空白组灌胃等体积生理盐水,模型组灌胃5mg/kg的sa溶液,其余5组分别灌胃相应剂量的药物+5mg/kg的sa溶液,每天1次,连续灌胃4周;在治疗组中除空白组外,其余各组连续4周按照5mg/kg
·
d的sa溶液进行造模处理,从第五周开始,模型组灌胃生理盐水,其余5组给予相应的药物持续治疗4周。
[0038]
2.测定及观察方法:末次给药后,所有小鼠均禁食、不禁水8h,称量其体重并记录;摘取眼球法收集小鼠血液样本,室温静置半小时后以3000r/min离心15min收集上清,冻存于-80℃冰箱中用于后续实验。采血后,颈椎脱臼法处死小鼠,摘取完整肝脏,快速用预冷的磷酸盐缓冲液(pbs)冲洗干净,滤纸吸干,称定肝脏重量。部分肝组织固定于4%多聚甲醛溶液中保存,以供病理学检查;其余肝脏组织迅速置于液氮,后冻存于-80℃冰箱中,用于后续实验。对所得数据进行统计学处理,与均数
±
标准差表示,差异显著性以t检验判定。
[0039]
3.实验结果:实验结果列入表1、2、3、4、5、6。
[0040]
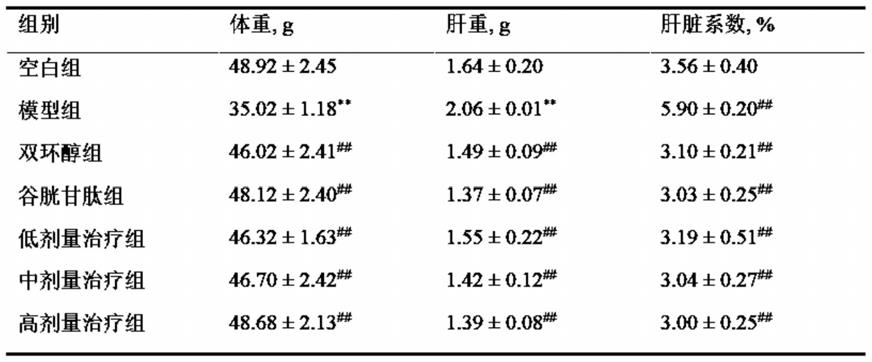
表1预防组小鼠体重、肝脏重量及肝脏系数的变化
[0041][0042]
注:与空白组比较,
**
p<0.01;与模型组比较,
##
p<0.01
[0043]
表2预防组小鼠体重、肝脏重量及肝脏系数的变化
[0044][0045]
注:与空白组比较,
**
p<0.01;与模型组比较,
##
p<0.01
[0046]
在预防组中(见表1),与空白组比较,模型组小鼠体重显著降低(p《0.01),肝重、肝脏系数显著上升(p《0.01),阳性对照组及sc各剂量组均没有显著差异(p》0.05);与模型组比较,阳性对照组及sc各剂量给药组小鼠体重均显著上升(p《0.01),肝脏系数显著下降(p《0.01);sc各剂量组与阳性对照组的上述指标相比较,均无显著差异(p》0.05)。在治疗组中(见表2),小鼠体重、肝重、肝脏系数变化趋势与预防组相一致,且均呈剂量依赖性,即随着sc 剂量升高,小鼠体重随之上升,而肝重及肝脏系数则随之下降。
[0047]
表3预防组小鼠血清中alt,ast,tbil活性的变化
[0048][0049]
注:与正常组比较,
**
p<0.01;与模型组比较,
##
p<0.01
[0050]
表4预防组小鼠血清中alt,ast,tbil活性的变化
[0051][0052]
注:与正常组比较,
**
p<0.01;与模型组比较,
##
p<0.01
[0053]
在预防组中(见表3),与空白组比较,模型组小鼠alt、ast、tbil活性显著上升(p《0.01),阳性对照组及sc各剂量组均无显著差异(p》0.05),然而与模型组比较,阳性对照组及sc各剂量组小鼠alt、ast、tbil活性下降(p《 0.01),以及sc各剂量组与阳性对照组进行上述指标的比较,均无显著差异(p》 0.05)。在治疗组中(见表4),小鼠血清alt、ast、tbil活性变化趋势与预防组相一致,且呈剂量依赖性,即随着sc剂量升高,其活性随之下降。
[0054]
表5预防组小鼠肝组织中mda含量、gsh含量和sod活性的变化
[0055][0056]
注:与正常组比较,
**
p<0.01;与模型组比较,
##
p<0.01
[0057]
表6预防组小鼠肝组织中mda含量、gsh含量和sod活性的变化
[0058]
[0059]
注:与正常组比较,
**
p<0.01;与模型组比较,
##
p<0.01
[0060]
在预防组中(见表5),与空白组比较,模型组小鼠mda含量显著上升(p《 0.01),gsh含量及sod活性显著下降(p《0.01),sc各剂量组及阳性对照组均无显著差异(p》0.05);与模型组比较,sc各剂量组及阳性对照组mda含量显著下降(p《0.01),gsh含量、sod活性显著上升(p《0.01);sc各剂量组与阳性对照组进行上述指标的比较,均无显著差异(p》0.05)。在治疗组中 (表6),与空白组比较,模型组小鼠mda含量显著上升(p《0.01),sod活性、gsh含量显著下降(p《0.01),阳性对照组及sc各剂量组均无显著差异(p》 0.05);与模型组比较,阳性对照组mda含量显著下降(p《0.01),gsh含量及sod活性显著上升(p《0.01);sc各剂量给药组小鼠mda含量显著下降(p《 0.01),gsh含量和sod活性显著上升(p《0.01);sc各剂量组与阳性对照组进行上述指标的比较,均显著差异(p》0.05)。
[0061]
通过对小鼠肝组织he染色镜下观察发现,预防组中,正常组肝细胞排列整齐,结构饱满,无炎症细胞渗出,肝小叶结构清楚,染色体质丰富,肝组织中央静脉轮廓清晰,肝索沿着中央静脉放射状排列。模型组肝细胞肿大,细胞结构疏松,可见玻璃样变性,肝小叶结构不清,细胞间质内有大量炎细胞浸润,肝血窦扩张,可见大量红细胞和部分圆形空泡,疑为脂肪变。双环醇组肝细胞结构疏松,细胞间质可见炎细胞浸润,肝窦内有少量充血。谷胱甘肽组肝细胞可见玻璃样变性,组织可见少量炎细胞浸润。sc低剂量组肝细胞可见玻璃样变性,肝窦可见少量充血,未见明显炎症细胞浸润。sc中剂量组肝窦间隙明显增大。sc高剂量组肝组织整体结构正常,未见明显病理变化。综上所述,sc高剂量组肝组织结构损伤较轻,肝小叶结构均较清楚,肝索排列较整齐,肝血窦稍扩张,炎症细胞浸润较少,改善了sa导致的肝脏病理损伤(见图1、2)。
[0062]
4.实验结论
[0063]
从以上药效学实验结果可知,该提取物对亚砷酸钠所致肝损伤具有预防和治疗作用,且预防作用优于治疗作用。
[0064]
实施例2
[0065]
取氯化血根碱作为原料药,加入1/12的药用淀粉,制粒,得颗粒剂。
[0066]
实施例3
[0067]
取氯化血根碱作为原料药,加入1/12的药用淀粉,混匀,装入胶囊,得胶囊剂。
[0068]
实施例4
[0069]
取氯化血根碱作为原料药,加入及1/15的药用淀粉混合均匀,干燥,制成丸剂。
[0070]
实施例5
[0071]
取氯化血根碱作为原料药,加入1/13的药用淀粉,制粒,压片,制成片剂。
[0072]
实施例6
[0073]
取氯化血根碱作为原料药,加入12倍量的注射用水,浸泡0.5小时,过滤,灭菌,得注射剂。
[0074]
实施例7
[0075]
取氯化血根碱作为原料药,加入11倍量的注射用水,浸泡0.5小时,过滤,冻干,得冻干粉剂。
[0076]
实施例8
[0077]
取氯化血根碱作为原料药,加入6倍量纯净水,混合均匀,浸泡1.5小时,过滤,灭
菌,得口服液。
[0078]
虽然,上文中已经用一般性说明、具体实施方式及试验,对本发明作了详尽的描述,但在本发明基础上,可以对之作出一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1