一种药物二聚体囊泡及其应用
1.本发明属于生物医药技术领域,具体涉及一种药物二聚体囊泡及其应用。
背景技术:
2.纳米制剂是近年来新兴的一种制剂形式,其具有多种传统制剂所没有的优势,因而近年来受到医药从业者的广泛关注。通常来讲,纳米制剂是指借助特定的载体材料作为辅料,将药物包载于其中,制备形成纳米级别的粒子。纳米药物具有多方面的优势,包括:改善疏水性药物的溶解度、延长血液循环半衰期、提高药物稳定性及保护药物活性、增强药物靶向性、实现药物缓控释等。目前已上市的纳米制剂有几十种,主要包括:脂质体、胶束以及白蛋白结合物等,实现了阿霉素、紫杉醇、多西他赛、阿糖胞苷等多种药物的增效减毒,具有非常好的应用前景。
3.囊泡,作为一种经典的纳米制剂,是具有一层或多层双层结构的纳米级空心球体,其结构比胶束更为复杂。根据膜的双层结构,囊泡可分为单层囊泡(ul)、多层囊泡(mlv)和多层囊泡(mv)。ul囊泡分为小型单板层囊泡(suv,100 nm)、中型单板层囊泡(muv)、大型单板层囊泡(luv,100
–
1000 nm)和巨型单板层囊泡(guv,1μm)。囊泡在药物递送上具有非常显著的优势,与纳米胶束不同,囊泡不仅能够包载疏水性药物,同时也能包载水溶性药物,是一种通用型药物载体。囊泡形成的关键在于结构中需包含亲水性“头部”以及疏水性“尾巴”,且二者之间的相对比重需要严格控制。目前已报道的囊泡主要有两种:脂质体和聚合物囊泡,其主要组成成分分别对应为磷脂和聚合物。
4.肿瘤微环境(tme)支持癌细胞的生长,并形成多个屏障以减弱纳米药物的治疗效果,。其中,肿瘤中高水平的谷胱甘肽(gsh)被认为是肿瘤发生、进展和转移的关键因素之一。此外,有研究表明,它还会导致多种疗法产生耐药性,包括光动力治疗(pdt)、铂类药物的化疗或放射疗法(rt)等。因此,消耗细胞内gsh对增效上述疗法的疗效具有重要的意义。然而,目前以脂质体为代表的囊泡并不具备gsh调控能力,具有一定的局限性。文献表明,还原巯基在其抗氧化活性中起着核心作用,而α,β-不饱和醛/酮可以与巯基发生迈克尔加成(michael addition)反应,从而导致gsh的消耗。肉桂醛(cin),作为天然肉桂的主要成分,其化学结构中包含α,β-不饱和醛结构,因而具有gsh消耗的应用潜力。目前以脂质体为代表的囊泡载体,主要以天然磷脂或者合成磷脂作为囊泡的主要组成材料,其载药量低(通常《10%),导致过多的使用载体材料,引起各种不良反应。此外,在达到靶细胞后,脂质体类囊泡释放包载的药物主要依赖于膜融合以及缓慢的磷脂降解,在靶细胞内尚无法实现按需可控释药,影响药物疗效的发挥。
技术实现要素:
5.本发明的目的是提供一种药物二聚体囊泡及其在药物联合递送中的应用。
6.为了实现上述目的,本发明采用以下技术方案:一种药物二聚体材料,其结构式为r-x-r;
r为含醛基或者醛基衍生的疏水性小分子药物,x为双胺类连接臂,r和x的连接方式为碳氮双键。
7.进一步地,所述含醛基或者醛基衍生的疏水性小分子药物选自肉桂醛、苯丙醛、紫杉醇或喜树碱。
8.进一步地,所述双胺类连接臂为二乙烯三胺、五乙烯六胺及其衍生物。
9.进一步地,所述含醛基或者醛基衍生的疏水性小分子药物为肉桂醛,双胺类连接臂为二乙烯三胺。
10.一种纳米囊泡,由上述药物二聚体材料经自组装形成。
11.进一步地,所述纳米囊泡包载有活性药物,所述活性药物为疏水性药物或/或亲水性药物。
12.上述纳米囊泡的制备方法,包括以下步骤:步骤1,将上述药物二聚体材料溶解于无水乙醇中;步骤2,将步骤1制备的药物二聚体材料溶液逐滴加入到水相溶液中,搅拌均匀后,旋蒸除去乙醇,即可得到空白纳米囊泡溶液。
13.上述纳米囊泡在制备肿瘤治疗药物中的应用。
14.在本发明的一个实施例中,以二乙烯三胺作为连接臂,未引入任何催化剂,通过简单的迈克尔加成反应合成了肉桂醛二聚体;并采用乙醇注入法制备了肉桂醛二聚体药物囊泡,该囊泡以药物二聚体作为囊泡组成材料,具备高载药量等优点,且能够同时包载油溶性和水溶性药物,解决了目前脂质体等囊泡载药量低的问题。此外,与普通纳米载体不同,二聚体药物载体具备药理活性,肉桂醛二聚体能够消耗细胞内过多的谷胱甘肽,诱导细胞内活性氧上调,从而诱导肿瘤细胞凋亡;与此同时,消耗gsh导致囊泡响应解组装,可控地释放包载的药物,激活免疫,用于肿瘤免疫治疗。
15.有益效果:1、本发明首次开发药物二聚体囊泡。与传统的无功能性磷脂等材料不同,药物二聚体作为一类新型囊泡制备材料,本身具备药效。
16.2、本发明制备的药物二聚体材料合成简单,普适性强;药物二聚体囊泡具备制备工艺简单、可重现性好、高载药量、高稳定性以及可控释药等优点,易于临床转化。
17.3、本发明制备的功能性药物囊泡可调节肿瘤微环境,逆战药物耐受及免疫抑制,从而可以增效临床化疗及免疫治疗,具备较高的临床使用价值。
附图说明
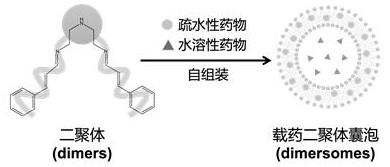
18.图1为肉桂醛二聚体材料自组装形成囊泡的原理图。
19.图2为肉桂醛二聚体材料的核磁共振氢谱图。
20.图3为肉桂醛二聚体囊泡的粒径分布图及透射电镜图。
21.图4为与肉桂醛(cin)或肉桂醛二聚体囊泡(cdc)孵育后细胞内谷胱甘肽(gsh)的水平变化。
22.图5为包载了索拉非尼的肉桂醛二聚体囊泡的粒径分布及透射电镜图。
23.图6为包载了索拉非尼的肉桂醛二聚体囊泡与10mm谷胱甘肽孵育后的透射电镜图。
24.图7为载索拉非尼的肉桂醛二聚体囊泡在不同介质中的药物释放行为。
25.图8为与索拉非尼(srf)、肉桂醛二聚体囊泡(cdc)或载索拉非尼的肉桂醛二聚体囊泡(cdc@srf)孵育后小鼠乳腺癌细胞活力变化。
26.图9 为与索拉非尼(srf)、肉桂醛二聚体囊泡(cdc)或载索拉非尼的肉桂醛二聚体囊泡(cdc@srf)处理过的肿瘤细胞上清液孵育后树突状细胞cd80和cd86表达情况。
具体实施方式
27.下面结合附图和具体实施例对本发明作进一步详细说明,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。实施例中未注明具体条件的实验方法及未说明配方的试剂均为按照本领域常规条件。
28.本发明以肉桂醛作为含有醛基的疏水性药物,以二乙烯三胺作为连接臂,合成肉桂醛二聚体,之后将其制成肉桂醛二聚体囊泡并用于疏水性药物索拉非尼的包载,协同诱导肿瘤细胞铁死亡,激活细胞免疫,用于肿瘤免疫治疗。肉桂醛二聚体材料自组装形成囊泡的原理如图1所示。
29.所述肉桂醛二聚体的结构式如下式所示:。
30.实施例1分别称取2.64g(20mmol)肉桂醛及1.03g(10mmol)二乙烯三胺,溶解于20 ml无水乙醇中,在室温下磁力搅拌反应12小时,通过薄层色谱(tlc)监测反应进程,反应结束后,通过旋转蒸发仪除去乙醇,得到肉桂醛二聚体粗品。之后通过硅胶柱层析进行分离纯化,制备得到纯净肉桂醛二聚体化合物。通过核磁共振氢谱表征其化学结构。
31.如图2所示,其中6.0-8.5ppm为肉桂醛上苯环和烯烃双键上氢的吸收峰,1-3ppm为二乙烯三胺上亚甲基氢的吸收峰,通过峰面积计算得到cin:det=2:1。
32.实施例2称取500mg肉桂醛二聚体,溶解于10ml无水乙醇中,配制50mg/ml肉桂醛二聚体乙醇溶液。之后取1ml肉桂醛二聚体溶液缓慢滴加至50ml无菌去离子水中,磁力搅拌4 h,获得空白肉桂醛二聚体囊泡(cdc)。通过动态光散射粒径仪评价囊泡的粒径分布,并通过透射电镜(tem)观察空白囊泡形貌。
33.如图3所示,cdc的平均粒径为88.5nm,表现出较窄的粒径分布;制剂溶液照片可以看出,cdc表现出经典的纳米制剂乳光;从透射电镜中可以明显的看出囊泡结构,表现为双层膜结构以及中空的水相内核。
34.实施例3小鼠乳腺癌4t1细胞铺于6孔板中,在co2培养箱中培养24小时。之后将肉桂醛(cin)和肉桂醛二聚体囊泡(cdc)分布与4t1细胞孵育12小时,反复冻融法裂解细胞,之后通过ellman检测法测定细胞内gsh水平。
35.如图4所示,游离的肉桂醛孵育后,胞内gsh水平仅有轻微下降,而与cdc囊泡孵育后,gsh水平显著降低,仅为untreated组的50%左右,证明cdc囊泡比游离cin药物具有更强的gsh消耗能力,体现出制备囊泡的优势。
36.实施例4称取100mg索拉非尼,溶解于10ml无水乙醇中,配制10mg/ml索拉非尼溶液。取1ml索拉非尼溶液,与1ml 50mg/ml的肉桂醛二聚体乙醇溶液混合,室温孵育30min,之后缓慢滴加至50ml无菌去离子水中,磁力搅拌4 h,获得包载索拉非尼的肉桂醛二聚体囊泡(cdc@srf)。通过动态光散射粒径仪评价囊泡的粒径分布,并通过透射电镜(tem)观察囊泡形貌。
37.如图5所示,包载了索拉非尼之后,cdc@srf同样表现出比较均匀的粒径分布,囊泡结构完整规则。
38.实施例5将实施例4制备得到的cdc@srf与10mm 谷胱甘肽(gsh)孵育1 h,通过透射电镜观察其形貌变化。
39.如图6所示,与gsh孵育后,囊泡结构解体破裂,变成小的碎片,证明肉桂醛二聚体囊泡具有非常显著的gsh敏感性。
40.实施例6分别配制ph=7.4、ph=5.0的磷酸盐缓冲液(pbs)以及含10mm gsh的pbs溶液作为释放介质,在37℃恒温水浴中恒速搅拌。接着将实施例4中制备得到的cdc@srf载药囊泡装入透析袋中,浸入不同释放介质中。分别在0、1、2、4、6、8、12、24、48 h取样,并补充相同体积的释放介质。通过高效液相色谱仪(hplc)测定释放药物含量。
41.如图7所示,cdc@srf在ph7.4的生理环境中释放非常缓慢,48小时释放不足10%,证明其稳定性良好,避免了在血液循环中的药物泄露。而在ph5.0的酸性环境下,释放明显加速,48小时可释放70%的药物。与酸性环境相比,cdc@srf囊泡表现出gsh超敏感释放行为,与gsh孵育后,在12小时内释放了72%的索拉非尼,而在24小时即达到释放平台期。
42.实施例7小鼠乳腺癌4t1细胞铺于96孔板中,在co2培养箱中培养24小时。之后将索拉非尼(srf)、肉桂醛二聚体囊泡(cdc)以及包载了索拉非尼的二聚体囊泡(cdc@srf)与4t1细胞孵育24小时,通过mtt法测定细胞活力。
43.如图8所示,单独与srf孵育后细胞活力为78%,单独与cdc孵育后细胞活力为76%,而cdc@srf载药囊泡给药组的细胞活力仅为36%,表现出较强的协同杀伤肿瘤细胞效果。
44.实施例8小鼠乳腺癌4t1细胞铺于12孔板中,在co2培养箱中培养24小时。之后将索拉非尼(srf)、肉桂醛二聚体囊泡(cdc)以及包载了索拉非尼的二聚体囊泡(cdc@srf)与4t1细胞孵育24小时。之后提取细胞培养上清液,与树枝状细胞(dc)继续孵育24小时,通过流式细胞仪测定细胞表面cd80和cd86表达情况,评价dc成熟效果。
45.通常以cd80+cd86+双阳性细胞比例作为dc细胞的成熟比例。从图9中可以看出,未给药细胞成熟率仅为6.72,而给了srf和cdc的细胞成熟率分别为11.5%和15.9%,相比为给药组有一定程度的升高。而cdc@srf囊泡给药组的细胞成熟率为42.4%,显著高于srf或cdc组,证明cdc@srf载药囊泡能显著诱导肿瘤细胞免疫原性死亡,并进一步激活免疫,诱导dc
成熟。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1