一种可降解生物医用镁合金药物洗脱血管支架及制备方法与流程
1.本发明涉及医疗器械领域,具体的说,本发明涉及一种可降解生物医用镁合金及血管支架及制备方法。
背景技术:
2.镁合金血管支架的使用过程,是一个大变形过程。支架需要先压握在球囊输送系统上,到达病变部位后充压扩张,局部应变可达15%以上。绝大多数的表面处理会在支架扩张后会出现局部破损。例如以氟化镁、碳酸镁、磷酸镁和羟基磷灰石等难溶镁盐或氧化镁、氢氧化镁等作为表面耐蚀层,即使通过微弧氧化、物理沉积、化学转化、电化学沉积等方式获得高牢固且致密的表面耐蚀层,但由于该耐蚀层物质本身性脆,在大变形过程中必然出现破损或微小裂缝,失去局部防护作用。而破损或裂缝部位通畅又是应力腐蚀严重区域,会导致支架支撑力快速下降。
3.另一种提高支架耐蚀性的方法为在镁合金支架表面增加高分子聚合物涂层,考虑支架大变形过程的特点,延展率低或与基体结合牢固度不高的高分子材料并不能满足实际需求。又由于支架尺寸小、结构复杂,通常需要将高分子材料溶于有机溶剂中,再经喷涂或旋涂方式涂敷于支架表面,经有机溶剂挥发,形成防护涂层。而有机溶剂的挥发过程会在涂层中形成微小气孔通道,镁合金基体可以通过通道与外部腐蚀环境进行离子交换,进而降低了涂层的防护效果,特别是经过大变形过程后,应力集中出的腐蚀加剧更为明显。
4.另外,支架的快速降解也会导致局部镁离子浓度过高而引发炎症与增生,而目前血管支架药物及其释放体系一般针对不可降解支架或是降解特别缓慢的可降解支架(如聚乳酸基体、纯铁基体等)进行设计的,并不适用于降解较快的镁合金血管支架。
技术实现要素:
5.本发明的一个目的在于提供一种可降解生物医用镁合金;本发明的另一目的在于提供一种可降解生物医用镁合金药物洗脱血管支架。
6.本发明的再一目的在于提供所述可降解生物医用镁合金药物洗脱血管支架的制备方法。
7.本发明的血管支架在近生理条件下经历大变形过程后,复合涂层对于应力集中区域依然具有良好的防护作用,并通过独特的复合药物控释体系抑制植入部位的炎症与增生。
8.为达上述目的,一方面,本发明提供了一种可降解生物医用镁合金,其中,以所述镁合金总重量为100%计,所述镁合金包括如下重量百分比成分:gd 3.0-6.0%、y 2.5-5.5%、li 1.0~3.0%、zn0.3-1.0%、zr 0.2-1.0%以及余量的mg。
9.根据本发明一些具体实施方案,其中,所述镁合金抗拉强度260~350mpa,屈服强度160~280mpa,断裂延伸率10~28%。
10.本发明的镁合金具有良好的生物相容性和腐蚀均匀性。
11.另一方面,本发明还提供了一种可降解生物医用镁合金药物洗脱血管支架,所述血管支架包括支架基体1,以及自支架基体由内向外设置的聚合物中间层7、聚合物保护层6及药物涂层8,其中,以所述支架基体总重量为100%计,所述支架基体1的材质包括如下重量百分比成分:gd 3.0-6.0%、y 2.5-5.5%、zn0.3-1.0%、zr 0.2-1.0%以及余量的mg。
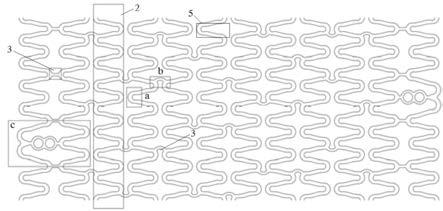
12.根据本发明一些具体实施方案,其中,所述支架基体1,如图1至图4所示,主要由多个环状的支撑体2、连接体3和端部显影结构4组成;各支撑体2及显影结构4之间由连接体3进行连接。
13.根据本发明一些具体实施方案,其中,任意相邻两个支撑体2互为镜像对称。
14.根据本发明一些具体实施方案,其中,所述支撑体2主要由支撑单元5组成;每个支撑单元5由一个波杆51、两个波杆连接段52和一个圆弧体53组成;波杆连接段52设置在波杆51的两端,其中一端的波杆连接段52与同一支撑单元的圆弧体53的两端的一端连接,另一端的波杆连接段52与相邻支撑单元的圆弧体53的一端连接(所述同一支撑单元的圆弧体53的另一端与另一支撑单元5的波杆连接段52连接,即,各支撑单元首尾连接),从而组成环状的支撑体2。
15.根据本发明一些具体实施方案,其中,所述支撑体2主要由4-18个支撑单元5组成。
16.根据本发明一些具体实施方案,其中,所述波杆51的宽度为0.1mm-0.18mm。
17.根据本发明一些具体实施方案,其中,所述波杆51的长度为0.35mm-1.2mm。
18.根据本发明一些具体实施方案,其中,所述波杆51的长度为0.80mm-1.2mm。
19.根据本发明一些具体实施方案,其中,所述波杆连接段52的宽度比波杆51宽度小0.01mm-0.05mm。
20.根据本发明一些具体实施方案,其中,所述圆弧体53包括外侧的外圆弧531和内侧的内圆弧532;内圆弧532与外圆弧531各自所在的圆的圆心均位于连接在同一圆弧体53的两个波杆51的对称轴线上,并且不为同心,外圆弧531的圆心在内圆弧532圆心朝向圆弧顶点一侧;内圆弧532和外圆弧531的间距在与波杆连接段52连接处最小,并向圆弧体53顶点方向开始逐渐增加,至所述对称轴线处最大。
21.根据本发明一些具体实施方案,其中,所述外圆弧531的直径为0.24-0.82mm,圆心角为π/2-3π/2;所述内圆弧532的直径为0.02-0.60mm,圆心角为π/2-3π/2;外圆弧和内圆弧的圆心的间距为0.01-0.05mm。
22.根据本发明一些具体实施方案,其中,所述外圆弧531的直径为0.40-0.80mm,圆心角为π/2-3π/2;所述内圆弧532的直径为0.20-0.45mm,圆心角为π/2-3π/2;外圆弧和内圆弧的圆心的间距为0.01-0.05mm。
23.根据本发明一些具体实施方案,其中,外圆弧531的直径大于内圆弧532的直径。
24.根据本发明一些具体实施方案,其中,所述内圆弧532和外圆弧531的最大间距(即所述对称轴线处的内圆弧532和外圆弧531的间距)比波杆宽度大0.01mm-0.05mm,且最小间距(即圆弧体53两个端部处的内圆弧532和外圆弧531的间距)比波杆51宽度小0.01-0.05mm。
25.根据本发明一些具体实施方案,其中,波杆连接段52两端宽度分别与波杆51宽度和圆弧体53端部宽度相同(即,波杆连接段52与波杆51连接处的宽度与波杆51宽度相同,波杆连接段52与圆弧体53连接处的宽度与圆弧体53端部宽度相同,使得波杆连接段52与波杆
51、圆弧体53平滑过渡连接),中间宽度为渐变过渡(即,波杆宽度从与波杆51连接处到与圆弧体53连接处逐渐变小)。
26.本发明所提供的支架结构通过独特的非同心圆弧支撑单元5的设计,使支架整体结构的应力分布均匀;在压握及扩张等剧烈变形过程中不易断裂,减缓应力腐蚀,提高支架服役时间。
27.根据本发明一些具体实施方案,其中,所述连接体3形状为“c”型、“i”型或“s”型。
28.根据本发明一些具体实施方案,其中,所述显影结构设置在支架基体的两端。
29.根据本发明一些具体实施方案,其中,所述显影结构包括显影点41和显影结构本体42;显影结构本体42上设置显影孔43。
30.根据本发明一些具体实施方案,其中,所述显影点41直径为0.2mm-0.5mm,厚度为0.1mm-0.2mm。
31.根据本发明一些具体实施方案,其中,所述显影点41直径比显影孔43直径小0.005 mm-0.01mm。
32.根据本发明一些具体实施方案,其中,每个显影结构4上设置1或2个显影孔43。
33.为避免支架显影受观察角度干扰,所述支架显影孔一般不在同一轴线上。
34.根据本发明一些具体实施方案,其中,所述显影点41材质选自pt、au和pt/ir合金中的一种或多种的混合。
35.根据本发明一些具体实施方案,其中,所述显影结构4设置在支架基体的端部的最外侧的两个支撑体之间(譬如,左端的第一个和第二个支撑体之间)。
36.根据本发明一些具体实施方案,其中,与显影结构4连接的两个相邻的支撑体之间的连接体3为“i”型结构,其他的任意两个相邻的支撑体之间的连接体3为“c型”结构。
37.根据本发明一些具体实施方案,其中,所述显影结构4与端部第一个支撑体2(即,最外侧支撑体)之间采用梯形连接体44连接;显影结构4与端部的第二个支撑体2之间采用“i”型连接体45连接。
38.根据本发明一些具体实施方案,其中,所述梯形连接体44的两个底边的宽度分别为0.05~0.35mm,两个底边的宽度差为0.02-0.08mm。
39.根据本发明一些具体实施方案,其中,所述梯形连接体44的长边(即长底边)连接在支撑体2上,短边(即短底边)连接在显影结构4上。
40.根据本发明一些具体实施方案,其中,所述“i”型连接体宽度为0.05~0.18mm。
41.所述“i”型连接体主体为长方形形状,并在与显影结构和支撑体连接处形成自然倒角。
42.根据本发明一些具体实施方案,其中,所述支架的压握直径为0.8mm-2.8mm,扩张直径为2.0mm-8.0mm,长度为6mm-150mm。
43.根据本发明一些具体实施方案,其中,所述支架的压握直径为1.0mm-2.0mm,扩张直径为2.2mm-5.0mm,长度为10mm-50mm。
44.根据本发明一些具体实施方案,其中,所述支架的压握直径为1.0mm-1.5mm,扩张直径为2.5mm-3.5mm,长度为10mm-20mm。
45.根据本发明一些具体实施方案,其中,所述血管支架还包括设置在支架基体1表面的聚合物保护层6,如图5所示;所述聚合物保护层的聚合物为聚偏氟乙烯及其共聚物(聚偏
氟乙烯-六氟丙烯共聚物);所述聚合物保护层6的厚度为2μm
ꢀ‑
10μm。
46.根据本发明一些具体实施方案,其中,所述聚合物保护层6的厚度为4μm
ꢀ‑
8μm。
47.根据本发明一些具体实施方案,其中,所述聚合物保护层6的厚度为5μm
ꢀ‑
6μm。
48.根据本发明一些具体实施方案,其中,所述聚合物保护层6经过退火处理以减少孔隙率。
49.本发明的聚合物保护层6具有良好的生物相容性,100~300%的延展率可以满足支架大变形的需求,而0.01~0.05%的极低吸水率可以有效阻隔透过支架药物控释涂层微小气孔、破损处进入的体液或血液与镁合金基体的接触,减少离子交换,提高镁合金支架耐蚀性。
50.根据本发明一些具体实施方案,其中,所述血管支架还包括设置在支架基体1和聚合物保护层6中间的聚合物中间层7,如图5所示;所述聚合物中间层的聚合物选自聚偏氟乙烯及其共聚物(聚偏氟乙烯-六氟丙烯共聚物)、聚甲基丙烯酸甲酯和聚甲基丙烯酸丁酯中的一种或多种的组合;所述聚合物中间层的厚度为100nm-2000nm。
51.根据本发明一些具体实施方案,其中,所述聚合物中间层的厚度为500nm-1500nm。
52.根据本发明一些具体实施方案,其中,所述聚合物中间层的厚度为800nm-1200nm。
53.根据本发明一些具体实施方案,其中,所述聚合物中间层的厚度为800nm-1000nm。
54.所述聚合物中间层可以作为粘结剂提高聚合物保护层的牢固度,同时可以阻隔透过聚合物保护层的微小气孔通道或未覆盖区域渗透进入的体液或血液。
55.根据本发明一些具体实施方案,其中,所述聚合物中间层7是经过氟化镁封孔处理的聚合物中间层。
56.所述氟化镁封孔处理是指将已涂敷聚合物中间层的镁合金支架进行氟化处理。
57.通过氟化处理,在镁合金支架基体(镁合金基体)与聚合物中间层的微小气孔或未覆盖区域,形成氟化镁屏障,进一步阻隔镁合金支架基体与体液或血液的接触,减少局部腐蚀的发生。
58.根据本发明一些具体实施方案,其中,所述血管支架还包括设置在聚合物保护层6外表面的药物涂层8,如图5所示;所述药物涂层的成分包括高分子载体和活性药物;所述活性药物为他克莫司和选自雷帕霉素和三氧化二砷中的一种的组合(即,他克莫司和雷帕霉素的组合,或者他克莫司和三氧化二砷的组合)。
59.根据本发明一些具体实施方案,其中,所述高分子载体的高分子材料选自聚乳酸、外消旋聚乳酸、聚乙醇酸、聚乳酸乙醇酸、聚已内酯和聚羟基丁酸戊酸共聚酯中的一种或多种的组合。
60.根据本发明一些具体实施方案,其中,所述高分子载体和活性药物的重量比为2:1-10:1。
61.根据本发明一些具体实施方案,其中,所述高分子载体和活性药物的重量比为4:1-8:1。
62.根据本发明一些具体实施方案,其中,所述高分子载体和活性药物的重量比为5:1-7:1。
63.根据本发明一些具体实施方案,其中,三氧化二砷或雷帕霉素和他克莫司的重量比为1:2-4:1。
64.根据本发明一些具体实施方案,其中,三氧化二砷或雷帕霉素和他克莫司的重量比为1:1-3:1。
65.根据本发明一些具体实施方案,其中,所述药物涂层8中三氧化二砷或雷帕霉素的含量为2-20μg/mm,他克莫司药物含量1~25μg/mm。
66.根据本发明一些具体实施方案,其中,所述药物涂层8中三氧化二砷或雷帕霉素的含量为5-15μg/mm,他克莫司药物含量1~6μg/mm。
67.根据本发明一些具体实施方案,其中,所述药物涂层8中三氧化二砷或雷帕霉素的含量为5-10μg/mm,他克莫司药物含量2~5μg/mm。
68.再一方面,本发明还提供了所述可降解生物医用镁合金药物洗脱血管支架的制备方法,所述方法包括如下步骤:(1)支架基体1的加工;(2)聚合物中间层7的涂覆;(3)聚合物保护层6的涂覆;(4)药物涂层8的涂覆。
69.根据本发明一些具体实施方案,其中,步骤(1)支架基体的加工包括如下步骤:(11)将所述可降解生物医用镁合金通过材料成型工艺制备成镁合金管材;(12)通过激光雕刻工艺将所述镁合金管材制备成切割支架;(13)通过超声清洗处理去除切割残渣与氧化层;(14)通过电化学抛光工艺获得表面光洁平整的镁合金支架基体。
70.根据本发明一些具体实施方案,步骤(11)所述材料成型工艺包括:采用真空半连续铸造方式按所述可降解生物医用镁合金成分及重量比例制备镁合金铸锭,经固溶处理后进行挤压成型制备镁合金棒材,再经过管材拉拔成型工艺制备镁合金管材。
71.根据本发明一些具体实施方案,其中,所述镁合金管材外径为1.4-4.0mm,壁厚为0.08-0.30mm,长度为0.5-2.0m。
72.上述镁合金管材尺寸可根据镁合金支架扩张外径和激光雕刻设备需求进行调整。
73.根据本发明一些具体实施方案,其中,步骤(13)所述超声清洗包括:将步骤(12)的切割支架浸没于镁合金支架清洗液中,超声处理1~8min,以去除由于激光雕刻形成的表面附着切割残渣与氧化层。
74.根据本发明一些具体实施方案,其中,所述镁合金支架清洗液由磷酸二氢钾、氟化钾、无水乙醇和纯化水配制而成。
75.根据本发明一些具体实施方案,其中,所述镁合金支架清洗液中,以镁合金支架清洗液单位体积计,各成分含量为:磷酸二氢钾30-50 g/l,氟化钾15-25 g/l,无水乙醇150-250 ml/l;优选为:磷酸二氢钾40g/l,氟化钾20g/l,无水乙醇200ml/l。
76.根据本发明一些具体实施方案,其中,步骤(14)所述电化学抛光工艺包括:将清洗后的切割支架浸入镁合金支架抛光液中进行电化学抛光,抛光温度18-60℃,抛光电流0.3~1.5a,抛光时间10~500s。
77.根据本发明一些具体实施方案,其中,所述镁合金支架抛光液由磷酸、无水乙醇和纯化水以体积比(0.8-1.2):(0.8-1.2):(0.8-1.2)配置而成;优选为1:1:1。
78.根据本发明一些具体实施方案,其中,步骤(2)聚合物中间层的涂覆包括如下步
骤:(21)在支架基体表面涂覆聚合物中间层;(22)对表面涂覆聚合物中间层的支架进行氟化处理。
79.根据本发明一些具体实施方案,其中,步骤(21)包括通过超声喷涂工艺于支架基体表面形成聚合物中间层。
80.根据本发明一些具体实施方案,其中,所述的氟化处理包括:将已涂敷聚合物中间层后的支架基体浸入氟化处理液中,对聚合物中间层进行氟化封孔处理。
81.根据本发明一些具体实施方案,其中,所述的氟化处理包括:将已涂敷聚合物中间层后的支架基体浸入氟化处理液中,在水浴摇床中持续搅动,转速50~200r/min,对聚合物中间层进行氟化封孔处理。
82.根据本发明一些具体实施方案,其中,所述氟化处理液由氢氟酸溶液和氟化钾溶液配置而成。
83.根据本发明一些具体实施方案,其中,所述氢氟酸溶液浓度10~40%(体积浓度),氟化钾溶液浓度0.5~5mol/l;氢氟酸溶液和氟化钾溶液的体积比为100:5-100:50。
84.根据本发明一些具体实施方案,其中,所述氟化处理液温度18-85℃,处理时间30-600min。
85.根据本本发明一些具体实施方案,其中,步骤(3)聚合物保护层的涂覆包括如下步骤:(31)涂覆聚合物保护层;(32)对涂覆聚合物保护层的支架进行退火处理。
86.根据本发明一些具体实施方案,其中,步骤(31)包括通过超声喷涂工艺于经过氟化处理的聚合物中间层表面形成聚合物保护层。
87.根据本发明一些具体实施方案,其中,步骤(32)所述退火处理包括:将已涂敷聚合物保护层的支架在真空条件下加热至60-200℃保温1-10h,然后降温至室温后取出支架。
88.根据本发明一些具体实施方案,其中,退火处理的温度为100-150℃;优选为120-130℃。
89.根据本发明一些具体实施方案,其中,退火处理的时间为2-8h。
90.根据本发明一些具体实施方案,其中,所述退火处理包括:将已涂敷聚合物保护层的支架置于石英蛊中退火处理。
91.根据本发明一些具体实施方案,其中,所述真空条件的真空度大于等于1
×
10-3
pa。
92.根据本发明一些具体实施方案,其中,所述退火处理包括:自然降温至50℃以下后,通入氩气,继续降温至室温后取出支架。
93.根据本发明一些具体实施方案,其中,步骤(4)包括通过超声喷涂工艺于支架防护涂层表面形成药物涂层。
94.根据本发明一些具体实施方案,其中,步骤(21)、步骤(31)和步骤(4)所述的超声喷涂工艺是指:将各步骤所要喷涂的各层的材质原料(聚合物、或高分子载体和活性药物的混合物)溶解于挥发性有机溶剂中,通过超声雾化后喷涂于支架表面或相邻的里层(聚合物中间层或聚合物保护层),有机溶剂挥发后形成相应层结构(聚合物中间层、聚合物保护层或药物涂层)。
95.根据本发明一些具体实施方案,其中,所述方法包括如下步骤:(a)将所述可降解生物医用镁合金通过材料成型工艺制备成镁合金管材;(b)通过激光雕刻工艺将所述镁合金管材制备成切割支架;(c)通过超声清洗处理去除切割残渣与氧化层;(d)通过电化学抛光工艺获得表面光洁平整的镁合金支架基体;(e)通过超声喷涂工艺于镁合金支架基体表面形成聚合物中间层;(f)通过氟化处理工艺对表面涂覆聚合物中间层的镁合金支架进行处理;(g)通过超声喷涂工艺于经过氟化处理的聚合物中间层表面形成聚合物保护层;(h)通过退火处理对支架防护涂层进行封孔;(i)通过超声喷涂工艺于支架防护涂层表面形成药物涂层。
96.(j)干燥后制得可降解生物医用镁合金药物洗脱血管支架。
97.再一方面,本发明还提供了所述可降解生物医用镁合金药物洗脱血管支架在制备用于治疗血管狭窄的医疗器械中的应用。
98.又一方面,本发明还提供了一种可降解生物医用镁合金药物洗脱血管支架在血管狭窄动物模型中的评价方法,其包括:首先对动物模型进行预处理,形成血管栓塞模型后,植入本发明所提供的可降解生物医用镁合金药物洗脱血管支架,分别在术后不同时间进行随访,随访方式为血管造影观察和血管内oct观察,对支架的内膜覆盖程度、再狭窄及降解情况进行综合性评价。
99.根据本发明一些具体实施方案,其中,动物模型的预处理是指:在预期植入支架的血管位置,使用一次性球囊扩张导管进行血管扩张,扩张比例为血管直径的1.3~1.5倍,造成血管一定程度的损伤,预处理后1~4周可形成血管狭窄模型。
100.根据本发明一些具体实施方案,其中,植入是指:将本发明提供的可降解生物医用镁合金药物洗脱血管支架植入狭窄模型,支架扩张比例为血管直径的1.1~1.3倍。
101.综上所述,本发明提供了一种可降解生物医用镁合金药物洗脱血管支架及制备方法。本发明的血管支架具有如下优点:1)本发明提供的血管支架基体材料为可被人体吸收的医用镁合金材料,并具有高抗拉强度、高延展率、高耐蚀性及均匀降解等优异性能;2)本发明提供的血管支架结构设计可以有效的降低支架扩张时的应力集中程度,并可在x光下显影;3)本发明提供的血管支架聚合物中间经氟化镁封孔处理后,可在支架涂层的微小气孔处或未覆盖区域形成氟化镁屏障,进一步阻隔支架基体与体液或血液的接触,有效的减少局部腐蚀的发生;4)本发明提供的血管支架聚合物保护层具有极高的疏水性,可以有效的阻隔支架与体液或血液间的离子交换,提高支架耐蚀性;5)本发明提供的血管支架保护层退火处理方法可以有效的降低孔隙率,提高与基体的结合力,减少支架大变形时的保护层破损,进一步提高支架的耐蚀性;6)本发明所提供的血管支架复合药物涂层利用三氧化二砷或雷帕霉素药物抑制平滑肌细胞生长的同时促进内皮细胞生长的特点,可以实现快速内皮化,有效的降低血栓风险和支架降解脱落风险;利用他克莫司药物良好的消炎作用,有效的抑制支架降解过程
中产生的炎症反应,减少增生和支架内再狭窄;7)本发明所提供的血管支架在模拟冠状动脉狭窄的大动物实验中表现良好的治疗结果,6个月的随访中血管管腔无塌陷、无炎症、无内膜增生,在降解过程中表现出了充分的安全性和有效性。
附图说明
102.图1为本发明可降解生物医用镁合金药物洗脱血管支架结构的整体示意图;图2为图1的a部分的放大示意图;图3为图1的b部分的放大示意图;图4为图1的c部分的放大示意图;图5为本发明可降解生物医用镁合金药物洗脱血管支架复合涂层构成的示意图;图6为本发明测试例1的拉拔曲线;图7为本发明测试例1的腐蚀电位图;图8为本发明测试例2的一般血管支架应力图;图9和图10分别为本发明测试例2的可降解生物医用镁合金药物洗脱血管支架的应力图;图11-图15分别为本发明测试例3的可降解生物医用镁合金药物洗脱血管支架的电镜图;图16和图17分别为本发明测试例3的对比支架的电镜图;图18至图20分别为本发明测试例4的对比支架在近生理条件下实验结果图;图21为本发明测试例4的可降解生物医用镁合金药物洗脱血管支架在实验结果图;图22至图26分别为本发明测试例6的oct图;图27为本发明测试例6的支架显影性照片;图28为本发明支架实施例4的超声喷涂过程照片。
具体实施方式
103.以下通过具体实施例详细说明本发明的实施过程和产生的有益效果,旨在帮助阅读者更好地理解本发明的实质和特点,不作为对本案可实施范围的限定。
104.镁合金材料实施例1本实施例提供一系列可降解生物医用镁合金材料,其元素组分含量如表1所示:其加工方法包括:按表1所述各组元素组分含量配比,采用真空半连续铸造方式将
各合金元素熔炼成镁合金铸锭,其中各组分原材料的纯度均为99.99%。将所述镁合金铸锭进行固溶处理,固溶温度450摄氏度,固溶时间8小时,再通过热挤压方式将所述镁合金铸锭挤压成直径10mm的棒材,热挤压温度340摄氏度。再截去棒材两端各20%长度的材料,仅取棒材中段用作血管支架的制备材料,以避免混料不均的影响。
105.支架结构实施例1本实施例提供一组镁合金血管支架结构,其材质为镁合金材料实施例1中的bdm-6#材料,由不同参数的支架基体1组成。不同组结构参数如表2所示,其中对照组为专利cn201520261612所述镁合金支架结构举例:除表2所示的不同参数外,各组结构的其余参数相同,即,支架基体1还包括通过连接体3连接设置在支架基体两端的显影结构4;显影结构包括材质为铂金的显影点41和显影结构本体42;显影结构本体42上设置显影孔43。显影点41直径为0.35mm,厚度为0.14mm;支架基体1的压缩直径为1.3mm,扩张直径为3.0mm,长度为13mm。
106.支架实施例1本实施例提供一种可降解生物医用镁合金药物洗脱血管支架(如图1至图5所示),包括支架基体1、以及自内向外包覆的聚合物中间层7、聚合物保护层6和药物涂层8。
107.所述支架基体1采用支架结构实施例1中的结构a,其材质为镁合金材料实施例1中的bdm-6#材料。
108.聚合物中间层7经过氟化镁封孔处理,其中的聚合物为聚偏氟乙烯,厚度为1000nm。
109.聚合物保护层6的聚合物为聚偏氟乙烯-六氟丙烯,厚度为6μm。
110.药物涂层的成分包括高分子载体和活性药物;所述高分子载体的高分子材料为plla;活性药物为重量比1:1的三氧化二砷和他克莫司;高分子载体和活性药物的重量比为5:1。三氧化二砷的含量为5μg/mm,他克莫司药物含5μg/mm。
111.该可降解生物医用镁合金药物洗脱血管支架的制备包括:
(a)采用镁合金材料实施例1中的方法制备bdm-6#镁合金棒材,再经过管材拉拔成型工艺制备镁合金管材。所述镁合金管材外径为3.0mm,壁厚为0.22mm,长度为1m。
112.(b)通过激光雕刻工艺将所述镁合金管材制备成切割支架。
113.(c)将激光雕刻后的支架浸没于镁合金支架清洗液中,超声处理2min,以去除由于激光雕刻形成的表面附着切割残渣与氧化层。所述镁合金支架清洗液由磷酸二氢钾、氟化钾、无水乙醇和纯化水配制而成,具体为磷酸二氢钾40g/l,氟化钾20g/l,无水乙醇200ml/l,溶剂为纯化水。
114.(d)将清洗后的切割支架用夹具夹持浸入镁合金支架抛光液中进行电化学抛光,抛光温度40℃,抛光电流1.2a,抛光时间80s。所述镁合金支架抛光液由磷酸、无水乙醇和纯化水以体积比1:1:1配置而成。
115.(e)通过超声喷涂工艺于镁合金支架基体表面形成聚合物中间层。
116.(f)将表面涂覆聚合物中间层的支架浸入氟化处理液中,在水浴摇床中持续搅动,转速80r/min,对聚合物底涂进行氟化封孔处理。所述氟化处理液由氢氟酸溶液和氟化钾溶液配置而成,具体为氢氟酸溶液浓度40%,氟化钾溶液浓度5mol/l,氢氟酸溶液和氟化钾溶液的体积比为100:30。所述氟化处理液温度75℃,处理时间300min。
117.(g)通过超声喷涂工艺于经过氟化处理的聚合物中间层表面形成聚合物保护层。
118.(h)将已涂敷聚合物保护层的支架,竖直置于石英管中,送入炉膛后开始抽真空,当真空度高于1
×
10-3
pa后开始加热,保温温度为120℃,保温时间为2h,随炉冷却至50℃以下,向石英管中通入氩气,当温度降至室温后取出支架。
119.(i)通过超声喷涂工艺于支架防护涂层表面形成药物涂层。
120.(j)干燥后制得可降解生物医用镁合金药物洗脱血管支架。
121.所述超声喷涂是指使用超声喷涂机将聚合物覆盖于支架表面,如图28所示,喷涂高度30mm,气压11kpa,转速205r/min。
122.支架实施例2本实施例提供一种可降解生物医用镁合金药物洗脱血管支架,仅由支架基体1构成裸支架(无表面处理且无任何涂层)。
123.所述支架基体1采用支架结构实施例1中径向支撑力较高且最大等效应变较小的结构a,其材质为镁合金材料实施例1中力学性能和耐蚀性能均较好的的bdm-6#材料。
124.该可降解生物医用镁合金药物洗脱血管支架的制备包括:(a)采用镁合金材料实施例1中的方法制备bdm-6#镁合金棒材,再经过管材拉拔成型工艺制备镁合金管材。所述镁合金管材外径为3.0mm,壁厚为0.22mm,长度为1m;(b)通过激光雕刻工艺将所述镁合金管材制备成切割支架。
125.(c)将激光雕刻后的支架浸没于镁合金支架清洗液中,超声处理2min,以去除由于激光雕刻形成的表面附着切割残渣与氧化层。所述镁合金支架清洗液由磷酸二氢钾、氟化钾、无水乙醇和纯化水配制而成,具体为磷酸二氢钾40g/l,氟化钾20g/l,无水乙醇200ml/l,溶剂为纯化水。
126.(d)将清洗后的切割支架用夹具夹持浸入镁合金支架抛光液中进行电化学抛光,抛光温度40℃,抛光电流1.2a,抛光时间80s。所述镁合金支架抛光液由磷酸、无水乙醇和纯化水以体积比1:1:1配置而成。
127.(e)清洗并干燥后制得可降解生物医用镁合金药物洗脱血管支架。
128.支架实施例3本实施例提供一种可降解生物医用镁合金药物洗脱血管支架,包括支架基体1以及氟化镁保护层。
129.所述支架基体1采用支架结构实施例1中径向支撑力较高且最大等效应变较小的结构a,其材质为镁合金材料实施例1中力学性能和耐蚀性能均较好的bdm-6#材料。
130.该氟化镁保护层由致密的氟化镁构成,均匀覆盖于支架表面,厚度1000nm。
131.该可降解生物医用镁合金药物洗脱血管支架的制备包括:(a)采用镁合金材料实施例1中的方法制备bdm-6#镁合金棒材,再经过管材拉拔成型工艺制备镁合金管材。所述镁合金管材外径为3.0mm,壁厚为0.22mm,长度为1m;(b)通过激光雕刻工艺将所述镁合金管材制备成切割支架。
132.(c)将激光雕刻后的支架浸没于镁合金支架清洗液中,超声处理2min,以去除由于激光雕刻形成的表面附着切割残渣与氧化层。所述镁合金支架清洗液由磷酸二氢钾、氟化钾、无水乙醇和纯化水配制而成,具体为磷酸二氢钾40g/l,氟化钾20g/l,无水乙醇200ml/l,溶剂为纯化水。
133.(d)将清洗后的切割支架用夹具夹持浸入镁合金支架抛光液中进行电化学抛光,抛光温度40℃,抛光电流1.2a,抛光时间80s。所述镁合金支架抛光液由磷酸、无水乙醇和纯化水以体积比1:1:1配置而成。
134.(e)将所得支架基体或支架基体单元浸入氟化处理液中,在水浴摇床中持续搅动,转速80r/min,进行氟化处理。所述氟化处理液由氢氟酸溶液和氟化钾溶液配置而成,具体为氢氟酸溶液浓度40%,氟化钾溶液浓度5mol/l,氢氟酸溶液和氟化钾溶液的体积比为100:30。所述氟化处理液温度75℃,处理时间300min。
135.(f)清洗并干燥后制得可降解生物医用镁合金药物洗脱血管支架。
136.支架实施例4本实施例提供一种可降解生物医用镁合金药物洗脱血管支架,包括支架基体1、氟化镁中间层以及聚合物保护层。
137.所述支架基体1采用支架结构实施例1中径向支撑力较高且最大等效应变较小的结构a,其材质为镁合金材料实施例1中力学性能和耐蚀性能均较好的bdm-6#材料。
138.该氟化镁中间层由致密的氟化镁构成,均匀覆盖于支架表面,厚度1000nm。
139.该聚合物保护层的聚合物为聚甲基丙烯酸甲酯,厚度为6μm。
140.该可降解生物医用镁合金药物洗脱血管支架的制备包括:(a)采用镁合金材料实施例1中的方法制备bdm-6#镁合金棒材,再经过管材拉拔成型工艺制备镁合金管材。所述镁合金管材外径为3.0mm,壁厚为0.22mm,长度为1m;(b)通过激光雕刻工艺将所述镁合金管材制备成切割支架。
141.(c)将激光雕刻后的支架浸没于镁合金支架清洗液中,超声处理2min,以去除由于激光雕刻形成的表面附着切割残渣与氧化层。所述镁合金支架清洗液由磷酸二氢钾、氟化钾、无水乙醇和纯化水配制而成,具体为磷酸二氢钾40g/l,氟化钾20g/l,无水乙醇200ml/l,溶剂为纯化水。
142.(d)将清洗后的切割支架用夹具夹持浸入镁合金支架抛光液中进行电化学抛光,
抛光温度40℃,抛光电流1.2a,抛光时间80s。所述镁合金支架抛光液由磷酸、无水乙醇和纯化水以体积比1:1:1配置而成。
143.(e)将所得支架浸入氟化处理液中,在水浴摇床中持续搅动,转速80r/min,进行氟化处理。所述氟化处理液由氢氟酸溶液和氟化钾溶液配置而成,具体为氢氟酸溶液浓度40%,氟化钾溶液浓度5mol/l,氢氟酸溶液和氟化钾溶液的体积比为100:30。所述氟化处理液温度75℃,处理时间300min。
144.(f)通过超声喷涂工艺于氟化镁保护层表面形成聚甲基丙烯酸甲酯保护层。
145.(j)清洗并干燥后制得可降解生物医用镁合金药物洗脱血管支架。
146.所述超声喷涂是指使用超声喷涂机将聚合物覆盖于支架表面,喷涂高度30mm,气压11kpa,转速205r/min。
147.测试例1可降解生物医用镁合金材料力学性能与降解性能评价测试材料:镁合金材料实施例1的材料;测试方法:按《gb/t 228.1-2010 金属材料 拉伸实验 第1部分:室温试验方法》所述试验方法进行力学性能试验。采用共培养的方法进行细胞毒性测试。
148.结果说明:本发明所提供的医用镁合金材料,在不同合金元素组分条件下可表现出不同的力学性能与耐蚀性能,可根据不同医疗器械的不同植入需求调整合金元素比例,控制基体材料的降解速率和力学性能。优选地,适用于血管支架的镁合金基体材料需要较高的耐蚀性能,而力学性能方面可通过本发明提供的可降解血管支架结构设计在应用端显著提高。
149.拉拔曲线见图6所示,腐蚀电位见图7所示,抗拉强度等力学性能如下表3所示。
150.此外,采用共培养的方法进行镁合金材料细胞毒性测试,材料的相对增值率均达到了90%以上,细胞毒性为1级,满足生物材料的特性,结果如表4所示。
151.测试例2支架应力有限元分析测试测试方法:
1)建立模型,按支架结构实施例1中所述各组支架基体1的结构尺寸1:1建模。
152.2)材料属性,由于血管支架扩张为大变形过程,在非线性有限元分析过程中应使用真实应力和塑性应变,所以材料拉伸实验所得测试应力与测试应变需转化为真实应力和塑性应变,将镁合金材料实施例1中bdm-6#材料的应力/应变数据转换为真实应力/塑性应变,赋予模型,转换公式如下:3)网格划分,单元大小0.016,厚度方向划分6层网格,选用8节点六面体线性减缩积分单元c3d8r。该单元对位移求解结果较精确,网格存在扭曲变形时(如quad单元的角度较大,远大于900),分析精度不会受到大的影响,且在弯曲载荷下不容易发生剪切自锁。
153.4)边界条件,在模型中心轴端部建立柱状坐标系,模型一端施加轴向约束和周向约束,限制模型的轴向刚体位移和端部周向转动位移;在模型内表面施加径向扩张位移,外表面施加径向压握位移。
154.5)计算支架结构的应力/应变分布,并计算支座反力评价支架的径向支撑力。
155.6)对比结果如下表5所示:结果说明:最大等效应变代表着支架扩张时的应力集中情况,其值越大则应力集中程度越高,而越接近材料的断裂延伸率越容易断裂。如表5所示,对照组的最大等效应变已接近材料的断裂延伸率(15%),断裂风险很高,但支撑力仅121kpa;相比于对照组,本发明提供的支架结构a,显著降低了支架的最大等效应变,并大幅度提高支架的径向支撑力水平;相比于对照组,本发明提供的支架结构b,具有更低的最大等效应变,在径向支撑力要求不高的条件下(如小规格的脑血管病变),可以提供更高的扩张安全性;相比于对照组,本发明提供的支架结构c,在保持径向支撑力与对照组接近的同时,大幅度降低了最大等效应变,提高了支架的扩张安全性;相比于对照组,本发明提供的支架结构d,最大等效应变与对照组接近,在支架断裂风险较低的条件下(如膝下血管病变),可以提供更高的径向支撑力。
156.一般血管支架中,如专利cn201520261612公布了一种开环管网状镁合金血管支架(对照组),主支撑体单元为“正弦波”形式,虽然支撑单元之间同样采用c型弧连接,但是该“正弦波”主支撑单元在支架扩张状态下,各波形圆弧内侧存在严重的应力/应变集中现象。经计算,其结构应力集中处均在波峰内侧中心处,支架扩展时容易断裂,如图8所示。由于镁合金塑性较差,在实际应用过程中需经过先压握(外径约1.0~1.2mm)再扩张(外径2.5~4.0mm)过程,严重的应力集中将导致支架扩张断裂。在该专利所述的结构参数范围内,通过增加波形高度可以减小支架扩张后的整体应力/应变,但径向支撑力会严重减小;通过减小
支架基体的尺寸也可以降低支架扩张后的整体应力/应变,在损失径向支撑力的同时,较细的支架基体增加了腐蚀断裂风险,也不利于抵抗疲劳破坏。
157.而本技术针对应力集中位置进行重点优化,创新圆弧设计使应力分布均匀化,保留充足的扩张安全欲度同时保证足够的尺寸以减少降解造成的结构破坏风险,以本技术支架实施例2为测试样本测得的应力分布图如图9和图10所示。
158.由图9和图10可以看出,本技术应力/应变向两侧梁均匀分布,在保证梁宽不变的前提下实现应力/应变均匀分布,大大提高镁合金支架的安全性能。
159.测试例3支架涂层评价测试方法:电镜观测。
160.结果说明:以本技术支架实施例1为测试样本的聚合物中间层电镜图片如图11所示,经过氟化镁封孔处理的聚合物中间层电镜图片如图12所示,喷涂聚合物保护层的电镜图片如图13所示,进一步经过退火处理后的电镜图片如图14所示,涂覆药物涂层后的电镜图片如图15所示。
161.与本技术的支架进行对照,仅氟化处理的镁合金支架(按照本技术支架实施例3制备),虽然表面有致密的氟化镁膜层覆盖,但在支架扩张过程中,应力集中区域的氟化镁膜层出现应力破坏,表面形成裂纹,大大降低了该处的抗腐蚀能力,进而在支架降解过程中产生严重的局部服饰,其膜层扩张破损的电镜图片如图16所示。
162.与本技术的支架进行对照,未进行退火处理的聚合物保护层(按照本技术支架实施例4制备),与基体的结合力不足,且聚合物保护层由于喷涂过程中的有机溶剂挥发形成了很多微小气孔,在支架扩张时易出现膜层破损,其电镜图片如图17所示。该破损会导致该区域失去隔绝体液或血液的能力,无法阻止基体与植入环境的离子交换,进而在降解早期出现严重的局部腐蚀。相应地,该局部腐蚀会导致血管支架前期支撑力损失严重,造成血管管腔塌陷等不良后果。
163.测试例4体外模拟环境中大变形条件下支架降解性能和支撑力评价测试方法:按照《yy/t 0808-2010 血管支架体外脉动耐久性标准测试方法》中所描述的疲劳耐久性测试方法进行试验。
164.结果说明:按照支架实施例2的方法制备可降解镁合金裸支架(即支架基体外无任何涂层),所得到的镁合金裸支架在经历大变形过程后的疲劳试验中,36h降解,支架碎裂,无支撑力,如图18所示。该测试说明,在近生理模拟条件下,无防护措施的镁合金裸支架经历大变形过程和持续应力作用下,其降解速度非常快,远高于普通环境下,如模拟体液浸泡形式的降解速度。
165.按照支架实施例3的方法制备可降解生物医用镁合金药物洗脱血管支架,3天降解结果显示,支架大面积结构脱落,无支撑力,如图19所示。该测试说明对镁合金支架做表面处理,如氟化处理,形成的无机盐(氟化镁)膜层虽能起到一定的抗腐蚀能力,但无法解决应力集中处膜层破损的问题,由于严重的局部腐蚀造成了支架降解初期出现大量结构破坏。
166.按照支架实施例4的方法制备可降解生物医用镁合金药物洗脱血管支架,15天降解结果显示,支架轴向断裂,应力腐蚀严重,无支撑力,如图20所示。该测试说明,虽经氟化镁和聚甲基丙烯酸甲酯保护层的多层防护处理,镁合金血管支架的抗腐蚀能力有一定提高,但依然无法解决近生理条件下经历大变形过程后的膜层破损问题,同样在降解初期就出现严重的局部腐蚀,进而导致支架结构脱落,并失去支撑力,造成血管管腔塌陷等不良后果。
167.完全按照支架实施例1的方法制备的可降解生物医用镁合金药物洗脱血管支架,3个月后的降解结果显示,支架整体结构无脱落、无断裂,仅有少量局部腐蚀,如图21所示。
168.该测试说明,本技术所提供的可降解生物医用镁合金药物洗脱血管支架的复合涂层,在近生理条件下经历大变形过程后依然能起到有效的防护作用,在应力集中区域仍能提供有效保护,大幅度提高降解时间,减少局部腐蚀区域,支架支撑力保留可达3个月。
169.测试例5动物实验评价测试方法:首先对动物模型进行预处理,即在预期植入支架的血管位置,使用一次性球囊扩张导管进行血管扩张,扩张比例为血管直径的1.5倍,造成血管一定程度的损伤,预处理后4周形成血管栓塞模型。随后在血管栓塞位置植入可降解生物医用镁合金药物洗脱血管支架,支架扩张比例为血管直径的1.1倍。分别在术后1个月和6个月进行随访,随访方式为血管造影观察和血管内oct观察,对支架的内膜覆盖程度、再狭窄及降解情况进行综合性评价。
170.将完全按照支架实施例1的方法制备的可降解生物医用镁合金药物洗脱血管支架,按支架测试例5所述测试方法进行试验,结果表明:1)猪血管预期置入位置的管腔oct照片如图22所示,管腔光滑圆润。
171.2)猪血管预期植入位置预处理后的狭窄模型oct照片如图23所示,内膜增生严重,管腔丢失,狭窄率近50%,满足血管栓塞模型的要求。
172.3)本技术所提供的可降解生物医用镁合金药物洗脱血管支架植入后oct照片如图24所示,支架贴壁良好,无断裂,管腔无塌陷。该结果说明本技术所提供的镁合金支架的支撑力能够满足需求。
173.4)本技术所提供的可降解生物医用镁合金药物洗脱血管支架术后1个月oct和dsa造影随访结果如图25所示,造影随访显示血流通畅无狭窄,显影点清晰可见;oct随访显示内膜已完全覆盖,管腔无内膜增生、无炎症,管腔丢失率小于5%;该结果说明本技术所提供的可降解生物医用镁合金药物洗脱血管支架,其聚合物中间层7和聚合物保护层6可以有效的控制镁合金基体降解,其药物涂层8可以实现快速内皮化,抑制平滑肌增生,并充分抑制炎症。
174.5)本技术所提供的可降解生物医用镁合金药物洗脱血管支架术后6个月oct随访结果如图26所示,血管管腔依然无增生、无炎症,无管腔丢失,支架部分小梁模糊,已开始降解。该结果说明本技术所提供的可降解生物医用镁合金药物洗脱血管支架在大动物冠脉狭窄模型试验中表现出良好的治疗效果,有效延长支架降解时间和支撑力保留时间,无炎症、无增生,具有长期安全性。
175.6)本技术所提供的可降解生物医用镁合金药物洗脱血管支架的显影性如图27所
示,在普通医用x射线照射下,支架两端显影点清晰可见。两端各两个显影点,周向90
°
分布,保证不同角度下均能呈现支架的长度和直径参数。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1