一种酸响应持续释放羟基自由基、单线态氧的纳米药物及其制备方法与应用
1.本发明涉及生物医学材料领域技术,涉及纳米材料领域,特别涉及一种酸响应持续释放羟基自由基、单线态氧的纳米药物及其制备方法与应用。
背景技术:
2.目前,恶性肿瘤的预防与控制是全球卫生系统的重点攻克难题,其中乳腺癌是威胁女性健康的第一大“杀手”,是发病率最高的恶性肿瘤之一,who调查研究表明乳腺癌占恶性肿瘤新发病例的25%。传统的乳腺癌治疗方法虽然是临床上成熟的治疗模式,也可以在一定程度上抑制乳腺癌,但由于其发展快预后差,手术疗法对于可能发生癌细胞转移的患者疗效不佳,联合化疗和放疗后虽然疗效有所提高,但由于无法实现精准治疗,对正常细胞毒副作用大,不利于日后的恢复;一旦出现多重耐药性,医师也将束手无策,给患者带来巨大的痛苦和经济负担。因此,开发安全有效的乳腺癌治疗策略迫在眉睫。近年来,光动力疗法(pdt)、光热疗法(ptt)、声动力疗法(sdt)和电动力疗法(edt)等基于活性氧自由基(ros)的治疗方法在乳腺癌治疗中引起了极大的关注。然而这些治疗方法存在一定的局限,需要施加外源刺激才可触发,对于已知的肿瘤组织具有抗肿瘤效果,然而对于转移灶等未知病灶依然是束手无策,无法实现肿瘤细胞的根除。同时,单一的肿瘤治疗策略效果有限,联合疗法成为肿瘤治疗的趋势。
3.近来,随着对肿瘤微环境研究的深入,研究肿瘤微酸环境特异性响应释放活性自由基的纳米药物,为肿瘤的高效治疗提供了新途径。人体自身抗肿瘤主要是通过免疫体统募集中心粒细胞于肿瘤组织附近,催化分解体内自身的h2o2产生高毒性单线态氧(1o2)抗肿瘤。中心粒细胞主要是通过分泌髓过氧化物酶(mpo)催化产生hclo和单线态氧,然而mpo的稳定性较低,利用mpo类似物酶(如氯过氧化物酶cpo)来构建中性粒细胞仿生体系成为研究热点。基于上述酶催化的纳米体系主要利用肿瘤组织中的双氧水产生单线态氧。然而,肿瘤微环境中h2o2浓度非常有限,介于50-100μm之间,因此无法实现h2o2的持续供应,这也限制了肿瘤内单线态氧的产量。因此,开发一种肿瘤微环境响应且能持续供应h2o2及高效产生单线态氧的纳米药物,对于实现高效的抗肿瘤效果意义重大。
4.目前,已有学者研发出可自供h2o2的纳米递送体系,主要通过使用可催化葡萄糖产生h2o2的酶如葡萄糖氧化酶gox来实现。然而,gox在纳米体系中的负载率有限,其在复杂的生物环境中其酶活性易失活,同时肿瘤组织内的葡萄糖含量也极为有限,因此都不利于在肿瘤组织内高效产生h2o2底物。因此,研究制备更为高效可行的h2o2自供纳米材料显得极为关键。
技术实现要素:
5.本发明的首要目的在于克服现有技术的缺点与不足,提供一种酸响应持续释放羟基自由基、单线态氧的纳米药物的制备方法。
6.本发明的另一个目的在于提供通过上述制备方法制备得到的酸响应持续释放羟基自由基、单线态氧的纳米药物。
7.本发明的再一个目的在于提供上述酸响应持续释放羟基自由基、单线态氧的纳米药物的应用。
8.本发明的上述目的通过如下技术方案实现:
9.一种酸响应持续释放羟基自由基、单线态氧的纳米药物的制备方法,包括如下步骤:
10.(1)中空聚多巴胺材料的制备
11.s1.二氧化硅表面涂覆多巴胺:将二氧化硅纳米粒子重悬于缓冲液中,加入盐酸多巴胺,反应,离心,取沉淀物,洗涤,冻干,即得表面涂覆多巴胺的二氧化硅纳米粒子;
12.s2.刻蚀二氧化硅得到中空聚多巴胺:将表面涂覆多巴胺的二氧化硅纳米粒子加入刻蚀液中,反应,离心,取沉淀物,洗涤,冻干,即得中空聚多巴胺;
13.(2)酸响应纳米载体材料的制备
14.将聚乙烯吡咯烷酮溶于含有强碱和铜盐的水溶液中,然后加入中空聚多巴胺和过氧化氢反应,离心,取沉淀物,洗涤,冻干,即得酸响应纳米载体材料;
15.(3)酸响应持续释放羟基自由基、单线态氧的纳米药物的制备
16.将酸响应纳米载体材料分散于过氧化物酶溶液中,搅拌,离心,取沉淀物,洗涤,得到洗涤后的沉淀,将洗涤后的沉淀重悬于巯基聚乙二醇-rgd聚合物溶液中,搅拌,离心,取沉淀物洗涤,冻干,即得酸响应持续释放羟基自由基、单线态氧的纳米药物。
17.步骤(1)中,所述的二氧化硅纳米粒子的制备方法优选为:将乙醇、水、氨水混合后加入正硅酸乙酯,搅拌反应,离心,取沉淀物洗涤,冻干,即得二氧化硅纳米粒子。
18.所述的二氧化硅纳米粒子的制备方法中,
19.所述的乙醇、水、氨水和正硅酸乙酯优选按体积比90~100:10~20:2~6:3~7计算;更优选按体积比94.2:16.2:4.54:5.4计算。
20.所述的将乙醇、水、氨水混合的方式优选为搅拌混合;所述的搅拌混合的时间优选为10~15min;更优选为15min。
21.所述的搅拌反应的时间优选为3~7h;更优选为5h。
22.所述的离心的条件优选为6000~10000rpm离心8~12min;更优选为8000rpm离心10min。
23.所述的洗涤的次数优选为至少一次;更优选为两次。
24.步骤s1中,所述的缓冲液优选包括tris-hcl缓冲液;更优选为ph8.5,10mm的tris-hcl缓冲液。
25.步骤s1中,所述的二氧化硅纳米粒子与盐酸多巴胺优选按质量比350:350~500计算;更优选按350:350计算。
26.步骤s1中,所述的反应的时间优选为22~26h;更优选为24h。
27.步骤s1中,所述的离心的条件优选为6000~10000rpm离心8~12min;更优选为8000rpm离心10min。
28.步骤s1中,所述的洗涤的次数优选为至少一次;更优选为两次。
29.步骤s2中,所述的刻蚀液优选由氢氟酸:氟化铵:水按2~5ml:4~8g:8~12ml混合
而成;更优选由氢氟酸:氟化铵:水按3ml:6g:10ml混合而成。
30.步骤s2中,所述的表面涂覆多巴胺的二氧化硅纳米粒子与刻蚀液优选按质量体积(g:ml)比100~200:10~20计算;更优选按质量体积(g:ml)比180:18计算。
31.步骤s2中,所述的离心的条件优选为6000~10000rpm离心8~12min;更优选为8000rpm离心10min。
32.步骤s2中,所述的洗涤的次数优选为至少一次;更优选为两次。
33.步骤(2)中,所述的聚乙烯吡咯烷酮的重均分子量优选为8000~12000;更优选为10000。
34.步骤(2)中,所述的聚乙烯吡咯烷酮与含有强碱和铜盐的水溶液优选按质量体积(g:ml)比0.3:1~3计算;更优选按质量体积(g:ml)比0.3:2计算。
35.步骤(2)中,所述的含有强碱和铜盐的水溶液中,所述的铜盐优选包括硫酸铜和氯化铜中的至少一种。
36.步骤(2)中,所述的含有强碱和铜盐的水溶液中,所述的强碱包括但不限于氢氧化钠、氢氧化钾中的至少一种。
37.步骤(2)中,所述的含有强碱和铜盐的水溶液中,强碱和铜盐的摩尔浓度比优选为0.5~3:1;更优选为1~3:1。
38.步骤(2)中,所述的聚乙烯吡咯烷酮与中空聚多巴胺优选按质量比0.3:0.1~2计算。
39.步骤(2)中,所述的中空聚多巴胺和过氧化氢优选按质量体积比(mg:μl)0.5:90~110计算;更优选按质量体积比(mg:μl)0.5:100计算。
40.步骤(2)中,所述的反应的时间优选为20~40min;更优选为30min。
41.步骤(2)中,所述的离心的条件优选为2000~6000rpm离心8~12min;更优选为4000rpm离心10min。
42.步骤(2)中,所述的洗涤的次数优选为至少一次;更优选为两次。
43.步骤(3)中,所述的酸响应纳米载体材料与过氧化物酶溶液优选按质量体积比(g:ml)0.5:1~3计算;更优选按质量体积比(g:ml)0.5:1计算。
44.步骤(3)中,所述的过氧化物酶包括髓过氧化物酶、氯过氧化物酶、乳过氧化物酶及其类似物中的至少一种。
45.步骤(3)中,所述的过氧化物酶的酶活优选为50~500u/ml;更优选为300~417u/ml。
46.步骤(3)中,所述的离心的条件优选为3500~6000rpm离心8~12min;更优选为4000rpm离心10min。
47.步骤(3)中,所述的酸响应纳米载体材料与巯基聚乙二醇-rgd聚合物优选按质量比0.5:0.5~3计算;更优选按质量比0.5:1计算。
48.步骤(3)中,所述的巯基聚乙二醇-rgd聚合物溶液的浓度优选为0.8~1g/ml;更优选为1g/ml。
49.一种酸响应持续释放羟基自由基、单线态氧的纳米药物,通过上述制备方法制备得到。
50.所述的酸响应持续释放羟基自由基、单线态氧的纳米药物在生物医学材料中的应
用。
51.本发明相对于现有技术具有如下的优点及效果:
52.(1)本发明通过合成酸响应纳米载体材料,将生物酶以化学键合或物理吸附的方式结合于载体材料表面或内部,获得酸响应持续释放羟基自由基、单线态氧的纳米药物。本发明的酸响应持续释放羟基自由基、单线态氧的纳米药物在肿瘤酸性条件作用下,纳米药物逐步降解,首先产生过氧化氢和金属cu
+
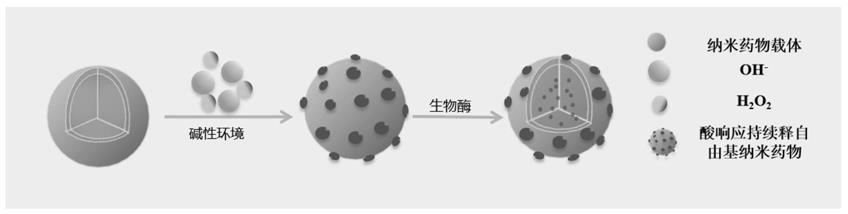
离子,随后cu
+
与过氧化氢发生芬顿反应生成羟基自由基,同时过氧化物酶催化过氧化氢产生单线态氧。
53.(2)本发明提供一种酸响应持续释放羟基自由基、单线态氧的纳米药物,该纳米药物的特征为:1)在肿瘤酸性条件作用下,纳米药物可逐步降解产生过氧化氢和金属cu
+
离子,且过氧化氢可持续产生。2)释放的cu
+
与过氧化氢发生芬顿反应生成羟基自由基,同时过氧化物酶催化过氧化氢产生单线态氧,即同时生成2种高活性自由基。3)羟基自由基和单线态氧发生协同作用,高效抑制肿瘤细胞生长。
54.(3)本发明提供了一种可响应肿瘤酸环境并持续释放自由基的纳米药物,在酸性条件下可发生级联反应产生大量过氧化氢进而产生大量1o2、
·
oh,具有高效抗肿瘤效果。
55.(4)本发明提供了一种肿瘤微酸环境响应并持续释放自由基的纳米药物,在酸性条件下逐步降解产生过氧化氢和金属离子,进而触发一系列的级联反应产生大量高活性的羟基自由基和单线态氧自由基,达到高效抗肿瘤效果。本发明酸响应持续释放羟基自由基、单线态氧的纳米药物仅响应肿瘤微酸环境,对于正常细胞几乎没有毒性,具有较好的生物相容性。
56.(5)本发明通过使用纳米药物载体制备出酸响应纳米载体材料,进而负载生物酶成功制备出酸响应持续释放羟基自由基、单线态氧的纳米药物,其可在酸性环境中释放出大量过氧化氢和可产生芬顿效应的金属离子。本发明可克服目前cdt等治疗方式中内源过氧化氢不足导致的有效疗效,其通过级联反应产生的大量自由基可增大肿瘤内环境的氧化应激,导致更强的抗肿瘤效果。本发明具有可批量生产、抗癌效率高、生物安全性好的特点。
57.(6)本发明酸响应持续释放羟基自由基、单线态氧的纳米药物能够酸性响应释放过氧化氢,其与cu
2+
发生芬顿反应,产生毒性羟基自由基;另外,过氧化氢作为酶的底物产生单线态氧,可以较好的突破化学动力疗法(pdt)中内源h2o2不足的局限,实现级联反应产生大量毒性羟基自由基和单线态氧。
附图说明
58.图1为酸响应持续释放羟基自由基、单线态氧的纳米药物的合成示意图。
59.图2为实施例1制备得到的中空聚多巴胺hpda的透射电镜结果图。
60.图3为实施例1酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cp@cpo的透射电镜结果图。
61.图4为实施例9中氯过氧化物酶cpo标准曲线及酸响应纳米载体材料hpda@cp负载cpo前后的紫外吸收光谱图;其中,a为实施例9中氯过氧化物酶cpo的标准曲线图;b为hpda@cp@cpo和hpda@cp的紫外吸收光谱图。
62.图5为实施例1制备的hpda@cp@cpo与酸性高锰酸钾反应所得混合液在400-650nm的紫外吸收曲线图。
63.图6为
·
oh产生情况的表征,具体为实施例11中hpda@cp@cpo在不同ph醋酸缓冲液条件下与tmb反应得到的混合液在500-800nm的紫外吸收曲线图。
64.图7为1o2产生情况的表征,具体为实施例12中不同药物与sosg和不同ph的醋酸缓冲液反应后所得混合液在不同波长下的荧光强度图;其中,a为hpda@cp@cpo与sosg和ph=5.5的醋酸缓冲液反应后所得混合液在0-60min内的荧光强度图;b为不同药物与sosg和ph=7.4的醋酸缓冲液反应后所得混合液的荧光强度图;c为不同药物与sosg和ph=5.5的醋酸缓冲液反应后所得混合液的荧光强度图。
65.图8为不同浓度药物对人源人乳腺癌细胞mcf-7细胞的细胞活力影响结果图。
66.图9为不同浓度药物对鼠源小鼠乳腺癌细胞4t1细胞的细胞活力影响结果图。
67.图10为不同浓度药物对人正常乳腺细胞mcf10a细胞的细胞活力影响结果图。
68.图11为不同药物对mcf-7移植瘤小鼠的抗肿瘤效果图;其中a为不同药物对mcf-7移植瘤小鼠的心肝脾肺肾的影响结果图;b为14天内不同药物对mcf-7移植瘤小鼠的相对肿瘤体积的影响结果图;c为14天内不同药物对mcf-7移植瘤小鼠的体重的影响结果图,其中1代表pbs;2代表hpda@cpo(i.t);3代表hpda@cp(i.t);4代表hpda@cp@cpo(i.v);5代表hpda@cp@cpo(i.t)。
69.图12为不同药物对4t1移植瘤小鼠的抗肿瘤效果图;其中a为不同药物对4t1移植瘤小鼠的心肝脾肺肾的影响结果图;b为14天内不同药物对4t1移植瘤小鼠的相对肿瘤体积的影响结果图;c为14天内不同药物对4t1移植瘤小鼠的体重的影响结果图,其中1代表pbs;2代表hpda@cpo(i.t);3代表hpda@cp(i.t);4代表hpda@cp@cpo(i.v);5代表hpda@cp@cpo(i.t)。
具体实施方式
70.下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
71.盐酸多巴胺、硅酸四乙酯、氨水均购于上海麦克林生化科技有限公司;生物酶购于sigma-aldrich公司。若非特殊说明实施例中所用的试剂均可通过市购得到。
72.实施例1:
73.一种酸响应持续释放羟基自由基、单线态氧的纳米药物的制备方法,其合成过程如图1所示,包括如下步骤:
74.(1)中空聚多巴胺材料的制备
75.s1.二氧化硅纳米粒子的制备:94.2ml乙醇、16.2ml纯水、4.54ml氨水混合搅拌15min,加入5.4ml正硅酸乙酯,搅拌5h后8000rpm离心10min取沉淀物,沉淀物洗涤两次后进行冻干,得到二氧化硅纳米粒子sio2;
76.s2.二氧化硅表面涂覆多巴胺:将350mg二氧化硅纳米粒子重悬于tris-hcl缓冲液(ph8.5,10mm)中,加入350mg盐酸多巴胺,搅拌反应24h后通过8000rpm离心10min取沉淀物,沉淀物洗涤两次后进行冻干,得到表面涂覆多巴胺的二氧化硅纳米粒子pda@sio2;
77.s3.刻蚀二氧化硅得到中空聚多巴胺:氢氟酸:氟化铵:水以3ml:6g:10ml的比例配置刻蚀液,将180g表面涂覆多巴胺的二氧化硅纳米粒子加入18ml刻蚀液中反应过夜,8000rpm离心10min取沉淀物,沉淀物洗涤两次后进行冻干,得到水合粒径为50-200nm中空
聚多巴胺hpda,其透射电镜结果如图2所示;
78.(2)酸响应纳米载体材料的制备
79.将0.3g重均分子量1万的聚乙烯吡咯烷酮(pvp)(购于sigma公司)溶解于2ml氢氧化钠和二水合氯化铜的水溶液中,其中,氢氧化钠和氯化铜的水溶液中氢氧化钠和氯化铜的摩尔比(m:m)为2:1,搅拌中加入0.5mg中空聚多巴胺和100μl过氧化氢,反应30min后,4000rpm离心10min,取沉淀物,沉淀物洗涤两次后进行冻干,得到酸响应纳米载体材料hpda@cp;
80.(3)酸响应持续释放羟基自由基、单线态氧的纳米药物的制备
81.将0.5g酸响应纳米载体材料分散于1ml 417u/ml氯过氧化物酶溶液中,搅拌过夜后,4000rpm离心10min,取沉淀物,沉淀物洗涤两次后重悬于1ml 1g/ml巯基聚乙二醇-rgd聚合物溶液中,搅拌过夜后,4000rpm离心10min,取沉淀物,沉淀物洗涤两次后进行冻干,得到酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cp@cpo,其透射电镜结果如图3所示。
82.hpda@cpo的制备方法如下:将0.5g上述方法中制备的中空聚多巴胺hpda分散于1ml 417u/ml氯过氧化物酶溶液中,搅拌过夜后,4000rpm离心10min,取沉淀物,沉淀物洗涤两次后重悬于1ml 1g/ml巯基聚乙二醇-rgd聚合物溶液中,搅拌过夜后,4000rpm离心10min,取沉淀物,沉淀物洗涤两次后进行冻干,得到hpda@cpo。
83.实施例2:
84.本实施例与实施例1基本相同,不同之处在于,步骤(2)酸响应纳米载体材料的制备中,中空聚多巴胺的用量为0.1mg。
85.按照上述方法制备得到了如实施例1所述的酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cp@cpo。
86.实施例3:
87.本实施例与实施例1基本相同,不同之处在于,步骤(2)酸响应纳米载体材料的制备中,中空聚多巴胺的用量为2mg。
88.按照上述方法制备得到了如实施例1所述的酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cp@cpo。
89.实施例4:
90.本实施例与实施例1基本相同,不同之处在于,步骤(2)酸响应纳米载体材料的制备中,氢氧化钠和氯化铜的水溶液中氢氧化钠和氯化铜的摩尔比(m:m)为3:1。
91.按照上述方法制备得到了如实施例1所述的酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cp@cpo。
92.实施例5:
93.本实施例与实施例1基本相同,不同之处在于,步骤(2)酸响应纳米载体材料的制备中,用氢氧化钠和硫酸铜的水溶液替换氢氧化钠和氯化铜的水溶液,其中氢氧化钠和硫酸铜的水溶液中氢氧化钠和硫酸铜的摩尔比(m:m)为1:1。
94.按照上述方法制备得到了如实施例1所述的酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cp@cpo。
95.实施例6:
96.本实施例与实施例1基本相同,不同之处在于,步骤(1)中空聚多巴胺颗粒材料的制备步骤s1.二氧化硅纳米粒子的制备中,94.2ml乙醇、16.2ml纯水、4.54ml氨水混合搅拌10min;步骤s2.二氧化硅表面涂覆多巴胺中,盐酸多巴胺的用量为500mg。
97.按照上述方法制备得到了如实施例1所述的酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cp@cpo。
98.实施例7:
99.本实施例与实施例1基本相同,不同之处在于,步骤(3)酸响应持续释放羟基自由基、单线态氧的纳米药物的制备中,氯过氧化物酶的酶活为300u/ml;巯基聚乙二醇-rgd聚合物溶液的浓度为0.1g/ml。
100.按照上述方法制备得到了如实施例1所述的酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cp@cpo。
101.实施例8:
102.本实施例与实施例1基本相同,不同之处在于,步骤(3)酸响应持续释放羟基自由基、单线态氧的纳米药物的制备中,用髓过氧化物酶(mpo)替换氯过氧化物酶。
103.按照上述方法制备得到了如实施例1所述的酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cp@mpo。
104.实施例9:酸响应持续释放羟基自由基、单线态氧的纳米药物的性能测试
105.取30u、40u、50u、60u、70u、80u、90u、100u氯过氧化物酶cpo加入1ml水溶液中,使用紫外分光光度计测试390nm处的吸光度,制成cpo浓度和吸光度的标准曲线如图4a所示。
106.将实施例1制备的酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cp@cpo和酸响应纳米载体材料hpda@cp分别分散于1ml超纯水中,得到hpda@cp@cpo溶液和hpda@cp溶液;测定hpda@cp@cpo溶液和hpda@cp溶液在350nm-550nm的紫外吸收值。
107.如图4b所示,hpda@cp@cpo在390nm处有高吸收,证明cpo的成功负载。
108.收集实施例1制备的酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cp@cpo的上清液,测定其于390nm处的紫外吸光值,对比标准曲线,计算cpo的负载率,cpo的理论负载率=(c
0v0-c
1v1
)/c
0v0
*100%。
109.c0,c1分别表示溶液中cpo起始的浓度与负载后上清液的浓度(u/ml),v0,v1分别表示溶液中cpo起始的浓度与负载后上清液的体积(ml)。
110.经计算,cpo的负载率为52.8%。
111.实施例10:
112.将实施例1制备得到的酸响应持续释放羟基自由基、单线态氧的纳米药物配置成1mg/ml的酸响应持续释放羟基自由基、单线态氧的纳米药物水溶液(hpda@cp@cpo);将100μl的100mm h2o2、150mm h2o2、1mg/ml hpda@cp@cpo分别与900μl 500μg/ml的酸性高锰酸钾溶液(酸性高锰酸钾溶液的溶剂为0.1m硫酸)反应1h后得到混合液,检测混合液在400-650nm的紫外吸收曲线。同时以1ml 500μg/ml的酸性高锰酸钾溶液(酸性高锰酸钾溶液的溶剂为0.1m硫酸)为对照。
113.实验结果如图5所示,实施例1制备得到的酸响应持续释放羟基自由基、单线态氧的纳米药物,其在酸性条件(酸性高锰酸钾溶液中)下可释放出大量过氧化氢(浓度大于10mm h2o2、小于15mm h2o2),使酸性高锰酸钾褪色(即450nm-600nm特征峰消失)。
114.实施例11:
115.将实施例1制备得到的酸响应持续释放羟基自由基、单线态氧的纳米药物配置成1mg/ml的酸响应持续释放羟基自由基、单线态氧的纳米药物水溶液(hpda@cp@cpo);将890μl ph=5.5的0.2m醋酸缓冲液+100μl 1mg/ml hpda@cp@cpo、890μl ph=7.4的0.2m醋酸缓冲液+100μl 1mg/ml hpda@cp@cpo分别与10μl 10mm 3,3',5,5'-四甲基联苯胺(tmb)反应2h后,得到混合液;检测各混合液在500-800nm的紫外吸收曲线。同时以ph=5.5的0.2m醋酸缓冲液、ph=7.4的0.2m醋酸缓冲液作为对照。
116.如图6所示,酸性条件下hpda@cp@cpo产生的过氧化氢可成功发生芬顿效应,生成羟基自由基
·
oh,使tmb显色,出现640nm处的高吸收峰。
117.实施例12:
118.将实施例1制备得到的酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cpo分别配置成1mg/ml的酸响应持续释放羟基自由基、单线态氧的纳米药物水溶液(hpda@cp@cpo)和1mg/ml hpda@cpo;
119.将100μl 1mg/ml hpda@cp@cpo、hpda@cpo、hpda@cp@cpo+h2o2(hpda@cp@cpo+h2o2中hpda@cp@cpo的浓度为1mg/ml,h2o2的浓度为100mm)、hpda@cpo+h2o2(hpda@cpo+h2o2中hpda@cpo的浓度为1mg/ml,h2o2的浓度为100mm)分别与10μl 50mm单线态氧绿色荧光探针(sosg)和890μl ph分别为5.5、7.4的0.2m醋酸缓冲液混合,得到各混合液;同时以单线态氧绿色荧光探针(sosg)为空白对照;于12h后测试各混合液的荧光强度,并在激发波长为504nm、发射波长扫描范围500-600nm条件下记录0-60min内100μl 1mg/ml hpda@cp@cpo与10μl 50mm单线态氧绿色荧光探针(sosg)和890μl ph=5.5的0.2m醋酸缓冲液混合后每10min(0min、10min、20min、30min、40min、50min、60min)所得混合液的荧光强度变化。
120.结果如图7所示,从图7a可以看出,在ph=5.5条件下,0-60min内荧光强度不断增强,说明混合液在持续释放单线态氧。从图7b可以看出,在ph=7.4条件下,各组均呈现出低信号,即几乎无单线态氧的产生。从图7c可以看出,hpda@cp@cpo+h2o2和hpda@cp@cpo在酸性条件下(ph=5.5)具有高荧光信号,hpda@cpo和hpda@cpo+h2o2仅有与空白对照组荧光探针几乎一致的低荧光信号,荧光信号大小与单线态氧自由基的释放量大小成正比。
121.实施例13:
122.使用购于atcc的人源人乳腺癌细胞mcf-7,在96孔板中将细胞以1
×
104个/100μl的密度进行铺板并培养24小时。将实施例1制得的酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cp@cpo、hpda、hpda@cp和hpda@cpo稀释成终浓度分别为100μg/ml、50μg/ml、25μg/ml、12.5μg/ml、6.25μg/ml、3.125μg/ml、1.56μg/ml的1640完全培养基。次日,吸走旧培养基后,使用pbs缓冲液(0.01m ph=7.4)洗涤2次后,分别加入上述含不同药物浓度的培养基溶液,每个浓度做3个平行。培养12h后使用cck-8法测各组的细胞存活率,评估其抗肿瘤效率。
123.实验结果如图8所示,从图8可以看出,酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cp@cpo的抗肿瘤效果具有浓度依赖性,浓度越高抗肿瘤效果越好,酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cp@cpo浓度为100μg/ml时抗肿瘤效果最佳。
124.实施例14:
125.使用购于atcc的鼠源小鼠乳腺癌细胞4t1,在96孔板中将细胞以1
×
104个/100μl
的密度进行铺板并培养24小时。将实施例1制得的酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cp@cpo、hpda、hpda@cp和hpda@cpo稀释成终浓度分别为100μg/ml、50μg/ml、25μg/ml、12.5μg/ml、6.25μg/ml、3.125μg/ml、1.56μg/ml的1640完全培养基。次日,吸走旧培养基后,使用pbs缓冲液(0.01m ph=7.4)洗涤2次后,分别加入上述含不同药物浓度的培养基溶液,每个浓度做3个平行。培养12h后使用cck-8法测各组的细胞存活率,评估其抗肿瘤效率。
126.实验结果如图9所示,从图9可以看出,酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cp@cpo的抗肿瘤效果具有浓度依赖性,浓度越高抗肿瘤效果越好,酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cp@cpo浓度为100μg/ml时抗肿瘤效果最佳,且抗肿瘤效果比实施例14的人源人乳腺癌细胞mcf-7的更好。
127.实施例15:
128.使用购于atcc的人正常乳腺细胞mcf10a,在96孔板中将细胞以1
×
104个/100μl的密度进行铺板并培养24小时。将实施例1制得的酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cp@cpo、hpda、hpda@cp和hpda@cpo稀释成终浓度分别为100μg/ml、50μg/ml、25μg/ml、12.5μg/ml、6.25μg/ml、3.125μg/ml、1.56μg/ml的1640完全培养基。次日,吸走旧培养基后,使用pbs缓冲液(0.01m ph=7.4)洗涤2次后,分别加入上述含不同药物浓度的培养基溶液,每个浓度做3个平行。培养12h后使用cck-8法测各组的细胞存活率,评估其抗肿瘤效率。
129.实验结果如图10所示,从图10可以看出,不同浓度的酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cp@cpo、hpda、hpda@cp和hpda@cpo对人正常乳腺细胞mcf10a细胞活力几乎没有影响,结合实施例13和14的结果,可见酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cp@cpo仅影响癌细胞细胞活性,对正常细胞无细胞毒性,具有良好的生物相容性。
130.实施例16:
131.从北京维通利华实验动物技术有限公司购买的spf级4~5周龄的balb/c雌性裸鼠。将购买回来的裸鼠饲养在暨南大学医学院的动物管理中心。在开展动物实验之前,这些裸鼠都要在动物房饲养10天,同时观察其状态并采集其粪便进行检测,确认实验动物无特定病原体后方可进行动物实验。
132.首先扩增培养购于atcc的人源人乳腺癌细胞mcf-7,后用胰酶将贴壁的癌细胞消化后,重悬于冰冷的pbs缓冲液(0.01m ph=7.4,300万个细胞/100μl),按照细胞密度为300万个/只把细胞接种到裸鼠的右大腿外侧。继续饲养并且观察裸鼠肿瘤的生长情况,当肿瘤的体积约为100mm3的时候,继续开展下一步的治疗方案。
133.使用实施例1制备得到的酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cp@cpo、hpda@cp和hpda@cpo对mcf-7移植瘤小鼠进行治疗,对mcf-7移植瘤小鼠分别静脉注射50μl 1mg/ml hpda@cp@cpo、hpda@cp和hpda@cpo,同时以pbs缓冲液为对照;另外对mcf-7移植瘤小鼠瘤内注射50μl 1mg/ml hpda@cp@cpo,记录不同治疗方式治疗14天后肿瘤大小和重量,评估各药物的抗肿瘤效率。另外取接受治疗的小鼠的心肝脾肺肾进行组化分析并统计小鼠体重。
134.结果如图11所示,从图11可以看出,实施例1制得的药物对小鼠重要器官(心肝脾
肺肾)无明显毒害作用,生物相容性良好。通过相对肿瘤体积可知,实施例1制得的酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cp@cpo具有优异的抗肿瘤效果。
135.实施例17:
136.从北京维通利华实验动物技术有限公司购买的spf级4~5周龄的balb/c雌性裸鼠。将购买回来的裸鼠饲养在暨南大学医学院的动物管理中心。在开展动物实验之前,这些裸鼠都要在动物房饲养10天,同时观察其状态并采集其粪便进行检测,确认实验动物无特定病原体后方可进行动物实验。
137.首先扩增培养购于atcc的鼠源小鼠乳腺癌细胞4t1细胞,后用胰酶将贴壁的癌细胞消化后,重悬于冰冷的pbs缓冲液(0.01m ph=7.4,100万个细胞/100μl),按照细胞密度为100万个/只把细胞接种到裸鼠的右大腿外侧。继续饲养并且观察裸鼠肿瘤的生长情况,当肿瘤的体积约为100mm3的时候,继续开展下一步的治疗方案。
138.使用实施例1制备得到的酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cp@cpo、hpda@cp和hpda@cpo对4t1移植瘤小鼠进行治疗,对4t1移植瘤小鼠分别静脉注射50μl 1mg/ml hpda@cp@cpo、hpda@cp和hpda@cpo,同时以pbs缓冲液为对照;另外对4t1移植瘤小鼠瘤内注射50μl 1mg/ml hpda@cp@cpo,记录不同治疗方式治疗14天后肿瘤大小和重量,评估各药物的抗肿瘤效率。另外取接受治疗的小鼠的心肝脾肺肾进行组化分析并统计小鼠体重。
139.结果如图12所示,从图12可以看出,实施例1制得的药物对小鼠重要器官(心肝脾肺肾)无明显毒害作用,生物相容性良好。通过相对肿瘤体积可知,实施例1制得的酸响应持续释放羟基自由基、单线态氧的纳米药物hpda@cp@cpo具有优异的抗肿瘤效果。
140.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1