在治疗前对直肠癌治疗抵抗及其分子机制的预测系统
1.本发明涉及治疗抵抗及其分子机制预测技术领域,尤其涉及一种在治疗前对直肠癌治疗抵抗及其分子机制的预测系统。
背景技术:
2.目前对于局部进展期直肠癌(locally advanced rectal cancer,larc)患者选术前新辅助放化疗(neoadjuvant chemoradiotherapy,ncrt)联合全系膜切除(total mesorectal excision,tme)手术及术后化疗的综合治疗方案,然而larc患者对于术前新辅助放化疗ncrt的治疗反应和预后差异很大,根据美国癌症联合委员会(american joint committee on cancer,ajcc)推荐的直肠癌新辅助治疗肿瘤退缩分级(tumor regression grade,trg)标准,不足50%的larc患者可达到病理良好反应,即trg0-1,获得明显的预后改善,对于超过50%的治疗不敏感患者即,trg 2-3,不仅不能从ncrt中获益,反而可能延误了手术时机,增加了术后并发症及进展风险。
3.治疗前大规模的分子表达或基因检测需要花费高额的检测成本和较长的检测时间,给病人和社会造成一定的经济负担,因此尽管上述标记物的预测性能很好,目前依然难以在临床大面积推广应用。此外,分子表达和基因检测一般需要术前肠镜活检增加组织取样量或者取一部分术后切除标本进行检测,前者增加了检测的创伤与风险,后者无法根据检测结果在术前进行有效的干预。
4.上述内容仅用于辅助理解本发明的技术方案,并不代表承认上述内容是现有技术。
技术实现要素:
5.本发明的主要目的在于提供一种在治疗前对直肠癌治疗抵抗及其分子机制的预测系统,旨在解决现有技术针对直肠癌新辅助治疗不敏感患者的检测效果差的技术问题。
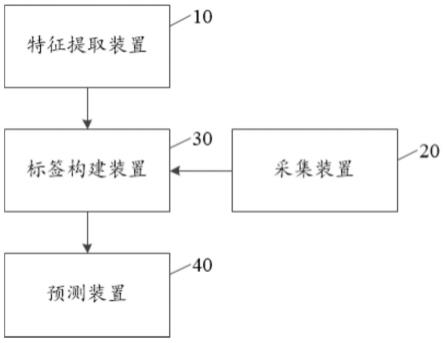
6.所述在治疗前对直肠癌治疗抵抗及其分子机制的预测系统包括:特征提取装置、采集装置、标签构建装置以及预测装置;
7.所述特征提取装置,用于对标注有患者的感兴趣区域的影像图像和病理图像进行特征提取,得到影像图像组学特征值和病理图像组学特征值;
8.所述采集装置,用于采集患者的临床资料;
9.所述标签构建装置,用于对所述影像图像组学特征值和病理图像组学特征值进行筛选,并构建表征治疗抵抗及其分子机制的多组学标签;
10.所述预测装置,用于对所述表征治疗抵抗及其分子机制的多组学标签和所述临床资料进行回归分析处理,并根据处理结果对直肠癌治疗抵抗及其分子机制的预测结果进行显示。
11.可选地,所述在治疗前对直肠癌治疗抵抗及其分子机制的预测系统还包括:图像预处理装置;
12.所述图像预处理装置,用于通过预设调取路径调取患者的经过过滤标准化信号强度的影像图像和直肠活检标本经染色的病理图像;
13.所述图像预处理装置,还用于通过itk-snap软件和imagescope软件对所述影像图像和病理图像进行勾画,得到标注有患者的感兴趣区域的影像图像和病理图像。
14.可选地,所述特征提取装置,还用于对标注有患者的感兴趣区域的影像图像至少基于描述病灶区的一阶特征、形状特征和纹理特征进行特征提取,得到影像图像组学特征值;
15.所述特征提取装置,还用于对标注有患者的感兴趣区域的病理图像至少基于像素强度、形态特征和核纹理特征进行特征提取,得到病理图像组学特征值。
16.可选地,所述采集装置,还用于调用信息采集平台,通过所述信息采集平台采集至少包括性别信息、年龄信息、体重指数信息、肿瘤分化程度信息、血清学化验结果、分子标志物检测信息以及手术病理trg分级信息;
17.所述采集装置,还用于根据所述性别信息、所述年龄信息、所述体重指数信息、所述肿瘤分化程度信息、所述血清学化验结果、所述分子标志物检测信息以及所述手术病理trg分级信息,得到患者的临床资料。
18.可选地,所述标签构建装置包括:数据清洗模块、逻辑回归模块以及标签向量计算模块;
19.所述数据清洗模块,用于对影像图像组学特征值和病理图像组学特征值的多组学数据进行清洗,清洗出无效数据和错误数据,得到符合要求的多组学数据,并将所述多组学数据中连续变量以中位数为界值转化为二分类变量,得到转化后的多组学数据;
20.所述逻辑回归模块,用于基于组学特征与分子标志物表达变量之间的关系对所述转化后的多组学数据进行数据降维,得到能够表征分子标志物表达水平和预设状态的影像图像组学特征和病理图像组学特征;
21.所述标签向量计算模块,用于将能够表征每个分子标志物表达水平和预设状态的影像图像组学特征和病理图像组学特征进行机器学习,得到对应的影像图像组学特征向量和病理图像组学特征向量,并对所述对应的影像图像组学特征向量和病理图像组学特征向量进行标记,得到表征治疗抵抗及其分子机制的多组学标签。
22.可选地,所述逻辑回归模块,还用于基于组学特征与分子标志物表达变量之间的关系通过r软件中的最小绝对收缩和选择运算符公式对转化后的多组学数据进行数据降维,筛选出能够表征分子标志物表达水平和是否为错配修复缺陷状态的影像图像组学特征和病理图像组学特征。
23.可选地,所述逻辑回归模块,还用于基于所述分子标志物检测信息和手术病理trg分级信息对筛选出的能够表征分子标志物表达水平和是否为错配修复缺陷状态的影像图像组学特征和病理图像组学特征进行验证。
24.可选地,所述预测装置包括:分析模块、生成模块以及预测模块;
25.所述分析模块,用于对所述临床资料进行单因素回归分析,并对所述表征治疗抵抗及其分子机制的多组学标签进行多因素回归分析,得到影响患者生存的临床因素和分子分型标签;
26.所述生成模块,用于通过初始学习模型对所述影响患者生存的临床因素和分子分
型标签和临床因素进行学习,生成预测模型;
27.所述预测模块,用于通过所述预测模型对输入的待预测病理信息的直肠癌治疗抵抗及其分子机制进行预测。
28.可选地,所述分析模块,还用于通过spss软件中的单因素回归分析,筛选出影响患者治疗抵抗敏感性的临床危险因素,并使用spss软件中的多因素回归分析对表征治疗抵抗及其分子机制的多组学标签进行多因素回归分析,得到能够独立影响患者生存的临床因素和分子分型标签。
29.可选地,所述预测装置还包括:显示模块;
30.所述显示模块,用于对预测的结果通过列线图显示,并显示相应的分子分型标签权重以及直肠癌治疗抵抗几率。
31.本发明在治疗前对直肠癌治疗抵抗及其分子机制的预测系统包括:特征提取装置、采集装置、标签构建装置以及预测装置;特征提取装置,用于对标注有患者的感兴趣区域的影像图像和病理图像进行特征提取,得到影像图像组学特征值和病理图像组学特征值;采集装置,用于采集患者的临床资料;标签构建装置,用于对影像图像组学特征值和病理图像组学特征值进行筛选,并构建表征治疗抵抗及其分子机制的多组学标签;预测装置,用于对表征治疗抵抗及其分子机制的多组学标签和临床资料进行回归分析处理,并根据处理结果对直肠癌治疗抵抗及其分子机制的预测结果进行显示。本发明可以在治疗前对患者的新辅助治疗反应进行预测,可对直肠癌治疗抵抗人群进行分析和其潜在的分子机制进行分析,实现对直肠癌治疗抵抗患者进行针对的个性化治疗,具有重要的临床意义,改善直肠癌患者的整体生存。
附图说明
32.图1是本发明在治疗前对直肠癌治疗抵抗及其分子机制的预测系统第一实施例的结构框图;
33.图2为本发明在治疗前对直肠癌治疗抵抗及其分子机制的预测系统第二实施例的结构框图;
34.图3为本发明在治疗前对直肠癌治疗抵抗及其分子机制的预测系统第三实施例的结构框图;
35.图4为本发明在治疗前对直肠癌治疗抵抗及其分子机制的预测系统第四实施例的结构框图;
36.图5为本发明在治疗前对直肠癌治疗抵抗及其分子机制的预测系统一实施例中的显示模块显示的列线图;
37.图6为本发明在治疗前对直肠癌治疗抵抗及其分子机制的预测系统一实施例中预测模型对于训练集病例和验证集病例的预测效能图。
38.本发明目的的实现、功能特点及优点将结合实施例,参照附图做进一步说明。
39.附图标号说明:
40.标号名称标号名称10特征提取装置40预测装置20采集装置401分析模块
30标签构建装置402生成模块301数据清洗模块403预测模块302逻辑回归模块404显示模块303标签向量计算模块50图像预处理装置
具体实施方式
41.应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
42.参照图1,图1为本发明在治疗前对直肠癌治疗抵抗及其分子机制的预测系统第一实施例的结构框图。
43.本实施例在治疗前对直肠癌治疗抵抗及其分子机制的预测系统包括:特征提取装置10、采集装置20、标签构建装置30以及预测装置40;所述特征提取装置10,用于对标注有患者的感兴趣区域的影像图像和病理图像进行特征提取,得到影像图像组学特征值和病理图像组学特征值。
44.需要说明的是,本发明实施例的执行主体为在治疗前对直肠癌治疗抵抗及其分子机制的预测的装置,还可为其他可实现相同或相似功能的设备或装置,本实施例对此不作限制。
45.在具体实施中,特征提取装置10用于对标注有患者感兴趣区域的影像图像和病理图像进行特征提取,影像图像为直肠mri(magnetic resonance imaging,磁共振成像)的磁共振t2加权像(t2wi)及dwi(diffusion-weighted imaging,扩散加权成像)序列图像,病理图像为直肠活检病理wsi(whole slide image,全视野数字切片)图像。
46.在本实施例中,所述采集装置20,用于采集患者的临床资料。患者的临床资料是采集装置20调用信息采集平台进行患者的临床资料采集,信息采集平台可为电脑、平板电脑或移动终端,通过操作者上传患者的临床资料至信息采集平台,当需要采集患者的临床资料时,采集装置20调用信息采集平台,通过信息采集平台采集患者的临床资料。
47.进一步地,采集装置20,还用于调用信息采集平台,通过所述信息采集平台采集至少包括性别信息、年龄信息、体重指数信息、肿瘤分化程度信息、血清学化验结果、分子标志物检测信息以及手术病理trg分级信息;采集装置20,还用于根据所述性别信息、所述年龄信息、所述体重指数信息、所述肿瘤分化程度信息、所述血清学化验结果、所述分子标志物检测信息以及所述手术病理trg分级信息,得到患者的临床资料。
48.可以理解的是,患者的临床资料至少包括患者的性别信息、年龄信息、体重指数(body mass index,bmi)信息、肿瘤分化程度、血清学化验结果、分子标志物检测信息以及手术病理trg分级信息,血清学化验结果包括:cea(carcinoembryonic antigen,癌胚抗原)、ca-199(carbohydrate antigen-199,糖类抗原-199)水平信息等,分子标志物检测信息包括:hif-1α信息(hypoxia inducible factor-1α,低氧诱导因子-1α)、vegf信息(vascular endothelial growth factor,血管内皮生长因子)、cd4(cluster of differentiation,分化簇)和cd8因子免疫组化染色得到的免疫评分信息以及dmmr(deficient mismatch repair,错配修复功能缺陷)状态信息等。用户可通过信息采集平台上传患者的临床资料,采集装置20通过调用信息采集平台采集患者的临床资料。
49.在本实施例中,所述标签构建装置30,用于对所述影像图像组学特征值和病理图
像组学特征值进行筛选,并构建表征治疗抵抗及其分子机制的多组学标签。
50.需要说明的是,标签构建装置30主要是基于特征提取装置10提取的影像图像组学特征值和病理图像组学特征值进行筛选,并对筛选后的数据进行标签构建,在进行标签构建前,通过采集装置20采集的临床资料中的分子标志物检测信息的hif-1α、vegf、cd4和cd8因子免疫组化染色得到的免疫评分及dmmr状态信息对筛选后的数据进行验证,并对验证后的数据进行标签构建,得到表征治疗抵抗及其分子机制的多组学标签。
51.应理解的是,所述预测装置40,用于对所述表征治疗抵抗及其分子机制的多组学标签和所述临床资料进行回归分析处理,并根据处理结果对直肠癌治疗抵抗及其分子机制的预测结果进行显示。
52.预测装置40通过接收标签构建装置30传输的表征治疗抵抗及其分子机制的多组学标签进行多因素回归分析,并接收采集装置20传输的患者的临床资料进行单因素回归分析。并对分析后的表征治疗抵抗及其分子机制的多组学标签和临床资料进行处理,通过处理结果对直肠癌治疗抵抗及其分子机制的预测结果进行显示。
53.在具体实施中,spss(statistics 22,ibm corp,armonk,ny)软件为统计分析软件,预测装置40通过使用spss(statistics 22,ibm corp,armonk,ny)软件中的单因素回归分析(univariable regression analysis)对临床资料进行单因素回归分析,并使用spss(statistics 22,ibm corp,armonk,ny)软件中的多因素回归分析(multiple regression analysis)对表征治疗抵抗及其分子机制的多组学标签进行多因素回归分析。
54.本实施例通过在治疗前对直肠癌治疗抵抗及其分子机制的预测系统中设置特征提取装置、采集装置、标签构建装置以及预测装置;特征提取装置,用于对标注有患者的感兴趣区域的影像图像和病理图像进行特征提取,得到影像图像组学特征值和病理图像组学特征值;采集装置,用于采集患者的临床资料;标签构建装置,用于对影像图像组学特征值和病理图像组学特征值进行筛选,并构建表征治疗抵抗及其分子机制的多组学标签;预测装置,用于对表征治疗抵抗及其分子机制的多组学标签和临床资料进行回归分析处理,并根据处理结果对直肠癌治疗抵抗及其分子机制的预测结果进行显示。本发明可以在治疗前对患者的新辅助治疗反应进行预测,可对直肠癌治疗抵抗人群进行分析和其潜在的分子机制进行分析,实现对直肠癌治疗抵抗患者进行针对的个性化治疗,具有重要的临床意义,改善直肠癌患者的整体生存。
55.参考图2,图2为本发明在治疗前对直肠癌治疗抵抗及其分子机制的预测系统第二实施例的结构框图。
56.基于上述第一实施例,本实施例在治疗前对直肠癌治疗抵抗及其分子机制的预测系统还包括:图像预处理装置50;所述图像预处理装置50,用于通过预设调取路径调取患者的经过过滤标准化信号强度的影像图像和直肠活检标本经染色的病理图像;所述图像预处理装置50,还用于通过itk-snap软件和imagescope软件对所述影像图像和病理图像进行勾画,得到标注有患者的感兴趣区域的影像图像和病理图像。
57.在本实施例中,预设调取路径可为用户提供的调取路径,例如电子计算机的内存盘的调取路径,还可为其它可对直肠mri和wsi图像存储并调取的设备,本实施例对此不作限制。当用户上传直肠mri影像图像和wsi病理图像时,对直肠mri影像图像通过滤波器进行过滤并标准化信号强度,得到患者的直肠mri影像图像。对直肠活检wsi病理标本通过苏木
精-伊红染色(hematoxylin-eosin staining)处理,得到患者的wsi病理图像。
58.在具体实施中,itk-snap(www.itksnap.org)软件为医学图像可视化处理的软件,当图像预处理装置50调取患者的经过处理的影像图像和病理图像后,通过itk-snap(www.itksnap.org)软件对直肠mri影像图像中代表肿瘤组织的感兴趣区域(region of interest,roi)进行勾画,得到标注有患者的感兴趣区域的影像图像,标注有患者的感兴趣区域的影像图像指的是图像中标注有代表肿瘤组织的感兴趣区域。imagescope(www.leicabiosystems.com)软件为图像浏览编辑的软件,用户可以通过imagescope(www.leicabiosystems.com)软件对图像进行调整放大,平移或缩放,标注感兴趣的领域,比较不同的污渍,其他功能之间进行图像分析。图像预处理装置50还通过imagescope(www.leicabiosystems.com)软件对wsi病理图像中的代表肿瘤组织的感兴趣区域进行勾画,得到标注有患者的感兴趣区域的病理图像。
59.应理解的是,在对影像图像和病理图像进行勾画时,可通过专业的临床医生使用图像预处理装置50对影像图像和病理图像进行勾画。
60.在本实施例中,所述特征提取装置10,还用于对标注有患者的感兴趣区域的影像图像至少基于描述病灶区的一阶特征、形状特征和纹理特征进行特征提取,得到影像图像组学特征值;所述特征提取装置10,还用于对标注有患者的感兴趣区域的病理图像至少基于像素强度、形态特征和核纹理特征进行特征提取,得到病理图像组学特征值。
61.pyradiomics(version2.1.1,https://github.com/radiomics/pyradiomics)软件平台为提取特征的软件平台,可从医学影像中提取出影像组学特征,在具体实施中特征提取装置10通过pyradiomics(version 2.1.1,https://github.com/radiomics/pyradiomics)软件平台对标注有患者的感兴趣区域的影像图像进行特征提取,对标注有患者的感兴趣区域的影像图像至少基于描述病灶区的一阶特征、形状特征和纹理特征进行特征提取,得到影像图像组学特征值,影像图像组学特征值至少包含707个特征值,分别为19个用于描述病灶区的一阶特征值、16个形状特征值以及672个纹理特征值,其中,672个纹理特征值包括28个glcm(gray-level co-occurrence matrix,灰度共生矩阵)特征值、16个glrlm(gray-level run-length matrix,灰度游程矩阵)特征值、16个glszm(gray-level size zone matrix,灰度区域大小矩阵)特征值、18个gldm(gray level dependence matrix,灰度相关矩阵)特征值、269个wavelets小波特征值以及325个logs特征值。cellprofiler软件平台(version2.2.1,https://cellprofiler.org/)为生物图像处理的软件平台,特征提取装置10还可通过cellprofiler软件平台(version2.2.1,https://cellprofiler.org/)对标注有患者的感兴趣区域的病理图像进行特征提取,对标注有患者的感兴趣区域的病理图像至少基于像素强度、形态特征和核纹理特征进行特征提取,得到病理图像组学特征值。病理图像组学特征值至少包含707个特征值,分别为175个像素强度特征值、285个形态特征至以及360个核纹理特征值。
62.本实施例通过在治疗前对直肠癌治疗抵抗及其分子机制的预测系统还设置图像预处理装置,图像预处理装置用于通过预设调取路径调取患者的经过过滤标准化信号强度的影像图像和直肠活检标本经染色的病理图像,所述图像预处理装置还用于通过itk-snap软件和imagescope软件对所述影像图像和病理图像进行勾画,得到标注有患者的感兴趣区域的影像图像和病理图像,通过图像预处理装置对影像图像以及病理图像进行预处理,对
患者的影像图像和病理图像的信息进行深层次挖掘,便于更准确地对影像图像以及病理图像进行特征提取,提高预测的效果。
63.参考图3,图3为本发明在治疗前对直肠癌治疗抵抗及其分子机制的预测系统第三实施例的结构框图。
64.基于上述第一实施例和第二实施例,本实施例中所述标签构建装置30包括:数据清洗模块301、逻辑回归模块302以及标签向量计算模块303;所述数据清洗模块301,用于对影像图像组学特征值和病理图像组学特征值的多组学数据进行清洗,清洗出无效数据和错误数据,得到符合要求的多组学数据,并将所述多组学数据中连续变量以中位数为界值转化为二分类变量,得到转化后的多组学数据。
65.在具体实施中,标签构建装置30主要基于特征提取装置10输入的影像图像组学特征值和病理图像组学特征值,进行筛选并构建表征三种ncrt抵抗机制代表性分子标志物分析的多组学标签。主要分为三个模块进行操作,第一个模块为数据清洗模块301,通过数据清洗模块301对特征提取装置10输入的影像图像组学特征值和病理图像组学特征值的多组学数据进行数据清洗,将影像图像组学特征值和病理图像组学特征值的多组学数据中的无效数据和错误数据清洗出来,得到有效的符合要求的多组学数据。数据清洗模块301还用于将得到的符合要求的多组学数据中的连续变量以中位数为界值转化为二分类变量,得到转化后的多组学数据。
66.在本实施例中,当得到转化后的多组学数据后,可对多组学数据进行降维筛选,则通过逻辑回归模块302进行处理,所述逻辑回归模块302,用于基于组学特征与分子标志物表达变量之间的关系对所述转化后的多组学数据进行数据降维,得到能够表征分子标志物表达水平和预设状态的影像图像组学特征和病理图像组学特征。
67.应理解的是,组学特征与分子标志物表达变量之间的关系可通过采集装置20采集的患者的临床资料中的分子标志物检测情况信息得到组学特征与分析标志物表达变量之间的关系。通过组学特征与分子标志物表达变量之间的关系对转化后的多组学数据进行数据降维,具体地,逻辑回归模块302,还用于基于组学特征与分子标志物表达变量之间的关系通过r软件中的最小绝对收缩和选择运算符公式对转化后的多组学数据进行数据降维,筛选出能够表征分子标志物表达水平和是否为错配修复缺陷状态的影像图像组学特征和病理图像组学特征。
68.r软件(version 3.5.1;http://www.rproject.org)为数据处理、计算和制图软件,逻辑回归模块302通过使用r软件(version 3.5.1;http://www.rproject.org)中的最小绝对收缩和选择运算符(least absolute shrinkage and selection operator,lasso)公式对转化后的多组学数据中的两千多个组学变量进行数据降维,得到能够显著表征hif-1α,vegf,cd4及cd8四个分子标志物表达水平和是否为错配修复缺陷状态的影像组学特征和病理组学特征,其中,判断是否显著表征上述四个分子标志物表达水平的条件为组学变量高于或低于设置的界值。
69.在具体实施中,所述逻辑回归模块302,还用于基于所述分子标志物检测信息和手术病理trg分级信息对筛选出的能够表征分子标志物表达水平和是否为错配修复缺陷状态的影像图像组学特征和病理图像组学特征进行验证。
70.需要说明的是,逻辑回归模块通过获取患者的临床资料中的分子标志物检测信息
以及手术病理trg分级信息对筛选出的能够表征分子标志物表达水平和是否为错配修复缺陷状态的影像图像组学特征和病理图像组学特征进行验证,根据验证结果得到更为准确的显著表征hif-1α,vegf,cd4及cd8四个分子标志物表达水平和是否为dmmr状态的影像图像组学特征和病理图像组学特征。当得到了影像图像组学特征和病理图像组学特征后,通过标签向量计算模块303对影像图像组学特征和病理图像组学特征进行计算,所述标签向量计算模块303,用于将能够表征每个分子标志物表达水平和预设状态的影像图像组学特征和病理图像组学特征进行机器学习,得到对应的影像图像组学特征向量和病理图像组学特征向量,并对所述对应的影像图像组学特征向量和病理图像组学特征向量进行标记,得到表征治疗抵抗及其分子机制的多组学标签。
71.在具体实施中,通过标签向量计算模块303对能够表征每个分子标志物表达水平和预设状态的影像图像组学特征和病理图像组学特征进行机器学习,机器学习的方法可为决策树法、随机森林法或其他可进行机器学习的方法,本实施例对此不作限制。通过机器学习得到对应的表征每个分子标志物的多个组学特征向量中的影像图像组学特征向量和病理图像组学特征向量,将表征每个分子标志物的多个组学特征向量纳入向量公式进行计算和标记,得到能够更精准地表征治疗抵抗及其分子机制的多组学标签,包括sighif-1α,sigvegf,sigcd4,sigcd8,sigdmmr。
72.本实施例通过在标签构建装置中设置数据清洗模块、逻辑回归模块以及标签向量计算模块;所述数据清洗模块,用于对影像图像组学特征值和病理图像组学特征值的多组学数据进行清洗,清洗出无效数据和错误数据,得到符合要求的多组学数据,并将所述多组学数据中连续变量以中位数为界值转化为二分类变量,得到转化后的多组学数据;所述逻辑回归模块,用于基于组学特征与分子标志物表达变量之间的关系对所述转化后的多组学数据进行数据降维,得到能够表征分子标志物表达水平和预设状态的影像图像组学特征和病理图像组学特征;所述标签向量计算模块,用于将能够表征每个分子标志物表达水平和预设状态的影像图像组学特征和病理图像组学特征进行机器学习,得到对应的影像图像组学特征向量和病理图像组学特征向量,并对所述对应的影像图像组学特征向量和病理图像组学特征向量进行标记,得到表征治疗抵抗及其分子机制的多组学标签。通过数据清洗模块对数据进行清洗,得到有效的数据,并通过逻辑回归模块对有效数据进行降维和筛选,得到更为准确地表征分子标志物表达水平和预设状态的影像图像组学特征和病理图像组学特征的数据,并通过标签向量计算模块对表征分子标志物表达水平和预设状态的影像图像组学特征和病理图像组学特征的进行标签构建,得到更为准确地表征分子分型的多组学标签。
73.参考图4,图4为本发明在治疗前对直肠癌治疗抵抗及其分子机制的预测系统第四实施例的结构框图。
74.基于上述第一实施例,本实施例所述预测装置40包括:分析模块401、生成模块402以及预测模块403;所述分析模块401,用于对所述临床资料进行单因素回归分析,并对所述表征治疗抵抗及其分子机制的多组学标签进行多因素回归分析,得到影响患者生存的临床因素和分子分型标签。
75.应理解的是,分析模块401通过使用spss(statistics 22;ibm corp,armonk,ny)软件中的单因素回归分析(univariable regression analysis),筛选出影响患者治疗抵
抗敏感性的临床危险因素,并使用spss(statistics 22;ibm corp,armonk,ny)软件中的多因素回归分析(multiple regression analysis)对表征治疗抵抗及其分子机制的多组学标签进行多因素回归分析,得到能够独立影响患者生存的临床因素和分子分型标签。
76.影响患者治疗抵抗敏感性的临床危险因素指的是显著独立影响患者治疗抵抗敏感性的临床危险因素,其中trg 1-2为敏感;trg 3-4为抵抗,临床危险因素即p《0.05的因素,p时统计假设检验的概率。分析模块通过使用spss(statistics 22;ibm corp,armonk,ny)软件中的多因素回归分析对表征治疗抵抗及其分子机制的多组学标签进行多因素回归分析,得到能够显著独立影响患者生成的分子分型标签。
77.进一步地,所述生成模块402,用于通过初始学习模型对所述影响患者生存的临床因素和分子分型标签和临床因素进行学习,生成预测模型;所述预测模块403,用于通过所述预测模型对输入的待预测病理信息的直肠癌治疗抵抗及其分子机制进行预测。
78.需要说明的是,初始学习模型可为通过决策树法、随机森林法、支持向量机法、朴素贝叶斯法或其他可进行机器学习的方法进行学习得到的机器学习模型。通过将分析模块401得到的显著独立影响患者生存的分子分型标签和临床因素输入至初始学习模型进行学习,生成预测模型。预测模型指的是精准度和稳定性高的治疗抵抗敏感性预测模型。当得到预测模型后,通过预测模块403接收操作者后续输入的待预测的前瞻性病理信息并输入至预测模型进行预测。待预测的前瞻性病理信息包括患者的mri图像、wsi图像以及临床资料。通过预测模型对输入的待预测病理信息的直肠癌治疗抵抗及其分子机制进行预测,得到预测的结果,实现在治疗前同时预测larc患者的ncrt抵抗及潜在分子机制。
79.进一步地,所述预测装置40还包括:显示模块404;所述显示模块404,用于对预测的结果通过列线图显示,并显示相应的分子分型标签权重以及直肠癌治疗抵抗几率。
80.显示模块404用于对预测模型预测的结果进行显示,通过生成结构列线图以及基于模型训练或者验证病例集的带的代表模型预测效能的接受者操作特征(receiver operating characteristic,roc)曲线,对预测的结果进行显示,通过列线图显示出相应的分子分型标签权重,即列线图评分并显示ncrt抵抗几率,即模型总分及对应概率,实现在治疗前同时预测larc患者的ncrt抵抗及潜在分子机制。
81.进一步地,对上述预测装置40通过具体的距离进行详细的说明,以一个包含有358例larc患者的临床资料、mri图像资料以及wsi图像资料进行在治疗前对直肠癌治疗抵抗及其分子机制的预测系统的构建及外部验证。将患者根据治疗时间排序并按7:3的比例分为训练组250例和外部验证组108例。将训练组患者的mri及活检病理wsi图像存入既定文件夹,在采集装置20中输入完整信息,经过上述系统模型构建过程最终在显示模块404中显示如下图5所示的列线图。图5中,分值为每个分子分型标签的列线图评分显示,分子分型包标签包括:cea、sighif-1α、sigvegf、sigdmmr、sigcd4以及sigcd8,通过对每个分子分型标签权重进行显示,并显示ncrt抵抗率,即模型总分以及对应的概率。
82.完成初始系统模型构建后,依次输入验证病例的mri、wsi图像和临床资料,临床资料中无分子检测信息和病理信息,系统即可基于上述列线图运算并显示出特定患者的各分子标签评分及ncrt抵抗率,给出治疗抵抗及其分子机制的预测,将待预测患者作为验证病例在得出所有预测结果后,将实际分子表达情况以及病理trg反应输入系统,根据预测与实际的偏差评价模型的一致性和稳定性。如图6所示,图6为本发明在治疗前对直肠癌治疗抵
抗及其分子机制的预测系统中的预测模型对于训练集病例和验证集病例的预测效能图,横轴为特异性的百分比、纵轴为敏感性的百分比,其中auc(area under curve,roc曲线下的面积)分别达到了0.994和0.731。
83.本实施例通过在预测装置中设置分析模块、生成模块以及预测模块;所述分析模块,用于对所述临床资料进行单因素回归分析,并对所述表征治疗抵抗及其分子机制的多组学标签进行多因素回归分析,得到影响患者生存的临床因素和分子分型标签;所述生成模块,用于通过初始学习模型对所述影响患者生存的临床因素和分子分型标签和临床因素进行学习,生成预测模型;所述预测模块,用于通过所述预测模型对输入的待预测病理信息的直肠癌治疗抵抗及其分子机制进行预测,实现在治疗前同时预测larc患者的ncrt抵抗及潜在分子机制。
84.应当理解的是,以上仅为举例说明,对本发明的技术方案并不构成任何限定,在具体应用中,本领域的技术人员可以根据需要进行设置,本发明对此不做限制。
85.需要说明的是,以上所描述的工作流程仅仅是示意性的,并不对本发明的保护范围构成限定,在实际应用中,本领域的技术人员可以根据实际的需要选择其中的部分或者全部来实现本实施例方案的目的,此处不做限制。
86.另外,未在本实施例中详尽描述的技术细节,可参见本发明任意实施例所提供的在治疗前对直肠癌治疗抵抗及其分子机制的预测系统,此处不再赘述。
87.此外,需要说明的是,在本文中,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者系统不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者系统所固有的要素。在没有更多限制的情况下,由语句“包括一个
……”
限定的要素,并不排除在包括该要素的过程、方法、物品或者系统中还存在另外的相同要素。
88.上述本发明实施例序号仅仅为了描述,不代表实施例的优劣。
89.通过以上的实施方式的描述,本领域的技术人员可以清楚地了解到上述实施例系统可借助软件加必需的通用硬件平台的方式来实现,当然也可以通过硬件,但很多情况下前者是更佳的实施方式。
90.以上仅为本发明的优选实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1