一种新冠疫苗载体及其应用
1.本发明属于生物技术领域,特别涉及一种新冠疫苗载体及其应用。
背景技术:
2.omicron在受体结合结构域(rbd)中包含15个氨基酸突变,导致大多数 治疗性单克隆抗体和临床可用的疫苗无法使用。因此,迫切需要开发针对广泛 的sars-cov-2变体的通用且持久的疫苗。
3.sars-cov-2是有包膜的正链rna病毒,周围环绕着刺突(s)蛋白三聚 体,在外表面形成特征性的球茎状冠状晕圈。s蛋白包含两个亚基:s1和 s2。s1亚基通过rbd和人血管紧张素转换酶2(hace2)的结合介导识别和进 入人体细胞。随后,s蛋白发生构象变化,参与病毒包膜和细胞膜的融合。迄 今为止,大多数临床covid-19疫苗都是针对s蛋白或rbd设计的。血清学 研究表明,covid-19恢复期血清中的大部分中和活性是由rbd产生的。由于 一些rbd特异性人类中和单克隆抗体对sars-cov-2变体表现出广泛的保护 作用,因此rbd被证明是开发广谱疫苗的一个有趣目标。
4.佐剂被认为是诱导抗原特异性细胞免疫的有效工具。铝疫苗佐剂因其安全 性而被广泛使用。铝已显示优先诱导抗体产生的th2反应。然而,需要激活病 毒特异性t细胞反应来加强对omicron和其他voc的广泛保护。因此,迫切 需要能够引发针对sars-cov-2和ovc的有效t细胞反应的疫苗。在过去的 几十年中,已经开发出几种模式识别受体(prr)的小分子激动剂作为有效的佐 剂来激活细胞免疫反应并优化疫苗的功效。在这些分子中,干扰素基因刺激剂(sting)激动剂已被报道为诱导i型干扰素(ifn-i)反应和炎性细胞因子的有吸 引力的佐剂。除了产生保护性抗体和刺激宿主对sars-cov-2的免疫反应外, 最近,sting激动剂已被证明可以抑制sars-cov-2在肺上皮细胞中的复制。 尽管有这些优势,但在体内直接利用sting激动剂仍面临许多挑战。covid
‑ꢀ
19的广泛传播为sting激动剂开发安全有效的递送平台的迫切需要,该平台 以延长半衰期和提高稳定性的免疫诱导位点为目标,以诱导体内持久的免疫记 忆。
5.将抗原递送至树突状细胞(dc)为引发抗原特异性细胞免疫提供了有利的 策略。dc作为最强大的抗原呈递细胞(apc),通过靶向用于摄取、加工和引 发t细胞反应的抗原,将先天免疫反应与适应性免疫反应联系起来。作为酿酒 酵母的天然提取物,酵母β-葡聚糖颗粒(gp)形成2-4μm大小的颗粒,可被吞 噬细胞吸收。gps作为病原体相关分子模式(pamp)被prr dectin-1特异性识 别,prr dectin-1主要在单核细胞/巨噬细胞表面表达。在被dc内化和交叉呈 递后,gp已被证明可以促进成熟dc刺激,并驱动t细胞克隆扩增。此外, 由于gp的安全性已获得fda的批准,gp可被设计为sting激动剂的理想递 送平台。
技术实现要素:
6.本发明的目的在于克服现有技术的缺点与不足,提供一种新冠疫苗载体。
7.本发明的另一目的在于,提供上述新冠疫苗载体的应用。
8.本发明的目的通过下述技术方案实现:
9.一种新冠疫苗载体,包括抗原蛋白、多糖以及干扰素基因刺激因子 (sting)激动剂。
10.所述的抗原蛋白、多糖以及干扰素基因刺激因子激动剂通过偶联结合在一 起。
11.所述的抗原蛋白和干扰素基因刺激因子激动剂被包裹偶联在多糖组成的颗 粒中。
12.所述的抗原蛋白包括但不限于:新型冠状病毒rbd(sars-cov-2spikeprotein rbd)、新型冠状病毒delta变种rbd(sars-cov-2spike proteinrbd-delta)、新型冠状病毒gamma变种rbd(sars-cov-2spike proteinrbd-gamma)、新型冠状病毒omicron变种rbd(sars-cov-2spike proteinrbd-omicron)。
13.所述的多糖优选为酵母β-葡聚糖(gp)。
14.所述的干扰素基因刺激因子激动剂优选为diabzi。
15.所述的新冠疫苗载体的制备方法,优选包括如下步骤:
16.(1)制备多糖微球;
17.(2)将步骤(1)得到的多糖微球浸泡在含有干扰素基因刺激因子激动剂 和抗原蛋白的水溶液中,离心去上清,所得沉淀再悬浮,之后再次离心,将得 到的沉淀再次悬浮在交联剂中交联,交联完成后洗涤即得新冠疫苗载体。
18.步骤(1)中所述的多糖微球优选为酵母β-葡聚糖颗粒(gp)微球,具体 制备步骤如下:
19.将酿酒酵母用水洗涤,将洗涤后的酵母悬浮在碱溶液中并加热搅拌,然后 离心,将沉淀物用水重新悬浮,然后使用酸溶液调节ph,孵育,再进行离 心,用水洗涤、异丙醇洗涤、丙酮洗涤后干燥得到酵母β-葡聚糖颗粒微球。
20.步骤(1)中所述的加热搅拌为加热到85~95℃搅拌0.5~2小时。
21.所述的多糖微球和抗原蛋白的质量比优选为20:1~30:1。
22.所述的干扰素基因刺激因子激动剂和抗原蛋白的质量比优选为1:1~3:1。
23.步骤(2)中所述的浸泡的时间为浸泡1~3小时。
24.步骤(2)中所述的离心的条件为2000~4000rpm,10~30分钟。
25.步骤(2)中所述的再悬浮的条件为使用0.1~0.3%质量浓度的壳聚糖溶液 在室温下再悬浮0.5~2小时。
26.步骤(2)中所述的再次离心的条件为2000~4000rpm,10~30分钟。
27.步骤(2)中所述的交联的条件为使用0.05~0.2%质量浓度的京尼平交联 溶液悬浮交联0.5~2小时。
28.步骤(2)中所述的洗涤为使用pbs洗涤1~3次。
29.所述的新冠疫苗载体在制备新冠疫苗中的应用。
30.本发明相对于现有技术具有如下的优点及效果:
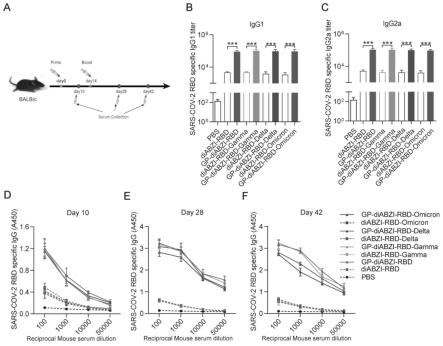
31.本发明提供了一种新冠疫苗载体及其应用。该载体由sars-cov-2rbd作 为抗原和sting激动剂diabzi与酵母β-葡聚糖颗粒(gp-diabzi-rbd)偶联组 成。与单独的diabzi-rbd疫苗相比,gp-diabzi-rbd疫苗表现出持续的疫 苗释放,并在小鼠中引发更持久的免疫反应。在小鼠中腹膜内注射gp
‑ꢀ
diabzi-rbd可以引起显着的细胞和体液免疫反应。特别是
gp-diabzi-rbd疫 苗提供的原型rbd抗原表现出更强和更长的体液免疫反应和抗病毒保护。
附图说明
32.图1是共聚焦激光扫描显微镜结果图。
33.图2是蛋白质印迹实验电泳结果图。
34.图3是蛋白质印迹实验电泳结果图,显示gp-diabzi-rbd疫苗激活 bmdcs细胞的sting信号通路。
35.图4是共聚焦激光扫描显微镜结果图,显示gp-diabzi-rbd疫苗可快速 被bmdcs细胞识别并摄取。
36.图5是rt-pcr结果分析图;gp-diabzi-rbd疫苗激活sting途径并显 示出更持久的免疫反应;rt-pcr分析显示指示的促炎细胞因子和干扰素刺激 相关的基因转录物在小鼠bmdcs细胞中的表达。
37.图6是gp-diabzi-rbd疫苗接种促进balb/c小鼠的t细胞免疫反应结果 图;a-b:流式细胞术显示小鼠在gp-diabzi-rbd或diabzi-rbd/gp-rbd治 疗下ifn-γ
+
cd4
+
t(a)和ifn-γ
+
cd8
+
t(b)的比例;c:elisa显示在gp
‑ꢀ
diabzi-rbd或diabzi-rbd/gp-rbd处理下小鼠中ifn-γ、il-2、il-6和il
‑ꢀ
10的产生。
38.图7是gp-diabzi-rbd疫苗接种在balb/c小鼠中诱导有效的体液免疫反 应结果图;a:流程图展示了疫苗策略;b:elisa分析显示在用gp-diabzi
‑ꢀ
rbd或diabzi-rbd免疫的小鼠中产生igg1和igg2a;c:elisa分析显示在 用gp-diabzi-rbd或diabzi-rbd免疫的小鼠中产生rbd特异性igg。
具体实施方式
39.下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方 式不限于此。
40.实验材料:
41.dmem(invitrogen,carlsbad,ca,usa).rpmi 1640,胎牛血清(fetalbovine serum),青霉素(penicillin),链霉素(streptomycin),β-巯基乙醇(β
‑ꢀ
mercaptoethanol),gibco(grand island,ny,usa),重组鼠gm-csf,重组鼠 il-4(hyclone,south logan,ut,usa),dmso(st.louis,mo,usa)。
42.ifnγelisa试剂盒(cat#430804)、il6 elisa试剂盒(cat#431304)、il10elisa试剂盒(cat#431417)、il2 elisa试剂盒(cat#431004)均来自biolegend(san diego,ca,usa)。pe抗小鼠cd11c抗体(cat#117307), percp抗小鼠cd3抗体(cat#100325),pe抗小鼠cd4抗体(cat#100407),apc 抗小鼠cd8抗体(cat#100711),pe-cy7抗小鼠ifn-γ抗体(cat#505825)购自 biolegend(san diego,ca,usa)。含有dapi-aqueous、辣根过氧化物酶(hrp) 缀合的山羊抗小鼠igg1(cat#ab97240)、igg2a(cat#ab97245)抗体的封固培养 基购自abcam(cambridge,england)。以下抗体用于蛋白质印迹:anti-tbk1 (cat#38066)、anti-irf3(cat#4302)、anti-nf-κb(cat#8242)、anti-sting(cat #13647)、anti-phospho-sting(ser366)(cat#50907)、anti-phospho-tbk1(ser172) (cat#5483)、anti-phospho-irf3
(ser396)(cat#37829)、anti-phospho-nf-κb p65 (ser536)(cat#3033)购自cell signaling technology(波士顿,马萨诸塞州, 美国)。抗sars-cov-2spike rbd抗体(cat#gt5449)是从genetex订购的。 diabzi sting激动剂(cat#s8796)和京尼平genipin(cat#s2412)购自selleckchemicals(houston,texas,usa)。所有其他化学试剂均购自sigma-aldrich(st. louis,mo,usa)。
43.从中国广州广东省实验动物中心获得无特定病原体(spf)6至8周龄 balb/c小鼠。所有动物实验均经暨南大学机构动物护理使用委员会批准。将 动物饲养在特定的无病原体环境中,并按照伦理机构指南进行小鼠实验。
44.实施例1
45.酵母β-葡聚糖颗粒(gp)微球的制备
46.将100g酿酒酵母(angel高活性干酵母,湖北,中国)用1.0l去离子水 洗涤两次以去除添加剂。将洗涤过的酿酒酵母悬浮在1.0l naoh(1.0m)中并在 90℃搅拌1.0h。然后以2000g离心10分钟。然后将沉淀物悬浮在1.0l去离子 水中,用hcl将ph值调至4.5,并在55℃下孵育1.5小时。然后3000rpm离 心10分钟沉淀物用1.0l去离子水洗涤两次,用250ml异丙醇洗涤4次,用 250ml丙酮洗涤两次。将沉淀物在室温下干燥成粉末,得到gp微球。
47.gp微球的制备步骤可参照文献(aouadi m,tesz g j,nicoloro s m,et al. orally delivered sirna targeting macrophage map4k4 suppresses systemicinflammation.[j].nature,2009,458(7242):1180.)。
[0048]
实施例2
[0049]
gp-diabzi-rbd颗粒及diabzi-rbd颗粒、gp-rbd颗粒的制备
[0050]
将实施例1中制备得到的gp微球(5mg)浸泡在100μl sars-cov-2原始 株rbd蛋白(购自华美生物工程有限公司,sars-cov-2coronavirus spikeglycoprotein rbd)溶液(2mg/ml)(含有200μg diabzi)(selleck chemicals, houston,usa)中2小时。然后通过离心(3000rpm,10分钟)丢弃上清液以 去除gp外的过量溶液。残余物用0.2%(w/v)壳聚糖溶液在室温下再悬浮 1h,同时振摇并再次离心(3000rpm,10分钟)。随后,将颗粒再次悬浮在5ml 体积的0.1%(w/v)京尼平交联溶液中1小时。最后,将得到的gp-diabzi-rbd 颗粒用pbs洗涤两次后储存于-80℃。
[0051]
diabzi-rbd颗粒的制备与上述步骤相同,区别仅在于不添加gp微球。
[0052]
gp-rbd颗粒的制备与上述步骤相同,区别仅在于不添加diabzi。
[0053]
实施例3
[0054]
gp-diabzi-rbd-fitc颗粒的制备
[0055]
使用fitc荧光标记rbd,取5mg的rbd蛋白溶液,加入10ml 5mm的 edta溶液和1.2ml碳酸盐缓冲液(0.1m,ph9.2)使其分散混匀。然后向溶 液中加入400μl 2.5mg/ml异硫氰酸荧光素(fitc)的dmso溶液,4℃避光孵 育过夜。最后加入2ml tris-hcl(1m,ph8.3)反应15min。透析去除未结合 的荧光素,低温冷冻干燥制备得到fitc荧光标记rbd荧光蛋白粉末,置于
‑ꢀ
80℃避光保存。
[0056]
之后通过实施例2相同步骤制备得到带有荧光标记的gp-diabzi-rbd
‑ꢀ
fitc颗粒。
[0057]
实施例4
[0058]
对gp-diabzi-rbd颗粒进行共聚焦成像分析
[0059]
使用tcs sp8共聚焦激光扫描显微镜(leica,germany)分析实施例2和 3中制备得到的颗粒的尺寸、分散性和形态。对于共聚焦成像分析,我们将 rbd用fitc标记后,与diabzi一起包裹到gp颗粒中,制备成gp-diabzi
‑ꢀ
rbd-fitc颗粒,结果如图1所示。
[0060]
实施例5
[0061]
小鼠骨髓来源的dcs(bmdcs)的产生
[0062]
从6-8周龄balb/c小鼠的股骨和胫骨中用pbs冲洗出骨髓细胞。用红细 胞裂解缓冲液对细胞进行3分钟处理,然后使用rpmi-1640洗涤。然后,将它 们在含有10%胎牛血清(fbs)、50mmβ-巯基乙醇、100u/ml青霉素、100 u/ml链霉素、重组小鼠il-4(10ng/ml)和重组小鼠的rpmi 1640培养基中培 养。以1x106个细胞/ml的浓度接种在10cm组织培养板中并加入小鼠gm
‑ꢀ
csf(20ng/ml),最终得到体积为10ml的完全rpmi 1640培养基。在第3天 和第5天,将一半培养基更换为等体积的完全rpmi 1640培养基,培养至第7 获得成熟的bmdcs。
[0063]
实施例6
[0064]
体外bmdcs摄取gp-diabzi-rbd
[0065]
使用实施例3制备得到的gp-diabzi-rbd-fitc载体(2.5μg)与实施例5 制备得到的2ml的dcs(bmdcs)(1*106个细胞)一起置于37℃细胞培养箱中 共孵育2h(bmdcs培养在含10%血清的rpmi-1640的完全培养基中)。
[0066]
孵育完成后,用300g离心bmdcs细胞,弃上清,细胞重新用2ml pbs洗 2次。然后将细胞用100ul含2μl抗小鼠cd11c-pe的抗体重悬,室温下避光染 色1h。染色完成后,pbs洗2次,再用含5μg/ml的dapi染料的pbs重悬细 胞,染色5min。随后再次用pbs将细胞洗2次,用200ul pbs重悬细胞。
[0067]
将染色完成的细胞,取10μl置于载玻片上,并轻轻用盖玻片覆盖,置于 tcs sp8共聚焦激光扫描显微镜(leica,germany)下观测gp-diabzi-rbd 载体被bmdcs细胞摄取情况,结果如图4所示。
[0068]
实施例7
[0069]
rt-pcr测定gp-diabzi-rbd疫苗激活sting途径免疫反应
[0070]
使用实施例2制备得到的gp-diabzi-rbd载体(2.5μg)与实施例5制备 得到的2ml的dcs(bmdcs)(1*106个细胞)一起置于37℃细胞培养箱中共孵 育(bmdcs培养在含10%血清的rpmi-1640的完全培养基中);并设立对照 组,使用纯diabzi(2.5μg)与bmdcs细胞孵育,第0h、6h、12h、24h取样 进行rt-pcr检测。
[0071]
cdna合成和实时pcr从实验细胞中提取总rna
[0072]
实验细胞:孵育后取样得到的bmdcs细胞
[0073]
rna提取:
[0074]
1)在1*107的细胞中加入1ml trizol裂解细胞,用取样器吹打几次,并震 荡混匀
[0075]
2)将混匀的样品在15~30℃放置5min,使得核酸蛋白复合物完全分离。
[0076]
3)加0.2ml氯仿,盖好管盖,在漩涡振荡器上震荡15s,室温放置3min。 如不能涡旋混匀,可手动颠倒混匀2min代替。
[0077]
4)4℃12000rpm,离心10-15min,样品会分成三层:红色的有机相,中 间层和上层无色的水相,rna主要在水相中,把水相(约600μl,约为所用 trizol试剂的60%)转移到新管中。
[0078]
5)在得到的水相溶液中加入等体积(约600μl)的异丙醇,上下颠倒混 匀,-20℃放置20~30min。
[0079]
6)4℃12000rpm离心10min,去上清。
[0080]
7)加入1ml 75%乙醇(depc水处理过的水配制)洗涤沉淀。加入后把管 子敲一敲,尽量使rna沉淀飘起来,加1ml乙醇。
[0081]
8)4℃12000rpm离心5min,弃上清;,用移液器小心吸弃上清,注意不 要吸起沉淀。
[0082]
9)将沉淀室温放置晾干,加入50μl depc水,用枪头吸打几次,充分溶 解rna。50℃保温1小时。溶解,-70℃保存。
[0083]
使用cdna合成试剂盒(takara)逆转录1μg rna得到cdna。然后使用 sybr green supermix试剂(bio-rad)对20μl cdna进行定量pcr(rt-qpcr) 分析。将基因表达水平标准化为gapdh。相对mrna表达通过循环阈值变化 法计算为2-δδc(t)
。通过熔解曲线分析评估rt-qpcr扩增的特异性。本研究中使 用的引物序列如下:
[0084]
ifnb1 f,5
’‑
atgaactccaccagcagaca-3’;
[0085]
ifnb1 r,5
’‑
cctgaagatctctgctcgga-3’.
[0086]
ifnλ1 f,5
’‑
cactgagccacattcactcc-3’;
[0087]
ifnλ1 r,5
’‑
caggttggaggtgacagagt-3’.
[0088]
ifit1 f,5
’‑
gcatcaccttcctctggcta-3’;
[0089]
ifit1 r,5
’‑
tggtgaatttctgcctgcac-3’.
[0090]
il-6 f,5
’‑
gccagagtccttcagagaga-3’;
[0091]
il-6 r,5
’‑
atggtcttggtccttagcca-3’.
[0092]
mx2 f,5
’‑
accagagttcagggaagagc-3’;
[0093]
mx2 r,5
’‑
cagacctaccccagcaatga-3’.
[0094]
cxcl10 f,5
’‑
ccaagtgctgccgtcatttt-3’;
[0095]
cxcl10 r,5
’‑
aatgatctcaacacgtgggc-3’.
[0096]
gapdh f,5
’‑
aacgaccccttcattgacct-3’;
[0097]
gapdh r,5
’‑
atgttagtggggtctcgctc-3’.
[0098]
将合成的cdna利用sybr green supermix试剂(bio-rad)的试剂进行荧光 定量pcr检测ifnβ、ifnλ、ifit1、mx2、il-6和cxcr10的相对于管家基 因gapdh的相对表达量变化,具体操作如下:
[0099]
q-pcr体系:
[0100][0101]
(1)按上述q-pcr体系将目的基因pcr溶液配制好(每样本3个复孔重 复),按照比例加入8联pcr管中;
[0102]
(2)震荡仪中震荡混匀,离心;
[0103]
(3)利用bio-rad实时荧光定量pcr仪进行pcr检测,具体程序如下:
[0104][0105]
(4)统计各组样本的ct值,以gapdh基因对照,计算各组目的基因的相 对表达量。
[0106]
实验结果如图5所示。
[0107]
实施例8
[0108]
蛋白质印迹实验
[0109]
对于图2,我们将gp-diabzi-rbd粒子500ug,加100ul ripa裂解液(50 mm tris
–
hcl,ph 7.5,1%triton x-100,0.5%脱氧胆酸钠,0.1%十二烷基硫 酸钠(sds),150mm nacl,添加蛋白酶抑制剂混合物(roche))中,置于超 声破碎仪中破碎3min,随后在冰上裂解30分钟。
[0110]
将裂解液以12000g,4℃,离心15分钟。取上清与5x sds-page上样缓 冲液混合,并在100℃变性10分钟,然后加入10%sds-page凝胶中电泳用 于分析蛋白质样品(以纯化的rbd蛋白10ug作为阳性对照样本)。之后使用 bio-rad蛋白转印系统将凝胶转移到pvdf膜上,用pbs-0.05%tween(pbst) 和5%bsa在室温下搅拌封闭pvdf膜1小时。按体积比1:1000加入一抗anti
‑ꢀ
sars-cov-2rbd antibody(兔抗)4度孵育过夜。与一抗孵育后,用pbst洗涤 pvdf膜4次。按体积比1:5000加入抗体抗兔hrp(cst)二抗,常温孵育 1h。在bio-rad chemidoc成像系统上使用ecl(pierce)显影pvdf膜,并使用 imagej(v1.51p)软件分析显影结果,结果如图2所示
[0111]
对于图3结果,我们分别将10ul dmso、10um diabzi或50ug gp
‑ꢀ
diabzi-rbd粒子加入培养有1*107个bmdcs细胞的培养板中,共培养3h后 收集细胞。然后pbs洗一次,500g离心获得细胞。用80ul ripa裂解液(50 mm tris
–
hcl,ph 7.5,1%triton x-100,0.5%脱氧胆酸钠,0.1%十二烷基硫 酸钠(sds),150mm nacl,添加蛋白酶抑制剂混合物(roche))重悬细胞, 随后在冰上裂解30分钟。
[0112]
将裂解液以12000g,4℃,离心15分钟。取上清与5x sds-page上样缓 冲液混合,并在100℃变性10分钟,然后加入10%sds-page凝胶中电泳用 于分析蛋白质样品。之后使用bio-rad蛋白转印系统将凝胶转移到pvdf膜 上,用pbs-0.05%tween(pbst)和5%bsa在室温下搅拌封闭pvdf膜1小 时。按体积比1:1000加入一抗(anti-phospho-sting,anti-sting、anti-tbk1、 anti-irf3、anti-nf-κb、anti-phospho-tbk1、anti-phospho-irf3、anti-phospho
‑ꢀ
nf-κb p65),4度孵育过夜。与一抗孵育后,用pbst洗涤pvdf膜4次。按 体积比1:5000加入抗体抗兔或鼠hrp(cst)二抗,常温孵育1h。在bio-radchemidoc成像系统上使用ecl(pierce)显影pvdf膜,并使用imagej(v1.51p) 软件分析显影结果,结果如图3所示。
[0113]
实施例9
[0114]
t细胞免疫反应实验
[0115]
(1)取健康6-8周龄balb/c小鼠,以实例2制备得到的gp-diabzi
‑ꢀ
rbd、diabzi-rbd
和gp-rbd进行t细胞免疫反应实验,每种载体设为一个实验组(每组总rbd含量均为2.5ug/只小鼠),总体积使用pbs调整为100ul;使用100ul/只小鼠的pbs为对照组,每组三只小鼠;
[0116]
(2)以注射当天记为第一天,按照分组分别在小鼠下腹部左侧进行一次腹腔注射。
[0117]
(3)小鼠免疫2周后,将小鼠的脾脏取出,研磨成单细胞悬液,用10mlpbs重悬,70um滤网过滤,去除组织残片;
[0118]
(4)1400rpm/min离心5min,加入2ml红细胞裂解液(碧云天)裂解3min,随后加入8mlrmpi-1640培养基,1400rpm/min,离心5min,弃上清,并对细胞计数。
[0119]
(5)将1*107细胞用1ml含5μg/mlrbd的完整rpmi1640培养基重悬,并加入培养皿中继续培养24h。
[0120]
(6)孵育24小时后,将细胞收集,1400rpm/min离心,将上清移至新的ep管中,-80℃冻存;
[0121]
(7)将细胞用cytofix/cytopermkit(bdbiosciences)对细胞进行固定和透化,并用anti-cd3,anti-cd4,anti-cd8,anti-ifnγ流式抗体进行流式染色;
[0122]
(8)将染色完成的细胞,利用bdfacsverse流式细胞仪用于获取数据,然后在flowjo软件(版本10,treestar)上进行数据分析。
[0123]
(9)利用il-6、il-10、ifn-γ和il-2elisa试剂盒测量脾脏细胞上清中il-6、il-10、ifn-γ和il-2细胞因子的分泌。实验数据如图6所示。ifn-γ,il-2,il-6以及il-10elisa实验严格按照试剂盒说明书进行操作。
[0124]
实验结果如图6所示
[0125]
实施例10
[0126]
体液免疫反应实验
[0127]
为了比较不同sarsvocs的免疫原性,我们进一步开发了六种gp-diabzi疫苗载体,分别传递delta(gp-diabzi-rbd-delta、diabzi-rbd-delta)、gamma(gp-diabzi-rbd-gamma、diabzi-rbd-gamma)和omicron(gp-diabzi-rbd-omicron、diabzi-rbd-omicron)vocs,突变株载体的制备步骤参照实施例2,其中rbd替换为相应的突变株的rbd。
[0128]
(1)取健康balb/c小鼠,以实施例2制备得到的原始株载体gp-diabzi-rbd、diabzi-rbd,以及上述制备得到的突变株载体进行体液免疫反应实验,每种载体设一个实验组,并设立使用pbs的对照组,每组三只小鼠;
[0129]
(2)所有小鼠在第0天和第14天腹腔接种含2.5ugrbd的疫苗载体(图7a)。分别在第一次免疫后的第10天、第28天和第42天收集血清,并在第42天取血清后对小鼠实施安乐死;
[0130]
(3)利用elisa法测量小鼠血清中sars-cov-2或突变株rbd特异性igg、igg1和igg2水平,具体步骤如下:
①
96孔的elisa板分别加入200ul1.5μg/ml原始型或突变株的rbd蛋白(华美生物工程有限公司),4℃孵育过夜。
②
吸走板中溶液,加入200ul的pbs洗2次,然后加入含5%bsa的pbs封闭1h。
③
将梯度稀释的小鼠血清样本200ul分别加入到板中,室温孵育2h。
④
弃去血清稀释液,用pbst溶液洗4次。
⑤
加入1:10000稀释的hrp偶联的羊抗鼠二抗溶液,室温孵育1h,再次用pbst洗4次。
⑥
加入50ul3,3',5,5'-四甲基联苯胺(tmb)底物,反应15min后加入50ul2m的h2so4终止反应。
⑦
最后将elisa板利用分光光度仪
读取450nm吸光度,使用graphpad prism 8.0软 件对数据进行非线性回归分析,以计算终点滴度,实验数据如图7所示。
[0131]
结果
[0132]
1、confocal免疫荧光证明gp-diabzi-rbd粒子可被抗原提呈细胞快速摄 取。rbd用fitc标记,发现diabzi-rbd被包裹偶联在gp颗粒中后可以被 抗原提呈细胞快速摄取(图1)。
[0133]
2、蛋白质印迹实验证明rbd蛋白被成功包裹进gps载体中(图2)。
[0134]
3、gp-diabzi-rbd颗粒可以在体外激活sting通路,诱导人上皮细胞 sting通路相关蛋白磷酸化和sting的多聚化(图3)。
[0135]
4、gp-diabzi-rbd颗粒可在体外被小鼠bmdc细胞快速的摄取(图4)。
[0136]
5、gp-diabzi-rbd疫苗可有效诱导干扰素相关基因表达,并显示更持久 的免疫反应,rt-pcr结果证明,促炎细胞因子和干扰素刺激相关的基因转录 物在小鼠bmdcs细胞中的表达特别是12h及以后的表达明显上调,证明gp
‑ꢀ
diabzi-rbd疫苗激活了sting途径并显示出更持久的免疫反应(图5)。
[0137]
6、gp-diabzi-rbd疫苗接种促进balb/c小鼠的t细胞免疫反应
[0138]
为了研究gp-diabzi-rbd疫苗接种是否可以驱动强烈的t细胞免疫反 应,我们首先检查了接种小鼠脾脏中的1型t辅助细胞(th1)免疫反应。
[0139]
实验结果表明,与pbs对照组相比,gp-diabzi-rbd免疫小鼠中ifn
‑ꢀ
γ
+
cd4
+
t细胞的百分比上调了5倍(图6a)。并且通过gp-diabzi-rbd免疫 诱导15倍的ifn-γ
+
和il-2的分泌。单独的diabzi-rbd/gp-rbd仅诱导适度 的th1细胞活化,如ifn-γ
+
cd4
+
t细胞和ifn-γ
+
、il-2分泌的百分比所示(图6c)。
[0140]
我们接下来分析了接种小鼠脾脏内的cd8 t细胞的免疫反应。我们观察到 gp-diabzi-rbd疫苗可以上调10倍的ifn-γ
+
cd8
+
t群体(图6b)。而 diabzi-rbd疫苗仅诱导适度的cd8 t细胞反应,如ifn-γ
+
cd8
+
t细胞和il
‑ꢀ
6、il-10分泌的百分比所示(图6c)。gp-rbd疫苗单独上调了适度表达ifn
‑ꢀ
γ的cd8
+
t细胞,然而,其对il-6、il-10产生的功效与gp-diabzi-rbd疫 苗相似。总之,这些结果表明gp-diabzi-rbd疫苗接种可以促进balb/c小鼠 的cd4和cd8 t细胞免疫反应。
[0141]
7、gp-diabzi-rbd疫苗接种在balb/c小鼠中诱导有效的体液免疫反应
[0142]
由于gp-diabzi-rbd和diabzi-rbd对t细胞免疫反应表现出不同的激 活能力,因此我们利用这两种策略来测试balb/c小鼠的免疫原性(图7a)。单 独接种gp-diabzi-rbd或diabzi-rbd可使小鼠血清中的igg1和igg2a水平 增加10000倍以上(图7b-c)。特别是gp-diabzi-rbd疫苗载体接种诱导的 igg1和igg2a水平比diabzi-rbd高10倍。在gp-diabzi-rbd或diabzi
‑ꢀ
rbd免疫的小鼠中不同时间段内收集的血清进行抗体检测,发现gp-diabzi
‑ꢀ
rbd载体包装的纳米疫苗相较于无载体包被的疫苗,能产生更高的的rbd特 异性igg抗体(图7d-f)。在免疫的早期(第10天),gp-diabzi-rbd疫苗组 就有低水平的特异性rbd igg抗体产生。而在两次免疫后(第28和42天), 特异性rbd igg抗体水平显著提高,而无gp载体包被的疫苗无法诱导强烈的 特异性抗体产生。此外,我们的结果还发现,包被不同rbd变体的gps载体 疫苗相对于无载体包被的疫苗均可以诱导小鼠产生高滴度的特异性rbd igg抗 体。
[0143]
可以看出,与单独的diabzi-rbd疫苗相比,gp-diabzi-rbd疫苗表现出 持续的疫苗释放,并在小鼠中引发更持久的免疫反应。在小鼠中腹膜内注射 gp-diabzi-rbd可以引起显着的细胞和体液免疫反应。
[0144]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实 施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修 饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围 之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1