微管抑制剂在制备抗肿瘤和/或抗病毒药物中的应用
1.本发明属于生物医药领域,具体涉及肿瘤免疫治疗及抗病毒新药的开发及其应用、包括多种微管抑制剂对cgamp-sting天然免疫通路的增强,以及微管抑制剂在抗肿瘤、抗病毒治疗效果的研究。
背景技术:
2.cgas-cgamp-sting信号通路是天然免疫系统重要组成部分,通过识别细胞质内异常dna诱导ⅰ型干扰素(interferons,ifns)和其他细胞因子产生,介导抗微生物先天免疫。cgas是一种胞质dna传感器,可合成2'3'-环gmp-amp(cgamp),这是cgas-sting通路中的第二信使。cgamp结合并激活效应蛋白sting,然后激活tbk1激酶并转录干扰素调节因子3(irf3),最终启动i型干扰素和其他免疫调节分子的表达;这些有效的抗病毒和抗肿瘤细胞因子可以触发适应性天然免疫反应。
3.近几年的研究表明,作为机体感应dna的主要反应通路,cgas-sting通路在多种病原微生物的感应和对应的抗感染领域具有重要作用。该通路对抵制dna病毒(比如单纯疱疹病毒hsv)以及rna病毒,都发挥着重要功能。cgas-sting通路在抗肿瘤免疫中也起着关键作用。此外,癌细胞通常携带不稳定的基因组,dna从肿瘤细胞核或线粒体中泄漏,可被吞噬细胞吸收并激活cgas-sting通路。癌细胞产生和合成的cgamp也可以激活宿主sting信号通路。因此,cgamp和sting是抗肿瘤反应中必不可少的介质。
4.sting从内质网(er)经er-高尔基体中间隔室(ergic)转移到高尔基体是其信号激活所必需的。其在结合cgamp后,sting寡聚化激活,最终被运送到溶酶体,并在溶酶体中降解。由于cgamp-sting信号传导可以引发强大的抗肿瘤、抗病毒反应,因此人们对开发sting激动剂,如cgamp类似物和其他环核苷酸产生了极大的兴趣。
5.微管是细胞骨架的主要组成部分,在维持细胞形态,细胞分裂,信号转导等过程中起着重要作用。由于微管在细胞分裂过程中的重要作用,微管蛋白已经成为研究与开发全新抗癌药物的重要靶点之一,作用于微管系统的微管蛋白抑制剂也成为一类有效的抗肿瘤药物。该类抑制剂的作用机制是通过抑制微管蛋白的聚合或者促进微管蛋白的聚合而干扰细胞的有丝分裂过程,从而发挥抗肿瘤的作用。然而,微管抑制剂在抗肿瘤领域缺乏肿瘤细胞的特异性,其对正常细胞的微管蛋白聚合也具有抑制作用及这类药物在抗肿瘤领域的应用毒副作用较大。
技术实现要素:
6.本发明的一个目的是提供一种微管抑制剂的应用。
7.本发明所提供的微管抑制剂的应用,为以下(a1)-(a7)中任一所述:
8.(a1)在制备特异性增强cgamp-sting信号通路转录激活的产品中的应用;
9.(a2)在制备增强cgamp或cgamp核苷类似物引起的免疫反应的产品中的应用;
10.(a3)在制备cgamp-sting信号增强剂中的应用;
11.(a4)在制备治疗与cgamp-sting信号通路相关的疾病的产品中的应用;
12.(a5)在制备治疗肿瘤药物中的应用;所述微管抑制剂与cgamp或cgamp的各种核苷类似物复配使用,增强cgamp的抗肿瘤作用;
13.(a6)在制备抗病毒中的应用;所述微管抑制剂与cgamp或cgamp的各种核苷类似物复配使用,增强cgamp的抗病毒作用;
14.(a7)在治疗与cgamp-sting信号通路相关的疾病中的应用。
15.示例性的,所述产品可为药物或药物制剂。
16.本发明中所述的cgamp具体为2'3'-cgamp
17.本发明的另一个目的是提供一种药物组合物。
18.本发明所提供的药物组合物,包括微管抑制剂、cgamp和/或cgamp的各种核苷类似物。
19.本发明中所述cgamp的核苷类似物是其它具有类似功能的环二核苷酸(如来源于细菌的3,3-cgamp、c-di-amp、c-di-gmp等)或cgamp分子经微小结构修饰后形成的具有类似功能的小分子。
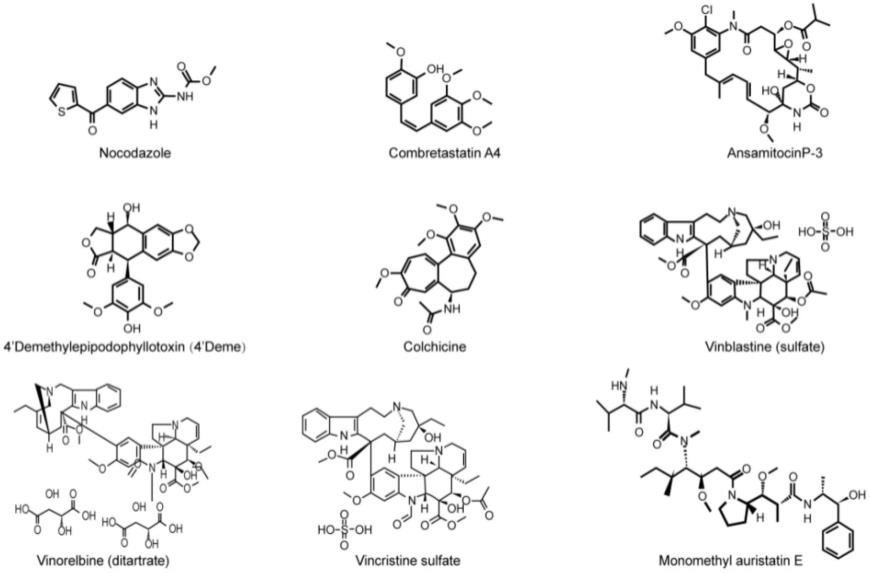
20.所述药物组合物中,所述微管抑制剂与所述cgamp的摩尔比为(0.1-1):1。本发明中所述微管抑制剂选自下述至少一种:鬼臼毒素(podofilox),甲基澳瑞他汀e(monomethyl auristatin e,mmae),诺考达唑(nocodazole),秋水仙素(colchicine),combretastatin a4(康普瑞汀),ansamitocin p-3(安丝菌素p-3),4’demethylepipodophyllotoxin(4'-去甲基表鬼臼毒素),vinblastine sulfate(硫酸长春碱),vinorelbine ditarate(酒石酸长春瑞滨),vincristine sulfate(硫酸长春新碱)。
21.上述微管抑制剂的结构式如下所示:
22.[0023][0024]
进一步的,所述微管抑制剂为鬼臼毒素(podofilox),所述药物组合物中,鬼臼毒素与cgamp的摩尔比可为(0.1-1):1,具体如0.1:0.5、0.5:0.5、1:0.5、5:0.5。
[0025]
进一步的,所述微管抑制剂为甲基澳瑞他汀e,所述药物组合物中,甲基澳瑞他汀e与cgamp的摩尔比可为(0.1-1):1,具体如0.1:0.5、0.25:0.5、1:0.5。
[0026]
上述药物组合物中,微管抑制剂和cgamp可分别独立包装,也可混合在一起。
[0027]
上述药物组合物具有下述至少一种功效:
[0028]
(b1)治疗与cgamp-sting信号通路相关的疾病;
[0029]
(b2)治疗肿瘤;
[0030]
(b3)抗病毒。
[0031]
本发明中,所述的与cgamp-sting信号通路相关的疾病包括肿瘤、感染性疾病等。
[0032]
本发明中,所述肿瘤包括实体肿瘤和非实体肿瘤,所述实体肿瘤包括但不限于肺癌、黑色素瘤、淋巴瘤等,所述非实体肿瘤包括但不限于白血病。
[0033]
本发明中,所述感染性疾病可为由病毒感染引起的疾病,所述病毒可为dna病毒或rna病毒,所述dna病毒具体如hsv-1病毒,所述rna病毒具体如vsv病毒。
[0034]
进一步的,所述药物组合物除含所述微管抑制剂与cgamp外,还可含有适宜的载体或赋形剂。
[0035]
这里的载体材料包括但不限于水溶性载体材料(如聚乙二醇、聚乙烯吡咯烷酮、有机酸等)、难溶性载体材料(如乙基纤维素、胆固醇硬脂酸酯等)、肠溶性载体材料(如醋酸纤维素酞酸酯和羧甲乙纤维素等)。其中优选的是水溶性载体材料。使用这些材料可以制成多种剂型,包括但不限于片剂、胶囊、滴丸、气雾剂、丸剂、粉剂、溶液剂、混悬剂、乳剂、颗粒剂、脂质体、透皮剂、口含片、栓剂、冻干粉针剂等。可以是普通制剂、缓释制剂、控释制剂及各种微粒给药系统。为了将单位给药剂型制成片剂,可以广泛使用本领域公知的各种载体。关于载体的例子是,例如稀释剂与吸收剂,如淀粉、糊精、硫酸钙、乳糖、甘露醇、蔗糖、氯化钠、葡萄糖、尿素、碳酸钙、白陶土、微晶纤维素、硅酸铝等;湿润剂与粘合剂,如水、甘油、聚乙二醇、乙醇、丙醇、淀粉浆、糊精、糖浆、蜂蜜、葡萄糖溶液、阿拉伯胶浆、明胶浆、羧甲基纤维素钠、紫胶、甲基纤维素、磷酸钾、聚乙烯吡咯烷酮等;崩解剂,例如干燥淀粉、海藻酸盐、琼脂粉、褐藻淀粉、碳酸氢钠与枸橼酸、碳酸钙、聚氧乙烯、山梨糖醇脂肪酸酯、十二烷基磺酸钠、甲基纤维素、乙基纤维素等;崩解抑制剂,例如蔗糖、三硬脂酸甘油酯、可可脂、氢化油等;吸
收促进剂,例如季铵盐、十二烷基硫酸钠等;润滑剂,例如滑石粉、二氧化硅、玉米淀粉、硬脂酸盐、硼酸、液体石蜡、聚乙二醇等。还可以将片剂进一步制成包衣片,例如糖包衣片、薄膜包衣片、肠溶包衣片,或双层片和多层片。为了将单位给药剂型制成丸剂,可以广泛使用本领域公知的各种载体。关于载体的例子是,例如稀释剂与吸收剂,如葡萄糖、乳糖、淀粉、可可脂、氢化植物油、聚乙烯吡咯烷酮、gelucire、高岭土、滑石粉等;粘合剂如阿拉伯胶、黄蓍胶、明胶、乙醇、蜂蜜、液糖、米糊或面糊等;崩解剂,如琼脂粉、干燥淀粉、海藻酸盐、十二烷基磺酸钠、甲基纤维素、乙基纤维素等。为了将单位给药剂型制成栓剂,可以广泛使用本领域公知的各种载体。关于载体的例子是,例如聚乙二醇、卵磷脂、可可脂、高级醇、高级醇的酯、明胶、半合成甘油酯等。为了将单位给药剂型制成注射用制剂,如溶液剂、乳剂、冻干粉针剂和混悬剂,可以使用本领域常用的所有稀释剂,例如,水、乙醇、聚乙二醇、1,3-丙二醇、乙氧基化的异硬脂醇、多氧化的异硬脂醇、聚氧乙烯山梨醇脂肪酸酯等。另外,为了制备等渗注射液,可以向注射用制剂中添加适量的氯化钠、葡萄糖或甘油,此外,还可以添加常规的助溶剂、缓冲剂、ph调节剂等。此外,如需要,也可以向药物制剂中添加着色剂、防腐剂、香料、矫味剂、甜味剂或其它材料。使用上述剂型可以经注射给药,包括皮下注射、静脉注射、肌肉注射和腔内注射等;腔道给药,如经直肠和阴道;呼吸道给药,如经鼻腔;粘膜给药。
[0036]
本发明还提供了治疗肿瘤的方法,包括如下步骤:给受体动物施用本发明所述药物组合物以治疗肿瘤。
[0037]
本发明还提供了抗病毒的方法,包括如下步骤:给受体动物施用本发明所述药物组合物以抑制病毒感染动物。
[0038]
本发明还提供了治疗感染性疾病的方法,包括如下步骤:给受体动物施用本发明所述药物组合物以治疗感染性疾病。
[0039]
所述感染性疾病可为由病毒感染引起的疾病,所述病毒可为dna病毒或rna病毒,所述dna病毒具体如hsv-1病毒,所述rna病毒具体如vsv病毒。
[0040]
本发明中,所述治疗肿瘤具体可为抑制肿瘤细胞增殖、抑制肿瘤体积。
[0041]
本发明所述药物组合物,通过其中微管抑制剂作为cgamp-sting信号增强剂,通过调控cgamp-sting信号通路进而发挥抗肿瘤的作用。
[0042]
本发明中,所述抑制病毒也可称为抗病毒。
[0043]
本发明所述药物组合物,通过其中微管抑制剂调控cgamp-sting信号活性从而上调ifnβ的水平进而发挥抗病毒作用。
[0044]
本发明中,所述动物可为哺乳动物,如人;所述动物还可为除哺乳动物以外的所述病毒感染的其他动物,如家禽和鱼类。
[0045]
天然免疫通路中的环状gmp-amp(cgamp)是第二信使,可激活干扰素基因先天免疫通路的刺激物sting蛋白,以诱导i型干扰素和其他细胞因子的表达。sting的药理学激活被认为是一种有效的抗肿瘤、抗病毒治疗策略。在本发明中,我们采用基于细胞的化学筛选,确定了nocodazole(诺考达唑),combretastatin a4(康普瑞汀),ansamitocin p-3(安丝菌素p-3),4’demethylepipodophyllotoxin(4'-去甲基表鬼臼毒素),colchicine(秋水仙碱),vinblastine sulfate硫酸长春碱),vinorelbine ditarate(酒石酸长春瑞滨),monomethyl auristatin e(甲基澳瑞他汀e)、微管去稳定剂包括鬼臼毒素(podofilox)是cgamp-sting信号通路强大的增强剂。我们发现,上述微管抑制剂通过分散含有sting的膜
结构和改变sting运输模式来增强sting寡聚化和活化。podofilox增加了sting激活后puncta的总数。podofilox可强烈增强由cgamp介导的免疫反应和抗肿瘤抗病毒作用。
[0046]
此外,cgamp和上述微管抑制剂的组合通过激活宿主sting信号传导的免疫反应对小鼠具有较强的抗肿瘤作用,并在细胞水平通过增强ifn-β的分泌发挥抗病毒的作用。总之,这些研究数据提供了微管抑制剂介导cgamp-sting通路激活进而发挥抗肿瘤、抗病毒药物研发的基础。
[0047]
本发明通过细胞表型isg-lucia报告基因表达的高通量筛选,鉴定到上述微管抑制剂均能增强cgamp-sting天然免疫信号通路的激活。因此,我们在肿瘤原位注射cgamp并通过低剂量微管抑制剂对cgamp引起的免疫信号,及抗肿瘤效果的显著放大作用实现对肿瘤病灶的治疗,并降低了微管抑制剂毒副作用。此外,微管抑制剂通过增强cgamp-sting通路进而增强了下游细胞因子ifn-β和其他趋化因子的表达从而发挥强大的抗病毒作用。这为抗肿瘤免疫治疗及抗病毒新药研发奠定了坚实的基础。
附图说明
[0048]
图1:为高通量化学筛选系统,以识别调节cgas-sting通路的小分子;
[0049]
图2:以鬼臼毒素(podofilox)为例,上述微管抑制剂能显著增强cgamp诱导的isre-荧光素酶活性;
[0050]
图3:以鬼臼毒素(podofilox)为例,研究微管抑制剂对cgamp-sting通路特异性激活的鉴定;
[0051]
图4:以鬼臼毒素(podofilox)为例,研究微管抑制剂通过分散含有sting的膜结构和改变sting运输模式来增强sting寡聚化和活化;
[0052]
图5:以鬼臼毒素(podofilox)为例,证明微管抑制剂在体外增强了人肺癌组织中cgamp-sting的激活进而发挥抗肿瘤作用;
[0053]
图6:以鬼臼毒素(podofilox)为例,证明微管抑制剂在体内增强cgamp在小鼠b16黑色素肿瘤模型中的抗肿瘤作用且延长了小鼠的寿命;
[0054]
图7:以鬼臼毒素(podofilox)为例,微管抑制剂通过激活cgamp-sting信号进而诱导ifnβ和其他一些细胞因子和趋化因子的表达并发挥抗病毒作用;
[0055]
图8:以monomethyl auristatin e(mmae)为例,微管抑制剂通过激活cgamp-sting信号进而诱导ifnβ和其他一些细胞因子和趋化因子的表达并发挥抗病毒作用。
具体实施方式
[0056]
最近的研究扩大了由cgamp诱导的先天免疫触发的免疫治疗范围,其可用作癌症治疗的新策略。因此,科学家们正在研究cgamp-sting信号通路的药理学激活原理。在本发明中,我们使用了thp1-lucia isg细胞(isg-thp1细胞,其中包含受干扰素调节因子(irf)诱导的ifn刺激反应元件(isre)启动子控制的荧光素酶报告基因),以识别来自约150,000个商业上可获得的结构多样的药物小分子集合,这些小分子以384孔板形式[10μm,0.1%二甲基亚砜(dmso)]被添加到thp1细胞中拟筛选出能调节先天免疫通路的小分子化合物(图1)。
[0057]
我们鉴定到如下微管抑制剂,包括鬼臼毒素(podofilox),nocodazole(诺考达
唑),combretastatin a4(康普瑞汀),ansamitocin p-3(安丝菌素p-3),4’demethylepipodophyllotoxin(4'-去甲基表鬼臼毒素),colchicine(秋水仙碱),vinblastine sulfate(硫酸长春碱),vinorelbine ditarate(酒石酸长春瑞滨),甲基澳瑞他汀e(monomethyl auristatin e,mmae)均能增强由cgamp诱导的thp1细胞中irf诱导的免疫反应(图2)。
[0058]
以下结合附图和实施例,对本技术的具体实施方式进行更加详细的说明,以便能够更好地理解本技术的方案以及其各个方面的优点。然而,以下描述的具体实施方式和实施例仅是说明的目的,而不是对本技术的限制。
[0059]
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为常规生物试剂商购买得到。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。下述实施例中如未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段和市售的常用仪器、试剂,可参见《分子克隆实验指南(第3版)》(科学出版社)、《细胞生物学实验(第4版)》(高等教育出版社)以及相应仪器和试剂的厂商说明书等参考。
[0060]
本技术提及的方法中各步骤的执行顺序,除特别说明外,并不限于本文的文字所体现出来的顺序,也就是说,各个步骤的执行顺序是可以改变的,而且两个步骤之间根据需要可以插入其他步骤。在本技术中,诸如第一和第二等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。
[0061]
下文的公开提供了许多不同的实施方式或例子用来说明本技术微管抑制剂的药理学作用。为了简化本技术的公开,下文中对特定例子的部件和设置进行描述。当然,它们仅仅为示例,并且目的不在于限制本技术。此外,本技术可以在不同例子中重复参考数字和/或参考字母,这种重复是为了简化和清楚的目的,其本身不指示所讨论各种实施方式和/或设置之间的关系。此外,本技术提供了的各种特定的工艺和材料的例子,但是本领域普通技术人员可以意识到其他工艺的应用和/或其他材料的使用。
[0062]
实施例1、高通量化学筛选以识别调节cgas-sting通路的小分子
[0063]
筛选工作流程如摘要图:首先用2'3'-cgamp和待筛选分子库内小分子同时处理isg-thp1细胞,并将化学发光检测值用dmso处理组进行归一化处理。从初筛的分子中选出候选分子进行二次筛选验证。最后进行isre-荧光素酶测定具体实验方法如下:isg-thp1细胞以3
×
106cells/ml的密度重悬于无血清或低血清生长培养基中,并用0.5μm 2'3'-cgamp和不同浓度的微管抑制剂/dmso一起处理isg-thp1细胞,24小时后进行化学发光检测。为了评估荧光素酶报告基因的表达,将20μl细胞悬浮液和60μl底物检测试剂(50mm hepes ph 7.0、50mm nacl、0.05%chaps、10mm edta、1μm coelenterazine)添加到96孔白板中。使用cytation
tm
cell imaging reader(biotek’s)酶标仪读取发光值。最后,将不同处理组的发光信号用dmso处理组进行归一化并以相对倍数变化作图。
[0064]
结果参见图2:我们的结果表明上述微管抑制剂确实增强了cgamp-sting信号通路的激活(图2)。与其他抑制剂相比,podofilox以剂量依赖性方式在cgamp处理后显著增强了基于细胞的活性(图2,j和k,j,用0.31nm-10μm podofilox处理isg-thp1细胞;k,不同微管抑制剂在5μm浓度下处理isg-thp1细胞),此外,podofilox对cgamp-sting信号增强效果最
强;然而,当细胞单独用微管抑制剂处理时,对cgamp-sting信号通路没有激活作用(数据未展示)。以上实验结果表明上述微管抑制剂对cgamp引起的免疫反应具有增强作用。
[0065]
实施例2、podofilox对cgamp-sting信号通路的特异性增强作用评估
[0066]
以podofilox为例研究微管抑制剂对cgamp-sting信号通路增强作用是否具有特异性,该通路下游信号是否能被上述微管抑制剂级联放大以诱导下游细胞因子、趋化因子的表达。
[0067]
具体实验方法如下:
[0068]
1.蛋白质印迹实验
[0069]
通过蛋白质印迹评估sting通路的激活情况,使用市售抗体检测cgamp-sting下游信号sting、tbk-1和irf3的磷酸化状态和总蛋白表达水平。用带有蛋白酶抑制剂(roche)的western和ip细胞裂解缓冲液(beyotime biotechnology)提取蛋白质,然后在冰上破碎30分钟,将细胞裂解物以13,000g离心10分钟,并用sds上样缓冲液在95℃下煮沸5分钟。此外,检测抗体按照制造商的建议稀释抗体。按照标准方案检测发光信号。
[0070]
2.rna提取及实时荧光定量rt-pcr
[0071]
将原代bmdm细胞以3
×
106cells/ml的密度重新悬浮在低血清生长培养基中,并在加或不加微管抑制剂的情况下用0.5μm cgamp处理。将2.5ml细胞接种到6孔板的每个孔中并孵育4h。用rneasy micro kit(qiagen)提取总rna,并用seniscript reverse transcription kit(qiagen)将1μg纯化的rna反转录为cdna。rna提取的cdna反转录具体操作过程严格根据制造商的说明和stepone plus(applied biosystems)上的不同引物组执行。最后,使用ssofast evagreen supermix(bio-rad)进行实时rt-pcr。使用2-δct方法对基因表达进行标准化,以不同处理组基因表达的倍数变化作图。
[0072]
3.酶联免疫吸附试验
[0073]
将thp1细胞和原代bmdm细胞分别以3
×
106cells/ml种入12孔培养板中。将细胞与cgamp(0.5μm)或cgamp(0.5μm)与不同剂量的微管抑制剂一起处理细胞24小时。加入triton x-100以获得细胞裂解物。根据制造商的说明分别用verikine-hs
tm
小鼠ifnβ血清elisa试剂盒(pbl assay science)和人的ifnβ酶联免疫吸附试剂盒(cloud-clone corp)测量不同处理ifn-β的浓度。
[0074]
4.isg-thp1荧光素酶报告基因表达检测如上
[0075]
isg-thp1细胞用cgamp(0.5μm)、lps(1μg)和仙台病毒(sev,moi=0.1)与podofilox处理,发光倍数变化同dmso处理组进行归一化。
[0076]
结果参见图3:我们通过分析tbk1、sting和irf3的磷酸化实验显示podofilox在cgamp(0.5μm)处理后促进了sting-tbk1-irf3信号级联激活(图3a)。此外,podofilox显著增强了cgamp诱导的野生型thp1细胞中干扰素-β(ifn-β)的产生,而不是在sting敲出的thp1细胞(图3b)。类似地,cgamp触发的ifn-β产生在用从野生型小鼠骨髓衍生的巨噬细胞(bmdm)观察到相同的增强作用,而在sting
gt/gt
(即sting敲出的小鼠)来源的bmdms细胞中并没有增强作用(图3c)。此外,我们通过对isg-thp1细胞进行基于细胞的荧光素酶测定观察到podofilox对cgamp-sting确实具备sting依赖的增强作用(图4d)。此外,为了评估ccl5、cxcl10、il-6和ifitm1在bmdms中的表达,实验结果表明微管抑制剂对sting依赖性的增强作用是微管抑制剂对cgamp触发的反应增强作用导致的(图3f)。为了验证podofilox对
cgamp-sting通路的特异性增强作用,而不是toll样受体(tlr)信号传导通路或rna感应的先天免疫通路。我们采用脂多糖(lps)、仙台病毒(sev)与podofilox组合刺激isg-thp1细胞。我们发现podofilox仅在cgamp处理后能增强免疫反应。此外,podofilox处理并未对tlr或rna感应的先天免疫途径产生影响(图3e)。总之,这些实验表明,上述微管抑制剂强有力且特异性地增强了cgamp-sting信号通路。
[0077]
实施例3、podofilox改变了sting的运输路线,增加了sting寡聚体的总数量,然后促进了sting信号的激活
[0078]
我们进一步探索了podofilox对cgamp-sting通路调节机制来解释微管抑制剂的增强作用。由cgamp介导的sting通路激活的一个重要特征是sting蛋白的动态运输。因此,我们检查了podofilox是否可以通过调节sting迁移来增强cgamp-sting途径。
[0079]
具体实验方法如下:
[0080]
1.免疫荧光显微染色
[0081]
我们构建稳定过表达sting-gfp的hela细胞,细胞在共聚焦培养皿(corning)上培养。然后用8μm cgamp(使用perfringolysin o蛋白递送)和1μm podofilox刺激细胞2h。使用63
×
(na 1.45)物镜在zeiss lsm980 airyscan2共聚焦显微镜上捕获共聚焦图像。细胞核用hoechst染色。采集的共聚焦显微图像在zen blue 3.1软件中进行图像后期处理。
[0082]
2.sting寡聚化测定
[0083]
将isg-thp1细胞以3
×
106cells/ml种入12孔培养板中。将细胞与cgamp(8μm)或cgamp(8μm)与不同剂量的podofilox一起处理4h。然后将细胞重新悬浮在含有25mm tris ph7.5、5mm mgcl2、1mm dtt、0.5mg/ml leupeptin的缓冲液中,总体积为300μl。然后将细胞在冰上孵育15min并使用微型超声仪进行超声处理。裂解物以800g离心5min以产生s1上清液。将含有20mm tris ph 7.5、150mm nacl、5mm mgcl2、10%甘油、2%np40、1mm dtt、5mm na3vo4和0.5mg/ml leupeptin的等体积缓冲液添加到40μl上清液中。使用标准方案进行native page和随后的免疫印迹。样品同时执行sds-page,并用指定的抗体进行免疫印迹。
[0084]
结果参见图4:cgamp能明显诱导sting易位和斑点形成(图4a)。重要的是,podofilox改变了cgamp-sting的运输模式,podofilox刺激使sting核周puncta分散在整个细胞质中并呈现小囊泡样(图4a)。我们推断sting信号在散在细胞质中的小囊泡中持续并被增强。我们进一步统计了sting斑点的数量,即通过将免疫荧光样本进行z-stack层扫,并从xyz三个方向统计puncta的体积,发现podofilox通过增加sting puncta的数量和体积进而增强了cgamp-sting信号的转录激活。为了确定新发现的囊泡与sting信号传导的相关性,我们收集了细胞膜并使用native page检测了sting寡聚化和活化。我们发现与单独的cgamp处理相比,podofilox诱导了更多的cgamp依赖性sting寡聚体(图4b)。此外,磷酸化的sting信号通过podofilox也被显著增强(图4b)。
[0085]
实施例4、podofilox通过增强cgamp引起的天然免疫反应在肿瘤类器官中发挥了强大的抗肿瘤作用
[0086]
我们采用肿瘤类器官作为体外肿瘤模型来评估podofilox通过增强cgamp-sting信号作为抗肿瘤新药开发的潜力。我们使用之前开发的机械样本处理方法首先获得临床非小细胞肺癌肿瘤样本。
[0087]
具体实验方法如下:
[0088]
1.肿瘤类器官培养
[0089]
简而言之,用外科剪刀将新鲜组织切碎,然后悬浮在addf+++(含1
×
glutamax、10mm hepes和1%青霉素和链霉素的dmem/f12)中,悬液经100μm和40μm膜双重过滤,将40~100μm大小的团簇释放到ocm(organoid culture)中。在细胞培养板和insmart芯片上进行器官培养。培养后的肿瘤细胞团悬液进行离心(500g,5min,4℃),并悬于低生长因子的matrigel(bd)中,60μl一滴接种于超低附着并提前预热的24孔细胞培养板中培养12天进行拍照。
[0090]
2.insmar芯片上类器官的培养及抗肿瘤药效研究
[0091]
insmar芯片上的3d药物分析。对于药物敏感性测定,收集类器官并用30μlmatrigel悬浮,使其中含有500-1000个类器官,然后接种在insmar芯片(命名为类器官芯片)上。我们使用标准微阵列机器人点样器将ocm分配在甲硅烷基化的玻璃上。在matrigel固化后,将载有玻璃的ocm阵列对齐并倒置夹在其上以接触insmar芯片和matrigel液滴。将insmar芯片置于37℃,5%co2培养箱中。一天后通过循环补料过程更新ocm培养基一次。第3天,使用alamarblue
tm
细胞活力试剂(简称ab1#)(invitrogen)进行第一次细胞活力检测,根据进样过程,将ab试剂分配到甲硅烷基化玻璃上,形成ab液滴阵列每个液滴约400nl,最终浓度为10%,并送入有机体芯片。将覆盖有ab试剂的类器官芯片转移到培养箱中培养2-3小时。之后,使用微荧光扫描仪扫描整个类器官芯片。为了消除ab试剂荧光信号引起的背景噪声,我们将ab试剂在空基质胶上孵育,作为阴性对照(nc)。扫描后,通过将滤纸扫过阵列来去除ab试剂,并用每个微孔中的1.6μl含cgamp,podofilox,cgamp+podofilox,gemcitabine+cisplatin ocm代替。
[0092]
药物化合物浓度计算如下:给药浓度=((终浓度
×
2))/1.6
[0093]
在评估第二次细胞活力(简称ab2#)之前,用cgamp,podofilox,cgamp+podofilox,gemcitabine+cisplatin处理类器官72小时。治疗结束时,去除含有药物的ocm,并再次将ab试剂玻璃送入类器官芯片上。孵育2-3小时后,再次扫描整个类器官芯片。通过将ab信号与对照组(0.1%dmso,vc)和nc组的信号标准化来分析药物处理后活细胞的百分比。细胞活力分数通过以下公式计算:
[0094][0095]
(oab1#&oab2#=第一次和第二次细胞活力测定中药物处理的类器官的荧光值;ncab1#&ncab2#=第一次和第二次细胞活力测定的对照组的背景噪声值;vcab1#&vcab2#=第一次和第二次细胞活力试验中vc的荧光值;n=每个药物浓度重复微孔数).
[0096]
将药物剂量-反应曲线绘制为细胞活力分数对μm药物浓度的对数,并进行拟合以估计半抑制浓度(ic50)。
[0097]
3.蛋白质印迹实验
[0098]
通过蛋白质印迹评估肿瘤类器官中sting通路的激活情况,使用市售抗体检测cgamp-sting下游信号sting、tbk-1和irf3的磷酸化状态和总蛋白表达水平。具体操作如实施例2。
[0099]
结果参见图5:我们使用肿瘤类器官作为体外肿瘤模型来评估podofilox是否增强cgamp介导的免疫治疗。使用之前开发的机械样本处理方法我们首先从临床手术获得样本
并培养成肺癌类器官(lc)(图5a,b)。免疫印迹结果显示,肺癌类器官对cgamp刺激有反应,cgamp处理激活了tbk1和sting的磷酸化和信号转导。与podofilox对细胞系的增强作用相似,在肺癌类器官中podofilox处理增强了cgamp诱导的sting信号磷酸化的相关激活(图5c)。此外,与临床一线化疗方案相比,cgamp和podofilox的组合对控制肺癌类器官的生长具有协同作用,单独使用podofilox治疗观察到较弱的抗肿瘤作用(图5d)。总的来说,这些结果表明,podofilox通过调控肿瘤类器官(源自人类患者肿瘤组织样本)中cgamp-sting信号通路进而发挥抗肿瘤的作用。
[0100]
实施例5、podofilox通过增强cgamp-sting信号激活在小鼠肿瘤模型中发挥抗肿瘤作用。
[0101]
为了测试podofilox在体内是否能增强cgamp的抗肿瘤活性,我们将免疫活性强的野生型c57bl/6小鼠皮下接种b16f10黑色素瘤细胞。肿瘤形成后,根据需要给予不同的治疗。
[0102]
具体实验方法如下:野生型c57bl/6小鼠和balb/c小鼠购自上海slac实验动物有限公司。sting
gt/gt
小鼠由上海交通大学医学院邓博士提供。所有小鼠均在隔离设施的特定无病原体(spf)条件下饲养,并提供无菌食物和水。动物实验按照中华人民共和国科学技术部颁布的《实验动物护理和使用指南》的规定进行。该方案经上海交通大学医学院动物护理和使用机构委员会批准。所有的实验都是在性别和年龄相匹配的老鼠身上进行的。b16f10黑色素瘤细胞在含10%胎牛血清的dmem中生长。在小鼠右侧背侧皮下注射100μl pbs共含有1
×
106个肿瘤细胞。肿瘤接种7d后,分别给予vehicle、cgamp(10μg/mice)、podofilox(0.7mg/kg)或cgamp(10μg/mice)与podofilox(0.7mg/kg)联合瘤内注射。每3天测量一次肿瘤体积,并根据π/6
×
长
×
宽
×
高的公式计算肿瘤大小。
[0103]
结果参见图6:cgamp治疗显著降低了肿瘤的生长,而podofilox的效果可以忽略不计(图6a)。podofilox和cgamp联合治疗能进一步降低了肿瘤负担(图6a)。生存曲线分析表明,由于肿瘤生长降低,cgamp治疗的小鼠比vehicle或podofilox治疗的小鼠活得更长,而podofilox和cgamp联合治疗与单独cgamp治疗相比显著延长了小鼠的生存期(图6b)。我们进一步研究了podofilox和cgamp联合治疗的抗肿瘤作用是否需要宿主sting。尽管联合治疗与单独治疗相比显著降低野生型小鼠肿瘤负荷,但在sting
gt/gt
缺陷的小鼠中,联合治疗的抗肿瘤效果能够被废除,这表明podofilox和cgamp联合治疗的抗肿瘤效果取决于小鼠宿主的sting信号通路,即在小鼠肿瘤模型中podofilox也是通过增强cgamp引起的免疫反应进而发挥了抗肿瘤的作用效率(图6c,d)。
[0104]
实施例6、podofilox通过调控cgamp-sting信号活性从而上调ifnβ的水平进而发挥抗病毒作用
[0105]
微管抑制剂作为cgamp-sting信号增强剂具有抗肿瘤的作用;此外,我们进一步研究微管抑制剂作为cgamp-sting信号增强剂能诱导ifnβ的表达并发挥抗病毒作用。
[0106]
具体实验方法如下:
[0107]
1.podofilox的抗病毒实验
[0108]
isg-thp1细胞在dmem培养基中培养,并用hsv-1-gfp(moi=1)或vsv-gfp(moi=1)感染24小时,在存在或不存在podofilox的情况下,用0.5μm cgamp刺激thp1细胞,并通过荧光显微镜(奥林巴斯)进行检测。通过imagej软件统计不同处理的荧光强度测定结果见图7。
[0109]
2.thp1感染病毒后检测细胞存活率
[0110]
利用血细胞计数板进行计数,将thp1细胞,以2
×
106的细胞数种入24孔板中进行培养,按照上述感染病毒和药物刺激24h后利用atp检测试剂盒(2.0cell viability assay no:g9241)检测不同处理组atp的含量用于指示podofilox抗病毒的效果是通过增强cgamp引起的天然免疫反应实现的,而不是小分子本身的药物毒性。atp检测具体参照试剂说明书,简而言之,首先配置atp检测试剂,按照atp检测说明书将10ml实验缓冲液加入到棕色冻干粉瓶中,轻轻混匀并在平衡至室温。随后向24孔板中分别加入50ul atp的检测试剂,室温条件下将24孔细胞培养板至于摇床上避光孵育10min,随后转移100ul悬液置入96孔白板中,使用cytation
tm
cell imaging reader(biotek’s)酶标仪读取发光值。最后,将不同处理组的发光信号用dmso处理组进行归一化并以相对倍数变化作图。
[0111]
结果参见图7:我们进一步评估podofilox通过调控cgamp-sting信号活性从而上调ifnβ的水平是否能够发挥抗病毒作用。我们使用dna病毒hsv-1-gfp和rna病毒vsv-gfp来感染thp1细胞。在有无podofilox存在的条件下检测cgamp的抗病毒效果,与之前的研究相一致,cgamp能显著降低hsv-1-gfp和vsv-gfp的荧光强度(图7a,7c)。重要的是podofilox通过增强cgamp-sting通路从而增强ifnβ产生量进而发挥了强大的抗病毒作用(图3b,图7a和图7c)。此外通过imagej对荧光强度的统计分析再次证明了podofilox和cgamp间的协同作用能抵抗dna和rna病毒的感染(图7b和图7d),且这种抗病毒的作用不是由于podofilox的毒性导致的(图7e)。总的来说,我们证明了podofilox和cgamp的联合治疗具有cgamp-sting通路依赖性的抗病毒作用,并在感染性疾病的免疫治疗中具有巨大的应用潜力。
[0112]
实施例7、monomethyl auristatin e通过调控cgamp-sting信号活性从而上调ifnβ的水平进而发挥抗病毒作用
[0113]
具体实验方法如实施例6。
[0114]
结果参见图8:我们还研究了广泛应用于抗体-偶联药物(adc)的甲基澳瑞他汀e(mmae)的作用。mmae是海兔毒素10的合成衍生物,通过抑制微管蛋白聚合而起到有效的有丝分裂抑制作用,是另一种常见的微管抑制剂。与podofilox抗病的效果类似,其也能通过增强cgamp-sting通路从而增强ifnβ产生量进而发挥了强大的抗病毒作用(图8a和图8d)。此外通过imagej对荧光强度的统计分析再次证明了mmae和cgamp间的协同作用能抵抗dna和rna病毒的感染(图8b和图8e),且这种抗病毒的作用不是因为mmae的毒性导致的(图8c和8f)。以此类推,我们的实验结果表明微管抑制剂与cgamp的联合治疗具有抗病毒的作用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1