一种伏格列波糖胶囊的制备方法与流程
1.本发明涉及一种伏格列波糖胶囊的制备方法,属于药物制剂领域。
背景技术:
2.伏格列波糖是一种α-葡萄糖苷酶抑制剂,其作用机理是竞争性抑制小肠粘膜上的麦芽糖酶、异麦芽糖酶、糖苷酶等,使双糖向单糖分解减少,导致d-葡萄糖形成减少,从而延缓淀粉和蔗糖的消化吸收,降低血糖,尤其可以控制餐后高血糖。伏格列波糖降糖作用平稳,且不刺激胰岛素的分泌,餐后无高胰岛素血症的出现,不易出现低血糖现象。
3.作为降糖药的伏格列波糖有着严格的使用方法,必须在饭前口服使用才能有效地控制饭后血糖水平,想要实现这一目的,伏格列波糖必须具备崩解快、溶出度高的特点,同时具有较好的含量均匀度。虽然伏格列波糖水溶性较好,但由于其晶形为矩阵排列的针状,因而遇到溶出介质后,溶解缓慢,起效时间较长。目前普通片剂30min的体外溶出度只有83%左右,其溶出度相对不佳,在不同程度上影响了伏格列波糖疗效的发挥。
4.中国专利cn103006597a公开了一种伏格列波糖片及其制备方法,该片剂组成以重量份计为:伏格列波糖1份、填充剂400~800份、粘合剂30~150份、润滑剂2~20份等组分;制备方法为先将原辅料分别通过筛处理,再把过筛后的物料混合均匀,加入一定量的粘合剂制备软材,经制粒、整粒后外加润滑剂,混合均匀,压片。该专利所得片剂,溶出度相对较好,但是伏格列波糖含量均匀度较差。
5.中国专利cn101219127a公开了一种伏格列波糖分散片及胶囊及其制备方法,分散片包括:伏格列波糖0.01~5%;崩解剂1~99%;稀释剂0~98%;润滑剂及助流剂0.5~20%;粘合剂0.1~20%;胶囊配方中不含粘合剂。该专利得到的分散片及胶囊,溶出度低,伏格列波糖含量均匀度也很差。
6.以上可以看到,目前伏格列波糖口服制剂仍存在溶出度低,伏格列波糖含量均匀度差等问题。
技术实现要素:
7.针对上述现有技术存在的不足,本发明提供一种伏格列波糖胶囊的制备方法,实现以下发明目的:制备出溶出度高,伏格列波糖含量均匀度好的伏格列波糖胶囊。
8.为实现上述发明目的,本发明采取以下技术方案:一种伏格列波糖胶囊的制备方法,包括原药液的制备,涂膜干燥,微粉化,冷冻干燥,胶囊灌装5个步骤。
9.以下是对上述技术方案的进一步改进:步骤1、原药液的制备将伏格列波糖加入去离子水中,溶解完全后,依次加入二十聚甘油单硬脂酸酯、聚乙烯吡咯烷酮、聚乙二醇15-羟基硬脂酸酯、燕麦β葡聚糖,搅拌溶解完全后,缓慢加入微粉硅胶,加料完毕后充分搅拌呈悬浊液状态后,得到原药液;
所述聚乙烯吡咯烷酮的分子量为6000~10000g/mol;所述聚乙二醇15-羟基硬脂酸酯的分子量为963.2 g/mol;所述燕麦β葡聚糖的分子量为6300~12000g/mol;所述微粉硅胶的粒径为3~8微米,比表面积为150~360m2/g;所述伏格列波糖、去离子水、二十聚甘油单硬脂酸酯、聚乙烯吡咯烷酮、聚乙二醇15-羟基硬脂酸酯、燕麦β葡聚糖、微粉硅胶的质量比为15~26:100~130:0.5~1.5:3~6:1~3:0.6~2:1~2。
10.步骤2、涂膜干燥将悬浊液状态的原药液涂成液态膜,控制干燥温度85~110℃,干燥时间30~70分钟,得到厚度为15~40微米的干膜。
11.步骤3、微粉化将干膜放入球磨机中,球磨至粒径为2~3微米的粉末,得到原药微粉。
12.步骤4、冷冻干燥将原药微粉于-60~-20℃下真空冷冻干燥3~6小时后得到干燥药粉。
13.步骤5、胶囊灌装将干燥药粉灌装入囊体内,得到伏格列波糖胶囊。
14.与现有技术相比,本发明取得以下有益效果:1、本发明制备出了溶出度高,伏格列波糖含量均匀度好的伏格列波糖胶囊,5分钟的溶出度为53.8~55.9%,15分钟的溶出度为93.6~96.7%,30分钟的溶出度为99.9~100%,伏格列波糖含量均匀度为0.35~0.43;2、本发明通过向伏格列波糖水溶液中加入聚乙烯吡咯烷酮和微粉硅胶并配合涂膜干燥的快速蒸发操作,抑制了伏格列波糖析出过程的结晶现象,得到了无定型粉末状态的伏格列波糖,使最终的胶囊制剂拥有极好的溶出度和含量均匀度;3、本发明通过添加二十聚甘油单硬脂酸酯和聚乙二醇15-羟基硬脂酸酯两种乳化剂,得到了分散较好的微粉硅胶悬浊液,保证了涂抹干燥过程中能够得到均匀程度好的干膜。
具体实施方式
15.以下对本发明的优选实施例进行说明,应当理解,此处所描述的优选实施例仅用于说明和解释本发明,并不用于限定本发明。
16.实施例1:一种伏格列波糖胶囊的制备方法包括以下步骤:1、原药液的制备将伏格列波糖加入去离子水中,溶解完全后,依次加入二十聚甘油单硬脂酸酯、聚乙烯吡咯烷酮、聚乙二醇15-羟基硬脂酸酯、燕麦β葡聚糖,搅拌溶解完全后,缓慢加入微粉硅胶,加料完毕后充分搅拌呈悬浊液状态后,得到原药液;所述聚乙烯吡咯烷酮的分子量为8800g/mol;所述聚乙二醇15-羟基硬脂酸酯的分子量为963.2 g/mol;所述燕麦β葡聚糖的分子量为10530g/mol;
所述微粉硅胶的粒径为5微米,比表面积为270m2/g;所述伏格列波糖、去离子水、二十聚甘油单硬脂酸酯、聚乙烯吡咯烷酮、聚乙二醇15-羟基硬脂酸酯、燕麦β葡聚糖、微粉硅胶的质量比为20:120:1:4:2:1.2:1.3。
17.2、涂膜干燥将悬浊液状态的原药液涂成液态膜,控制干燥温度100℃,干燥时间50分钟,得到厚度为30微米的干膜。
18.3、微粉化将干膜放入球磨机中,球磨至粒径为2.5微米的粉末,得到原药微粉。
19.4、冷冻干燥将原药微粉于-30℃下真空冷冻干燥4小时后得到干燥药粉。
20.5、胶囊灌装将干燥药粉灌装入囊体内,得到伏格列波糖胶囊。
21.实施例2:一种伏格列波糖胶囊的制备方法包括以下步骤:1、原药液的制备将伏格列波糖加入去离子水中,溶解完全后,依次加入二十聚甘油单硬脂酸酯、聚乙烯吡咯烷酮、聚乙二醇15-羟基硬脂酸酯、燕麦β葡聚糖,搅拌溶解完全后,缓慢加入微粉硅胶,加料完毕后充分搅拌呈悬浊液状态后,得到原药液;所述聚乙烯吡咯烷酮的分子量为6000g/mol;所述聚乙二醇15-羟基硬脂酸酯的分子量为963.2 g/mol;所述燕麦β葡聚糖的分子量为6300g/mol;所述微粉硅胶的粒径为3微米,比表面积为150m2/g;所述伏格列波糖、去离子水、二十聚甘油单硬脂酸酯、聚乙烯吡咯烷酮、聚乙二醇15-羟基硬脂酸酯、燕麦β葡聚糖、微粉硅胶的质量比为15:100:0.5:3:1:0.6:1。
22.2、涂膜干燥将悬浊液状态的原药液涂成液态膜,控制干燥温度85℃,干燥时间30分钟,得到厚度为15微米的干膜。
23.3、微粉化将干膜放入球磨机中,球磨至粒径为2微米的粉末,得到原药微粉。
24.4、冷冻干燥将原药微粉于-60℃下真空冷冻干燥3小时后得到干燥药粉。
25.5、胶囊灌装将干燥药粉灌装入囊体内,得到伏格列波糖胶囊。
26.实施例3:一种伏格列波糖胶囊的制备方法包括以下步骤:1、原药液的制备将伏格列波糖加入去离子水中,溶解完全后,依次加入二十聚甘油单硬脂酸酯、聚乙烯吡咯烷酮、聚乙二醇15-羟基硬脂酸酯、燕麦β葡聚糖,搅拌溶解完全后,缓慢加入微粉硅胶,加料完毕后充分搅拌呈悬浊液状态后,得到原药液;
所述聚乙烯吡咯烷酮的分子量为10000g/mol;所述聚乙二醇15-羟基硬脂酸酯的分子量为963.2 g/mol;所述燕麦β葡聚糖的分子量为12000g/mol;所述微粉硅胶的粒径为8微米,比表面积为360m2/g;所述伏格列波糖、去离子水、二十聚甘油单硬脂酸酯、聚乙烯吡咯烷酮、聚乙二醇15-羟基硬脂酸酯、燕麦β葡聚糖、微粉硅胶的质量比为26:130:1.5:6:3:2:2。
27.2、涂膜干燥将悬浊液状态的原药液涂成液态膜,控制干燥温度110℃,干燥时间70分钟,得到厚度为40微米的干膜。
28.3、微粉化将干膜放入球磨机中,球磨至粒径为3微米的粉末,得到原药微粉。
29.4、冷冻干燥将原药微粉于-20℃下真空冷冻干燥6小时后得到干燥药粉。
30.5、胶囊灌装将干燥药粉灌装入囊体内,得到伏格列波糖胶囊。
31.对比例1:实施例1基础上,原药液制备过程中将聚乙烯吡咯烷酮和微粉硅胶等量替换为低取代羟丙甲纤维素步骤1中,实施例1基础上,将4份聚乙烯吡咯烷酮和1.3份微粉硅胶替换为5.3份低取代羟丙甲纤维素;所述低取代羟丙甲纤维素的分子量为15340g/mol;步骤2、3、4、5操作同于实施例1。
32.对比例2:实施例1基础上,原药液制备过程中不加入二十聚甘油单硬脂酸酯和聚乙二醇15-羟基硬脂酸酯步骤1中,实施例1基础上,将1份二十聚甘油单硬脂酸酯和2份聚乙二醇15-羟基硬脂酸酯替换为3份伏格列波糖;步骤2、3、4、5操作同于实施例1。
33.对比例3:实施例1基础上,将涂膜干燥变为普通的蒸发干燥步骤1操作同于实施例1;步骤2中,将悬浊液状态的原药液放入旋转蒸发仪中,控制干燥温度100℃,干燥时间150分钟,得到干燥料;步骤3、4、5操作同于实施例1。
34.对比例4:实施例1基础上,不进行冷冻干燥步骤步骤1、2、3操作同于实施例1;不进行步骤4的操作;步骤5操作同于实施例1。
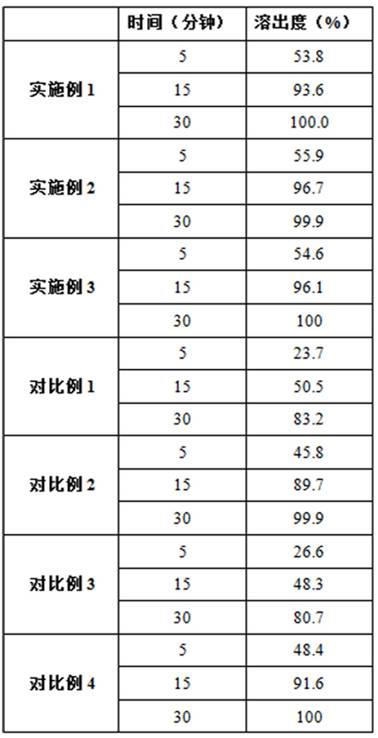
35.溶出度的测试实施例1、2、3和对比例1、2、3、4得到的样品,按中国药典2015年版四部通则0931第二法,经5分钟、15分钟、30分钟取样测定样品中伏格列波糖溶出度;测试结果见表1:表1
表1中可以看到,相比实施例1、2、3的溶出度,不加聚乙烯吡咯烷酮和微粉硅胶的对比例1以及不进行涂膜干燥的对比例3,溶出度降幅最大,这两组效果是最差的;对比例2和对比例4的溶出度也有所下降,可见加入二十聚甘油单硬脂酸酯和聚乙二醇15-羟基硬脂酸酯以及冷冻干燥步骤,对溶出度也有较大影响。
36.含量均匀度测试按照中国药典2015年版四部通则0512含量测定项下的方法,对实施例1、2、3和对比例1、2、3、4得到的样品进行含量均匀度的测定;测试结果见表2:
表2表2中可以看到,相比实施例1、2、3的含量均匀度,不加聚乙烯吡咯烷酮和微粉硅胶的对比例1以及不进行涂膜干燥的对比例3,这两组的含量均匀度是最差的;对比例2的含量均匀度也有所下降,可见加入二十聚甘油单硬脂酸酯和聚乙二醇15-羟基硬脂酸酯对含量均匀度有一定影响;对比例4的含量均匀度没有变化,冷冻干燥对含量均匀度没有影响。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1