植入物输送系统的制作方法
植入物输送系统
1.交叉参考相关引用
2.本发明要求于2021年06月10日提交的题为“implant delivery system,introducer,hemodynamic pressure monitoring system and aiding device for monitoring hemodynamic pressure”的美国临时申请第63/209,296号的优先权,以上申请的全部内容通过引用并入本发明中。
技术领域
3.本发明涉及医疗器械技术领域,尤其涉及植入物输送系统。
背景技术:
4.在经导管的瓣膜置换术中,心脏瓣膜假体在卷曲状态下被安装在输送系统的柔性导管的末端部分上,并随着柔性导管被推进穿过患者的血管,直到瓣膜假体到达植入位置;最后导管尖端处的心脏瓣膜假体在有缺陷的原生瓣膜的部位处扩展到其功能大小。
5.在现有的经导管植入的心脏瓣膜假体中,包括一种带套囊的心脏瓣膜假体。该心脏瓣膜假体在进行扩展时,需在其套囊内填充液体或气体使其膨胀。通过输送系统将该心脏瓣膜假体安放到原生瓣膜处后,由于某些生理结构原因,导致心脏瓣膜假体无法充分膨胀或良好贴壁,使得植入的心脏瓣膜假体在扩张和压差上不能满足临床要求,需引入球囊对该心脏瓣膜假体进行后扩张整形。但是,现有的球囊独立于植入物输送系统,不便于医护人员操作,手术流程复杂。
技术实现要素:
6.本发明提供植入物输送系统,以至少解决球囊独立于植入物输送系统,不便于医护人员操作,手术流程复杂的技术问题。
7.本发明的上述目的可采用下列技术方案来实现:
8.本发明提供一种植入物输送系统,适于输送心血管假体植入物,该输送系统包括外鞘管、球囊、球囊管、鼻锥体以及导丝管。球囊连接于所囊管的远端,及鼻锥体和导丝管,所述鼻锥体连接于所述导丝管的远端,球囊管和导丝管纵向延伸设置于外鞘管中且配置成可操纵地穿过外鞘管的远端。
9.进一步地,导丝管部分地穿设于球囊管中,导丝管包括自由段和毗邻该自由段的约束段。其中,该约束段由纵向延伸并穿过所述球囊管的一段导丝管所限定,该自由段由位于所述球囊管之外且与所述球囊管并行纵向延伸的一段导丝管所限定。
10.进一步地,导丝管被构造成可相对于球囊管纵向移动。具体地,球囊管包括近段管、中段管和远段管,中段管位于近段管与远段管之间,导丝管的约束段纵向延伸穿过球囊管的远段管。优选地,球囊管的中段管的外径小于近段管的外径。优选地,球囊管的远段管的近端附近设有侧壁开口,导丝管的约束段经过该侧壁开口纵向延伸穿过球囊管的远段管。优选地,球囊管的远段管被构造成双腔管,该双腔管具有与球囊相连通的第一管腔和与
球囊相隔断的第二管腔,球囊管的远段管的第一管腔与球囊管的中段管的管腔相连通,导丝管的约束段纵向延伸穿过球囊管的远段管的第二管腔。优选地,球囊管的中段管和近段管的腔体截面呈圆形,球囊管的远段管的第一管腔的腔体截面呈类月牙形。
11.进一步地,球囊内部设有与球囊的内腔相隔断的内管,球囊管的远段管的第二管腔从所述内管的近端与该内管相连通,导丝管的约束段纵向延伸穿过该内管。
12.进一步地,所述输送系统还包括若干定位丝和适于容纳所述若干定位丝的内套管,所述若干定位丝被构造成其远端连接植入物。其中,内套管的近端、导丝管的近端与球囊管的近端被构造成横向互不嵌套地并行纵向延伸穿设于外鞘管中。
13.进一步地,所述输送系统还包括手柄。外鞘管的近端与手柄连接,手柄被构造成驱使所述外鞘管向近端运动以释放所述植入物。
14.上述输送系统的特点和优点至少包括:
15.输送系统集成了球囊和球囊管,球囊和球囊管设置在外鞘管内,球囊可以随连接于定位丝远端的植入物一起输送至植入位置。使用集成在输送系统上的球囊对植入物进行调整,有利于简化手术流程,缩短手术时间,降低手术风险。
16.本发明提供再一种植入物输送系统,包括:外鞘管;若干定位丝和适于容纳若干定位丝的内套管,若干定位丝被构造成其远端可连接植入物;球囊和球囊管,所述球囊连接于所述球囊管的远端;以及鼻锥体和导丝管,所述鼻锥体连接于所述导丝管的远端。其中,所述内套管、所述导丝管及所述球囊管贯穿设置于所述外鞘管中,且所述内套管、所述导丝管以及所述球囊管三者的主体部分被构造成横向互不嵌套地并行纵向延伸穿设于所述外鞘管中。特别地,所述内套管与所述外鞘管为分体的,所述内套管的材料的硬度大于所述外鞘管的材料的硬度。特别地,所述外鞘管的材质为尼龙,所述内套管的材质为聚醚醚酮。
17.进一步地,所述内套管为三腔管,所述三腔管包括3个独立的管腔,以适于容纳3根定位丝。优选地,内套管的外侧轮廓贴近于所述外鞘管的内周壁而设置。具体地,所述内套管的三个管腔呈弧形分布,所述内套管的外轮廓的外接圆的直径与外鞘管的内径相等。
18.进一步地,所述输送系统还包括手柄,外鞘管的近端和内套管的近端连接至所述手柄。球囊管的近端、导丝管的近端及所述若干定位丝的近端均延伸至所述手柄之外。手柄中设有第一密封构件,第一密封构件可被构造成为内套管、球囊管和导丝管提供密封。其中,第一密封构件为球囊管和导丝管提供的密封是可纵向活动的密封。优选地,手柄中还设有第二密封构件,第二密封构件可被构造成为所述若干定位丝提供可纵向活动的密封。具体地,第一密封构件可以是密封垫,所述第二密封构件可以是颈缩件。
19.上述再一种植入物输送系统的特点及优点至少包括:
20.该输送系统集成了球囊和球囊管,球囊和球囊管设置在外鞘管内,球囊可以随连接于定位丝远端的植入物一起输送至植入位置。通过定位丝对植入物的位置和形态进行调整,并通过定位丝向植入物输送填充物,使植入物膨胀。球囊随植入物一起到达植入位置,方便利用球囊对植入物进行调整。有利于简化手术流程,缩短手术时间。内套管、球囊管以及导丝管三者在外鞘管中相对独立,可降低操作单个内部导管时对其它的内部导管的干扰。
附图说明
21.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
22.图1a-图1b为一种实施方式的植入物输送系统的结构示意图;
23.图1c为图1a中的a-a向的剖视图;
24.图2a-图2b为球囊管与导丝管的装配关系示意图;
25.图3a-图3h为球囊管的示意图;
26.图4a-图5为鼻锥体的示意图;
27.图6a-图6b为手柄的示意图;
28.图7、图8a为托架与密封组件、外鞘管、定位丝、球囊管、导丝管的装配关系示意图;
29.图8b为图8a中去除定位丝、球囊管、导丝管的剖视图;
30.图8c为图8a中去除定位丝的爆炸示意图;
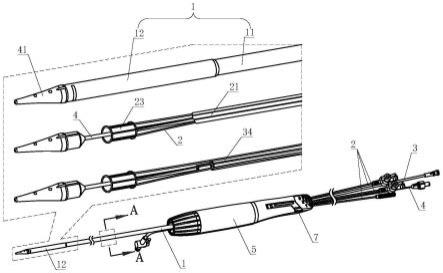
31.图9a、9b为托架与密封组件的爆炸示意图;
32.图10a-图10h为植入物输送系统的工作过程示意图;
33.图11为另一种实施方式的植入物输送系统的结构示意图;
34.图12a-图13c为导引鞘管及其与外鞘管配合的示意图。
具体实施方式
35.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
36.实施例一
37.植入物输送系统,如图1a、图1b、图2a和图2b所示,该输送系统包括手柄5、外鞘管1、定位丝2、球囊34、球囊管3、导丝管4、和鼻锥体41,外鞘管1的近端与手柄5连接。定位丝2穿设于外鞘管1内,定位丝2的远端被构造成连接植入物23,通过定位丝2可调节植入物23的位置从而对植入物23进行精准定位,并且定位丝2还可以为植入物23内填充或回收介质提供流体通道。球囊34连接于球囊管3的远端,鼻锥体41连接于导丝管4的远端,球囊管3和导丝管4在外鞘管1的内腔中纵向延伸且可穿过外鞘管1的远端。球囊34可设置于鼻锥体41内,也可设置在外鞘管1的腔体中。手柄5被构造成可用于驱使外鞘管1向近端运动以释放植入物23。其中,输送部署完成后,定位丝远端与植入物的断开方法可以包括切断附接物、旋转螺丝、取出或者剪断针、机械去耦联锁组件、电力分离溶合的结合、从管中去除受限圆筒、粉碎工程区、取出夹头装置以显示机械接头或者本行业已知的其他的方法。
38.如图1a所示,外鞘管1包括杆部11和连接于杆部11的远端的套管护套12。套管护套12被构造成适于容置内套管21、球囊管3、导丝管4、植入物23和球囊34。在一些实施例中,套管护套12可以容纳收缩状态的植入物23和收缩状态的一部分球囊34,并且,植入物23和部分的球囊34纵向分离地布置于套管护套12中,以方便将植入物23和球囊34一起输送至植入
位置。在一些实施例中,套管护套12的内径大于杆部11的内径,使得该输送系统可以输送较大尺寸的植入物23;另一方面,通过增大套管护套12的内径,将有助于降低植入物23的装载阻力及释放阻力。液体或气体等填充物可以通过定位丝2被输送至植入物23,植入物23与定位丝2的远端可拆卸地连接。具体地,植入物23和定位丝2通过螺纹连接,例如,植入物23设置螺纹孔,定位丝2的远端设置螺纹柱。
39.该输送系统集成了球囊34和球囊管3,球囊34可以随连接于定位丝2远端的植入物23一并通过该输送系统输送至植入位置。通过球囊管3将球囊34移动至扩张的植入物23内,并通过球囊管3向球囊34输送填充物,使球囊34在植入物23内侧膨胀,对植入物23进行扩张整形和形状调整,可以促使植入物23充分膨胀,并与生理结构实现良好贴壁,有利于植入的植入物23在扩张和压差上满足临床要求,从而确保植入物23的有效固定且最大程度减少瓣周漏、脱离或移位。使用集成在输送系统上的球囊34对植入物23进行调整,有利于简化手术流程,缩短手术时间,降低手术风险。植入物23可以为心血管植入物,例如心脏主动脉瓣膜、二尖瓣膜、肺动脉瓣膜和/或三尖瓣膜等。
40.如图1a所示,该输送系统还包括穿设于外鞘管1内的内套管21,内套管21适于容纳定位丝2,定位丝2穿设于内套管21中,且从内套管21的远端延伸穿出,定位丝2可在内套管21中自由纵向移动。内套管21为定位丝2提供独立的腔体,避免操作定位丝2时被位于外鞘管1内的其它部件干扰。在一些实施方式中,内套管21在外鞘管的内腔中纵向延伸并穿过外鞘管1的近端。
41.在一些实施例中,内套管21与外鞘管1为分体的,内套管21与外鞘管1采用不同的材料制成,例如:外鞘管的材质为尼龙(nylon),内套管的材质为聚醚醚酮(peek)。peek材质的内套管21有利于为定位丝2提供支撑力。外鞘管的材质除了nylon,还可以是现有技术中已知的可用于外鞘管的材质。内套管的材质除了peek,还可以是比外鞘管材质更硬的其他树脂或金属材质。
42.定位丝的数量可以是1根、2根或者多根。在一些实施方式中(如图1c所示),该输送系统包括3根定位丝2。相对应的,内套管21可以为三腔管21,三腔管21包括3个独立的管腔,以适于容纳3根定位丝。3根定位丝2分别位于独立的管腔中,可避免3根定位丝之间相互接触,避免各定位丝移动时相互干扰。在一些实施方式中,三腔管21的外轮廓贴近于外鞘管的内周壁设置,以充分利用外鞘管的内部空间,从而有利于缩小外鞘管1的外形轮廓尺寸(profile)。在优选的实施方式中,如图1c所示,三腔管21的三个管腔呈弧形分布,三腔管21的外轮廓的外接圆的直径与外鞘管1的内径相等,以充分利用外鞘管1内部空间,缩小外鞘管1的管径。同时,在外鞘管1内径尺寸一定的情况下,三腔管21的外轮廓紧贴外鞘管1内壁的弧形设计方式可为外鞘管1中的球囊管3和导丝管4预留更多空间,使球囊管3和导丝管4在独立操作时,降低两者间的相互干扰。
43.如图1a、图1b和图1c所示的实施例中,导丝管4中设置纵向延伸的腔体,用于容纳导丝(图中未示出)。导丝管4至少部分穿进手柄5,并穿入连接在手柄5上的外鞘管1内。鼻锥体41近端的连接段45(参考图4a)与套管护套12的远端可拆卸地连接,便于植入物在从套管护套中释放出来时,使鼻锥体41与套管护套12分离。在优选的实施方式中,鼻锥体41的连接段45的外径与套管护套12的内径过盈配合,可有效降低鼻锥体41弯曲时套管护套12形成的鱼嘴(鼻锥体41处于弯曲方向时,套管护套12的远端端部与鼻锥体41之间的间隙)。鼻锥体
41的远端锥部延伸至外鞘管1以外;导丝管4的远端端部与鼻锥体41的近端连接,导丝管4可粘接于鼻锥体41的近端端部,且导丝管4的内腔与鼻锥体41的轴孔相通。在一些实施方式中,导丝管4的远端端部插接于鼻锥体41的近端轴孔中。
44.参考图10a-图10h,植入物23输送到目标位置后,对球囊34的纵向位置进行调整,使球囊34穿设于植入物23中且与植入物23横向对准,球囊34扩展膨胀从而对植入物23扩张整形,实现后扩张。根据手术需要,可以在将植入物23输送到目标位置后与原生组织形成配合之前,先将球囊34调整至与原生组织配合,球囊34扩展膨胀从而对原生组织的形态进行调整,实现预扩张,便于后续植入物23的顺利到位。
45.球囊34可以采用半顺应性球囊(semi-compliant balloon),命名压(nominal pressure)约为1atm~2atm,爆破压约为3atm。球囊34的命名压和爆破压可以根据需要进行调整。球囊34的材料可以采用聚乙烯(pe)、聚氨酯或者尼龙。原生瓣膜被预扩张后,再将将膨胀的心脏瓣膜假体植入物23定位于原生瓣膜处;1atm~3atm压力的球囊34可助于对膨胀的假体再次进行后扩张。
46.在一些实施方式中,球囊管3与导丝管4在外鞘管1中并列设置,导丝管4可相对于球囊管3纵向移动,通过球囊管3可独立地调整球囊34的位置。
47.在另一些实施方式中,如图2b所示,导丝管4部分地穿设于球囊管3中,并且导丝管4的远端延伸至球囊34的远端以外。导丝管4包括自由段47和毗邻自由段47的约束段48;其中,自由段47由导丝管4的近端端部至导丝管4穿进球囊管前的一段导丝管所限定,导丝管4的自由段47与球囊管3在外鞘管1中并行纵向延伸。约束段48由导丝管4穿进球囊管3后至导丝管4的远端端部的一段导丝管所限定。即导丝管4的自由段47由位于球囊管3之外且与球囊管3并行纵向延伸的一段导丝管4所限定,约束段48由穿设于球囊管3中并向远端纵向延伸的另一段导丝管4所限定。在优选的实施方式中,导丝管4可相对于球囊管3纵向移动。当导丝管4相对于球囊管3向远端运动时,约束段48变长,自由段47变短;当导丝管4相对于球囊管3向近端运动时,约束段48变短,自由段47变长。
48.导丝管4的一部分穿设于球囊管3中,通过球囊管3调整球囊34的位置时,球囊34沿着导丝管4移动,可以通过导丝管4对球囊34进行导向,以便于更容易快速将球囊34移动到植入物23中。导丝管4的自由段47独立于球囊管3,有利于独立操作导丝管4和球囊管3。例如,在一些实施方式中,在释放植入物23前,需要先通过导丝管4将鼻锥体41相对于外鞘管1向远端移动,此时,球囊管3相对于外鞘管1保持不动;当植入物23精准定位到合适的植入位置后,需要通过球囊管3移动球囊34对植入物23进行扩张整形,此时,导丝管4不动。
49.在一些实施方式中,如图2a-图3c所示,球囊管3包括近段管33、中段管32和远段管31,中段管32位于近段管33与远段管31之间,近段管33、中段管32与远段管31依次连接并贯通,导丝管4的约束段48纵向延伸穿过远段管31。中段管的外径小于近段管的外径,中段管的内径和近段管的内径相等。中段管32的外径小,管壁薄,使得球囊管3的中段更具柔性,这将有利于球囊管3的弯曲及转向。近段管33的外径大,管壁厚,可为球囊管3提供更多的支撑力,便于近端操作者从操控球囊管3。另外,外径较小的中段管32有利于节省球囊管3在外鞘管1内的占用空间,中段管32对应的这段节省空间将更有助于球囊管3和内套管21的独立操控。总之,球囊管3的远段和近段刚度比中段大,可提供较强的支撑力,中段柔性较强,这些特征的配合将有利于操作者独立地操控球囊管3、导丝管4和内套管21。
50.导丝管4可以从远段管31的近端端面进入远段管31,也可以从远段管31的近端侧壁进入远段管31。在如图2b所示的实施例中,远段管31的近端附近设有侧壁开口313,导丝管4经过侧壁开口313纵向延伸穿过远段管。
51.如图3b所示,球囊管3的远段管31为双腔管31;双腔管31具有与球囊34相连通的第一管腔311和与球囊34相隔断的第二管腔312。第一管腔311与中段管32的管腔相通,导丝管4的约束段48纵向延伸穿过第二管腔312。球囊34内部设有与球囊34的内腔相隔断的内管35,第二管腔312与内管35相连通,导丝管4的约束段48纵向延伸穿过内管35。第一管腔311用于输送填充介质(液体或气体)以使球囊34膨胀,第二管腔312用于容纳导丝管4。导丝管4的部分约束段48穿设于第二管腔312和内管35,并且导丝管4能够在第二管腔312和内管35中移动,以便于在导丝管4保持不动时,对球囊34的位置进行调整。在一些实施方式中,如图3a和3g所示,中段管32和近段管33的腔体截面呈圆形,双腔管31的第一管腔311的截面可以是类月牙形,第二管腔312的截面可以是圆形。作为优选的实施方式,第一管腔311的截面积、中段管32腔体的截面积、近段管33腔体的截面积三者相等,这将在前述的可独立、灵活调控球囊管和导丝管的基础上,进一步有利于球囊34的快速充胀或排空,减少因某段截面积变小而降低球囊的工作效率。
52.导丝管4的约束段48与球囊34之间的配合方式不限于上述的方式。在另一些情况下,导丝管4穿过球囊34且与球囊34固接,可以对球囊34的位置和导丝管4的位置同步进行调整,使球囊34与原生组织或者植入物23形成配合。具体地,导丝管4贯穿球囊34,导丝管4的管腔与球囊34的内腔相隔开,导丝管4与球囊34可以为一体成型的。
53.在图3b至图3h所示的实施例下,球囊34中设有与球囊34相隔断的内管35,导丝管4延伸穿过内管35。内管35的近端与远段管31的远端连接,内管35的远端可延伸至球囊34外,球囊34固定于内管35上。导丝管4能够在内管35中移动,即球囊管3可带动球囊34相对于导丝管4纵向运动,以方便对球囊34的位置进行调整。例如,在一些实施方式中,导丝管4可保持不动,球囊34及球囊管3可以向远端移动。在优选的实施例中,如图2b所示,位于球囊34内的内管35设于球囊的中心轴线上。在一些实施例中,内管35上设置第三标记带351,用于显示球囊34的位置。
54.如图4a和图4b所示,鼻锥体41设有与导丝管4相连通的轴孔42,轴孔42被构造成可供导丝管4内的导丝贯穿通过。导丝管4和鼻锥体41的轴孔42用于容纳导丝,导丝可自导丝管4的管腔延伸至轴孔42中。在一些实施方式中,鼻锥体41设有与轴孔42相连通的若干侧孔43。在优选的实施例中,若干侧孔43沿鼻锥体41的径向设置,侧孔43数量为偶数,例如2个、4个等。在轴孔42被心脏壁堵住的情况下,鼻锥体41外周的血流经若干侧孔43与鼻锥体41内的血流保持流通,有利于设置于鼻锥体41内的压力传感器准确测量鼻锥体41外周的血流压力。
55.导丝管4的远端端部与鼻锥体41的近端连接,且导丝管4的内腔与鼻锥体41的轴孔相通,导丝管4可粘接于鼻锥体41的近端端部。在一些实施方式中,导丝管4的远端端部插接于鼻锥体41的近端轴孔中。
56.如图4a和图5所示,鼻锥体41近端的连接段45与套管护套12的远端可拆卸地连接,鼻锥体41的远端延伸至外鞘管1外。在优选的实施方式中,鼻锥体41的连接段45的外径与套管护套12的内径过盈配合可有效降低鼻锥体41弯曲时套管护套12形成的鱼嘴(鼻锥体41处
于弯曲方向时,套管护套12的远端端部与鼻锥体41之间的间隙)。在更优选的实施例中,可以设置较大长度的连接段45,例如长度大于5mm,避免鼻锥体41弯曲时鼻锥体41与套管护套12之间产生较大的鱼嘴而发生分离。
57.在一些实施方式中,鼻锥体41的外侧壁上设有与外鞘管1的内腔相连通的冲洗凹槽44。在冲洗外鞘管1的内腔时,空气和液体可以从冲洗凹槽44中顺利排出。具体地,冲洗凹槽44沿鼻锥体41的近端端部纵向延伸贯穿鼻锥体41的外侧壁,多个冲洗凹槽44沿鼻锥体41的周向分布于鼻锥体41的侧壁。
58.实施例二
59.植入物输送系统,如图1c、图8a-图9b所示,该输送系统包括外鞘管1、若干定位丝2和适于容纳若干定位丝2的内套管21、球囊管3和球囊34、以及导丝管4和鼻锥体41。若干定位丝2被构造成其远端可拆卸地连接植入物,球囊34连接于球囊管3的远端,鼻锥体41连接于导丝管4的远端。其中,内套管21、导丝管4与球囊管3贯穿设置于外鞘管1中,且内套管21、导丝管4以及球囊管3三种导管的主体部分被构造成横向互不嵌套地并行纵向延伸穿设于外鞘管1。一并参考图1c、图2a和图3a,内套管21、导丝管4以及球囊管3三种导管的主体部分尤其是指由近向远地对应于导丝管4和球囊管3尚未发生干涉的部分。在一些实施方式中,内套管21、球囊管3及导丝管4的近端延伸到外鞘管1的近端之外;若干定位丝2的远端延伸穿过内套管21,且定位丝2的近端延伸到内套管21的近端之外。内套管21的远端可延伸穿过外鞘管1。在优选的实施方式中,内套管21的远端始终位于外鞘管1的内腔中,且内套管21与外鞘管1为分体设计。根据本发明的实施方式,内套管21被构造成三腔管,该三腔管包括3个独立的管腔,以适于容纳3根定位丝。
60.在优选的实施方式中,内套管21的外侧轮廓贴近于外鞘管1的内周壁而设置。具体地,内套管21的三个管腔呈弧形分布,使内套管的外轮廓的外接圆的直径与外鞘管1的内径相等。内套管21、导丝管4以及球囊管3在外鞘管1中的这种设置方式,在保证各自独立操作性并降低相互干扰的基础上,能够使整体的集成了球囊的输送系统的轮廓(profile)最小化。
61.该输送系统还包括手柄5,外鞘管1的近端和内套管21的近端连接至手柄5。球囊管3的近端、导丝管4的近端及若干定位丝2的近端均延伸穿过手柄5之外。手柄中设有第一密封构件,第一密封构件被构造成为内套管21、球囊管3和导丝管4提供密封,防止输送系统进入体内后血液顺着内套管21、球囊管3和导丝管4的外表面流出体外。根据密封构件与被密封部件之间是否具有相对运动,可将密封构件提供的密封分为两类,分别为静止的密封和活动的密封。因此,第一密封构件可提供这两类密封方式的任意一种或两种。在一些实施方式中,内套管21与第一密封构件固定连接,第一密封构件为内套管21提供静止的密封;而球囊管3和导丝管4可相对第一密封件纵向移动,第一密封构件为球囊管3和导丝管4提供可纵向活动的密封。
62.如图8a所示,手柄中还设有第二密封构件,第二密封构件为若干定位丝2提供密封。第二密封构件用于密封若干定位丝2与内套管21的腔体之间的间隙,防止输送系统进入体内后血液顺着定位丝2的外表面流出体外。
63.如图8b、图8c和图9b所示,第一密封构件为密封垫63,密封垫63设置有第一通孔661、第二通孔662和第三通孔663;内套管21穿过第一通孔661且由第一通孔661提供密封;
球囊管3穿过第二通孔662且由第二通孔662提供密封,导丝管4穿过第三通孔663且由第三通孔663提供密封。第二密封构件为颈缩件22,定位丝2纵向穿过颈缩件22,颈缩件22被构造成适于为定位丝2提供可相对内套管21纵向移动的密封。
64.如图1a所示,手柄中还设有锁夹7,若干定位丝2穿过锁夹7,锁夹7可用于锁定若干定位丝2。植入物23连接于定位丝2的远端,将植入物23输送至植入位置后,利用锁夹7对定位丝2进行锁定,有利于使植入物23的位置保持稳定,可以减少在调整球囊管3时定位丝2及植入物23受到干扰。该输送系统预装植入物23后,将植入物23输送至人体目标位置的过程中,利用锁夹7来锁定定位丝2,能够防止外鞘管1与鼻锥体41之间发生相对运动。当外鞘管1向近端移动时,可利用锁夹7来保持定位丝2被锁定,从而顺利释放植入物23。在需要调节植入物23位置时,可以解除定位丝2的锁定。具体的,锁夹7的具体结构在此处不做具体限定,只要能实现锁定和解锁功能即可。
65.实施例三
66.如图11所示,一种植入物输送系统,适于输送心血管假体植入物,该输送系统在输送心血管假体植入物时通常与导引器80配合完成,导引器80包括导引器手柄81和导引鞘管82,如图12a和12b所示,导引鞘管82的远端的内壁设有凸起结构821;该输送系统包括外鞘管1,外鞘管1经导引鞘管82穿过导引器80,外鞘管1的远端延伸到导引鞘管82的远端之外。外鞘管的远端的外径大于导引鞘管82的远端的内径;外鞘管1的远端从导引鞘管82的远端进入导引鞘管82时,凸起结构821用于使外鞘管1的远端的外轮廓减小。
67.在一些具体的实施例中,外鞘管1包括杆部11和连接于杆部11的远端的套管护套12;套管护套12的内径大于杆部11的内径,套管护套12适于容纳心血管假体植入物;杆部11适于延伸穿过导引鞘管82,套管护套12的外径大于导引鞘管82的内径;套管护套12被构造成从导引鞘管82的远端进入导引鞘管82时受导引鞘管82的凸起结构作用而外轮廓减小。
68.在一些具体的实施方式中,外鞘管1的远端的套管护套12外径大于导引鞘管82的内径,约为20fr;杆部11的外径小于导引鞘管82的内径,杆部11的外径约为18fr。在另一些实施方式中,套管护套12的外径约为25fr。套管护套12的厚度约为0.2mm,例如,套管护套12的厚度为0.18~0.22mm,以实现既能为植入物23提供可靠支撑,也能使套管护套12从导引鞘管82中通过时易于折叠,使套管护套12的外轮廓缩小,例如,套管护套12从导引鞘管82中撤离时。
69.如图11及如上所述,在执行微创手术之前,可以将外鞘管1预安装进导引鞘管82中。例如,输送系统的制造者将外鞘管1预安装进导引鞘管82中,例如,在将手柄5附接到外鞘管1的近端之前,将外鞘管1的近端延伸穿过导引鞘管82。
70.在一些实施方式中,如图12a和图12b所示,导引鞘管82的远端的内壁设有凸起结构821,凸起结构821被构造成用于使外鞘管1远端侧壁向内弯折。如图13a~图13c所示,外鞘管1远端的套管护套12的外径大于导引鞘管82的内径,外鞘管1的杆部11的外径小于导引鞘管82的内径,套管护套12从导引鞘管82中回撤时,即套管护套12从导引鞘管82的远端进入导引鞘管82时,套管护套12抵接到凸起结构821时,套管护套12在长度方向上形成径向上朝内折叠的折痕以缩小套管护套12的外周尺寸,使套管护套12的外轮廓减小,便于将套管护套12从导引鞘管82中撤回。具体地,凸起结构821沿纵向延伸,数量可以是一个或多个;形成凸起结构821的方式有多种,例如,可以在导引鞘管82成型时形成,也可以在导引鞘管82
上热回流形成。参见图13b和图13c,套管护套12从导引鞘管82回撤时向内折叠。由于杆部11的外径小于导引鞘管82的内径,参见图13a,杆部11从导引鞘管82向近端撤回时未折叠。
71.为了便于在影像下显示套管护套12的位置,套管护套12上设有周向延伸的第一标记带121;进一步地,为了便于套管护套12形成朝内折叠的折痕,套管护套12上设有周向延伸且不连续的第一标记带121。在一些实施方式中,周向延伸且不连续的第一标记带121可以由多段不连续的标记带形成,多段不连续的标记带可以形成封闭的第一标记带121(不存在缺口),也可以形成不封闭的第一标记带121(存在至少一个缺口);在另一些实施方式中,周向延伸且不连续的第一标记带121可以由一段首尾断开的标记带形成,一段首尾断开的标记带形可以形成封闭的第一标记带121(不存在缺口),也可以形成不封闭的第一标记带121(存在一个缺口)。其中,第一标记带121可以设置在套管护套12的任意位置上,为了便于观察套管护套12是否全部进入导引鞘管82,优选地,在套管护套12的远端设置第一标记带121。在一些实施方式中,为了便于套管护套12在凸起结构821的挤压下在长度方向上形成径向上朝内折叠的折痕,作为优选的实施方式,套管护套12上设有周向延伸且不封闭的第一标记带121,作为更优选的实施方式,第一标记带121的不封闭部位与凸起结构821对齐。
72.作为优选的实施方式,如图13c所示,外鞘管1的远端设有周向延伸的第一标记带121,在一些具体的实施例中,第一标记带121设置在套管护套12的远端,第一标记带121设有第一缺口122,第一缺口122在周向上与凸起结构821对齐;有利于套管护套12在与凸起结构821接触时,凸起结构821挤压套管护套12,套管护套12在长度方向上形成径向上朝内折叠的折痕以缩小套管护套12的外周尺寸,从而使套管护套12的外轮廓减小。
73.在一些实施方式中,导引鞘管82的远端设有周向延伸的第二标记带822,便于在影像下显示导引鞘管82。在优选的实施方式中,导引鞘管82的远端设有周向延伸且不封闭的第二标记带822,第二标记带822的不封闭部位与凸起结构821对齐。其中,不封闭的第二标记带822可以由多段不连续的标记带形成,也可以由一段首尾断开的标记带形成。在另一些实施例中,如图11所示,导引鞘管82的远端设有周向延伸的第二标记带822,第二标记带822设有第二缺口823,第二标记带822为带缺口的环形,凸起结构821设于第二缺口823处,有利于对第二缺口823处的导引鞘管82进行热回流形成凸起结构821。
74.在一些实施例中,该输送系统还包括位于外鞘管1的远端的心血管植入物,例如,心血管假体植入物位于外鞘管1远端的套管护套12内。
75.为了便于套管护套12通过导引鞘管82,对套管护套12作了进一步的改进。在一些实施方式中,套管护套12的壁厚约为0.2mm,套管护套12的厚度适宜在0.18~0.22mm范围内,以实现既能为植入物23提供可靠支撑,也能使套管护套12从导引鞘管82中通过时易于折叠,套管护套12能够在受到凸起结构821的挤压时向内折叠,从而使套管护套12的外轮廓减小。在一些实施方式中,套管护套的材料为nylon(尼龙)或pebax(聚醚嵌段聚酰胺)。
76.导引器80适于导引心血管植入物输送导管,该心血管植入物输送导管可以为外鞘管1。如图11所示,导引器80包括导引器手柄81和与导引鞘管82相连通的冲洗口811。
77.如图11所示的导引器80,适于导引心血管植入物输送导管,导引器80包括导引鞘管82,心血管植入物输送导管的远端的外径大于导引鞘管82的内径,导引鞘管82的远端的内壁设有凸起结构;其中,心血管植入物输送导管从导引鞘管82的远端进入导引鞘管82时,凸起结构使心血管植入物输送导管的远端的外轮廓减小。外鞘管1作为心血管植入物输送
导管的其中一个具体的实施方式,外鞘管1的远端具体为套管护套12。当手术流程中,需要从导引鞘管82中撤离外鞘管1时,导引鞘管82的远端内壁的凸起结构使套管护套12的外轮廓减小便于撤离。
78.作为优选的实施方式,导引鞘管82的远端设有周向延伸的第二标记带,便于在影像下显示导引鞘管82,标记带设有第二缺口,凸起结构设于第二缺口。第二标记带822为带缺口的环形,凸起结构821设于第二缺口823处,有利于对第二缺口823处的导引鞘管82进行热回流形成凸起结构821。
79.实施例四
80.参照图8a至8c,一种植入物输送系统,适于输送心血管假体植入物,包括外鞘管1、内套管21、止血密封组件和若干第一可动细长构件2;内套管21延伸穿设于外鞘管1,且内套管21的近端延伸到外鞘管1的近端之外;若干第一可动细长构件2延伸穿过内套管21,且若干第一可动细长构件2的近端延伸到内套管21的近端之外;止血密封组件包括第一密封构件和第二密封构件。第一密封构件被构造成密封外鞘管1与内套管21之间的间隙,第二密封构件被配置成密封内套管21与若干第一可动细长构件2之间的间隙。内套管21为第一可动细长构件2提供独立的空间,避免第一可动细长构件2受到外鞘管1内的其它构件的干扰。第一可动细长构件2能够相对于内套管21和第二密封构件活动,通过设置的第二密封构件,使得在第一可动细长构件2活动的过程中,保障内套管21内的流体不会向外流出。
81.在一些实施方式中,外鞘管1、内套管21和止血密封组件三者固定连接。在另一些实施方式中,第二密封构件与内套管21之间也可以可拆卸地连接。
82.具体地,请参照图8b、图8c和图9b,第一密封构件包括密封垫63,密封垫63设置第一通孔661,内套管21穿过第一通孔661且由第一通孔661提供密封。第二密封构件配置为颈缩件22,颈缩件22被构造成适于为若干第一可动细长构件2提供可相对内套管21纵向移动的密封。如图8b和图8c所示,颈缩件22连接于内套管21的端部,第一可动细长构件2经过颈缩件22穿出。具体地,如图9a和9b所示,颈缩件22包括颈缩连接部221和连接于颈缩连接部221近端的颈缩密封部222,颈缩密封部222为若干第一可动细长构件提供可相对内套管21纵向移动的密封。
83.参照图8a至9b,在一些实施方式中,该输送系统还包括托架6,托架6设置托架腔611,托架腔611与外鞘管1的管腔相连通;外鞘管1的近端、内套管21和密封垫63均与托架6固接;其中,托架6被构造成可带动外鞘管1和内套管21相对若干第一可动细长构件2纵向移动。通过托架6带动外鞘管1和内套管21相对若干第一可动细长构件2纵向移动,可以释放安装在第一可动细长构件2远端的心血管植入物。
84.继续参照图8a至9b,在一些实施方式中,该输送系统还包括第二可动细长构件,第二可动细长构件延伸穿设于外鞘管1,且第二可动细长构件的近端延伸到外鞘管1的近端之外;密封垫63还设置第二通孔662,第二可动细长构件穿过第二通孔662且由第二通孔662提供密封;托架6被构造成还可带动外鞘管1和内套管21相对第二可动细长构件纵向移动。其中,第二可动细长构件可以为导丝管4和/或球囊管3。外鞘管1和内套管21可相对第二可动细长构件纵向移动,第一可动细长构件2位于内套管21之内,第二可动细长构件位于内套管21之外,内套管21将第一可动细长构件2与第二可动细长构件隔开,避免两者发生干扰。密封垫63与外鞘管1之间可以固定连接,第二可动细长构件经密封垫63穿出,通过密封垫63,
对第二可动细长构件进行密封。
85.在一些具体的实施方式中,如图6a-图7所示,该输送系统还包括手柄5,通过手柄5来驱动套管护套12向近端移动,从而释放出植入物23,手柄5包括托架6和驱动机构51,驱动机构51与托架6耦接,外鞘管1的杆部11的近端固接于托架6,驱动机构51被构造成用于驱动托架6纵向移动,驱动机构51可以驱动托架6沿纵向向近端运动,托架6带动外鞘管1一起向近端运动,使植入物23从外鞘管1的套管护套12中被释放出。内套管具体为三腔管21,三腔管21可以安装于托架6,托架6被构造成可带动外鞘管1和三腔管21纵向移动,三腔管21的近端与托架6固定连接,三腔管21与外鞘管1一起随托架6移动。如图8a和图8c所示,第二可动细长构件贯穿托架6,第二可动细长构件能够相对于托架6纵向移动。在一些具体的实施方式中,如图6a和图6b所示,手柄5包括手柄壳体501,托架6可移动地安装于手柄壳体501,并且托架6被限制相对于手柄壳体501转动;驱动机构51包括旋转部件52,旋转部件52与托架6通过螺旋结构53连接,螺旋结构53被构造成旋转部件52作旋转运动时能够带动托架6在手柄壳体501中平移。由于托架6被限制相对于手柄壳体501转动,因此,旋转部件52相对于手柄壳体501转动时,通过螺旋结构53,旋转部件52会带动托架6在手柄壳体501上沿纵向移动。具体地,如图6b和图7所示,螺旋结构53包括设置于旋转部件52上的螺旋凹槽531和设置于托架6上的凸块532,凸块532可滑动地嵌设于螺旋凹槽531中。手柄壳体501中固设有沿纵向延伸的导杆502,托架6与导杆502配合,以阻止托架6转动,并对托架6的纵向移动起到导向作用。具体地,如图6b所示,导杆502包括两根导向杆503,两根导向杆503相平行且沿纵向延伸,两根导向杆503分别位于托架6的两侧且均与托架6的侧壁接触配合,托架6被限制于两根导向杆503之间,托架6被限制发生转动,托架6可以沿导向杆503移动。旋转部件52能够相对于手柄壳体501旋转运动且被限制相对于手柄壳体501作纵向移动。旋转部件52包括旋钮521和螺杆部件522,螺杆部件522呈圆筒状,螺旋凹槽531设置于螺杆部件522的内壁,旋钮521与螺杆部件522固定连接,旋钮521至少部分伸出至手柄壳体501外,以方便手持操作。
86.如图8a-图9b所示,下面以第二可动细长构件包括导丝管4和球囊管3为例进行详细说明,导丝管4、球囊管3以及定位丝2穿过托架6后,从手柄5的近端穿出。密封垫63设置于托架6中。托架6包括托架主体61、托架板62和托架盖64,外鞘管1的近端固接于托架主体61,托架腔611设置于托架主体61;托架盖64、密封垫63和托架板62均安装于托架主体61的近端侧且沿从近端向远端的方向依次分布,托架板62和托架盖64被构造为将密封垫63固定于托架主体61。托架盖64、密封垫63和托架板62分别设有第一通孔661、第二通孔662和第三通孔663,穿设于外鞘管1内的内套管21内的定位丝2经托架腔611和第一通孔661延伸至托架6外,穿设于外鞘管1的球囊管3经托架腔611和第二通孔662延伸至托架6外,穿设于外鞘管1的导丝管4经托架腔611和第三通孔663延伸至托架6外。具体地,如图8c和9b所示,定位丝2(图中未示出)穿设于三腔管21中,三腔管21经托架腔611和所有第一通孔661延伸至托架6外,三腔管21的近端固接于托架盖64的第一通孔661并从第一通孔661中穿出。三腔管21、导丝管4和球囊管3从外鞘管1的近端延伸出后穿过托架6,通过密封垫63对经过托架6的三腔管21、导丝管4和球囊管3进行密封,避免外鞘管1内的血液沿三腔管21的外壁、导丝管4的外壁或者球囊管3的外壁向外泄露。
87.在一些实施方式中,内套管21和第二可动细长构件分别纵向延伸穿过托架板62和托架盖64;其中,对应于第二可动细长构件的纵向延伸位置,密封垫63与托架盖64之间、密
封垫63与托架板62之间分别设有间隙67,参见图8b和图8c所示,间隙67围绕球囊管3和导丝管4设置,间隙67可在球囊管3、导丝管4穿过密封垫63时为密封垫63提供变形空间,降低球囊管3和/或导丝管4相对密封垫63运动时的摩擦力,便于球囊管3和/或导丝管4移动。具体地,如图8c-图9b所示,可以通过在密封垫63的远端面设置凹槽,或者在托架板62的近端面设置凹槽,使得密封垫63与托架板62之间形成间隙67;可以通过在密封垫63的近端面设置凹槽,或者在托架盖64的远端面设置凹槽,使得密封垫63与托架盖64之间形成间隙67。
88.在一些具体实施方式中,第一可动细长构件2为定位丝2,定位丝2的数量可以为3根;内套管21可以为三腔管21,三腔管21包括3个独立的管腔,以适于容纳3根定位丝,3根定位丝2分别位于独立的管腔中,可避免3根定位丝2间相互接触,从而避免各定位丝2活动时的相互干扰;颈缩连接部221具有连接腔,连接腔的横截面形状被构造成与内套管的外轮廓的形状相一致;颈缩密封部222具有三个密封腔,三个密封腔为3根定位丝提供密封。如图8b、图9a和图9b所示,内套管21为三腔管,三腔管21的近端连接有颈缩件22,颈缩件22包括颈缩连接部221和颈缩密封部222,三腔管21连接于颈缩连接部221,颈缩密封部222设有三个定位丝孔223,定位丝2的近端经定位丝孔223延伸至颈缩件22外。颈缩连接部221的腔体与三腔管21连通,定位丝孔223与颈缩连接部221的腔体相连通,并且定位丝孔223分别对各根定位丝2密封,提高了对定位丝2的密封效果。三腔管21上设置的定位丝孔223的数量可以根据定位丝2的数量来设置,使定位丝2与定位丝孔223一一对应。在优选的实施例中,该输送系统包括3根定位丝2,对应地,三腔管21上设置有3个定位丝孔223。其中,第二可动细长构件可以为导丝管4和/或球囊管3。内套管的材质可以为peek,颈缩件的材质可以为pebax(聚醚嵌段聚酰胺),pebax具有介于热塑性弹性体和橡胶体之间的许多优异性能,而且加工方便。
89.如图8a和图8b所示,托架主体61连接有冲洗端65,冲洗端65与托架腔611相连通且与外鞘管1相连通。冲洗端65可以通过托架腔611将冲洗材料送至托架6内,冲洗端65还可以将冲洗材料送至外鞘管1内。具体地,托架主体61上设有冲洗孔612,冲洗端65连接于冲洗孔612,冲洗孔612与托架腔611相连通,托架腔611与外鞘管1相连通,从而实现冲洗端65既与托架腔611连通,又与外鞘管1连通。冲洗端65可以耦联至托架主体61,以使冲洗端65随托架主体61一起移动。
90.在一实施方式中,托架主体61、托架板62、托架盖64材料为注模塑料,例如聚碳酸酯、酚醛树脂模塑料等。托架主体61、托架板62、托架盖64材料可以是透明材料,优选的,以允许进行uv(ultra-violet ray,紫外线)连接处理。托架主体61与冲洗端65通过uv处理进行连接,托架盖64与三腔管21也通过uv处理进行连接。具体地,托架主体61与冲洗端65的接触面分别涂抹uv胶,通过uv光照射uv胶,使uv胶固化,将托架主体61与冲洗端65固接到一起。托架主体61与托架板62可以是单独成型连接到一起,也可以是一体成型的。密封垫63可以由弹性聚合物构成,该弹性聚合物可以为硅树脂、聚亚安酯、乳胶;该弹性聚合物优选为尼龙。
91.图10a-图10h示出了该输送系统的远端在手术流程中的部分示意图。参见图10a,外鞘管1的远端沿脉管前进至人体适当位置(例如,接近植入位置);参见图10b,导丝管4及鼻锥体41向远端移动,鼻锥体41与外鞘管1分离;参见图10c,转动手柄5上的旋转部件52,托架6带动套管护套12向近端移动以释放植入物23;参见图10d,通过定位丝2向植入物23内填
充填充物,使植入物23膨胀并调整植入物23至病变生理瓣膜处;参见图10e,球囊管3向远端移动,球囊34在导丝管4的引导下向远端运动,进入植入物23中;参见图10f,通过球囊管3向球囊34填充填充物,球囊34膨胀后对膨胀的植入物23扩张整形;参见图10g,球囊34收缩后,球囊34在球囊管3的带动下向近端移动,球囊34从植入物23中撤离;参见图10h,定位丝2与植入物23分离,该输送系统从人体撤离。
92.如图1a、图1b和图11所示,该输送系统集成了球囊组件,通过球囊34可对扩展或膨胀的植入物23(例如,心脏瓣膜假体)进行扩张整形,有利于植入的瓣膜在扩张和压差上满足临床要求。在手术过程中,通过使用集成的球囊34对膨胀的心脏瓣膜假体进行扩张整形能有效简化手术流程,缩短手术时间。该输送系统中的鼻锥体41设置侧孔43,在轴孔42被堵塞的情况下,侧孔43使鼻锥体41外周的血流压力与鼻锥体41腔内的血流压力保持一致,有利于设置于鼻锥体41内的压力传感器准确测量鼻锥体41外周的血流压力。该输送系统的手柄5中,托架6对定位丝2、导丝管4和球囊管3进行密封,具有较好的密封效果。该输送系统中的导引鞘管82设置有凸起结构821,凸起结构821使套管护套12从导引鞘管82中向近端撤回时朝内纵向折叠而缩小套管护套12的外周尺寸,有利于套管护套12顺利撤回。
93.实施例五
94.如图1a和图4a-图5所示,一种血流压力监测系统,包括导丝管4、压力传感器和连接于导丝管4的远端的鼻锥体41。鼻锥体41设有与导丝管4相连通的轴孔42和与轴孔42相连通的若干侧孔43,压力传感器被配置为感测流通若干侧孔和轴孔中的至少一个孔的血流的压力。轴孔42被构造成供导丝管4内的导丝贯穿通过。压力传感器(图中未示出)可设置于鼻锥体41的轴孔或侧孔中或者导丝管4中。当轴孔42的端部被心脏壁堵住时,通过若干侧孔43可使鼻锥体41外周的血流压力与鼻锥体41内的血流压力保持一致,有利于设置于鼻锥体41内或导丝管4中的压力传感器准确测量鼻锥体41外周的血流压力。在一些实施方式中,该血流压力监测系统为适用于部署心血管植入物的血流压力监测系统。该血流压力监测系统包括植入物输送系统,导丝管4和鼻锥体41作为植入物输送系统的组成部件。前面已经对导丝管4、鼻锥体41以及植入物输送系统的具体结构和工作方式作了详细描述,在此不再赘述。
95.压力传感器用于感测血流压力,压力传感器可以被置于鼻锥体41中,也可以被置于导丝管4中。侧孔43的中心线可以与鼻锥体41的轴线垂直,也可以不垂直。如图4b所示,鼻锥体41上横向对称地设置有两对侧孔43,两对侧孔关于过鼻锥体的轴线的平面对称。
96.在一些实施例中,植入物输送系统还包括外鞘管1,鼻锥体41被构造成能够可拆卸地与外鞘管1连接。鼻锥体41具有与外鞘管1的远端相连接的连接段45,鼻锥体41近端的连接段45与外鞘管1的远端可拆卸地连接。优选的实施方式,鼻锥体41连接段45的外径与外鞘管1的远端的内径过盈配合,可有效降低鼻锥体41弯曲时套管护套12形成的鱼嘴。
97.在一些实施方式中,鼻锥体41的外侧壁上设有与外鞘管1的内腔相连通的冲洗凹槽44。在冲洗外鞘管1的内腔时,空气和液体可以从冲洗凹槽44中顺利排出。具体地,冲洗凹槽44沿鼻锥体41的近端端部纵向延伸贯穿鼻锥体41的外侧壁,多个冲洗凹槽44沿鼻锥体41的周向分布于鼻锥体41的侧壁。
98.该实施方式中,植入物输送系统可以包括外鞘管,鼻锥体被构造成可拆卸地与外鞘管连接。
99.在一实施方式中,心血管植入物为心脏主动脉瓣膜假体,压力传感器被配置为感
测左心室中的血流压力。
100.在一实施方式中,该血流压力监测系统适用于经导管主动脉瓣置换术,辅助监测左心室中的血流压力。
101.本发明还提出一种辅助监测血流压力的装置,适用于经导管心脏瓣膜置换或修复术,装置包括导丝管4和连接于导丝管4远端的鼻锥体41。鼻锥体41设有与导丝管4相连通的轴孔42和若干侧孔43。检测血流压力时,在鼻锥体41中或导丝管4中配置用于检测鼻锥体41外周血流压力的压力传感器,前文已对压力传感器的布置位置、侧孔43的布置方式和作用效果等已做详细描述,在此不再赘述。
102.在一些实施方式中,该辅助监测血流压力的装置适用于经定位丝导管主动脉瓣置换术,辅助监测左心室中的血流压力。
103.本发明提供的血流压力监测系统或辅助监测血流压力的装置,通过在鼻锥体上同时设置轴孔和侧孔,当部分孔被组织壁堵住时,至少能够有一个孔与实际血流环境保持畅通,进而使传感器能够感测到实际的血流动力学参数值,提高监测数据的准确性。另外,由于轴孔和若干侧孔的存在,每次传感器的监测值都基本能够反应实际的血流情况,因而能够减少医生为了追求监测准确性而反复调整、重复测量的次数,从而提高手术效率。
104.实施例六
105.提供一些实施方式,具体说明操作植入物输送系统的方法。
106.使用输送系统之前:将定位丝2与植入物23连接;折叠植入物23后通过装载工具将植入物23装载到套管护套12;用生理盐水冲洗导丝管4;拉导丝管4使鼻锥体41与套管护套12连接;将生理盐水从手柄5中的托架6的冲洗端65引入,冲洗外鞘管1。
107.在一些实施例中,使用前述假体输送系统通过微创手术将植入物23部署到病变瓣膜位置,例如,部署到主动脉位置。在一些实施例中,该方法通常包括通过股动脉进入主动脉。可以根据标准做法准备血管通路部位,并且可以通过血管通路将导丝插入左心室。
108.参照图10a,放置了心血管假体植入物23的输送系统可以经血管推进。在一些实施方式中,在输送系统中插入导丝(图中未示出)。在这样的实施例中,鼻锥体41可以通过导丝直接进入血管中,鼻锥体41可扩张血管便于外鞘管1在血管中顺利推进。外鞘管1可以被推进到接近病变瓣膜的位置。
109.参照图10b和图10c,在一些实施例中,可以通过部分或完全缩回外鞘管1同时保持若干定位丝2静止,从而在适当位置显露或释放出植入物23,例如在病变瓣膜处或下方。此时,球囊34仍位于外鞘管1中或部分露出外鞘管1。在一些实施例中,还可以通过在保持外鞘管1静止的同时向远侧推动定位丝2来显露或释放植入物23,球囊34在外鞘管1中保持位置不变。参照图10d,一旦植入物23从外鞘管1中释放出来,它就可以向近侧或远侧移动,并且流体或膨胀介质可以被引入植入物23的套囊以提供形状和结构完整性。定位丝2既可用于输送介质填充植入物23的套囊,又可用于控制植入物23,将植入物23定位在植入部位。
110.参照图10e,在一些实施例中,输送系统上集成的球囊34在导丝管4的引导下前进至与植入物23对齐,即球囊34的中部位于植入物23中。参照图10f,球囊34膨胀后可进一步扩张植入物23,可以促使植入物23充分膨胀,并与生理结构实现良好贴壁。1atm~3atm压力的球囊34将有助于对膨胀的假体再次进行扩张。在一些实施方式中,球囊34对植入物23进行扩张时,植入物23的套囊内压力迅速升压至10~12atm,或者升压至更高的压力值。
111.在一些实施方式中,在植入物23定位在植入部位前,输送系统上集成的球囊34可先用于扩张病变的组织瓣膜。球囊34扩张病变的组织瓣膜的方式与球囊34扩张植入物23的方式相似,此处不再赘述。
112.参见图11所示,在一些实施例中,集成了导引器80的假体输送系统,在执行微创手术之前,可以沿着外鞘管1预安装导引鞘管82。例如,制造者可以沿着外鞘管1预安装导引鞘管82。例如,在一些布置中,在将手柄附接到外鞘管1的近端之前,将外鞘管1的近端延伸穿过导引鞘管82是合适的。
113.参照图13a-图13c,在一些实施方式中,外鞘管1的远端的套管护套12从导引鞘管82中向近端撤离时,套管护套12经由导引鞘管82的凸起结构821在长度方向上形成径向上朝内折叠的折痕以缩小套管护套12的外周尺寸,从而使套管护套12能够进入到导引鞘管82内。
114.以上所述仅为本发明的几个实施例,本领域的技术人员依据申请文件公开的内容可以对本发明实施例进行各种改动或变型而不脱离本发明的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1