S100A9抑制剂在制备防治C型产气荚膜梭菌感染性腹泻药物中的应用
s100a9抑制剂在制备防治c型产气荚膜梭菌感染性腹泻药物中的应用
技术领域
1.本发明属于家畜疾病药物领域,更具体地,涉及s100a9抑制剂在制备防治c型产气荚膜梭菌感染性腹泻药物中的应用。
背景技术:
2.s100蛋白家族是一个大的钙结合蛋白家族,s100蛋白是一种对钙离子有高度亲和性的蛋白质,首次分离于牛大脑组织中,近年来,随着研究的深入,更多种类的s100蛋白被发现,目前s100家族有20种以上成员,s100a9蛋白是其中较为重要的一个。s100a9蛋白最初从髓样细胞中纯化获得,s100a9蛋白与多种疾病有关,如s100a9基因在多种肿瘤中表达上调,包括肝癌、肺癌、前列腺癌等;在免疫性疾病中s100a9蛋白诱导细胞增值,诱导哮喘发病;而利用s100a9特性治疗疾病的药物也相继开发;吡美莫司通过诱导s100a8/a9及其他基因表达上调,来预防异位性皮炎;在心血管疾病治疗中,部分学者通过药物阻断s100a8/a9基因表达,来尝试通过下调炎症通路治疗动脉粥样硬化。
3.c型产气荚膜梭菌是引起猪梭菌性肠炎的病原菌,可引起仔猪坏死性肠炎,具有病程短、致死率高的特点。现有的治疗c型产气荚膜梭菌是引起猪梭菌性肠炎的药物主要为:抗生素、疫苗等。通过抗生素、疫苗等手段虽然降低了仔猪腹泻的发生率,但抗生素过多的使用会大幅度损害了猪的健康生长和肉质;中国发明专利公开了一种仔猪红痢c型产气荚膜梭菌类毒素疫苗,涉及一种c型产气荚膜梭菌类毒素疫苗来防治其产生的疾病;但免疫疗法存在个体差异,且不同个体对于疫苗的免疫应答不同,往往需要多次接种,且测定是否产生抗体,只有产生抗体的个体才会产生对于c型产气荚膜梭菌类毒素的免疫反应,可见其有效性上存在一定的不足和风险。因此,亟需开发一种新的针对c型产气荚膜梭菌感染性腹泻的药物。
技术实现要素:
4.本发明为解决上述现有技术中存在的问题,提供了s100a9抑制剂在制备防治c型产气荚膜梭菌感染性腹泻药物中的应用。
5.本发明的目的是提供s100a9抑制剂在制备防治c型产气荚膜梭菌感染性腹泻药物中的应用。
6.本发明的另一目的是提供一种包含s100a9抑制剂的防治腹泻的药物。
7.本发明为了实现上述目的,采用以下技术方案:
8.本发明提供了s100a9抑制剂在制备防治c型产气荚膜梭菌感染性腹泻药物中的应用。
9.本发明通过实验发现s100a9在c型产气荚膜梭菌感染性仔猪腹泻组织和细胞中的表达量增加,s100a9加重c型产气荚膜梭菌感染诱导的猪肠上皮细胞炎症损伤,抑制细胞活力和细胞增殖,破坏细胞间紧密连接,而通过抑制s100a9,使s100a9基因的下调可以作为药
物治疗c型产气荚膜梭菌感染性腹泻。
10.进一步地,所述s100a9抑制剂为抑制s100a9基因在组织和/或肠上皮细胞中表达。
11.进一步地,所述组织为内脏组织。
12.进一步地,所述内脏组织为肺、脾、肝、回肠、肾、十二指肠、空肠或心脏。
13.进一步地,所述s100a9抑制剂降低c型产气荚膜梭菌感染下的肠上皮细胞中炎症因子il-6、il-8、tnf-α和il-1β的表达水平,减轻细胞损伤。
14.进一步地,所述s100a9抑制剂维持c型产气荚膜梭菌感染下的肠上皮细胞的细胞活力。
15.进一步地,所述s100a9抑制剂提高c型产气荚膜梭菌感染下的肠上皮细胞的s期比例,维持肠上皮细胞的细胞增殖。
16.进一步地,所述s100a9抑制剂降低c型产气荚膜梭菌感染下肠上皮细胞的活性氧和ldh酶活性,进而减弱c型产气荚膜梭菌对肠上皮细胞的细胞毒性。
17.进一步的,所述s100a9抑制剂维持紧密连接蛋白zo-1、ocln和cldn-12的表达显著上调,进而抑制c型产气荚膜梭菌感染诱导的肠上皮细胞紧密连接下降。
18.本发明还请求保护一种包含s100a9抑制剂的防治腹泻的药物。
19.进一步地,所述腹泻为c型产气荚膜梭菌感染性腹泻。
20.进一步地,所述s100a9抑制剂为抑制s100a9基因转录的rna干扰药物。
21.进一步地,所述s100a9抑制剂为干扰rna si-s100a9,其序列为seq id no.21~seq id no.22所示。
22.进一步地,所述s100a9抑制剂为抑制s100a9基因翻译得到的s100a9蛋白的单克隆抗体或多克隆抗体。
23.进一步地,所述药物还含有必要的辅料。
24.本发明上述方案适用于c型产气荚膜梭菌感染性腹泻,适用动物包括猪、牛、马、羊、人类等哺乳动物,以及禽类等,易被c型产气荚膜梭菌感染性的动物,尤其是幼小动物。
25.本发明的有益效果为:
26.(1)本发明提供了一种s100a9抑制剂在制备针对c型产气荚膜梭菌感染性腹泻药物中的应用,也提供了一种新的防治腹泻的药物。
27.(2)在c型产气荚膜梭菌感染后,包含s100a9抑制剂的药物可以提高肠上皮细胞活力、提高s期细胞比例,促进细胞增殖;减弱c型产气荚膜梭菌感染对细胞的毒性;提高细胞间的紧密连接,可以发挥很好的防治c型产气荚膜梭菌感染性腹泻。
附图说明
28.图1为s100a9在仔猪不同组织中的相对mrna表达水平。
29.图2为回肠组织中s100a9蛋白的相对表达水平;图中ic表示对照组;is表示易感组;ir表示耐受组。
30.图3为空肠组织中s100a9蛋白的表达水平;图中jc表示对照组;js表示易感组;jr表示耐受组。
31.图4为cpb2毒素处理条件下s100a9随时间的表达。
32.图5为s100a9的转染效率;图中a表示s100a9的mrna相对表达水平;b表示s100a9的
蛋白相对表达水平。
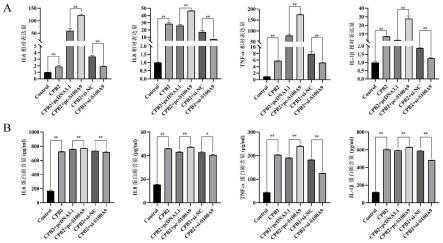
33.图6为s100a9对cpb2诱导的ipec-j2细胞炎症因子表达的影响;图中a表示mrna相对表达水平;b表示蛋白相对表达水平。
34.图7为s100a9对cpb2毒素诱导的ipec-j2细胞活力和增殖的影响;图中a表示cck8法测定细胞存活率;b表示edu阳性细胞比率;c表示edu细胞增殖试验。
35.图8为cpb2诱导的ipec-j2细胞中活性氧水平和细胞毒性检测;图中a表示ros水平检测;b表示乳酸脱氢酶(ldh)活性检测。
36.图9为s100a9对cpb2毒素诱导的ipec-j2细胞周期的影响。
37.图10为s100a9对cpb2毒素诱导的ipec-j2细胞紧密连接蛋白表达的影响。
38.上图中标注:“**”表示显著性p《0.01,“*”显著性p《0.05,“ns”表示显著性p》0.05。
具体实施方式
39.以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
40.除非特别说明,以下实施例所用试剂和材料均为市购。
41.实验例1动物实验s100a9在组织中的表达
42.1.实验方法
43.(1)实验分组
44.随机选取30只7日龄健康仔猪(长白猪
♂×
大白猪
♀
),公母各半,仔猪的重量均为3.2kg
±
0.5kg,对仔猪进行分组,随机选取5只作为对照组,25只作为实验组,实验组每只仔猪灌服5ml的c型产气荚膜梭菌,灌服c型产气荚膜梭菌的菌落形成单位为1
×
109cfu/ml,连续灌服5天,每天灌服量相同。实验组根据粪便评分分为敏感组和耐受组。处死后,各处理组取心、肝、脾、肺、肾、十二指肠、空肠、回肠组织,液氮快速冷冻保存,动物实验方法符合人类的道德伦理标准和国际惯例。
45.(2)rt-qpcr检测s100a9的表达量
46.采用实时荧光定量(real time quantitative pcr,rt-qpcr)法测定对照组、易感组和耐受组仔猪的肺(lung)、脾(spleen)、肝(liver)、回肠(ileum)、肾(kidney)、十二指肠(duodenum)、空肠(jejunum)、心脏(heart)组织中s100a9的表达量,按照trizol试剂盒说明,使用trizol(tiangen,中国北京)试剂从组织中提取仔猪组织的总rna,以gapdh为内参,相应引物如表1。检测合格的rna,使用evo m-mlv reverse transcription master mix kit(accurate biotechnology,hunan,china)试剂盒合成cdna。rt-qpcr在lightcycler480ii仪器(瑞士罗氏公司)和green premix pro taq hs qpcr kit(accurate biotechnology,中国湖南)上进行,rt-qpcr测定s100a9引物如表1,引物序列为seq id no.1~seq id no.2和seq id no.11~seq id no.12。
47.表1 rt-qpcr检测所需引物
[0048][0049]
(3)蛋白免疫印迹检测
[0050]
采用western blot法检测s100a9在回肠和空肠组织中的蛋白表达水平。具体的,采用适量含苯甲烷磺酰氟(pmsf)的裂解液(ripa)收集回肠和空肠组织总蛋白,蛋白浓度测定采用bca蛋白检测试剂盒,变性后的蛋白样品在8%sds-page上进行电泳,浓缩胶电压75v,分离胶120v。转膜用5%脱脂牛奶(0.5%tbst缓冲液)在37℃下振荡封膜1h,然后用s100a9抗体稀释比例为1:900(建议稀释比例为1:800~1:1000)或β-肌动蛋白抗体稀释比例为1:900(建议稀释比例为1:800~1:1000)在4℃下稀释过夜,然后与辣根过氧化物酶(hrp)标记的山羊抗鼠二抗稀释比例为1:900(建议稀释比例为1:800至1:1000)结合,在脱色摇床上用tbst洗涤3次后,采用化学发光检测系统曝光,采用imagej(v1.8.0)软件进行定量分析。
[0051]
2.实验结果
[0052]
s100a9在腹泻仔猪中的表达量增加,实验结果如图1所示,易感组中s100a9的表达量显著高于对照组。基于这一特征,我们进一步鉴定了与仔猪腹泻发生最密切相关的小肠组织,采用western blot法检测s100a9在回肠(图2)和空肠(图3)组织中的蛋白表达水平。结果表明,其表达趋势与rt-qpcr一致。
[0053]
实验例2s100a9在细胞中的表达
[0054]
1.实验方法
[0055]
(1)细胞培养
[0056]
猪ipec-j2细胞系(猪小肠上皮细胞系)由北京北纳生物技术有限公司提供。所有细胞保存在dulbecco's modified eagle medium(dmem,hyclone,logan,usa)培养基中,含有10%胎牛血清(fbs),1%青霉素和链霉素。细胞在37℃,5%co2的环境培养箱中培养。当细胞汇合度达到80%以上时,用0.25%胰蛋白酶溶液消化细胞,继续传代培养或进行试验。
[0057]
(2)细胞感染cpb2毒素
[0058]
取(1)培养得到的ipec-j2细胞平均分成2组,cpb2毒素处理组和对照组,cpb2毒素处理组加入20ug/ml剂量的cpb2毒素处理,对照组给予相应剂量的生理盐水处理,分别在0h、12h、24h、36h、48h测定s100a9的表达,测定方法同试验例1仔猪组织中s100a9表达的rt-qpcr法。
[0059]
2.实验结果
[0060]
实验结果如图4所示,可以看出,cpb2毒素处理组从12h开始显著诱导ipec-j2细胞损伤,s100a9的表达呈时间依赖性上调,并在cpb2处理24h达到峰值,之后趋于稳定。与对照组相比,cpb2组s100a9水平显著升高;结果表明,s100a9在cpb2毒素诱导的ipec-j2细胞中表达也显著升高,表明s100a9在cpb2毒素诱导的ipec-j2细胞损伤中发挥关键作用。
[0061]
实验例3s100a9对ipec-j2细胞的转染效率
[0062]
1.实验方法
[0063]
将细胞悬液接种到培养板上,待细胞生长状态良好,细胞汇合度达到70%-80%时开始转染。将待转染的细胞分成4组,分别为干扰阴性对照组(si-nc)、s100a9抑制剂(si-s100a9)组、mrna过表达空载体组(pcdna3.1)、s100a9过表达载体组(pc-s100a9),每组分别用干扰阴性对照(si-nc)载体、s100a9抑制剂载体、mrna过表达空载体、s100a9过表达载体转染ipec-j2细胞,对于s100a9的敲除和过表达,参照2000reagent
[0064]
(invitrogen,ca,usa)转染试剂说明书,载体的构建以pcdna3.1克隆载体为基础,以5'nhei和3'xhoi为克隆位点,构建s100a9过表达载体,命名为pc-s00a9,由苏州金唯智生物科技有限公司合成。干扰阴性对照(si-nc)和s100a9抑制剂(si-s100a9)均由上海吉玛制药技术有限公司(中国上海)合成。其中,干扰rna的序列信息如表2所示,引物序列为seq id no.19~seq id no.22。待接种细胞培养至汇合度达到70%-80%时开始转染,转染24h后,每组加入cpb2毒素使得毒素浓度为20μg/ml,继续培养24h。培养完成后,采用rt-qpcr和western blot法检测s100a9的表达情况,测定方法同试验例1仔猪组织中s100a9表达的rt-qpcr法和western blot法。
[0065]
表2干扰rna的序列信息
[0066][0067]
2.实验结果
[0068]
实验结果如图5,rt-qpcr结果显示,与过表达阴性对照pcdna3.1相比,pc-s100a9转染后s100a9的表达水平显著升高。与干扰阴性对照si-nc相比,si-s100a9转染后s100a9的表达水平显著降低。western blot检测结果与rt-qpcr检测结果一致,表明s100a9的过表达和干扰成功,可进行后续试验。
[0069]
实验例4s100a9与cpb2毒素诱导的炎症因子关系
[0070]
1.实验方法
[0071]
将细胞悬液接种到培养板上,待细胞生长状态良好,细胞汇合度达到70%-80%时开始转染。将待转染的细胞分成6组,分别为对照组(control)、cpb2处理组(cpb2)、阴性对照组(cpb2+pcdna3.1)、s100a9过表达组(cpb2+pc-s100a9)、干扰阴性对照组(cpb2+si-nc)、s100a9干扰组(cpb2+si-s100a9);对照组(control)不做处理,cpb2处理组(cpb2)加入cpb2毒素使得毒素浓度为20μg/ml,其他4组分别用mrna过表达空载体、s100a9过表达载体、s100a9抑制剂阴性对照(si-nc)载体、s100a9抑制剂载体转染ipec-j2细胞,后加入浓度为20μg/ml的cpb2毒素,继续培养24h,培养完成后,采用rt-qpcr法检测il6、il8、tnfα和il-1β的mrna相对表达情况,测定方法参照试验例1中rt-qpcr法,其中il6、il8、tnfα和il-1β及总mrna相应的引物序列如表1所示,引物序列为seq id no.3~seq id no.12。
[0072]
同时采用酶联免疫吸附试验(elisa)检测上述各组细胞中的炎症因子il6、il8、tnfα和il-1β的水平,来验证rt-qpcr的检测准确性。具体操作如下:收集转染及cpb2毒素处理48h后的细胞培养上清液,2500rpm离心20min作为待测样品。根据elisa试剂盒说明书,使用elisa试剂盒(江苏科特生物科技有限公司,中国江苏)检测待测样品中炎性细胞因子il6、il8、tnfα和il-1β的含量。最后,在酶标仪下测定od450值,绘制标准曲线,计算样品浓度,浓度以pg/ml表示。
[0073]
2.实验结果
[0074]
rt-qpcr结果如图6a,cpb2毒素诱导ipec-j2细胞后炎症因子il6、il8、tnfα和il-1β的表达均显著上调。过表达s100a9后,cpb2诱导的ipec-j2细胞中il6、il8、tnfα和il-1β的表达均显著上调;s100a9干扰下cpb2诱导的ipec-j2细胞il6、il8、tnfα和il-1β的表达均显著降低。同时采用酶联免疫吸附试验(elisa)检测细胞培养上清中炎症因子il6、il8、tnfα和il-1β的含量,如图6b所示,其测定结果与rt-qpcr结果一致。以上结果表明,s100a9可增加cpb2毒素诱导的ipec-j2细胞炎症因子的释放,加重细胞损伤。
[0075]
实验例5s100a9对cpb2毒素诱导的ipec-j2细胞活力和增殖的影响
[0076]
1.实验方法
[0077]
(1)s100a9对cpb2毒素诱导的ipec-j2细胞活力
[0078]
将细胞悬液以1
×
106的密度接种到96孔板上,当细胞密度达到70%-80%合流时转染。转染24h后,用浓度为20μg/ml的cpb2毒素孵育细胞24h;处理结束后,每孔加入10μl cck-8溶液(cell counting kit-8细胞计数试剂),在温度37℃下,5%co2和95%o2培养箱中孵育1h,用酶标仪测定450nm波长下的吸光度。
[0079]
(2)s100a9对cpb2毒素诱导的ipec-j2的edu细胞活性检测测定edu(5-乙炔基-2'-脱氧尿苷,5-ethynyl-2
’‑
deoxyuridine)阳性细胞的数量,具体为将收集的ipec-j2细胞悬浮液以1
×
106的密度接种到24孔板上,培养24小时。然后分别用2000将si-nc、si-s100a9、pcdna3.1、pc-s100a9转染ipec-j2细胞24小时。用浓度为20μg/ml的cpb2毒素处理ipec-j2细胞24小时后,连同对照组和cpb2组分别用beyoclick
tm
edu-555细胞增殖试验试剂盒(碧云天,中国上海)将ipec-j2细胞与edu(10μm)工作液孵育2小时,并用hoechst 33342染色以便观察。在荧光倒置显微镜(olympus,日本)下进行检测。
[0080]
2.实验结果
[0081]
结果如图7所示,与对照组(control)相比,cpb2组细胞活力显著降低,同时s100a9过表达组(cpb2+pc-s100a9)细胞活力极显著低于阴性对照组(cpb2+pcdna3.1)。s100a9干扰组(cpb2+si-s100a9)的结果正好相反(图7a)。采用edu法检测细胞增殖。结果显示,s100a9过表达组(cpb2+pc-s100a9)的阳性细胞数量极显著低于阴性对照组(cpb2+pcdna3.1)。干扰组(cpb2+si-s100a9)阳性细胞数极显著高于s100a9干扰阴性对照组(cpb2+si-nc)(图7b、图7c)。以上研究表明,s100a9抑制了细胞活力和细胞增殖。
[0082]
实验例6活性氧ros和细胞毒性ldh
[0083]
1.实验方法
[0084]
(1)活性氧(ros)水平检测
[0085]
以2
′
,7
′‑
二氢二氯荧光素二乙酸酯(dcfh-da)为荧光探针检测细胞内活性氧(reactive oxygen species,ros)水平。转染和接种细胞,收集和悬浮细胞加入浓度为10μmol/l的dcfh-da稀释剂在37℃,5%二氧化碳细胞培养20分钟。为了使细胞完全接触dcfh-da,每隔3-5分钟颠倒混匀一次,在1500转离心5分钟,弃去上清液,用pbs洗涤未进入细胞的dcfh-da,用荧光酶标仪检测各组dcfh-da的荧光强度。
[0086]
(2)乳酸脱氢酶(ldh)活性测定
[0087]
参照实验例4的6个分组培养方式,培养完成后,收集各组细胞,用乳酸脱氢酶检测试剂盒测定ipec-j2细胞样品中ldh的活性。
[0088]
2.实验结果
[0089]
荧光强度和乳酸脱氢酶(ldh)活性测定结果如图8,结果表明,于对照组相比dcfh-da荧光强度cpb2毒素处理ipec-j2细胞后明显增强(图8a),s100a9过表达组(cpb2+pc-s100a9)显著高于阴性对照组(cpb2+pcdna3.1);与阴性对照组(cpb2+si-nc)相比,干扰组(cpb2+si-s100a9)荧光强度显著降低。进一步检测了细胞培养液中乳酸脱氢酶(ldh)的酶活性(图8b);cpb2毒素处理后,细胞培养液中ldh的酶活性显著提高。同时,与转染过表达载体对照(pcdna3.1)相比,转染s100a9过表达载体(pc-s100a9)增加了cpb2毒素对细胞的损伤,提高了细胞培养液中ldh酶活性。而转染s100a9抑制剂后,cpb2毒素对细胞的细胞毒性减弱。
[0090]
实验例7流式细胞检测细胞周期
[0091]
1.实验方法
[0092]
ipec-j2细胞经0.25%胰蛋白酶消化后,用75%预冷乙醇重悬,4℃孵育过夜;将ipec-j2细胞样品加入2μl 10mg/ml rnasea,37℃去除rna 30min,然后加入100μl浓度为100μg/ml的pi染色液,避光10min;最后,将ipec-j2细胞样品用流式细胞仪(cytoflex,beckman,usa)检测,激发波长为488nm,发射波长为585
±
21nm,利用modfit软件分析细胞周期分布。
[0093]
2.实验结果
[0094]
实验结果如图9,图9中所示为各实验组g0/g1期、g2期和s期细胞的百分率,可以看出与cpb2组相比,pc-s100a9组的g0/g1期百分比明显增加,s期明显降低,而si-s100a9组的结果则相反。因此,s100a9的过表达延长了cpb2毒素诱导的ipec-j2细胞的细胞周期。
[0095]
实验例8紧密连接蛋白zo-1、ocln和cldn-12的表达
[0096]
1.实验方法
[0097]
实验分组同实施例4,培养完成后,利用rt-qpcr检测了三个紧密连接蛋白zo-1、ocln和cldn-12在每个实验组中的表达水平,引物如表1所示,引物序列为seq id no.13~seq id no.18。
[0098]
2.实验结果
[0099]
结果如图10所示,暴露于cpb2毒素的ipec-j2细胞紧密连接蛋白mrna表达水平降低;与s100a9过表达阴性对照组(cpb2+pcdna3.1)相比,s100a9过表达组(cpb2+pc-s100a9)紧密连接蛋白zo-1、ocln和cldn-12表达均显著下调。与s100a9干扰阴性对照组(cpb2+si-nc)相比s100a9干扰组(cpb2+si-s100a9)紧密连接蛋白zo-1、ocln和cldn-12的表达均显著上调。上述结果表明s100a9破坏了cpb2毒素诱导的ipec-j2细胞的紧密连接。
[0100]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1