一种抗菌水凝胶及其制备方法和应用
1.本发明涉及生物医药领域,特别是涉及一种抗菌水凝胶及其制备方法和应用。
背景技术:
2.全身感染是严重烧伤患者主要的死亡原因之一,细菌主要来自于烧伤创面。烧伤创面存在大量毁损及失活组织,是细菌繁殖的良好场所,可导致全身侵袭性感染。而皮肤组织经烧伤后可释放tnfα等炎性细胞因子,并产生一种脂蛋白复合物的毒性物质“烧伤毒素”,对多种脏器组织细胞均具有直接损害作用;不仅如此,烧伤坏死组织还能激活巨噬细胞、淋巴细胞及中性粒细胞等炎性细胞,释放氧自由基、溶酶体酶、白三烯及细胞因子等对组织细胞有损害作用的介质。因此,如何能够有效抑菌的同时抑制炎症反应是当下治疗烧伤创面的首要问题。
技术实现要素:
3.针对上述技术问题,本发明提供一种抗菌水凝胶,该抗菌水凝胶能够有效抑菌。
4.本发明提供了一种抗菌水凝胶,包括水凝胶溶液、药物载体和药物活性成分,所述水凝胶溶液的制备原料包括以下重量份比的成分:
[0005][0006]
所述qcsg通过以下制备方法制备得到:将壳聚糖季铵盐溶于水,滴加甲基丙烯酸缩水甘油酯进行反应,过滤,取滤液,透析,冻干,得到qcsg;
[0007]
所述rcolma的制备方法包括以下步骤:将重组胶原蛋白溶于水,滴加甲基丙烯酸缩水甘油酯进行反应,透析,冻干,得到rcolma。
[0008]
qcsg具有良好的抗菌性、成膜性、阳离子吸附性、吸湿保湿性、絮凝性、抗静电性,rcolma具有良好的水溶性和较低的致敏性。壳聚糖季铵盐是海洋生物壳聚糖经化学改性修饰而制得的壳聚糖高级衍生物,具有良好的水溶性其吸湿性强相容性好、可生物降解,其抗菌性能优于壳聚糖及其它壳聚糖衍生物,壳聚糖季铵盐加入甲基丙烯酸缩水甘油酯会引入光交联基团(c=c),制备得到的qcsg在光引发剂和紫外光的条件下,可以形成水凝胶;重组胶原蛋白是细胞外基质的主要成分,为大多数组织提供基本结构和机械支持,广泛应用于组织工程、伤口愈合、骨和神经再生等领域。
[0009]
在其中一个实施例中,所述水凝胶溶液的制备原料包括以下重量份比的成分:
[0010][0011]
在其中一个实施例中,所述qcsg的制备方法中,所述滴加甲基丙烯酸缩水甘油酯进行反应的反应温度为50℃-60℃,反应时间为4小时-6小时,所述滴加甲基丙烯酸缩水甘油酯的滴加速度为每25-35s滴加1滴;所述rcolma的制备方法中,所述滴加甲基丙烯酸缩水甘油酯进行反应的反应温度为22℃-28℃,反应时间为4小时-6小时,所述滴加甲基丙烯酸缩水甘油酯的滴加速度为每25-35s滴加1滴。
[0012]
在其中一个实施例中,所述药物载体在所述水凝胶溶液中的工作浓度为18-22μg/ml,所述药物活性成分在所述水凝胶溶液中的工作浓度为3-4mg/ml。
[0013]
所述工作浓度为上述成分在使用时能够达到预期效果的浓度,可以理解的,本领域技术人员在配制上述水凝胶溶液时,可以配制浓度更高的母液或者储备液,待使用时再稀释,所述母液或者储备液及其浓度均在本发明的保护范围之内。
[0014]
在其中一个实施例中,所述药物载体为ag@mof,所述ag@mof通过以下制备方法制备得到:将cd-mof加入硝酸银乙腈溶液,搅拌,干燥,离心,洗涤,冻干,得到ag@mof;
[0015]
所述药物活性成分为lip@as,所述lip@as通过以下制备方法制备得到:采用薄膜分散法制备脂质体,加入积雪草苷,超声,得到lip@as。
[0016]
金属-有机骨架(mofs)作为优良的药物载体,负载ag后具有抗菌性为对抗致病性细菌感染提供了新的策略,ag@mof纳米复合材料具有高效的金属离子释放能力和强大的光热转换效应,在上述抗菌水凝胶中能发挥协同杀菌的作用,通过将ag@mof负载水凝胶内部,从而实现缓控释,减少药物的失效进而达到更好的抗菌效果;积雪草苷(as)是一种有机化合物,具有促进创伤愈合的作用,可用于治疗外伤、手术创伤、烧伤、疤痕疙瘩及硬皮病,将积雪草苷负载与脂质体(lip),能使lip@as具备促进创伤愈合作用的同时,具有较高的生物相容性和安全性,通过将积雪草苷(as)负载脂质体内部,实现了as在水凝胶中的缓慢释放,避免了药物的失效和加强抗炎效果。采用上述原料制备得到的水凝胶,同时具有抗炎和抗菌效果,该水凝胶负载了脂质体与超细纳米结构,可注射器注射和可编程释放药物,通过可调的超分子相互作用控制药物的释放,独立于药物的大小和物理化学性质,正交调节多种药物的释放行为,这种模块化、可扩展和易于管理的水凝胶材料将使各种治疗方法的可调释放成为可能,从而开发出改善人类健康的有效治疗方法。
[0017]
在其中一个实施例中,所述ag@mof的制备方法中,所述搅拌的时间为10小时-14小时,所述干燥的温度为95℃-105℃。
[0018]
在其中一个实施例中,所述lip@as的制备方法中,所述薄膜分散法包括:将卵磷脂和胆固醇溶于乙酸乙酯,通过旋转蒸发法挥干乙酸乙酯,得到脂质体。
[0019]
本发明还提供了所述抗菌水凝胶的制备方法,该制备方法包括以下步骤:将rcolma溶于溶剂,加入qcsg、光引发剂,照射紫外光,得到水凝胶溶液;将药物载体、药物活
性成分与水凝胶溶液混合,得到抗菌水凝胶。
[0020]
在其中一个实施例中,所述紫外光的波长为300nm-400nm,所述紫外光的照射时间为20s-40s。
[0021]
本发明还提供了所述抗菌水凝胶在制备抗菌药物中的应用
[0022]
与现有技术相比,本发明具有以下有益效果:
[0023]
本发明提供了一种抗菌水凝胶,该抗菌水凝胶的水凝胶溶液的原料包括qcsg、rcolma和光引发剂,其中,qcsg具有良好的抗菌性、成膜性、阳离子吸附性、吸湿保湿性、絮凝性、抗静电性,rcolma具有良好的水溶性和较低的致敏性,制备得到的抗菌水凝胶能够有效抑菌,具有优异的抗菌抗炎性,有望成为抗生素的替代品,同时该抗菌水凝胶生物相容性更好,并因其具有合适的溶胀率、稳定的流变性能、缓慢的生物降解性、适当的力学性能和药物的持续释放等特性,可以广泛的应用于载药系统。
附图说明
[0024]
图1为实验例1电镜检测中lip@as脂质体的tem图;
[0025]
图2为实验例1电镜检测中ag@mof的tem图;
[0026]
图3为实验例1核磁检测中rcol、rcolma的核磁氢谱图;
[0027]
图4为实验例1核磁检测中qcs、qcsg的核磁氢谱图;
[0028]
图5为实验例2外观检测中水凝胶成胶示意图;
[0029]
图6为实验例3电镜检测中水凝胶扫描电镜图,其中1为实施例1制备得到的rcolma,2为实施例2制备得到的rcolma/4%qcsg,3为实施例3制备得到的rcolma/8%qcsg,4为实施例4制备得到的rcolma/12%qcsg;
[0030]
图7为实验例5体外积雪草苷释放试验中积雪草苷在模拟人体微环境条件下的药物释放曲线;
[0031]
图8为实验例6生物相容性检测中细胞存活率结果图。
具体实施方式
[0032]
为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
[0033]
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
[0034]
定义:
[0035]
qcsg:又称甲基丙烯酸缩水甘油酯功能化壳聚糖。
[0036]
rcolma:又称甲基丙烯酸化重组胶原蛋白。
[0037]
ag@mof:又称银-金属有机骨架。
[0038]
lip@as:又称负载积雪草苷的脂质体。
[0039]
gma:又称甲基丙烯酸缩水甘油酯。
[0040]
cd-mof:又称环糊精-金属有机骨架。
[0041]
来源:
[0042]
本实施例所用试剂、材料、设备如无特殊说明,均为市售来源;试验方法如无特殊说明,均为本领域的常规试验方法。
[0043]
实施例1
[0044]
qcsg、rcolma、ag@mof、lip@as的制备。
[0045]
一、qcsg的制备。
[0046]
将20g的壳聚糖季铵盐溶于400ml水中,在55℃下缓慢滴加12ml甲基丙烯酸缩水甘油酯(gma),滴加速度为每30s滴加1滴,反应5小时后过滤,将滤液透析三天,冻干收集,即得。
[0047]
二、rcolma的制备。
[0048]
将20g重组胶原蛋白溶于400ml水,常温(22℃-28℃)下逐滴加入12ml甲基丙烯酸甘油酯,滴加速度为每30s滴加1滴,反应5小时后透析三天,冻干收集,即得。
[0049]
三、ag@mof的制备。
[0050]
将1g的cd-mof在室温下浸泡在20ml硝酸银乙腈溶液中,具体操作为将1g的cd-mof悬浮于10ml乙腈中,然后浸泡在agno3溶液(10ml,10mmol/l)中,持续搅拌12h,然后在100℃下真空离心干燥,用离心机分离得到ag@mof,用乙醇洗涤,冻干保存。
[0051]
四、lip@as的制备。
[0052]
利用薄膜分散法制备空白脂质体,具体过程为:将90mg的卵磷脂和15mg的胆固醇溶于20ml乙酸乙酯中,通过旋转蒸发仪挥干乙酸乙酯,形成还有脂质体的膜;2mg积雪草苷溶于20ml去离子水后将上述含有脂质体的膜溶解,超声4次,即得。
[0053]
实施例2
[0054]
一种水凝胶溶液。
[0055]
采用实施例1制备得到的rcolma、qcsg溶解于去离子水,然后加入光引发剂lap,使rcolma的浓度为10%(w/v)、qcsg的浓度为4%(w/v)、lap的浓度为0.1%(w/v),混合,即得rcolma/4%qcsg水凝胶溶液。
[0056]
实施例3
[0057]
一种水凝胶溶液。
[0058]
采用实施例1制备得到的rcolma、qcsg溶解于去离子水,然后加入光引发剂lap,使rcolma的浓度为10%(w/v)、qcsg的浓度为8%(w/v)、lap的浓度为0.1%(w/v),混合后,即得rcolma/8%qcsg水凝胶溶液。
[0059]
实施例4
[0060]
一种水凝胶溶液。
[0061]
采用实施例1制备得到的rcolma、qcsg溶解于去离子水,然后加入光引发剂lap,使rcolma的浓度为10%(w/v)、qcsg的浓度为12%(w/v)、lap的浓度为0.1%(w/v),混合,即得rcolma/12%qcsg水凝胶溶液。
[0062]
实施例5
[0063]
一种水凝胶。
[0064]
取1ml实施例3制备得到的水凝胶溶液,与4μl浓度为5mg/ml的实施例1制备得到的
ag@mof混合,使药物载体ag@mof在水凝胶溶液中的工作浓度为20μg/ml,然后采用365nm紫外光照射30s,得到rcolma/qcsg/ag@mof水凝胶。
[0065]
实施例6
[0066]
一种水凝胶。
[0067]
取1ml实施例3制备得到的水凝胶溶液,与50μl浓度为67mg/ml的实施例1制备得到的lip@as混合,使药物活性成分lip@as在水凝胶溶液中的工作浓度为3.35mg/ml,然后采用365nm紫外光照射30s,得到rcolma/qcsg/lip@as水凝胶。
[0068]
实施例7
[0069]
一种抗菌水凝胶。
[0070]
取1ml实施例3制备得到的水凝胶溶液,与4μl浓度为5mg/ml的实施例1制备得到的ag@mof、50μl浓度为67mg/ml的实施例1制备得到的lip@as混合,使药物活性成分lip@as在水凝胶溶液中的工作浓度为3.35mg/ml,使药物载体ag@mof在水凝胶溶液中的工作浓度为20μg/ml,然后采用365nm紫外光照射30s,得到rcolma/qcsg/lip@as/ag@mof水凝胶。
[0071]
实验例1
[0072]
对实施例1制备得到的原料进行检测。
[0073]
一、电镜检测。
[0074]
将实施例1制备得到的lip@as、ag@mof超声分散后配置成悬浮液。用移液枪滴几滴在电镜铜网上,待其干燥(或用滤纸吸干)后,即成为电镜观察用的样品,检测结果如图1、图2所示。
[0075]
从图1可知,tem图像证实了lip@as的球状结构,负载积雪草苷的脂质体直径大概100nm左右。从图2可知,ag+被cd-mof还原成ag单质,在cd-mof空间结构中的微孔中聚集,形成粒径约为10nm的ag nps。
[0076]
二、核磁检测。
[0077]
分别称取rcol、实施例1制备得到的rcolma、qcs、实施例1制备得到的qcsg各3-5mg样品溶于氘代重水中,待样品完全溶解至溶液澄清后,装入干净的核磁管中,利用核磁共振光谱仪在室温条件下进行核磁结构测定,并采用mestrenova软件进行图谱分析。结果如图3、图4所示。
[0078]
从图3可知,rcol核磁氢谱图中在化学位移为5.42和5.66新出现的吸收峰,对应为甲基丙烯酰胺键烯烃键上氢的吸收峰,可证明rcol改性成功。从图4可知,qcsg核磁氢谱图中在化学位移为5.33和5.64新出现的吸收峰,对应为甲基丙烯酰胺键烯烃键上氢的吸收峰,可证明qcs改性成功。
[0079]
实验例2
[0080]
外观检测。
[0081]
采用实施例2的水凝胶溶液,经365nm紫外光照射30s,得到成胶的水凝胶,如图5所示。从图5可知,在紫外光和光引发剂lap存在下,通过c=c键会发生自由基聚合形成rcolma/qcsg水凝胶的交联网络。
[0082]
实验例3
[0083]
电镜检测。
[0084]
分别取600μl实施例1制备得到的rcolma、实施例2制备得到的rcolma/4%qcsg、实
施例3制备得到的rcolma/8%qcsg、实施例4制备得到的rcolma/12%qcsg,照射紫外光,使其成胶,置于-80℃中预冻,冻干收集,对水凝胶表面喷金30s后,利用扫描电子显微镜观察水凝胶的表面形貌。测试条件为:5kv electron beam。结果如图6所示。
[0085]
从图6可知,实施例1的rcolma、实施例2的rcolma/4%qcsg、实施例3的rcolma/8%qcsg、实施例4的rcolma/12%qcsg水凝胶均呈现三维多孔的网状结构,其中1为实施例1制备得到的rcolma,2为实施例2制备得到的rcolma/4%qcsg,3为实施例3制备得到的rcolma/8%qcsg,4为实施例4制备得到的rcolma/12%qcsg。与实施例1的rcolma相比,实施例2的rcolma/4%qcsg、实施例3的rcolma/8%qcsg、实施例4的rcolma/12%qcsg的水凝胶孔径更大,这可能是相比于重组胶原蛋白,壳聚糖季铵盐分子量更大,从而导致形成的网络结构的孔径更大。
[0086]
实验例4
[0087]
压缩强度检测。
[0088]
分别取600μl实施例1制备得到的rcolma、实施例2制备得到的rcolma/4%qcsg、实施例3制备得到的rcolma/8%qcsg、实施例4制备得到的rcolma/12%qcs,照射紫外光,使其成胶,放于凝胶强度专用探头的正下方,凝胶探头对水凝胶进行挤压,直至破裂,记录下水凝胶破裂所需的力,定义为水凝胶的凝胶强度。取40%应变下的斜率作为水凝胶的压缩模量。结果如下表所示。
[0089]
表1各水凝胶的压缩模量
[0090] 压缩模量(kpa)实施例1制备得到的rcolma52.0
±
2.9实施例2制备得到的rcolma/4%qcsg215.5
±
12.0实施例3制备得到的rcolma/8%qcsg376.6
±
61.1实施例4制备得到的rcolma/12%qcs634.4
±
97.5
[0091]
因本发明旨在制备的抗菌水凝胶在注射之后,需要光照成胶,成胶之后的强度需要能够在创面使用并且不会破损,因此,理想的抗菌水凝胶应具有良好的力学性能,以保持其使用时的方便性和完整性。由上表可知,实施例3制备得到的rcolma/8%qcsg、实施例4制备得到的rcolma/12%qcsg水凝胶的压缩性能更好,表明水凝胶内部可能形成了较好的交联度,其力学性能更好。
[0092]
实验例5
[0093]
体外积雪草苷释放试验。
[0094]
将实施例1制备得到的lip@as、实施例6制备得到的rcolma/qcsg/lip@as水凝胶置于2ml pbs溶液(ph 7.4)中,移入透析袋,将装有样品的透析袋在37℃下pbs溶液环境中孵育,在每个时间点收集pbs上清液,然后用相同体积的新鲜pbs替换。将收集到的pbs上清液用hplc检测积雪草苷的含量,计算累计释放速率。结果如图7所示。
[0095]
从图7可知,脂质体封装可以提高积雪草苷的生物利用度,并且可以通过将脂质体掺入水凝胶中来进一步稳定药物递送系统。通过上述体外释放试验,以及以下包封率和载药率的计算公式,计算得到实施例1制备得到的lip@as中as在脂质体中的包封率为98.21%和载药量为15.76%,表明在混合过程中有少量药物从脂质体中渗出。
[0096]
载药率(%)=包载入脂质体的积雪草苷实际质量/载药脂质体的质量
×
100
[0097]
包封率(%)=包载入脂质体的积雪草苷实际质量/投入反应的积雪草苷总质量
×
100
[0098]
在释放实验中,脂质体在前3天内显示出78%的as快速释放,并在7天后完全释放。相比之下,rcolma/qcsg/lip@as在长达7天的时间内表现出相对缓慢的as释放,表明水凝胶可以稳定脂质体,从而延长药物释放。
[0099]
实验例6
[0100]
生物相容性检测。
[0101]
分别吸取500μl实施例1制备得到的rcolma、实施例3制备得到的rcolma/qcsg水凝胶溶液、实施例5制备得到的未采用紫外光固化的rcolma/qcsg/ag@mof水凝胶溶液、实施例7制备得到的未采用紫外光固化的rcolma/qcsg/lip@as/ag@mof水凝胶溶液,加入到12孔板中,用405nm、3w光源光照20秒,充分固化水凝胶后,加入含2ml 2
×
104个/毫升细胞的培养基连续培养5天。将每个时间点的孔板取出,用pbs溶液洗两次,取出其中负载细胞的凝胶,然后均匀地切碎。随后将混合物离心处理,留下上层清液,每孔加500μl cck8工作液,在37℃恒温二氧化碳培养箱(含5%的co2)中孵育1~2h后,用酶标仪在450nm波长处测定吸光度(od),按照公式计算细胞存活率:细胞存活率(%)=od
实验组
/od
对照组
×
100%。
[0102]
结果如图8所示,通过cck-8测定法测定的每组中的细胞数量随时间增加而没有组间差异。表明rcolma/qcsg/lip@as/ag@mof凝胶具有良好的生物相容性,可应用于体内应用。
[0103]
实验例7
[0104]
抗菌性检测。
[0105]
检测方法:用革兰氏阳性金黄色葡萄球菌(s.aureus)和革兰氏阴性大肠杆菌(e.coli)评价纳米材料的抗菌性。分别取400μl实施例1制备得到的rcolma、实施例3制备得到的rcolma/qcsg水凝胶、实施例5制备得到的rcolma/qcsg/ag@mof(ag@mof的工作浓度为20μg/ml)水凝胶,以及采用实施例5的方法制备得到的rcolma/qcsg/ag@mof(ag@mof的工作浓度为10μg/ml)水凝胶、rcolma/qcsg/ag@mof(ag@mof的工作浓度为40μg/ml)水凝胶溶液,与1ml的细菌悬浮液(1
×
106cfu/ml)共同培养,在37℃下培养4h。将稀释后的菌悬液(100μl)接种到lb琼脂平板上,在37℃下培养24h,计算菌落数,并按以下公式计算细菌存活率。
[0106]
细菌存活率(%)=n
sample
/n
control
×
100
[0107]
其中n
control
是对照样品中的平均菌落数,n
sample
是水凝胶材料处理样品中的平均细菌菌落。
[0108]
检测结果:如下表所示。
[0109]
表2抗菌性检测试验的结果
[0110]
[0111][0112]
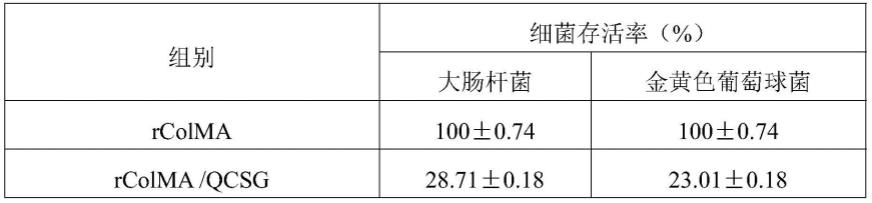
结果分析:由于许多基于生物材料的治疗失败的案例都是由细菌感染引起的,因此具有抑菌作用的生物材料目前在临床应用中越来越受到关注,尤其是伤口敷料。因此,在体外研究了制备的水凝胶对两种代表性微生物(革兰氏阳性金黄色葡萄球菌和革兰氏阴性大肠杆菌和铜绿假单孢菌)的抗菌性能。结果表明,在37℃下接触4小时后,rcolma/qcsg/ag@mof水凝胶具有更好的抗菌性能,优于rcolma/qcsg和rcolma水凝胶,rcolma/qcsg水凝胶的抗菌活性优于rcolma。如表所示,rcolma/qcsg/ag@mof水凝胶的抗菌率与rcolma/qcsg的抗菌率显着不同,且rcolma/qcsg/ag@mof(20)和rcolma/qcsg/ag@mof(40)水凝胶可杀死多达100%的金黄色葡萄球菌和大肠杆菌。该结果表明,qcsg和ag@mof均具有抗菌活性,并且与任何一个个体的存在相比,两者的协同作用可以显着提高材料的抗菌活性。
[0113]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0114]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1