一种非那雄胺类脂囊泡及其制备方法和应用
1.本发明涉及防脱发技术领域,尤其涉及一种非那雄胺类脂囊泡及其制备方法和应用。
背景技术:
2.雄性激素性脱发是一种雄激素依赖的遗传性疾病,是临床上最常见的脱发性疾病。雄激素性脱发的发病机制与雄激素水平异常有关。雄激素调毛发正常生长的重要因素,其在青春期后,促进头皮表皮层的休止期毛囊向真皮区域生长转化为生长期毛囊,进而促进细软的无色素毳毛沙僧张为粗大的色素性终毛,然而雄激素水平异常时可逆转此过程,使终毛逐渐被毳毛代替,最终导致脱发。对于雄激素性脱发患者来说,头皮毛囊中的雄激素受体表达更高,增强了毛囊对雄激素的敏感性。男性体内的雄激素主要为睾酮,脱发患者毛囊中的ⅱ型5α-还原酶可以将睾酮转化为活性更强的二氢睾酮,使局部二氢睾酮水平升高,二氢睾酮与雄激素受体的亲和性是睾酮的5倍,能对毛囊产生毒性作用,导致头皮毛囊微型化,使毛发进入休止期进而脱发。
3.通过抑制ⅱ型5α-还原酶来降低雄激素水平已成为治疗雄激素源性脱发的重要方法。非那雄胺是一种4-氮杂甾体化合物,它是睾酮代谢成为二氢睾酮过程中的细胞内酶
‑ⅱ
型5α-还原酶的特异性抑制剂,能够阻断睾酮向活性更强的二氢睾酮转化,从而降低毛囊和血液中的二氢睾酮水平,遏制或逆转二氢睾酮接到的毛囊微型化效应,诱导毛发周期从休止期向生长期转化,进而发挥预防和治疗脱发的作用。非那雄胺用于治疗雄激素源性脱发,具有显著的疗效。鉴于病情的进展性,需要长期服用非那雄胺才能使脱发得到持续的改善。但长期口服非那雄胺在缓解患者病情,促进毛发生长的同时也降低了全身血液中雄激素的水平,这可能会引起严重的全身性不良反应,如性欲减退、勃起功能障碍、睾丸疼痛等。
技术实现要素:
4.本发明的目的在于提供一种非那雄胺类脂囊泡及其制备方法和应用,所述非那雄胺类脂囊泡可以克服皮肤障碍以增加非那雄胺的皮肤吸收。
5.为了实现上述发明目的,本发明提供以下技术方案:
6.本发明提供了一种非那雄胺类脂囊泡,包括非那雄胺和封装所述非那雄胺的双分子层结构的封闭体系;
7.所述双分子层结构的封闭体系的制备原料包括聚乙二醇单硬脂酸酯和药学上可接受的脂质材料。
8.优选的,所述非那雄胺类脂囊泡的粒径为200~300nm。
9.优选的,所述聚乙二醇单硬脂酸酯和脂质材料的质量比为1:(1~5);
10.所述非那雄胺和脂质材料的质量比为1:(4~10)。
11.优选的,所述脂质材料包括脂肪酸山梨坦类脂质材料和/或聚山梨酯类脂质材料。
12.优选的,所述脂肪酸山梨坦类脂质材料包括司盘40和/或司盘60;
13.所述聚山梨酯类脂质材料包括吐温40和/或吐温60。
14.本发明还提供了上述技术方案所述的非那雄胺类脂囊泡的制备方法,其特征在于,包括以下步骤:
15.将非那雄胺、聚乙二醇单硬脂酸酯、脂质材料和乙醇混合,得到有机相;
16.将所述有机相加入水相中,挥发乙醇,得到所述非那雄胺类脂囊泡。
17.优选的,所述水相的温度为45~65℃。
18.优选的,所述有机相中非那雄胺的质量浓度为0.1%~0.9%;
19.所述聚乙二醇单硬脂酸酯和脂质材料的质量比为1:(1~5);
20.所述非那雄胺和脂质材料的质量比为1:(4~10);
21.所述有机相和水相的体积比为1:(7~15)。
22.优选的,所述挥发乙醇在搅拌的条件下进行;
23.所述搅拌的时间为1~3h。
24.本发明还提供了上述技术方案所述的非那雄胺类脂囊泡或上述技术方案所述的制备方法制备得到的非那雄胺类脂囊泡在制备预防脱发和促进生发的非口服药物、口服药物或保健品中的应用。
25.本发明提供了一种非那雄胺类脂囊泡,包括非那雄胺和封装所述非那雄胺的双分子层结构的封闭体系;所述双分子层结构的封闭体系的制备原料包括聚乙二醇单硬脂酸酯和药学上可接受的脂质材料。本发明所述的非那雄胺类脂囊泡的结构与人体细胞膜结构相似,所述非那雄胺类脂囊泡与皮肤角质层紧密接触,可以吸附并融合到皮肤表面,使界面处药物形成热力学活度梯度,形成药物的穿透推动力;类脂囊泡的脂质材料还可以发挥透皮促进剂的作用与角质层成分相互作用,促进药物的经角质层渗透与吸收;类脂囊泡进入角质细胞间脂质中,破坏角质细胞周围的密集脂质结构,通过改变角质层结构提高药物的渗透以提高药物在皮肤中的蓄积;用于皮肤表面,水分蒸发后,可以在表面形成一层闭塞薄膜,减少经表皮的失水引起角质层特性的改变,增加角质层的水合作用,可逆的降低角质细胞结构的紧密型,从而促进非那雄胺经角质层渗透并增加药物在皮肤中的保留。
26.在局部外用产品中,使用类脂囊泡的一个主要问题是其稳定性差,为了克服上述问题,本发明在所述非那雄类脂囊泡中引入聚乙二醇单硬脂酸酯,在类脂囊泡表面涂覆亲水性聚合物,进而在相邻类脂囊泡双层膜之间引入立体屏障,从而很好的解决了其稳定性问题。因此,本发明所述非那雄胺类脂囊泡作为一种替代口服的皮肤局部给药系统,以减少长期口服非那雄胺可能产生的全身性副作用。本发明所述的非那雄胺类脂囊泡具有良好的物理稳定性,可以促进非那雄胺穿透皮肤角质层,增加药物在皮肤层尤其是毛囊的保留和蓄积,提高非那雄胺抗雄性激素性脱发作用。
附图说明
27.图1为实施例1所述非那雄胺类脂囊泡的粒径分布图;
28.图2为实施例1所述非那雄胺类脂囊泡的透射电镜照片;
29.图3为实施例1所述非那雄胺类脂囊泡的体外皮肤累积渗透曲线;
30.图4为测试例5中小鼠毛发再生情况的观察图;
31.图5为测试例5中毛发重量结果图;
32.图6为测试例5中毛囊组织学的观察图。
具体实施方式
33.本发明提供了一种非那雄胺类脂囊泡,包括非那雄胺和封装所述非那雄胺的双分子层结构的封闭体系;
34.所述双分子层结构的封闭体系的制备原料包括聚乙二醇单硬脂酸酯和药学上可接受的脂质材料。
35.在本发明中,所述非那雄胺类脂囊泡的粒径优选为200~300nm,更优选为220~280nm,最优选为240~260nm。
36.在本发明中,所述聚乙二醇单硬脂酸酯和脂质材料的质量比优选为1:(1~5),更优选为1:(2~4),最优选为1:(2.5~3.5)。
37.在本发明中,所述非那雄胺和脂质材料的质量比优选为1:(4~10),更优选为1:(5~8),最优选为1:(6~7)。
38.在本发明中,所述脂质材料优选包括脂肪酸山梨坦类脂质材料和/或聚山梨酯类脂质材料;所述脂肪酸山梨坦类脂质材料优选包括司盘40和/或司盘60;所述聚山梨酯类脂质材料优选包括吐温40和/或吐温60;当所述脂质材料为上述具体选择中的两种以上时,本发明对上述具体物质的配比没有任何特殊的限定,按任意配比进行混合即可。
39.本发明还提供了上述技术方案所述的非那雄胺类脂囊泡的制备方法,其特征在于,包括以下步骤:
40.将非那雄胺、聚乙二醇单硬脂酸酯、脂质材料和乙醇混合,得到有机相;
41.将所述有机相加入水相中,挥发乙醇,得到所述非那雄胺类脂囊泡。
42.在本发明中,若无特殊说明,所有制备原料均为本领域技术人员熟知的市售产品。
43.本发明将非那雄胺、聚乙二醇单硬脂酸酯、脂质材料和乙醇混合,得到有机相。
44.在本发明中,所述有机相中非那雄胺的质量浓度优选为0.1%~0.9%,更优选为0.3%~0.7%,最优选为0.5%~0.6%。
45.本发明对所述混合的过程没有任何特殊的限定,采用本领域技术人员熟知的过程进行即可。
46.得到有机相后,本发明将所述有机相加入水相中,挥发乙醇,得到所述非那雄胺类脂囊泡。
47.在本发明中,所述有机相和水相的体积比优选为1:(7~15),更优选为1:(8~13),最优选为1:(9~10)。
48.在本发明中,所述水相的温度优选为45~65℃,更优选为50~60℃,最优选为53~56℃。
49.在本发明中,所述加入的方式优选为滴加;本发明对所述滴加的过程没有任何特殊的限定,采用本领域技术人员熟知的过程进行即可。
50.在本发明中,所述挥发乙醇优选在搅拌的条件下进行,所述搅拌的时间优选为1~3h,更优选为1.5~2.5h,最优选为2h。本发明对所述搅拌的过程没有任何特殊的限定,
51.本发明还提供了上述技术方案所述的非那雄胺类脂囊泡或上述技术方案所述的制备方法制备得到的非那雄胺类脂囊泡在制备预防脱发和促进生发的非口服药物、口服药
物或保健品中的应用。本发明对所述应用的方法没有任何特殊的限定,采用本领域技术人员熟知的方法进行即可。
52.下面结合实施例对本发明提供的非那雄胺类脂囊泡及其制备方法和应用进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
53.实施例1
54.将0.25g非那雄胺、1.00g聚乙二醇单硬脂酸脂、2.00g司盘60和50ml乙醇混合,搅拌使其充分溶解,得到有机相;
55.在搅拌的条件下,将所述有机相滴入500ml温度为55℃的纯化水中,55℃搅拌2h至乙醇挥发,得到所述非那雄胺类脂囊泡。
56.实施例2
57.将0.25g非那雄胺、1.00g聚乙二醇单硬脂酸脂、1.25g司盘60、0.75g吐温40和50ml乙醇混合,搅拌使其充分溶解,得到有机相;
58.在搅拌的条件下,将所述有机相滴入750ml温度为45℃的纯化水中,45℃搅拌2h至乙醇挥发,得到所述非那雄胺类脂囊泡。
59.实施例3
60.将0.25g非那雄胺、0.50g聚乙二醇单硬脂酸脂、0.50g司盘60、0.50g吐温60和125ml乙醇混合,搅拌使其充分溶解,得到有机相;
61.在搅拌的条件下,将所述有机相滴入1000ml温度为65℃的纯化水中,65℃搅拌1h至乙醇挥发,得到所述非那雄胺类脂囊泡。
62.实施例4
63.将0.25g非那雄胺、1.00g聚乙二醇单硬脂酸脂、1.00g司盘60、1.00g吐温60和70ml乙醇混合,搅拌使其充分溶解,得到有机相;
64.在搅拌的条件下,将所述有机相滴入500ml温度为60℃的纯化水中,65℃搅拌1h至乙醇挥发,得到所述非那雄胺类脂囊泡。
65.实施例5
66.将0.125g非那雄胺、0.50g聚乙二醇单硬脂酸脂、0.50g司盘60、0.50g吐温60和125ml乙醇混合,搅拌使其充分溶解,得到有机相;
67.在搅拌的条件下,将所述有机相滴入1000ml温度为60℃的纯化水中,65℃搅拌1h至乙醇挥发,得到所述非那雄胺类脂囊泡。
68.实施例6
69.将0.35g非那雄胺、0.75g聚乙二醇单硬脂酸脂、2.50g司盘40和50ml乙醇混合,搅拌使其充分溶解,得到有机相;
70.在搅拌的条件下,将所述有机相滴入500ml温度为60℃的纯化水中,65℃搅拌1h至乙醇挥发,得到所述非那雄胺类脂囊泡。
71.实施例7
72.将0.45g非那雄胺、0.90g聚乙二醇单硬脂酸脂、4.50g司盘40和50ml乙醇混合,搅拌使其充分溶解,得到有机相;
73.在搅拌的条件下,将所述有机相滴入350ml温度为60℃的纯化水中,65℃搅拌1h至乙醇挥发,得到所述非那雄胺类脂囊泡。
74.实施例8
75.将0.20g非那雄胺、2.00g聚乙二醇单硬脂酸脂、2.00g司盘40和50ml乙醇混合,搅拌使其充分溶解,得到有机相;
76.在搅拌的条件下,将所述有机相滴入500ml温度为45℃的纯化水中,45℃搅拌3h至乙醇挥发,得到所述非那雄胺类脂囊泡。
77.实施例9
78.将0.30g非那雄胺、1.00g聚乙二醇单硬脂酸脂、2.00g司盘40、1g吐温60和55ml乙醇混合,搅拌使其充分溶解,得到有机相;
79.在搅拌的条件下,将所述有机相滴入500ml温度为65℃的纯化水中,65℃搅拌1h至乙醇挥发,得到所述非那雄胺类脂囊泡。
80.实施例10
81.将0.30g非那雄胺、1.00g聚乙二醇单硬脂酸脂、3.0g吐温60和60ml乙醇混合,搅拌使其充分溶解,得到有机相;
82.在搅拌的条件下,将所述有机相滴入500ml温度为55℃的纯化水中,55℃搅拌2h至乙醇挥发,得到所述非那雄胺类脂囊泡。
83.实施例11
84.将0.30g非那雄胺、0.75g聚乙二醇单硬脂酸脂、3.0g吐温40和60ml乙醇混合,搅拌使其充分溶解,得到有机相;
85.在搅拌的条件下,将所述有机相滴入500ml温度为55℃的纯化水中,55℃搅拌2h至乙醇挥发,得到所述非那雄胺类脂囊泡。
86.实施例12
87.将0.30g非那雄胺、1.00g聚乙二醇单硬脂酸脂、3.0g司盘60和60ml乙醇混合,搅拌使其充分溶解,得到有机相;
88.在搅拌的条件下,将所述有机相滴入500ml温度为55℃的纯化水中,55℃搅拌2h至乙醇挥发,得到所述非那雄胺类脂囊泡。
89.测试例1
90.通过动态光散射测量了非那雄胺类脂囊泡的粒径,精密量取实施例1中的新鲜制备的非那雄胺类脂囊泡0.5ml于10ml容量瓶中,加蒸馏水稀释至刻度摇匀。用nanobrook-173plus粒度和电位测量仪测定非那雄胺类脂囊泡的粒径,平行测定三次,结果如图1所示,由图1可知,非那雄胺类脂囊泡的粒径范围为100~1000nm,集中分布在200~300nm。
91.测试例2
92.非那雄胺类脂囊泡的包封率:
93.采用膜过滤法测定包封率。分别取实施例1中过膜前和过膜后的非那雄胺类脂囊泡0.5ml,用甲醇溶液破乳并稀释至10ml,超声15min,于2000rpm离心10min。取上清液,进样20μl,高效液相色谱法测定非那雄胺的量;根据公式计算包封率(ee)。
94.ee=m1/m2×
100%;
95.其中:m1为过膜后上清液中非那雄胺的量;m2为过膜前上清液中非那雄胺的量。
96.经计算,所述非那雄胺类脂囊泡包封率为94.00
±
0.15%。
97.测试例3
98.精密量取实施例1制备的非那雄胺类脂囊泡1ml置于5ml棕色容量瓶中,加蒸馏水稀释至刻度,取一滴滴在铜网上,晾干后用2%(w/v)磷钨酸水溶液染色3min,吸去多余染色剂,置于h-600透射电镜下观察形态,并拍摄照片,结果如图2所示,由图2可知,实施例1所述非那雄胺类脂囊泡外观表面光滑,呈均匀规则的圆形或近圆形颗粒。
99.测试例4
100.非那雄胺类脂囊泡的体外皮肤渗透性和滞留性评价:
101.按照实施例1制备非那雄胺类脂囊泡,考察非那雄胺类脂囊泡的体外经皮渗透与皮肤保留行为;
102.采用franze扩散池法进行透皮实验,通过颈椎脱臼法处死sd大鼠后,用动物脱毛器将背部毛发剔除干净,剥离背部皮肤,去除皮下组织和粘黏的脂肪,用生理盐水反复冲洗干净,即取得离体鼠皮;
103.剪取合适大小的大鼠皮肤固定在充满接收介质的扩散池上,角质层面向上,朝向给药池,与药物紧密接触。真皮层面向下,朝向接收池,与接受介质紧密接触。给药池分别加入非那雄胺类脂囊泡、非那雄胺混悬液、非那雄胺水醇溶液,设置转速为400rpm,温度为37
±
0.2℃。
104.在本实验中,各给药组如下:
105.非那雄胺类脂囊泡组:实施例1制备的非那雄胺类脂囊泡,作为目标制剂组;
106.非那雄胺混悬液组:作为对照组。制备步骤如下:(1)配置0.5%羧甲基纤维素钠液,具体的方法为:取2.50g羧甲基纤维素钠缓缓加入适量的超纯水中,加热并不断搅拌,最后补加超纯水至500ml,配成0.5%(w/v)羧甲基纤维素钠混悬液;(2)取非那雄胺0.25g加入上述羧甲基纤维素钠混悬液即可;
107.非那雄胺水醇溶液组:作为对照组。制备步骤如下:称取非那雄胺0.25g,溶于500ml的乙醇和超纯水(乙醇与水的体积比为3:7)的混合溶液中,搅拌加热溶解即可。
108.分别于给药后第1、2、4、6、8、10和12h取样1ml,并立即补充等量同温接收介质,高效液相色谱仪测定样品的药物含量,计算各时间点单位面积药物累积透皮量。所得累积渗透曲线如图3所示。
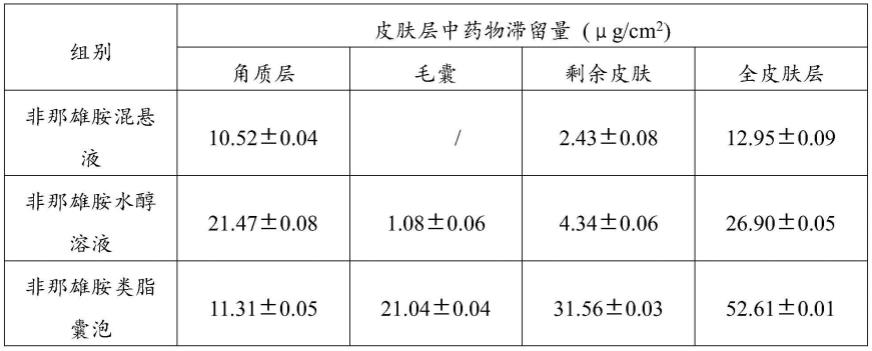
109.经皮渗透12h后,将鼠皮从扩散池上取下,用3ml甲醇冲洗皮肤,重复冲洗三次,用浸水的纱布擦拭干净,再用滤纸吸干皮肤表面水分。用胶带剥离技术将皮肤角质层与皮肤分开,再采用氰基丙烯酸酯活检技术制备毛囊铸型,将毛囊从皮肤中提取出来。胶带剥离法是用特定的胶带以一定压力按压在皮肤上,15s后,撕下皮肤上的胶带,弃去第一条胶带后,重复剥离15次,将15条胶带剪成小块,浸泡在甲醇中,超声15min,并在37℃下震摇12h后,2000rpm离心20min后,取上清液经0.22μm有机微孔滤膜过滤后,高效液相色谱仪检测药物含量,计算出药物在皮肤角质层、毛囊以及剩余皮肤中的滞留量。皮肤角质层、毛囊以及剩余皮肤中非那雄胺的滞留量如表1所示:
110.表1肤角质层、毛囊以及剩余皮肤中非那雄胺的滞留量
[0111][0112]
从图3与表1可得,非那雄胺混悬液的累积透皮量最低,全皮肤中的药物保留量为12.95
±
0.09μg/cm2,毛囊中基本检测不到药物;非那雄胺水醇溶液显示在三组中最高的累积透皮量,药物在全皮肤层与毛囊中的保留量分别为26.9
±
0.02μg/cm2、1.08
±
0.06μg/cm2,说明乙醇可以促进药物的经皮渗透,这是因为乙醇可以干扰皮肤表面的脂质结构,可逆的破坏皮肤脂质屏障,但乙醇无法促进药物在皮肤中的保留;非那雄胺类脂囊泡中药物的累积渗透曲线、经皮渗透速率(1.85
±
0.01μg/cm2/h)与非那雄胺水醇溶液相似,但非那雄胺类脂囊泡中药物在全皮肤层、毛囊中的保留量分别为52.61
±
0.01μg/cm2、21.04
±
0.04μg/cm2,约为非那雄胺水醇溶液的2、20倍,说明非那雄胺类脂囊泡可以提高皮肤尤其是毛囊部位的药物浓度。
[0113]
测试例5
[0114]
非那雄胺类脂囊泡在雄激素性脱发小鼠模型中抑制毛囊微型化和促进毛发再生效果的评价:
[0115]
使用动物剃毛器和脱毛膏除去每只8周龄c57bl/6小鼠背部的毛发,24h后,将睾酮溶解在乙醇:1,2丙二醇:超纯水(体积比为54:26:20)的混合溶液中,并以0.5%(w/v)睾酮浓度每天施加在除空白组的小鼠脱毛区域,并因此制造类似人雄激素性脱发的环境,建立经睾酮诱导的雄激素脱发(aga)模型小鼠。
[0116]
在本实验中,各实验组如下:
[0117]
空白组:未经睾酮处理的组,仅施用生理盐水;
[0118]
模型组:仅用睾酮处理;
[0119]
非那雄胺类脂囊泡组:用睾酮处理1h后使用实施例1的非那雄胺类脂囊泡;
[0120]
非那雄胺混悬液组:用睾酮处理1h后使用测试例3的非那雄胺混悬液;
[0121]
米诺地尔组:用睾酮处理1h后使用市售的5%米诺地尔。
[0122]
给药周期为天2次,于给药后第0、9、14、21和28天观察并记录毛发生长情况,毛发生长观察实验结束后即28天后记录各实验组小鼠背部实验区域毛发重量。各实验组小鼠毛发再生的情况和28天后毛发重量分别如图4和5所示。
[0123]
为了评价各给药组对脱发模型小鼠毛囊微型化的抑制效果,在毛发再生观察28天后,通过颈椎脱臼法处死小鼠,取下各组的小鼠背部实验区域的皮肤放置于新鲜组织固定液中,固定24h后,制作石蜡切片,最后于显微镜下观察毛囊形态并拍摄图片。各实验组对脱发模型小鼠毛囊微型化的抑制效果如图6所示。
[0124]
图4中,睾酮诱导的雄激素性脱发(aga)小鼠的毛发再生明显延迟。模型组直到第19天仍然是大面积脱毛的皮肤,没有色素沉着,直到第28天出现少量的毛干,这表明aga模型建立成功。空白组在第9天出现灰色皮肤,然后毛发开始迅速生长,第14天毛发基本生长完全。米诺地尔能明显促进睾酮诱导的小鼠毛发生长,第14天生长出毛干,21天时脱毛区域覆盖大量毛发,28天时毛发基本生长完全。非那雄胺混悬液组直到第21天才出现较少的色素沉着,28天后约有20~40%的脱毛区出现了毛干,恢复毛发生长效果并不理想。使用非那雄胺类脂囊泡治疗的aga小鼠,在第14天就出现了毛轴,在第21天脱毛区域基本覆盖了毛发。在所有的治疗中,非那雄胺类脂囊泡促进aga小鼠的头发再生作用最明显,其效果甚至超过了阳性对照药物米诺地尔。
[0125]
图5中,空白组小鼠毛发重量为54.6g,毛发发质硬且密。模型组仅有少许毛干。非那雄胺混悬液组小鼠毛发重量略好与模型组,该组小鼠仅有少许毛发生长,毛发细脆且疏,其毛发重量为4g。米诺地尔组与非那雄胺类脂囊泡组小鼠毛发发质质较硬且较密,其毛发重量分别为44.1、49.4g,应用非那雄胺类脂囊泡组的实验小鼠28天后毛发重量甚至好于阳性对照药物米诺地尔组。上述实验表明非那雄胺类脂囊泡能较好地促进雄激素性脱发(aga)小鼠毛发再生。
[0126]
图6中,空白组小鼠毛囊长度较长,数量较多,毛干色素深,大部分毛囊处于生长期。模型组小鼠毛囊明显微小化,且数量变少,毛囊萎缩,毛干色素浅淡,大部分毛囊处于休止期。非那雄胺混悬液组毛囊与模型组相似。非那雄胺类脂囊泡组小鼠毛囊数量较多,毛囊微小化不明显,毛干色素较深,大部分毛囊处于生长期,与米诺地尔组基本相当,说明非那雄胺类脂囊泡可抑制雄激素性脱发模型小鼠毛囊微型化,促进小鼠毛发从休止期进入生长期。
[0127]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1