一种治疗儿童时疫的中药组合物及其应用的制作方法
一种治疗儿童时疫的中药组合物及其应用
【技术领域】
1.本发明涉及中药领域,具体地说,涉及一种治疗儿童时疫的中药组合物及其应用。
背景技术:
2.儿童时疫即儿童流行性传染病,儿童常见的流行传染病有流行性感冒、风疹、麻疹、水痘、猩红热、腮腺炎、流行性脑炎等,4到9月容易出现手足口病,夏季容易出现痢疾,肠炎、乙型脑炎、登革热等。秋季容易出现轮状病毒肠炎。传染性单细胞增多没有明显的季节性。经过长期不懈努力钻研和实践,特别是疫苗的应用和不断改进,儿童传染性疾病得到了有效控制。如今一些新的传染性疾病及各种病原微生物的耐药问题成为儿童传染性疾病治疗中面临的日趋严重的问题。而小儿的上感要做到详细检查,结合病史、流行病学史、预防接种史,及时作出正确的诊断和治疗。
3.在儿童流行性传染病中最常见的就是流行性感冒,指儿童被流感病毒感染之后所引发的急性呼吸道传染病,呼吸道感染主要是由于病毒、细菌、支原体、真菌、寄生虫等侵犯呼吸道,引发呼吸道疾病,而儿童呼吸道感染主要由病毒引起,其中以呼吸道合胞病毒、腺病毒、流感病毒、副流感病毒等较为多见,特别是近年来爆发的新型冠状病毒,需对症治疗。同时我国加强临床合理用药管理,在临床治疗中明确病毒类型是指导治疗的重要依据。由于此类疾病易引发炎症,所以大多数治疗此类疾病的药物中为抗生素类,此类药物的使用可能会导致一系列不良反应,同时还使得病毒的抗药性大大增强,很难再用传统的普通药物治愈,以往医生的治疗经验已经不能很快治愈,所以治疗前景令人堪忧。
4.中国专利文献cn104800382a,公开日2015.07.29,公开了一种用于治疗感冒的中药组合物及其制备方法和应用,由下列中药原料制成:羌活、黄连、防风、柴胡、黄芩、紫苏叶、滑石粉、甘草、葛根、青蒿、连翘、大黄、荆芥、栀子、薄荷、车前子、独活、广藿香、薄荷素油以及鬼羽箭。中国专利文献cn1544035a,公开日2004.11.10,中国专利文献cn107929502a,公开日2018.04.20,公开了一种治疗小儿上呼吸道感染的中药组合物及其制备方法,由下列中药原料制成:白地紫菀、马棘、橙皮、厚朴花、万寿菊根、粟米草、水茴香、白花龙胆、鼠曲草、浙贝母、猪笼草。中国专利文献cn107823489a,公开日2018.03.23,公开了一种儿科治疗反复上呼吸道感染的中药组合物及其制备方法,所述中药组合物的原料药由黄芪2-4份,薏仁4-8份,大枣4-8份,蝉衣1-2份,炙甘草6-10份,煅牡蛎2-4份,莲子3-6份,桔梗6-10份,人参1-3份,鳖甲1-3份,骨碎补1-3份,补骨脂2-4份,牛膝2-4份,蛇床子5-7份,仙茅2-4份,牛蒡子4-8份,桑叶4-6份,苇茎4-8份,荆芥6-10份,淡豆鼓1-3份,北杏1-3份,苏叶2-4份,连翘4-8份。上述中药组合物药味数较多,增加了药物制备的程序,较为繁琐,且还存在取材难,价格昂贵和药效不显著等缺点,因此研制能治疗儿童时疫且效果明显、药味数适中、便于制备的药物很有必要。
技术实现要素:
5.本发明的目的是针对现有技术中的不足,提供一种治疗儿童时疫的药物。
6.本发明的第二个目的是,提供中药组合物的用途。
7.为实现上述目的,本发明采取的技术方案是:
8.一种治疗儿童时疫的中药组合物,所述中药组合物由以下重量份的原料药制成:柴胡4-8份、黄芩7-11份、紫苏叶4-8份、金银花7-11份、太子参7-11份、藿香7-11份、苍术4-8份、芦根7-11份、甘草4-8份组成。
9.作为一个优选例,所述中药组合物由下列重量份的原料药制成:柴胡5-7份、黄芩8-10份、紫苏叶5-7份、金银花8-10份、太子参8-10份、藿香8-10份、苍术5-7份、芦根8-10份、甘草5-7份。
10.更优选地,所述的药物由下列重量份的原料药制成:柴胡6份、黄芩9份、紫苏叶6份、金银花9份、太子参9份、藿香9份、苍术6份、芦根9份、甘草6份。
11.更优选地,所述的中药组合物的剂型为胶囊、颗粒、片剂、口服液、合剂或糖浆剂。
12.为实现上述第二个目的,本发明采取的技术方案是:
13.如上任一所述的中药组合物在制备治疗儿童时疫药物中的应用。
14.本发明配方中各中药的功效是:
15.以“疏风和解、扶正祛邪”为主要治疗原则。柴胡为君,黄芩、太子参为臣,紫苏叶、藿香、苍术、芦根为佐,甘草为使。遵循儿童用药宜精宜轻的原则,以金银花疏散风热,芦根清热生津,加入紫苏叶加强疏风散邪之功效;儿童呼吸道传染病早期可见咳嗽等症状,有风热之邪内伏化热之嫌,黄芩为肺经要药,取其清热解毒之功;表里之间为膜原之处,为和解表里,透达膜原,故取柴胡达原饮之柴胡透解邪毒,疏达经气,黄芩清泄郁热,甘草调和诸药;结合儿童多肺脾气虚,加入藿香辟秽化湿、苍术健脾燥湿,太子参益气健脾,从而达到扶正达邪的功效。
16.本发明优点在于:
17.1、本发明的药物由纯中药制成,无毒副作用,且易于被患者接受。
18.2、本发明的药物原料组分少,原材料丰富易得,价格便宜,制备工艺简单,适合推广使用。
【具体实施方式】
19.下面对本发明提供的具体实施方式作详细说明。
20.实施例1治疗儿童时疫的药物组合物(一)
21.柴胡6份、黄芩9份、紫苏叶6份、金银花9份、太子参9份、藿香9份、苍术6份、芦根9份、甘草6份。
22.实施例2治疗儿童时疫的物组合物(二)
23.柴胡6份、黄芩8份、紫苏叶7份、金银花7份、太子参11份、藿香9份、苍术5份、芦根10份、甘草4份得。
24.实施例3治疗儿童时疫的药物组合物(三)
25.柴胡5份、黄芩10份、紫苏叶4份、金银花11份、太子参9份、藿香8份、苍术7份、芦根7份、甘草8份。
26.实施例4治疗儿童时疫的药物组合物(四)
27.柴胡7份、黄芩7份、紫苏叶8份、金银花9份、太子参8份、藿香10份、苍术4份、芦根11
份、甘草6份。
28.实施例5治疗儿童时疫的药物组合物(五)
29.柴胡4份、黄芩11份、紫苏叶6份、金银花8份、太子参10份、藿香7份、苍术8份、芦根9份、甘草5份。
30.实施例6治疗儿童呼时疫的药物组合物(六)
31.柴胡8份、黄芩9份、紫苏叶5份、金银花10份、太子参7份、藿香11份、苍术6份、芦根8份、甘草7份。
32.实施例7治疗儿童时疫的药物组合物(七)
33.柴胡6份、黄芩10份、紫苏叶4份、金银花11份、太子参9份、藿香8份、苍术7份、芦根7份、甘草8份,按上述中药原料开水冲泡即得。
34.实施例8治疗儿童时疫的药物组合物(八)
35.柴胡5份、黄芩7份、紫苏叶8份、金银花9份、太子参8份、藿香10份、苍术4份、芦根11份、甘草6份。
36.实施例9治疗儿童时疫的药物组合物(九)
37.柴胡7份、黄芩11份、紫苏叶6份、金银花8份、太子参10份、藿香7份、苍术8份、芦根9份、甘草5份。
38.实施例10治疗儿童时疫的药物组合物(十)
39.柴胡4份、黄芩9份、紫苏叶5份、金银花10份、太子参7份、藿香11份、苍术6份、芦根8份、甘草7份。
40.实施例11治疗儿童时疫的药物组合物(十一)
41.柴胡8份、黄芩8份、紫苏叶7份、金银花7份、太子参11份、藿香9份、苍术5份、芦根10份、甘草4份。
42.需要说明的是,实施例1-11所述的常规方法煎煮是中药汤剂常规的制作方法,即将所述的原料药加水煎煮成汤剂。
43.实施例12治疗儿童时疫药物片剂/胶囊的制备
44.取实施例1-11任一所述的药物,加9-11倍量水,煎煮2-3.5小时,滤出药汁。再加9倍量水,煎煮2.5小时,滤出药汁,合并二次煎液,静置,滤取上清液,浓缩,放冷,加浓缩液3倍量酒精,搅拌沉淀过夜。取上清液,浓缩至稠浸膏;加入制药辅料,真空干燥,粉碎制粒,压制成片剂或填充装胶囊。
45.实施例13治疗儿童时疫药物颗粒的制备
46.取实施例1-11任一所述的药物,加8-10倍量水,煎煮3小时,滤出药汁。再加10倍量水,煎煮2.5小时,滤出药汁,合并二次煎液,静置,滤取上清液,浓缩,放冷,加浓缩液2倍量酒精,搅拌沉淀过夜。取上清液,浓缩至稠浸膏;加适当制药辅料,制粒,干燥,整粒,得20g颗粒,分装10g/袋。
47.实施例14治疗儿童时疫合剂/口服液/糖浆剂的制备
48.取实施例1-11任一所述的药物,加8-11倍量水,煎煮3小时,滤出药汁。再加8倍量水,煎煮3小时,滤出药汁,合并二次煎液,静置,滤取上清液,浓缩,放冷,加浓缩液3.5倍量酒精,搅拌沉淀过夜。取上清液,浓缩至稠浸膏;加适当制药辅料,制成合剂、口服液或糖浆剂。
49.实施例15本发明的药物在儿童儿童时疫疾病中的临床试验
50.1研究资料和方法
51.1.1一般资料
52.2022年3月30日至2022年5月18日期间确诊并分别收治于仁济医院南院、上海新国际博览中心方舱医院、长兴岛方舱医院无症状新冠肺炎患儿临床资料。
53.1.2用药方案
54.无症状感染患儿共66例,治疗组33例、对照组33例,按以下方式用药:
55.治疗组:以中药颗粒:柴胡6份、黄芩9份、紫苏叶6份、金银花9份、太子参9份、藿香9份、苍术6份、芦根9份、甘草6份,开水冲开服用,共200ml,分早晚两次服用。
56.对照组:重组人干扰素α2b喷雾剂(捷抚,天津未名生物医药有限公司,国药准字s20030028)。雾化吸入治疗,1~6岁,一日2次,每次1喷;1-2岁,一日3次,每次1喷。
57.两组均连续治疗7天为1个疗程,治疗周期为1周。
58.1.3诊断标准
59.西医诊断符合《新型冠状病毒肺炎诊疗方案(试行第九版)》,和儿童新型冠状病毒感染诊断、治疗和预防专家共识(第三版)。
60.无症状感染者:呼吸道等标本病原学检测呈阳性,整个病程中无相关临床表现,如发热、干咳、咽痛等可自我感知或可临床识别的症状与体征,且ct影像学无阳性特征者。
61.1.4纳入标准:
62.(1)符合上述诊断标准;
63.(2)符合无症状感染临床分型标准;
64.(3)年龄1~6岁,男女不限;
65.(4)研究开始前其法定监护人自愿签署书面的知情同意书。
66.1.5排除标准:
67.(1)经过病原学检测和临床表现或体征确诊的新型冠状病毒肺炎轻型、重型及危重型患者;
68.(2)过敏体质,如对两种或以上药物或食物过敏史者,或已知对本药成分过敏者;
69.(3)正在进行本研究之外的其他治疗方案者。
70.1.6脱落或剔除标准
71.(1)依从性差,或主动退出本研究者,视为脱落病例;
72.(2)发生严重的不良事件,计入不良反应的统计;
73.(3)因无效而自行脱落者,记入疗效分析;
74.(4)纳入病例未按规定用药,疗程不足或病例报告填写不全者
75.1.7试验中止条件
76.(1)试验中发生严重安全性事件,及时中止试验;
77.(2)试验中发现临床试验方案有重大失误,或者方案虽好但在实施中发生严重偏差,难以评价药物疗效,应中止试验;
78.(3)试验中发现药物治疗效果较差,不具备临床价值,应中止试验。
79.2观察指标及方法
80.2.1疗效指标
81.(1)一般资料包括患儿年龄、性别、身高、体重、疫苗接种情况、过敏史、基础疾病史等基线指标。
82.(2)核酸转阴时间连续两次新型冠状病毒核酸检测(荧光定量pcr方法,界限值低于35,采样时间至少间隔24小时)转阴时间;转阴时间是指首次核酸阳性结果的采样日期和两次连续阴性核酸检测结果(第二次核酸阴性结果的采样日期)之间的间隔时间。
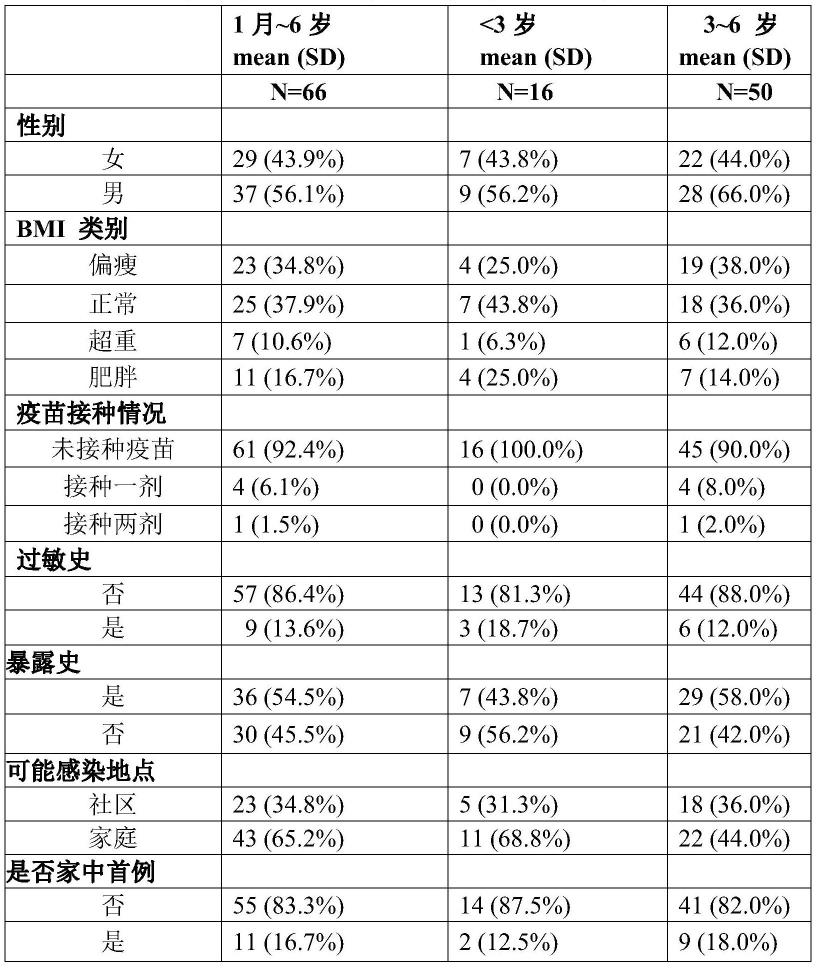
83.(3)核酸转阴率服用药物第1-7天新型冠状病毒核酸检测(荧光定量pcr方法,界限值低于35,采样时间至少间隔24小时)转阴率。
84.2.2安全性指标
85.安全性指标包括过敏反应、恶心呕吐等不良反应。不良反应发生率=服用该中药组方后发生不良反应的患者例数/观察总例数
×
100%。
86.3统计学方法:
87.本研究中资料采用统计软件spss 25.0进行分析。计量资料的统计描述采用或中位数和四分位数间距表示,组间比较采用t检验或mann-whitney u检验,组内比较采用配对t检验或wilcoxon符号秩检验;计数资料用率、构成比进行统计描述,组间比较采用χ2检验或fisher确切概率法。p<0.05为差异有统计学意义。
88.4结果
89.纳入的1~6岁无症状患儿流行病学特征
90.本试验收集1~6岁确诊covid-19无症状感染患儿共66例,其中治疗组33例、对照组33例。具体情况见表1。
91.表1纳入的1~6岁无症状患儿流行病学特征
[0092][0093]
3.2两组患儿一般资料比较
[0094]
本试验收集1~6岁确证covid-19无症状感染患儿共66例,治疗组33例和对照组33例,两组患儿在性别、年龄、身高、体重、既往史、接种疫苗情况等一般资料比较差异均无统计学意义,具有可比性,见表2-3。
[0095]
表2无症状感染治疗组与对照组组患儿一般资料比较
[0096][0097]
表3无症状感染治疗组与对照组患儿既往史
[0098][0099]
3.3核酸转阴时间结果分析
[0100]
治疗组转阴时间为(9.33
±
3.07)天,对照组核酸转阴时间为(11.85
±
2.39)天;与对照组相比,治疗组核酸转阴时间显著缩短(p《0.01),具体见表4。
[0101]
表4无症状感染治疗组、对照组患儿核酸转阴时间比较
[0102][0103]
注:与对照组比较,
*
p《0.05.
[0104]
3.4核酸转阴率比较
[0105]
比较无症状感染治疗组、对照组1~6岁患儿核酸转阴率,结果表明,患者进入方舱或定点医院后开始服用该中药组方一个疗程(7天),在用药后第1、2、3、4、5、6、7天,总体转阴率分别为3%、12%、15%、18%、24%、33%、45%。同期无症状感染对照组总体阴转率分别为0%、0%、0%、0%、3%、6%、18%。与对照组比较,治疗组用药后第2、3、4、5、6、7天核酸转阴率明显升高,均具有统计学意义,见表5。
[0106]
表5无症状感染治疗组、对照组患儿核酸转阴率比较
[0107][0108]
注:与对照组比较,
*
p《0.05,
**
p《0.01。
[0109]
3.5安全性分析
[0110]
在此次临床研究过程中,治疗组、对照组患儿均未出现过敏反应、恶心呕吐、肝肾功能损害等不良反应。
[0111]
4结论
[0112]
本发明研究结果显示,该中药组方治疗儿童新型冠状病毒奥密克戎变异株无症状感染者具有较好的临床疗效,可显著缩短核酸转阴时间,提高核酸转阴率,且未见不良反应。
[0113]
实施例15本发明中药组合物的动物实验
[0114]
1材料
[0115]
1.1药物与试剂
[0116]
本发明中药组合物一制备:按照实施例1所述的重量份秤取各原料药,煎煮浓缩至含生药1.17g/ml。
[0117]
本发明中药组合物二制备:按照实施例2所述的重量份秤取各原料药,煎煮浓缩至含生药1.17g/ml。
[0118]
对照组中药组合物一制备:按重量份配比称取柴胡6份、黄芩9份、紫苏叶6份、金银
花9份、太子参9份、藿香9份、苍术6份、芦茎9份、人参6份,煎煮浓缩至含生药1.17g/ml。
[0119]
对照组中药组合物二制备:按重量份配比称取柴胡6份、黄芩9份、紫苏叶6份、金银花9份、太子参9份、藿香9份、苍术6份、茅根9份、西洋参6份,煎煮浓缩至含生药1.17g/ml。
[0120]
空白组:生理盐水
[0121]
1.2主要试剂:
[0122]
sars-cov-2蛋白(2019新型冠状病毒)(广州派真生物技术有限公司);小鼠白介素-6(1il-2)elisa试剂盒;小鼠肿瘤坏死因子-α(tnf-elisa)试剂盒;小鼠γ干扰素(ifn-γ)elisa试剂盒均购自上海酶联生物科技有限公司。
[0123]
1.3动物
[0124]
hace2转基因小鼠120只,雄性,体质量(25
±
2)g,由上海南方模式生物科技股份有限公司提供。
[0125]
1.4主要仪器
[0126]
pb1501-e型电子分析天平(mettler公司);heraleus-fresco21微量冷冻离心机(德国thermo fisher科技公司);dk-s24电热恒温水浴锅(上海精宏实验设备公司);elx800酶标仪(美国biotek公司);motic-ba400显微镜(日本olympus公司)。
[0127]
2方法与结果
[0128]
2.1动物造模
[0129]
hace2转基因小鼠,选正常小鼠中的100只随机分五组,每20只一组,进行鼻内接种sars-cov-2病毒,剂量为50μl(105tcid
50
)/只,25℃下,8:00-20:00光照条件下维持一个明暗循环,以实验室标准饲料喂养,正常饮水,24h后观察小鼠症状,若有咳嗽、气促、呼吸困难烦躁和耸毛等症状说明造模成功。
[0130]
2.2试验方案
[0131]
最后造模成功小鼠为91只,分组情况如下:本发明组一17只,本发明组二18只,对照组一17只,对照组二19只,模型组17只;再挑选正常的20只小鼠作为空白组,按以下方式连续给药5天:
[0132]
本发明组一:每天用本发明中药组合物一制备的汤剂20mg/kg灌胃。
[0133]
本发明组二:每天用本发明中药组合物二制备的汤剂20mg/kg灌胃。
[0134]
对照组一:每天用对照组中药组合物一制备的汤剂20mg/kg灌胃。
[0135]
对照组二:每天用对照组中药组合物二制备的汤剂20mg/kg灌胃。
[0136]
模型组:每天按20ml/kg去离子水灌胃。
[0137]
空白组:每天按20ml/kg去离子水灌胃。
[0138]
给药结束记录小鼠体重,颈椎脱臼处死小鼠,解剖取出胸腺、脾脏、肺脏于电子分析天平上称重,器官指数=器官重量(mg)/体质量(g);眼球取血,4℃下静置过夜,3000r/min离心10min收集血清,elisa试剂盒检测血清中il-6、ifn-γ、tnf-α水平。
[0139]
2.3统计学方法
[0140]
实验结果以平均数
±
标准误(x
±
sem)表示,通过spss23.0进行t检验,p<0.05可认为数据具有统计学差异。组间两两比较采用lsd检验;方差不齐时,采用dunnett'st3检验。不满足正态分布者,采用非参数kruskul-wullas检验。p《0.05表示差异有统计学意义。
[0141]
2.4结果
[0142]
2.4.1中药组合物对小鼠体质量的影响
[0143]
给药后,模型组小鼠的体重显著低于正常小鼠(p《0.01);本发明组和对照组的小鼠体重都显著高于模型组(p《0.05)。见表6。
[0144]
表6中药组合物对小鼠体质量的影响
[0145]
组别n(例)体质量/g本发明组一1724.37
±
1.66
2)
本发明组二1823.15
±
2.34
2)
对照组一1722.46
±
1.78
2)
对照组二1822.85
±
1.62
2)
模型组1721.03
±
1.98
1)
空白组2025.56
±
2.39
[0146]
注:与空白组比较
1)
(p《0.01);与模型组比较
2)
(p《0.05);与对照组一、二比较
3)
(p《0.05)
[0147]
2.4.2小鼠胸腺、脾脏、肺脏指数检测结果
[0148]
与正常小鼠比较,模型组小组的胸腺指数和脾脏指数都显著降低(p《0.001),肺脏指数显著升高(p<0.05);与模型组比较,本发明组和对照组的胸腺指数和脾脏指数都显著升高(p《0.001)、(p<0.05);其中本发明组一的胸腺指数和脾脏指数显著高于对照组一、二(p<0.05);本发明组一的肺脏指数相较于模型组显著降低(p<0.05)。见表7。
[0149]
表7各组小鼠胸腺指数、脾脏指数、肺脏指数检测结果(n=107,mg.g-1
)
[0150]
组别n(例)胸腺指数脾脏指数肺脏指数本发明组一171.84
±
0.20
3,5)
3.79
±
0.34
3,5)
5.07
±
0.47
5)
本发明组二181.71
±
0.77
3,5)
3.64
±
0.30
4)
5.26
±
0.37对照组一171.60
±
0.08
3)
3.54
±
0.31
4)
5.28
±
0.42对照组二181.62
±
0.14
3)
3.57
±
0.35
4)
5.22
±
0.31模型组171.33
±
0.33
1)
3.44
±
0.25
2)
5.32
±
0.56
2)
空白组202.05
±
0.193.94
±
0.264.99
±
0.51
[0151]
注:与空白组比较,
1)
p《0.001;
2)
p《0.05与模型组比较
3)
p《0.001;
4)
p《0.05;与对照组一、二比较
5)
p《0.05。
[0152]
2.4.31l-6、ifn-γ、tnf-α表达水平检测结果
[0153]
与正常小鼠相比,模型组小鼠的1l-6、ifn-γ和tnf-α水平都显著升高,(p<0.001);与模型组相比,本发明组一、二与对照组一,二的1l-6、ifn-γ和tnf-α的水平显著降低(p<0.01)、(p<0.05);其中本发明组一、二的1l-6的水平都显著低于对照组一、二(p<0.05);其中本发明组一的tnf-γ水平显著高于对照组一、二(p<0.05);本发明组一的tnf-α水平显著高于对照组一二以及本发明组二(p<0.05)。见表8。
[0154]
表8血清细胞因子1l-6、ifn-γ、tnf-α表达水平检测结果(n=107,pg.ml-1
)
[0155]
组别n(例)il-6ifn-γtnf-α本发明组一17155.64
±
18.59
3,4)
364.54
±
46.10
3,4)
364.06
±
77.78
3,4,5)
本发明组二18159.58
±
34.23
3,4)
372.54
±
39.65
3)
380.88
±
38.94
3)
对照组一17158.44
±
14.49
2)
422.192
±
85.90
3)
391.88
±
36.31
2)
对照组二18172.0.
±
17.88
2)
428.89
±
53.31
3)
388.18
±
32.67
2)
模型组17190.48
±
12.84
1)
484.32
±
32.32
1)
432.42
±
46.95
1)
空白组20134.10
±
27.67310.30
±
46.45306.55
±
30.50
[0156]
注:与空白组比较,
1)
p《0.001;与模型组比较
2)
p《0.05;
3)
p《0.01;与对照组一、二比较
4)
p《0.05。与本发明组二比较
5)
p《0.05;
[0157]
综上,本发明组和对照组都在不同程度上能改善小鼠的胸腺、脾脏和肺脏组织,并能调节其血清细胞因子1l-6、ifn-γ、tnf-α表达水平,本发明组优于对照组,其中本发明组一的改善效果最突出。
[0158]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1