CTRP6基因在制备预防、治疗或缓解非酒精性脂肪肝病的药物中的应用
ctrp6基因在制备预防、治疗或缓解非酒精性脂肪肝病的药物中的应用
技术领域
1.本发明属于生物技术领域,具体涉及ctrp6基因在制备预防、治疗或缓解非酒精性脂肪肝病的药物中的应用。
背景技术:
2.在过去的二十年,我国人民生活水平迅速提升,饮食结构和生活习惯也发生改变,非酒精性脂肪肝病(nonalcoholic fatty liver disease,nafld)患者数量不断增加。nafld是指除酒精和其他明确因素如病毒性肝炎等所致的、以肝细胞内脂肪过度沉积为主要特征的临床病理综合征,包括单纯性非酒精性脂肪肝(non-alcoholic fatty liver,nafl)和由其演变的非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,nash)。nafld不仅会损害肝功能,长期发展还将增加肝硬化、肝癌等严重肝病及肝外疾病的风险,但临床上尚无针对性药物,发掘药物靶点将为治疗nafld的药物开发奠定基础。
3.补体c1q/肿瘤坏死因子相关蛋白6(complement-c1q/tumor necrosis factor-related protein 6,ctrp6),是由wong等人发现的一种新的脂肪因子分泌蛋白,结构上与脂联素高度相似,具有一个氨基末端的信号肽,一个短的可变结构域,一个胶原样结构域和一个与补体蛋白c1q同源的羧基末端球形结构域。ctrp6具有多种生物学功能,主要包括调控脂肪细胞代谢、影响巨噬细胞炎症状态等,有文献报道了血液中ctrp6蛋白水平在胰岛素抵抗人群中升高;也有部分报道了ctrp6与癌症相关的研究,涉及到的癌症类型包括口腔鳞状癌、肝癌、胃癌、卵巢癌、肺腺癌以及结肠癌等,但其对非酒精性脂肪肝的影响尚无报道。
技术实现要素:
4.本发明所要解决的技术问题是如何利用ctrp6基因预防、治疗或缓解非酒精性脂肪肝病。所要解决的技术问题不限于所描述的技术主题,本领域技术人员通过以下描述可以清楚地理解本文未提及的其它技术主题。
5.为解决上述技术问题,本发明首先提供了ctrp6基因的下述任一种应用:
6.a1)在制备预防、治疗或缓解非酒精性脂肪肝病的药物中的应用;
7.a2)在制备干预或缓解饮食诱导的非酒精性脂肪肝的药物中的应用;
8.a3)在制备干预或缓解由禁食诱发的非酒精性脂肪肝的药物中的应用;
9.a4)在抑制、降低或减少脂肪积累或制备用于抑制、降低或减少脂肪积累的试剂中的应用;
10.a5)在调控肝脏脂肪积累或制备调控肝脏脂肪积累的试剂中的应用。
11.所述ctrp6基因的核苷酸序列可为seq id no.2,其编码的蛋白质(ctrp6蛋白)的氨基酸序列可为seq id no.1。
12.所述ctrp6基因及其编码蛋白质可为人源的。
13.本发明还提供了ctrp6抑制剂的下述任一种应用:
14.b1)在制备预防、治疗或缓解非酒精性脂肪肝病的药物中的应用;
15.b2)在制备干预或缓解饮食诱导的非酒精性脂肪肝的药物中的应用;
16.b3)在制备干预或缓解由禁食诱发的非酒精性脂肪肝的药物中的应用;
17.b4)在抑制、降低或减少脂肪积累或制备用于抑制、降低或减少脂肪积累的试剂中的应用。
18.上述应用中,所述ctrp6抑制剂可为抑制ctrp6基因表达、沉默或敲除ctrp6基因的物质,和/或,降低ctrp6蛋白含量和/或活性的物质。
19.进一步地,所述抑制ctrp6基因表达、沉默或敲除ctrp6基因可通过本领域技术人员所熟知的基因突变、基因沉默、基因敲除、基因编辑或基因敲减技术实现。如利用rna干扰(rnai)技术可以特异性剔除或关闭特定基因的表达;利用基因编辑技术的工具可以是crispr/cas9技术、锌指核酸酶(zfns)或转录激活因子样效应物核酸酶(talens)技术等,但不限于此。
20.利用基因敲减(基因敲低,gene knock-down)技术从转录后水平或翻译水平使ctrp6基因表达失活或基因沉默的技术为本领域技术人员所熟知。所述基因敲减技术包括rna干扰、morpholino干扰、反义核酸、核酶或显性负抑制突变但不限于此。
21.利用病毒(如慢病毒、腺相关病毒)表达的shrna或sirna抑制ctrp6基因的表达,进行ctrp6基因的沉默是本领域技术人员所熟知的。
22.上述应用中,所述ctrp6抑制剂可为核酸分子、碳水化合物、脂、小分子化合物、抗体、多肽、蛋白、基因编辑载体、慢病毒或腺相关病毒中的一种或多种。
23.上述应用中,所述核酸分子可为microrna、sirna、shrna和/或反义寡核苷酸。
24.进一步地,所述microrna、sirna、shrna和/或反义寡核苷酸(如反义rna)用于抑制ctrp6基因的表达。
25.上述应用中,所述抗体可为抗ctrp6蛋白的抗体或其功能性片段。
26.上述应用中,所述shrna靶向干扰ctrp6基因的表达。
27.上述应用中,所述sirna靶向干扰ctrp6基因的表达。
28.上述应用中,所述sirna可为下述任一种:
29.c1)所述sirna的正义链的核苷酸序列为seq id no.3,反义链的核苷酸序列为seq id no.4;
30.c2)所述sirna的正义链的核苷酸序列为seq id no.5,反义链的核苷酸序列为seq id no.6;
31.c3)所述sirna的正义链的核苷酸序列为seq id no.7,反义链的核苷酸序列为seq id no.8;
32.c4)所述sirna的正义链的核苷酸序列为seq id no.3的第1-19位,反义链的核苷酸序列为seq id no.4的第1-19位;
33.c5)所述sirna的正义链的核苷酸序列为seq id no.5的第1-19位,反义链的核苷酸序列为seq id no.6的第1-19位;
34.c6)所述sirna的正义链的核苷酸序列为seq id no.7的第1-19位,反义链的核苷酸序列为seq id no.8的第1-19位。
35.本文所述sirna,编码所述sirna的dna分子,或含有所述dna分子的重组载体、慢病
毒或腺相关病毒均在本发明的保护范围内。
36.所述慢病毒可为表达用于敲低ctrp6基因的sirna的重组慢病毒。
37.本发明还提供了用于预防、治疗或缓解非酒精性脂肪肝病的药物组合物,所述药物组合物可包括本文中任一所述的ctrp6抑制剂。
38.进一步地,所述药物组合物还可包括一种或者是多种药学上可接受的载体。
39.所述药学上可接受的载体可为稀释剂、赋形剂、填充剂、粘合剂、湿润剂、崩解剂、吸收促进剂、吸附载体、表面活性剂或润滑剂。
40.本发明所述ctrp6抑制剂或所述药物组合物可具有下述至少一种功能:
41.c1)预防、治疗或缓解非酒精性脂肪肝病;
42.c2)干预或缓解饮食诱导的非酒精性脂肪肝;
43.c3)干预或缓解由禁食诱发的非酒精性脂肪肝;
44.c4)抑制、降低或减少脂肪积累;
45.c5)提高胰岛素敏感性;
46.c6)增强葡萄糖耐受性;
47.c7)减少肝脏脂质积累;
48.c8)降低肝脏脂质含量;
49.c9)抑制肝脏脂肪合成;
50.c10)促进肝脏脂肪分解;
51.c11)调控(增加或减少)肝细胞脂质积累。
52.本文所述脂肪积累可为肝脏或肝细胞脂肪积累。
53.本文所述禁食可为隔日禁食。
54.本文所述隔日禁食可为间断性禁食,是一种能促进减肥并改善代谢的饮食模式。通过一段时间不进食或很少进食,引起机体肝糖原储备耗尽,激发脂肪酸动员,被认为是一种干预肥胖代谢疾病的潜在有效新手段。但是申请人发现:隔日禁食能诱发肝脏脂质异常积累,存在健康隐患。
55.本发明还提供了ctrp6基因在筛选预防、治疗或缓解非酒精性脂肪肝病的药物中的应用,所述筛选预防、治疗或缓解非酒精性脂肪肝病的药物可为以ctrp6基因为靶标对药物或制剂进行筛选,以能降低ctrp6基因的表达水平的药物或制剂作为候选药物。
56.本文所述非酒精性脂肪肝病(nonalcoholic fatty liver disease,nafld)包括非酒精性脂肪肝(non-alcoholic fatty liver,nafl)和非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,nash)。
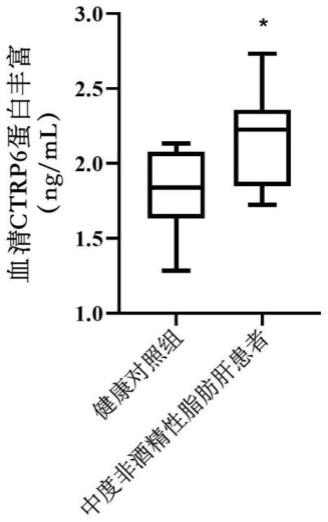
57.本文所述非酒精性脂肪肝病可为饮食诱导的非酒精性脂肪肝或由禁食诱发的非酒精性脂肪肝。
58.进一步地,所述由禁食诱发的非酒精性脂肪肝可为由禁食诱发的肝脏脂质异常积累。
59.上述应用的目的可以是疾病诊断目的、疾病预后目的和/或疾病治疗目的,它们的目的也可以是非疾病诊断目的、非疾病预后目的和非疾病治疗目的;它们的直接目的可以是获取疾病诊断结果、疾病预后结果和/或疾病治疗结果的中间结果的信息,它们的直接目的可以是非疾病诊断目的、非疾病预后目的和/或非疾病治疗目的。
60.本发明经过广泛而深入的研究,首次发现了ctrp6基因表达水平与非酒精性脂肪肝密切相关,可作为潜在的靶点进一步研究ctrp6基因及其编码蛋白在预防、治疗或缓解非酒精性脂肪肝病中的应用。为了进一步研究ctrp6基因与非酒精性脂肪肝的关系,本发明通过构建ctrp6基因敲除小鼠验证了ctrp6基因缺失在缓解饮食诱导的非酒精性脂肪肝、缓解由隔日禁食诱发的非酒精性脂肪肝中的应用。本发明还利用sirna技术,设计了靶向ctrp6基因的sirna作为ctrp6抑制剂,验证了敲减ctrp6基因表达,可通过激活自噬减少肝细胞脂质积累,进而缓解非酒精性脂肪肝。因此,本发明的ctrp6基因具有调控肝细胞脂质积累的功能。下调(抑制)ctrp6基因的表达可以减少肝细胞脂质积累,而上调ctrp6基因的表达(过表达)可以增加肝细胞脂质积累。
61.综上,本发明实验结果表明,通过降低ctrp6基因的表达或活性可以显著地减少肝脏脂质积累,缓解非酒精性脂肪肝病,对非酒精性脂肪肝的治疗具有潜在的价值。
附图说明
62.图1为中度非酒精性脂肪肝患者血清中ctrp6蛋白丰度分析。
63.图2为ctrp6基因缺失对小鼠体重与摄食量的影响。其中,图2中a为ctrp6基因缺失对小鼠形态的影响;图2中b为ctrp6基因缺失对小鼠体重的影响;图2中c为ctrp6基因缺失对小鼠摄食量的影响。与普通野生型组相比,*表示p《0.05,差异显著,**表示p《0.01,差异极显著;与高脂野生型组相比,#表示p《0.05,差异显著,##表示p《0.01,差异极显著。
64.图3为ctrp6基因缺失对胰岛素敏感性和葡萄糖耐受性的影响。其中,图3中a和b为ctrp6基因缺失对小鼠胰岛素敏感性的影响,横坐标为血糖值测定时间;图3中c和d为ctrp6基因缺失对小鼠葡萄糖耐受性的影响,横坐标为血糖值测定时间。与wt小鼠相比,*表示p《0.05,差异显著;**表示p《0.01,差异极显著。
65.图4为小动物ct分析显示ctrp6基因缺失缓解饮食诱导的脂肪肝。
66.图5为ctrp6基因缺失缓解小鼠肝脏脂质异常积累。
67.图6为隔日禁食处理对小鼠累积进食量(图6中a)和累积体重增量(图6中b)的影响。
68.图7为隔日禁食处理后小鼠的葡萄糖耐受试验结果。图7中a为注射葡萄糖溶液后小鼠血糖水平变化曲线;图7中b为a图中血糖曲线对应曲线下面积(该面积与小鼠的葡萄糖耐能力呈负相关)。
69.图8为ctrp6基因缺失缓解隔日禁食引起的肝脏脂质异常积累的小鼠肝脏组织形态学观察结果。
70.图9为ctrp6基因缺失抑制肝脏成脂基因表达。图9中a为fas基因表达水平分析;图9中b为pparγ基因表达水平分析。
71.图10为敲减ctrp6基因降低肝细胞内脂质沉积。其中图10中a为对照组肝细胞诱导成脂24小时后的油红o染色图片;图10中b和图10中c为ctrp6敲减组肝细胞诱导成脂24小时后的油红o染色图片;图10中d为对照和ctrp6敲减组肝细胞诱导成脂24小时后ctrp6的基因表达水平图;图10中e为对照组和ctrp6敲减组肝细胞诱导成脂24小时后的油红o定量分析。
72.图11为敲减ctrp6基因对肝细胞相关蛋白表达的影响。其中图11中a为成脂标志蛋白fas和自噬相关蛋白p62的western blot分析(其与脂积累正相关);图11中b为fas蛋白表
达水平定量分析;图11中c为p62蛋白表达水平定量分析(其与自噬水平成负相关)。
73.图12为超表达ctrp6基因增加肝细胞内脂质沉积。其中图12中a为对照组肝细胞诱导成脂24小时后的油红o染色图片;图12中b为超表达ctrp6组肝细胞诱导成脂24小时后的油红o染色图片;图12中c为对照组和ctrp6超表达组肝细胞诱导成脂24小时后的油红o定量分析;图12中d为对照组和超表达ctrp6组肝细胞诱导成脂24小时后成脂标志基因fas和pparγ的mrna水平;图12中e为对照组和超表达ctrp6组肝细胞诱导成脂24小时后成脂标志基因fas和pparγ的蛋白表达水平;图12中f和g是对图e的定量分析。
74.图13为超表达ctrp6基因抑制肝细胞自噬的实验结果。其中图13中a为对照组和超表达ctrp6组肝细胞诱导成脂24小时后自噬相关蛋白p62和lc3bⅱ/ⅰ以及信号通路蛋白mtor的western blot分析;图13中b为mtor磷酸化定量分析(磷酸化水平与mtor信号通路活性成正比,但该通路负调控细胞自噬活性,既:mtor磷酸化越高,提示细胞自噬活性可能越低);图13中c为p62蛋白表达水平的定量分析(其与自噬活性成负相关);图13中d为lc3bⅱ/ⅰ蛋白表达水平的定量分析(其与自噬活性成正相关)。
具体实施方式
75.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
76.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
77.下述实施例中的中度非酒精性脂肪肝患者血清样本15例来源于嘉兴市第一医院。
78.实施例1、ctrp6基因在预防、治疗或缓解非酒精性脂肪肝病中的应用
79.1、ctrp6基因表达水平与非酒精性脂肪肝的相关性
80.选择临床诊断为中度非酒精性脂肪肝患者,采用elisa试剂盒(华美生物(cusabio)公司产品,货号csb-el003651hu)检测血清样本中ctrp6蛋白浓度,与健康人群相比,发现中度非酒精性脂肪肝患者血清中ctrp6蛋白的浓度显著升高(图1),表明ctrp6基因表达水平与非酒精性脂肪肝密切相关,可作为潜在的标识分子用于非酒精性脂肪肝病的早期诊断,或治疗靶点用于进一步研究ctrp6基因及其编码蛋白在预防、治疗或缓解非酒精性脂肪肝病中的应用。
81.ctrp6基因的核苷酸序列为seq id no.2。
82.ctrp6蛋白的氨基酸序列为seq id no.1。
83.2、ctrp6基因缺失缓解饮食诱导的非酒精性脂肪肝
84.为了进一步研究ctrp6基因与非酒精性脂肪肝的关系,我们构建了ctrp6基因基因敲除小鼠(ko小鼠),断奶后采用普通饲料(脂肪含量10%)以及高脂饲料(脂肪含量60%)饲喂13周,分别以野生型小鼠(wt小鼠)作对照,具体步骤如下:
85.委托苏州大学-剑桥基因组中心构建ctrp6基因缺失的小鼠模型(ctrp6的genbank登录号为xm_006521455.4),主要流程为:以c57bl/6n小鼠为材料,在胚胎干细胞突变体库中筛选出ctrp6-/-胚胎干细胞,显微注射胚胎后移植到孕母鼠体内,得到3只雌性嵌合体,进
而与野生型小鼠杂交筛选得到杂合子ctrp6
+/-小鼠。
86.小鼠的繁殖:按照spf级标准饲养,饲喂正常日粮。将获得的ctrp6
+/-小鼠按性别单笼饲养,根据保存种源繁殖策略,f1代采用杂合子(ctrp6
+/-)与杂合子(ctrp6
+/-)杂交,雄鼠与雌鼠交配后,将雄鼠移出,密切观察雌鼠是否有产崽。孕鼠产幼崽3周后,断奶,根据幼鼠性别分笼,并进行基因型鉴定获得纯合子(ctrp6-/-)小鼠。
87.本批实验鼠为了获得全同胞对照,采用杂合子(ctrp6
+/-)与杂合子(ctrp6
+/-)杂交扩繁。选择其后代中ctrp6
+/+
和ctrp6-/-两种基因型小鼠用于饮食饲喂试验。
88.实验分组信息:实验小鼠有四种类型,分别为:饲喂普通饲料的野生型小鼠(chow diet-wt,lw),饲喂普通饲料的敲除型小鼠(chow diet-ko,lk),饲喂高脂饲料的野生型小鼠(high fat diet-wt,hw),饲喂高脂饲料的敲除型小鼠(high fat diet-ko,hk)。每种类型的小鼠各9只,每三只饲养在同一个笼子内。
89.2.1、体重分析
90.体重分析如图2所示,在普通日粮(普通饲料,脂肪含量10%)饲喂下(chow diet),ko小鼠在第12周和第13周时体重显著小于wt小鼠(p《0.05)(图2中a、图2中b);在高脂日粮(高脂饲料,脂肪含量60%)饲喂下(high-fat diet),ko小鼠从第11周开始至实验结束,其体重均显著低于wt小鼠(p《0.05)(图2中a、图2中b)。图2中b的hw表示高脂野生型组、hk表示高脂敲除组、lw表示普通野生型组、lk表示普通敲除组。通过对小鼠的摄食量分析发现,各组小鼠的日摄食量均差异不显著(图2中c)。结果表明,ctrp6基因缺失有利于抑制、降低或减少脂肪积累,缓解饮食诱导的非酒精性脂肪肝。
91.2.2、ctrp6基因缺失对胰岛素敏感性和葡萄糖耐受性的影响
92.受试小鼠为步骤2中制备的ctrp6基因敲除小鼠(ko小鼠)和野生型小鼠(wt小鼠)。实验分组和各组小鼠的处理喂养方式同步骤2。
93.首先将小鼠禁食4h,根据0.05u/ml的剂量注射胰岛素,在注射第0、15、30、60、90、120和150min时,取小鼠尾静脉血液测定小鼠血糖浓度。结果显示,在普通饲喂或高脂饲喂下,与wt组小鼠相比,ko组小鼠在30min时其血糖浓度最低,且差异显著(p《0.05)(图3中a、图3中b)。因此,ctrp6基因缺失能提高小鼠的胰岛素敏感性。
94.进一步检测了小鼠的葡萄糖耐受性。首先将小鼠禁食16h,再注射20mg/ml的葡萄糖溶液,在注射第0、15、30、60、90、120和150min时,取尾静脉血液检测。结果发现,小鼠在15min时血糖浓度达到最高,普通饲喂下,ko组小鼠在30min时血糖浓度与wt组小鼠差异显著(p《0.05)(图3中c);高脂饲喂下,ko组小鼠在第15min时血糖浓度与wt组小鼠差异显著(p《0.05)(图3中d)。因此,ctrp6基因缺失可以促进或增强小鼠的葡萄糖耐受性,对小鼠的葡萄糖耐受性具有显著增强作用。
95.2.3、ctrp6基因缺失对肝脏脂质积累的影响
96.受试小鼠为步骤2中制备的ctrp6基因敲除小鼠(ko小鼠)和野生型小鼠(wt小鼠)。实验分组和各组小鼠的处理喂养方式同步骤2。high fat diet-wt(hf-wt)表示高脂野生型组、high fat diet-ko(hf-ctrp6)表示高脂敲除组、chow diet-wt(chow-wt)表示普通野生型组、chow diet-ko(chow-ctrp6)表示普通敲除组。
97.饲喂13周后,对小鼠肝脏进行ct扫描。首先将小鼠固定在小动物ct仪(平生医疗科技(昆山)有限公司,micro ct nemo ii)上,采用异氟烷麻醉小鼠,在计算机程序上选择小
鼠的肝脏部位进行ct扫描,采集到的图像进行剖图处理。系统根据密度分析可自动识别肝脏的脂肪部分。图4中白色部分即为小鼠肝脏脂肪。
98.通过小动物ct分析发现,与wt组小鼠相比,ko组小鼠在两种饮食下的肝脏脂质积累显著低于wt组(图4)。
99.病理切片h&e染色步骤:
100.饲喂13周后,颈椎脱臼法处死小鼠,解剖后取新鲜肝脏左外叶下三分之一处组织,10%甲醛固定。
101.染色步骤如下:从低浓度到高浓度乙醇脱水、透明、石蜡将组织样包埋、修整蜡块并切片(厚度为5μm)、二甲苯脱蜡、苏木精-伊红染色(he染色)以及树胶封片,然后使用leica显微镜观察并拍照,最后用image j图像软件进行分析。
102.结果如图5所示,病理切片分析肝脏脂质含量,高脂饲喂的wt小鼠肝脏脂质大量积累,已经为重度脂肪肝,而高脂饲喂的ko鼠,肝脏脂质积累并不明显,说明ctrp6基因缺失有助于缓解饮食诱导的非酒精性脂肪肝。
103.3、ctrp6基因缺失缓解由隔日禁食诱发的非酒精性脂肪肝
104.间断性禁食是一种能促进减肥并改善代谢的饮食模式。通过一段时间不进食或很少进食,引起机体肝糖原储备耗尽,激发脂肪酸动员,被认为是一种干预肥胖代谢疾病的潜在有效新手段。但是申请人发现:隔日禁食能诱发肝脏脂质异常积累,存在健康隐患(图8)。
105.在此基础上,申请人利用ctrp6基因敲除(ko)鼠开展为期4个月的隔日禁食研究,发现ctrp6基因缺失可缓解由隔日禁食诱发的非酒精性脂肪肝。相关实验步骤和结果如下:
106.3.1、小鼠采食量和体重
107.选用10周龄雌鼠(c57bl/6n)野生型和ctrp6基因敲除鼠各18只,每种基因型均随机分为两组(共计四组):自由采食组(con)的野生型(wt)、ctrp6敲除型(ko)和隔日禁食组(if)的野生型(wt)、ctrp6敲除型(ko)。预饲期1周后开始禁食试验:禁食组第一天17:00移除饲料,第二天17:00添加过量饲料,第三天17:00移除饲料,第四天17:00添加过量饲料,即一个禁食循环包含24h禁食和24h自由采食,为期4个月(120天)。每天记录采食量(进食量),每6天称量体重,每组小鼠的累积采食量与累积增加体重的比值为饲料转化率。
108.结果如图6所示,与自由采食(con)相比,隔日禁食处理(if)可显著降低野生型小鼠(wt)和敲除型小鼠(ko)的累积采食量(图6中a)和累积体重增加量(图6中b)(p《0.05)。
109.3.2、葡萄糖耐受性实验
110.小鼠禁食6h后,尾部采血,利用血糖仪测定小鼠血糖,记为0min血糖值,适应30min,腹腔注射葡萄糖(2g/kg体重),15、30、60、90和120min测定小鼠血糖值,绘制血糖变化曲线,计算曲线下面积(auc)。
111.结果如图7所示。葡萄糖耐受试验结果表明,ctrp6基因敲除小鼠葡萄糖耐受较野生型小鼠高(p《0.05),与正常采食组相比,隔日禁食对两种基因型小鼠的葡萄糖耐受性均有显著促进作用(p《0.05)。
112.3.3、小鼠肝脏组织形态学观察
113.取新鲜肝脏左外叶下三分之一处组织,10%甲醛固定,委托武汉赛维尔生物科技有限公司制作石蜡切片,he染色,显微镜下观察肝脏形态学变化。
114.结果如图8所示。通过he染色显示,wt组肝脏组织肝小叶结构正常,肝细胞索呈放
射状排列,且肝细胞未见水肿、坏死等;隔日禁食处理后肝细胞索排列紊乱,肝细胞质疏松并伴有明显的脂肪变性,细胞内可见大小不一的脂滴。说明隔日禁食导致小鼠肝脏出现变性现象,能诱发肝脏脂质异常积累,存在健康隐患。
115.在ctrp6基因敲除后,肝脏变性有所改善,表明ctrp6基因缺失可缓解肝脏脂质异常积累。
116.3.4、小鼠肝脏脂代谢关键基因转录表达
117.采用trizol法提取各组实验小鼠肝脏总rna,反转录得cdna作为荧光定量pcr模板。primer premier 5.0设计待检测基因引物,采用thermo fisher qs3实时定量pcr仪完成检测,以gapdh为内参,采用2-δδct
法计算各目标基因相对表达丰度。
118.结果如图9所示。图9中a为fas基因表达水平分析(禁食导致wt组脂合成标志基因fas表达水平上升,但ko组在禁食下fas表达未上升);图9中b为pparγ基因表达水平分析(禁食导致wt组脂合成标志基因pparγ表达水平上升,但ko组在禁食下pparγ表达未上升)。
119.可见,脂肪合成方面,禁食干预引起野生型小鼠肝脏中fas和pparγ表达增加(p《0.05),但对敲除小鼠肝脏中fas和pparγ基因的表达无显著影响(图9),提示ctrp6基因敲除可抑制肝脂肪合成。
120.实施例2、ctrp6抑制剂在预防、治疗或缓解非酒精性脂肪肝病中的应用
121.ctrp6抑制剂可为抑制ctrp6基因表达、沉默或敲除ctrp6基因的物质,也可为抑制或降低ctrp6蛋白含量和/或活性的物质。本实施例利用sirna技术验证敲减ctrp6基因表达,可通过激活自噬减少肝细胞脂质积累,进而缓解非酒精性脂肪肝。具体步骤如下:
122.1、实验细胞
123.人肝癌细胞(hepg2)购于中国科学院干细胞库。
124.诱导细胞成脂步骤:
125.(1)配置诱导母液:称取摩尔比为2:1的油酸钠和棕榈酸钠,加适量无菌去离子水在90℃金属浴溶解2分钟,得到浓度为100mmol的诱导母液;
126.(2)配置诱导工作液:取适量的诱导母液加入到dmem高糖培养基内,得到浓度为1mmol的诱导工作液;
127.(3)细胞接种到细胞培养板后培养至汇合度为90%时,移去原细胞培养基,加入适量的诱导工作液后再放入细胞培养箱培养24h即可诱导细胞成脂。
128.2、实验分组及处理
129.空白对照组:加诱导工作液诱导处理24h。
130.nc对照组:转染sirna-nc后加诱导工作液诱导处理24h。
131.实验组:转染sirna-ctrp6后加诱导工作液处理24h。
132.3、操作步骤
133.(1)sirna的设计和序列
134.nc对照组sirna-nc的序列如下所示:
135.sirna-nc:正义链(sense):5
’‑
uucuccgaacgugucacgutt-3’,
136.反义链(antisense):5
’‑
acgugacacguucggagaatt-3’。
137.实验组sirna-ctrp6为如下三个sirna:
138.ctrp6-sirna1:
139.正义链(sense):5
’‑
cccuacauuaauaucaccatt-3’(seq id no.3),
140.反义链(antisense):5
’‑
uggugauauuaauguagggtt-3’(seq id no.4)。
141.ctrp6-sirna2:
142.正义链(sense):5
’‑
gggucuuugugaaccuugatt-3’(seq id no.5),
143.反义链(antisense):5
’‑
ucaagguucacaaagaccctt-3’(seq id no.6)。
144.ctrp6-sirna3:
145.正义链(sense):5
’‑
cguacgugcacauuaugcatt-3’(seq id no.7),
146.反义链(antisense):5
’‑
ugcauaaugugcacguacgtt-3’(seq id no.8)。
147.(2)利用sirna转染敲减ctrp6基因表达
148.由公司合成sirna,通过lipofectamine 3000(赛默飞世尔科技公司,货号:l3000015)转染诱导成脂后的hepg2细胞。用trizol法提取细胞总rna,反转录得到cdna作为检测模板。primer premier 5.0设计待检测基因引物,采用thermo fisher qs3实时定量pcr仪完成检测,以gapdh为内参,采用2-δδct
法计算各目标基因相对表达丰度。
149.(3)油红o检测胞内成脂情况
150.1g油红o粉末溶解于100ml异丙醇中60℃水浴震荡过夜配置成油红o工作液,工作液和双蒸水以3:2的比例配置成油红o工作液,将细胞固定后用pbs缓冲液冲洗3次,加入油红o工作液置于暗处20分钟,再用pbs缓冲液冲洗3次,置于显微镜下观察细胞内脂滴形成情况。之后每孔加入100ml的异丙醇将油红o脱色至溶剂内,于510nm波长处测定吸光度,分析可得油红o定量结果。
151.(4)成脂标志蛋白fas及p62蛋白分析
152.a)12孔板每孔加入100ul的蛋白裂解液置于冰上10min并收集。离心取上清液转移至新的离心管中,根据bca蛋白质测定试剂盒测定细胞的总蛋白浓度,并将各蛋白浓度调整一致。根据上清液:缓冲液=4:1的比例添加5
×
蛋白上样缓冲液,煮沸10min,分装保存。
153.b)安装电泳槽模具,配制12%分离胶与5%浓缩胶。室温放置30min凝固,将胶板安装至电泳槽中,加入1
×
电泳缓冲液且没过中间室与胶孔。
154.c)点样,浓缩胶用80v电压电泳,待样品进入分离胶时调整电压为120v。电泳结束后,拆胶板,并小心取出凝胶,并做好标记。
155.d)安装转膜装置,转移夹从负极开始组装,顺序为海绵、滤纸、凝胶、pvdf膜、滤纸、海棉。将组装好的转移夹放入转移电泳槽中,加入转膜缓冲液,200ma电流转膜冰浴1.5h。
156.e)拆除转移装置,取出pvdf膜,根据marker指示将目的条带剪切下来,放入tbst溶液中洗涤10min。用5%脱脂奶粉进行封闭膜2h,tbst溶液洗膜3次,每次10min。
157.f)按照一抗说明书对抗体进行稀释,将膜放入自封袋中,4℃摇床过夜孵育。
158.g)tbst溶液洗膜3次,每次10min。根据说明书稀释二抗,摇床孵育2h。tbst溶液洗膜3次,每次10min。避光配制化学发光液,滴加在膜上并充分融合,使用bio-rad凝胶成像系统检测蛋白含量。
159.结果如图10和图11所示。本实施例利用体外培养的肝细胞系hepg2,通过添加油酸钠、棕榈酸钠,诱导细胞成脂。利用sirna技术,敲减ctrp6基因表达,以不相干序列为对照,发现ctrp6-sirna3的敲减效果更好,导致ctrp6基因表达水平仅有对照组的50%。与对照组
相比,ctrp6-sirna(ctrp6-sirna2和ctrp6-sirna3)显著降低了胞内甘油三酯的含量。利用western blot对蛋白丰度分析发现,ctrp6-sirna可显著降低成脂标志基因fas和自噬相关蛋白p62的表达水平,表明敲减ctrp6基因表达,可以显著减少肝细胞脂质积累,激活肝细胞自噬。
160.实施例3、ctrp6基因在调控肝细胞脂质积累中的应用
161.本实施例验证了过表达ctrp6基因导致肝细胞脂质积累增加,抑制自噬,表明ctrp6基因具有调控肝细胞脂质积累的功能。下调(抑制)ctrp6基因的表达可以减少肝细胞脂质积累,而上调ctrp6基因的表达(过表达)可以增加肝细胞脂质积累。
162.(1)构建ctrp6-pcdna3.1超表达载体
163.a)设计引物从hepg2细胞上扩增得到ctrp6的全长cds区(ctrp6基因,seq id no.2),将pcdna3.1空载体和扩增得到的ctrp6基因于37摄氏度水浴中进行双酶切。
164.b)酶切后加入5
×
loading buffer,于琼脂糖凝胶电泳100v电压下电泳30min后将条带切下进行胶回收。
165.c)胶回收后将ctrp6基因和pcdna3.1空载体用dna连接酶进行过夜连接。
166.d)连接后的产物以体积比1:10的比例加入到大肠杆菌感受态细胞内进行转化操作。转化后将大肠杆菌均匀涂布在lb固体培养基内培养12h。
167.e)挑取单克隆加入到lb液体培养基内扩大培养14h。
168.f)提取质粒,送至测序公司进行样品的测序。经比对,构建的质粒为ctrp6-pcdna3.1超表达质粒。
169.(2)转染质粒,实验分组和处理
170.空白对照组:加诱导工作液处理24h;
171.空质粒对照组:转染pcdna3.1空质粒后,加诱导工作液处理24h;
172.ctrp6超表达组:转染ctrp6-pcdna3.1质粒后,加诱导工作液处理24h。
173.(3)检测rna超表达效率
174.用trizol法提取细胞总rna,反转录得到cdna后通过荧光定量pcr仪检测干扰效率。
175.(4)油红o检测胞内成脂情况
176.1g油红o粉末溶解于100ml异丙醇中60℃水浴震荡过夜配置成油红o工作液,工作液和双蒸水以3:2的比例配置成油红o工作液,将细胞固定后用pbs缓冲液冲洗3次,加入油红o工作液置于暗处20分钟,再用pbs缓冲液冲洗3次,置于显微镜下观察细胞内脂滴形成情况。之后每孔加入100ml的异丙醇将油红o脱色至溶剂内,于510nm波长处测定吸光度,分析可得油红o定量结果。
177.(5)成脂标志基因fas和pparg分析
178.用trizol法提取细胞总rna,反转录得到cdna作为检测模板。primer premier5.0设计待检测基因引物,采用thermo fisher qs3实时定量pcr仪完成检测,以gapdh为内参,采用2-δδct
法计算各目标基因相对表达丰度。
179.(6)自噬标志蛋白分析
180.同实施例2的操作步骤(4)中的蛋白分析步骤相同。
181.结果如图12和图13所示。本实施例克隆得到人的ctrp6基因编码区,构建表达载
体,转染hepg2细胞,油红o染色分析发现过表达ctrp6基因可显著增加肝细胞内脂质积累,并且脂生成基因相关基因(fas和pparr)的mrna水平升高。采用western blot检测gapdh、lc3、p62、mtor、p-mtor蛋白丰度。方法简述如下:使用ripa裂解液提取组织蛋白,利用bca蛋白定量试剂盒测定蛋白质浓度,含相同蛋白量的样本经聚丙烯酰胺凝胶进行电泳分离,经转膜、封闭,用相应蛋白抗体4℃孵育过夜,tbst洗涤,二抗孵育1h,tbst洗脱,使用ecl发光,采集图片,利用imagej软件分析条带灰度值,以gapdh为内参计算样本中目的蛋白的相对丰度。结果如图12、13所示。利用western blot技术检测分析过表达ctrp6基因可增加细胞内fas和pparγ蛋白表达水平(图12中e),对蛋白条带定量分析结果见图12中f和图12中g,提示过表达ctrp6基因可增加脂合成;对自噬相关信号通路和标志基因分析发现,mtor磷酸化加强(图13中a、图13中b,磷酸化水平与mtor信号通路活性成正比,但该通路负调控细胞自噬活性,既:mtor磷酸化越高,提示细胞自噬活性可能越低),说明mtor信号通路活性增强,而该通路是负调控细胞自噬活性的,因此推断过表达ctrp6基因能抑制细胞自噬活性;自噬受体蛋白p62表达量升高(该值越小,说明自噬活性越高)。(图13中a和图13中c),自噬体标志蛋白lc3
‑ⅱ
/lc3-ι降低(该比值越大,说明自噬活性越高)(图13中a和图13中d),也印证了细胞自噬水平增加。上述结果提示:ctrp6基因可能通过mtor通路调控肝细胞自噬活性,进而影响肝细胞脂质代谢。上述结果表明,ctrp6基因过表达能够抑制肝细胞自噬活性,引起肝细胞脂质积累增加。
182.以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1