一种BADSCs膜片与导电纳米纤维复合心脏贴片及其制备方法与流程
一种badscs膜片与导电纳米纤维复合心脏贴片及其制备方法
技术领域
1.本发明涉及生物科技、再生生物工程、医用心脏贴片技术领域,具体涉及一种badscs膜片与导电纳米纤维复合心脏贴片及其制备方法。
背景技术:
2.由血液供应中断引起的缺血性心肌梗死(简称mi)占疾病和死亡的大部分。目前心肌梗死的治疗原则主要是保护和维持心脏功能,挽救垂死的心肌,防止梗死面积扩大。然而,天然心肌细胞的有限增殖和伴随的炎症反应经常导致纤维重塑和心力衰竭。一般来说,心肌梗死的有效治疗需要引入功能性物质,例如注射活细胞、蛋白质和基因等。而心肌细胞的及时更新对于治疗心肌梗死具有重要意义。迄今为止,基于干细胞的疗法已成为各种难治性疾病的新兴解决方案,包括急性心肌梗死。然而,注射后的低细胞保留仍然影响干细胞疗法的治疗效率。
3.近年来,人工心脏贴片在提供心肌再生疗法方面显示出巨大潜力,从而促进了心脏组织重塑。例如,制造了具有临床相关大小的人类诱导多能干细胞衍生的心肌贴片用于治疗mi。这种心脏贴片不仅显着减少了梗死面积,并可改善了心脏功能。与含有生物制剂的人工支架不同,细胞膜片工程作为心脏贴片更具有优势,包括加速心肌生成、整合细胞外基质和更强大的旁分泌效应。通过在心脏表面应用含有干细胞的心脏贴片,来自干细胞的一组旁分泌因子可以促进梗塞心肌的内源性修复。
4.众所周知,脂肪组织是富含干细胞的储存库。临床前数据表明,心包脂肪组织可以通过释放细胞因子和生长因子来调节心室功能以响应mi。脂肪干细胞(adscs)也被认为在mi的治疗中显示出巨大的应用前景。通过与天然心肌细胞的直接细胞间相互作用以及接受来自这些心肌细胞的因子的刺激,adscs具有分化成心肌细胞样细胞的强大潜力。在这方面,基于adscs的贴片可以通过恢复血液循环、调节免疫微环境和更新心肌细胞来重塑梗死心脏。一般来说,哺乳动物中存在两类adscs,白色脂肪干细胞(wadscs)和棕色脂肪干细胞(badscs)。以往的研究已经证实,与wadscs相比,badscs具有更强的心肌细胞分化能力。
5.然而,细胞膜片的成功应用受到mi治疗中两个主要障碍的阻碍。首先,理想的心脏补片需要合适的机械强度来匹配原生心脏。其次,人工补片必须通过导电连接健康的心肌和梗死区域,从而重建受损的心脏组织。有趣的是,基于生物材料的薄膜膜片也可以作为贴片来传递治疗分子并提供机械支持。丝素蛋白(sf)是一种天然生物大分子,由于其生物相容性、生物可降解性、形态灵活性和良好的机械性能,在组织工程中引起了广泛的兴趣。最近,sf已被证明是一种潜在的替代方法,可在不影响转录因子的情况下诱导大鼠静止心室心肌细胞重编程和转化为起搏器心肌细胞。因此,我们提出了一种基于静电纺丝聚pcl/sf/cnts纳米纤维和badscs膜片的新型复合心脏贴片,可以有效治疗缺血性心肌梗死。
技术实现要素:
6.为了解决上述存在的现有技术对于治疗mi的缺点和不足,本发明提供一种badscs
膜片与导电纳米纤维复合心脏贴片及其制备方法。实验结果表明,badscs倾向于在psn上产生心肌样结构,与含有badscs悬液的静电纺丝纳米纤维相比,psn-badscs膜片复合心脏贴片(ps-as)的移植在大鼠心肌梗死模型中显示出加速血管生成且可通过调节巨噬细胞的极化减少炎症反应,能够有效促进组织再生。
7.为了达到上述目的,本发明采用如下技术方案:
8.一种badscs膜片与导电纳米纤维复合心脏贴片的制备方法,该导电纳米纤维复合心脏贴片主要由棕色脂肪来源的干细胞(badscs)膜片逐层堆叠,并附着于导电纳米纤维(psn)薄膜表面组成;其中psn薄膜主要由电纺聚(ε-己内酯)(pcl)、丝素蛋白(sf)和碳纳米管(cnts)共混并通过静电纺丝制得,制备步骤如下:s1:badscs的分离:从大鼠的肩胛骨部位分离出棕色脂肪组织,进而将这些组织用冷的dulbecco磷酸盐缓冲溶液洗涤,并用小剪刀切碎至体积大小为1mm3左右,然后用混合消化酶溶液在37℃摇床中,间隔摇动30-50分钟;接下来,将badscs细胞组织通过200目细胞筛过滤,并将所得细胞悬液以1000rpm匀速离心5-10分钟,备用;s2:badscs的培养:将步骤s1中所得的细胞沉淀重悬于α-mem基础培养基中,并使用血细胞计数器计数;将分离的细胞按照6万/ cm2接种到温敏性六孔板中,在37℃下孵育,并保持每隔一天更换一次培养基;s3: badscs膜片的制备:将步骤s2中的细胞培养10天后,将六孔板移至室温静置1小时,然后以单层细胞膜片的形式收集细胞,并进行h&e染色以观察badscs细胞膜片;badscs细胞膜片的平均厚度为200-300μm;s4:sf的制备:将天然蚕丝在特制的碳酸钠溶液中煮沸50分钟,然后用沸腾的去离子水洗涤;并经过重复五次的洗涤后,丝胶被完全去除;然后,将脱胶的蚕丝纤维在60℃下溶解于溴化锂溶液中;随后在离心机中以 8000 rpm离心20分钟,去除杂质以及未能充分溶解的丝素纤维;并使用mwco=3.5-8kda的透析袋,将上清液于去离子水中进行透析;最后,经过冷冻干燥处理,获得再生丝素蛋白,并在4℃下干燥储存直至使用;s5:psn薄膜的制备:通过称重获取足量的sf,将干燥后的sf与pcl分别溶解在六氟异丙醇溶剂中,分别制备浓度为10wt% 的pcl溶液和相同浓度的sf溶液;进而将pcl溶液、sf溶液和浓度为10mg/ml的cnts溶液充分混合来制备纺丝溶液;然后,使用以下参数通过静电纺丝获得psn薄膜:电压为10-18kv,针尖-收集器距离为10-20cm,溶液流速保持0.5-5 ml/h;将获得的psn薄膜浸入75%的酒精中,保持30分钟以使sf交联;最后,将所制备的psn薄膜放置于离心管中,在室温下真空干燥3-10天,并于4℃的冰箱内保存备用;s6:扫描电子显微镜(sem)测试:通过 sem观察psn薄膜的表面形态;获得psn薄膜的sem照片,并使用imagej软件对psn薄膜的纳米纤维的直径和孔径大小进行分析;s7:接触角测试:psn薄膜的亲水性通过使用接触角分析仪进行评估:在室温下将4微升超纯水滴到psn薄膜表面;在水与样品接触后连续记录图像;从5次独立重复的数据中获得平均接触角数值;s8:机械测试:在室温下使用单轴拉伸测试仪检测psn薄膜的机械性能;将psn薄膜切成尺寸为20
×
10
×
3mm的薄膜单元;拉伸速度设定为20mm/min;并记录每种类型的psn薄膜的应力-应变曲线;s9:psn薄膜的电化学测量:用电化学工作站测量电纺纳米纤维的阻抗;将测试样
品(10
×
10
×
3mm)夹在导电电极和溶液槽之间;电化学阻抗谱在pbs缓冲液中获得,频率范围为100khz至1hz;s10:psn薄膜的生物相容性检测:将步骤s1中获取的badscs接种至psn薄膜表面,加入适量培养基,于37 ℃孵育;在确定的时间点(24h、48h、72h),将培养基更换为含有10 v/v%的cck-8试剂的新鲜培养基;再孵育1-2小时,用酶标仪测量复合材料450nm处的吸光度,计算细胞存活率;s11:导电纳米纤维复合心脏贴片的制备:将badscs膜片逐层堆叠到psn薄膜上获得最终的psn薄膜-badscs膜片复合心脏贴片(ps-as)。
9.优选的技术方案,步骤s1中的所述混合消化酶溶液为含有0.05%胰蛋白酶、0.1%胶原酶iv和0.1%dispase酶ⅱ的混合溶液。
10.进一步优选的技术方案,步骤s4中的所述碳酸钠溶液为浓度0.2mol/l的na2co3水溶液。
11.进一步优选的技术方案,步骤s4中的溴化锂溶液为浓度为9.3mol/l的溴化锂水溶液。
12.进一步优选的技术方案,所述pcl溶液、sf溶液的体积组分比例1:(0.2-5)。
13.一种badscs膜片与导电纳米纤维复合心脏贴片,采用上述所述的导电纳米纤维复合心脏贴片的制备方法制备而成。
14.本发明相比于现有技术的优点是:将psn和badscs膜片堆叠以获得由四层badscs膜片和一层psn薄膜组成的ps-as心脏贴片;然后制备ps-as衍生的条件培养基(ps-ascm) 以评估生物活性;在ps-ascm中培养的huvecs在划痕愈合和transwell迁移实验中显示出增强的迁移能力(如图3a-d); ps-ascm中培养的huvecs在12h和24h后划痕融合率分别达到72.67%和92.00%,明显高于对照组(两个时间点分别为32.07%和71.11%);同样,与对照组相比,在 ps-ascm组中迁移到transwel上腔底部的细胞数量更多;同时,cck-8测定的结果表明,用 ps-ascm处理的huvecs比对照增殖更快(图3e);此外,体外成管实验显示ps-ascm具有促进血管生成的能力(图3f-h);总之,这些结果表明ps-as贴片促进huvecs的迁移、增殖和体外成管;表明ps-as贴片不仅对心肌细胞更新有积极作用,也可以促进血管生成;
15.该ps-as心脏贴片可以在mi后恢复心脏功能;结合碳纳米管使ps-as贴片具有高导电性; 结果表明,ps-as心脏贴片比悬液更能提高badscs的保留和稳定性;体内实验进一步证明ps-as 贴片能够增强血管生成并降低炎症反应;此外,ctnt和cx43表达上调也证明其增强的心脏重塑能力;除了减少纤维修复外,badscs分化而来的心肌细胞还可以促进心脏功能;总之,该ps-as心脏贴片有效地显示了结合生物材料基底和细胞膜片,在缺血性mi后恢复心肌的潜在治疗效率。
附图说明
16.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
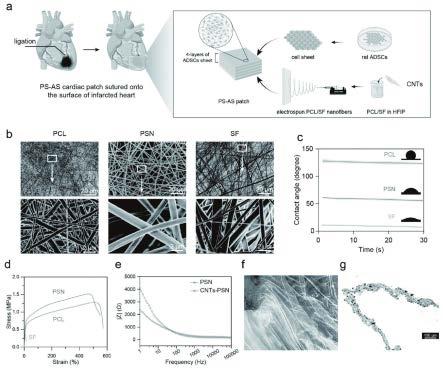
17.图1为本发明的ps-as心脏贴片的制备和表征示意图。
18.图2为本发明的pcl/sf纳米纤维对badscs分化的影响。
19.图3为本发明的ps-as 心脏贴片的体外活性结果。
20.图4为本发明的ps-as 贴片在大鼠 mi 模型中的体内稳定性和心脏重塑表征。
21.图5为本发明的ps-as 贴片对体内血管生成和免疫调节影响。
22.图6为本发明的ps-as贴片抑制细胞凋亡促进心肌重构的结果。
23.图7为本发明的ps-as贴片治疗改善心室功能障碍的结果。
24.图8本发明的导电pcl/sf纳米纤维薄膜的制备示意图及照片。
25.图9为本发明的pcl/sf纳米纤维的傅里叶红外检测结果。
26.图10为本发明的pcl/sf纳米纤维直径分布及孔径分布统计结果。
27.图11为本发明的badscs在pcl/sf纳米纤维薄膜上跳动的结果。
28.图12为本发明的badscs在pcl/sf纳米纤维薄膜上跳动的统计结果。
29.图13为本发明的ps-as贴片对大鼠心脏胶原分布影响的染色结果。
30.图14为本发明的pcl/sf纳米纤维的物理性能表征结果图表。
31.图15为本发明在rt-pcr检测中所使用的引物图表。
具体实施方式
32.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
33.需要说明的是,本发明的具体实施方式中,可能出现的术语如“第一”和“第二”等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何实际的关系或者顺序。而且,可能出现的术语如“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括这种过程、方法、物品或者设备所固有的要素。在没有更多限制的情况下,可能出现的语句“包括一个......”等限定的要素,并不排除在包括所述要素的过程、方法、物品或者设备中还存在另外的相同要素。
34.在本发明的描述中,除非另有明确的规定和限定,可能出现的术语“安装”、“相连”、“连接”、“设有”应做广义理解,例如,可以是固定连接,也可以是可拆连接,或一体地连接;可以是机械连接,也可以是电连接;可以是直接连接,也可以是通过中间媒介间接相连,或者可以是两个元件内部的连通。对于本领域技术人员而言,可以通过具体情况理解上述术语在本发明中的具体含义。
35.一种badscs膜片与导电纳米纤维复合心脏贴片的制备方法的实施例:如图1-图7所示:该导电纳米纤维复合心脏贴片(以下简称为ps-as贴片)主要由棕色脂肪来源的干细胞(以下简称为badscs)膜片逐层堆叠,并附着于导电纳米纤维(以下简称为psn)薄膜表面组成;其中psn薄膜主要由电纺聚(ε-己内酯)(以下简称为pcl)、丝素蛋白(以下简称sf)和碳纳米管(以下简称为cnts)共混并通过静电纺丝制得。
36.首先制造并表征了含有碳纳米管的psn薄膜。接下来,分离出大鼠原代的丝素蛋白
badscs,并制作了badscs膜片。而ps-as心脏贴片是通过以psn静电纺丝膜作为基材逐层堆叠badscs膜片来制备的,如图1所示;并在体外评估ps-as贴片的生物活性后,将它们用于治疗大鼠模型中的心肌梗死mi。
37.其中图1中:(a)ps-as心脏贴片的制造和用于治疗mi的示意图。(b)通过sem观察到 pcl纳米纤维、psn和sf纳米纤维的代表性微观结构。 (c)pcl纳米纤维、psn和sf纳米纤维的水接触角。 (d)pcl纳米纤维、psn和sf纳米纤维的应力-应变曲线。(e)pbs中纯psn和含cnts的psn的eis。(f)单层badscs膜片的光学照片。(g)badscs膜片横截面的苏木精/伊红(h&e)染色。
38.图2中:(a)光学图像显示在不同时间点接种在培养皿和psn上的badscs。(b)显示 badscs分化的代表性荧光图像。(图c和d)示意α-肌动蛋白(绿色)和cx43(红色)的定量。其中,对于(c和d),使用双因素方差分析和sidak事后检验确定统计显着性。(图e-h)为使用imagej软件中的“musclemotion”插件计算的收缩-时间曲线图。
39.图3中:(图3a和b):显示对照和ps-ascm处理后的划痕愈合面积测定,以及定量结果。 (c和d) :显示对照和ps-ascm的transwel室迁移,以及迁移细胞的数量。(e)表征cck-8测定在450nm处的od值。 (f-h)处理对照和ps-ascm后的成管实验的管形成测定,以及使用imagej软件中的“angiogenesisanalyzer”插件进行定量分析。其中,对于(b、d和e),使用双因素方差分析和sidak事后检验确定统计显着性。对于(g和h),使用双边非配对t检验确定统计显着性。
40.图4中:(a-c)为大鼠移植ps-as贴片或psn-sus后的荧光图像、荧光强度的定量数据和曲线下的归一化面积图。(d和e)为石蜡包埋切片进行masson三色染色,根据masson三色染色计算梗死面积图。(f和g)代表if染色的代表性图像显示大鼠心脏中的ki67(橙色)表达和ki67表达的相应量化(比例尺,100μm)。其中,对于(c),使用双边非配对t检验确定统计显着性。对于(e和g),使用单因素方差分析和tukey的事后检验确定统计显着性。
41.图5中:(a和b)表征if染色的代表性图像显示大鼠心脏中的cd34(红色)表达和cd34表达的相应量化(比例尺,100μm)。(c和d)为大鼠心脏对cd68的ihc染色的代表性图像(比例尺,100μm)以及cd68表达的量化图。(e-g)通过rt-qpcr测量的三组中mrna (促炎和抗炎基因)的相对表达。其中,对于(b和d-g),使用单向方差分析和tukey的事后检验确定统计显着性。
42.图6中:(a和b)表示tunel染色的代表性图像显示大鼠心脏中的细胞凋亡(比例尺,100μm)。(c和d)表示ihc染色的代表性图像显示大鼠心脏中的ctnt表达和ctnt蛋白表达的相对倍数变化(比例尺,100μm)。(e和f)表示ihc染色的代表性图像显示大鼠心脏中的cx43表达和cx43蛋白表达的相对倍数变化(比例尺,100μm)。其中,对于(b、d和f),使用单向anova和tukey的事后检验确定统计显着性。
43.图7中:(a)为显示心脏功能的代表性m型超声心动图图像。(b-e)表示相应地评估左心室射血分数(lvef)、缩短分数(lvfs)、舒张期容积(esv)和舒张末期容积(edv)。 其中,对于(b-e),使用单向方差分析和tukey的事后检验确定统计显着性。
44.该导电纳米纤维复合心脏贴片制备方法制备步骤如下:
45.s1:badscs的分离:从大鼠的肩胛骨部位分离出棕色脂肪组织,进而将这些组织用冷的dulbecco磷酸盐缓冲溶液洗涤,并用小剪刀切碎至体积大小为1mm3左右,然后用混合
消化酶溶液在37℃摇床中,间隔摇动30-50分钟;接下来,将badscs细胞组织通过200目细胞筛过滤,并将所得细胞悬液以1000rpm匀速离心5-10分钟,备用;其中,所述混合消化酶溶液为含有 0.05%胰蛋白酶、0.1%胶原酶iv和0.1%dispase酶ii 的混合溶液。
46.s2:badscs的培养:将步骤s1中所得的细胞沉淀重悬于α-mem基础培养基中,并使用血细胞计数器计数;将分离的细胞按照6万/ cm2接种到温敏性六孔板中,在37℃下孵育,并保持每隔一天更换一次培养基;
47.s3: badscs膜片的制备:将步骤s2中的细胞培养10天后,将六孔板移至室温静置1小时,然后以单层细胞膜片的形式收集细胞,并进行h&e染色以观察badscs细胞膜片;badscs细胞膜片的平均厚度为200-300μm。如图1g所示,其中,adscs细胞膜片为平均厚度227.43μm的透明膜;badscs细胞膜片的结构如图1f所示。
48.s4:sf的制备:将天然蚕丝在特制的碳酸钠溶液中煮沸50分钟,然后用沸腾的去离子水洗涤;并经过重复五次的洗涤后,丝胶被完全去除;然后,将脱胶的蚕丝纤维在60℃下溶解于溴化锂溶液中;随后在离心机中以 8000 rpm离心20分钟,去除杂质以及未能充分溶解的丝素纤维;并使用mwco=3.5-8kda的透析袋,将上清液于去离子水中进行透析;最后,经过冷冻干燥处理,获得再生丝素蛋白,并在4℃下干燥储存直至使用。其中,所述碳酸钠溶液为0.02mol的去离子水的na2co3水溶液。溴化锂溶液为9.3mol的溴化锂和双蒸水的混合溶液。
49.s5:psn薄膜的制备:通过称重获取足量的sf,将干燥后的sf与pcl分别溶解在六氟异丙醇溶剂中,分别制备浓度为10wt% 的pcl溶液和相同浓度的sf溶液;进而将pcl溶液、sf溶液和浓度为10mg/ml的cnts溶液充分混合来制备纺丝溶液;然后,使用以下参数通过静电纺丝获得psn薄膜:电压为10-18kv,本实施例中优选为18kv。针尖-收集器距离为10-20cm,优选为15cm。溶液流速保持0.5-5 ml/h;优选为2ml/h。将获得的psn薄膜浸入75%的酒精中,保持30分钟以使sf交联;最后,将所制备的psn薄膜放置于离心管中,在室温下真空干燥3-10天,优选为7天;并于4℃的冰箱内保存备用。
50.s6:扫描电子显微镜(sem)测试:通过 sem观察psn薄膜的表面形态;获得psn薄膜的sem照片,并使用imagej软件对psn薄膜的纳米纤维的直径和孔径大小进行分析。
51.s7:接触角测试:如图1c所示:psn薄膜的亲水性通过使用接触角分析仪的进行评估:在室温下将4微升超纯水滴到psn薄膜表面;在水与样品接触后连续记录图像;从5次独立重复的数据中获得平均接触角数值。
52.s8:机械测试:在室温下使用单轴拉伸测试仪检测psn薄膜的机械性能;将psn薄膜切成尺寸为20
×
10
×
3mm的薄膜单元;拉伸速度设定为20mm/min;并记录每种类型的psn薄膜的应力-应变曲线。如图1d所示。
53.s9:psn薄膜的电化学测量:用电化学工作站测量电纺纳米纤维的阻抗;将测试样品(10
×
10
×
3mm)夹在导电电极和溶液槽之间;电化学阻抗谱在pbs缓冲液中获得,频率范围为100khz至1hz;如图1e所示。
54.s10:psn薄膜的生物相容性检测:将步骤s1中获取的badscs接种至psn薄膜表面,加入适量培养基,于37 ℃孵育;在确定的时间点(24h、48h、72h),将培养基更换为含有10 v/v%的cck-8试剂的新鲜培养基;再孵育1-2小时,用酶标仪测量复合材料450nm处的吸光度,计算细胞存活率。
55.s11:导电纳米纤维复合心脏贴片的制备:将badscs膜片逐层堆叠到psn薄膜上获得最终的psn薄膜-badscs膜片复合心脏贴片(ps-as)。
56.其中,对ps-as复合材料进行成管实验:原代人脐静脉血管内皮细胞(huvecs)是从人脐带静脉(取自中国北京大学人民医院)中分离出来的。首先,制备ps-as贴片条件培养基(ps-ascm)。将ps-as贴片切碎并转移到含有10%fbs(sciencell,usa)的内皮细胞培养基(ecm)中。在37℃孵育24小时后,将混合物在4℃环境温度条件下,在离心机中以1000rpm离心10分钟以沉淀贴片碎片。接下来,回收上清液并使用0.22μm滤膜过滤。将huvec接种到matrigel(corning,usa)包被的96孔板中。四小时后,用光学显微镜对管形成进行拍照,并使用imagej软件(版本1.8.0)中的“angiogenesisanalyzer”插件进行分析。
57.进一步对ps-as复合材料进行划伤实验:将1.5
×
105个 huvecs接种到用于细胞培养的24孔板中,并使其在一夜之间达到90%的融合。使用200μl的枪尖,在细胞单层上产生划痕并拍照。培养24小时和48小时后,再次拍摄相同的位置。使用imagej软件(1.8.0版)测量划痕面积。每孔记录三个非重叠区域。
58.进一步的transwell迁移试验中,将huvecs以 5
×
105个细胞/ml的密度接种在 transwell的上室中并使其沉降。然后,将600μl的ecm或ps-ascm小心地添加到 24孔板的下室底部。孵育指定时间后,将transwell上室从孔板中取出并用 pbs 洗涤3次。在使用棉签去除膜顶部的剩余细胞后,将这些transwell的上室浸入4%的多聚甲醛中10分钟,并用结晶紫溶液(0.1wt%)染色。然后用imagej软件(1.8.0版)对迁移的细胞进行拍照和分析。
59.为了验证ps-as心脏贴片应用于mi治疗的效果,采用上述实验检测合格的导电纳米纤维心脏贴片ps-as,制备心梗动物模型以及心脏贴片移植实验:
60.采用spraguedawley大鼠(雄性,270-350g)购自北京军事医学科学院实验动物中心。动物实验获得北京航空航天大学动物伦理委员会批准(批准文号:bm20200059)。所有动物均按照美国国立卫生研究院的指导方针进行照料。mi大鼠模型是根据先前的研究制备的。简而言之,通过腹腔内注射剂量为30mg/kg 的戊巴比妥钠(2wt%)来麻醉大鼠。剃去皮毛后,左开胸暴露大鼠心脏,用6-0缝线结扎左冠状动脉前降支,诱发急性心肌梗死。心电图检测证实大鼠心肌梗死的成功建立。将大鼠随机分为三个治疗组:(i)未进行进一步治疗的 mi(阴性对照组),(ii)采用psn和adscs悬浮治疗的mi(psn-sus组),(iii) 采用ps-as的mi心脏贴片治疗(ps-as贴片组)。将相应的psn-sus或ps-as贴片移植并缝合到梗塞的心脏区域,缝合伤口,继续饲养大鼠,直至取材。
61.超声心电图观察:手术后4周,通过腹膜内注射戊巴比妥钠(2wt%)麻醉大鼠。一位对实验分组不清楚的医学成像专家操纵了多普勒超声机(vevo2100,fujifilmvisualsonicsinc.,usa)。收集二维图像并记录相应的参数,包括左心室射血分数(lvef)、左心室缩短分数(lvfs)、舒张末期容积(edv)和收缩末期容积(esv)。
62.体内细胞稳定性观察:荧光探针did(beyotime,china)用于标记badscs进行体内稳定性测定。移植前,将badscs膜片或badscs悬浮液与20μm的did孵育2h,然后用pbs冲洗3次。通过腹膜内注射戊巴比妥钠(2wt%)来麻醉大鼠。在确定的时间点,使用体内成像系统(ivisluminaiii,perkinelmer,usa)拍摄和分析图像。
63.组织学和免疫染色实验:用生理盐水进行血管灌注后收获大鼠心脏组织。对于masson染色和弹性蛋白染色,将石蜡包埋的心脏组织切成5μm厚的切片,然后按照制造商的
说明,使用相应的染色试剂盒(g1346和g1593;solarbio,中国)对切片进行再水化和染色。随后将它们用中性树脂固定并用光学显微镜(nikoneclipsete2000-ukanagawa,日本)拍照。
64.对于免疫组织化学(ihc)和免疫荧光(if)染色,用pbs冲洗大鼠冷冻切片并用4%pfa固定。在ihc的柠檬酸盐缓冲液中进行抗原修复。之后,用含有0.25%tritonx-100(medchemexpress,美国)的5%bsa封闭缓冲液(solarbio,中国)在室温下透化切片并封闭1小时。以下一抗与切片在4℃下孵育过夜:兔抗cx4(1:100;#3512;cellsignalingtechnology),小鼠抗α-actinin(1:100;#6487;cellsignalingtechnology),兔抗ki67(1:100;ab15580;abcam),兔抗ctnt(1:100;ab209813;abcam),兔抗68(1:100;ab28365;abcam),兔抗cd34(1:200;ab881289;abcam)。第二天,将与alexafluor594(1:400;ab150080;abcam)或alexafluor488(1:400;ab150117,ab150113;abcam)结合的二抗与切片一起孵育1小时。dapi(solarbio,中国)用于核复染。使用共聚焦显微镜(leicamicrosystemsgmbh,mannheim,germany)拍摄图像。对于ihc染色,dab(3,3'-二氨基联苯胺)底物用于显示阳性区域,苏木精用于复染细胞核。用光学显微镜(nikoneclipsete2000-ukanagawa,japan)拍摄图像。使用imagej软件(版本1.8.0)进行量化。
65.逆转录聚合酶链反应观察:从梗塞的大鼠心脏中收集总rna。使用primescript
™ꢀ
rtmastermix (takara,japan) 形成互补dna(cdna)。使用thermalcyclerdice
™ꢀ
real time system(takara,japan) 进行实时定量pcr(rt-pcr)。使用2-(δδct)
方法计算感兴趣基因的相对表达并标准化为gapdh。所有引物均由sangonbiotech(中国上海)合成,并列于图15。
66.采用导电纳米纤维心脏贴片ps-as,在大鼠心梗动物模型以及心脏贴片移植实验的统计数据:条形图中的散点表示独立实验的值。数据显示为平均值
±
标准差。使用graphpadprism软件(9.0 版)计算组间的统计学显着性。双尾非配对t检验用于比较两个独立组的平均值。单向方差分析和turkey事后检验(将每列的平均值与其他列的平均值进行比较)用于在一个数据集中的多组之间进行比较。除非另有说明,否则使用双边anova和sidak事后检验进行体外实验。p《0.05被认为具有统计学意义。ns,无统计学差异;*,p《0.05;**,p《0.01;***,p《0.001;****p《0.0001。
67.ps-as心脏贴片的制造方法如图1a所示。简而言之,导电纳米纤维膜psn首先由 pcl 和sf(体积组分比例1:(0.2-5))以及碳纳米管材料的混合物,在本实施例中,优选的pcl 和sf的体积组分比例为1:1。并通过静电纺丝溶解在hfip中制备。用一片锡箔收集混合纳米纤维,如图8和图9所示。其中,制备的导电纳米纤维膜psn的平均纤维直径为972nm,略大于pcl(361nm)或sf(513nm)纳米纤维,如图1b所示。
68.psn、pcl和 sf的平均孔径分别为5.6μm、1.93μm 和2.94μm,如图10和表s1所示。与pcl纳米纤维相比,天然丝素蛋白sf的引入也提高了表面亲水性,接触角降低了54.38
°
,如图1c所示。然后通过拉伸试验检测导电纳米纤维psn的机械性能。
69.其中,psn薄膜的应力-应变曲线显示,由于加入了机械强度稍弱的丝素蛋白sf,psn的拉伸强度和断裂伸长率略有下降(图1d和图14)。通过比较它们的电阻抗与频率来评估电纺纳米纤维的电化学性能。在低频下,结合了cnts的psn显示出比纯psn更低的电阻抗
(如图1e)。更重要的是,培养3天后badscs存在明显的脂滴,而我们观察到badscs在psn上培养10天后倾向于自发产生心肌细胞样结构,如图11所示。为了制备badscs膜片,我们选择了温度响应性细胞培养表面。获得badscs膜片,平均厚度为227.43μm的透明膜,如图 1f,1g所示。
70.badscs的分化实验中,为了研究psn对badscs分化的影响,将细胞接种在psn上。培养3天后发现badscs自发收缩,如图2a所示。培养10天后,培养皿底部形成致密的单层细胞膜片。badscs聚集成束排列,可以同步收缩并产生明显的肌管结构,如图2a所示。相反,在培养皿表面培养的badscs显示出延迟分化,如图12所示。
71.通过if染色进一步评估心脏特异性蛋白、心肌肌钙蛋白t(ctnt)和连接蛋白43 (cx43) 的表达。结果表明,psn有效上调了ctnt和cx43的表达,如图2b-2d所示。其中,收缩图还揭示了在psn上培养的badscs的跳动特性增强,表明psn促进了badscs分化为心肌细胞,如图 2e-2h和图13所示。
72.进一步的表征的还有ps-as贴片的体外生物活性:将psn和badscs膜片堆叠以获得由四层badscs膜片和一层 psn薄膜组成的ps-as心脏贴片。然后制备ps-as衍生的条件培养基(ps-ascm)以评估生物活性。在ps-ascm中培养的huvecs在划痕愈合和transwell中显示出增强的迁移能力,如图 3a-3d所示。ps-ascm组培养12h和24h后划痕融合率分别达到72.67%和92.00%,明显高于对照组(两个时间点分别为32.07%和71.11%)。
73.同样,与对照组相比,在 ps-ascm 组中迁移到transwell上腔底部的细胞数量更多。同时,cck-8 测定的结果表明,用ps-ascm 处理的huvecs比对照增殖更快,如图 3e所示。此外,成管实验显示ps-ascm具有促进血管生成的能力,如图3f-3h所示。总之,这些结果表明ps-as贴片促进huvecs迁移、增殖和体外成管。ps-as贴片的体外生物活性存在。
74.而对于体内稳定性测定,我们使用did染料标记badscs片,然后将did标记的ps-as 贴片移植到大鼠心脏。psn与badscs悬浮液(psn-sus)结合用作对照。如图4a所示,移植后立即在ps-as贴片和psn-sus组中发现强荧光信号。对于psn-sus,7天后无法检测到该荧光信号;而在ps-as贴片组中,即使在移植14天后也发现了该信号(图4b和图4c)。这些数据表明,ps-as延长促进心脏周围badscs的保留,并提高其稳定性。
75.然后进行masson三色染色以分析治疗4周后的心脏纤维化。结果表明,缝线结扎导致大鼠心脏大面积受损,证明mi造模成功。ps-as贴片移植促进了梗死区域和纤维化区域的减少,如图4d和图4e所示。我们还证实ps-as贴片上调了ki67的表达,表明ps-as贴片对心肌细胞更新有积极作用,如图4f和图4g所示。
76.进一步评估ps-as贴片的促血管生成和免疫调节作用:ps-as贴片也可以促进血管生成,这可以通过cd34表达的显著性增加来证实,如图5a和图5b所示。这些数据表明,ps-as贴片可以促进血液微环境,从而改善心肌细胞功能。进一步通过大鼠mi模型,我们还证实ps-as贴片在调节炎症反应中发挥重要作用。ihc染色结果显示,由于心肌梗死的,cd68蛋白大量产生。然而,当用ps-as贴片处理时,cd68阳性细胞显着减少,如图5c和 图5d所示。同时,与其他两组相比,促炎基因il-1β和tnf-α的表达在ps-as贴片组中也下调,而抗炎基因il-10的表达上调,如图1、图5e、图5g所示。
77.通过末端脱氧核苷酸转移酶缺口末端标记(tunel)法测定以评估细胞凋亡。如图6a和图6b所示,tunel染色显示,与psn-sus或对照组相比,用ps-as贴片处理的大鼠心脏中
存在较少的凋亡区域。此外,与psn-sus或对照组相比,ps-as贴片组中成熟心肌细胞的两种标志物ctnt和cx43的表达明显上调。ps-as贴片治疗维持心肌的正常形态,表明其对mi有效的修复或对损伤的保护作用。与之前的报道一致,尽管psn-sus也产生了一些治疗效果,但是比ps-as贴片弱,具体如图6c、图6f所示。
78.最后,工作人员进行了多普勒超声检测以评估治疗4周后的心脏功能,如图7a所示。大鼠梗死心脏表现出典型的mi特征,即lvef和lvfs显着降低。接受psn-sus治疗的大鼠心脏显示出显着增加的lvef和lvfs。ps-as贴片进一步放大了治疗效率,这与之前的报道疗效相当,如图7b和图7c所示。同时,发现移植ps-as贴片的大鼠的edv和esv最低,表明该组大鼠的心脏功能更加健康,参照图7d和图7e所示。同时badscs分化成心肌细胞样细胞,有利于心肌功能重塑。
79.该ps-as中的psn旨在提高该复合材料的机械强度,而badscs膜片则主要提供修复作用。在体外通过实验研究了psn的益处后,在大鼠mi实验研究模型中进一步评估了ps-as 贴片的体内治疗效率。其中,sf因其生物相容性和生物降解性而成为最有前途的生物材料之一。考虑到sf的延展性较差,我们选择了含有碳纳米管的电纺psn作为基材,满足心脏组织收缩和舒张功能的力学要求。
80.心脏贴片的相对较低的杨氏模量将允许其随着心脏跳动而变形。在我们的研究中,psn的杨氏模量约为12.38mpa,与电纺sf纳米纤维(25.52mpa)相比,更接近心脏组织的报道值。然而,使用人造材料再现人体肌肉的机械特性具有挑战性。因此,仍有很大的空间来优化心脏贴片的机械性能。同时,由于较大的电容电流,纯psn和含cnts的psn的阻抗都随着频率的增加而降低。我们观察到在低频范围内,含碳纳米管的 psn 的阻抗明显低于纯psn的阻抗,这与之前的研究相符。数据显示,添加cnts可以增强纳米纤维的导电性以模拟天然心脏组织。
81.更重要的是,在psn表面培养的badscs观察到强α-actinin/cx43双阳性染色,表明psn具有支持badscs向心肌细胞分化的巨大潜力。与对照组中细胞聚集的跳动相比,在psn上培养的badscs表现出更有力的收缩,如图2e-2h所示。电纺纳米纤维的孔隙率可以保护受损区域周围的活细胞或生物活性物质,并使纳米纤维与宿主组织之间得以整合。
82.与细胞悬液不同,细胞膜片可以保留相对完整的细胞外基质,从而促进周围细胞的生长和增殖。使用ps-as贴片,观察到所述的badscs膜片在体内保留和稳定性显着增加。即使在多层细胞膜片的内部如何有效维持足够的细胞存活率存在争议,但移植到大鼠体内4周后仍有大量活细胞。更重要的是,我们证实了梗死区域和移植的ps-as贴片内部的心肌再生增强,如图 7所示。
83.badscs可以通过旁分泌作用调节血液微环境并维持周围细胞的存活。众所周知,经典激活的巨噬细胞(m1巨噬细胞)促进炎症、细胞外基质破坏和细胞凋亡,而另一种激活的巨噬细胞(m2巨噬细胞)则有助于组织重塑和血管生成。m2巨噬细胞已被证明可以分泌抗炎介质和血管生成因子。我们还通过免疫染色和rt-pcr测定证实ps-as贴片上调m2巨噬细胞极化,如图4所示。
84.该ps-as贴片的上述效果解释了心脏功能的恢复。已经达成共识,损伤后有效的心脏再生受益于心肌细胞更新。添加多能干细胞的移植物可以通过心肌细胞更新来重建和更新梗死心肌。凭badscs的巨大应用前景,ps-as贴片为心脏重塑提供了有利的微环境,并且
大面积的梗塞心脏被ps-as贴片修复。ps-as贴片可防止左心室扩大。同样,ps-as贴片组中高水平的cx43和ctnt表达表明心肌细胞之间间隙连接的重塑,这是健康心肌的独有特征。
85.综上所述,我们提出一种生物相容性的ps-as心脏贴片,可以在mi后恢复心脏功能。 结合cnts使ps-as贴片具有高导电性。结果表明,ps-as心脏贴片比悬液更能提高badscs 的保留和稳定性。体外实验揭示了用ps-as贴片治疗的血管生成增强和炎症反应减少。此外,增强的心脏重塑表现为ctnt和cx43表达上调。除了减少纤维重塑外,badscs衍生的心肌细胞还可以促进心脏功能。总之,本技术方案显示了结合生物材料底物和细胞膜片在缺血性mi后恢复心肌的潜在治疗效率。
86.本发明的一种badscs膜片与导电纳米纤维复合心脏贴片,采用上述的导电纳米纤维复合心脏贴片的制备方法制备而成。
87.以上仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1