一种透明质酸-海兔毒素结合物及其在抗肿瘤中的应用
1.本发明属于生物医药技术领域,具体涉及一种透明质酸-海兔毒素结合物、其制备方法、包含所述结合物的药物组合物,及上述结合物、药物组合物在抗肿瘤中的应用。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.恶性肿瘤(癌症)已经成为严重威胁人群健康的主要公共卫生问题之一,据统计数据显示,近几年来,恶性肿瘤发病率每年保持约3.9%的增幅,死亡率每年保持2.5%的增幅。病人基数在一个很长的周期里都将呈现稳步增加的趋势,寻找合适的药物来应对恶性肿瘤是当前的重中之重。
4.海兔毒素10(d10)是一种天然海洋生物提取物,它是一种有效的抗有丝分裂药,高细胞毒性的多肽类化合物。其抗癌机理与长春花碱类似,通过与β微管蛋白的氨基酸残基结合,强烈的抑制微管的形成和聚合,还可以抑制微管蛋白依赖gtp的水解,使有丝分裂停滞。进一步的研究还发现d10可以诱导多种癌细胞凋亡,具有很强的抗血管生成作用。d10在临床前研究中表现出令人鼓舞的抗肿瘤作用效果,但也正是因为其过于强大的活性,导致其在体内正常细胞也存在强烈的杀伤作用,产生了较强的副作用。
5.对于多种肿瘤细胞都显示出极强的抑制能力,其作为抗肿瘤药物在临床中显示出极好的效果,但因为其毒性太大未通过临床试验,随后,海兔毒素10的衍生物mmae被开发出来,目前已上市应用。结构式如下:
[0006][0007]
mmae相对与d10毒副作用虽已有了很大的改善,但对正常细胞同样具有杀伤作用,因此急需找到一种修饰剂去降低mmae的毒性并提高其的靶向性。
[0008]
透明质酸及其衍生物作为药物传递系统是研究的一个热点,这是基于透明质酸可以和细胞表面的某些特异性受体结合,因此将其用作药物载体可以提高药物的靶向性,同时延长药物在体内的作用时间,提高生物利用度,提高疗效。透明质酸分子量范围很广,主要为4000-10mda,研究表明不同分子量的作用不同,高分子量具有抗血管增生的作用且无免疫原性,低分子量的作用相反。目前研究采用高分子量透明质酸作为主动靶向因子,与肿
瘤细胞表面的特异性受体结合,介导药物入胞,在细胞内释放药物。但目前尚无透明质酸(ha)修饰的mmae结合物研究。
技术实现要素:
[0009]
为实现现有技术不足,本发明提供一种透明质酸(ha)修饰的mmae结合物,使药物靶向于肿瘤细胞,增加药物在肿瘤部位的浓集,可以提高药效,降低给药剂量,同时降低药物的不良反应,此外,由脂质纳米粒包裹药物,可以解决药物难溶性的问题,有效避免药物生物降解,有助于改善被包封药物的释放和生物分布。
[0010]
药物载体材料可分为两种:聚合物载体和脂质类载体,脂质类载体因其具有良好的生物相容性和生物可降解性的特点,在研究中广泛应用。基于脂质类的载体包括:固体脂质纳米粒,脂质纳米混悬液,脂质体等。即由固态脂质载药制备纳米粒,自应用以来,一直是给药系统研究的热点。虽然它具有众多优势,适合亲水基疏水药物的包封等,但是也有不足之处,其中主要的一个方面就是载药量低。近年来,纳米脂质载体的诞生克服了的这一缺陷,提高了药物的载药量,成为更新一代的脂质载体。
[0011]
本发明根据上述优势,构建了透明质酸修饰载mmae纳米脂质载体系统,首先采用纳米脂质载体包载mmae,增加药物的溶解性,避免使用增溶剂,降低了给药系统的毒性;然后采用透明质酸作为靶向因子,经电荷吸附作用对纳米脂质载体进行靶向修饰,实现主动靶向肿瘤的目的。
[0012]
为了实现上述目的,本发明采用如下技术方案:
[0013]
本发明的第一个方面,提供了一种透明质酸-海兔毒素结合物,所述结合物的化学式为ha-mmae,其中,透明质酸与海兔毒素10衍生物通过共价键连接。
[0014]
本发明的第二个方面,提供了一种上述的透明质酸-海兔毒素结合物的制备方法,包括:
[0015]
釆用溶融乳化低温固化法制备载mmae纳米脂质载体;
[0016]
采用电荷吸附法制备透明质酸修饰mmae纳米脂质载体。
[0017]
本发明的第三个方面,提供了一种药物组合物,述药物组合物中包括:上述透明质酸-海兔毒素10衍生物结合物。
[0018]
本发明的第四个方面,提供了上述透明质酸-海兔毒素10衍生物结合物、上述药物组合物在制备抗肿瘤产品中的应用。
[0019]
基于上述的研究步骤,采用透明质酸修饰mmae纳米脂质体一方面能够降低毒性,另一方面在血管中拥有一个较长的血液循环,主动靶向肿瘤,在抗肿瘤领域可有效的发挥抑制癌细胞生长等功效。
[0020]
本发明的有益效果
[0021]
基于上述纳米给药系统,其有益效果:(1)避免了使用有机溶剂,降低了给药系统的毒性,减少了药物的不良反应;(2)采用纳米技术达到被动靶向的目的,改善药物的分布,增加药效。因为mmae不具备主动靶向特性,缺乏对肿瘤细胞的选择性,从而产生不良反应:(3)此脂质体不会全部固化,减少药物析出,包载率提升,稳定性提高,该药物的包载率高达90%,相比其它纳米脂质体包载药物,提高10%的包封率。
[0022]
基于透明质酸的修饰,其有益效果:增加药物的主动靶向性,使药物在肿瘤部位达
到最大蓄积,进一步延长其在体内的作用时间,以增加肿瘤的杀伤效力,同时降低对周围正常细胞的杀伤毒性,这是降低化疗药物不良反应的关键。且透明质酸自身也具有很多优势,水溶性好,生物可降解,生物相容性好,无毒,无免疫原性,容易进行化学修饰等。
附图说明
[0023]
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示例性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
[0024]
图1不同纳米脂质体包载药物比较图;
[0025]
图2冻干后透射电镜图;
[0026]
图3冻干后粒径图;
[0027]
图4冻干后制剂的粒径。
[0028]
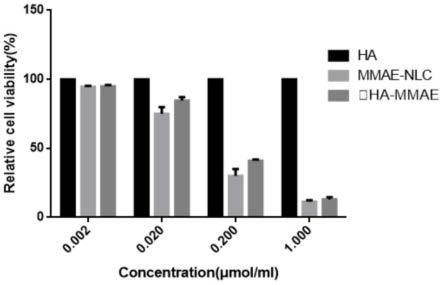
图5抗肿瘤活性评价结果。
具体实施方式
[0029]
应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本发明使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
[0030]
一种透明质酸-海兔毒素结合物,所述结合物的化学式为ha-mmae,其中,透明质酸与海兔毒素10衍生物通过共价键连接。
[0031]
基于上述结合物,本发明还针对透明质酸-海兔毒素结合物中所需的透明质酸、海兔毒素等成分的用量进行了探究。经验证,ha浓度为0.5~0.6mg/ml,ha与mmae纳米脂质体的质量比为1:3~4,构建的透明质酸修饰载mmae纳米脂质载体系统的显著增加了稳定性高,药物的包载率和主动靶向性。
[0032]
一种透明质酸-海兔毒素结合物的制备方法,包括:
[0033]
釆用溶融乳化低温固化法制备载mmae纳米脂质载体;
[0034]
采用电荷吸附法制备透明质酸修饰mmae纳米脂质载体。
[0035]
在一些实施例中,制备载mmae纳米脂质载体的具体步骤包括:
[0036]
取mmae,单硬脂酸甘油酯,注射用大豆卵磷脂和大豆油,加入乙醇,超声溶解,形成油相;
[0037]
取ctab的水溶液,形成水相,水浴加热至70~80℃,在搅拌条件下,将油相加至水相中,并继续搅拌乳化,最后置于冰浴下搅拌固化,即得。
[0038]
在一些实施例中,制备载mmae纳米脂质载体的具体条件为:药脂比1:30~40,脂质浓度为1~1.5mg/ml,固液脂质比为3~4:1,油水相比为1:20~25,表面活性剂浓度为0.1~0.15%,乳化温度为70~80℃,滴加速度为18~20ml/h,搅拌速度为600~650rpm。
[0039]
在一些实施例中,制备透明质酸修饰mmae纳米脂质载体的具体步骤包括:取将mmae纳米脂质载体滴入至透明质酸溶液中,进行反应,即得。
[0040]
在一些实施例中,所述制备透明质酸修饰mmae纳米脂质载体的具体工艺条件为:ha分子量30万,ha浓度为0.5~0.6mg/ml,ha与mmae纳米脂质体的质量比为1:3~4,滴加速度为20~25ml/h,搅拌速度为600~650rpm。
[0041]
一种药物组合物,所述药物组合物中包括第一方面所述透明质酸-mmae结合物。
[0042]
所述药物组合物可以为以下制剂形式:固体制剂形式的粉剂、胶囊剂、片剂、膜剂;液体制剂形式的溶液剂、合剂、糖浆剂、酊剂、注射剂;半固体制剂的膏剂和栓剂等。优选的,所述药物组合物中,还包括必需的载体。本技术中所述“必须的载体”主要表示药物产品中所必需的辅料,主要包括油相、水相、赋形剂等。
[0043]
进一步的,所述油相包括例如烃、酯、动植物油和脂肪、蜡、虾虎油、高级脂肪酸、高级醇、硅酮类物质、固醇和树脂、以及通过酶(例如,水解和酯交换)或化学(例如,酯交换和氢化)处理的上述物质;具体的实例如杏仁油、坚果油、鳄梨油、猴面包树油、茶花油、胡萝卜油、蓖麻油、香茅油、椰子油、酸果蔓籽油、葡萄籽油、大麻籽油、霍霍巴油、澳洲坚果油、草甸泡沫种子油、燕麦润肤剂、红树莓种子油、玫瑰果油、大豆油、菜籽油、玉米油、芝麻籽油、棉籽油、红花油、葵花籽油、花生油、胚芽油、夏威夷果油、大蒜油、山茶油、棕榈油、橄榄油、亚麻籽油、桉树油、月见草油、乌龟油、貂油、猪油、牛脂、马油、蛇油、鱼油、蛋黄油;液体石蜡、异链烷烃、凡士林、角鲨烷、角鲨烯、松节油、聚乙二醇、肉豆蔻酸异丙酯、肉豆蔻酸异棕榈酰酯、2-肉豆蔻酸辛基十二烷基酯、2-乙基己酸十六烷基酯、三-2-乙基甘油酯己酸、甘油三辛酸酯、辛酸和癸酸的混合脂肪酸甘油三酸酯、新戊二醇二-2-乙基己酸酯、苹果酸二异硬脂基酯、异壬酸异壬酸酯(3,5,5-三甲基己基-3'、5'、5'-三甲基己酸)、胆固醇12-羟基硬脂酸酯、二季戊四醇和异硬脂酸和/或高级脂肪酸的单酯至六酯、对甲氧基肉桂酸和2-己酸的甘油酯、对甲氧基肉桂酸异辛酯、三硬脂酸甘油酯、松香、胆固醇、植物甾醇、羊毛脂、肉豆蔻酸、棕榈酸、异棕榈酸、硬脂酸、异硬脂酸、油酸、亚油酸、亚油酸、蓖麻油酸、12-羟基硬脂酸酸、10-羟基硬脂酸、山嵛酸、芥酸、花生四烯酸、二十碳五烯酸、二十二碳六烯酸、肉豆蔻醇、鲸蜡醇、硬脂醇、异硬脂醇、山嵛醇、羊毛脂醇、石蜡、微晶蜡、蜜蜂蜡、乳木果油、凡士林、硬脂、巴西棕榈蜡、小烛树蜡、米糠蜡、向日葵蜡、浆果蜡、杨梅果蜡、月桂树蜡、日本蜡、虫胶、二甲基聚硅氧烷、甲基苯基聚硅氧烷。
[0044]
上述载体中成分的具体选择根据药物组合物的制剂形式决定,固体形式如膏剂、乳剂中的油相成分可从上述原料中选择一种或多种植物性油、动物油脂、黄油、蜡进行组合。水溶性的软膏制剂中,至少包括一种聚乙二醇类成分。
[0045]
进一步的,所述赋形剂为包括但不限于增稠剂、胶凝剂、中和剂、吸留剂、抗氧化剂、缓冲剂、ph调节剂、填充剂、乳化剂、助乳化剂、润肤剂、溶剂、稳定剂、增溶剂、增硬剂、助悬剂、粘合剂、增粘剂、渗透促进剂、防腐剂、螯合剂、崩解剂、增塑剂、湿润剂、香料等。
[0046]
所述抗氧化剂的实例如抗坏血酸(维生素c)、谷胱甘肽、硫辛酸、尿酸、生育酚(维生素e)、丁基化羟基甲苯(bht)、丁基化羟基茴香醚(bha)、胡萝卜素或泛醇(辅酶q)。
[0047]
所述胶凝剂的实例如西黄蓍胶、海藻酸钠、果胶、硅酸盐(例如气相二氧化硅)、明胶、纤维素衍生物(例如甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素)、卡波姆、瓜尔豆胶、聚乙烯醇粘土等。
[0048]
所述渗透促进剂的实例如油酸、卵磷脂、尿素、丁香油、肉豆蔻酸异丙酯、薄荷醇、香芹酚、芳樟醇、柠檬烯、香叶醇、橙花醇、丙二醇双戊四酸酯或环糊精。
[0049]
所述抗菌防腐剂的实例如羟基苯甲酸甲酯、羟基苯甲酸丙酯、氯甲酚、苯甲酸、硝酸苯汞、氯化苯扎氯铵、乙酸洗必太、苄醇或汞。
[0050]
所述螯合剂的实例如柠檬酸或马来酸。
[0051]
所述润滑剂的实例如聚乙二醇、甘油或山梨糖醇。
[0052]
所述香料的实例如薰衣草油、玫瑰油、柠檬油、石灰油、佛手柑油、橙油、petgragrain油、橘油、洋甘菊油、肉桂油、鼠尾草精油、柏树油、天竺葵油、姜油、杜松油、马郁兰精油、桃金娘油、橙花油、松木油、紫檀木油、依兰油、雪松木油、茉莉花油、乳香油、没药油、广藿香油、檀香油或刺五加油。
[0053]
所述乳化剂的实例如烷基硫酸盐、肥皂、十二烷基苯磺酸盐、乳酸酯、磺基琥珀酸酯、单酸甘油酯磺酸盐、磷酸酯、硅氧烷、牛磺酸盐等。
[0054]
本发明第四方面,提供第一方面所述透明质酸-mmae结合物、第三方面所述药物组合物在肿瘤治疗中的应用。
[0055]
上述技术方案中,所述药物通过抑制微管蛋白聚合而起到有效的有丝分裂抑制作用,其用于包括但不限于黑色素瘤、乳腺癌、小细胞肺癌、卵巢癌、结肠癌、前列腺癌、子宫内膜癌等多种肿瘤,抗肿瘤作用范围广泛。
[0056]
下面结合具体的实施例,对本发明做进一步的详细说明,应该指出,所述具体实施例是对本发明的解释而不是限定。
[0057]
实施例1建立mmae纳米脂质体
[0058]
在固体脂质纳米粒的生产过程中,药物在起始步骤便溶解于经高温熔融的液态脂质中,待温度下降以后,固态脂质固化,此时药物会在固态脂质中结晶导致药物析出。纳米结构脂质载体通过加入液态脂质,在温度下降以后,脂质不会全部固化,减少药物析出。相比于固体脂质纳米粒,纳米结构脂质载体的优势在于提高载药量和实现药物缓控释。
[0059]
釆用溶融乳化低温固化法制备载mmae纳米脂质载体。纳米脂质载体物理包载mmae。精密称取处方量的mmae,单硬脂酸甘油酯,注射用大豆卵磷脂和大豆油,加入一定量的乙醇,超声溶解,形成油相。量取含有0.3%ctab的水溶液40ml,形成水相,置于100ml烧杯中,并水浴加热至70℃。在600rpm的搅拌速度下,油相以20ml/h的速度逐滴滴加至水相中,滴加完继续搅拌乳化15min,最后置于冰浴下搅拌固化30min,即得载mmae纳米脂质载体。
[0060]
所述制备方法还包括对产物的包封率和载药量测定过程。
[0061]
具体如下:精密量取100μl mmae纳米脂质载体混悬液置于管中,然后加入4.9ml 2%吐温80-pbs(0.05mmol/ml,ph=7.4)溶液,涡旋5min,使游离药物mmae完全溶解。把混悬液置于高速离心机下,以15000r/min的转速离心30min。取一定量上清液,经适量稀释后,测定上清液中游离药物的量;同时取等量的载mmae纳米脂质载体混悬液用甲醇破乳,稀释至适量,过0.22μm滤膜,进样20μl,测定药物总量。
[0062]
按照以下公式计算出药物的包封率:
[0063]
ee%=(w
总-w
上清
)/w
总
×
100
[0064]
dl%=(w
总-w
上清
)/w
nlc
×
100
[0065]
其中w
总
为mmae纳米脂质载体混悬液中药物总量,w
上清
为上清中游离药物量,w
nlc
为单硬脂酸甘油醋、磷脂、大豆油和药物的总质量。
[0066]
计算所得纳米脂质体的包封率为91%。
[0067]
mmae纳米脂质体确定的最优处方及工艺为:药脂比1:30,脂质浓度为1mg/ml,固液脂质比为3:1,油水相比为1:20,表面活性剂浓度为0.1%,乳化温度为70℃,滴加速度为18ml/h,搅拌速度为600rpm。
[0068]
实施例2透明质酸修饰mmae纳米脂质体
[0069]
本实施例采用ha作为靶向因子,利用电荷吸附作用,对mmae-nlc表面进行靶向修饰,以实现高效、低毒和主动革向的目的。ha表面含有羧基,与mmae-nlc表面正电荷相互作用,吸附在表面,制备简单,原料易得,无需化学合成,节省时间和成本。
[0070]
采用电荷吸附法制备透明质酸修饰mmae纳米脂质载体。量取0.5%透明质酸溶液10ml置于烧杯中,在600rpm搅拌速度下,以20ml/h滴加速度把一定体积的mmae纳米脂质载体滴入至透明质酸溶液中,滴加完继续搅拌10min,即得透明质酸修饰mmae纳米脂质载体(ha-mmae)。
[0071]
透明质酸修饰mmae纳米脂质体确定的最优处方及工艺为:ha分子量30万,ha浓度为0.5mg/ml,ha与mmae纳米脂质体的质量比为1:3,滴加速度为20ml/h,搅拌速度为600rpm。
[0072]
针对上述不同纳米脂质体药物的包封率,透明质酸-mmae的结合物的理化性质包括形态、粒径、电位进行了评价,测试结果图1-图5所示。
[0073]
结果表明,冻干后粒径为约150μm。冻干后ha-mmae性质稳定,和冻干前相比,理化性质基本无变化。
[0074]
针对上述透明质酸-mmae的结合物的药效包括体外释放情况和体外细胞毒性进行了评价:
[0075]
(1)体外释放情况考察:精密量取ha组、mmae-nlc组、ha-mmae组各1ml置于透析袋(截留分子量8000-10000中,再置于30ml含1m水杨酸钠的pbs(0.05mol/l,ph=7.4)溶液中,37℃下恒温振荡,振荡速度100rpm/min,于不同的时间点取出介质1ml,同时把剩余的介质弃去,重新更换新的释放介质30ml,取出的介质采用hplc法测定药物浓度,计算累积释放率,绘制释放曲线,并拟合释放数学模型。
[0076]
(2)体外细胞毒性考察:选择三种肿瘤细胞系,采用mtt法测定ha组、mmae-nlc组、ha-mmae组对三种肿瘤细胞系的生长抑制作用,同时设置对照组及空白组。
[0077]
取对数生长期二种肿瘤细胞混悬液100μl(约4000个),分别置于96孔培养板中。然后置于co2培养箱中,保持培养箱的环境恒定:温度37℃,co2含量5%,饱和湿度。细胞培养24h后,分别加入100μl不同浓度(0.002,0.02,0.2,1μmol/ml)的ha、mmae-nlc、ha-mmae,继续培养96h。然后在96孔板中分别加入mtt,20μl/孔,继续孵育4h。最后弃去孔内上清液,加入200μldmso,并在摇床上振荡5min,每组均有6个平行孔,并重复3次。最后,用酶联免疫检测仪测定吸收度,考察各组制剂的体外抗肿瘤活性,测试结果如图5所示。
[0078]
由此可知,本发明的透明质酸(ha)修饰的mmae结合物,使药物靶向于肿瘤细胞,增加药物在肿瘤部位的浓集,可以提高药效,降低给药剂量。
[0079]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1