羊油在制备增强机体免疫功能药品中的应用的制作方法
1.本发明涉及食用油脂技术领域,具体涉及羊油在制备增强机体免疫功能药品中的应用。
背景技术:
2.油脂是机体重要的能量来源,维持着人体的各项生理活动。研究显示,不同种类的油脂对于机体免疫的调节同样具有重要的作用,最具典型代表的是鱼油和橄榄油。鱼油补充肠外营养可以减轻腹腔脓毒症大鼠急性肺损伤,调节免疫反应,减轻炎症反应(nutr res,2015,35(9):784-791)。而橄榄油对包括系统性红斑狼疮在内的各种免疫炎症性疾病具有预防作用(br j nutr,2018,120(6):681-692)。因此,筛选并发现更多的潜在功能油脂增强免疫力具有重要的研究价值。
3.羊油具有重要的药用价值,可以作为炮制辅料用于中药材的配制。在哈萨克医学中羊油被广泛用于治疗多种疾病。羊油中除常见的棕榈酸c16:0和硬脂酸c18:0和油酸c18:1之外,还含有反刍动物特有的奇数脂肪酸,以及部分支链脂肪酸和共轭亚油酸。含有这些脂肪酸的羊油是否具有增强免疫功能的作用还未见报道。
技术实现要素:
4.本发明的目的在于提供了一种羊油在制备增强机体免疫功能药品中的应用,以充分利用羊油的药用价值以及提供更多的药品。
5.本发明通过以下技术方案来实现上述目的:
6.羊油在制备增强机体免疫功能药品中的应用,所述羊油中含有脂肪酸c16:0、c18:0、c18:1以及c17:0。
7.进一步改进在于,所述应用包括增强单核巨噬细胞的吞噬效果、合成促进免疫的细胞因子能力、减少食源性细菌感染的能力。免疫力相关检测细胞可以为人thp-1细胞和鼠源raw264.7细胞。
8.进一步改进在于,所述羊油取自草原领头羊、蒙鑫伊族羊、阿勒泰羊或哈萨克羊等品种,其中草原领头羊和蒙鑫伊族羊的羊油中c17:0含量较高。
9.进一步改进在于,所述羊油是通过加热熬制、除菌、过滤工序处理后获得的食品安全级别油脂。
10.进一步改进在于,所述功能药品的类型包括药品补充剂、特医油脂或保健功能药品。
11.本发明的有益效果在于:羊油属于一种食用油脂,本发明首次探明了羊油对机体免疫细胞的激活、发挥免疫作用方面具有积极效果,尤其是对单核巨噬细胞的抗细菌感染作用方面。为今后增强免疫力提供了成本低廉、效果优化的功能药品,具有重要意义。
附图说明
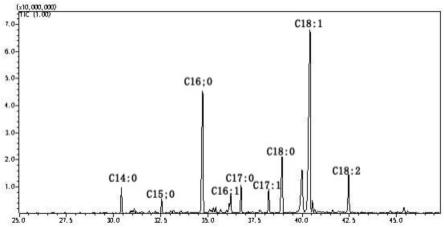
12.图1为羊油中各种脂肪酸组成分析示意图;
13.图2为羊油添加后对2种单核巨噬细胞吞噬中性红的影响示意图;
14.图3为羊油对单核巨噬细胞中活性氧产生的影响示意图;
15.图4为羊油对单核巨噬细胞中一氧化氮产生的影响示意图;
16.图5为羊油对单核巨噬细胞中不同细胞因子产生的影响示意图;
17.图6为羊油对单核巨噬细胞抵抗单增李斯特杆菌感染的影响示意图;
18.图7为羊油对单核巨噬细胞中脂滴的影响示意图。
具体实施方式
19.下面结合附图对本技术作进一步详细描述,有必要在此指出的是,以下具体实施方式只用于对本技术进行进一步的说明,不能理解为对本技术保护范围的限制,该领域的技术人员可以根据上述申请内容对本技术作出一些非本质的改进和调整。
20.下述实施例中的实验方法,如无特殊说明均为常规生化方法;下述实施例中所用的试验材料如无特殊说明均为常规生化试剂公司购买所得。其中,实验所用thp-1(人急性单核白血病细胞)、raw264.7(小鼠单核巨噬细胞)、单核李斯特杆菌(listeria monocytogenes,lm)cmcc(b)54002均可在市面购买得到,其他试验材料见表1。以下实施例中的实验均设置三次重复实验,结果取平均值,*表示p《0.05,**表示p《0.01,***表示p《0.001。
21.羊油可以来源于草原领头羊、蒙鑫伊族羊、阿勒泰羊、哈萨克羊、苏尼特羊或乌珠沁羊等品种,加热熬制,并用纱布过滤,4℃分装保存,这些油的理化性质,如酸值、碘值等均符合动物油脂食品安全国家标准并与文献报道基本一致。4℃分装保存6个月后,12个月后再次检测性状稳定。
22.表1:实验材料的来源
23.表1实验材料及来源
[0024][0025]
一、羊油脂肪酸组分检测
[0026]
取0.04g油脂于10ml玻璃管中,加入3ml的正己烷,待其充分溶解后,再加入
1.5ml0.5mol/l的koh-ch3oh饱和溶液,最后混合均匀,40℃静置30min,待分层后,取上层液于样品瓶中,上机检测。
[0027]
gc-ms检测条件:使用sh-fame wax毛细管气相色谱柱进行检测。将样品按顺序上样,样品进样量为1μl,以氮气作为载气进行检测。以分流比为10:1进行分流进样,离子源温度为240℃,进样口的温度为250℃。柱前压为278.6kpa,初始柱温为130℃,然后以以4℃/min的速度升到220℃,再保留10min。电子能量为70ev,扫描范围为35-650m/z。
[0028]
检测结果表明羊油中的脂肪酸主要由c16:0、c18:0和c18:1组成,还有反刍动物中特有的脂肪酸c17:0,同时含有一些支链脂肪酸。不同品种羊来源的羊油检测结果大体相同(如图1所示)。并将羊油用dmso进行溶解,用于后续实验分析。
[0029]
二、羊油对巨噬细胞吞噬功能的影响
[0030]
取对数生长期细胞,制备细胞悬液,按照每孔100μl的细胞悬液,细胞密度为1
×
104个/孔,待细胞贴壁(thp-1细胞需加入终浓度为100ng/ml的pma试剂诱导贴壁)。加入浓度为2、4、6、8、10mg/ml的羊尾油(stf)、dmso和lps溶液(5μg/ml),继续培养24h。吸掉上清,迅速向每孔中加100μl0.1%的中性红,继续孵育1h。用pbs洗三次后加入用5ml冰醋酸和5ml无水乙醇配成的细胞裂解液,放置3h后用多功能酶标仪上检测od450nm的值。吞噬试验结果显示raw264.7细胞和thp1细胞在加入2、4、6、8、10mg/ml的stf时相对于溶剂对照组吞噬中性红的能力显著增强(如图2所示)。因此证明stf能在一定条件下提高巨噬细胞的吞噬活性,激活巨噬细胞。
[0031]
三、羊油对巨噬细胞活性氧生成的影响
[0032]
取对数生长期细胞,制备细胞悬液,按照每孔1.5ml的细胞悬液,细胞密度为1
×
105个/孔,待细胞贴壁(thp-1细胞需加入终浓度为100ng/ml的pma试剂诱导贴壁)。然后加入dmso和浓度为4和8mg/ml的stf孵育12h,再加入终浓度5μg/ml的lps处理12h。pbs洗一遍后加胰酶消化,离心收集细胞,在4℃离心机中用pbs洗3遍。提前稀释探针dcfh-da(比例为1:1000),荧光易淬灭所以稀释过程需要用锡箔纸包裹进行避光。将稀释好的带有探针的培养基与收集好细胞混匀,用锡箔纸包住避光,37℃孵育30min,每隔4min拿出来轻轻混匀一次。20min后4℃、2000rpm离心去上清,用培养基离心洗3次后重悬细胞,移至流式细胞仪配套的管子中,避光放冰上备用。使用流式细胞仪进行检测,检测到dcfh-da的荧光强度越强,表示产生ros的量越多。活性氧检测实验结果表明stf能促进raw264.7和thp1细胞中ros的生成,进而激活巨噬细胞(如图3所示)。
[0033]
四、羊油对巨噬细胞产生一氧化氮(no)的影响
[0034]
取对数生长期细胞,制备细胞悬液,按照每孔1.5ml的细胞悬液,细胞密度为1
×
105个/孔,待细胞贴壁(thp-1细胞需加入终浓度为100ng/ml的pma试剂诱导贴壁)。加入浓度为2、4、6、8、10mg/ml的stf、dmso和lps溶液(5μg/ml),继续培养24h。收集细胞上清,然后取50μl加入96孔板。再先后向每孔加50μlgriessⅰ和griessⅱ,检测540nm处的吸光值。no检测结果表明stf能促进raw264.7和thp1细胞中no的生成(如图4所示)。
[0035]
五、elisa检测羊油对lps激活的巨噬细胞产生细胞因子的影响
[0036]
取对数生长期细胞,制备细胞悬液,按照每孔1.5ml的细胞悬液,细胞密度为1
×
105个/孔,待细胞贴壁(thp-1细胞需加入终浓度为100ng/ml的pma试剂诱导贴壁)。然后加入dmso和浓度为4、8mg/ml的stf孵育12h,再加入终浓度5μg/ml的lps处理12h。收集细胞上
清液,离心取上清。参照说明书要求稀释标准品,溶解后30min内用完。检测抗体(100
×
)浓缩液和hrp标记抗体/hrp标记链霉素亲和素(100
×
)先瞬时离心后按1:100的比例稀释后备用。洗涤液(20
×
)使用前先平衡室温,然后以1:100的比例用超纯水稀释后备用。根据实验用量取出酶标条,分别向每孔加入100μl标准稀释液和待测样品稀释液,然后贴上封板膜,37℃培养箱中孵育2h。然后揭开封板膜,提前准备好纱布,轻柔地将液体拍出,加满洗涤液(1
×
)洗涤4次。加入100μl的1
×
检测抗体,盖膜,继续孵育1h。揭开封板膜,提前准备好纱布,轻柔地将液体拍出,加满洗涤液(1
×
)洗涤4次。100μl1
×
hrp标记抗体加到每孔,贴上封板膜,孵育40min。揭开封板膜,重复用洗涤液(1
×
)洗涤4次后加100μl tmb显色液,用锡箔纸包好后置于37℃孵育,显色后可以看到溶液变蓝。20min后不用洗涤直接加100μl终止溶液,颜色变为黄色。以630nm为矫正波长,用多功能酶标仪检测od450nm时的读数,加样后5min内读数。elisa检测结果表明stf能增加已被激活的raw264.7细胞中il-6和il-1β的分泌量(如图5所示)。
[0037]
六、羊油保护巨噬细胞抵抗lm感染的作用
[0038]
取对数生长期细胞,制备细胞悬液,按照每孔1.5ml的细胞悬液,细胞密度为1
×
105个/孔,待细胞贴壁(thp-1细胞需加入终浓度为100ng/ml的pma试剂诱导贴壁)。然后分别加入浓度为4、8mg/ml的stf和dmso,继续培养24h。细菌加入细胞时的moi=100,37℃、5%co2的培养箱中培养1h。然后吸出上清,用pbs洗一遍后加入终浓度100μg/ml硫酸庆大霉素处理1h。接着再用pbs洗一遍换终浓度的25μg/ml硫酸庆大霉素处理24h。然后加入1ml0.25%的tritonx-100,30min后梯度稀释细胞裂解液,用移液器吸取10μl稀释液均匀点在lb平板上,37℃孵育24h后统计菌落克隆数。抗感染实验结果表明stf能有效抑制lm在thp1和raw264.7细胞中的繁殖,表明stf能保护巨噬细胞抵抗lm的感染(如图6所示)。
[0039]
七、羊油加入后脂滴的积累
[0040]
取对数生长期细胞,制备细胞悬液,按照每孔1.5ml的细胞悬液,细胞密度为1
×
105个/孔,待细胞贴壁(thp-1细胞需加入终浓度为100ng/ml的pma试剂诱导贴壁)分别加入浓度为4、8mg/ml的stf和dmso,继续培养24h。pbs洗3遍后加入4%的多聚甲醛,30min后加入配制好油红o溶液,37℃培养箱孵育1h。60%的异丙醇冲洗一遍洗去细胞表面多余的油红o溶液,pbs洗三遍后移至荧光倒置显微镜下观察。观察结束后用异丙醇溶解细胞中的油红,收集溶解液,检测其在510nm处的吸光值。脂滴检测结果显示stf在8mg/ml时脂滴有明显的积累,表明stf可能对thp1细胞具有一定的抗菌作用(如图7所示)。
[0041]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1