一种组织选择性递送核酸药物的类脂质纳米颗粒及其制备方法和应用
本发明涉及一种组织选择性递送核酸药物的类脂质纳米颗粒及其制备方法和应用,属于生物医药领域。
背景技术:
1、基因治疗作为一种新型的疾病治疗方式,在治疗遗传性疾病、癌症以及开发疫苗等方面被广泛应用。基因治疗的基本原理是将功能性的正常基因导入目标细胞中,对异常基因进行纠正或补偿缺陷进而实现疾病治疗。目前,常用于基因治疗的核酸药物主要包括质粒dna(pdna)、反义核酸(aso)、小干扰rna(sirna)、信使rna(mrna)、微小rna(microrna)及grispr-cas9基因编辑系统等。与小分子药物和抗体类药物相比,核酸药物表现出显著优势,例如作用范围广、对细胞内外均可发挥调节作用、易于设计等。然而,目前核酸药物的发展仍面临重重障碍:1)分子量比较大且常带负电荷使其无法顺利通过细胞膜导致细胞摄取效率低;2)稳定性差,易被体内外的酶降解;3)具有免疫原性,被免疫系统识别后激发免疫反应;4)进入生物体内后易被肝脏肾脏清除;5)进入细胞后内涵体逃逸效率低。因此,研发安全高效的递送载体以弥补核酸药物的固有缺陷对于实现基因疗法至关重要。
2、近年来,各种天然或合成材料形成的纳米颗粒,如脂质及类脂质、聚合物、多肽、蛋白质、细胞外囊泡和无机纳米粒子等,已被设计用于核酸药物的体内外递送。其中,基于脂质及类脂形成的纳米颗粒(lnp)由于具备良好的生物相容性、低免疫原性以及易于批量制备等优势,目前已被广泛用于核酸药物体内外递送并对其优化方案进行了深入研究。最近,辉瑞和moderna研发的基于lnp的covid-19mrna疫苗获得使用许可,这再次引起了研究者们对lnp作为基因递送载体的关注,成为目前最热门的递送系统。此外,聚合物及其衍生物形成的纳米颗粒因易于合成已成为核酸药物体内外递送载体的重要组成部分。用于基因递送的聚合物应易于在体内降解且不会产生有毒成分。其中,线型或支状聚乙烯亚胺(pei)是一种广泛用于体内外核酸递送的经典阳离子聚合物,可以单独使用也可以通过修饰提高转染效率,例如:tarn3c10,dd90-c12-122和氨基聚酯(ape)在联合其他脂质后能够将mrna传递到体内并达到理想的转染效率和安全性结果。
3、基于核酸药物的治疗方式在应对遗传病、癌症、传染病以及其他疾病方面有着光明的应用前景,目前在相关技术上也实现了一定的突破。然而,在基因递送、脱靶和免疫原性这些关键问题上依旧存在重大挑战。在基因递送方面,与其他递送方式相比,基于纳米颗粒的各种制剂介导的转染表现出明显的优势,例如易于制造,不同批次重复性好,良好的生物相容性,能够增强核酸药物在体内的稳定性进而提高药物的生物利用度等,尤其是脂质纳米颗粒已成为最先进的核酸非病毒递送系统之一。然而,目前核酸药物递送系统面临的一个巨大挑战是其组织选择性。已研发的常用纳米颗粒通过静脉注射后倾向于在肝脏中聚集,最终被肝细胞吸收,易被肝脏清除,导致效果变弱,虽然已有研究解决了易被肝脏清除的难题,但均是采用联合生物靶向分子或者调节助剂组分来实现核酸药物的组织选择性递送。
4、因此,设计优化纳米递送系统,在不使用生物分子靶向技术或不改变材料本身外助剂组分的前提下,将核酸药物通过全身递送后选择性地转移至非肝脏组织,是当前的一个难题。
技术实现思路
1、为克服当下核酸药物递送系统的局限性,无法实现体内组织选择性递送,尤其是需要借助联合生物靶向分子或者调节助剂组分,完成全身递送后的组织选择性富集与转染的难题,本发明提供一种组织选择性递送核酸药物的类脂质纳米颗粒及其制备方法和应用。
2、本发明是采用如下技术方案实现的:
3、一种组织选择性递送核酸药物的类脂质纳米颗粒,所述的类脂质纳米颗粒按质量百分比计,是由如下组分组成:
4、可电离两亲性聚合物30~80%,辅助脂质5~60%,生物稳定增强剂5~40%,
5、所述的可电离两亲性聚合物是由头部富含胺基的聚合物与尾链含疏水烃基的脂质通过加成反应得到,所述辅助脂质为类固醇或类固醇与永久阳离子脂质的混合,所述生物稳定增强剂为聚乙二醇化脂质。
6、根据本发明优选的,头部富含胺基的聚合物为聚乙烯亚胺(pei)。
7、进一步优选的,聚乙烯亚胺(pei)为线性pei(lpei)或支状pei(bpei)。
8、最为优选的,聚乙烯亚胺(pei)为支状pei(bpei)。
9、根据本发明优选的,聚乙烯亚胺(pei)的分子量为0.3kda-20kda。
10、进一步优选的,聚乙烯亚胺(pei)的分子量为0.3kda-10kda。
11、根据本发明优选的,尾链含疏水烃基的脂质为丙烯酸酯、丙烯酰胺或环氧化物。
12、进一步优选的,尾链含疏水烃基的脂质为丙烯酸酯,丙烯酸酯为含直链烷基尾链的丙烯酸酯,直链烷基碳原子数为c1~c18。
13、最为优选的,直链烷基碳原子数为c10~c14。
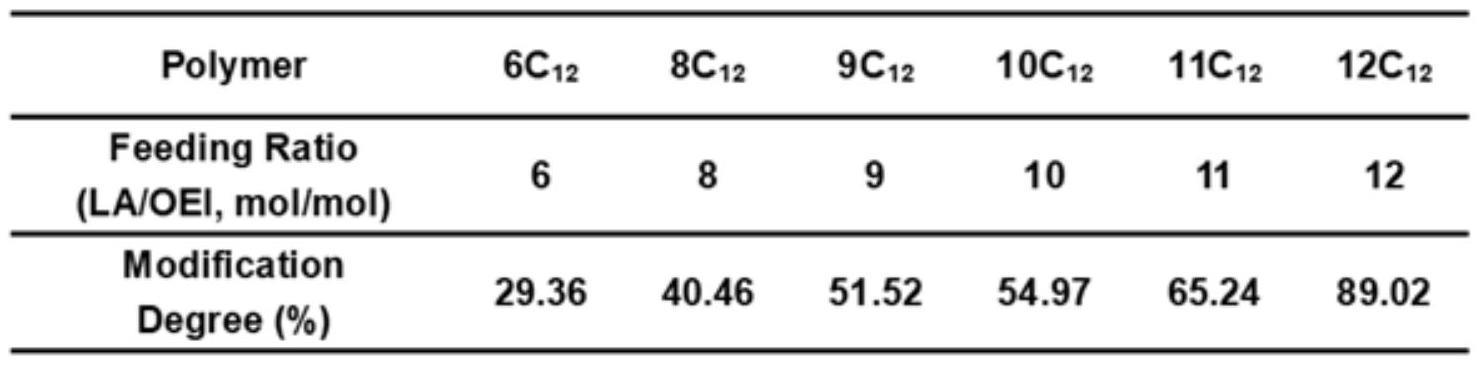
14、根据本发明优选的,所述的可电离两亲性聚合物是由头部富含胺基的聚合物与尾链含疏水烃基的脂质通过加成反应得到,尾链含疏水烃基的脂质与头部富含胺基的聚合物的摩尔比为0.1-14:1。
15、进一步优选的,尾链含疏水烃基的脂质与头部富含胺基的聚合物的摩尔比为6-12:1。
16、尾链含疏水烃基的脂质与头部富含胺基的聚合物的摩尔比越高,可电离两亲性聚合物的修饰度越高,不同修饰度可电离两亲性聚合物得到的类脂质纳米颗粒作用及效果不同。
17、根据本发明优选的,加成反应为80℃-100℃,反应时间为24-72小时。
18、进一步优选的,加成反应为85℃-95℃,反应时间为48-72小时。
19、根据本发明优选的,类固醇选自胆固醇、β-谷甾醇、岩皂甾醇、豆甾醇、麦角固醇或豆甾烷醇。
20、根据本发明优选的,永久阳离子脂质选自(2,3-二油酰基-丙基)-三甲基氯化铵(dotap)、双十八烷基二甲基溴化铵(ddab)或1,2-双十八烯氧基-3-甲基铵丙烷(氯盐)(dotma)。
21、根据本发明优选的,当辅助脂质为单独的类固醇时,类固醇的质量百分比为5~20%。
22、根据本发明优选的,当辅助脂质为类固醇与永久阳离子脂质的混合物时,类固醇的质量百分比为5~20%,永久阳离子脂质的质量百分比为5~40%。
23、根据本发明优选的,单独的类固醇与类固醇、永久阳离子脂质的混合物中类固醇的用量相同。
24、根据本发明优选的,聚乙二醇化脂质选自二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(dspe-peg)、1,2-二肉豆蔻酰-rac-甘油-3-甲氧基-聚乙二醇2000(dmg-peg)、d-α琥珀酸生育酚聚乙二醇酯(tpgs)、2-豆蔻酸锡酰-3-磷脂乙醇胺-聚乙二醇2000(dmpe-peg)、l-磷脂酰乙醇胺-聚乙二醇2000(dppe-peg)、1,2-二棕榈酰基-sn-甘油-聚乙二醇2000(dpg-peg)、1,2-二硬脂酰基-sn-甘油-聚乙二醇2000(dsg-peg)。
25、本发明选自的各种聚乙二醇化脂质均为现有技术,参见文献:surface de-pegylation controls nanoparticle-mediated sirna delivery in vitro and invivo,xi zhu等。
26、根据本发明优选的,聚乙二醇化脂质为二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(dspe-peg)或1,2-二肉豆蔻酰-rac-甘油-3-甲氧基-聚乙二醇2000(dmg-peg)。
27、根据本发明优选的,所述的类脂质纳米颗粒按质量百分比计,是由如下组分组成:
28、可电离两亲性聚合物36~58%,辅助脂质10~40%,生物稳定增强剂18~38%。
29、上述组织选择性递送核酸药物的类脂质纳米颗粒的制备方法,包括步骤如下:
30、1)将可电离两亲性聚合物、辅助脂质和生物稳定增强剂溶解在有机溶剂中,形成脂质预混液,
31、2)将脂质预混液滴加到缓冲液中,形成类脂质纳米颗粒。
32、根据本发明优选的,所述有机溶剂为无水乙醇。
33、根据本发明优选的,所述缓冲液为醋酸-醋酸钠缓冲液,ph为5.2-7.2。
34、根据本发明优选的,有机溶剂的用量为溶解量。
35、根据本发明优选的,缓冲液的用量为使所得混合物为胶状分散体。
36、上述组织选择性递送核酸药物的类脂质纳米颗粒的应用,用于递送治疗药物。
37、根据本发明优选的,所述治疗药物为小分子、蛋白和核酸其中的一种或几种混合。
38、根据本发明优选的,所述治疗药物为核酸。
39、根据本发明优选的,核酸选自反义寡核苷酸(aso)、小干扰rna(sirna)、信使rna(mrna)、微小rna(microrna)、规律成簇间隔短回文重复序列(grispr)相关核酸、单向导rna(sgrna)以及质粒dna(pdna)。
40、根据本发明优选的,具体应用方法如下:
41、将治疗药物与上述类脂质纳米颗粒混合,形成类脂质纳米颗粒-核酸药物复合物,将类脂质纳米颗粒-核酸药物复合物施用至生物体上,在生物体内实现递送,进行生物组织选择性富集并发挥效用。
42、根据本发明优选的,治疗药物与类脂质纳米颗粒的质量比为1:(0.5-50)。
43、进一步优选的,治疗药物与类脂质纳米颗粒的质量比为1:(7-15)。
44、根据本发明优选的,所述施用方式包括静脉注射、肌肉注射、鼻腔吸入、口服、皮下注射、气管给药。
45、本发明的类脂质纳米颗粒-核酸药物复合物可在心、肝、脾、肺、肾生物体组织上选择性富集并发挥效用。
46、本发明的技术特点及优点:
47、1、本发明的组织选择性递送核酸药物的类脂质纳米颗粒,是基于可电离两亲性聚合物,用于递送治疗药物时,通过调节聚合物自身的固有特性实现了核酸药物在受试生物体内的组织选择性递送,而不需要使用生物分子靶向技术或改变材料本身外助剂组分。
48、2、本发明的组织选择性递送核酸药物的类脂质纳米颗粒,无需采用联合生物靶向分子或者调节助剂组分来实现核酸药物的组织选择性递送,不容易被肝脏清除,在肝脏富集可以发挥效用以抑制肝纤维化的发展。
49、3、本发明的组织选择性递送核酸药物的类脂质纳米颗粒,实现核酸药物在受试生物体内的组织选择性递送的关键是尾链含疏水烃基的脂质与头部富含胺基的聚合物的摩尔比,特定的摩尔比范围内,得到的类脂质纳米颗粒中可电离两性聚合物具有不同的选择性,在其高修饰度时容易携带核酸药物在肝脏富集并发挥效用以抑制肝纤维化的发展,而在低修饰度时更倾向于将核酸药物递送至肺部并发挥效用以抑制肿瘤的肺部转移。
50、4、本发明尾链含疏水烃基的脂质与头部富含胺基的聚合物的摩尔比为6-10:1,可电离两亲性聚合物的修饰度低,低修饰度可电离两亲性聚合物得到的类脂质纳米颗粒对肺选择性强,高选择的富集在肺部用以抑制肿瘤的肺部转移。
51、5、本发明能够激发核酸药物递送领域的进一步突破,促进基因疗法等多种创新治疗模式的开发。
- 还没有人留言评论。精彩留言会获得点赞!