用于预防肿瘤和癌症的组合物和方法与流程
本公开的主题涉及用于诱导针对肿瘤和癌症的体液和细胞免疫的组合物和方法。在一些实施方式中,本公开的主题涉及向有需要的受试者施用针对胃泌素肽的体液或细胞免疫应答的治疗诱导剂和/或与针对肿瘤或癌症的细胞免疫应答的诱导剂组合,以预防包括但不限于胰癌的癌症的发生和/或进展。
背景技术:
1、胰癌,通常称为胰腺导管腺癌(pdac),是一种复杂的疾病,涉及多个细胞生长调节途径中基因突变的连续积累。胰腺上皮内瘤变(panin;hruban et al.,2008)中相对良性的病变开始发展为多种异常基因表达模式、基因组不稳定性,并最终发展为对治疗有抗性的侵袭性癌症。
2、组织学上,pdac通常分化良好并且主要由腺泡导管化生、免疫抑制性炎症细胞的存在、细胞毒性t细胞的缺乏以及致密纤维化基质的存在来定义。这些表现的程度差异很大,并且可能没有明显的临床症状,这使得pdac的早期诊断非常罕见。pdac肿瘤基质由间充质细胞(例如纤维母细胞和胰腺星状细胞(psc))、细胞外基质蛋白、肿瘤周围神经纤维、内皮细胞和免疫细胞组成。影响基质细胞产生丰富的促结缔织增生作用的具体机制涉及生长因子的激活(包括胃泌素)、胶原蛋白和细胞外基质的合成和分泌(zhang et al.,2007),以及血管和细胞因子介导过程的众多调节因子的表达(hidalgo et al.,2012)。
3、侵袭性pdac占导管谱系癌的绝大多数(>85%)。pdac的特点是不受控制的浸润和早期转移。推定的导管腺癌前体是panin显微病变,其经历导管内增殖性变化,并最终经历从panin-1a到panin-3(原位癌)和成熟恶性肿瘤的一系列肿瘤转化。
4、pdac的重要特性是肿瘤细胞表面上胃泌素/肠促胰酶肽受体(cck-b)的异常表达(smith et al.,1994)以及肿瘤高水平胃泌素的表达(prasad et al.,2005)。胃泌素(smith,1995)和肠促胰酶肽(smith et al.,1990;smith et al.,1991)蛋白都会刺激胰腺肿瘤的生长。然而,只有胃泌素还可以通过自分泌机制刺激生长(smith et al.,1996a;smith et al.,1998b),并且抑制胃泌素表达(matters et al.,2009)或阻断cck-b受体功能(fino et al.,2012;smith&solomon,2014)抑制了癌症生长。
5、尽管多年来在治疗许多癌症方面取得了令人印象深刻的成功,但可悲的是,用于pdac的突破性疗法在市场批准方面几乎没有取得成功(参见hidalgo,2010;ryan et al.,2014),这在所有胃肠道恶性肿瘤中预后最差(siegel et al.,2016)。目前pdac的五年生存率约为9-10%,是所有癌症中最低的(siegel et al.,2016)。
6、过去30年来,pdac的不良结果没有显著改变。多学科诊断,然后进行手术、化疗和放射治疗是一线治疗方法。然而,基于小分子化疗药物吉西他滨和5-氟尿嘧啶的疗法并未产生令人满意的结果,并且这些方案的平均生存期仍不足1年(hoff et al.,2011,conroyet al.,2011)。
7、导致存活率低的因素包括无法在早期诊断这种疾病、细胞和解剖肿瘤细胞的异质性、高转移率以及抑制药物渗透和暴露的致密纤维化微环境的存在(neesse et al.,2013)。肿瘤的不可接近导致pdac对标准化疗和免疫治疗药物的相对抗性(templeton&brentnall,2013),并导致这种致命疾病的预后不良。
8、宿主免疫应答是导致pdac顽固性和侵袭性性质的另一个关键因素。pdac微环境中重要的的免疫细胞不支持抗肿瘤免疫(zheng et al.,2013)。相反,这些细胞(包括m2极化巨噬细胞、t调节性(treg)细胞和中性粒细胞)实际上促进肿瘤生长和侵袭。事实上,pdac的标志之一是其逃避免疫破坏的能力(hanahan&weinberg,2011)。
9、包括pdac在内的癌症利用许多工具来逃避和/或击败患者免疫系统的攻击(pardoll,2012;weiner&lotze,2012)。肿瘤代谢环境的成分已被证明可以调节这些应答(feig et al.,2012;quante et al.,2013)。癌症治疗学的一个重大突破是作为免疫抵抗的机制的免疫检查点途径的发现,这些途径通常由肿瘤细胞调节(leach et al.,1996)。已开发出靶向检查点途径中蛋白质的抗体,例如细胞毒性t淋巴细胞相关抗原4(ctla-4)、程序性细胞死亡蛋白1(pd-1)和程序性细胞死亡配体1(pd-l1),并已被证明在临床上可有效逆转某些癌症中的免疫抵抗力,例如黑色素瘤、非小细胞肺癌(nsclc)和肾癌(pardoll,2012)。然而,pdac的特点是免疫学“冷”肿瘤,其微环境以免疫抑制t调节(treg)细胞为主,缺乏cd8+肿瘤浸润效应t细胞(feig et al.,2012;vonderheide&bayne,2013;zheng et al.,2013),且血管化不良。致密基质环境的纤维化性质以及缺乏通过血流的可及性部分地解释了这种观察,pdac对抗pd-1和抗pd-l1抗体的应答至多是适度的(brahmer et al.,2012,zhang,2018)。
10、pdac细胞表面上检查点配体pd-l1的表达水平被认为是对免疫检查点抑制剂免疫疗法应答的另一个决定因素(zheng,2017)。一些研究表明,低水平的pd-l1表达与缺乏对免疫检查点抑制剂的应答相关(soares et al.,2015),并且刺激pd-1或pd-l1表达有助于促进抗检查点蛋白抗体的有效性(lutz et al.,2014)。在pdac的其他研究中,发现pd-l1在大多数肿瘤细胞中以及许多肿瘤样品中高表达(lu et al.,2017)。因此,通过考虑肿瘤中pd-l1的状态并寻求调节pd-l1表达的方法以配合pdac靶向疗法,可以潜在地增强免疫检查点抑制剂疗法的有效性。
11、目前,治疗pdac的临床试验包括组合抗体免疫检查点抑制剂与化疗、放疗、趋化因子失活(olaptesed)、细胞周期蛋白依赖性激酶抑制(阿贝西利)、tgf-β受体i激酶抑制剂(galunisertib)、局灶性粘连激酶抑制剂(地法替尼)、csf1r抑制剂(培西达替尼)、维生素d和聚adp核糖聚合酶抑制剂(尼拉帕利)。这些研究旨在联合可能改善pdac肿瘤微环境中免疫细胞的物理渗透和/或免疫细胞存在的药剂,以及提高免疫检查点抑制剂治疗的有效性。在最近的报告中(smith et al.,2018),抑制cck-b受体功能减少了pdac纤维化,并提高了使用抗pd-1抗体(ab)或抗ctla-4ab的抗体疗法的有效性。
12、鉴于pdac肿瘤的复杂性,需要更深入地了解如何使用新策略来改变患者异质性的pdac微环境的免疫表型,并使肿瘤对化疗和免疫疗法更加敏感。
13、胃癌是另一种毁灭性的癌症,并且特别是胃腺癌是所有癌症中预后最差的癌症之一,其5年生存率至多30%(ferlay et al.,2013)。这种恶性肿瘤的早期检测是难以捉摸的,并且需要有意识的筛查实践,但这种做法并不常用。大多数诊断已处于晚期,中位生存期为9-10个月(wagner et al.,2010;ajani et al.,2017)。目前胃癌的护理标准包括适当时进行手术,然后进行放射和/或使用dna合成抑制剂(如5-氟尿嘧啶)和/或dna损伤剂(如顺铂)进行化疗。
14、用于治疗某些胃癌的靶向疗法也已开始出现。表达人类表皮生长因子受体2(egfr2)的肿瘤可以用曲妥珠单抗(由美国加利福尼亚州南旧金山的genentech,inc.以商品名出售)与化疗联合治疗。一些胃癌也响应抗血管生成药物,例如雷莫芦单抗(由美国印第安纳州印第安纳波利斯市的eli lilly and company以商品名出售)。迫切需要额外的靶向疗法来改善这种普遍恶性肿瘤的不良预后。
15、胃腺癌通常过度表达胃泌素以及胃泌素受体,称为cck-b受体(smith et al.,1998a;mcwilliams et al.,1998),并且胃泌素介导的增殖作用在与cck-b结合后导致这些肿瘤中生长和表达不受控制的自分泌周期。多年来,阻断胃泌素的功能作为治疗这种癌症的一种手段一直是研究的焦点(rai et al.,2012中的综述)。在靶向疗法的候选药物中,胃泌素疫苗多克隆抗体刺激剂(pas)已经在二期临床试验中显示出改善胃癌生存率的显著前景,并且在二期和三期临床试验中显示出改善胰癌生存率的显著前景。pas疫苗接种已被证明可引发体液免疫应答,如胃泌素中和抗体的产生所证明的。通过消除胃泌素,该疫苗可以减缓肿瘤生长,并有可能提供长期的肿瘤杀伤活性。
16、当免疫介导的靶抗原固定或失活不会对身体其他部位产生有害影响时,提高针对特定肿瘤抗原的免疫应答的癌症疫苗是一种有吸引力的治疗策略。肽疫苗具有缩小免疫应答特异性的潜在优势,但有时也存在引发较弱免疫原性的缺点。仔细选择肽组成以及掺入佐剂分子和递送系统可能是必要的,以确保强有力的应答并启动所需免疫途径的诱导。短至9-11个氨基酸的肽可以产生特异性cd8+t细胞介导的应答,尽管表位中即使一个氨基酸的变化也可以阻止该应答(gershoni et al.,2007)。
17、选择要包括在肽上的表位需要考虑所需的免疫应答的类型,包括用于诱导cd4+辅助t细胞的mhc ii类表位以及用于诱导辅助t细胞和cd8+细胞毒性t淋巴细胞的mhc i类cd8表位(li et al.,2014)。
18、胃泌素肽疫苗(例如pas)与免疫检查点抑制剂的组合代表了一种改善受胃泌素肽激素的生长刺激的癌症结果的新方法。
技术实现思路
1、本
技术实现要素:
列出了本公开主题的多个实施方式,并且在许多情况下,列出了这些实施方式的变化和排列。本发明内容仅是众多不同实施方式的示例性的。给定实施方式的一个或多个代表性特征的提及同样是示例性的。这样的实施方式通常可以具有或不具有所提到的特征而存在;同样,那些特征可以应用于本公开主题的其他实施方式,无论是否在本发明内容中列出。为了避免过度重复,本发明内容并未列出或建议此类特征的所有可能组合。
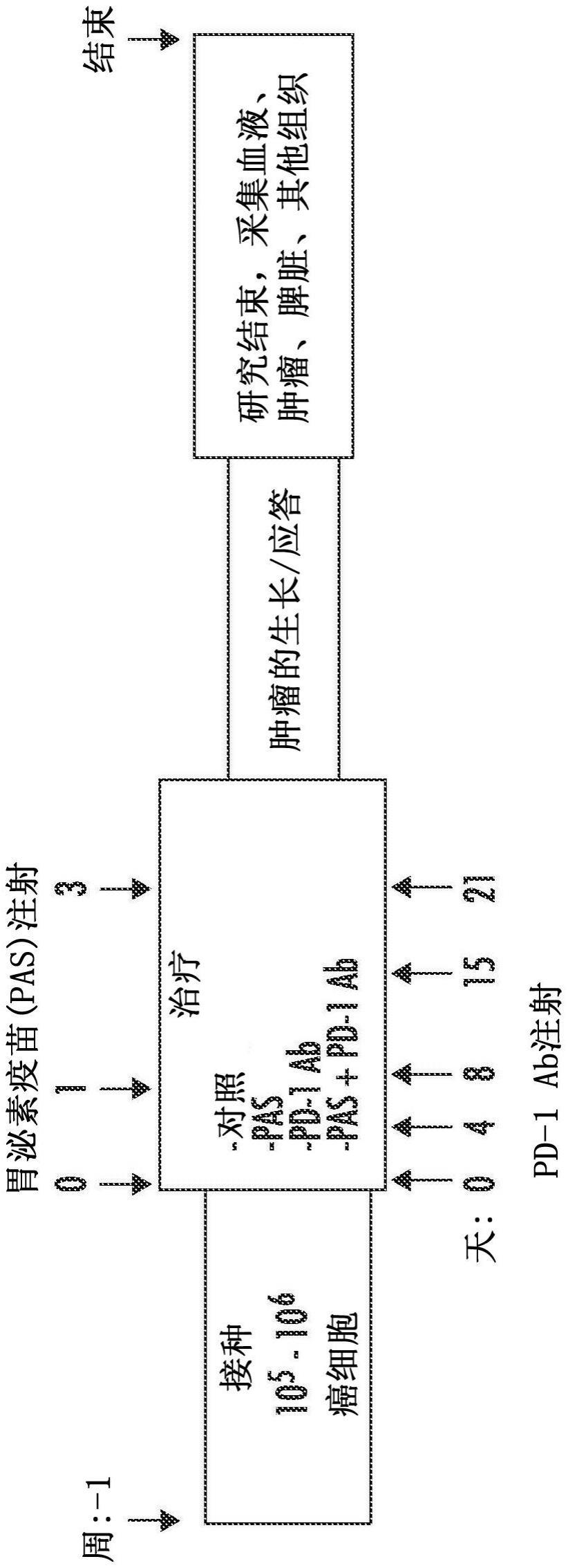
2、在一些实施方式中,本公开主题涉及用于预防受试者中胃泌素相关肿瘤和/或癌症的起始和/或进展的方法。在一些实施方式中,该方法包括提供处于发生胃泌素相关肿瘤和/或癌症风险的受试者;和向受试者施用包含胃泌素免疫原的组合物,其中所述胃泌素免疫原在受试者中诱导抗胃泌素体液免疫应答和/或细胞免疫应答,其足以预防受试者中胃泌素相关肿瘤或癌症的起始或进展。在一些实施方式中,所述胃泌素免疫原包含胃泌素肽,可选地胃泌素肽包含选自egpwleeeee(seq id no:1)、egpwleeee(seq id no:2)、egpwleeeeeay(seq id no:3)和egpwleeeeeaygwmdf(seq id no:4)的氨基酸序列,基本上由其组成或由其组成。在一些实施方式中,胃泌素肽可选地通过接头缀合至免疫原性载体。在一些实施方式中,所述免疫原性载体选自白喉类毒素、破伤风类毒素、匙孔血蓝蛋白和牛血清白蛋白。在一些实施方式中,接头包含ε-马来酰亚胺基己酸n-羟基琥珀酰胺酯。在一些实施方式中,其中接头和胃泌素肽被氨基酸间隔子分开,可选地其中氨基酸间隔子的长度为1至10个氨基酸,进一步可选地其中氨基酸间隔子的长度为7个氨基酸。在一些实施方式中,组合物进一步包含佐剂,可选地基于油的佐剂。在一些实施方式中,胃泌素相关肿瘤和/或癌症是胰癌。在一些实施方式中,所述组合物诱导与胰癌相关的纤维化的减少和/或预防其发展。在一些实施方式中,所述组合物以选自约50μg至约1000μg、约50μg至约500μg、约100μg至约1000μg、约200μg至约1000μg和约250μg至约500μg中的剂量施用,并且可选地其中该剂量重复一次、两次或三次,可选地其中第二剂量在第一剂量后1周施用并且第三剂量(如果施用)在第二剂后1或2周施用。
3、在一些实施方式中,目前公开的主题还涉及用于抑制受试者中胃泌素相关癌前病变发展的方法。在一些实施方式中,该方法包括提供处于发生胃泌素相关癌前病变风险的受试者;和向受试者施用包含胃泌素免疫原的组合物,其中胃泌素免疫原抑制受试者中胃泌素相关癌前病变的发展。在一些实施方式中,胃泌素免疫原包含胃泌素肽。在一些实施方式中,胃泌素肽包含选自egpwleeeee(seq id no:1)、egpwleeee(seq id no:2)、egpwleeeeeay(seq id no:3)和egpwleeeeeaygwmdf(seq id no:4)中的氨基酸序列,基本上由其组成或由其组成。在一些实施方式中,胃泌素肽可选地通过接头缀合至免疫原性载体。在一些实施方式中,所述免疫原性载体选自白喉类毒素、破伤风类毒素、匙孔血蓝蛋白和牛血清白蛋白。在一些实施方式中,所述接头包含ε-马来酰亚胺基己酸n-羟基琥珀酰胺酯。在一些实施方式中,所述接头和胃泌素肽由氨基酸间隔子分开,可选地其中氨基酸间隔子的长度为1至10个氨基酸,进一步可选地其中氨基酸间隔子的长度为7个氨基酸。在一些实施方式中,所述组合物进一步包含佐剂,可选地基于油的佐剂。在一些实施方式中,胃泌素相关肿瘤和/或癌症是胰癌。在一些实施方式中,所述组合物诱导与胰癌相关的纤维化的减少和/或预防其发展。在一些实施方式中,胃泌素相关癌前病变包括胰腺上皮内瘤变(panin)。在一些实施方式中,所述组合物以选自约50μg至约1000μg、约50μg至约500μg、约100μg至约1000μg、约200μg至约1000μg和约250μg至约500μg中的剂量施用,并且可选地其中该剂量重复一次、两次或三次,可选地其中第二剂量在第一剂量后1周施用并且第三剂量(如果施用)在第二剂量后1或2周施用。
4、在一些实施方式中,本公开主题还涉及用于预防与肿瘤和/或癌症相关的纤维化形成的方法。在一些实施方式中,所述方法包括使肿瘤和/或癌症的细胞与组合物接触,所述组合物包含直接或间接抑制肿瘤和/或癌症中胃泌素的一种或多种生物活性的药剂,基本上由其组成或由其组成。在一些实施方式中,药剂诱导针对胃泌素肽的体液免疫应答,可选地其中药剂包含诱导受试者中中和性抗胃泌素抗体产生的胃泌素肽。在一些实施方式中,所述中和性抗胃泌素抗体结合存在于氨基酸序列egpwleeeee(seq id no:1)、egpwleeee(seq id no:2)、egpwleeeeeay(seq id no:3)或egpwleeeeeaygwmdf(seq idno:4)内的表位。在一些实施方式中,药剂包含胃泌素肽,其诱导缀合至免疫原性载体的中和性抗胃泌素抗体的产生。在一些实施方式中,胃泌素肽包含选自egpwleeeee(seq id no:1)、egpwleeee(seq id no:2)、egpwleeeeeay(seq id no:3)和egpwleeeeeaygwmdf(seq idno:4)中的氨基酸序列,基本上由其组成或由其组成。在一些实施方式中,免疫原性载体选自白喉类毒素、破伤风类毒素、匙孔血蓝蛋白和牛血清白蛋白。在一些实施方式中,胃泌素肽通过接头缀合至免疫原性载体。在一些实施方式中,所述接头包含ε-马来酰亚胺基己酸n-羟基琥珀酰胺酯。在一些实施方式中,所述接头和胃泌素肽由氨基酸间隔子分开,可选地其中该氨基酸间隔子的长度为1至10个氨基酸,进一步可选地其中氨基酸间隔子的长度为7个氨基酸。在一些实施方式中,组合物进一步包含佐剂,可选地基于油的佐剂。在一些实施方式中,肿瘤和/或癌症是胰癌。
5、在一些实施方式中,本公开主题还涉及包含一种或多种胃泌素免疫原的组合物用于预防胃泌素相关肿瘤或癌症的起始和/或发展的用途。
6、在一些实施方式中,本公开主题还涉及包含一种或多种胃泌素免疫原的组合物用于制备预防胃泌素相关肿瘤或癌症的起始和/或发展的药物的用途。
7、在一些实施方式中,本公开主题还涉及用于预防胃泌素相关肿瘤和/或癌症和/或其癌前病变的起始和/或发展的组合物。在一些实施方式中,该组合物包含一种或多种胃泌素免疫原,基本上由其组成,或由其组成,可选地其中所述一种或多种胃泌素免疫原中的至少一种包含胃泌素肽,胃泌素肽诱导与免疫原性载体缀合的中和抗胃泌素抗体的产生。在一些实施方式中,所述一种或多种胃泌素肽中的至少一种包含选自egpwleeeee(seq idno:1)、egpwleeee(seq id no:2)、egpwleeeeeay(seq id no:3)和egpwleeeeeaygwmdf(seqid no:4)中的组的氨基酸序列,基本上由其组成,或由其组成。在一些实施方式中,免疫原性载体选自白喉类毒素、破伤风类毒素、匙孔血蓝蛋白和牛血清白蛋白。在一些实施方式中,所述一种或多种胃泌素肽中的至少一种通过接头缀合至免疫原性载体。在一些实施方式中,所述接头包含ε-马来酰亚胺基己酸n-羟基琥珀酰胺酯。在一些实施方式中,所述接头和胃泌素肽由氨基酸间隔子分开,可选地其中该氨基酸间隔子的长度为1至10个氨基酸,进一步可选地其中该氨基酸间隔子的长度为7个氨基酸。在一些实施方式中,组合物还包含佐剂,可选地基于油的佐剂。在一些实施方式中,肿瘤和/或癌症是胰癌。
8、因此,本公开主题的一个目的是提供一种用于预防胃泌素相关肿瘤和/或癌症和/或其癌前病变的起始和/或进展的方法。
9、本公开主题的一个目的已在上文中陈述,并且其通过本文公开的组合物和方法全部或部分实现,当结合下文最佳描述的附图进行描述时,其他目的将变得显而易见。
- 还没有人留言评论。精彩留言会获得点赞!