作为PD1/PD-L1抑制剂的化合物及其方法与流程
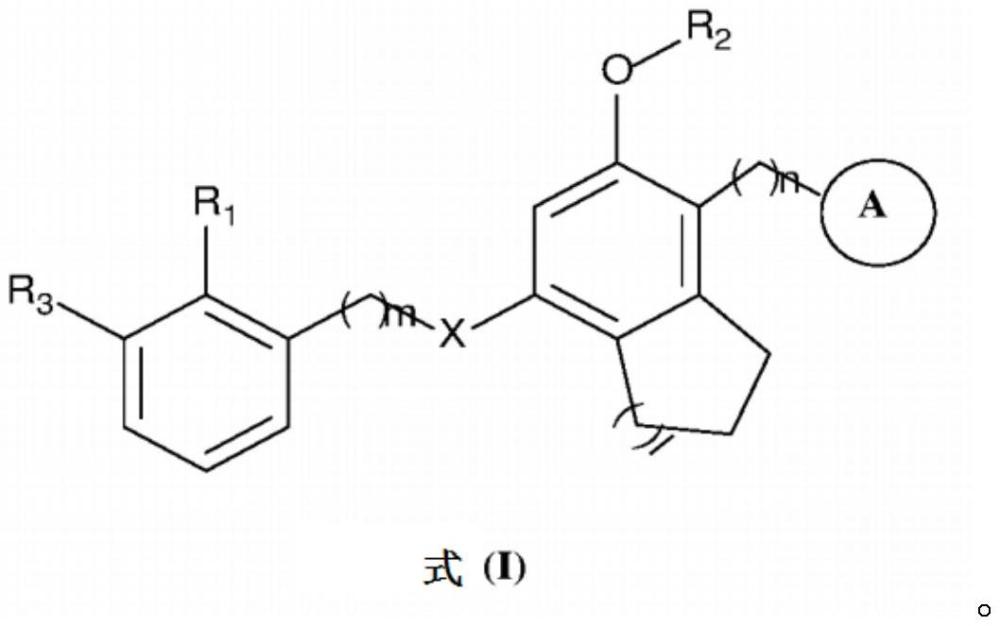
本发明一般性地涉及药物化合物领域,更具体地涉及作为针对pd1/pd-l1相互作用的抑制剂的式(i)化合物。本发明还涉及式(i)化合物的制备方法:
背景技术:
1、程序性细胞死亡蛋白1(programmed cell death protein 1,pd-1)是细胞表面上的蛋白质,其在人体中调节免疫系统方面发挥着重要作用。其通过抑制t细胞炎症活性来下调免疫系统并促进自身耐受从而提供对人体细胞的应答。因此,pd-1预防自身免疫病,然而,其也阻止免疫系统杀伤癌细胞。pd-1有两个配体,pd-l1(程序性死亡配体1)和pd-l2(程序性死亡配体2),它们都是b7家族的成员。多种证据表明pd-1及其配体负调节免疫应答。已发现pd-l1在数种癌症中高度表达,并且因此pd1在癌症免疫逃逸中的作用是普遍为人所知的。
2、在癌症中,pd-l1在多种实体恶性病中的肿瘤细胞的表面上表达,所述实体恶性病例如头颈部鳞状细胞癌、黑素瘤、脑癌、甲状腺癌、胸腺癌、食管癌、肺癌、乳腺癌、胃肠道癌、结直肠癌、肝癌、胰腺癌、肾癌等。(topalian s.l.et al.,curr.opin.immunol.,2012,24(2):207-212;wang x.etal.,oncotargets and therapy,2016,9:5023-5039)。在肝细胞癌、黑素瘤和乳腺癌中,pd-l1阳性与较差的预后相关(muenst s.et al.,breast cancerres.treat.,2014,146(1):15-24;leung j.et al.,immune network,2014,14(6):265-276;wang q.et al.,medicine(baltimore),2017,96(18):e6369)。相反,正常人组织很少在其细胞表面上表达pd-l1蛋白,这表明pd-l1可以是用于抗肿瘤治疗的选择性靶标(chenl.et al.,j.clin.invest.,2015,125(9):3384-3391)。
3、pd-1/pd-l1分子途径是癌症免疫逃逸的主要机制之一。pd-1/pd-l1途径的激活诱导活化的t细胞凋亡,促进t细胞的能量和耗竭,增强调节性t细胞的功能,并且抑制t细胞的增殖。因此,阻断该途径可恢复ctl的增殖和细胞毒性,抑制调节性t细胞(treg)的功能,并且导致t细胞凋亡降低。
4、通过治疗性抗体来阻断pd-1/pd-l1途径已表明阻止来自癌细胞的抑制性信号传导,并且使ctl能够引发针对靶/癌细胞的免疫应答。迄今为止,已经开发了许多靶向pd-1的癌症免疫治疗剂,并被批准用于许多恶性病。然而,仍然需要pd-1/pd-l1相互作用途径的强效和选择性小分子抑制剂。
5、抗pd-1抗体和抗pd-l1抗体二者的常见药物相关不良作用包括腹泻、肺炎、皮疹、瘙痒、肾感染和激素失衡。还报道了免疫相关的不良作用,例如皮炎、结肠炎、肝炎、白癜风和甲状腺炎。单克隆抗体(monoclonal antibody,mab)的长停留时间可导致这些ae,其可使用小分子抑制剂来部分规避。另外,使用较小的细胞穿透生物制剂和dna适配体的研究已表明发挥抗体模拟功能,并且由于其化学合成性质、低免疫原性和有效的组织穿透而优于抗体(lai w.y.et al.,mol.therapy-nucl.acids,2016,5:e397)。因此,小分子抑制剂可提供提高的经口生物利用度、提高的生物效率和缩短的半衰期活性以用于更可控的治疗,特别是在自身免疫或其他不良事件的情况下。
6、如所讨论的,pd-1/pd-l1抑制性化合物在上调免疫系统以用于有效对抗癌症方面具有巨大的效用。因此,有必要鉴定促进这种抑制的化学部分,特别是小分子抑制剂。因此,鉴定和开发治疗癌症和与pd-1/pd-l1激活相关的其他疾病或病症的新的pd-1/pd-l1抑制剂化合物将在癌症治疗领域带来新的机会。
技术实现思路
1、在本发明的一个方面中,提供了式(i)化合物、其立体异构体、n-氧化物或其可药用盐:
2、
3、其中,
4、x选自o或nr’;
5、环a选自c6-10芳基、c3-10环烷基、c7-16烷基芳基、c2-10杂芳基、c2-20杂环基、-co-c2-20杂环基或-c(o)nr4-c2-20杂环基;其中,c6-10芳基、c3-10环烷基、c7-16烷基芳基、c2-10杂芳基、c2-20杂环基、-co-c2-20杂环基或-c(o)nr4-c2-20杂环基任选地经一个或更多个基团取代,所述一个或更多个基团选自卤素、羟基、c1-10烷基、c1-10烷氧基、c1-10卤代烷基、c2-10烷基烷氧基、-ch2-nrac(o)rb、-crarb-orc、-crarb-nrcrd或-ch2-nhc(o)nrarb;其中,ra、rb、rc和rd独立地选自氢、卤素、c1-10烷基、-c(o)r”、c3-10环烷基、c1-10卤代烷基或c1-10烷氧基;
6、r’选自氢或c1-10烷基;
7、r1选自氢、氰基或c1-10烷基;
8、r2选自氢、c1-10烷基、c6-10芳基、c3-10环烷基、c1-10卤代烷基、c7-16烷基芳基、c2-10杂芳基、c3-20烷基杂芳基、c2-20杂环基或c3-20烷基杂环基;其中,c1-10烷基、c6-10芳基、c3-10环烷基、c1-10卤代烷基、c7-16烷基芳基、c2-10杂芳基、c3-20烷基杂芳基、c2-20杂环基或c3-20烷基杂环基任选地经一个或更多个基团取代,所述一个或更多个基团选自卤素、氰基、羟基、-c(o)nh2、c1-10烷基或c6-10芳基;
9、r3选自卤素、c6-10芳基或c2-10杂芳基;其中,c6-10芳基或c2-10杂芳基任选地经一个或更多个基团取代,所述一个或更多个基团选自卤素、卤代烷基、氰基、羟基、氨基、c1-10烷基、or”、c6-10芳基、c2-20杂环基或c2-10杂芳基;
10、其中,r”选自氢、卤素、c1-10烷基或c1-10卤代烷基;
11、r4选自氢或c1-10烷基;
12、m为1至5;n为0至5;并且l为1至5,
13、前提是所述式(i)化合物不是:
14、
15、在本发明的另一方面中,提供了用于制备式(i)化合物、其立体异构体、n-氧化物或其可药用盐的方法,所述方法包括以下步骤:(a)在存在还原剂和溶剂的情况下,使式(ia)化合物与化合物a反应以获得式(i)化合物:
16、
17、在本发明的另一方面中,提供了药物组合物,其包含式(i)化合物或其可药用盐以及可药用载体,任选地与一种或更多种其他药物组合物组合。
18、在本发明的另一方面中,提供了用于治疗和/或预防增殖性疾病或癌症或由pd-1/pd-l1介导的病症的方法,其包括向患有增殖性疾病或癌症或由pd-1/pd-l1介导的病症的对象施用治疗有效量的如本文中公开的式(i)化合物或药物组合物。
19、在本发明的另一方面中,提供了如本文中公开的式(i)化合物或药物组合物,其用于制备用于抑制细胞中pd-1/pd-l1酶的药物。
20、在本发明的又一方面中,提供了如本文中公开的式(i)化合物或药物组合物,其用于治疗和/或预防增殖性疾病或癌症或由pd-1/pd-l1介导的病症,所述治疗/预防包括向患有增殖性疾病或癌症或由pd-1/pd-l1介导的病症的对象施用。
21、在本发明的另一方面中,提供了式(i)化合物或药物组合物用于与其他临床相关细胞毒性剂或非细胞毒性剂一起来治疗或预防疾病或增殖性病症或癌症的用途。
22、在本发明的另一方面中,提供了用于癌症治疗的方法,所述方法包括向有此需要的对象施用如本文中公开的式(i)化合物或药物组合物与其他临床相关的细胞毒性剂或非细胞毒性剂的组合。
23、参考以下描述,将更好地理解本主题的这些和另一些特征、方面和优点。提供本
技术实现要素:
是为了以简化的形式介绍选择的概念。本发明内容不旨在确定本发明的关键特征或基本特征,也不旨在用于限制主题的范围。
- 还没有人留言评论。精彩留言会获得点赞!