抗体-药物缀合物与免疫检查点抑制剂组合用于治疗尿路上皮癌的用途的制作方法
本公开涉及精确治疗癌症的领域,涉及靶向her2(人表皮生长因子受体2)的抗体药物缀合物(adc)与免疫检查点抑制剂组合在治疗尿路上皮癌中的用途。
背景技术:
1、尿路上皮癌(uc;或移行性细胞癌,tcc)是一种通常在泌尿系统(肾、膀胱和附属器官)中出现的癌症。它是膀胱癌以及输尿管、尿道和脐尿管癌的最常见类型。它是肾癌的第二常见类型,占所有原发性肾恶性肿瘤的5-10%。(en.wikipedia.org:https://en.wikipedia.org/wiki/t ransitional_cell_carcinoma)。
2、尿路上皮(也称作移行性上皮)是膀胱、输尿管和尿道的内侧,并且是肾盂(肾脏的一部分,其中收集尿液)的内衬。它由尿路上皮细胞和移行性细胞组成。这些细胞可变成癌细胞,即,称作尿路上皮癌(或移行性细胞癌)。
3、视癌细胞的侵袭力而定,尿路上皮癌可以是非侵袭性的(仅在膀胱的内衬中)或侵袭性的(生长至膀胱壁的其他层中)。其中,非侵袭性尿路上皮癌仅在膀胱的内膜中生长并且不在膀胱壁中更深生长。在诊断时,50-60%患有尿路上皮癌的患者的肿瘤是非侵袭性的。非侵袭性尿路上皮癌的类型包括:非侵袭性鳞状尿路上皮癌(也称作原位癌);高级别非侵袭性乳头状尿路上皮癌;以及具有低级别恶性肿瘤的非侵袭性乳头状尿路上皮癌,其中具有低恶性潜力的非侵袭性乳头状尿路上皮肿瘤不太可能发展成侵袭性癌症。
4、相比之下,侵袭性尿路上皮癌从膀胱内膜生长至膀胱壁的更深层,诸如结缔组织(称作固有层)和肌肉层(称作肌层)。在诊断时,40-50%患有尿路上皮癌的患者的肿瘤是侵袭性的。
5、理论上,尿路上皮癌可在尿道的任何位置(包括但不限于肾盂、输尿管、膀胱或尿道)开始。
6、当相关肿瘤细胞尚未转移时,手术切除为优选治疗选项。针对具有转移性肿瘤的患者,一般需要抗癌药物治疗。目前一线疗法为吉西他滨(gemcitabine)和顺铂(cisplatin)的组合疗法。然而,放射疗法在尿路上皮癌中效果不佳并且一般用作辅助疗法。当治疗肾盂/输尿管上皮癌时,可使用bcg注射疗法(牛分枝杆菌(mycobacteriumbovis)的导管注射)。
7、尿路上皮癌转移并且频繁复发。根治性膀胱切除术为具有涉及肌层的肿瘤的患者的第一选择,并且在手术后需要严格和定期审查。因此,其治疗是困难的并且复发率高。(lixuesong、wang gang和zhang qian编辑,essence of urology cases,peking universitymedical press,2017)。在手术后早期(在24小时内)以单剂量或在手术后数周以六剂量方案向膀胱施用丝裂霉素(化学疗法药物)也是一些患者的治疗选项。
8、欧洲已批准长春氟宁(vinflunine)用于治疗尿路上皮晚期或转移性tcc(bellmunt,j.等人,j clin oncol.27(27):4454-4461(2009))。当以单剂疗法测试时,若干药物已显示中等活性,具有5至10个月的中值生存期(yafi,f.a.等人,current oncol.18(1):e25-e34(2011))。在转移性环境下,向患有移行性细胞癌的患者施用多西他赛作为缓和选项(nccn 2014)。此外,基于来自2期研究(wo2016/064649a1)的证据,美国和加拿大医学界赞同多西他赛作为晚期疾病的治疗方案。
9、近年来,用于治疗尿路上皮癌的新型药物主要包括:
10、1.roche的阿特珠单抗(atezolizumab)(2016),欧盟批准的首个抗pd-l1癌症免疫疗法药物,可用于治疗转移性尿路上皮癌。被分配至实验组的患者的客观缓解率(orr)为63%,而化学疗法组的患者的orr为21%。来自imvigor210研究的群组的结果显示阿特珠单抗小组中的15.9个月的中值总生存期(os)。阿特珠单抗的常见不良反应包括疲劳、食欲下降、恶心、呼吸困难、腹泻(18.6%)、发热、皮疹、呕吐、关节痛、虚弱和发痒。
11、2.bristol-myers squibb的纳武单抗(nivolumab)(2017),由us fda批准用于患有局部晚期或转移性尿路上皮癌的患者。纳武单抗为抗pd-1单克隆抗体。临床数据显示,客观缓解率(orr)为19.6%,中值治疗持续时间为3.3个月(时间范围:0-13.4个月),并且54%的患者经历严重不良事件。具有至少2%的发生率的最常见严重不良事件包括尿道感染、脓毒症、腹泻、小肠梗阻和一般健康恶化。最常见不良反应包括疲劳、肌肉和骨痛、恶心和食欲下降。由于17%的患者中的不良反应,中止纳武单抗治疗,并且由于不良反应,在46%的患者中延迟给药。由于肺炎或心血管衰竭,4个患者出现治疗相关的死亡。
12、3.johnson&johnson’s janssen的厄达替尼(erdafitinib),一种纤维母细胞生长因子受体(fgfr)酪氨酸激酶抑制剂,由us fda(2018)批准用于治疗尿路上皮癌。研究结果显示,厄达替尼在患有复发/难治性转移性尿路上皮癌的59个患者中具有42%的客观缓解率(orr),所述患者的肿瘤具有fgfr突变(janssen宣布厄达替尼在转移性尿路上皮癌的治疗中的u.s.fda突破疗法指定)。
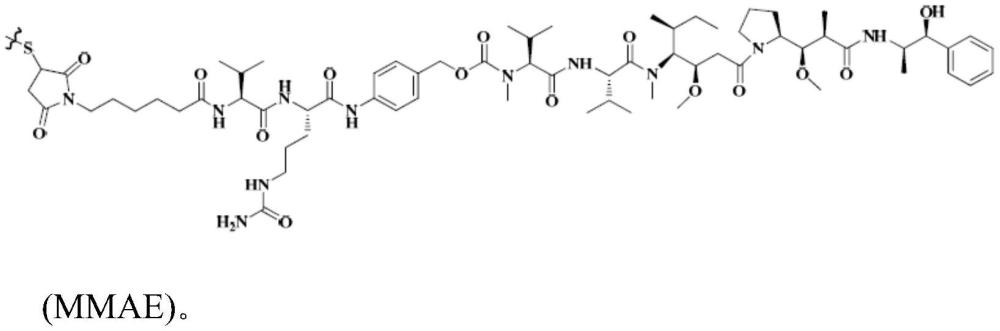
13、4.padcev(维汀-恩诺单抗(enfortumab vedotin)),由us fda在2019年12月批准用于患有局部晚期或转移性尿路上皮癌的患者,所述患者先前已接受pd-1/l1抑制剂的治疗并且已在新辅助/辅助疗法中或在局部晚期或转移性疾病的治疗中接受以铂为主的化学疗法方案。数据显示,padcev治疗在大多数患者中快速收缩肿瘤,具有44%(55/125,95%ci:35.1-53.2)的客观缓解率,12%(15/125)的完全缓解率,以及7.6个月(范围:0.95-11.3+)的中值缓解持续时间。padcev是靶向在膀胱癌中高度表达的细胞表面蛋白的第一类adc。所述药物通过缀合靶向nectin-4的人igg1单克隆抗体恩诺单抗与细胞毒性剂mmae(单甲基澳瑞他汀e,一种微管干扰剂)来制备。
14、5.抗体-药物缀合物(即,维迪西妥单抗(disitamab vedotin)),它可特异性结合至her2靶标并且具有由公布号cn105008398a的中国专利公开的药物部分mmae。目前,正在探索所述药物作为各种表达her2(ihc 1+或以上)的癌症适应症(包括乳腺癌,诸如胃癌和尿路上皮癌)和her2低表达(ihc 2+/fish-或ihc 1+)癌症适应症(诸如her2低表达乳腺癌)的治疗。2020年9月,u.s.fda也对维迪西妥单抗用于表达her2(ihc 2+或ihc 3+)的局部晚期或转移性尿路上皮癌适应症的二线治疗授予突破疗法指定。
15、目前,针对转移性尿路上皮癌(muc)的一线化学疗法的orr为约50%,并且据报道,铂不耐受患者的一线治疗的维汀-恩诺单抗组合免疫的orr(ev-103研究)在海外国家为73.3%。
16、本文所引用的所有参考文献(包括专利申请、专利公布和uniprotkb/swiss-prot登录号)均以全文引用的方式并入本文中,就如同明确并且个别地指示各个别参考文献以引用的方式并入一般。
技术实现思路
1、本公开提供用抗her2抗体-药物缀合物(adc)和免疫检查点抑制剂治疗尿路上皮癌患者的方法和用途。这些方法和用途至少部分地基于本文中所呈现的动物模型和临床数据的深入分析,所述分析证实了申请人的出人意料的发现,即her2抗体-药物缀合物(adc)和免疫检查点抑制剂的组合在尿路上皮癌、尤其患有局部晚期或转移性尿路上皮癌的患者的治疗中具有协同效应,以及与现有标准疗法相比的临床效益。orr随着her2或pd-l1的更高表达而增加。此外,针对具有低her2 ihc表达(1+)的患者,所述组合治疗仍具有良好功效。
2、例如,维迪西妥单抗和pd-l1抗体的组合对皮下移植ht-29的肿瘤的增殖抑制具有协同效应。此外,在维迪西妥单抗与pd-1抗体(特瑞普利单抗(toripalimab))组合的临床试验中,结果指示所述组合疗法与单独单一治疗相比产生改进的患者结果,特别地关于pfs。
3、本文提供抗体-药物缀合物(adc)与免疫检查点抑制剂组合在用于治疗尿路上皮癌患者的药物的制备中的用途,其中所述抗体-药物缀合物具有通式ab-(l-u)n的结构,其中ab表示抗her2(人表皮生长因子受体2)抗体;l表示接头;u表示缀合的细胞毒性分子;并且n为1至8的整数,并且表示与各抗体结合的细胞毒性分子的数目,并且其中:所述抗体包含重链可变区和轻链可变区,其中所述重链可变区的cdr和/或所述轻链可变区的cdr具有与维迪西妥单抗相同的cdr序列;所述接头l包含马来酰亚胺基-己酰基-缬氨酸-瓜氨酸-对氨基苄氧基(mc-vc-pab),其中所述接头借助于巯基缀合共价连接至所述抗体,并且连接位点为所述抗体的链间二硫键位点;所述细胞毒性分子u包含mmae(单甲基澳瑞他汀e);并且所述免疫检查点抑制剂为pd-1抗体或pd-l1抗体。
4、本文还提供用于治疗尿路上皮癌患者的方法,所述方法包括向所述患者施用有效量的抗体-药物缀合物(adc)和免疫检查点抑制剂,其中所述抗体-药物缀合物具有通式ab-(l-u)n的结构,其中ab表示抗her2(人表皮生长因子受体2)抗体;l表示接头;u表示缀合的细胞毒性分子;并且n为1至8的整数,并且表示与各抗体结合的细胞毒性分子的数目,并且其中:所述抗体包含重链可变区和轻链可变区,其中所述重链可变区的cdr和/或所述轻链可变区的cdr具有与维迪西妥单抗相同的cdr序列;所述接头l包含马来酰亚胺基-己酰基-缬氨酸-瓜氨酸-对氨基苄氧基(mc-vc-pab),其中所述接头借助于巯基缀合共价连接至所述抗体,并且连接位点为所述抗体的链间二硫键位点;所述细胞毒性分子u包含mmae(单甲基澳瑞他汀e);并且所述免疫检查点抑制剂为pd-1抗体或pd-l1抗体。
5、在以上所有的一些实施方案中,所述患者针对her2表达呈阳性。在以上所有的一些实施方案中,从所述患者的尿路上皮癌获得的样品为her2阳性。在以上所有的一些实施方案中,基于免疫组织化学(ihc)分析,从所述患者的尿路上皮癌获得的所述样品为her2阳性。在以上所有的一些实施方案中,从所述患者的尿路上皮癌获得的所述样品中的her2表达为ihc 3+或ihc 2+。在以上所有的一些实施方案中,所述患者针对pd-l1或pd-1表达呈阳性。
6、在以上所有的一些实施方案中,所述抗体包含重链可变(vh)区和轻链可变(vl)区;其中所述vh区包含:包含gytftdyy(seq id no:3)的氨基酸序列的hcdr1,包含vnpdhgds(seq id no:4)的氨基酸序列的hcdr2,和包含arnylfdh(seq id no:5)的氨基酸序列的hcdr3;并且其中所述vl区包含:包含qdvgta(seq id no:6)的氨基酸序列的lcdr1,包含was(seq id no:7)的氨基酸序列的lcdr2,和包含hqfatyt(seq id no:8)的氨基酸序列的lcdr3。在以上所有的一些实施方案中,所述抗体包含重链可变(vh)区和轻链可变(vl)区;其中所述vh区包含:包含dyyih(seq id no:31)的氨基酸序列的hcdr1,包含rvnpdhgdsyynqkfkd(seq id no:32)的氨基酸序列的hcdr2和包含arny lfdhw(seq id no:33)的氨基酸序列的hcdr3;并且其中所述v l区包含:包含kasqdvgtava(seq id no:34)的氨基酸序列的lcdr1,包含wasirht(seq id no:35)的氨基酸序列的lcdr2和包含hqfatyt(seq id no:8)的氨基酸序列的lcdr3。在以上所有的一些实施方案中,所述抗体包含重链可变(vh)区和轻链可变(v l)区,所述抗体为鼠科、嵌合或人源化抗体。在以上所有的一些实施方案中,所述抗体包含重链可变(vh)区和轻链可变(vl)区;其中所述vh区包含evqlvqsgaevkkpgatvkisckvsgytftdyyihwv qqapgkglewmgrvnpdhgdsyynqkfkdkatitadkstdtaymelsslrsedtavyfcarnylfdhwgqgtlvtvss(seq id no:9)的氨基酸序列;并且其中所述vl区包含diqmtqspssvsasvgd rvtitckasqdvgtavawyqqkpgkapklliywasirhtgvpsrfs gsgsgtdftltisslqpedfatyychqfatytfgggtkveik(seq id no:10)的氨基酸序列。在以上所有的一些实施方案中,所述抗体为人igg抗体。在以上所有的一些实施方案中,所述抗体为人igg1、igg2和igg4抗体。在以上所有的一些实施方案中,所述抗体的重链的氨基酸序列为seq idno:1,并且所述抗体的轻链的氨基酸序列为seq id no:2。
7、在以上所有的一些实施方案中,所述抗体-药物缀合物为维迪西妥单抗或其生物类似物。在以上所有的一些实施方案中,所述抗体-药物缀合物的平均dar(即,药物:抗体比率)值为2至7的任何数字。在以上所有的一些实施方案中,所述平均dar值为4±0.5。
8、在以上所有的一些实施方案中,所述免疫检查点抑制剂为pd-1抗体。在以上所有的一些实施方案中,所述pd-1抗体为特瑞普利单抗、多塔利单抗(dostarlimab)、帕洛利单抗(prolgolimab)、替雷利珠单抗(tislelizumab)、卡瑞利珠单抗(camrelizumab)、信迪利单抗(sintilimab)、西米普利单抗(cemiplimab)、派姆单抗(pembrolizumab)、纳武单抗、派安普利单抗(penpulimab)、杰诺单抗(genolimzumab)、赛帕利单抗(zimberelimab)或巴替利单抗(balstilimab)。在以上所有的一些实施方案中,所述免疫检查点抑制剂为pd-l1抗体。在以上所有的一些实施方案中,所述免疫检查点抑制剂为pd-l1抗体,所述抗体为德瓦鲁单抗(durvalumab)、阿维单抗(avelumab)、阿特珠单抗、恩沃利单抗(envafolimab)或rc98。
9、在以上所有的一些实施方案中,所述患者先前已接受一种或多种先前治疗,诸如化学疗法药物、靶向疗法、免疫疗法或内分泌疗法。在以上所有的一些实施方案中,所述尿路上皮癌患者是患有无法手术切除的局部晚期尿路上皮癌的患者、患有局部晚期或转移性尿路上皮癌的患者、患有her2阳性尿路上皮癌的患者、患有her2阳性局部晚期或转移性尿路上皮癌的患者或无法耐受以铂为主的化学疗法的尿路上皮癌患者。在以上所有的一些实施方案中,所述尿路上皮癌患者是患有不可切除的局部晚期或转移性尿路上皮癌的患者。在以上所有的一些实施方案中,所述尿路上皮癌患者是无资格接受或拒绝以顺铂为主化学疗法的患者。在以上所有的一些实施方案中,所述尿路上皮癌患者是在化学疗法后出现进展的患者。在以上所有的一些实施方案中,所述尿路上皮癌患者是在完成新辅助或辅助的以顺铂为主的化学疗法后的12个月内经历疾病进展的患者。
10、在以上所有的一些实施方案中,鼻内、皮下、皮内、肌肉内或静脉内施用所述药物。在以上所有的一些实施方案中,以1.5mg/kg或2.0mg/kg的剂量施用所述adc。在以上所有的一些实施方案中,每2周或14天施用所述adc。
11、在以上所有的一些实施方案中,所述抗体-药物缀合物和免疫检查点抑制剂施用于所述尿路上皮癌患者会导致大于7.5个月的无进展生存期(pfs)。
12、应了解,可组合本文所述的各种实施方案的一种、一些或所有性质以形成本发明的其他实施方案。本发明的这些和其他方面对于本领域技术人员将变得显而易知。通过以下具体实施方式进一步描述本发明的这些和其他实施方案。
- 还没有人留言评论。精彩留言会获得点赞!