延长释放涂层的组合物和应用延长释放涂层的方法与流程
背景技术:
1、可以使用胰岛素输注套件(iis)进行csii。iis装置100的一个实例显示在图1中。示例性装置100包括第一近端112和第二远端114,所述第一近端112与泵的胰岛素储库(未显示)连通以接收胰岛素制剂,所述第二远端114与患者(未显示)连通以递送胰岛素制剂(即,输注物)。在第一端112处,示例性装置100包括配置成与胰岛素储库偶联的储库连接器120、线组管道122和基座连接器124。在第二端114处,示例性装置100包括配置成接收基座连接器124的输注基座130、配置成将输注基座130粘附至患者皮肤的粘合垫132和配置成用于插入患者皮肤的输注导管或针134。在使用中,胰岛素制剂从泵通过线组管道122、通过输注导管或针134进入患者皮下(sc)组织中。
2、iis装置可以在尺寸、形状、外观、材料和其它特征上变化。在一个实例中,用于构建输注导管134的材料可以变化(例如,可从animus corporation获得的contact detachtm输注套件使用钢输注导管,而可从medtronic获得的输注套件使用塑料输注导管)。在另一个实例中,线组管道122的排列可以变化(例如,可从animascorporation获得的contact detachtm输注套件使用经由中间应变减轻基座偶联在一起的两组线组管道,而可从medtronic获得的输注套件使用单线组管道)。
3、患者的身体可以在输注导管或针134的部位表现出炎症和/或异物反应。输注部位处的这种反应可以因患者而异,这取决于各种因素,包括患者对伤口形成的易感性、患者相关的组织重塑和患者对特定胰岛素制剂、包括例如对胰岛素类似物和例如对胰岛素制剂中的酚类赋形剂(例如间甲酚、苯酚、尼泊金甲酯、尼泊金乙酯、尼泊金丁酯、其它防腐剂及其组合)的敏感性。特别地,间甲酚已经显示出诱导炎性通路,在体外负面影响人免疫细胞类型,降解脂质双层和神经元细胞膜,并诱导蛋白质聚集和引发蛋白质解折叠,这可能导致输注部位事件。
4、用于csii的已知iis装置目前被指示使用两到三天(2-3天)。在甚至短的配戴时间之后,炎症和/或异物反应可能损害患者输注部位的功效,从而限制胰岛素摄取、增加高血糖症的风险和限制可行的输注部位长久性。iis装置的有限配戴时间与连续葡萄糖监测器(cgms)的配戴时间相比表现出二到七倍差异,因此给实现方便的、完全集成的csii/cgm人工胰腺系统带来障碍。
5、发明简述
6、公开了一种包括治疗剂颗粒的聚合物涂层,其用于与长期配戴的输注导管一起使用。这种涂层减轻了导管部位的炎症,在该部位提供药物的引入持续至少十四天的延长时间,以提供连续插入导管到患者体内。
7、根据本公开的一个说明性实施方案,提供了一种输注装置,其包括基座、被配置成将基座偶联到患者皮肤的粘合物以及具有治疗涂层的导管。所述涂层包括聚合物基质和治疗剂。所述涂层定义了至少40μm(微米)的厚度和至少30wt.%(重量百分比)的治疗剂载量。
8、根据本公开的另一个说明性实施方案,提供了一种延长释放涂层,其包括具有治疗剂的聚合物基质,所述治疗剂占所述涂层的至少45wt.%。所述涂层定义了至少40μm的厚度。
9、根据本公开的又一个说明性实施方案,提供了一种用于将治疗涂层应用到导管的方法。所述方法包括聚合物和治疗剂的混合物混配以形成聚合物基质和治疗剂混合物,所述混合物具有至少30wt.%的治疗剂载量。所述方法还包括使混合物成形,以形成用于应用于导管的涂层。所述涂层定义了至少40μm的厚度。
10、附图简述
11、通过参考本公开的以下实施方案描述并结合附图,本公开的上述和其它特征以及实现它们的方式将变得更加显而易见,并且本发明自身将被更好地理解,其中:
12、图1是已知胰岛素输注套件(iis)装置的俯视图;
13、图2a是示例性iis装置的横截面图,所述装置包括储库连接器、线组管道、基座连接器和输注基座,其中所述装置应用于患者皮肤并且包括在输注导管上的治疗涂层;
14、图2b是图2a的输注导管和治疗涂层的一部分的横截面示意图;
15、图3a是成型聚合物-治疗剂涂层的第一种管设计图示;
16、图3b是成型聚合物-治疗剂涂层的第二种管设计图示;
17、图4a是包括聚合物-治疗剂涂层的示例性微注射成型导管的透视图;
18、图4b是包括聚合物-治疗剂涂层的示例性微注射成型导管的侧面透视图和横截面图;
19、图5a的图说明了用示例性溶剂浇铸eva试样处理14天时间的大鼠中美洛昔康血浆浓度的平均水平;
20、图5b的图说明了图5a中参考的大鼠中美洛昔康血浆浓度的剂量标准化平均水平;
21、图6的多个图说明了厚硅氧烷化涂层对图5b的示例性试样的示例性作用;
22、图7的图说明了图5a的示例性试样的示例性体内治疗剂释放曲线;
23、图8说明了包括针的示例性导管组件;
24、图9说明了具有可移动工作台和卡盘的压缩测试仪,以帮助将图8的导管浸入溶液中;
25、图10说明了正在浸入含有溶液的小瓶中的图8的示例性导管组件;
26、图11说明了浸入溶液后的图8的示例性导管组件,其中所述溶液在导管组件上形成涂层;
27、图12a的图说明了根据示例性实施方案在试样预洗脱的最大载荷下的应力;
28、图12b的图说明了洗脱后在图12a的示例性试样的最大载荷下的应力;
29、图12c的图说明了洗脱前和洗脱后在图12a的示例性试样的最大载荷下的应力变化比较;
30、图13a的图说明了洗脱前在图12a的示例性试样的最大载荷下的应变;
31、图13b的图说明了洗脱后在图12a的示例性试样的最大载荷下的应变;
32、图13c的图说明了洗脱前和洗脱后在图12a的示例性试样的最大载荷下的应变变化比较;
33、图14a的图说明了洗脱前图12a的示例性试样的杨氏模量;
34、图14b的图说明了洗脱后图12a的示例性试样的杨氏模量;
35、图14c的图说明了洗脱前和洗脱后图12a的示例性试样的杨氏模量变化比较;
36、图15a的图说明了多个示例性导管的特征和所述导管的子集的横截面几何形状;
37、图15b说明了图15a的示例性导管的几何形状,尺寸以毫米(mm)表示;
38、图15c说明了图15a的导管的机械测试结果;
39、图16的图说明了具有大治疗剂颗粒的示例性试样的平均治疗剂释放曲线与具有相对较小治疗剂颗粒的示例性试样的平均治疗剂释放曲线的比较;
40、图17的图说明了制备的涂覆单丝的平均治疗剂释放曲线,其中所述释放曲线被标准化为9mm导管的表面积;
41、图18是涂覆单丝(pcl-美洛昔康涂层)的横截面图,说明了围绕单丝的涂层的同心布置;
42、图19a的图说明了由图18示例的涂覆单丝的累积体外释放曲线,其中所述释放曲线被标准化为6mm导管的表面积;
43、图19b的图说明了由图18示例的涂覆单丝的累积体外释放曲线,其中所述释放曲线被标准化为9mm导管的表面积;
44、图19c的图说明了由图18示例的涂覆单丝的体外释放速率曲线,其中所述释放速率曲线被标准化为6mm导管的表面积;
45、图19d的图说明了由图18示例的涂覆单丝的体外释放速率曲线,其中所述释放速率曲线被标准化为9mm导管的表面积;
46、图20说明了用于6mm导管长度的具有hdpe的第一射的示例性成型圆柱体部件;
47、图21说明了对于9mm导管长度,具有hdpe的第一射和具有50wt%美洛昔康载量的pcl的第二射的示例性双射圆柱体部件;
48、图22的图说明了图21示例的双射圆柱体成型部件和图18示例的涂覆单丝的体外累积释放曲线的比较,其中所述释放曲线被标准化为9mm导管的表面积;
49、图23a是涂覆单丝的侧视图,说明了涂覆单丝的半粗糙表面;
50、图23b是双射圆柱体成型部件的侧视图,说明了双射圆柱体成型部件的光滑表面,与图23a进行比较;
51、图24是根据一个示例性实施方案的涂层管道的最大衬里厚度和最小衬里厚度;
52、图25的表提供了根据对于图24的最大衬里厚度和最小衬里厚度中的每一个而言的最小和最大目标释放速率,eva-治疗剂的不同制剂的示例性厚度和相应的总导管外径,其中所提供的厚度根据13mm导管的表面积进行标准化;
53、图26的表提供了根据对于图24的最大衬里厚度和最小衬里厚度中的每一个而言的最小和最大目标释放速率,eva-治疗剂的不同制剂的示例性厚度和相应的总导管外径,其中所提供的厚度根据9mm导管的表面积进行标准化;
54、图27的表提供了根据对于图24的最大衬里厚度和最小衬里厚度中的每一个而言的最小和最大目标释放速率,eva-治疗剂的不同制剂的示例性厚度和相应的总导管外径,其中所提供的厚度根据6mm导管的表面积进行标准化;
55、图28的表提供了根据对于图24的最大衬里厚度和最小衬里厚度中的每一个而言的最小和最大目标释放速率,pcl-治疗剂的不同制剂的示例性厚度和相应的总导管外径,其中所提供的厚度根据13mm导管的表面积进行标准化;
56、图29的表提供了根据对于图24的最大衬里厚度和最小衬里厚度中的每一个而言的最小和最大目标释放速率,pcl-治疗剂的不同制剂的示例性厚度和相应的总导管外径,其中所提供的厚度根据9mm导管的表面积进行标准化;和
57、图30的表提供了根据对于图24的最大衬里厚度和最小衬里厚度中的每一个而言的最小和最大目标释放速率,pcl-治疗剂的不同制剂的示例性厚度和相应的总导管外径,其中所提供的厚度根据6mm导管的表面积进行标准化。
58、在这些视图中,相应的参考字符表示相应的部件。尽管本文列出的范例以若干形式说明了本公开的实施方案,但是下面公开的实施方案并不旨在穷举或解释为将本发明的范围限制为所公开的精确形式。
59、详细说明
60、为了促进对本发明原理的理解,现在将参考附图中说明的实施方案,并且将使用具体语言来描述这些实施方案。然而,应当理解,并不旨在由此限制本发明的范围。所描述的实施方案中的任何改变和进一步修改以及如本文所述的本发明原理的任何进一步应用都被认为是本发明所属领域技术人员通常会想到的。详细示出了本发明的一个实施方案,但是对于本领域技术人员显而易见的是,为了清楚起见,可能未示出与本发明不相关的一些特征。
61、装置
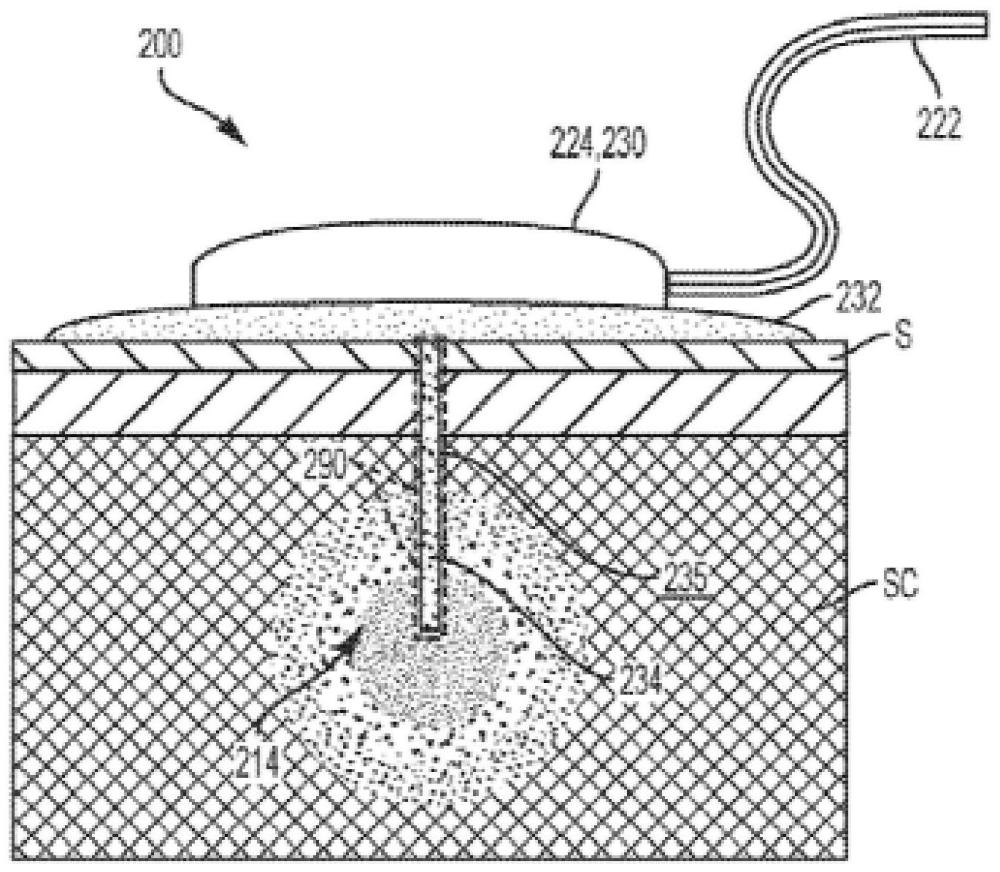
62、示例性的iis装置200显示在图2a中,用于与本文所述的治疗剂涂层和系统一起使用。装置200包括呈公扣部分的形状的基座连接器224和呈母扣部分的形状的输注套件基座230,所示输注套件基座230配置为接收基座连接器224。粘合垫232被配置为将输注基座230和偶联的基座连接器224粘附到患者的皮肤s上。输注导管234形式的输注元件被配置成插入患者的皮下sc组织中,并且被不固定地偶联到装置的输注基座230和基座连接器224。输注元件是针也在本公开的范围内。柔性线组管道222将输注基座230和基座连接器224不固定地偶联到储库连接器(未显示),该储库连接器被配置成与胰岛素储库(未显示)偶联。在使用中,胰岛素制剂从泵通过线组管道222、通过输注套件基座230中的流体路径、然后通过输注导管234、进入患者的皮下sc组织。
63、输注导管234可以由钢、塑料(例如聚四氟乙烯(ptfe)、氟化乙烯丙烯(fep)、聚丙烯、高密度聚乙烯(hdpe)、低密度聚乙烯(ldpe)、乙基醋酸乙烯酯(eva)、其共聚物及其组合)或其它适宜的材料构成。输注导管234可以足够厚以承受植入,同时足够细以提升患者舒适度。在一些实施方案中,输注导管234可以具有例如小于约200μm、小于约150μm或小于约100μm的厚度。在一些实施方案中,输注导管234可以具有小于约1mm的外径。在一些实施方案中,输注导管234可以具有约0.7mm至0.8mm的外径。
64、治疗涂层290可以位于装置200上和/或装置200中。治疗涂层290可以被配置成以延长的方式向患者释放和递送一种或多种治疗剂,如下文进一步所描述。
65、治疗涂层290向装置200的应用可以变化。在某些实施方案中,治疗涂层290可以直接结合(例如,包埋)到装置200中。在其它实施方案中,治疗涂层290可以应用(例如,涂覆)到装置200的下表面上。在其它实施方案中,治疗涂层290可以应用到安装在装置200中的过滤装置上。
66、治疗涂层290在装置200上的位置也可以变化。在图2a和2b的说明性实施方案中,例如,治疗涂层290被涂覆到输注导管234的外表面235上,以基本上覆盖外表面235。治疗涂层290可以与接触患者sc组织并与通过装置200的胰岛素制剂一起分散在患者sc组织中,这可以降低患者炎症反应的幅度或速度。在其它实施方案中,并且如上所述,治疗涂层290可以结合到输注导管234中。在该实施方案中,输注导管234和治疗涂层290可以由相同的材料整体形成。
67、治疗涂层290沿着装置200的流体通道安置也在本公开的范围内。更特别地,治疗涂层290可以位于线组管道222内部、基座连接器224内部、输注基座230内部和/或输注导管234内部,从而使得治疗涂层290可以溶解到通过装置200转运的胰岛素制剂中,以便同时递送给患者。
68、在本文所述的实施方案中,输注部位可持续至少3天、5天、7天、10天或更长时间,例如约7至14天或长达21天,这可以减少胰岛素浪费、改善血糖控制、减少疤痕形成和能够实现完全集成人工胰腺系统的每周一次或每两周一次更换时间框。装置200可以包括被设计成实现csii输注部位生存力的长久性的各种其它特征。另外的特征和特征描述可见于2019年2月21日公布的、发明名称为“infusion set with components comprisingapolymeric sorbent to reduce the concentration of m-cresol in insulin”的demaria等人的美国专利申请公布第2019/0054233号中,该文献的全部公开内容通过引用明确地并入本文。
69、涂层/制剂
70、一种示例性治疗涂层290更详细地显示在图2b中。如上文所讨论,延长释放治疗涂层290可以应用于示例性装置200的输注导管234的外表面235,其以受控的释放速率分散一种或多种治疗剂以在装置部位局部治疗患者身体。
71、治疗涂层290可以包括一种或多种抗炎剂形式的第一治疗剂250,包括非甾体抗炎治疗剂(nsaids)。示例性的抗炎剂包括例如美洛昔康、溴芬酸、布洛芬、萘普生、阿司匹林、蓝雪醌、鸡蛋花素、塞来考昔、双氯芬酸、依托度酸、吲哚美辛、酮洛芬、酮咯酸、萘丁美酮、奥沙普秦、吡罗昔康、双水杨酯、舒林酸、托美丁、雷帕霉素、地塞米松、倍他米松、肝素、西罗莫司和紫杉醇。当局部施用nsaid时,装置部位及其相应的装置200可以持续更长时间,从而为患者带来进一步的益处,包括使用更少的装置、更少的针刺以及避免与炎症反应相关的高血糖症。在插入部位处从输注导管234的外表面235局部控制释放nsaid可以允许装置部位及其相应的装置200持续长于3天、5天、7天、10天或更长的延长时间段,例如约7至14天或长达21天。
72、治疗涂层290也可以包括单独的或与抗炎的第一治疗剂250组合的其它或第二治疗剂252。示例性的第二治疗剂252包括酪氨酸激酶抑制剂(例如马赛替尼)、基质细胞蛋白血小板反应蛋白2(tsp2)抑制剂、包括结缔组织生长因子(ctgf)在内的纤维化刺激细胞因子的抑制剂、受体整联蛋白家族成员的抑制剂、血管内皮生长因子(vegf)、局部胰岛素受体抑制剂、抗微生物剂(例如银)和扩散增强剂(例如透明质酸酶)。在一个特定实例中,治疗涂层290包括第二治疗剂vegf与抗炎剂地塞米松的组合,但是也包括了其它组合。
73、治疗涂层290还可以包括一种或多种聚合物以形成治疗剂的基质252,其可以改善膜或涂层性质,改善溶解或洗脱性质,和/或给治疗涂层290向患者sc组织中的洗脱赋予时间释放效应。示例性的聚合物包括例如乙基醋酸乙烯酯(eva)、聚乙二醇(peg)、聚乙烯醇(pva)、聚乳酸(pla)、聚乙醇酸(pga)、聚(乳酸乙醇酸共聚物)(plga)、聚羟乙基甲基丙烯酸酯(phema)、聚(甲基丙烯酸)(pmaa)、藻酸盐(聚)磷酰氯和(聚)酯酰胺、聚己内酯(pcl)、热塑性聚氨酯(tpu)、羟丙基甲基纤维素(hpmc)、共聚维酮、其共聚物及其其它组合。聚合物基质252可以是不可降解的材料,当治疗剂250、258从聚合物基质252扩散时,其基本上保持完整,如本文进一步所述。
74、说明性地,如图2b所示,治疗涂层290可以包括第一治疗剂250,例如在聚合物基质252(例如eva、pcl、tpu)内捕获的nsaid(例如美洛昔康)。特别地,nsaid 250的颗粒作为结晶固体分散体离散地分散、而不是无定形地分散在聚合物基质252内。如本文进一步讨论的,在其它实施方案中,形成了治疗剂在聚合物内的无定形固体分散体,从而产生了治疗剂的无定形固体分散体。然而,在本实施方案中,如下文提供的实施例所阐述的,通过使治疗剂250保持其结晶形式而实现了治疗剂250的期望释放曲线。结晶治疗剂250还产生了离散治疗剂颗粒域,其在洗脱后留下孔254,该孔254允许体液在聚合物基质252的表面256下方运行,使得更大量的治疗剂250溶解在体液中并以延长的方式从聚合物基质252的表面256的更下方扩散。这种离散的颗粒可以通过在熔融混配聚合物治疗涂层290时将混配温度保持在聚合物252的熔点以上、但低于治疗剂250的熔点以下来实现,如下文进一步描述。如上所述,第二治疗剂258也可以根据需要分配在聚合物基质252中。
75、在一些实施方案中,可以期望较小粒度的治疗剂250、258。较小粒度可以提供更快的溶解(更快地溶解在流体中)和形成在聚合物内api(活性药物成分)网络的更好互连性,从而允许改善药物释放。在其它实施方案中,可以期望较大粒度的治疗剂250、258。在基于eva的系统的实例中,在某些实施方案中,大粒度可以使得治疗剂250、258从聚合物基质252更持续地释放。在一些实施方案中,治疗剂250、258的较大粒度产生较大的孔254,其可以允许更大量的治疗剂250、258从聚合物基质252的表面256的更下方扩散,使得治疗剂250、258更持续地释放。治疗剂250、258的平均粒度可以是约1μm至约100μm,更特别地是约5μm至约60μm。在一个实施方案中,美洛昔康的平均粒度为约7.4μm。延长释放涂层290的较高的表面积:体积比也可以引起更持续的释放,因为治疗剂250、258的洗脱导致在聚合物表面256上产生更多数量的孔254,以使得治疗剂250、258更容易从表面256的更下方扩散,同时还提供了治疗剂250、258从其洗脱的更薄的聚合物基质252。
76、对于这类实施方案,将产生的材料分类为结晶固体分散体,其中结晶形式的治疗剂250、258分散并物理包埋在聚合物基质252中。历经延长的时间段,治疗剂释放的机制涉及治疗剂250、258从聚合物基质252的溶解,在聚合物基质252中留下空隙或孔254,同时保持聚合物基质252完整。当进一步从聚合物基质252释放治疗剂颗粒时,孔254变得相互连接,并且相互连接的孔可形成通道,其可以增强治疗剂250、258从聚合物基质252内的释放。此外,在一些实施方案中,例如至少eva和pcl系统,涂层表面质地影响治疗剂释放动力学。例如,较粗糙的表面质地具有较大的表面积,在涂层表面附近提供允许流体吸收的通道,从而导致更多的api溶解和释放。在另一个实例中,更平滑的表面质地可以提供改善的插管插入、美观和涂层完整性。因此,在系统的设计中可以调节涂层的表面质地,以促进获得期望的释放速率。
77、在一个示例性实施方案中,本公开的目标释放曲线提供了历经14天对每9mm装置而言约.75mg释放的美洛昔康至1.75mg释放的美洛昔康。制剂可以包括具有例如2803a、2820a、3325a或4030ac的eva等级的聚合物基质。当聚合物基质252具有2803a的eva等级时,制剂可以包括约28%的醋酸乙烯酯百分比,熔融指数为3dg/min。当聚合物基质252具有2820a的eva等级时,制剂可以包括约28%的醋酸乙烯酯百分比,熔融指数为25dg/min。当聚合物基质252具有3325a的eva等级时,制剂可以包括约33%的醋酸乙烯酯百分比,熔融指数为约43dg/min。当聚合物基质252具有4030ac的eva等级时,制剂可以包括约40%的醋酸乙烯酯百分比,熔融指数为约55dg/min。表1提供了基本上实现了该目标释放性质的包含eva的示例性制剂。
78、
79、表1:基本上实现目标释放性质的eva聚合物基质的制剂
80、治疗涂层290可以载荷期望量的治疗剂250、258,例如约20-75wt.%,更特别是约30-75wt.%,更特别是30-65wt.%,更特别是约35-60wt.%,更特别是约40-55wt.%,和更特别是约45-55wt.%。如上表1所示,例如,对于eva涂层,治疗涂层290可以包含约55-70wt.%的美洛昔康载量,其分别相当于约42-58vol.%的美洛昔康。为了减轻不良涂层完整性的风险,以便聚合物基质252在美洛昔康释放时保持基本上完整,美洛昔康的优选载荷重量百分比可以为约55wt.%或更少,使得超过50vol.%的涂层由例如eva组成。在包括pcl-美洛昔康涂层的其它实施方案中,治疗涂层290可以包括约30-65重量%、更特别是约50重量%的美洛昔康载量。
81、治疗涂层290的涂层厚度可以为约20μm至约200μm,更特别是约40μm至约160μm。例如,涂层厚度可以为约20μm、约40μm、约60μm、约80μm、约100μm、约120μm、约140μm、约160μm、约180μm或约200μm。涂层厚度可以基于治疗剂250、258的平均粒度而变化。在一些实施方案中,涂层厚度可以是治疗剂250、258的平均粒度的约3倍至约30倍,以便治疗涂层290可以在表面256下方容纳若干“层”治疗剂颗粒250、258。
82、在一些实施方案中,涂层290的厚度可以取决于聚合物-美洛昔康制剂和导管几何形状,包括衬里厚度和导管长度。例如,示例性pcl-美洛昔康涂层厚度的范围可以是约48-224μm,包括对于13mm导管为约48-101μm,对于9mm导管为约67-139μm,或对于6mm导管为约96-224μm。在将导管总直径限制为1mm或更小的实施方案中,根据如本文进一步讨论的衬里厚度,对于约0.07-0.12mm的衬里厚度,最大涂层厚度可以是约160-210μm。
83、在一些实施方案中,如图2b所示,治疗涂层290可以至少部分地被任选的屏障层292覆盖。屏障层292可以配置为促进延迟或以其它方式抑制治疗剂250、258从下面的治疗涂层290洗脱。屏障层292可以包括例如任何适宜的材料,例如厚的硅氧烷层。在其它实施方案中,应用到导管的薄的硅氧烷涂层基本上不影响治疗剂的血浆分布和释放。
84、方法
85、基于溶剂
86、可以使用基于溶剂的方法来生产图1-2b的治疗涂层290。在这种方法中,将期望的聚合物和一种或多种治疗剂溶于溶剂中。如本文进一步讨论的,溶剂可以包括氯仿或适于溶解期望的聚合物和治疗剂的其它溶剂。
87、然后通过喷涂、涂抹、浸渍或以其它方式覆盖输注导管234,将含有溶剂、溶解的聚合物和治疗剂的溶液应用到图1、2a和2b的输注导管234的外表面235。在浸渍的情况中,例如,可以改变浸渍计数、在涂层溶液中的停留时间、浸渍速度以及浸渍之间的干燥或停留时间以获得治疗涂层290的期望涂层厚度,并且不用过度置换涂层溶液。例如,输注导管234可以浸渍一次(以产生相对薄的治疗涂层290)至五次或更多次(以产生相对厚的治疗涂层290)。此外,可以允许输注导管234在重复浸渍之间干燥,以允许每个层在被重新引入涂层溶液(可置换或以其它方式干扰前一层)之前达到更持久的状态。作为另一个实例,输注导管234可以以约1英寸/分钟至约20英寸/分钟的速度浸渍。
88、最后,允许溶剂从溶液中蒸发,在输注导管234上留下聚合物基质252和治疗剂250、258的治疗涂层290。
89、基于熔融的成型(melt-based molding)
90、可以使用基于熔融的成型方法来生产图1-2b的治疗涂层290。在这种方法中,将期望的聚合物如eva熔融。将治疗剂颗粒250、258(例如美洛昔康颗粒)混合到聚合物熔融物中。使组合的治疗剂颗粒250、258和聚合物熔融物保持低于治疗剂250、258的熔点,以避免治疗剂250、258的熔融和重结晶。这种低的温度减轻了损害聚合物基质252的内聚特性的风险,同时确保治疗剂颗粒250、258保持较大的尺寸。具有治疗剂颗粒250、258的聚合物熔融物通过加压成型、注射成型或如本文进一步描述的其它成型方法形成形状,并允许固化以形成膜。然后,可以通过粘附将膜应用到图1-2b的输注导管234。在其它实施方案中,聚合物熔融物可以经由包覆成型应用到导管234,并允许在导管234上固化。
91、热熔挤出方法
92、在一些实施方案中,可以使用单螺杆或双螺杆热熔挤出来形成图1-2b的治疗涂层290。挤出可以使用挤出机或具有单螺杆或双螺杆的料筒进行,所述螺杆旋转以将期望的熔融聚合物和治疗剂250、258通过料筒输送和混合,并从孔口出来,所述孔口将混合的聚合物和治疗剂250、258形成期望的形状,例如棒。可以使用摩擦加热或外部来源的热来达到和/或维持聚合物的熔融状态。在双螺杆挤出机中,可以使用高速能量输入双螺杆挤出机或低速后熔合双螺杆挤出机。双螺杆挤出机可以是同向旋转的或反向旋转的。
93、在一个实施方案中,使用两阶段方法。使用双螺杆挤出进行混配,以产生均匀的聚合物-治疗剂材料的粒料。在第二挤出阶段,将聚合物-治疗剂材料的粒料进料到作为形成形状步骤的单螺杆挤出方法中,例如用于将聚合物-治疗剂涂层应用到管上的包覆挤出(over-extrusion)。在其它实施方案中,第二阶段可以是微注射成型,其中将聚合物-治疗剂的粒料进料到料斗中,通过包覆成型或双射成型(two-shot molding)进行注射成型以形成导管或导管涂层234。
94、为了生产双层药物洗脱导管,可以使用双螺杆挤出进行混配以将聚合物和治疗剂混合,从而生产出目标治疗剂载荷水平(wt.%)的均匀的聚合物-治疗剂粒料。可以使用单螺杆挤出方法作为形成形状的步骤。单螺杆挤出的选择可以包括:(1)包覆挤出,其中将聚合物-治疗剂作为涂层应用到管上(聚合物衬里和管分开生产);和(2)双层管的共挤出,其中内层(衬里)是不含治疗剂的聚合物(例如hdpe、tritan、ptfe、tpu、fep等),外层或涂层是聚合物-治疗剂涂层。涂覆的管是中间产品,需要后处理以形成导管。所述后处理包括:(1)将涂覆的管切割成6mm、9mm或13mm目标长度的导管;(2)在近端处完成燃过程(flaringprocess),并将套筒(bushing)压入配合近端;和(3)完成导管尖化过程(tippingprocess),以在远端处形成导管外径和内径的逐渐变窄。然后,将双层导管组装为输注套件的一部分。
95、用于管和其它型材的注射成型方法
96、在一些实施方案中,可以使用注射成型方法来形成聚合物-api材料的成型形状。图3a和3b说明了管的两个示例性设计,包括如图3a所示的标准管或如图3b所示的锥形管。示例性的标准管具有牵伸度(degrees of draft)为0.5的测量为约2.55mm的外径、牵伸度为0.5的测量为约1.4mm的内径以及差异为0.5mm的测量为约8.6mm的长度。由内径和外径限定的管壁可以是约0.5mm厚度。示例性的锥形管具有牵伸度为0.5的测量为约2.55mm的外径、具有牵伸度为3的测量为约0.65mm尖端的内径以及在牵伸度为0.5的测量为约8.6mm的长度。注塑成型的控释系统的另外实例可以在2020年10月22日公开的、发明名称为“infusion head with controlled release of secondary drug”的carter等人的国际pct申请号pct/us2020/028195中找到,将其全部公开内容通过引用明确地并入本文。
97、用于被涂覆导管的微注射成型方法
98、微注射成型方法可以包括双射成型或包覆成型。模具可以被设计用于生产这样的导管:所述导管包括在近端处的套筒和在远端处的锥形部,因此不需要后处理步骤。第一射可以是没有治疗剂的聚合物作为衬里和套筒的材料(例如hdpe等),第二射可以是载荷有治疗剂的聚合物。特别地,可以将由双螺杆挤出混配步骤生产的聚合物-美洛昔康粒料进料到微注射成型机的料斗中用于第二射。来自双射微注射成型方法的最终产品可以是双层药物洗脱导管,其可以组装为输注套件的一部分。图4a和4b说明了通过微注射成型生产的示例性导管400。导管400包括第一射402和第二射404,第一射402包括衬里和套筒,第二射404是由聚合物和治疗剂组成的涂层。
99、实施例
100、以下实施例描述了本公开的方式、制备方法和/或使用方法,并且旨在是说明性的而不是限制性的。
101、基于溶剂的实施例1
102、将定量的eva和美洛昔康溶解在氯仿溶剂中。使用移液管将eva-美洛昔康溶液分散在teflon表面上,然后使氯仿蒸发,形成膜或试样。一旦氯仿蒸发,就将膜从teflon表面上剥离,同时保持基本上完整。将膜各自浸入磷酸盐缓冲盐水(pbs)中以产生目标治疗剂浓度,假设治疗剂释放速率为100%。使用的pbs体积根据测量的膜重量而变化。试样包括40wt.%、55wt.%或70wt.%的治疗剂载量。将每个试样皮下植入大鼠中。试样可以在植入之前立即进行硅氧烷化处理,或者也可以不进行硅氧烷化处理。对于两周的试验期,从大鼠抽取全血,从全血中分离血浆,并通过hplc-ms测量血浆美洛昔康水平。
103、图5a提供了在皮下植入后历经14天所述试样制剂的体内平均释放曲线。特别地,图5a提供了历经14天在测试大鼠中美洛昔康血浆浓度的平均水平,其中每个平均水平对应于指定的制剂。例如,将三角形数据点相连接的线502说明了来自用eva等级为2803a且包含55wt.%美洛昔康载量的膜处理的大鼠的美洛昔康血浆浓度的平均水平。将方形数据点相连接的线504说明了来自用eva等级为2820a且具有70wt.%美洛昔康载量的膜处理的大鼠的美洛昔康血浆浓度的平均水平。将菱形数据点相连接的线506说明了来自用eva等级为3325a且具有55wt.%美洛昔康载量的膜处理的大鼠的美洛昔康血浆浓度的平均水平。将圆形数据点相连接的线508说明了用eva等级为4030ac且具有70wt.%美洛昔康载量的膜处理的大鼠的美洛昔康血浆浓度的平均水平。
104、四种制剂各自的美洛昔康剂量可以根据美洛昔康载荷水平和涂层厚度而不同。图5b提供了历经14天在测试大鼠中美洛昔康血浆浓度的平均剂量标准化水平。例如,将三角形数据点相连接的线510说明了来自用eva等级为2803a且具有55wt.%美洛昔康载量的膜处理的大鼠的剂量标准化美洛昔康平均血浆浓度。将方形数据点相连接的线512说明了来自用eva等级为2820a且具有70wt%美洛昔康载量的膜处理的大鼠的剂量标准化美洛昔康平均血浆浓度。将菱形数据点相连接的线514说明了来自用eva等级为3325a且具有55wt%美洛昔康载量的膜处理的大鼠的剂量标准化美洛昔康平均血浆浓度。将圆形数据点的线516说明了来自用eva等级为4030ac且具有70wt%美洛昔康载量的膜处理的大鼠的剂量标准化美洛昔康平均血浆浓度。
105、如图5b所示,每种膜的释放曲线在前三天相对于其它膜可以变化,这取决于使用的eva制剂。然而,剩余天数的释放曲线基本上相同。因此,为了治疗目的,可以改变制剂以满足个性化目标。例如,如线516所示,具有eva等级为4030ac且具有70wt.%美洛昔康载量的膜具有最高的美洛昔康峰浓度。另外,如线512所示,具有eva等级为2820a且具有70wt.%美洛昔康载量的膜具有最低的美洛昔康峰浓度。当期望高的美洛昔康洗脱的初始突释时,可以使用与线516一致的具有70wt.%美洛昔康载量的eva 4030ac制剂。当期望低的美洛昔康洗脱的初始突释时,可以使用与线512一致的具有70wt.%美洛昔康载量的eva 2820a制剂。
106、如上所述,在植入之前,可以用硅氧烷涂覆膜。图6说明了通过将膜浸入硅氧烷油中以形成厚的硅氧烷层的这种硅氧烷化的示例性效果,如下详述。例如,图520说明了硅氧烷油对具有eva等级为2803a且具有55wt.%美洛昔康载量的膜的剂量标准化释放曲线的影响,其中实线520a说明了未硅氧烷化的膜的平均释放曲线,短划线520b说明了用高粘度油硅氧烷化的膜的平均释放曲线,虚线520c说明了用低粘度油硅氧烷化的膜的平均释放曲线。图522说明了硅氧烷油对具有eva等级为2820且具有70wt.%美洛昔康载量的膜的剂量标准化释放曲线的影响,其中实线522a说明了未硅氧烷化的膜的平均释放曲线,短划线522b说明了用高粘度油硅氧烷化的膜的平均释放曲线,虚线522c说明了用低粘度油硅氧烷化的膜的平均释放曲线。
107、图524说明了硅氧烷油对具有eva等级为3325a且具有55wt.%美洛昔康载量的膜的剂量标准化释放曲线的影响,其中实线524a说明了未硅氧烷化的膜的平均释放曲线,短划线524b说明了用高粘度油硅氧烷化的膜的平均释放曲线,虚线520c说明了用低粘度油硅氧烷化的膜的平均释放曲线。图526说明了硅氧烷油对具有eva等级为4030ac且具有70wt.%美洛昔康载量的膜的剂量标准化释放曲线的影响,其中实线526a说明了未硅氧烷化的膜的平均释放曲线,短划线526b说明了用高粘度油硅氧烷化的膜的平均释放曲线,虚线526c说明了用低粘度油硅氧烷化的膜的平均释放曲线。
108、硅氧烷层(特别是线520b、522b、524b和526b的高粘度硅氧烷层)用作扩散屏障,其使得如所示那样美洛昔康的吸收减少和/或延迟,特别是在初始突释洗脱时,如图6所示。另外可以使用薄的硅氧烷油层来提供较小或可忽略的屏障作用,而较厚的硅氧烷油层可以用来控制美洛昔康的洗脱,如所示那样。
109、使用用于将大鼠血浆曲线浓度转化为体内释放曲线的去卷积模型计算了体内释放曲线。去卷积方法是一种估计输入函数的技术,所述输入函数是来自eva-美洛昔康试样的释放曲线,对于系统给出相应的输入-响应函数(其是来自eva-美洛昔康试样的血浆浓度数据)和脉冲响应函数(其是iv推注剂量后的血浆浓度曲线)。该模型的关键假设如下:(i)皮下剂量显示非常快的吸收,假设其行为像iv给药,因此被用作脉冲响应函数,(ii)线性度:f(d1+d2)=f(d1)+f(d2),和(iii)时间不变性:无论何时给予d,f(d)都具有相同的形状。图7说明的体内释放曲线是使用考虑了吸收和系统清除的去卷积模型由图5b所示的大鼠血浆浓度计算的。
110、基于溶剂的实施例2
111、参考图8-11的实施例,为了将eva-美洛昔康溶液应用于导管602,使用了浸涂方法。如上文所讨论,使用校准天平和移液管将eva聚合物溶解在氯仿中以达到目标eva浓度。具体而言,以60mg/ml的目标浓度制备了eva2820a,以100mg/ml的目标浓度制备了eva3325a。向每种溶液中加入美洛昔康以达到目标浓度。具体而言,将美洛昔康以70wt.%加入eva2820a溶液中,以55wt.%加入eva3325a溶液中。将溶液在各自的小瓶中合并。
112、现在参考图8-10,将导管602安装到针604上,使得导管602的尖端和针604的尖端对准。针604的近端偶联在压力测试组件608的卡盘(chuck)606内,特别是thwing albert测试框。将含有预期溶液的小瓶610设置在压力测试仪608的可移动台612上。压力测试仪608启动可移动台612,使得小瓶610被升起直到导管602浸没在溶液内。导管602以18英寸/分钟的速率浸渍。图11说明了示例性导管602,其具有由本文讨论的浸渍方法产生的eva-美洛昔康涂层614。
113、基于熔融的成型实施例3
114、在该实施例中,美洛昔康和乙基醋酸乙烯酯(eva)的片材是通过熔融混配和加压成型形成的,具有标称厚度90μm、120μm或150μm。使用冲压机从这些片材模切出微型拉伸棒,然后使用测微计测量每个微型拉伸棒的实际厚度。
115、在23℃和50%rh下,在instron中以5in/min的延伸速率一式三份地拉所述微型拉伸棒,以测量每个微型拉伸棒的最大载荷下应力、最大载荷下应变和杨氏模量。
116、应力测量在图12a、12b和12c中给出。图12a提供了对于具有相同的特征性标称厚度、聚合物类型和相应的熔融指数以及洗脱前治疗剂载荷的每类微型拉伸棒而言在最大载荷下的平均应力。图12b提供了对于具有相同的特征性标称厚度、聚合物类型和相应的熔融指数以及洗脱后治疗剂载荷的每类微型拉伸棒而言在最大载荷下的平均应力。图12c提供了对于具有相同的特征性标称厚度、聚合物类型和相应的熔融指数以及治疗剂载荷的每类微型拉伸棒而言在洗脱前和洗脱后之间在最大载荷下的平均应力变化。
117、从图12a、12b和12c的实例中观察到了以下效果。增加治疗剂载荷降低了所有其它特征性类型的拉伸强度,因为治疗剂颗粒的增加可破坏周围聚合物基质的聚合物链交错接合。另外,拉伸强度倾向于随着熔融指数增加而降低,其中由2803a组成的微型拉伸棒显示出最高的拉伸强度,由3325a组成的微型拉伸棒显示出最低的拉伸强度。然而,这些熔融指数效应仅在具有25%的最低治疗剂载量的微型拉伸棒中可观察到;加入美洛昔康足以使得聚合物弱化到不能再观察到聚合物类型之间的差异。对于大多数微型拉伸棒特征性类型,在治疗剂洗脱对微型拉伸棒的平均拉伸强度的影响方面几乎没有可观察到的趋势。通常,观察到20%或更小的变化。
118、应变测量在图13a、13b和13c中给出。图13a提供了对于具有相同的特征性标称厚度、聚合物类型和相应的醋酸乙烯酯百分比以及洗脱前治疗剂载荷的每类微型拉伸棒而言在最大载荷下的平均应变。图13b提供了对于具有相同特征性的标称厚度、聚合物类型和相应的醋酸乙烯酯百分比以及洗脱后治疗剂载荷的每类微型拉伸棒而言在最大载荷下的平均应变。图13c提供了对于具有相同的特征性标称厚度、聚合物类型和相应的醋酸乙烯酯百分比以及治疗剂载荷的每类微型拉伸棒而言在洗脱前和洗脱后之间在最大载荷下的平均应变变化。
119、从图13a、13b和13c的实例中观察到了以下效果。增加治疗剂载荷降低了所有其它特征性类型在最大载荷下的应变,因为治疗剂颗粒的增加可破坏周围聚合物基质的聚合物链交错接合。随着醋酸乙烯酯的百分比增加,最大载荷下的应变倾向于增加。例如,如所示那样,由1241a组成的微型拉伸棒在最大载荷下平均为最低应变,而由3325a组成的微型拉伸棒在最大载荷下平均为最高应变。对于治疗剂载量,可观察到应变和醋酸乙烯酯百分比之间的这种趋势。对于在洗脱前在最大载荷下显示出极低应变的微型拉伸棒(即,具有50%治疗剂载荷的1241a;具有150μm标称厚度和40%治疗剂载荷的12471a;具有90μm或150μm标称厚度和50%治疗剂载荷的2803a),在洗脱后观察到应变的增加。因为洗脱前应变如此低,所以在图13c中观察到洗脱前和洗脱后之间应变的显著变化。
120、杨氏模量测量在图14a、14b和14c中给出。图14a提供了对于具有相同的特征性标称厚度、聚合物类型和相应的醋酸乙烯酯百分比以及洗脱前治疗剂载荷的每类微型拉伸棒而言的平均杨氏模量。图14b提供了对于具有相同的特征性标称厚度、聚合物类型和相应的醋酸乙烯酯百分比以及洗脱后治疗剂载荷的每类微型拉伸棒而言的平均杨氏模量。图14c提供了对于具有相同的特征性标称厚度、聚合物类型和相应的醋酸乙烯酯百分比以及治疗剂载荷的每类微型拉伸棒而言在洗脱前和洗脱后之间的平均杨氏模量变化。
121、从图14a、14b和14c中观察到了以下效果。增加治疗剂载量增加了所有样品的杨氏模量,因为治疗剂颗粒的增加可破坏周围聚合物基质的聚合物链交错接合。随着醋酸乙烯酯的百分比增加,杨氏模量趋向于降低。例如,如所示那样,由1241a组成的微型拉伸棒平均为最高杨氏模量值,而由3325a组成的微型拉伸棒平均为最低杨氏模量值。如图14c所示,暴露于洗脱缓冲液通常使杨氏模量随着微型拉伸棒变得不太脆而降低。对于具有高治疗剂载荷和高百分比醋酸乙烯酯的样品,这种效果更大。随着治疗剂从聚合物洗脱,聚合物链变得水合,特别是在聚合物更亲水和具有高百分比的醋酸乙烯酯时,例如3325a。
122、基于熔融的成型实施例4
123、进行有限元件分析以对各种导管配方和几何形状建模,以比较对机械载荷的响应,包括对径向挤压和轴向屈曲的响应。根据图15a提供的信息形成了导管几何形状和材料的十六种不同组合。另外,根据如图15b所示的几何形状“e”和“f”形成了导管,其中这些导管各自包括聚四氟乙烯(ptfe)和低密度聚乙烯(ldpe)中的至少一种的内部材料。几何形状“a”;“b”;“c”;“d”;“e”;和“f”是根据图15b中给出的规格形成的,其中尺寸以毫米显示,几何形状“b”和“c”包括外部材料,而几何形状“a”、“d”、“e”和“f”不包括外部材料。内部材料包括下述中的至少一种:ptfe;ldpe;无治疗剂载荷的1241a(“1241(净)”);或洗脱前具有50%治疗剂载荷的1241a(“1241-50”),如图15a中所示和所述。对于包括外部材料的导管,外部材料包括下述中的至少一种:洗脱前具有50%治疗剂载荷的1241a;洗脱前具有25%治疗剂载荷的3325a(“3325a-25”);洗脱前具有50%治疗剂载荷的3325a(“3325a-50”);洗脱后具有50%治疗剂载荷的3325a;和洗脱后具有50%治疗剂载荷的2803a(“2803a-50”)。
124、为了分析每个测试导管的径向挤压响应,将直径为1mm的刚性不锈钢圆柱体放置约0.2mm进入导管侧壁。在距测试导管尖端6mm处施用负载。为了分析每个测试导管的轴向屈曲,将测试导管的整个底表面固定地偶联到固定表面,然后在测试导管的上表面上施用轴向负载。这种测试的结果可以在图15c中找到,其中对于该实验发现:较硬的内部材料与较不硬的内部材料相比改善了性能,并且较硬的涂层材料与较不硬的内部材料相比改善了性能。值得注意的是,在该实施例中,涂层的刚硬度减小了内部材料的影响。另外,在该实施例中,较薄的内部材料壁在挤压和屈曲测试期间降低了性能。最终,所述发现得出如下结论:包括涂层的导管可以加入到现有的ptfe导管或增厚的ldpe导管中,并且在挤压和/或屈曲事件中表现得与常规ptfe导管一样。
125、基于熔融的成型实施例5
126、在该实施例中,使用具有55wt.%美洛昔康的治疗剂载荷的eva 3325a制备膜试样。以90μm的测量厚度制备了每个试样,其中美洛昔康的粒度为d90=26μm或d90=50μm。对于洗脱测试,将每个涂覆单丝样品在漏槽条件(sink conditions)下浸入ph7.4的磷酸盐缓冲盐水中,于37℃培养,以50rpm振荡14天研究持续时间。在整个洗脱研究的预定点,从溶液中取等分试样并进行置换,通过吸光度测量等分试样中的美洛昔康浓度。
127、图16说明了根据测量的美洛昔康粒度制备的试样的平均治疗剂释放曲线。虚线1000a说明了最小目标治疗剂释放曲线,虚线1000b说明了最大目标治疗剂释放曲线。将中空菱形数据点相连接的线1000c说明了对于具有美洛昔康粒度d90=26μm的试样的平均治疗剂释放曲线,将阴影菱形数据点相连接的线1000d说明了具有美洛昔康粒度d90=50μm的的试样的平均治疗剂释放曲线。如所示那样,具有美洛昔康粒度d90=50μm的试样最接近地符合目标治疗剂释放曲线。
128、包覆挤出涂覆单丝实施例6
129、在该实施例中,使用包括双螺杆挤出混配步骤的两步热熔挤出方法制造了eva-美洛昔康涂覆的尼龙单丝,其中将eva 3325a和美洛昔康混合以产生具有55wt.%美洛昔康载量的均匀eva-美洛昔康粒料。所述两步热工艺还包括单螺杆挤出成型步骤。在成型步骤期间,将eva-美洛昔康粒料进料到具有十字头的单螺杆挤出机中,该挤出机用于将100μm厚的eva-美洛昔康涂层应用到直径为0.73mm的尼龙单丝上,得到最终总直径为0.93mm的eva-美洛昔康涂覆的尼龙单丝。
130、在双螺杆挤出步骤和单螺杆挤出步骤之后,测试了涂覆单丝样品。所有涂覆单丝样品均未灭菌。对于洗脱测试,将每个涂覆单丝样品在漏槽条件下浸入ph7.4的磷酸盐缓冲盐水中,于37℃培养,以50rpm振荡14天研究持续时间。在整个洗脱研究的预定点,从溶液中取等分试样并进行置换。通过美洛昔康效力测定测量了每个等分试样中的美洛昔康浓度。
131、图17说明了制备的涂覆单丝的平均治疗剂释放曲线。将所示的累积释放曲线标准化为9mm导管的表面积。虚线1500a说明了最小目标治疗剂释放曲线,虚线1500b说明了最大目标治疗剂释放曲线。线1500c说明了用高速和高温挤出制备的单丝样品的平均治疗剂释放曲线。线1500d说明了用高速和低温挤出制备的单丝样品的平均治疗剂释放曲线。线1500e说明了用低速和高温挤出制备的单丝样品的平均治疗剂释放曲线。线1500f说明了用低速和低温挤出制备的单丝样品的平均治疗剂释放曲线。如所示那样,历经14天,每个平均单丝样品释放曲线满足目标治疗剂的目标释放。
132、包覆挤出涂覆单丝实施例7
133、在该实施例中,使用两步热熔挤出方法制备了用聚己内酯(“pcl”)和美洛昔康涂层涂覆的尼龙单丝。使用双螺杆挤出完成混配步骤,以混合pcl和美洛昔康以产生均匀的pcl-美洛昔康粒料。具体而言,所述制剂由具有50wt.%美洛昔康载量的pc 17(corbion)组成。然后,将粒料进料到单螺杆挤出机中用于成型过程。单螺杆挤出机具有十字头,以将厚度约100μm的pcl-美洛昔康涂层应用到直径为0.73mm的尼龙单丝上,得到总直径为0.93mm的pcl-美洛昔康涂覆的尼龙单丝。为了评估加工条件对美洛昔康从pcl-美洛昔康涂层中释放的影响,如下表2所示测试了单螺杆挤出步骤的螺杆速度和加工温度的高值和低值。最终产品是pcl-美洛昔康涂覆的尼龙单丝,并且在检查横截面时发现涂层是高度同心的,如图18所示。
134、 制剂 目标涂层厚度(μm) 螺杆速度(rpm) 加工温度(℃) 具有50wt.%的pc17 100-130 2(高) 145(高) 具有50wt.%的pc17 100-130 2(高) 135(低) 具有50wt.%的pc17 100-130 1(低) 145(高) 具有50wt.%的pc17 100-130 1(低) 135(低)
135、表2:单螺杆挤出加工条件
136、从溶剂提取和美洛昔康效力测定中,所有样品的药物载荷测定为约49wt%美洛昔康,这与50wt%美洛昔康的目标标称载荷一致。结果表明,在该实施例中的加工条件,包括螺杆速度和加工温度,对美洛昔康载荷水平具有最小的影响至没有影响。
137、对于洗脱测定,将每种涂覆单丝样品在漏槽条件下浸入ph7.4的磷酸盐缓冲盐水中,于37℃培养并以50rpm振荡14天研究持续时间。在整个洗脱研究的预定点,从溶液中取等分试样并进行置换。通过美洛昔康效力测定测量了每个等分试样中美洛昔康的浓度。
138、现在参考图19a-d,给出了每6mm导管和9mm导管的体外释放数据。根据具有100-130μm涂层厚度的标准商业导管的表面积,使得6mm导管和9mm导管的表面积分别为16.6mm2和24.9mm2,按比例缩放每个样品的美洛昔康累积释放。另外,释放速率(mg/d)是累积释放曲线的导数。
139、特别地参考说明每个6mm导管的累积释放曲线速率的图19a,线1600a说明了最小目标治疗剂释放曲线。线1600b说明了最大目标治疗剂释放曲线。将倒三角形数据点相连接的线1600c说明了经受高速和高温工艺的样品的释放曲线。将圆形数据点相连接的线1600d说明了经受高速和低温工艺的样品的释放曲线。将正三角形数据点相连接的线1600e说明了经受低速和高温工艺的样品的释放曲线。将菱形数据点相连接的线1600f说明了经受低速和低温工艺的样品的释放曲线。
140、现在参考说明每个9mm导管的累积释放曲线的图19b,线1602a说明了最小目标治疗剂释放曲线。线1602b说明了最大目标治疗剂释放曲线。将倒三角形数据点相连接的线1602c说明了经受高速和高温工艺的样品的释放曲线。将圆形数据点相连接的线1602d说明了经受高速和低温工艺的样品的释放曲线。将正三角形数据点相连接的线1602e说明了经受低速和高温工艺的样品的释放曲线。将菱形数据点相连接的线1602f说明了经受低速和低温工艺的样品的释放曲线。
141、现在参考说明每个6mm导管的释放速率的图19c,线1604a说明了最小目标治疗剂释放曲线。线1604b说明了最大目标治疗剂释放曲线。将倒三角形数据点相连接的线1604c说明了经受高速和高温工艺的样品的释放曲线。将圆形数据点相连接的线1604d说明了经受高速和低温工艺的样品的释放曲线。将正三角形数据点相连接的线1604e说明了经受低速和高温工艺的样品的释放曲线。将菱形数据点相连接的线1604f说明了经受低速和低温工艺的样品的释放曲线。
142、图19d说明了每个9mm导管的释放速率,线1606a说明了最小目标治疗剂释放曲线。线1606b说明了最大目标治疗剂释放曲线。将倒三角形数据点相连接的线1606c说明了经受高速和高温工艺的样品的释放曲线。将圆形数据点相连接的线1606d说明了经受高速和低温工艺的样品的释放曲线。将正三角形数据点相连接的线1606e说明了经受低速和高温工艺的样品的释放曲线。将菱形数据点相连接的线1606f说明了经受低速和低温工艺的样品的释放曲线。
143、如图19a和19b所示,具有~100-130μm厚度的pcl-美洛昔康涂层的单丝样品的体外药物释放曲线达到并超过6mm和9mm导管的目标释放曲线。在10天时间点的累积释放曲线中记录的下降可能是由于源自高效液相色谱法校准误差的测量误差。释放曲线具有初始突释,然后历经14天持续释放。
144、另外参考图19c和19d,释放速率曲线显示了释放速率随时间的变化,在第7-10天左右的释放中存在一些平台期。在第一个小时内存在初始突释,对于6mm导管速率为~1.3mg/d,对于9mm导管速率为~2.0mg/d。在初始突释后,释放速率开始稳定并从第2天到第7天保持相对恒定,其在0.0675-0.135mg/d的目标每日释放速率范围内。然后,在第14天,每日释放速率下降至略低于目标范围。对于9mm导管,从第2天至第7天的释放速率略高于0.135mg/d的最大目标释放速率,然后每日释放速率下降至0.0675mg/d的最小目标释放速率附近。体外释放结果表明,6mm和9mm导管的100-130μm涂层是实现体内目标释放的候选者。另外,加工条件(包括螺杆速度和加工温度)的影响在该实施例中是最小的,表明该方法在测试的加工窗口内是稳健的。
145、微注射成型实施例8
146、在该实施例中,设计了具有代表商业导管的尺寸(例如壁厚和长度)的双射圆柱体模具,其中第一射是用于提供机械完整性的仅聚合物的衬里材料,第二射是用于控制美洛昔康释放到局部皮下组织的pcl-美洛昔康涂层护套。圆柱体模具包括多个插入件,用于区分第一射和第二射的壁厚以及对应于6mm和9mm导管的两个长度。所述模具还具有双重门控以促进流出和压力的平衡。芯杆尺寸保持恒定在0.432mm。对于第一射和第二射中的每一个,最小壁厚为0.076,得到0.152mm的最小总壁厚和0.736mm的总最小外径。最大总壁厚为0.254mm,总最大外径为0.940mm。
147、使用20吨sodick(型号lp20eh2,系列1073)成型机形成了双射圆柱体模制部件。用于第一射的材料是高密度聚乙烯(“hdpe”)borealis bormed he7541-ph。用于第二射的材料是pc17(在上文实施例12中进一步讨论),其具有50wt.%美洛昔康载荷,作为在预处理混配步骤中通过双螺杆挤出形成的粒料供应。对于第一射,对于6mm和9mm导管长度,以三种不同的壁厚生产了hdpe部件:0.076mm、0.102mm和0.127mm。
148、对于hdpe的第一射,对于6mm和9mm导管长度,对于降低至0.076mm的壁厚,部件实现了完全填充。所有部件在不使用脱模剂的情况下容易地从芯杆移除。图20显示了用于6mm导管长度的hdpe的第一射的示例性模制部件。对于具有50wt.%美洛昔康的pc17的第二射,对于9mm长度,对于0.127mm、0.152mm和0.178mm的壁厚,实现了完全填充。图21显示了对于9mm导管长度的hdpe的第一射和具有50wt.%美洛昔康载荷的pcl的第二射的示例性成型。因为9mm长度的填充比较短的6mm长度更具挑战性,所以假设对于6mm长度可以实现对于0.127mm和0.152mm的第二射壁厚的完全填充。测试了用于6mm导管的0.178mm壁厚,并实现了完全填充。
149、下表3显示了对于6mm和9mm导管长度的第二射、装载在涂层中的美洛昔康剂量和实现的导管尺寸的填充结果。对于6mm长度的每个导管部件中装载的美洛昔康剂量对于14天目标剂量在0.945-1.89mg的范围内,对于9mm长度的部件超过该14天目标剂量范围。双射成型导管的总外径为0.889-0.940mm,这满足了该实施例中导管的总外径不应超过1mm的指导。
150、 <![cdata[<u>长度</u>]]> <![cdata[<u>6mm</u>]]> <![cdata[<u>9mm</u>]]> <![cdata[<u>9mm</u>]]> <![cdata[<u>9mm</u>]]> <![cdata[<u>9mm</u>]]> <![cdata[<u>第二射壁厚(mm)</u>]]> <![cdata[<u>0.178</u>]]> <![cdata[<u>0.127</u>]]> <![cdata[<u>0.152</u>]]> <![cdata[<u>0.152</u>]]> <![cdata[<u>0.178</u>]]> 第二射填充 完成 完成 完成 完成 完成 美洛昔康载荷剂量(mg) 1.710 1.832 2.125 2.272 2.565 第一射壁厚(mm) 0.076 0.102 0.076 0.102 0.076 总外径(mm) 0.940 0.889 0.889 0.940 0.940
151、表3:对于6mm和9mm导管长度,具有50wt.%美洛昔康的pc17的第二射的填充结果
152、参考图22,给出了每9mm导管的体外累积美洛昔康释放。线1700a说明了最小目标治疗剂释放曲线。线1700b说明了最大目标治疗剂释放曲线。线1700c说明了在尼龙丝上具有50wt.%美洛昔康载量的包覆挤出pc17涂层的治疗剂释放曲线,其中涂层测量为~100-130μm。线1700d说明了微模制圆柱体部件的治疗剂释放曲线,其中具有50wt.%美洛昔康载量的pc17的第二射包覆hdpe的微成型第一射,所述微成型第二射具有128μm的厚度。
153、与接近最大目标释放的包覆挤出样品(1700c)相比,从微成型部件的释放(1700d)接近最小目标释放。微成型部件的释放曲线(1700d)显示历经14天持续释放,具有相对线性的释放曲线。在进一步表征两个样品时,观察到表面质地的差异,其影响药物释放。如图23a所示,在如上所述测试的所有四种条件下,包覆挤出样品具有半粗糙的表面质地,而微成型样品如图23b所示具有更光滑的表面光洁度。
154、涂层厚度实施例9
155、对于上述讨论的eva-美洛昔康制剂和pcl-美洛昔康制剂,由不同制剂的实验结果计算了涂层厚度。参考图24,根据最小目标释放速率(0.0675mg/天,在14天总共0.945mg美洛昔康)、最大目标释放速率(0.135mg/天,在14天总共1.89mg美洛昔康)和三种不同的导管长度,计算了最大衬里厚度几何形状2800和最小衬里厚度几何形状2802的厚度。
156、根据上述提供的体外洗脱结果计算了表面积标准化的平均释放速率。特别地,平均释放速率计算为历经14天释放速率的加权平均值,因为释放速率历经14天不恒定。根据导管长度,将平均释放速率根据样品的表面积进行标准化。基于表面积标准化的实验平均释放速率,使用以下方程计算了涂层厚度,其中m=质量,v=体积,p=密度,w=重量分数,a=面积,r=半径,d=直径,h=高度,和φ=体积分数。这些计算假设导管是中空圆柱体。
157、目标表面积的方程如下:
158、
159、导管的总半径的方程如下,其中目标表面积和高度是已知的:
160、a圆柱体=2πrh+2πr2
161、假设导管的表面积没有端部,则表面积可以简化为:
162、a=2πrh
163、总直径的方程如下:
164、d总=2r总
165、涂层厚度的方程如下:
166、厚度=r总-r衬里
167、为了确定聚合物-美洛昔康层的涂层厚度是否具有足够量的美洛昔康以获得目标美洛昔康14天剂量(0.945-1.89mg),使用以下方程基于涂层体积计算了涂层中载荷的美洛昔康的质量。涂层体积的方程为:
168、v涂层=v管=πh[(d总/2)2-(d衬里/2)2][=]mm3
169、基于上述计算的涂层体积,载荷美洛昔康的质量的方程如下,其中涂层体积、美洛昔康密度、聚合物密度和药物重量是已知的:
170、
171、质量平衡的方程如下:
172、m涂层=m药物+m聚合物
173、
174、
175、体积平衡的方程如下:
176、v涂层=v药物+v聚合物
177、
178、当代入聚合物质量时,所述方程变成:
179、
180、为了求解美洛昔康的质量,使用以下方程:
181、
182、如果美洛昔康的质量大于或等于目标14天美洛昔康剂量,则报告了根据表面积标准化的基于实验平均释放速率计算的涂层厚度。然而,如果美洛昔康的质量低于目标14天美洛昔康剂量,则基于目标美洛昔康剂量计算了涂层厚度。在这种情况中,基于目标美洛昔康剂量的涂层厚度大于基于实验释放速率的涂层厚度。根据以下方程计算了基于目标美洛昔康剂量的涂层厚度:
183、
184、为了计算总外径,其中涂层体积和衬里直径是已知的:
185、v涂层=πh[(d总/2)2-(d衬里/2)2]
186、为了求解总外径:
187、
188、为了计算总半径:
189、d总=2r总
190、为了求解涂层厚度:
191、厚度=r总-r衬里
192、图25-27分别提供了13mm、9mm和6mm导管的测试eva-美洛昔康涂层的厚度,以及对于最大衬里厚度和最小衬里厚度各自的最小和最大目标释放速率的相应总导管外径。基于实验平均释放速率计算了涂层厚度,除非涂层厚度值加下划线,表明涂层厚度是基于目标美洛昔康剂量计算的。
193、参考图25,对应于13mm的导管长度,假定理想的总导管直径小于1mm且操作的总导管直径为1.5mm或更小,经受所有测试的加工方法的具有40-55wt.%美洛昔康载量的eva-美洛昔康制剂eva 2803a满足了理想的总直径。另外,具有50wt.%美洛昔康载量的eva-美洛昔康制剂eva 2020a满足了理想的总直径。经受基于熔融的成型和挤出加工方法的具有50-55wt.%美洛昔康载量的eva-美洛昔康制剂eva 3325a满足了理想的总直径。对于满足最小释放速率的最大和最小衬里直径中的每一个,经受基于溶剂的方法的具有55wt.%美洛昔康载量的eva-美洛昔康制剂eva 3325a满足了理想总直径;然而,对于满足最大释放速率的最大和最小衬里直径中的每一个,该制剂满足了操作总直径。
194、参考图26,对应于9mm导管长度并假设与上述相同的导管直径类别,对于满足最小释放速率的最大和最小衬里直径中的每一个,经受所有测试的加工方法的具有40-55wt.%美洛昔康载量的eva-美洛昔康制剂eva 2803a满足了理想的总直径;然而,对于满足最大释放速率的最大和最小衬里直径中的每一个,这些制剂满足了操作总直径,例外的是经受基于熔融的成型的具有50wt.%美洛昔康的eva 2803a,其满足了所有构型的理想总直径。经受基于熔融的成型加工方法的具有50wt.%美洛昔康载量的eva-美洛昔康制剂eva 2020a和具有50wt.%美洛昔康载量的eva 3325a满足了理想的总直径。对于满足最小释放速率的最大和最小衬里直径中的每一个,经受基于溶剂和挤出加工方法的具有55wt.%美洛昔康载量的eva-美洛昔康制剂eva 3325a满足了理想总直径;然而,对于满足最大释放速率的最大和最小衬里直径中的每一个,这些制剂满足了操作总直径。
195、参考图27,对应于6mm导管长度并假设与上述相同的导管直径类别,对于满足最小释放速率的最大和最小衬里直径中的每一个,经受基于熔融的成型加工方法的具有40-50wt.%美洛昔康载量的eva-美洛昔康制剂eva 2803a、经受基于熔融的成型加工方法的具有50wt.%美洛昔康载量的eva 2029a和经受基于熔融的成型加工方法的具有55wt.%美洛昔康的eva 3325a满足了理想总直径;然而,对于满足最大释放速率的最大和最小衬里直径中的每一个,这些制剂满足了操作总直径。对于满足最小释放速率的最大和最小衬里直径中的每一个,经受基于溶剂的加工方法的具有55wt.%美洛昔康载量的eva-美洛昔康制剂eva 2803a和经受基于溶剂和挤出加工方法的具有55wt.%美洛昔康载量的eva 3325a满足了理想总直径。
196、图28-30分别提供了13mm、9mm和6mm导管的测试的pcl-美洛昔康涂层的厚度,以及对于最大衬里厚度和最小衬里厚度各自的最小和最大目标释放速率的相应的总导管外径。基于实验平均释放速率计算了涂层厚度,除非涂层厚度值加了下划线,表明该涂层厚度是基于目标美洛昔康剂量计算的。根据不同的加工方法,根据上文讨论的具有50wt.%美洛昔康载荷的pc17制剂进行所有计算。
197、参考图28,对应于13mm的导管长度,假定理想的总导管直径小于1mm且操作总导管直径为1.5mm或更小,经受所有测试的加工方法的pcl-美洛昔康制剂满足了理想总直径。还参考图29,对应于9mm导管长度并假定与上述相同的导管直径类别,经受所有测试的加工方法的pcl-美洛昔康制剂满足了理想总直径。
198、参考图30,对应于6mm导管长度并假定与上述相同的导管直径类别,对于满足最小释放速率的最大和最小衬里直径中的每一个以及对于满足最大释放速率的最小衬里直径,经受低速加工方法的pcl-美洛昔康制剂满足了理想总直径;然而,对于满足最大释放速率的最大衬里直径,这些制剂满足了操作总直径。对于满足最小释放速率的最大和最小衬里直径中的每一个,经受高速加工方法的pcl-美洛昔康制剂满足了理想总直径;然而,对于满足最大释放速率的最大和最小衬里直径中的每一个,该制剂满足了操作总直径。
199、下表4和5提供了导管长度为6mm、9mm和13mm的两种测试聚合物基质各自的示例性最小壁厚。所提供的测量各自假定了最小目标美洛昔康剂量为0.945mg,历经14天100%释放,并且美洛昔康载量为55wt.%。然而,测量没有考虑表面积对释放速率的影响。
200、
201、表4:对于最大衬里厚度,根据6mm、9mm和13mm导管标准化的eva和pcl制剂的最小涂层厚度。
202、
203、表5:对于最小衬里厚度,根据6mm、9mm和13mm导管标准化的eva和pcl制剂的最小涂层厚度。
204、虽然已经将本发明的实施方案描述为具有示例性的设计,但是本公开的实施方案可以在本公开的宗旨和范围内进一步改变。因此,本技术旨在涵盖使用其一般原理的所公开的实施方案的任何变型、用途或改编。
技术实现思路
- 还没有人留言评论。精彩留言会获得点赞!