一种特异性靶向肺部炎症组织的工程化间充质干细胞仿生柔性脂质体及其制备方法和应用
本发明涉及药物靶向递送系统领域,具体涉及一种特异性靶向肺部炎症组织的工程化间充质干细胞仿生柔性脂质体及其制备方法和应用。
背景技术:
1、肺脏是人体进行气体交换的门户,不断暴露于外界环境刺激,因此容易受到各种外界病因影响而引发炎症。由于肺部感染或损伤引起的肺部炎症疾病也是目前临床上最常见的肺部疾病。目前,临床上对肺部炎症的治疗主要以支持治疗和药物治疗为主,但这些策略都存在着一些不足和局限性。
2、针对肺部炎症的药物治疗面临的其中一个瓶颈问题是有效的肺部药物递送载体的缺乏,导致药物的生物利用度低、体内清除速度快,且由于缺乏对肺部炎症部位的特异性靶向,容易引起全身性的毒副作用。比如,皮质类固醇类药物甲泼尼龙是常用于治疗急性肺损伤引起的肺部炎症药物。临床上,常使用大剂量甲泼尼龙注射来维持肺内足量的药物浓度,发挥其药效作用。但是大剂量注射甲泼尼龙会导致免疫功能的下降,诱发继发性感染,对肝脏功能也有损害。采用合适的药物载体来靶向递送抗炎药物至肺部炎症组织被认识是一种行之有效的解决方法,既可以提高抗炎药物在炎症组织的浓集,提高疗效,减少用药剂量,还可以减少抗炎药物向其中组织的分布,避免毒副作用。因此,研发高效的靶向肺脏炎症部位的药物载体对解决目前临床肺部炎症疾病治疗的困境具有重要的科学意义和临床治疗价值。
3、脂质体是一种由磷脂双分子层构成的柔性药物载体,其具有一定的靶向能力和良好的载药能力,近年来成为一种备受关注的药物递送载体。通过控制脂质体的纳米尺寸(>500nm)可以方便地实现对肺部的被动靶向。此外,通过脂质体还能实现药物的缓慢释放,延长药物的释放周期,提高药物生物利用度。但是,脂质体也存在在体内被网状内皮系统识别和快速清除等问题,其半衰期往往不足1h,难以发挥长效缓释的效果,影响了药物治疗疗效的发挥;另外,脂质体虽然可以借助尺寸效应实现向肺部的被动靶向,但是缺乏对肺部炎症组织的进一步精准靶向能力。因此,在脂质体基础上进一步开发具有向炎症组织主动精准靶向的药物载体就十分必要。
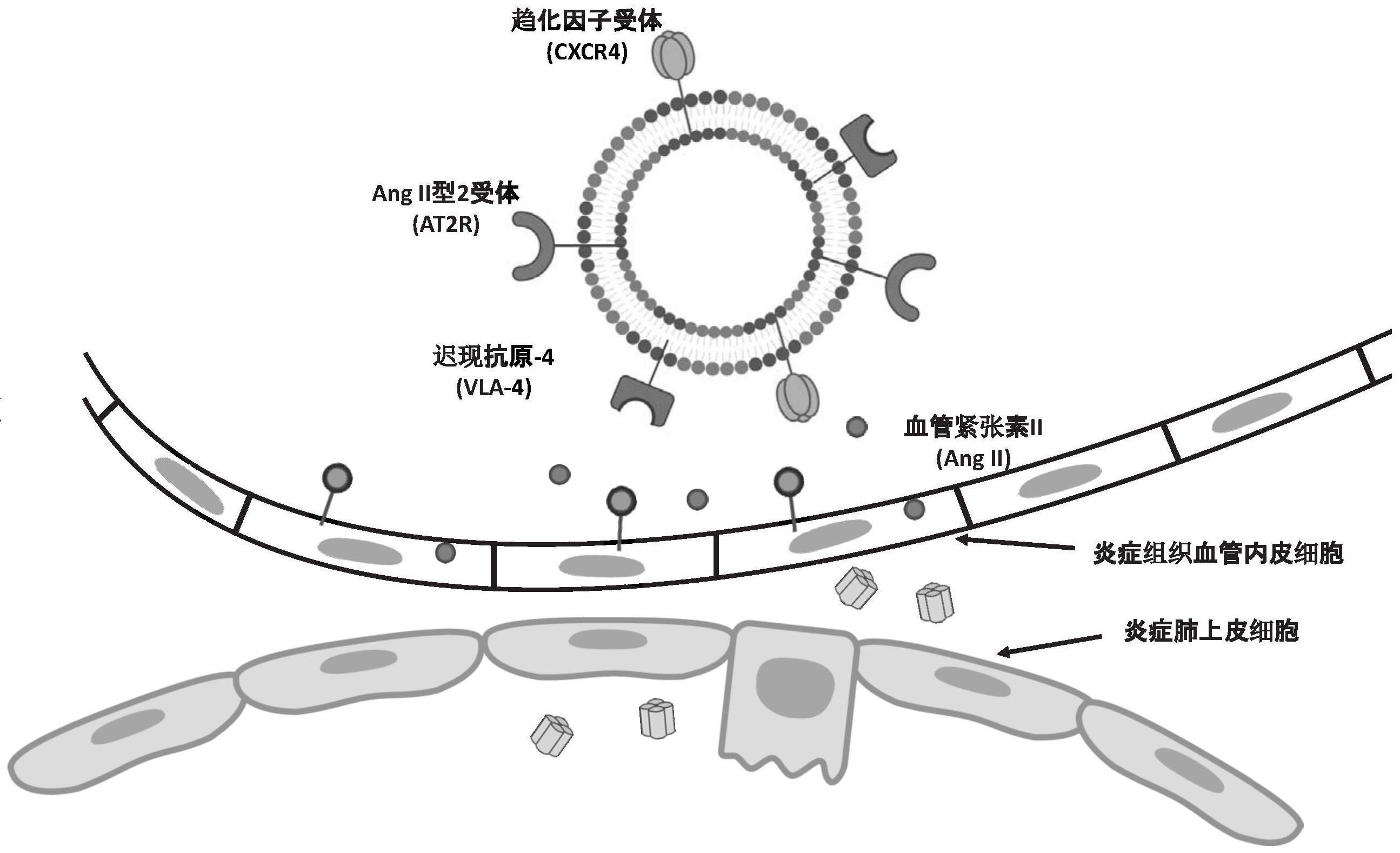
4、近年来,研究者们发现一些细胞,如干细胞和免疫细胞等具有向炎性组织的主动趋向能力,因此提出了利用具有炎症组织归巢能力的细胞来作为药物传递系统用于炎症疾病靶向治疗的新设想。其中,间充质干细胞由于其良好的向炎症组织的归巢能力,易于获取和在体外大量扩增,低免疫原性和在疾病组织较长的驻留能力等被认为是一种潜在的良好细胞载体用于肺部炎症的靶向递药。比如,当肺部发生炎症反应时,血管紧张素ii(ang ii)的产生会增加,而间充质干细胞膜表面表达有ang ii型2受体(at2r),因而可以驱动间充质干细胞向炎症肺部的精准靶向。此外,肺实质中损伤的肺上皮细胞会大量分泌sdf-1α,间充质干细胞上表达有sdf-1α的特异性受体cxcr4,因而可以引导间充质干细胞沿着sdf-1α的浓度梯度实现向炎症受损肺上皮细胞的主动精准靶向。同时,炎症受损组织附近的血管内皮细胞也会高表达血管细胞黏附分子-1(vcam-1)。而mscs也表达有vcam-1的特异性受体vla-4,可以让静脉注射的mscs特异性粘附于炎症受损组织的血管内皮细胞上,并进一步向炎症受损组织迁移,实现对炎症受损组织的主动精准靶向。但是,利用干细胞作为药物递送载体也存在着一些明显的限制:1.干细胞载体的载药能力有限。由于活细胞的物质交换能力,药物很难长时间在细胞内富集;2.干细胞载体的保存和运输条件较为苛刻,在临床使用上具有一定的不便性。3.干细胞载体因为具有生物活性,使用时存在一定的安全风险。比如,间充质干细胞在体内递药过程中也存在不受控分化等的风险。
5、为了既能充分发挥上述干细胞载体对炎症组织的主动趋向能力,又能避免干细胞载体的一些天然不足和安全风险,近年来利用干细胞膜构建工程化仿生柔性脂质体成为一种可行的解决方案。干细胞向炎症组织的主动归巢和体内长循环与干细胞膜表面表达的一些蛋白密切相关。因此,使用干细胞膜构建仿生递送载体既可以保留干细胞的主动靶向炎症组织的能力,又可以解决干细胞载体在载药和安全风险等方面的问题,成为一种极具应用前景的新型药物靶向递送载体。比如,将间充质干细胞膜和脂质体融合,制备得到的工程化间充质干细胞仿生柔性脂质体,既具备间充质干细胞向炎症组织的特异性趋向,又具有脂质体良好的载药能力,还能避免使用活细胞载体带来的安全风险。
6、然而,天然的干细胞载体向炎症组织的主动靶向效率依然受到细胞膜表面较低的受体蛋白表达水平的制约。而在细胞膜的分离过程中又会不可避免地造成上述受体蛋白的损失,进一步影响其靶向效率。如何最大限度地保留或者提高干细胞膜上与炎症靶向相关的受体蛋白如at2r或cxcr4等的表达水平就成为提高干细胞仿生混合脂质体的靶向效率的关键。
7、因此,研究新的干细胞仿生脂质体,其具有高效的与炎症靶向相关的受体蛋白表达水平,可以实现对肺部炎症组织的主动精准靶向,进而实现维持抗炎药物在炎症局部区域的高浓度,减少药物的全身分布,降低给药剂量和给药频次对解决目前临床肺部炎症药物治疗面临的递送难题和毒副作用就非常重要,有望为临床治疗肺部炎症疾病提供一种新的靶向递药方案,具有重大的科学研究价值和重要的临床治疗意义。
技术实现思路
1、本发明的目的是要解决现有药物在肺部炎症治疗中面临的靶向递送难题,提供一种可以通过系统注射将药物主动精准靶向递送至肺部炎症组织的药物制剂。该制剂是由工程化改良后高表达炎症靶向相关的受体蛋白的间充质干细胞膜和磷脂双分子层膜组成的膜壳结构的柔性脂质体。抗炎药物可以根据其物理化学特性被包裹与杂合膜壳材料形成的空腔内部或嵌入在杂合膜壳材料上。本发明公开的脂质体在系统注射后首先可以向肺部炎症血管内皮细胞聚集,进而在炎症因子的引导下向损伤肺上皮细胞迁移,最终实现在肺部炎症组织的精准释药。同时,本制剂还可以通过脂质体的缓慢释药性能维持抗炎药物在肺部炎症组织较高的浓度,进一步提高药物的抗炎效果。本发明公开的制剂可以为肺部炎症的靶向治疗提供一种高效和精准的药物靶向递送手段。
2、为达到上述目的,本发明是按照以下技术方案实施的:
3、本发明提供了一种特异性靶向肺部炎症组织的工程化间充质干细胞仿生柔性脂质体,包含杂合膜壳材料和负载的抗炎药物,所述杂合膜壳材料由来源于间充质干细胞的间充质干细胞膜和磷脂双分子层膜融合而成,其中,所述间充质干细胞经过基因工程修饰过表达炎症靶向的受体蛋白。
4、优选地,所述基因工程修饰方法包括但不限于病毒载体基因转导和非病毒载体基因转染
5、具体的,所述间充质干细胞为以下至少一种:骨髓来源的间充质干细胞,脂肪来源间充质干细胞,脐带血来源间充质干细胞和胎盘绒毛来源的间充质干细胞。
6、具体的,炎症靶向的受体蛋白为以下至少一种:vla-4、at2r和cxcr4。
7、上述技术方案中,为了实现对肺部炎症组织的精准靶向,采用了基因工程修饰后高表达vla-4和at2r或者高表达vla-4和cxcr4的干细胞膜,vla-4可以实现本发明通过血液循环进入肺部后在炎症组织的血管内皮细胞上精准定位,at2r或cxcr4可以实现本发明进一步向炎症肺上皮细胞靶向,从而实现对炎症部位的精准靶向递药。为了实现本发明对抗炎药物的高效携载和缓释,本发明进一步引入了磷脂双分子层膜与基因修饰的干细胞膜进行“膜-膜”融合,解决了单纯采用细胞膜载体的载药量低的问题。
8、具体的,制备磷脂双分子层膜的磷脂材料为以下至少一种:蛋黄卵磷脂、大豆卵磷脂、二棕榈酰磷脂酰胆碱和二硬脂酰磷脂酰胆碱。
9、优选的,特异性靶向肺部炎症组织的工程化间充质干细胞仿生柔性脂质体的尺寸为100~300nm。
10、优选的,间充质干细胞膜上的总蛋白含量和磷脂双分子层膜中的磷脂含量的质量比为1∶0.25~0.5。
11、具体的,所述抗炎药物为以下至少一种:甲泼尼龙,地塞米松。
12、本发明还提供了所述特异性靶向肺部炎症组织的工程化间充质干细胞仿生柔性脂质体在制备用于治疗肺部炎症疾病的药物中的应用。
13、优选的,所述肺部炎症疾病为以下至少一种:急性肺损伤、慢性阻塞性肺疾病、肺纤维化、肺气肿、肺脓肿和肺炎。
14、本发明还提供了所述特异性靶向肺部炎症组织的工程化间充质干细胞仿生柔性脂质体的制备方法,包括以下步骤:
15、(1)通过转基因方法构建过表达炎症靶向的受体蛋白的间充质干细胞;
16、(2)提取步骤(1)所得间充质干细胞的细胞膜获得所述间充质干细胞膜;
17、(3)将抗炎药物加载到脂质体上制备负载抗炎药物的磷脂双分子层膜;
18、(4)将步骤(2)所得所述间充质干细胞膜与步骤(3)所得负载抗炎药物的磷脂双分子层膜融合制备得到所述特异性靶向肺部炎症组织的工程化间充质干细胞仿生柔性脂质体。
19、具体的,所述步骤(2)中提取步骤(1)所得间充质干细胞的细胞膜的具体过程:将步骤(1)所得间充质干细胞的细胞膜放入液氮中30~60s后置于37℃水浴中5min复融,如此反复3次后,转移至玻璃匀浆器于冰上匀浆10~100次。随后,将匀浆液离心(20000×g,30min,4℃),弃去沉淀后将上清液再次离心(100000×g,30min,4℃)并收集沉淀,即得到所述间充质干细胞膜。
20、具体的,将磷脂溶于乙醇或氯仿,采用薄膜分散法或逆向蒸发法制备得到步骤(3)中所述脂质体。薄膜分散法或逆向蒸发法可以采用现有的方法,根据需要携载的药物的亲疏水性选择合适的方法以保证载药量。
21、优选的,步骤(4)所述负载抗炎药物的磷脂双分子层膜与所述间充质干细胞膜的混合比例为1∶0.1~1(磷脂:蛋白,质量比)。干细胞膜的含量会直接影响具有“膜-膜”融合结构的工程化间充质干细胞仿生柔性脂质体对炎症组织的靶向能力,且不同混合比对柔性脂质体的粒径和电位均有一定影响,会间接影响其靶向能力。进一步优选的,脂质体与干细胞膜的混合比例为1∶0.25(磷脂:蛋白,质量比)。
22、优选的,步骤(4)中使用超声法进行融合,所述超声法超声功率为60~200w,每工作3s,休息2s,总工作时间为1~3min。超声功率和时长会影响杂合膜壳材料中两种膜成分的融合程度、粒径大小以及制剂的稳定性。进一步优选的,超声功率为100w,总工作时间为3min。
23、同现有技术相比,本发明的有益效果体现在:
24、(1)本发明借助基因工程修饰后的干细胞膜可以实现首先向肺部炎症组织的血管内皮细胞靶向,然后进一步向炎症肺上皮细胞靶向,具有更高效和更精准的靶向能力。该顺序双靶向设计可以确保抗炎药物的精准靶向递送,提高抗炎药物的疗效,降低抗炎药物的使用剂量和减少毒副作用,有望满足临床对肺部炎症靶向治疗的需求。
25、(2)本发明构建的工程化间充质干细胞仿生柔性脂质体,制备方法简便,制备条件温和,对于不同理化性质的抗炎药物均可适用,具有良好的临床转化前景。
- 还没有人留言评论。精彩留言会获得点赞!