HER2二聚化抑制剂帕妥珠单抗的用途和包含HER2二聚化抑制剂帕妥珠单抗的制品的制作方法
发明领域本发明涉及her2-二聚化抑制剂类别中第一种,帕妥珠单抗(pertuzumab)的用途和包含her2-二聚化抑制剂类别中第一种,帕妥珠单抗(pertuzumab)的制品。具体地,本发明涉及延长her2阳性乳腺癌患者群体中的无进展存活;组合两种her2抗体来治疗her2阳性癌症,而不增加心脏毒性;治疗早期her2阳性乳腺癌;通过共施用来自同一静脉内袋的帕妥珠单抗和曲妥珠单抗(trastuzumab)的混合物来治疗her2阳性癌症;治疗her2阳性转移性胃癌;用帕妥珠单抗、曲妥珠单抗和长春瑞滨(vinorelbine)来治疗her2阳性乳腺癌;用帕妥珠单抗、曲妥珠单抗和芳香酶抑制剂来治疗her2阳性乳腺癌;及治疗低her3卵巢癌、原发性腹膜癌或输卵管癌。还涉及一种制品,其包含其中有帕妥珠单抗的管形瓶和其上提供安全性和/或功效数据的包装插页;一种制备所述制品的方法;和一种确保与其相关的、帕妥珠单抗的安全和有效使用的方法。另外,本发明涉及一种静脉内(iv)袋,其含有适于对癌症患者施用的、帕妥珠单抗和曲妥珠单抗的稳定混合物。
背景技术:
0、发明背景
1、her受体酪氨酸激酶家族的成员是细胞生长、分化和存活的重要介导物。该受体家族包括四种独特的成员,包括表皮生长因子受体(egfr、erbb1、或her1)、her2(erbb2或p185neu)、her3(erbb3)和her4(erbb4或tyro2)。该受体家族的成员已牵连于多种类型的人恶性肿瘤。
2、鼠抗her2抗体4d5的重组人源化型式(humab4d5-8,rhumab her2,曲妥珠单抗或美国专利no.5,821,337)在患有过表达her2的转移性乳腺癌、已接受过大量在前抗癌疗法的患者中是有临床活性的(baselga等,j.clin.oncol.14:737-744(1996))。
3、曲妥珠单抗在1998年9月25日从食品药品管理局得到上市许可,用于治疗其肿瘤过表达her2蛋白的转移性乳腺癌患者。目前,批准曲妥珠单抗在转移性背景中用作单一药剂或与化疗或激素治疗组合,和作为单一药剂或与化疗组合作为辅助治疗用于患有早期her2阳性乳腺癌的患者。基于曲妥珠单抗的疗法现在是用于患有her2阳性早期乳腺癌、不具有其使用禁忌证的患者的推荐治疗(处方信息;nccn指南,版本2.2011)。曲妥珠单抗加多西他赛(或帕利他赛)是一线转移性乳腺癌(mbc)治疗背景中的经注册的标准医护(slamon等,n engl j med.2001;344(11):783-792;marty等,j clin oncol.2005;23(19):4265-4274)。
4、尽管曲妥珠单抗的施用已在乳腺癌治疗中产生很好的结果,但来自拉帕替尼(1apatinib)临床试验的最近数据似乎表明即使施用曲妥珠单抗,her2也在肿瘤生物学中起着活性作用(geyer等,n engl j med 2006;355:2733-2743)。
5、基于her2表达为疗法选择用her2抗体曲妥珠单抗治疗的患者。参见例如,wo99/31140(paton等)、us2003/0170234a1(hellmann,s.)和us2003/0147884(paton等);以及wo01/89566,us2002/0064785和us2003/0134344(mass等)。亦参见美国专利no.6,573,043、美国专利no.6,905,830和us2003/0152987,cohen等,其涉及用于检测her2过表达和扩增的免疫组织化学(ihc)和荧光原位杂交(fish)。如此,对转移性乳腺癌的最佳管理现在不仅考虑患者的一般状况、医学史、和受体状态,而且还考虑her2状态。
6、帕妥珠单抗(亦称为重组人源化单克隆抗体2c4(rhumab 2c4);genentech,inc,south san francisco)代表称为her二聚化抑制剂(hdi)的一类新药剂中的第一种,且发挥抑制her2与其他her受体(如egfr/her1、her2、her3和her4)形成活性异二聚体或同二聚体的能力的功能。参见例如,harari和yarden oncogene 19:6102-14(2000);yarden和sliwkowski.nat rev mol cell biol 2:127-37(2001);sliwkowski nat struct biol10:158-9(2003);cho等nature 42l:756-60(2003);和malik等pro am soc cancer res44:176-7(2003)。
7、已显示帕妥珠单抗对肿瘤细胞中her2-her3异二聚体形成的阻断抑制关键的细胞信号传导,其导致降低的肿瘤增殖和存活(agus等cancer cell 2:127-37(2002))。
8、帕妥珠单抗已在临床中进行作为单一药剂的试验,即患有晚期癌症的患者的ia期试验和患有卵巢癌和乳腺癌以及肺癌和前列腺癌的患者中的ii期试验。在i期研究中,将患有不能治愈的、局部晚期的、再发或转移性实体瘤,已在标准疗法期间或之后进展的患者用每3周静脉内给药的帕妥珠单抗治疗。帕妥珠单抗一般耐受较好。20位可评估应答的患者中有3位实现肿瘤消退。确认了2位患者的部分响应。在21位患者中有6位中观察到持续超过2.5个月的稳定疾病(agus等pro am soc clin oncol 22:192(2003))。在2.0-15mg/kg的剂量,帕妥珠单抗的药动学为线性,且均值清除范围为2.69至3.74ml/d/kg,均值终末消除半衰期范围为15.3至27.6天。未检测到针对帕妥珠单抗的抗体(allison等pro am soc clinoncol 22:197(2003))。
9、us 2006/0034842描述了用抗erbb2抗体组合来治疗表达erbb的癌症的方法。us2008/0102069描述了曲妥珠单抗和帕妥珠单抗在治疗her2阳性转移性癌症如乳腺癌中的用途。baselga等,j clin oncol,2007asco annual meeting proceedings part i,col.25,no.18s(june 20 supplement),2007:1004报告了对患有经预治疗的her2阳性乳腺癌、在用曲妥珠单抗治疗期间已进展的患者的治疗,其使用曲妥珠单抗和帕妥珠单抗的组合。portera等,j clin oncol,2007 asco annual meeting proceedings part i.vol.25,no.18s(june 20 supplement),2007:1028评估了曲妥珠单抗+帕妥珠单抗组合疗法在已在基于曲妥珠单抗的疗法上疾病进展的her2阳性乳腺癌患者中的功效和安全性。作者得出结论,需要对该组合治疗的功效的进一步评估来定义该治疗方案的总体风险和益处。
10、帕妥珠单抗已在ii期研究中与曲妥珠单抗组合在患有her2阳性转移性乳腺癌、先前针对转移性疾病接受过曲妥珠单抗的患者中进行评估。一项由国家癌症研究院(nci)进行的研究招募了11位患有先前治疗过的her2阳性转移性乳腺癌的患者。11位患者中有2位展现出部分响应(pr)(baselga等,j clin oncol 2007 asco annual meetingproceedings;25:18s(june 20 supplement):1004。在患有早期her2阳性乳腺癌的女性中评估帕妥珠单抗和曲妥珠单抗加化疗(多西他赛)的新组合方案效果的ii期新辅助研究的结果(2010年12月8-12日在ctrc-aacr圣安东尼奥乳腺癌学术会议(sabcs)上呈现)显示,在手术前的新辅助背景中给予两种her2抗体加多西他赛将乳腺中完全肿瘤消失的比率(病理学完全响应率,pcr,45.8个百分数)相比于曲妥珠单抗加多西他赛(pcr,29.0个百分数)显著改进了超过一半,p=0.014。
11、涉及her2抗体的专利公开文本包括:美国专利no.5,677,171;5,720,937;5,720,954;5,725,856;5,770,195;5,772,997;6,165,464;6,387,371;6,399,063;6,015,567;6,333,169;4,968,603;5,821,337;6,054,297;6,407,213;6,639,055;6,719,971;6,800,738;8,075,890;5,648,237;7,018,809;6,267,958;6,685,940;6,821,515;7,060,268;7,682,609;7,371,376;6,127,526;6,333,398;6,797,814;6,339,142;6,417,335;6,489,447;7,074,404;7,531,645;7,846,441;7,892,549;8,075,892;6,573,043;6,905,830;7,129,051;7,344,840;7,468,252;7,674,589;7,919,254;6,949,245;7,485,302;7,498,030;7,501,122;7,537,931;7,618,631;7,862,817;7,041,292;6,627,196;7,371,379;6,632,979;7,097,840;7,575,748;6,984,494;7,279,287;7,811,773;7,993,834;8,076,066;8,044,017;7,435,797;7,850,966;7,485,704;7,807,799;8,142,784;7,560,111;7,879,325;8,241,630;7,449,184;8,163,287;7,700,299;7,981,418;8,247,397;和us2010/0016556;us 2005/0244929;us 200i/0014326;us 2003/0202972;us 2006/0099201;us 2010/0158899;us 2011/0236383;us 2011/0033460;us 2008/0286280;us 2005/0063972;us 2006/0182739;us 2009/0220492;us 2003/0147884;us 2004/0037823;us2005/0002928;us 2007/0292419;us 2008/0187533;us 2011/0250194;us 2012/0034213;us 2003/0152987;us 2005/0100944;us 2006/0183150;us 2008/0050748;us 2009/0155803;us 2010/0120053;us 2005/0244417;us 2007/0026001;us 2008/0160026;us2008/0241146;us 2005/0208043;us 2005/0238640;us 2006/0034842;us 2006/0073143;us 2006/0193854;us 2006/0198843;us 2011/0129464;us 2007/0184055;us 2007/0269429;us 2008/0050373;us 2006/0083739;us 2009/0087432;us 2006/0210561;us2002/0035736;us 2002/0001587;us 2008/0226659;us 2002/0090662;us 2006/0046270;us 2008/0108096;us 2007/0166753;us 2008/0112958;us 2009/0239236;us 2012/0034609;us 2012/0093838;us 2004/0082047;us 2012/0065381;us 2009/0187007;us2011/0159014;us 2004/0106161;us 2011/0117096;us 2004/0258685;us 2009/0148402;us 2009/0099344;us 2006/0034840;us 2011/0064737;us 2005/0276812;us 2008/0171040;us 2009/0202536;us 2006/0013819;us 2012/0107391;us 2006/0018899;us2009/0285837;us 2011/0117097;us 2006/0088523;us 2010/0015157;us 2006/0121044;us 2008/0317753;us 2006/0165702;us 2009/0081223;us 2006/0188509;us 2009/0155259;us 2011/0165157;us 2006/0204505;us 2006/0212956;us 2006/0275305;us2012/0003217;us 2007/0009976;us 2007/0020261;us 2007/0037228;us 2010/0112603;us 2006/0067930;us 2007/0224203;us 201i/0064736;us 2008/0038271;us 2008/0050385;us 2010/0285010;us 201i/0223159;us 2008/0102069;us 2010/0008975;us2011/0245103;us 201i/0246399;us 201i/0027190;us 2010/0298156;us 2011/0151454;us 2011/0223619;us2012/0107302;us 2009/0098135;us 2009/0148435;us 2009/0202546;us 2009/0226455;us 2009/0317387;us 2011/0044977;us 2012/0121586。
技术实现思路
0、发明概述
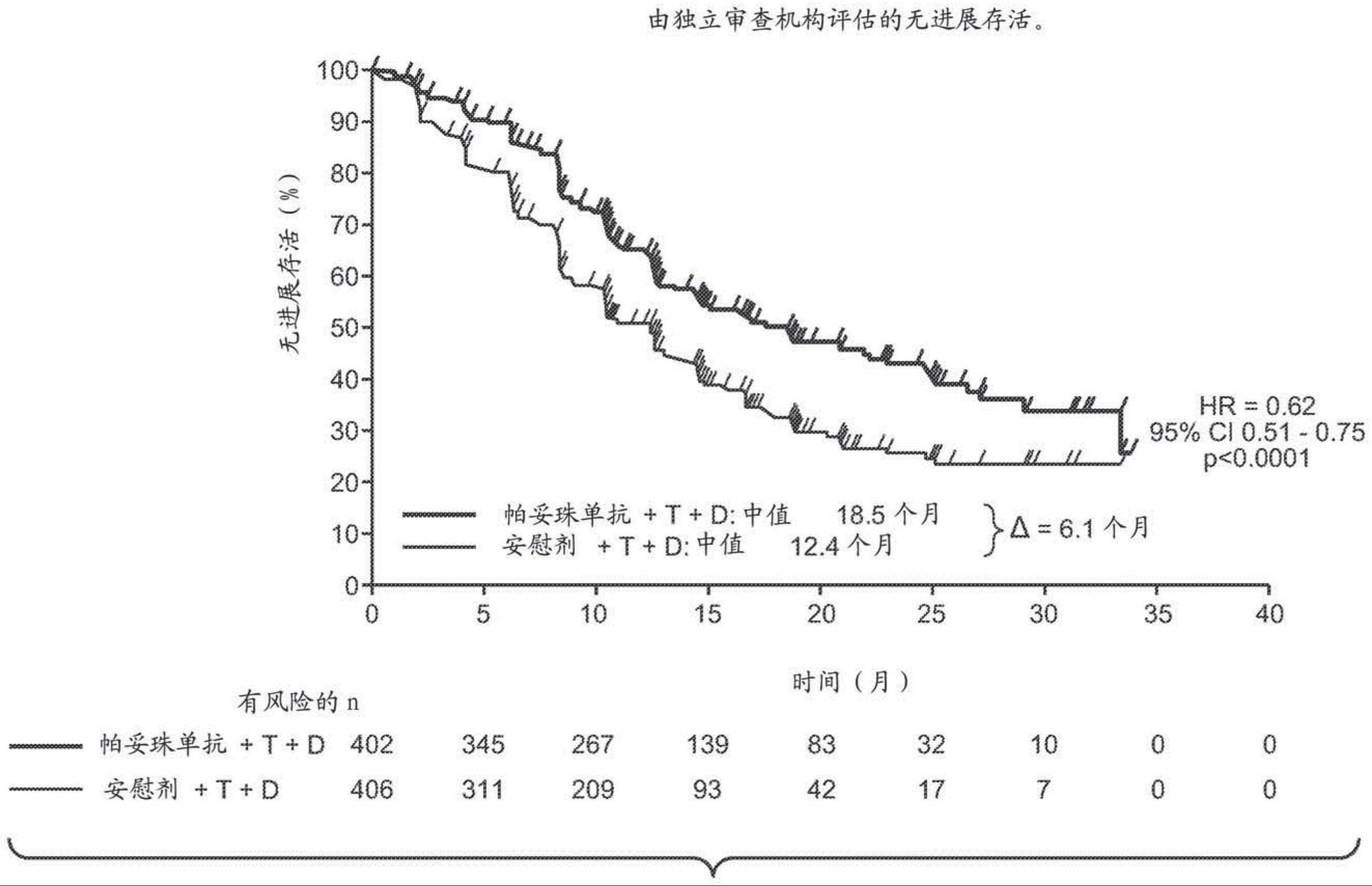
1、在第一个方面,本发明涉及一种用于将her2阳性乳腺癌患者群体中的无进展存活延长6个月或更长的方法,包括对群体中的患者施用帕妥珠单抗、曲妥珠单抗和化疗(例如紫杉烷,如多西他赛)。任选地,所述方法导致群体中的患者中客观响应率为80%或更高。任选地,乳腺癌是转移性或局部再发的、不可切除的乳腺癌,或从头iv期疾病(de novo stageiv disease)。在一个实施方案中,群体中的患者:未接受先前治疗或在辅助治疗后复发,在基线处具有≥50%的左心室射血分数(lvef),和/或具有0或1的东部肿瘤学协作组表现状况(eastern cooperative oncology group performance status)(ecog ps)。任选地,her2阳性乳腺癌定义为免疫组织化学(ihc)3+和/或荧光原位杂交(fish)扩增比≥2.0。任选地,所述方法将死亡风险相对于用曲妥珠单抗和化疗治疗的患者降低约34%或更多。
2、在另一个方面,本发明涉及在her2阳性癌症患者群体中组合两种her2抗体来治疗her2阳性癌症而不增加心脏毒性的方法,包括对所述群体中的患者施用帕妥珠单抗、曲妥珠单抗和化疗。任选地,针对症状性左心室收缩功能障碍(lvsd)或充血性心力衰竭(chf)的发生率或左心室射血分数(lvef)的降低来监测所述患者群体中心脏毒性。任选地,her2阳性癌症为乳腺癌,例如转移性或局部再发的、不可切除的乳腺癌,或从头iv期疾病。
3、在另一个方面,本发明涉及一种制品,包含其中有帕妥珠单抗的管形瓶和包装插页,其中所述包装插页提供表3或表4中的安全性数据和/或表2、表5、图8或图10中的功效数据。
4、本发明另外涉及一种用于制备制品的方法,包括将其中有帕妥珠单抗的管形瓶与包装插页包装在一起,其中所述包装插页提供表3或表4中的安全性数据和/或表2、表5、图8或图10中的功效数据。
5、在一个相关方面,本发明涉及一种确保帕妥珠单抗的安全和有效使用的方法,包括将其中有帕妥珠单抗的管形瓶与包装插页包装在一起,其中所述包装插页提供表3或表4中的安全性数据和/或表2、表5、图8或图10中的功效数据。
6、任选地,所述制品包含单剂管形瓶,其含有约420mg的帕妥珠单抗。
7、任选地,所述包装插页进一步包含实施例4中的警告框(warning box)。
8、任选地,所述包装插页进一步提供实施例9或表14中的总体存活(os)功效数据。
9、在另一个方面,本发明涉及一种治疗早期her2阳性乳腺癌的方法,包括对患有乳腺癌的患者施用帕妥珠单抗、曲妥珠单抗和化疗,其中所述化疗包含基于蒽环类抗生素(anthracycline)的化疗(例如5-fu、表柔比星(epirubicin)和环磷酰胺(fec)),或基于卡铂的化疗(例如多西他赛和卡铂)。任选地,将帕妥珠单抗与基于蒽环类抗生素的化疗或基于卡铂的化疗并行施用。在该方法的一个实施方案中,帕妥珠单抗施用相对于没有帕妥珠单抗的治疗不增加心脏毒性。任选地,这类对早期her2阳性乳腺癌的治疗包含新辅助或辅助疗法。
10、本发明还涉及一种治疗患者中her2阳性癌症的方法,包括对所述患者共施用来自同一静脉内袋的帕妥珠单抗和曲妥珠单抗的混合物。这类方法任选地还包括对患者施用化疗。
11、在一个相关方面,本发明提供一种静脉内(iv)袋,其含有适于对癌症患者施用的帕妥珠单抗和曲妥珠单抗的稳定混合物。任选地,所述混合物在盐水溶液中;例如包含约0.9%nacl或约0.45%nacl。任选地,iv袋是250ml0.9%盐水聚烯烃(saline polyolefin)或聚氯乙烯输注袋。在一个实施方案中,iv袋含有约420mg或约840mg帕妥珠单抗和约200mg至约1000mg曲妥珠单抗的混合物。在一个实施方案中,所述混合物在5℃或30℃稳定长达24小时。混合物的稳定性可通过一种或多种选自以下的测定法来评估:颜色、外观和澄清度(cac),浓度和浊度分析,微粒分析,大小排阻层析(sec),离子交换层析(iec),毛细管区带电泳(cze),成像毛细管等点聚焦(icief)或效力测定法。
12、本发明提供一种针对胃癌的新治疗方案。具体地,本发明涉及用曲妥珠单抗、帕妥珠单抗和至少一种化疗的组合来治疗人受试者中的her2阳性胃癌。
13、在一个方面,本发明涉及一种在人受试者中治疗her2阳性胃癌的方法,包括对所述受试者施用帕妥珠单抗、曲妥珠单抗和化疗。
14、在一个方面,本发明涉及一种在人受试者中治疗胃癌的方法,包括对患有胃癌的受试者施用帕妥珠单抗,其中在所有治疗周期中以840mg的剂量施用帕妥珠单抗。
15、在另一个方面,本发明涉及一种改进患有her2阳性胃癌的人受试者中的存活的方法,包括对所述受试者施用帕妥珠单抗、曲妥珠单抗和化疗。
16、在又一个方面,本发明涉及帕妥珠单抗,其用于与曲妥珠单抗和化疗组合在人受试者中治疗her2阳性胃癌。
17、在再一个方面,本发明涉及帕妥珠单抗在制备用于治疗her2阳性胃癌的药物中的用途,其中所述治疗包括与曲妥珠单抗和化疗组合施用帕妥珠单抗。
18、在又一个方面,本发明涉及曲妥珠单抗在制备用于治疗her2阳性胃癌的药物中的用途,其中所述治疗包括与帕妥珠单抗和化疗组合施用曲妥珠单抗。
19、在另一个方面,本发明涉及一种包含包括帕妥珠单抗的容器和用法说明书的试剂盒,所述用法说明书关于与曲妥珠单抗和化疗组合施用帕妥珠单抗以治疗受试者中的her2阳性胃癌。
20、在又一个方面,本发明涉及一种包含包括曲妥珠单抗的容器和用法说明书的试剂盒,所述用法说明书关于与帕妥珠单抗和化疗组合施用曲妥珠单抗以治疗受试者中的her2阳性胃癌。
21、在所有方面,胃癌可以是例如不可切除的局部晚期的胃癌,或转移性胃癌,或晚期的、术后再发的胃癌,其可能不适合由通过已知方法的治愈性治疗处理。在所有方面,胃癌包括胃或胃食管连接部的腺癌。在所有方面,在一个具体的实施方案中,所述患者未接受针对转移性胃癌的在前抗癌治疗。在所有方面,在一个具体的实施方案中,化疗包括施用铂和/或氟嘧啶。在某些实施方案中,所述铂是顺铂。在其他实施方案中,所述氟嘧啶包含卡培他滨和/或5-氟尿嘧啶(5-fu)。在所有方面,患者的her2阳性状态可以为例如ihc 3+或ihc2+/ish+。在所有方面,在具体的实施方案中,所述治疗改进存活,包括总体存活(os)和/或无进展存活(pfs)和/或响应率(rr)。在所有方面,在具体的实施方案中,所述患者具有0-1的ecog ps。在所有方面,治疗周期一般彼此相隔4周或更短,或相隔3周或更短,或相隔2周或更短,或相隔1周或更短。
22、在一个具体的方面,本发明涉及一种在未接受针对转移性疾病的在前化疗(除了在当前治疗前超过6个月完成的在前辅助或新辅助治疗)的人患者中治疗her2阳性不可切除的或转移性的胃或胃食管连接部腺癌的方法,包括以改进无进展存活(pfs)和/或总体存活(os)的量对所述患者施用帕妥珠单抗、曲妥珠单抗、顺铂和卡培他滨和/或氟尿嘧啶(5-fu),其中所述患者具有0-1的ecog ps。在一个具体的实施方案中,所述患者未接受过使用铂的在前治疗。
23、在另一个方面,本发明涉及一种在患有her2阳性不可切除的或转移性的胃或胃食管连接部腺癌的患者中改进无进展存活的方法,包括与曲妥珠单抗和化疗组合地对所述患者施用帕妥珠单抗。
24、在一个别的方面,本发明涉及一种在患者中治疗her2阳性乳腺癌的方法,包括对所述患者施用帕妥珠单抗、曲妥珠单抗和长春瑞滨。任选地,从单个静脉内袋内对所述患者共施用帕妥珠单抗和曲妥珠单抗。任选地,乳腺癌是转移性或局部晚期的。在一个实施方案中,所述患者先前未接受转移性背景中的系统性非激素抗癌疗法。
25、在另一个方面,本发明涉及一种在患者中治疗her2阳性乳腺癌的方法,包括对所述患者施用帕妥珠单抗、曲妥珠单抗和芳香酶抑制剂(例如阿那曲唑(anastrazole)或来曲唑(1etrozole))。任选地,所述乳腺癌是激素受体阳性的晚期乳腺癌,其中所述激素受体例如是雌激素受体(er)和/或孕酮受体(pgr)。依照本发明的这一实施方案,患者先前未接受转移性背景中的系统性非激素抗癌疗法。而且,本文中患者任选地接受诱导化疗(例如包含紫杉烷)。
26、在另一个实施方案中,本发明涉及一种治疗癌症患者的方法,包括对所述患者施用起始剂量为840mg的帕妥珠单抗,接着其后每3周420mg剂量的帕妥珠单抗,而且如果连续两剂420mg之间的时间为6周或更长的话,进一步包括对所述患者再施用840mg剂量的帕妥珠单抗。任选地,所述方法还包括在再施用840mg剂量后每3周施用420mg的帕妥珠单抗。在一个实施方案中,所述癌症患者患有her2阳性乳腺癌。
27、在一个别的方面,本发明涉及一种在患者中治疗her2阳性转移性或局部再发的乳腺癌的方法,包括对所述患者施用帕妥珠单抗、曲妥珠单抗和类紫杉烷(例如多西他赛、帕利他赛或nab-帕利他赛),其中所述患者先前已用曲妥珠单抗和/或拉帕替尼作为辅助或新辅助疗法治疗过。
28、在又一个方面,本发明涉及一种用于在患者中治疗低her3卵巢癌、原发性腹膜癌或输卵管癌的方法,包括对所述患者施用帕妥珠单抗和化疗,其中所述化疗包含类紫杉烷(例如帕利他赛)或托泊替康(topotecan)。
29、在一个另外的方面,本发明涉及一种用于在患者中治疗低her3卵巢癌、原发性腹膜癌或输卵管癌的方法,包括对所述患者施用帕妥珠单抗和化疗,其中所述低her3癌症以等于或低于约2.81的浓度比表达her3 mrna,如通过聚合酶链式反应(pcr)评估的。在一个实施方案中,所述化疗包含吉西他滨(gemcitabine)、卡铂、帕利他赛、多西他赛、托泊替康或peg化脂质体多柔比星(doxorubicin)(pld)。任选地,所述化疗包含帕利他赛或托泊替康。在一个实施方案中,所述癌症是铂抗性或铂不应性的上皮卵巢癌。
30、本技术涉及下述实施方案。
31、1.一种用于将her2阳性乳腺癌患者群体中的无进展存活延长6个月或更长的方法,其包括对所述群体中的患者施用帕妥珠单抗(pertuzumab)、曲妥珠单抗(trastuzumab)和化疗。
32、2.实施方案1的方法,其导致所述群体中的患者中客观响应率为80%或更高。
33、3.实施方案1或实施方案2的方法,其中所述化疗包含紫杉烷(taxane)。
34、4.实施方案3的方法,其中所述紫杉烷是多西他赛(docetaxel)。
35、5.实施方案1至4中任一项的方法,其中所述乳腺癌是转移性或局部再发的、不可切除的乳腺癌,或从头iv期疾病(de novo stage iv disease)。
36、6.实施方案1至5中任一项的方法,其中所述群体中的患者未接受过先前治疗或在辅助治疗后复发。
37、7.实施方案1至6中任一项的方法,其中所述her2阳性乳腺癌定义为免疫组织化学(ihc)3+和/或荧光原位杂交(fish)扩增比≥2.0。
38、8.实施方案1至7中任一项的方法,其中所述群体中的患者在基线处具有≥50%的左心室射血分数(lvef)。
39、9.实施方案1至8中任一项的方法,其中所述群体中的患者具有0或1的东部肿瘤学协作组表现状况(ecog ps)。
40、10.一种在her2阳性癌症患者群体中组合两种her2抗体来治疗her2阳性癌症而不增加心脏毒性的方法,其包括对所述群体中的患者施用帕妥珠单抗、曲妥珠单抗和化疗。
41、11.实施方案10的方法,其中针对症状性左心室收缩功能障碍(lvsd)或充血性心力衰竭(chf)的发生率,或左心室射血分数(lvef)的降低来监测所述患者群体中的心脏毒性。
42、12.实施方案10或实施方案11的方法,其中所述her2阳性癌症是乳腺癌。
43、l3.实施方案10至12中任一项的方法,其中所述乳腺癌是转移性或局部再发的、不可切除的乳腺癌,或从头iv期疾病。
44、14.一种制品,其包含其中有帕妥珠单抗的管形瓶和包装插页,其中所述包装插页提供表3或表4中的安全性数据。
45、15.实施方案14的制品,其中所述包装插页提供表2、表5、图8或图10中的功效数据。
46、16.实施方案14或实施方案15的制品,其中所述管形瓶是单剂管形瓶,其含有约420mg的帕妥珠单抗。
47、17.一种制备制品的方法,其包括将其中有帕妥珠单抗的管形瓶与包装插页包装在一起,其中所述包装插页提供表3或表4中的安全性数据。
48、18.一种确保帕妥珠单抗的安全和有效使用的方法,其包括将其中有帕妥珠单抗的管形瓶与包装插页包装在一起,其中所述包装插页提供表3或表4中的安全性数据和表2、表5、图8或图10中的功效数据。
49、19.一种治疗早期her2阳性乳腺癌的方法,其包括对具有乳腺癌的患者施用帕妥珠单抗、曲妥珠单抗和化疗,其中所述化疗包含基于蒽环类抗生素(anthracycline)的化疗或基于卡铂(carboplatin)的化疗。
50、20.实施方案19的方法,其中所述化疗包含基于蒽环类抗生素的化疗,其包含5-fu、表柔比星(epirubicin)和环磷酰胺(fec)。
51、21.实施方案20的方法,其中帕妥珠单抗与基于蒽环类抗生素的化疗并行施用。
52、22.实施方案19的方法,其中所述化疗包含基于卡铂的化疗,其包含多西他赛和卡铂。
53、23.实施方案22的方法,其中帕妥珠单抗与基于卡铂的化疗并行施用。
54、24.实施方案19至23中任一项的方法,其中帕妥珠单抗施用相对于没有帕妥珠单抗的治疗不增加心脏毒性。
55、25.实施方案19至24中任一项的方法,其包含新辅助或辅助疗法。
56、26.一种在患者中治疗her2阳性癌症的方法,其包括对所述患者共施用来自同一静脉内袋的帕妥珠单抗和曲妥珠单抗的混合物。
57、27.实施方案26的方法,其进一步包括对所述患者施用化疗。
58、28.一种静脉内(iv)袋,其含有适用于对癌症患者施用的帕妥珠单抗和曲妥珠单抗的稳定混合物。
59、29.实施方案28的iv袋,其中所述混合物在盐水溶液中。
60、30.实施方案29的iv袋,其中所述盐水溶液包含约0.9%nacl或约0.45%nacl。
61、31.实施方案28至30中任一项的iv袋,其为250ml 0.9%盐水聚烯烃(salinepolyolefin)或聚氯乙烯输注袋。
62、32.实施方案28至31中任一项的iv袋,其含有约420mg或约840mg的帕妥珠单抗和约200mg至约1000mg的曲妥珠单抗的混合物。
63、33.实施方案28至32中任一项的iv袋,其中所述混合物在5℃或30℃稳定达长达24小时。
64、34.实施方案28至33中任一项的iv袋,其中稳定性已通过选自下组的测定法评估:颜色、外观和澄清度(cac),浓度和浊度分析,微粒分析,大小排阻层析(sec),离子交换层析(iec),毛细管区带电泳(cze),成像毛细管等点聚焦(icief)和效力测定法。
65、35.一种在人受试者中治疗her2阳性胃癌的方法,其包括对具有her2阳性胃癌的受试者施用帕妥珠单抗、曲妥珠单抗和化疗。
66、36.实施方案35的方法,其中所述胃癌包括不可切除的、局部晚期的胃癌,或转移性胃癌,或晚期术后再发的胃癌,其可能不适合通过已知方法的治愈性疗法处理,或胃或胃食管连接部的腺癌。
67、37.实施方案35或实施方案36的方法,其中所述患者未接受过针对转移性胃癌的在前抗癌治疗,具有0-1的东部肿瘤学协作组表现状况(ecog ps),或具有ihc 3+或ihc2+/ish+的her2阳性状态。
68、38.实施方案35至37中任一项的方法,其中所述化疗包含铂(顺铂(cisplatin))和/或氟嘧啶(卡培他滨(capecitabine)或5-氟尿嘧啶(5-fu))。
69、39.实施方案38的方法,其中施用帕妥珠单抗、曲妥珠单抗、顺铂、和卡培他滨或5-fu。
70、40.实施方案35至39中任一项的方法,其中帕妥珠单抗在所有治疗周期中以840mg的剂量施用。
71、41.实施方案35至40中任一项的方法,其相对于仅用曲妥珠单抗和化疗治疗的患者改善总体存活(os),或相对于仅用曲妥珠单抗和化疗的治疗改善无进展存活(pfs)或响应率(rr)。
72、42.一种在人受试者中治疗胃癌的方法,其包括对具有胃癌的受试者施用帕妥珠单抗,其中在所有治疗周期中以840mg的剂量施用帕妥珠单抗。
73、43.实施方案42的方法,其中对于6个治疗周期以840mg的剂量施用帕妥珠单抗。
74、44.实施方案42或实施方案43的方法,其维持所述受试者中帕妥珠单抗谷水平(trough level)在约20μg/ml以上。
75、45.实施方案42至44中任一项的方法,其进一步包括对所述受试者施用曲妥珠单抗和化疗。
76、46.一种在除当前治疗之前超过6个月已完成的辅助或新辅助疗法外未接受过针对转移性疾病的在前化疗的人患者中治疗her2阳性不可切除或转移性的胃或胃食管连接部腺癌的方法,其包括对所述患者以改善无进展存活(pfs)和/或总体存活(os)的量施用帕妥珠单抗、曲妥珠单抗、顺铂、和卡培他滨或氟尿嘧啶(5-fu),其中所述患者具有0-1的东部肿瘤学协作组表现状况尺度(ecog ps)。
77、47.一种改善具有her2阳性不可切除或转移性的胃或胃食管连接部腺癌的人患者中的无进展存活(pfs)的方法,其包括与曲妥珠单抗和化疗组合对所述患者施用帕妥珠单抗。
78、48.一种在患者中治疗her2阳性乳腺癌的方法,其包括对所述患者施用帕妥珠单抗、曲妥珠单抗和长春瑞滨(vinorelbine)。
79、49.实施方案48的方法,其中对所述患者共施用来自单个静脉内袋的帕妥珠单抗和曲妥珠单抗。
80、50.实施方案48或实施方案49的方法,其中所述乳腺癌是转移性或局部晚期的。
81、51.实施方案48至50中任一项的方法,其中所述患者先前未接受过转移性背景中的系统性非激素抗癌疗法。
82、52.一种在患者中治疗her2阳性乳腺癌的方法,其包括对所述患者施用帕妥珠单抗、曲妥珠单抗和芳香酶抑制剂。
83、53.实施方案52的方法,其中所述芳香酶抑制剂是阿那曲唑(anastrazole)或来曲唑(letrozole)。
84、54.实施方案52或实施方案53的方法,其中所述乳腺癌是激素受体阳性的晚期乳腺癌。
85、55.实施方案54的方法,其中所述激素受体是雌激素受体(er)和/或孕酮受体(pgr)。
86、56.实施方案52至55中任一项的方法,其中所述患者先前未接受过转移性背景中的系统性非激素抗癌疗法。
87、57.实施方案52至56中任一项的方法,其中所述患者接受诱导化疗。
88、58.实施方案57的方法,其中所述诱导化疗包含紫杉烷。
89、59.实施方案17或实施方案18的方法,其中所述包装插页进一步包含实施例4中的警告框。
90、60.一种治疗癌症患者的方法,其包括对所述患者施用起始剂量为840mg的帕妥珠单抗,继之以其后每3周剂量为420mg的帕妥珠单抗,并进一步包括如果连续两剂420mg之间的时间为6周或更长的话,再施用840mg剂量的帕妥珠单抗。
91、61.实施方案60的方法,其进一步包括在再施用840mg剂量之后每3周施用420mg的帕妥珠单抗。
92、62.实施方案60或实施方案61的方法,其中所述癌症患者具有her2阳性乳腺癌。
93、63.实施方案1至13中任一项的方法,其将死亡风险相对于用曲妥珠单抗和化疗治疗的患者降低约34%或更多。
94、64.实施方案17或实施方案18的方法,其中所述包装插页进一步提供实施例9或表14中的总体存活(os)功效数据。
95、65.一种在患者中治疗her2阳性转移性或局部再发的乳腺癌的方法,其包括对所述患者施用帕妥珠单抗、曲妥珠单抗和类紫杉烷(taxoid),其中所述患者先前已用曲妥珠单抗和/或拉帕替尼(lapatinib)作为辅助或新辅助疗法治疗过。
96、66.实施方案65的方法,其中所述类紫杉烷是多西他赛、帕利他赛(paclitaxel)或nab-帕利他赛。
97、67.实施方案65的方法,其中所述类紫杉烷是帕利他赛或nab-帕利他赛。
98、68.实施方案65至67中任一项的方法,其中所述患者先前已用曲妥珠单抗作为新辅助疗法治疗过。
99、69.一种在患者中治疗低her3卵巢癌、原发性腹膜癌或输卵管癌的方法,其包括对所述患者施用帕妥珠单抗和化疗,其中所述低her3癌症以等于或低于约2.81的浓度比率表达her3 mrna,如通过聚合酶链式反应(pcr)评估的。
100、70.实施方案69的方法,其中所述化疗包含吉西他滨(gemcitabine)、卡铂、帕利他赛、多西他赛、托泊替康(topotecan)、或peg化脂质体多柔比星(doxorubicin)(pld)。
101、71.实施方案70的方法,其中所述化疗包含帕利他赛或托泊替康。
102、72.实施方案69至71中任一项的方法,其中所述癌症是铂抗性或铂不应性的上皮卵巢癌。
- 还没有人留言评论。精彩留言会获得点赞!