一种仿生铁死亡诱导剂及其制备方法和在制备肿瘤治疗药物中的应用
本发明涉及一种能够调节肿瘤免疫微环境并诱导细胞发生铁死亡的纳米药物及其制备方法和应用,具体涉及一种仿生铁死亡诱导剂及其制备方法和在制备肿瘤治疗药物中的应用,属于纳米药物的。
背景技术:
1、铁死亡是近年来研究较为广泛的一种细胞死亡形式。铁死亡的原理是fe2+催化芬顿反应产生活性氧自由基(reactive oxygen species,ros)介导脂质过氧化,导致细胞内脂质过氧化物(lipid hydroperoxide,lpo)蓄积,从而发生细胞死亡。同时发生铁死亡的细胞可以释放lpo作为“找到我”的信号,从而触发抗原提呈细胞的成熟,从而诱导抗肿瘤免疫。许多抗肿瘤药物通过诱导肿瘤细胞铁死亡,发挥抗肿瘤效果。然而,细胞铁死亡的过程中会释放出多种细胞因子,诱导具有免疫抑制作用的treg、中性粒细胞、m2型巨噬细胞的浸润,形成免疫抑制的微环境,从而导致肿瘤对治疗药物的不敏感。双氢青蒿素(dihydroartemisinin,dha)是一种具有代表性的小分子铁死亡诱导剂,因其可以通过多种途径诱导细胞发生铁死亡,在肿瘤治疗领域也受到了广泛关注。但是,dha存在靶向性差,血液循环半衰期短等问题,临床应用时副反应多,如需达到治疗效果需要重复注射或大剂量局部注射。实体肿瘤中缺乏足够的fe2+也阻碍了dha作为铁死亡诱导剂的疗效。空心结构的介孔氧化硅纳米颗粒(hmsns)因其密度低、孔道多、渗透性高等优异性能,在生物医学中常用作纳米药物递送系统,保证其内部药物稳定并在肿瘤的微酸环境中分解释放,实现靶向效果。因此,迫切需要开发一种新型仿生铁死亡诱导剂,用于实现铁死亡诱导剂高效、稳定、特异性的作用于肿瘤部位,诱导肿瘤细胞铁死亡的同时,利用局部免疫细胞对铁死亡的差异敏感性,重塑肿瘤免疫微环境,最终实现安全高效的肿瘤治疗效果。
技术实现思路
1、基于上述问题,本发明的目的在于提供一种安全、高效、稳定的肿瘤治疗用纳米仿生铁死亡诱导剂及其制备方法和应用。
2、一方面,本发明提供了一种具有靶向性的仿生铁死亡诱导剂(d@fmn-m),包括:铁离子掺杂的空心介孔氧化硅纳米颗粒fe-hmsns(可简写为fmn)、负载在fe-hmsns内部的双氢青蒿素dha(可简写为d@fmn),以及包裹在fe-hmsns表面的大肠杆菌e.coli来源的外膜囊泡omvs(可简写为d@fmn-m)。
3、在本公开中,fmn中包含的铁离子(fe3+)可以在血液循环中保持稳定,在运送过程中不与其内部的dha发生反应,同时表面包裹的omvs提高了纳米粒子的生物相容性。当d@fmn-m到达肿瘤部位之后,omvs协助d@fmn更好地透过磷脂双分子层。此时,fmn外壳在肿瘤的酸性环境中发生分解,释放出dha及fe3+,与肿瘤内的过氧化氢发生反应后可以释放出氧自由基产生细胞损伤,fe3+被还原为fe2+并在细胞内蓄积,通过芬顿反应进一步放大铁死亡效应。
4、而且,d@fmn-m在血液循环中保持稳定,其外壳中的fe3+不与其内部搭载的dha发生反应,达到稳定运输的效果。d@fmn-m外部包裹的omvs可以提高纳米粒子的生物相容度,达到仿生效果。具体地,d@fmn-m只有在肿瘤局部的微酸环境中才会分解,释放内部的dha及fe3+,同时在肿瘤局部富含h2o2的环境中,进一步产生氧自由基,诱发肿瘤及特定免疫细胞铁死亡,实现靶向、高效的治疗作用。
5、较佳的,所述铁离子掺杂的空心介孔氧化硅纳米颗粒fe-hmsns中铁离子的掺杂量为10~20at%。
6、较佳的,所述铁离子掺杂的空心介孔氧化硅纳米颗粒fe-hmsns的粒径为100~200nm,孔径分布为3nm~5nm,比表面积为150~200cm2/g。
7、较佳的,所述仿生铁死亡诱导剂中双氢青蒿素dha的负载量为15~30wt%,优选为20~25wt%。
8、较佳的,所述大肠杆菌e.coli来源的外膜囊泡omvs的直径为100~150nm。omvs透射电镜图片可见较典型的茶托状囊泡形态,直径分布50~150nm。
9、较佳的,所述仿生铁死亡诱导剂为球形形貌,粒径为100~150nm。
10、再一方面,本发明提供了一种上述仿生铁死亡诱导剂的制备方法,包括:
11、(1)将双氢青蒿素dha溶液加入至fe-hmsns分散液中,在室温下磁力搅拌后再经离心,得到负载有双氢青蒿素dha的fe-hmsns,记为d@fmn;
12、(2)将修饰剂、负载有双氢青蒿素dha的fe-hmsns和溶剂混合得到混合溶液后,在25~30℃下反应10~12小时,得到改性的负载有双氢青蒿素d@fmn;
13、(3)将改性的负载有双氢青蒿素dha的fe-hmsns加入到omvs和溶液形成的悬浮液中,采用微型挤出机多次挤出,得到所述仿生铁死亡诱导剂d@fmn-m。
14、本发明中,通过合成fmn作为靶向释药系统。在fmn内部搭载经典铁死亡诱导剂dha,合成d@fmn。使用聚乙烯亚胺(pei)修饰d@fmn颗粒表面,使其表面带正电荷,从而更容易与omvs发生强离子相互作用,提高包裹效率。
15、较佳的,步骤(1)中:所述双氢青蒿素dha溶液中双氢青蒿素dha的浓度为2~5mg/ml,优选为2.5mg/ml;
16、所述fe-hmsns分散液中fe-hmsns的浓度为5~10mg/ml,优选为5mg/ml;
17、所述fe-hmsns和双氢青蒿素dha的质量比为(2~5):1;
18、所述室温的范围为25~30℃;
19、所述磁力搅拌的转速为300~500rpm,时间为10~12小时、优选为12小时
20、所述离心的转速为8000~12000rpm,优选为10000rpm;
21、优选地,所述双氢青蒿素dha溶液的溶剂选自无水乙醇、二甲基亚砜和甲醇中的至少一种;
22、优选地,所述fe-hmsns分散液的溶剂选自去离子水、自无水乙醇和二甲基亚砜中的至少一种。
23、较佳的,步骤(2)中:所述修饰剂选自聚乙烯亚胺pei;
24、所述溶剂选自乙醇、二甲基亚砜和甲醇中的至少一种;
25、所述负载有双氢青蒿素dha的fe-hmsns和修饰剂的质量比为(2~5):1,优选为2:1;
26、所述反应的温度为20~30℃,时间为20~30小时;优选所述反应的温度为25℃,时间为24小时。
27、较佳的,步骤(3)中:所述溶液为去离子水或者pbs;
28、所述改性的负载有双氢青蒿素dha的fe-hmsns和omvs的质量比为(5~10):1;
29、所述微型挤出机的挤出直径为0.2nm~0.5μm;
30、所述多次为至少3次;
31、所述挤出时的温度为5~10℃,优选为8℃。
32、再一方面,本发明还提供了一种仿生铁死亡诱导剂在制备肿瘤治疗药物中的应用。其中,d@fmn-m纳米颗粒可以在肿瘤局部的微酸环境(ph=5.5~6.5)中分解释放fe3+和dha,导致fe离子蓄积,且fe3+被gsh还原为fe2+并进一步放大dha诱导的铁死亡效应。
33、有益效果:
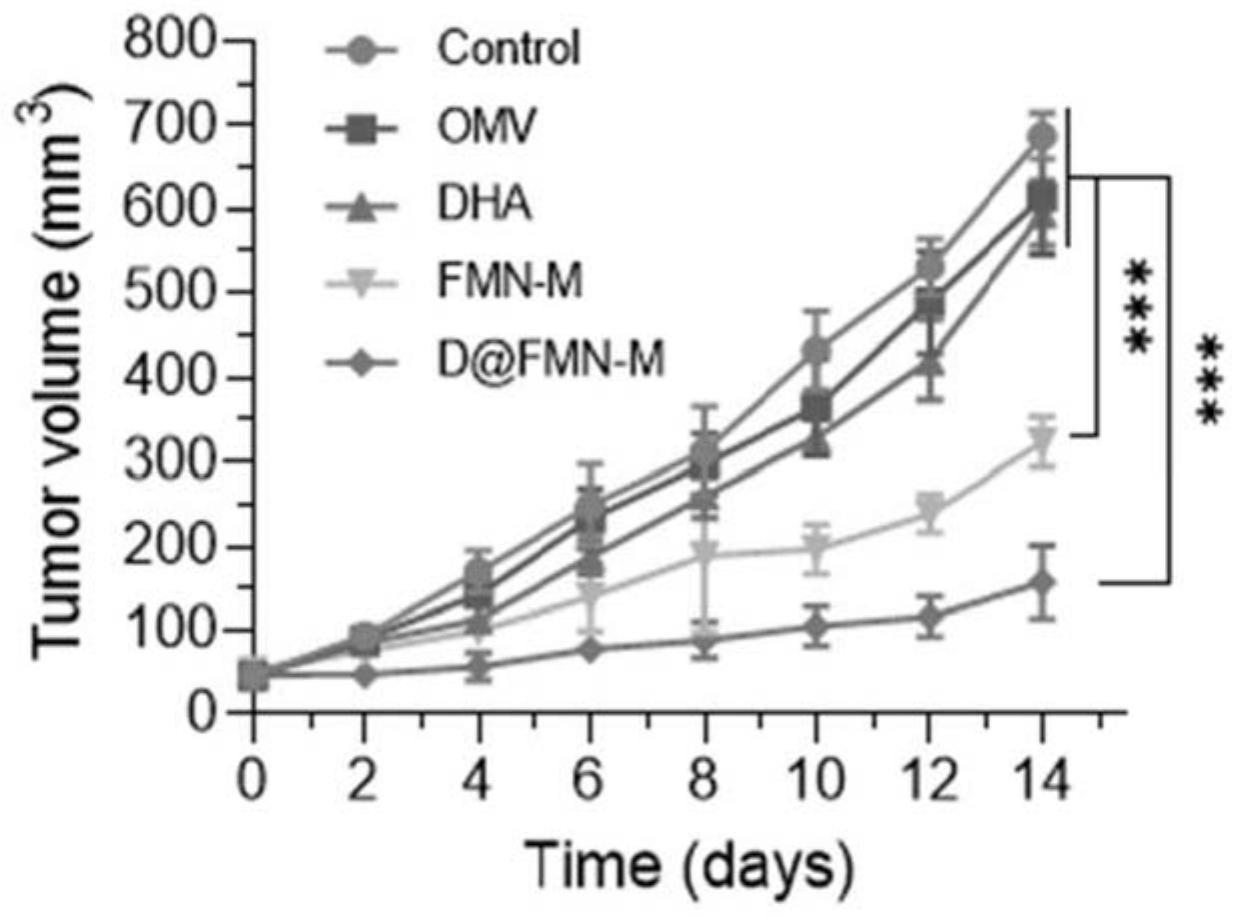
34、本发明中,负载dha的fe-hmsns并经过omvs修饰之后形成的仿生铁死亡诱导剂(d@fmn-m),一方面在肿瘤微环境下可原位触发dha-fe及芬顿反应产生活性氧高效诱导肿瘤细胞发生铁死亡,进而释放免疫刺激信号,激活机体的抗肿瘤免疫响应,提高乳腺癌免疫原性。另一方面,对铁死亡敏感的m2型巨噬细胞捕获d@fmn-m后,发生铁死亡被清除或被驯化成耐铁死亡的m1型抗肿瘤巨噬细胞,从而逆转itme,增强机体免疫抗肿瘤效率,最终实现乳腺癌的铁死亡-免疫增效治疗;
35、本发明的制备方法简单易行、无污染、产量高、成本低、效率高,得到的仿生铁死亡诱导剂稳定性好、生物相容度高,有利于在肿瘤部位的靶向释放,诱导肿瘤细胞铁死亡并调节肿瘤免疫微环境,是极具应用前景的肿瘤治疗方案之一。
- 还没有人留言评论。精彩留言会获得点赞!