一种FXIa的药物组合物及其制备方法与医药用途与流程
本发明属于药物制剂领域,提供了一种fxia的药物组合物及其制备方法与医药用途,具体涉及一种氧代哒嗪酰胺类衍生物的药物组合物及其制备方法与医药用途。
背景技术:
1、由心脑血管疾病和糖尿病及其并发症引起的血栓问题,成为当今要解决的刻不容缓的问题。
2、人体血液凝固过程由内源性途径(intrinsic pathway)、外源性途径(extrinsicpathway)和共同通路组成(annu.rev.med.2011.62:4157),是通过多种酶原被顺序激活而过程不断得到加强和放大的一种连锁反应。凝血级联反应由内源性途径(又称接触激活途径)及外源性途径(又称组织因子途径)启动生成fxa,再经共同途径生成凝血酶(fiia),最终形成纤维蛋白。
3、内源性途径是指由xii因子被激活形xia-viiia-ca2+-p l复合物、并激活x因子的过程,外源性凝血途径则是从组织因子(tf)释放到tf-viia-ca2+复合物形成并激活因子x的过程。共同通路是指因子xa形成后,两条途径合二为一,激活凝血酶原并最终生成纤维蛋白的过程,其中fxi是维持内源性途径所必需的,而且在凝血级联反应放大过程中发挥关键作用。在凝血级联反应中,凝血酶可反馈激活fxi,活化的fxi(fxia)又促使凝血酶的大量产生,从而使凝血级联反应放大。因此,fxi的拮抗剂被广泛开发,用于各种血栓的治疗。
4、传统的抗凝药物,如华法林、肝素、低分子量肝素(lmwh),以及近年上市的新药,如fxa抑制剂(利伐沙班、阿哌沙班等)和凝血酶抑制剂(达比加群酯、水蛭素等),对减少血栓形成均具有较好效果,以其显著有效性占据广大心脑血管市场,然而其副作用也越来越显著,其中“出血风险(bleeding risk)”是首当其冲最为严峻的问题之一(n engl j med1991;325:153-8、blood.2003;101:4783-4788)。
5、研究发现,在血栓模型中,抑制fxia因子可以有效抑制血栓的形成,但在更为严重的血栓情况下,fxia的作用微乎其微(blood.2010;116(19):3981-3989)。临床统计显示,提高fxia的量会增加vte的患病率(blood 2009;114:2878-2883),而fxia严重不足者其患有dvt的风险性减少(thromb haemost2011;105:269273)。
6、fxia作为目前抑制血栓的新兴靶点,公开具有fxia抑制活性的化合物的专利申请有wo9630396、wo9941276、wo2013093484、wo2004002405、wo2013056060、wo2017005725、wo2017/023992、wo2018041122等。
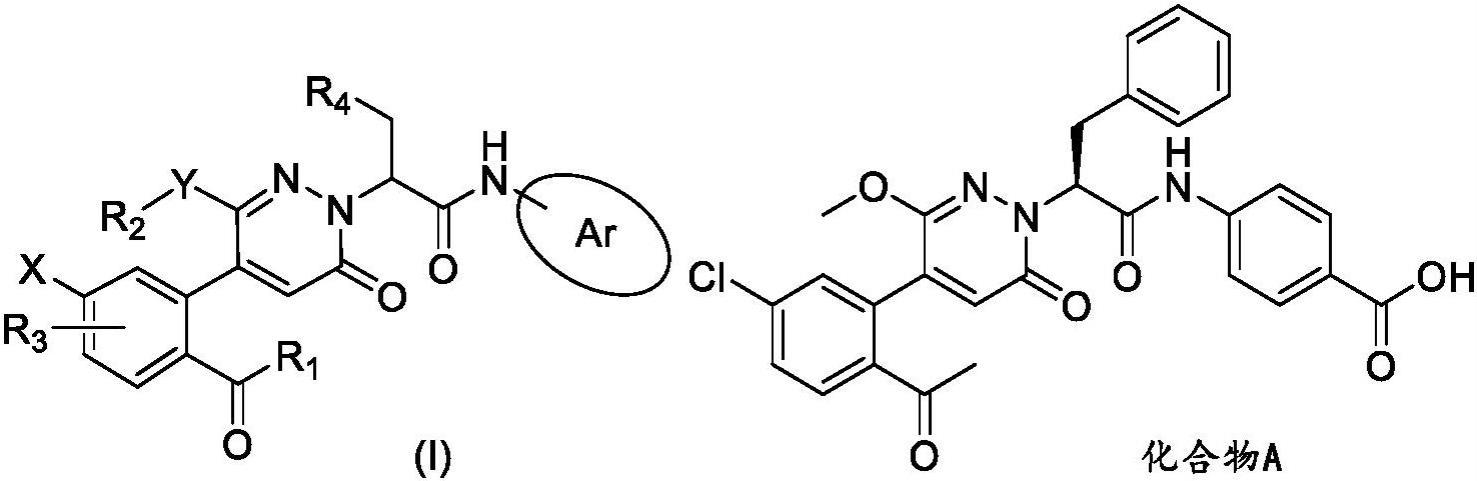
7、pct/cn2020/117257公开了一种氧代哒嗪酰胺类衍生物,作为fxia拮抗剂,可用于血栓栓塞等病症,通式和具体化合物如下式所示:
8、
9、为了用于患者治疗相关疾病,需要进一步研究适宜的药物组合物。
技术实现思路
1、本发明提供了一种fxia的药物组合物及其制备方法与医药用途,具体涉及一种氧代哒嗪酰胺类衍生物的药物组合物及其制备方法与医药用途。
2、本发明提供了一种药物组合物,所述药物组合物为固体分散体,含有活性成分化合物a或其可药用盐,和载体材料。其中活性成分分散在载药材料中,形成药物与载体材料的共分散体系。
3、具体地,一种药物组合物,所述药物组合物为固体分散体,含有活性成分化合物a或其可药用盐,
4、和载体材料,其中所述载体材料为醋酸羟丙甲纤维素琥珀酸酯、丙烯酸树脂、醋酸纤维素、醋酸纤维钛酸酯、羟丙甲纤维素邻苯二甲酸酯、羟丙甲纤维素、羟丙纤维素、聚乙二醇、聚维酮或共聚维酮,所述载体材料和活性成分的重量比不小于0.2:1。在可选实施方案中,本发明所述药物组合物中所用载体材料和活性成分的重量比至少为0.2:1以上时,通过实验中的制备方法得到活性成分与载体的均匀分散体系,其中活性成分呈无定型,从而提高药物的溶解度和药物在体内的吸收,且口服后药物起效快,生物利用度高,同时该药物组合物稳定。
5、作为本发明的一种优选技术方案,所述载体材料和活性成分的重量比为0.2:1~4:1,可以为0.2:1、0.3:1、0.4:1、0.5:1、0.6:1、0.7:1、0.8:1、0.9:1、1:1、1.1:1、1.2:1、1.3:1、1.4:1、1.5:1、1.6:1、1.7:1、1.8:1、1.9:1、2:1、2.2:1、2.4:1、2.6:1、2.8:1、3:1、3.2:1、3.4:1、3.6:1、3.8:1、4:1等等。
6、作为本发明的一种优选技术方案,本发明所述载体材料可选自但不限于3,4-二甲基-苯甲基氨基甲酸酯,醋酸羟丙甲纤维素琥珀酸酯、邻苯二甲酸羟丙甲纤维素、泊洛沙姆188、泊洛沙姆407、聚(甲基)丙烯酸酯、n-乙烯基-2-吡咯烷酮的均聚物、聚维酮、共聚维酮、羧甲基乙基纤维素、邻苯二甲酸乙酸纤维素、甲基丙烯酸共聚物、甲基丙烯酸共聚物、甲基丙烯酸氨基烷基酯共聚物e、聚(乙烯基乙缩醛)二乙基氨基乙酸酯、聚乙烯吡咯烷酮、乙基纤维素、甲基丙烯酸共聚物rs、聚乙烯醇、乙烯基吡咯烷酮及醋酸乙烯共聚物、甲基纤维素、羟丙基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠、糊精、支链淀粉、阿拉伯胶、藻酸钠、卵磷脂、环氧乙烷与环氧丙烷的嵌段共聚物、聚乙二醇、偏苯二酸纤维素、偏苯三酸醋酸羟丙甲纤维素和聚乙烯己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物,优选自醋酸羟丙甲纤维素琥珀酸酯、聚维酮和共聚维酮。
7、其中,所述醋酸羟丙甲纤维素琥珀酸酯为hpmcas。进一步选自hpmcas-mg、hpmcas-mf、hpmcas-mp,聚维酮优选为k30,共聚维酮优选为pvp/va;优于载体材料选为乙基纤维素的技术方案。
8、作为本发明的一种能显著提高动物体内吸收的优选技术方案,所述载体材料和活性成分的重量比优选为0.3:1~3:1。
9、作为本发明的一种优选技术方案,制备方法包括将载体材料与活性成分溶解于有机溶剂中,或将载体材料混悬分散在含活性成分的有机溶剂中,而后除去有机溶剂后、或热熔挤出、或熔融法制得药物组合物。
10、作为本发明的一种优选技术方案,所述去除有机溶剂的方法选自蒸发法、喷雾干燥法、冷冻干燥法或流化床干燥法。
11、作为本发明的一种优选技术方案,所述有机溶剂选自甲醇、乙醇、异丙醇、丙酮、丁酮、四氢呋喃、二氯甲烷、二氯乙烷、三氯甲烷或四氯化碳中的至少一种。
12、本发明进一步提供了一种固体制剂,其包含前述的药物组合物,所述固体制剂选自片剂、丸剂、颗粒剂或胶囊剂。
13、作为本发明的一种优选技术方案,所述固体制剂还包含药学上可接受的赋形剂,所述赋形剂选自崩解剂、填充剂、粘合剂、助流剂、表面活性剂或润滑剂中的至少一种。
14、作为本发明的一种优选技术方案,所述崩解剂选自低取代羟丙基纤维素、交联羧甲基纤维素钠、交联聚维酮、羧甲基淀粉钠、羧甲基纤维素钙、淀粉、预胶化淀粉、微晶纤维素、二氧化硅、泡腾成分或海藻酸中的至少一种,所述崩解剂的用量占固体制剂重量的1~50%。
15、其中,作为一种优选技术方案,崩解剂为含有两种崩解剂的组合,包含:低取代羟丙基纤维素和羧甲基纤维素钙,二者的质量配比为1:2-2:1,优选1:1。
16、所述填充剂选自糊精、乳糖、蔗糖、磷酸氢钙、淀粉、无水磷酸氢钙、磷酸氢钙、微晶纤维素、硅化微晶纤维素、微晶纤维素乳糖复合物、或甘露醇中的至少一种,所述填充剂的用量占固体制剂重量的30~90%;
17、所述粘合剂选自聚乙烯吡咯烷酮、淀粉、甲基纤维素、羧基纤维素、羟丙基纤维素、羟丙甲基纤维素、羧甲纤维素钠、或海藻酸盐中至少一种,所述粘合剂的用量占固体制剂重量的0.5~10%。
18、所述助流剂选自气相二氧化硅、三硅酸镁、粉状纤维素、淀粉或滑石粉中的至少一种,所述助流剂的用量占固体制剂重量的0.1~10%;
19、所述表面活性剂选自十二烷基苯磺酸钠、十二烷基硫酸钠、泊洛沙姆、多库酯钠中的至少一种,所述表面活性剂的用量占固体制剂重量的0.1~10%;
20、所述润滑剂选自硬脂酸镁、硬脂酸、棕榈酸、硬脂酸钙、滑石粉、巴西棕榈蜡或硬脂富马酸钠中的至少一种,所述润滑剂的用量占固体制剂重量的0.1~5%。
21、在可选实施方案中,本发明所述药物组合物还可进一步制备成固体制剂,所述固体制剂为片剂、丸剂、颗粒剂和胶囊剂等。
22、所述胶囊剂包括:胃溶胶囊剂、肠溶胶囊剂、微型胶囊剂。
23、其中,胃溶型胶囊剂为最常见的胶囊剂,口服后,胶囊在胃中溶解,药物释放出来产生药效。
24、肠溶胶囊剂实际上就是硬胶囊剂或软胶囊剂中的一种,只是在囊壳中加入了特殊的药用高分子材料或经特殊处理,所以它在胃液中不溶解,仅在肠液中崩解溶化而释放出活性成分,达到一种肠溶的效果,故而称为肠溶胶囊剂。
25、微型胶囊剂是利用天然的或合成的高分子材料,将固体药物微粒或液体药物微滴包裹成直径1~500微米的微小胶囊剂。
26、所述固体制剂中活性成分含量为5~60%,可以为5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、55或60%,优选为8~25%,以固体制剂重量计;在实施方案中,本发明所述活性成分的量(重量或质量)为10~500mg,可以为400mg、390mg、380mg、370mg、360mg、350mg、340mg、330mg、320mg、310mg、300mg、290mg、280mg、270mg、260mg、250mg、240mg、230mg、220mg、210mg、200mg、190mg、180mg、170mg、160mg、150mg、140mg、130mg、120mg、110mg、100mg、95mg、90mg、85mg、80mg、75mg、70mg、65mg、60mg、55mg、50mg、45mg、40mg、35mg、30mg、25mg、20mg、15mg或10mg。
27、进一步地,本发明所述固体制剂中还含药学上可接受的赋形剂,所述赋形剂为本领域技术人员所熟知或可以确定的,选自但不限于崩解剂、填充剂、粘合剂、助流剂、润滑剂中的至少一种。
28、本发明所述崩解剂为本领域技术人员所知或可以确认的,选自但不限于交联羧甲基纤维素钠、交联聚维酮、羧甲基淀粉钠、羧甲纤维素钙、淀粉、预胶化淀粉、微晶纤维素、二氧化硅、泡腾成分或海藻酸中的至少一种;优选地,所述崩解剂的用量占固体制剂重量的1~50%,可以为1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5、11.0、11.5、12.0、12.5、13.0、13.5、14.0、14.5、15.0、15.5、16.0、16.5、17.0、17.5、18.0、18.5、19.0、19.5、20.0%,21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49或50,优选为5~50%,以固体制剂重量计。
29、本发明所述填充剂为本领域技术人员所知或可确定的,选自但不限于糊精、乳糖、蔗糖、磷酸氢钙、淀粉、无水磷酸氢钙、磷酸氢钙、微晶纤维素、硅化微晶纤维素、微晶纤维素乳糖复合物、或甘露醇中至少一种;优选地,所述填充剂的用量占固体制剂重量的30~90%,更优选35~60%,可以为35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60%,以固体制剂重量计。
30、本发明所述粘合剂为本领域技术人员所知或可以确认的,选自但不限于聚乙烯吡咯烷酮、淀粉、甲基纤维素、羧基纤维素、羟丙基纤维素、羟丙甲基纤维素、羧甲纤维素钠、或海藻酸盐中的至少一种,优选自聚乙烯吡咯烷酮(优选商品名k30的聚维酮)、羟丙基纤维素中的至少一种;优选所述粘合剂的用量占固体制剂重量的0.5~10%,可以为0.5、0.6、0.7、0.8、0.9、1.0、1.2、1.4、1.6、1.8、2.0、2.2、2.4、2.6、2.8、3.0、3.2、3.4、3.6、3.8、4.0、4.2、4.4、4.6、4.8、5.0、5.2、5.4、5.6、5.8、6.0、6.2、6.4、6.6、6.8、7.0、7.2、7.4、7.6、7.8、8.0、8.2、8.4、8.6、8.8、9.0、9.2、9.4、9.6、9.8或10.0%,以固体制剂重量计。
31、本发明所述助流剂为本领域技术人员所知或可以确认的,选自但不限于气相二氧化硅(例如aerosil200)、三硅酸镁、粉状纤维素、淀粉、滑石粉中的至少一种,优选气相二氧化硅;所述助流剂的用量占固体制剂重量的0.5~10%,可以为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.2、1.4、1.6、1.8、2.0、2.2、2.4、2.6、2.8、3.0、3.2、3.4、3.6、3.8、4.0、4.2、4.4、4.6、4.8、5.0、5.2、5.4、5.6、5.8、6.0、6.2、6.4、6.6、6.8、7.0、7.2、7.4、7.6、7.8、8.0、8.2、8.4、8.6、8.8、9.0、9.2、9.4、9.6、9.8或10.0%,以固体制剂重量计。
32、本发明所述表面活性剂为本领域技术人员所知或可以确认的,选自但不限于十二烷基苯磺酸钠、十二烷基硫酸钠、泊洛沙姆、多库酯钠的至少一种;优选地,本发明所述述表面活性剂的用量占固体制剂重量的0.1~10%,可以为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9或5.0%,优选为0.1~2%,以固体制剂重量计。
33、本发明所述润滑剂为本领域技术人员所知或可以确认的,选自但不限于硬脂酸镁、硬脂酸、棕榈酸、硬脂酸钙、滑石粉、巴西棕榈蜡或硬脂富马酸钠中的至少一种;优选地,本发明所述润滑剂的用量占固体制剂重量的0.1~5%,可以为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9或5.0%,优选为0.1~2%,以固体制剂重量计。
34、本发明还提供了制备前述固体制剂的方法,该方法包括:先将化合物a或其可药用盐药物组合物经粉碎后,再与固体制剂成型所需的填充剂和/或崩解剂等混合均匀,加入粘合剂湿法制粒,或干法制粒,制备的颗粒干燥过筛整粒后与润滑剂混合均匀,制备丸剂或颗粒剂或压片或装胶囊;也可采用药物组合物加入适当辅料直接装胶囊或制剂压片的方法。根据需要,所的颗粒剂或素片或胶囊还可以进一步包衣等。
35、作为本发明的一种优选技术方案,所述固体制剂含有1)前述固体分散体,包含10mg~600mg重量的活性成分;
36、进一步任选含有以下组成的一种以上的赋形剂:
37、2)5~15%重量的崩解剂;
38、3)30~90%重量的填充剂;
39、4)0.5~10%重量的粘合剂;
40、5)0.1~10%重量的助流剂;
41、6)0.1~10%重量的表面活性剂;
42、7)0.1~5%重量的润滑剂;
43、固体制剂各组份之和为100%。
44、作为本发明的一种优选技术方案,进一步任选含有以下赋形剂的组合:
45、 组合1 聚维酮k30 交联聚维酮xl 微晶纤维素 乳糖一水合物 交联羧甲基纤维素钠 二氧化硅 硬脂酸镁
46、制备方法包括:将api溶于溶剂系统,再将pvp溶于api溶液中,得到粘合剂溶液;将交联聚维酮xl、微晶纤维素和乳糖置流化床中预混,再喷粘合剂溶液制粒,再外加交联羧甲基纤维素钠、二氧化硅和硬脂酸镁总混后,灌装胶囊,得到胶囊剂。
47、作为本发明的一种优选技术方案,所述固体制剂含有1)前述固体分散体,包含10mg~600mg重量的活性成分;
48、进一步任选含有以下组成的一种以上的赋形剂:
49、2)5~50%重量的崩解剂;
50、3)0.1~5%重量的润滑剂;
51、固体制剂各组份之和为100%。
52、作为本发明的一种优选技术方案,进一步任选含有以下赋形剂的组合:
53、 组合2 hpmcas-mg 羧甲基纤维素钙 低取代羟丙基纤维素 硬脂酸镁
54、制备方法包括:将api与hpmcas-mg共同溶在有机溶剂中,旋蒸或喷雾干燥得到固体分散体,将固体分散体再加入崩解剂干法制粒后,最后加入硬脂酸镁填充胶囊,得到胶囊剂。
55、有机溶剂的选择可以是丙酮、乙醇、二氯甲烷、甲醇等,也可以前述溶剂两种以上的混合溶剂,或者前述溶剂与水组成的混合溶剂,例如,二氯甲烷和甲醇混合溶剂,二者重量比为:1∶1-32∶1;含水乙醇,含水丙酮等。
56、本发明固体制剂所述溶出实验通过“模拟空腹胃肠液转换的介质”条件进行,15min达到50%或更高,比如大于或等于70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95%。
57、本发明所述固体制剂在温度40℃±2℃、相对湿度75%±5%的条件下放置3个月以上(比如3个月、6个月、12个月、18个月、24个月等)不会出现老化现象,各项考核指标(如有关物质、溶出度等)均没有明显变化。
58、本发明所述化合物a可药用盐,选自但不限于钠盐、钾盐、葡甲胺盐、钙盐及胆碱盐等,优选钠盐和葡甲胺盐。
59、本发明所述的“以固体制剂的重量计”为不包含包衣剂的片芯重量计算活性成分或其他种类药用辅料的使用量数值范围。
60、本发明所述制剂设备和药物辅料或试剂均可来自商业途径获得。
- 还没有人留言评论。精彩留言会获得点赞!