肝素-青蒿琥酯前药、其制备方法和应用
本发明属于医药,涉及二硫键偶联的肝素-青蒿琥酯前药、其制备方法,及其用作(载药)自组装胶束、用于制备治疗抗肿瘤药物的应用,该前药是以胱胺为中间体,将肝素和青蒿琥酯共价偶联获得。
背景技术:
1、癌症是严重威胁全球人类健康的重大疾病,癌症最广泛的治疗方案是化学药物治疗。在化疗过程中,肿瘤细胞对抗癌药物产生多药耐药是导致化疗药物治疗失败的重要原因之一。许多癌症随着时间的推移而产生耐药性,其中一个主要机制是膜蛋白泵的过度表达导致药物外流,导致药物无效或药物浓度低[ma x,hu m,wang h,et al.discovery oftraditional chinese medicine monomers and their synthetic intermediates,analogs or derivatives for battling p-gp-mediated multi-drug resistance[j].eur j med chem,2018,159:381-92]。此外,大多数化疗药物存在水溶性低、稳定性不佳、对肿瘤组织缺乏选择性等问题,导致肿瘤的化疗往往难以取得理想的效果,治疗过程中常伴随有严重的毒副作用。
2、p-糖蛋白(p-glycoprotein,p-gp)介导的多药耐药(multidrug resistance,mdr)是阻碍患者对化疗反应的主要表型。最近,研究人员报道,青蒿素及其衍生物可以对抗多药耐药性[levy j m m,towers c g,thorburn a.targeting autophagy in cancer[j].natrev cancer,2017,17(9):528-42.]耐药相关基因如mdr1、p-gp、多药耐药相关蛋白1(multidrug resistance-associated protein 1,mrp1)和乳腺癌耐药蛋白(breastcancer resistance protein,bcrp),已被证明对青蒿素化合物的疗效影响较小[effertht,sauerbrey a,olbrich a,et al.molecular modes of action of artesunate intumor cell lines[j].mol pharmacol,2003,64(2):382-94]。这表明当肿瘤出现对化疗药物的耐药性时,青蒿素及其衍生物仍可发挥抗肿瘤活性。青蒿素化合物已被证明在对紫杉醇、阿霉素、甲氨蝶呤和羟基脲耐药的癌症株中有效,没有交叉耐药性[mabuchi s,hisamatsu t,kimura t.targeting mtor signaling pathway in ovarian cancer[j].curr med chem,2011,18(19):2960-8.li z,zhu y t,xiang m,et al.enhancedlysosomal function is critical for paclitaxel resistance in cancer cells:reversed by artesunate[j].acta pharmacol sin,2021,42(4):624-32]。
3、由于肿瘤细胞中的氧化还原水平高于正常细胞[luo c,sun b,wang c,etal.self-facilitated ros-responsive nanoassembly of heterotypic dimer forsynergistic chemo-photodynamic therapy[j].j control release,2019,302:79-89],尤其是肿瘤细胞中的活性氧(reactive oxygen species,ros)和谷胱甘肽(glutathione,gsh)浓度分别比正常细胞高100倍和4倍以上[moradi kashkooli f,soltani m,sourim.controlled anti-cancer drug release through advanced nano-drug deliverysystems:static and dynamic targeting strategies[j].j control release,2020,327:316-49]。例如在对卵巢癌的研究中发现,谷胱甘肽(gsh)耗竭以及谷胱甘肽过氧化物酶4(gpx4)表达降低会导致细胞铁死亡。在多药耐药肿瘤细胞中,通常发现gsh水平升高,降低了它们对化疗药物的敏感性和治疗效果。多药耐药细胞还依赖gpx4,减少其氧化应激,促进其存活。因此,gsh耗竭和gpx4表达降低有可能成为多药耐药肿瘤的一种更好的治疗策略。
4、因此,合理设计氧化还原响应型药物递送系统是有效治疗癌症的良好前景。各种对氧化还原微环境敏感的化学键被用来促进药物从纳米粒中释放[sun b,luo c,zhang x,et al.probing the impact of sulfur/selenium/carbon linkages on prodrugnanoassemblies for cancer therapy[j].nat commun,2019,10(1):3211]。但是,目前应用于临床的纳米制剂还存在诸多不足,包括:载药量低(通常低于10%)、稳定性差、载体材料相关的毒副作用和储存过程中药物的结晶和泄漏等问题。因此,设计和构建新型的高效纳米药物传递系统仍然是亟待解决的难题。
5、青蒿素及其衍生物(artemisinin and its derivatives,arts)具有优异的临床疗效和安全性,是目前最有效的抗疟疾药物,最先是由屠呦呦团队从青蒿属植物中分离得到。近年来,arts的抗癌活性受到越来越多的关注[deeken j f,wang h,hartley m,etal.a phase i study of intravenous artesunate in patients with advanced solidtumor malignancies[j].cancer chemother pharmacol,2018,81(3):587-96;shiq,xiaf,wang q,et al.discovery and repurposing of artemisinin[j].front med,2022,16(1):1-9]。arts可以通过调节自噬、线粒体自噬和铁蛋白自噬等发挥抗癌作用[sun x,yanp,zou c,et al.targeting autophagy enhances the anticancer effect ofartemisinin and its derivatives[j].med res rev,2019,39(6):2172-93],自噬涉及多个信号通路的变化。虽然青蒿素显示出一些抗癌作用,但与其显著的抗疟疾作用相比,其效力有限,青蒿素抗癌的ic50在微摩尔范围内[efferth t,dunstan h,sauerbrey a,etal.the anti-malarial artesunate is also active against cancer[j].oncol,2001,18(4)]。因此,仅靠青蒿素及其衍生物很难达到临床治疗的抗肿瘤效果,只有与化疗药物联合治疗,才有较强地抗癌作用且无明显不良反应。此外,jigang wang等[wang j,zhang cj,chia w n,et al.haem-activated promiscuous targeting of artemisinin inplasmodium falciparum[j].nat commun,2015,6:10111.lew v l,tiffert t,ginsburgh.excess hemoglobin digestion and the osmotic stability of plasmodiumfalciparum-infected red blood cells[j].blood,2003,101(10):4189-94.wang j,zhang j,shi y,et al.mechanistic investigation of the specific anticancerproperty of artemisinin and its combination with aminolevulinic acid forenhanced anticolorectal cancer activity[j].acs cent sci,2017,3(7):743-50]用炔烃或生物素标记的青蒿素探针观察到了青蒿素与广泛的蛋白质靶标相互作用,表明其作用机制混杂。鉴于其混杂靶向机制的特点,探索青蒿素及其衍生物在抗癌联合治疗中的应用具有重要意义,因为多靶向性确保其不太容易受到化疗耐药的影响。
6、近年来,天然生物大分子作为生物医学载体受到越来越多的关注,因为它们具有可再生性、无毒性、生物相容性、生物降解性、血液循环时间长和靶向能力等特性。同时,它们还能够控制和持续释放药物。肝素是一种水溶性、带负电荷的多糖,具有重要的生物学功能,包括抗凝活性、与血管内皮生长因子、碱性成纤维细胞生长因子和骨形态发生蛋白-2等生长因子的强结合。因此,肝素作为一种抗凝血药物和抗肿瘤药物载体,由于其多靶向性和抗转移活性而被广泛研究。肝素-药物结合物目前被认为是药物输送载体和联合治疗的极佳候选药物。当肝素与疏水分子结合时,有可能组装成纳米颗粒。li等人[li n-n,zheng b-n,lin j-t,et al.new heparin-indomethacin conjugate with an ester linkage:synthesis,self aggregation and drug delivery behavior[j].mater sci eng cmater biol appl,2014,34:229-35]合成了一种具有酯键的肝素-吲哚美辛结合物,用于缓释和酯酶敏感的药物释放。该偶联物具有两亲性,可在水溶液中自组装成直径200nm的球形纳米颗粒。zhang等人[12]设计了一种低分子肝素(low molecular weight heparin,lmwh)和全反式维甲酸(all-trans retinoic acid,atra)的两亲性结合物,可以自组装成纳米粒子并包裹抗癌药物阿霉素(doxorubicin,dox)。dox-lmwh-atra纳米粒通过增强渗透性和滞留(enhanced permeability and retention,epr)效应和基于lmwh的内吞作用表现出良好的相容性和在肿瘤中的蓄积。与单一疗法相比,三种成分在一个纳米颗粒系统中的联合递送增强了抗肿瘤效果。
7、目前,尚无报道将肝素与青蒿琥酯联合制备前药用于制备抗肿瘤药的研发内容。
技术实现思路
1、发明目的:为了克服现有技术的不足,本发明的目的是提供肝素-青蒿琥酯前药、其制备方法和应用,肝素和青蒿琥酯通过二硫键(s-s)共价连接构建具有还原响应肝素-青蒿琥酯前药,s-s键可以响应肿瘤组织微环境的还原性,消耗谷胱甘肽并释放出青蒿琥酯。青蒿琥酯可以降低铁死亡关键蛋白slc7a11和gpx4的表达,造成gsh耗竭和脂质过氧化物的积累,诱导肿瘤细胞铁死亡从而克服肿瘤多药耐药。所得肝素-青蒿琥酯前药可以在超声条件下自组装成为胶束,该胶束可用于携载抗肿瘤药物构建肿瘤靶向性递药系统,实现高载药量及高溶解度,延长半衰期,提高生物利用度和克服肿瘤耐药性。
2、技术方案:为了实现上述目的,本发明采用了以下技术方案:
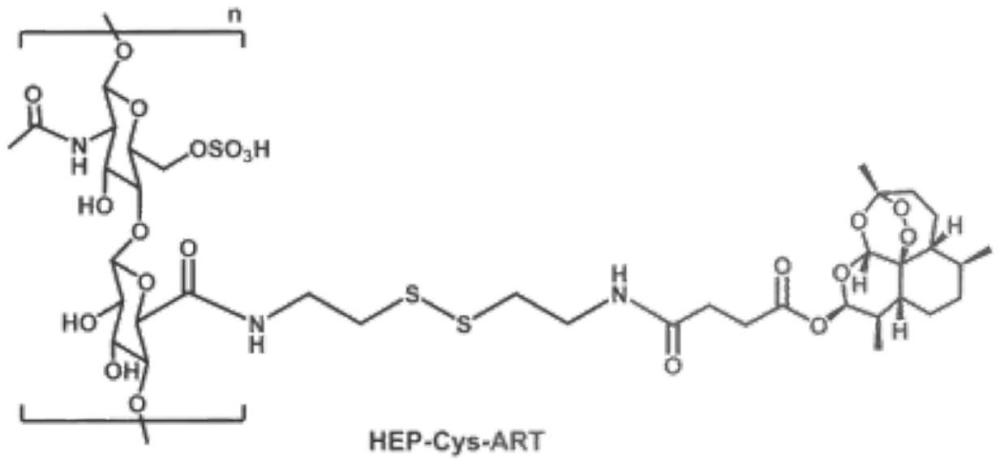
3、肝素-青蒿琥酯前药(hep-cys-art,简称为hca),结构通式如下所示。
4、
5、上述肝素-青蒿琥酯前药的制备方法如下:
6、(1)胱胺二盐酸盐与肝素发生酰胺反应得到中间产物;
7、(2)然后中间产物再与青蒿琥酯以不同质量比(1:3、1:6、1:12)发生酰胺反应,得到肝素-青蒿琥酯前药hca1:3、hca1:6、hca1:12。
8、具体的,包括如下步骤:
9、①称取100mg的hep至100ml的圆底烧瓶中,用10ml 0.01mol/l的mes缓冲液溶解,再加入300mg edci和400mg nhs,在25℃下搅拌,活化羧基12h后,恒定搅拌下加入2.8g的cys,继续反应24h,然后将反应液透析(mwco:3500)24h,最后冷冻干燥,4℃保存。
10、②另一反应中,取4ml的dmf至100ml的圆底烧瓶,加入85mg的art,100mg的edci,120mg的nhs,活化羧基12h。
11、③称取50mg的hep-cys冻干样品,用6ml甲酰胺40℃水浴溶解后,滴加至活化后的art溶液中。在25℃下反应24h,将反应液在水中透析(mwco:3500)24h除去未反应的小分子。最后,冷冻干燥后获得hep-cys-art,4℃保存备用。
12、hep-cys与art的不同质量投料比1:3、1:6、1:12制备得到的肝素-青蒿琥酯前药分别标记为hca1:3、hca1:6、hca1:12。
13、一种肝素-青蒿琥酯前药的自组装胶束,临界胶束浓度以上的肝素-青蒿琥酯前药的水溶液,在超声作用下,疏水性青蒿琥酯内核、亲水性肝素外壳,在连接键二硫键作用下,自发形成均匀稳定的胶束。
14、一种肝素-青蒿琥酯前药的载药自组装胶束,是采用透析法,借助肝素-青蒿琥酯前药的疏水核心将疏水的药物包裹到hca胶束中形成载药自组装胶束,所述的疏水的药物为紫杉醇、索拉菲尼、荧光标记物香豆素-6的任一种。
15、一种肝素-青蒿琥酯前药的载药自组装胶束的制备方法,其特征在于,
16、(1)肝素-青蒿琥酯前药溶解到水中形成溶液备用;
17、(2)疏水性药物溶解到无水乙醇中形成溶液备用;
18、(3)搅拌下,将步骤(2)所得乙醇溶液缓缓滴加到步骤(1)所得含有肝素-青蒿琥酯前药的水溶液中,超声破碎仪超声后透析除去乙醇,自发形成均匀的载药胶束。
19、一种药物组合物,包含肝素-青蒿琥酯前药和药学上可接受的载体或赋形剂。
20、一种药物靶向递送系统,包含肝素-青蒿琥酯前药的自组装胶束或者肝素-青蒿琥酯前药的载药自组装胶束,以及药学上可接受的载体或赋形剂。
21、肝素-青蒿琥酯前药、肝素-青蒿琥酯前药的自组装胶束,以及肝素-青蒿琥酯前药的载药自组装胶束在制备抗肿瘤药物中的应用。
22、具体来说,所述的肿瘤为卵巢癌。
23、有益效果:本发明的优势在于:
24、①本发明通过具有还原响应的胱胺为连接桥将青蒿琥酯与肝素偶联得到内疏水、外亲水的两亲性hca前药,良好的水溶性、稳定性及体外释药性能;合成方法简单易行,合成得到的hca1:3、hca1:6、hca1:12中art含量分别为8.26%、13.01%和18.96%。
25、②通过对前药水溶液的超声,借助疏水性青蒿琥酯内核、亲水性肝素外壳,二硫键为连接键,制备得到均匀稳定的前药自组装胶束,所得胶束外形为球形,粒径在100-200nm,安全性高,不会引起溶血。制备方法简单易实施,无需使用有机溶剂,对环境和操作人员无污染。
26、③二硫键的二面角可以显著提高空间柔性,从而促进纳米粒自组装并增强其稳定性。在肿瘤细胞内,二硫键能被肿瘤细胞高表达的gsh还原为硫醇,并且在ros的作用下被氧化为强亲水性的亚砜或砜,进而增加体系的亲水性,促进药物释放,增加药物在肿瘤细胞的快速蓄积,从而提高肿瘤杀伤效果,并降低对正常组织的副作用。这些氧化还原刺激响应型的载体往往表现出长循环、高响应以及定点释药等诸多优势。
27、④所得前药自组装胶束可用于携载诸如紫杉醇或索拉菲尼或荧光标记物香豆素-6的抗肿瘤药,在肿瘤部位释放度高,体内循环时间得以延长,且载药量高。具有良好的靶向性,实现高载药量及高溶解度,延长半衰期,提高生物利用度和克服肿瘤耐药性。
- 还没有人留言评论。精彩留言会获得点赞!