一种药物组合物及其在制备治疗肝癌的药物中的用途
本发明涉及生物医药领域,尤其是涉及一种药物组合物及其在制备治疗肝癌的药物中的用途。
背景技术:
1、癌症是一种慢性疾病,近年来患病率和致死率都在逐年上升。癌细胞通常在新陈代谢方面具有特征性。变化异常的癌症代谢有助于细胞增殖和肿瘤进展。目前临床上常用的肿瘤治疗方案主要有化疗、放疗免疫治疗和靶向治疗。由于这些治疗手段受个体差异的影响,因此治疗效果因人而异。此外,化疗、免疫和靶向药物在治疗的中后期容易产生耐药性阻碍药效的发挥,并且一部分肿瘤对放疗也存在天然不敏感的情况,这些都是肿瘤在治疗过程中的亟待解决的难题。
2、铁死亡(ferroptosis)是一种铁依赖性的,区别于细胞凋亡、细胞坏死、细胞自噬的新型细胞程序性死亡方式。生化特征主要表现为铁积累、ros升高、谷胱甘肽(gsh)耗竭、谷胱甘肽过氧化物酶4(gpx4)和胱氨酸/谷氨酸反转运体slc7a11(xct)失活等。
3、肿瘤的发生和发展与机体代谢异常息息相关,因此异常的铁水平在某种程度上是肿瘤的一大特征。恶性肿瘤为机体部分组织细胞长期异常增殖所形成的疾病,严重危害了人们的健康及降低了生存质量。tp53(编码p53)是抑癌基因,正常情况p53是抵御癌症的有效屏障。tp53的突变会导致p53功能的缺失,这是大多数癌症的标志。这种突变和缺失会增加癌症风险、加快癌症进展、降低癌症患者对治疗的敏感性。研究发现p53可通过抑制slc7a11的转录而诱导铁死亡。
4、越来越多的研究表明铁死亡是克服肿瘤耐药的新思路。研究者们发现在胆管癌细胞中沉默sharpin基因能够抑制胆管癌细胞的增殖。sharpin的沉默将导致ros积累,线粒体裂变减少和线粒体膜电位降低,同时能抑制p53的泛素化和降解,并抑制了slc7a11和gpx4,最终诱导了肿瘤细胞铁死亡。研究者用龙胆紫诱导了sk-hep-1和smmc-7721细胞铁死亡和细胞凋亡,发现龙胆紫在体外以剂量依赖性方式成功抑制了肝癌细胞的增殖,迁移和侵袭,并显着缓解了肿瘤在体内的生长。同时通过sirna沉默mdm2和p53基因,减少了ros的产生,部分挽救了龙胆紫诱导的细胞死亡。
5、研究发现,核因子e2相关因子2(nrf2)的激活调节了ros水平,介导kelch样环氧氯丙烷相关蛋白1(keap1)功能丧失,从而诱导了仑伐替尼的耐药性。在hep3b和huh7细胞中研究证实了仑伐替尼诱导铁死亡的可能性。研究发现仑伐替尼靶向fgfr4,抑制了slc7a11的表达,诱导了脂质ros积累,引发铁死亡。且这种诱导受nrf2调节,因此下调nrf2的表达是增加hcc对仑伐替尼敏感性的又一思路。研究报道,通过抑制二磷酸腺苷核糖基化因子6(adpribosylation factor 6,arf6)激活acsl4诱导的铁死亡降低了胰腺癌中的吉西他滨(gemcitabine)耐药性。
6、此外,铁死亡与肝细胞癌(hepatocellular carcinoma,hcc)的耐药性也密切相关,通过使用多基因或化合物增敏索拉非尼以及通过铁死亡治疗肝癌的多项进展,发现肿瘤微环境中掺锰介孔二氧化硅纳米颗粒(manganese-doped mesoporous silicananoparticles,mmsn)和低密度脂蛋白-二十二碳六烯酸(ldl-dha)纳米颗粒能够促进hcc细胞铁死亡,为肝癌患者带来更好的预后。
7、仑伐替尼(lenvatinib)是一种多激酶口服抑制剂,靶向血管内皮生长因子受体(vascular endothelial growth factor receptor,vegfr)1–3、成纤维细胞生长因子受体(fibroblast growth factor receptor,fgfr)1–4、血小板衍生生长因子受体a(platelet-derived growth factor receptor,pdgfrα)、原癌基因kit和ret。肿瘤生长依赖于新血管的形成,当配体与细胞膜中各自的酪氨酸激酶受体结合时,会引发肿瘤细胞内信号转导磷酸化级联反应,促进血管生成和肿瘤细胞增殖。仑伐替尼的主要作用机制为:靶向vegf受体阻止了肿瘤血管生成,靶向fgfr,ret,pdgfrα和kit能够阻止肿瘤细胞的进一步增殖。仑伐替尼已经在多种实体瘤中显示出活性,已在多种甲状腺癌、肝细胞癌和肾细胞癌中作为单药或联合使用。此外,仑伐替尼在非小细胞肺癌、腺样囊性和子宫内膜癌等实体瘤中也表现出强大的抗肿瘤活性。
8、原发性肝癌是全球第六大最常诊断的癌症类型和第三大癌症死亡原因,其中肝细胞癌(hepatocellular carcinoma,hcc)占75%-85%的比重。hcc早期症状隐匿但进展迅速,因此极大多数hcc患者在中晚期疾病阶段才被诊断出来,仅20%左右的患者能够手术切,其余无法手术者5年生存率小于18%。索拉菲尼于2007年被批准用于不可切除的hcc一线药物,但其对患者生存预后的改善有限。直至2018年,reflect研究显示:在不可切除hcc患者中,仑伐替尼组的总生存期os非劣效于索拉非尼组,至此仑伐替尼成为了第二个用于不可切除hcc的一线用药,同年于中国上市,打破了分子靶向药物治疗hcc的困境。遗憾的是,由于hcc的高度异质性以及仑伐替尼的原发性或适应性耐药,其单药治疗效果令人唏嘘。因此多数hcc晚期患者无法从仑伐替尼的治疗中获益,总体有效率只有24.1%。所以,探索仑伐替尼的耐药机制和寻找有效的联合治疗靶点对提高仑伐替尼干预hcc治疗效果具有重大意义。
9、冬凌草[rabdosiarubescens(hemsl.)hara],又名破血丹、雪花草、冰凌草,为唇形科香茶菜属植物碎米亚的一种药用植物,其茎、叶可供药用,性味苦、甘,微寒,具有消炎止痛、清热去火、疏通气血,可用于治疗咽喉肿痛、症瘕痞块、蛇虫咬伤等等疾病。冬凌草乙素(ponicidin,pon)是一种烯类二萜,由冬凌草提取而来,研究发现pon在抗肿瘤方面表现出强大的生物活性。冬凌草乙素可有效干预直接肠癌细胞上皮-间充质转化和转移,同时抑制其体内肝转移。联合放疗对肺癌a549细胞凋亡具有协同作用,其机制可能与冬凌草乙素促进mir-16-5p的表达进而抑制wee1表达有关。此外,采用uplc-ms/ms代谢组学和分子对接模拟实验,发现pon可以通过抑制γ-谷氨酰循环和调节sw1990细胞中的多不饱和脂肪酸代谢来诱发铁死亡,进而抑制胰腺癌细胞的增殖,其机制可能为pon直接与gsh共价结合,形成偶联物pon-gsh,从而显著降低细胞中游离gsh和gpx4的含量。
技术实现思路
1、本发明的目的在于提供一种药物组合物及其在制备治疗肝癌的药物中的用途。本发明通过研究冬凌草乙素抑制原发性肝癌的作用及其机制,从而发现冬凌草乙素在逆转肝癌中仑伐替尼耐药性中起作用,仑伐替尼耐药后的细胞对铁死亡抵抗,冬凌草乙素通过能够与keap1结合,削弱nrf2磷酸化来诱导铁死亡从而逆转仑伐替尼耐药,为冬凌草克服仑伐替尼耐药性的临床应用提供实验依据,且冬凌草乙素与仑伐替尼在体内和体外都表出现显著的协同作用。
2、本发明的目的可以通过以下技术方案来实现:
3、本发明的第一个目的在于提供一种药物组合物,所述药物组合物包括含有烯类二萜成分的药物和仑伐替尼。
4、进一步地,所述含有烯类二萜成分的药物选自冬凌草乙素、冬凌草甲素或熊果酸中的一种或多种。
5、上述更进一步地,当含有烯类二萜成分的药物为冬凌草乙素时,其中,所述冬凌草乙素和仑伐替尼的摩尔质量比为1.5~2.5:1,优选为2:1。
6、上述更进一步地,当含有烯类二萜成分的药物为熊果酸时,其中,所述熊果酸和仑伐替尼的摩尔质量比为3.5~4.5:1,优选为4:1。
7、上述更进一步地,当含有烯类二萜成分的药物为冬凌草甲素时,其中,所述冬凌草甲素和仑伐替尼的摩尔质量比为1.5~2.5:1,优选为2:1。
8、本发明的第二个目的在于提供一种药物组合物在制备治疗肝癌的药物中的用途。
9、进一步地,所述药物组合物用于制备抑制肝癌细胞增殖的药物,
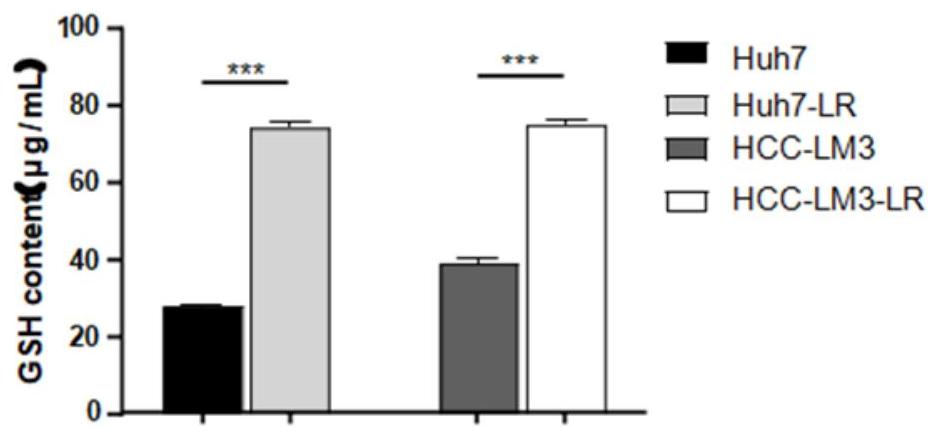
10、所述肝癌细胞选自mhcc-97h、snu449、snu398、huh7、huh7-lr、hcc-lm3、hcc-lm3-lr或hep-g2。
11、上述更进一步地,所述肝癌细胞选自hcc-lm3-lr或huh7-lr。
12、进一步地,所述药物组合物在制备激活铁死亡通路,抑制肝癌细胞的增殖的药物中的用途。
13、进一步地,所述药物组合物在制备降低肝癌细胞gsh水平的药物中的用途。
14、进一步地,所述药物组合物在制备升高肝癌细胞mda水平的药物中的用途。
15、进一步地,所述药物组合物在制备上调肝癌细胞fe2+水平的药物中的用途。
16、进一步地,所述药物组合物在制备上调肝癌细胞ros水平的药物中的用途。
17、与现有技术相比,本发明的有益效果如下所示:
18、本发明通过选择huh7、hcc-lm3细胞为研究对象,构建仑伐替尼耐药株huh7-lr、hcc-lm3-lr。通过检测铁死亡相关指标gsh、mda、ros证明细胞耐药后铁死亡途径被抑制。cck-8实验分析冬凌草乙素对huh7-lr、hcc-lm3-lr细胞增殖的影响;平板克隆形成实验观察冬凌草乙素对huh7-lr、hcc-lm3-lr细胞克隆形成能力的影响;划痕实验和transwell侵袭实验检测冬凌草乙素对肿瘤细胞迁移和侵袭能力的影响。在机制实验中qrt-pcr、westernblot、蛋白质组芯片分析、免疫荧光、免疫共沉淀等实验探索冬凌草乙素如何改善肿瘤耐药。balb/c-nude小鼠尾皮下注射huh7-lr细胞建立仑伐替尼耐药的荷瘤小鼠模型,冬凌草乙素灌胃给药,检测冬凌草乙素和仑伐替尼单用或联用对肝癌耐药小鼠模型的影响。
19、本发明的体外实验表明,肝癌细胞huh7和hcc-lm3产生仑伐替尼耐药后,其铁死亡途径被抑制;冬凌草乙素能阻碍huh7-lr和hcc-lm3-lr细胞的增殖、克隆形成、迁移和侵袭能力。冬凌草乙素和仑伐替尼联用可以通过激活铁死亡通路,显著抑制huh7-lr、hcc-lm3-lr的增殖和逆转耐药。机制的初步探索显示冬凌草乙素能够与keap1结合,使得keap1-nrf2的结合更加稳定,抑制了nrf2的核易位和活化,进而诱导铁死亡,克服了仑伐替尼的耐药性。体内实验中双药联用表现出显著的协同作用,阻碍了肿瘤的生长。
20、综上所述,本发明认为肿瘤耐药的发生与铁死亡抵抗的产生有着密切的关系。并且,冬凌草乙素具备能够诱导铁死亡的天然优势。因此,冬凌草乙素能够通过诱导肝癌耐药细胞铁死亡,从而增强其对仑伐替尼的敏感性,为仑伐替尼耐药的hcc晚期患者获益。通过从细胞生物学、分子生物学及实验动物学水平,证实了冬凌草乙素能够通过影响仑伐替尼耐药的肝癌细胞铁死亡,抑制肝癌耐药细胞的生长,增强了肝癌耐药细胞对仑伐替尼的治疗敏感性,为冬凌草在原发性肝癌的治疗方面提供数据支撑。
- 还没有人留言评论。精彩留言会获得点赞!