一种适用于mRNA肿瘤疫苗筛选的肿瘤移植模型及其构建方法和应用与流程
本发明涉及免疫学,具体涉及一种适用于mrna肿瘤疫苗筛选的肿瘤移植模型及其构建方法和应用。
背景技术:
1、肿瘤相关抗原(在肿瘤细胞以及正常细胞都存在的一类抗原)以及肿瘤特异性抗原(仅表达于某种肿瘤细胞而不在正常细胞表达的一类抗原)是临床前开发抗肿瘤药物的靶点,如mrna肿瘤疫苗、过继性免疫疗法、免疫检查点阻断剂、抗体偶联药物等。抗体偶联药物(antibody drug conjugate,adc)类药物能够靶向并强力抑杀快速增殖的肿瘤细胞,但有时会因稳定性而误伤正常自然增殖的人体细胞(如骨髓细胞、消化道黏膜和毛囊等),有关不良反应常常限制其临床应用。随着免疫学的发展、人类基因组学和对肿瘤发生发展机制研究的不断深入,精准医学和个体化治疗的理念已深入人心并且在临床实践中得以成功验证。在此背景下,mrna肿瘤疫苗的临床前研发以及筛选有待进一步研究和优化。
2、mrna肿瘤疫苗(mrna tumor vaccine)属于核酸疫苗,是旨在靶向肿瘤抗原。这些抗原通常由肿瘤细胞所表达或为肿瘤细胞所特有,释放后被抗原呈递细胞(antigenpresentation cell,apc如树突状细胞、巨噬细胞、b细胞),随后t细胞通过识别肿瘤组织的特异性抗原发挥杀伤作用。但是这种肿瘤抗原表达水平较低,无法激活强有力的免疫反应。而mrna肿瘤疫苗往往是一段编码肿瘤相关抗原或者肿瘤特异性抗原的模板信使rna(mrna),以此为基础完成制备并注射进入体内,被抗原呈递细胞吞噬后,依靠细胞的蛋白质合成系统翻译出特异性蛋白,作为“靶标”,诱导机体产生对“靶标”的免疫应答,进而针对性攻击肿瘤细胞。
3、由于mrna肿瘤疫苗在选取靶抗原、运输载体等方面各有不同,使其结构上存在多样性和复杂性;mrna肿瘤疫苗并不简单地等同于抗体药物和adc类药物,在临床前研发中存在诸多挑战,包括药代动力学(生物分布)的复杂性、肿瘤靶向和疗效的评估等。
4、所以本技术利用人源肿瘤活组织生物样本库和数据库为抗肿瘤药物临床前试验提供足量的、合适的生物样本来源,通过基于样本库和数据库的小鼠临床试验可提前确认真实世界的临床试验的适应症患者入组方案,并基于肿瘤活组织生物样本库和数据库及多种pdtx技术建立一套适用范围广、客观准确的适用于mrna肿瘤疫苗的适应症筛选方法,为肿瘤药物临床前试验提供合适的临床试验前研究模型,可极大程度的缩短临床试验的周期、降低总体费用的同时提高临床试验的成功率。
技术实现思路
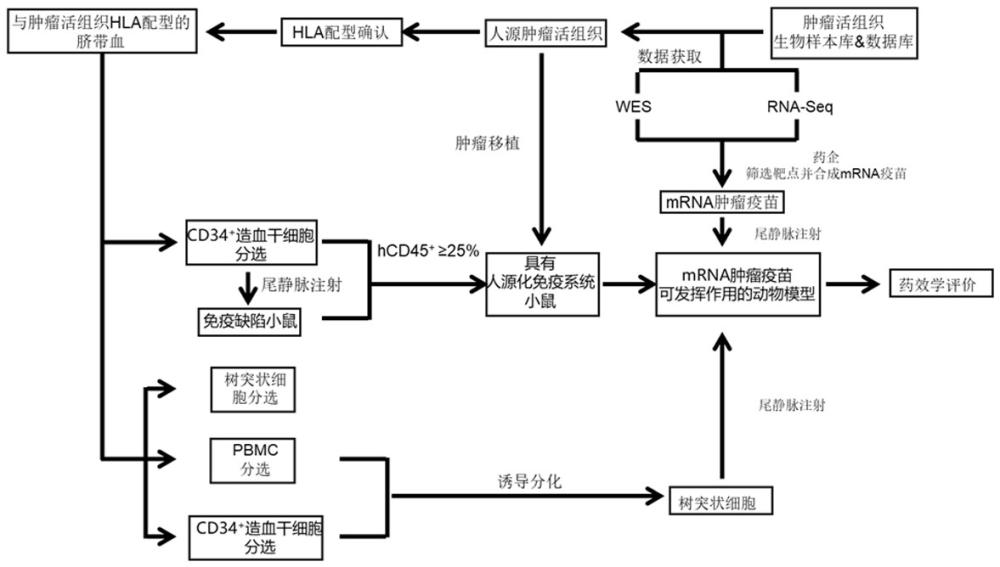
1、解决的技术问题:本发明针对上述技术问题,提供一种适用于mrna肿瘤疫苗筛选的肿瘤移植模型及其构建方法和应用。该模型构建方法不仅利用人源肿瘤活组织生物样本库提供足量的、符合药物作用机制要求的肿瘤活组织样本;此外,还利用人源肿瘤活组织数据库内的wes、rna-seq数据筛选mrna肿瘤疫苗的靶点。同时分析肿瘤活组织内的免疫微环境,降低肿瘤免疫微环境带来的药效影响;更针对mrna肿瘤疫苗作用机制建立具有人源化免疫系统的pdtx动物模型;并且通过引入与动物模型内免疫细胞相同来源的树突状细胞来避免mhc限制性的发生,以此在反应mrna肿瘤疫苗在动物体内真实的疗效。还能通过脐带血与肿瘤活组织的hla配型,延长mrna肿瘤疫苗动物实验的窗口期;最终,该模型通过重建人源化免疫系统以及补充树突状细胞满足mrna肿瘤疫苗的发挥作用的免疫环境。
2、技术方案:一种适用于mrna肿瘤疫苗筛选的肿瘤移植模型的构建方法,步骤为:(1)肿瘤活组织样本筛选:选择通过pdtx技术进行传代后可稳定扩增的活组织并保存在气相液氮存储罐中;(2)数据质量控制:记录pdtx建模获得的接种有肿瘤活组织的免疫缺陷型小鼠模型体内肿瘤组织体积变化及小鼠的体重变化,保留体重减轻不超过20%和肿瘤生长体积不超过2000mm3的小鼠数据;(3)肿瘤活组织的挑选、复苏及传代:在肿瘤活组织生物样本库中选取目标肿瘤活组织进行复苏,记录接种有目标肿瘤活组织的nsg小鼠模型内肿瘤组织体积变化及小鼠的体重变化,当肿瘤体积达到100mm3时,即表示肿瘤组织复苏成功;(4)nsg小鼠的免疫系统重建:获取具有与肿瘤活组织hla分型相匹配的脐带血,将获取的脐带血用磷酸盐缓冲液按照1:3的体积比稀释脐带血,使用微珠试剂盒分离纯化得到cd34+hscs细胞;使用三周龄的nsg小鼠,用功率为100cgy/min的x射线照射3周龄nsg小鼠全身2.4min进行清髓,随后通过尾静脉注射5×105 cells/ml的cd34+ hsc细胞液,然后在尾静脉注射后的第4周开始每隔两周对nsg小鼠进行免疫学指标检测,当nsg小鼠血液中的hcd45+ 大于或等于25%,得到重建免疫系统的nsg小鼠模型;(5)his-pdtx(hla配型)建模:记录接种有复苏成功的肿瘤组织的重建免疫系统的nsg小鼠模型内肿瘤组织体积变化及小鼠的体重变化,当肿瘤体积达到100mm3时,即表示his-pdtx(hla配型)建模成功;(6)小鼠模型中树突状细胞(dendritic cells,dcs)的引入:在体外的情况下,通过以下3种方式中的任一种获取dcs:1、通过磁珠在脐带血中分选dcs细胞;2、从脐带血中分选出单核细胞进而在il-4和gm-csf的刺激下分化为dcs;3、从脐带血中分选出cd34+造血前体干细胞进而在gm-csf、il-4、tnf-α、scf、flt3 ligand的刺激下分化为dcs;随后将成熟的dcs通过尾静脉注射至his-pdtx(hla配型)的动物模型体内,获得适用于mrna肿瘤疫苗筛选的肿瘤移植模型。
3、上述构建方法获得的适用于mrna肿瘤疫苗筛选的肿瘤移植模型。
4、上述模型在mrna肿瘤疫苗筛选中的应用。
5、上述筛选的方法包括药效评估,模式为dasctm,设定入组的药物方案数量、癌种数量、同癌种活组织数量,计算所有试验组所需的pdtx模型数量n,计算公式如下:
6、n=d×c×t×m+a×c×t×m+s×c×t×m
7、根据试验入组癌种数量、同癌种活组织数量,计算所有空白组所需的pdtx模型数量x,计算公式如下:
8、x=c×t×m
9、根据试验入组癌种数量、同癌种活组织数量,计算所需肿瘤活组织生物样本库中的肿瘤活组织数量y,计算公式如下:
10、y=c×t
11、根据试验入组所涉及的mrna肿瘤疫苗的数量、免疫检查点抗体数量,计算pdtx动物模型给药的方案数量s,计算公式如下:
12、s=d×a
13、上述d:mrna肿瘤疫苗的药物方案数量,d为整数,d≥1;a:抗体种类,a为整数,a≥0;s:联合治疗方案的数量=mrna肿瘤疫苗的药物方案数量+免疫检查点抑制剂的数量,s为整数,s≥1;c:癌种数量,c为整数,c≥1;t:同癌种活组织数量,t为整数,t≥1;m:每份活组织建模数量,m为整数,m≥3;每份活组织对应一个具有独立表型信息的个体;所以,药效评估体系所需的pdtx模型数量为n+x,其中每个空白组和药物试验组的模型数量为t×m。
14、上述筛选的方法包括药效评估,方式采用自体比较tgi:在试验组到达预期给药周期时,记录试验组小鼠模型的终点时间肿瘤体积与对应个体的起始时间体积进行差异性比较,计算自身的肿瘤生长抑制率(tumor growth inhibition, tgi);
15、自身tgi计算公式如下:
16、tgi1(%) = (v0 - vt) / v0 ×100%
17、v0:每只小鼠起始给药时测量所得肿瘤体积(单位:mm3),vt:每只小鼠在时刻t时测量时的肿瘤体积(单位:mm3);
18、根据实体瘤疗效评价标准评价每只小鼠肿瘤药效结果mpd、mpr、msd、mcr;当tgi>95%时,判断为mcr;当95%≥tgi>30%时,判断为mpr;当30%≥tgi>-20%时,判断为msd;当tgi≤-20%时,判断为mpd。
19、上述方式为试验组与空白组的组间比较tgi:在试验组到达预期给药周期时,记录试验组小鼠模型的终点时间肿瘤体积与空白组小鼠模型的终点时间肿瘤体积进行差异性比较,计算组间的肿瘤生长抑制率(tumor growth inhibition, tgi);
20、如果空白组与试验组的记录时间周期相同,组间tgi计算公式如下:
21、tgi2 (%) = (1 - rtvt / rtvc) ×100%
22、rtvt = (tt - t0) / t0
23、rtvc = (ct - c0) / c0
24、t0:试验组小鼠起始给药时测量所得肿瘤体积(单位:mm3);tt:试验组小鼠在时刻t时测量时的肿瘤体积(单位:mm3);c0:空白组小鼠起始给药时测量所得肿瘤体积(单位:mm3);ct:空白组小鼠在时刻t时测量时的肿瘤体积(单位:mm3);
25、如果空白组与试验组的记录时间周期不同,组间tgi计算公式如下:
26、tgi2 (%) = (1 -rtvt / rtvc) × 100%
27、rtvt = tt1 / t0 / t1
28、rtvc = ct2 / c0 / t2
29、t1:实际试验组小鼠记录时间周期(单位:day);t2:实际空白组小鼠记录时间周期(单位:day);tt1:试验组t1时刻肿瘤体积(单位:mm3);ct2:空白组t2时刻肿瘤体积(单位:mm3);t0:试验组t0时刻肿瘤体积(单位:mm3);c0:空白组t0时刻肿瘤体积(单位:mm3);根据肿瘤药物pdtx药效检测评估标准,当tgi≥60%时,判断为药效阳性;当tgi<60%时,判断为药效阴性。
30、有益效果:本发明通过肿瘤活组织生物样本库提供足量的、具有mrna肿瘤疫苗靶标抗原的肿瘤活组织样本;同时利用人源肿瘤活组织数据库的wes, rna-seq数据筛选mrna肿瘤疫苗设计的靶点。进而实现了通过分析肿瘤活组织内的免疫微环境,降低肿瘤免疫微环境带来的药效影响;更为重要的是针对mrna肿瘤疫苗作用机制建立具有人源化免疫系统的pdtx动物模型;所构建动物模型内抗原呈递细胞与t细胞表面的tcr的相互识别避免了mhc限制性,更能呈现mrna肿瘤疫苗的疗效;通过脐带血与肿瘤活组织的hla配型,延长mrna肿瘤疫苗动物实验的窗口期;所构建的动物模型通过重建人源化免疫系统以及补充树突状细胞满足mrna肿瘤疫苗的发挥作用的免疫环境,同时,丰富了树突状细胞的获取渠道,使其能够通过脐带血分离、pbmc诱导、cd34+造血干细胞等多种方式获取。
- 还没有人留言评论。精彩留言会获得点赞!