一种用于分离循环肿瘤细胞的磁性纳米短纤维的制备方法与流程
本发明属于细胞分选领域,特别涉及一种用于分离循环肿瘤细胞的磁性纳米短纤维的制备方法。
背景技术:
循环肿瘤细胞(circulatingtumorcells,ctcs)是指从原发灶实体瘤上脱落进入血液循环系统的癌细胞。研究表明,ctcs与癌症的转移和复发密切相关,且癌症病人外周血中ctcs的数量与癌症的分期密切相关,还可以反映癌症的治疗效果。检测和分析ctcs对于癌症的早期诊断、疗效评估、预后判断和个体化治疗具有极其重要的意义。但是血液中ctcs数目极少,每毫升血液中的血细胞超过109个,而ctcs只有几个到几百个,因此采用常规手段难以实现ctcs的捕获和分离。
目前,针对ctcs的捕获和分离的方法主要有基于细胞尺寸差异的过滤分离方法、密度梯度离心法、磁分离技术、电化学分选、微流控技术以及基于各种纳米基底的免疫识别分离方法。其中,细胞磁分离技术一般是通过表面连接有靶向配体的磁性材料与含有靶细胞的细胞悬液共同孵育一段时间,然后利用外部磁场分离出靶细胞的方法。该方法可以在几分钟内从复杂的细胞混合物中分离出目标细胞,简便、快速实现目标细胞的分离和纯化,因而在基础科学研究和临床应用中得到广泛关注。但是,常见的ctcs磁分离方法大多只用于ctcs的捕获和分离,分离出的ctcs被磁性材料紧密包覆,不利于后续对ctcs的检测和分析。例如,被fda认证的cellsearch系统就是采用免疫磁珠磁分离的方法实现ctcs分选,该系统仅能用于ctcs的计数,无法实现活细胞的捕获,并进行后续基因检测和用药指导。
静电纺纳米纤维具有比表面积大、生物相容性好、可模拟天然细胞外基质以及易于制备和表面功能化修饰等优点,因而可在纳米纤维表面修饰靶向配体用于癌细胞的特异性捕获。聚乙烯亚胺/聚乙烯醇(pei/pva)静电纺纳米纤维是一种以水为溶剂的绿色纳米纤维,且pei/pva纳米纤维表面带有大量的氨基和羟基便于后续的功能化修饰,可将靶向配体修饰在纳米纤维表面用于癌细胞的特异性捕获。
dna适配体是一类能够特异性地和细胞膜表面受体结合的单链寡核苷酸序列,其亲和力与抗体相当甚至更强。由于dna适配体本身的负电性,使其很少参与细胞的非特异性相互作用,因而具有较高的靶向特异性。同时,dna适配体具有良好的生物相容性、稳定性、可体外合成和易于修饰等诸多优点,因而可以利用dna核酸适配体作为靶向配体,用于ctcs的捕获和分离。此外,还可以通过dna互补序列或者核酸酶的作用,切断dna适配体与捕获癌细胞的靶向结合作用,实现捕获细胞的快速、无损释放。因此,dna适配体可以作为一种理想的ctcs捕获靶向配体。
检索国内外有关磁性纳米短纤维制备的文献和专利结果表明,利用静电纺丝和均质技术制备磁性纳米短纤维及其表面修饰dna适配体用于循环肿瘤细胞分选应用的研究尚未见相关报道。
技术实现要素:
本发明所要解决的技术问题是提供一种用于分离循环肿瘤细胞的磁性纳米短纤维的制备方法,该方法制备得到的磁性纳米短纤维不仅可以实现ctcs的高效捕获,而且能够快速、无损释放捕获的癌细胞。
本发明提供了一种用于分离循环肿瘤细胞的磁性纳米短纤维的制备方法,包括:
(1)通过一步水热合成法,合成外部包裹聚乙烯亚胺pei的磁性四氧化三铁纳米颗粒fe3o4@pei;将fe3o4@pei加入到pei/pva纺丝液中,搅拌得到fe3o4@pei/pva混合纺丝液,通过静电纺丝得到fe3o4@pei/pva复合纳米纤维膜,最后进行交联;
(2)将交联后的fe3o4@pei/pva复合纳米纤维膜浸泡在聚乙烯醇溶液中进行均质,经过后处理得到fe3o4@pei/pva磁性纳米短纤维;
(3)将fe3o4@pei/pva磁性纳米短纤维分散于二甲基亚砜dmso中,加入3-马来酰亚胺基丙酸(n-羟基琥珀酰亚胺)酯nhs-mal,以三乙胺作为催化剂,室温条件下反应;将产物重分散于超纯水中,以三(2-羧乙基)膦tcep作为催化剂和还原剂,加入dna适配体水溶液,室温搅拌反应,最后经过磁分离、水洗,得到用于分离循环肿瘤细胞的磁性纳米短纤维fe3o4@pei/pva-aptamer。
所述步骤(1)中的fe3o4@pei和pei/pva的质量比为1~3:20;其中,pei与pva的质量比为1:2~4。
所述步骤(1)中的静电纺丝的工艺条件为:纺丝电压20~25kv,注射泵流速为0.2~0.4ml/h,接收距离为20~25cm,环境温度22~24℃,湿度45~50%。
所述步骤(3)中的fe3o4@pei/pva磁性纳米短纤维与dmso的质量体积比为5:1~5:2mg/ml。
所述步骤(3)中的fe3o4@pei/pva磁性纳米短纤维与nhs-mal的质量比为50~150:1。
所述步骤(3)中的三乙胺与nhs-mal的摩尔比为1~1.2:1。
所述步骤(3)中的tcep与dna适配体的摩尔比为1:1~2。
所述步骤(3)中的dna适配体水溶液的浓度为5~20μm。
所述步骤(3)中得到的fe3o4@pei/pva-aptamer用于ctcs分选,包括癌细胞的捕获和释放。
本发明结合静电纺纳米纤维和磁分离技术,通过均质处理获得磁性纳米短纤维,表面修饰dna适配体作为靶向分子用于癌细胞的捕获,通过引入核酸酶分解dna适配体,实现捕获癌细胞的高效、无损释放。
有益效果
(1)本发明中主体材料为纳米纤维和磁性氧化铁纳米颗粒,材料加工工艺简单,成本低廉,具有产业化实施的前景;
(2)本发明以高特异性、高亲和力的dna适配体作为靶向分子用于癌细胞的捕获,可以实现癌细胞的高效、高特异性捕获;相比于包埋取向纳米纤维膜的微流控芯片,本发明采用的磁分离方法更简单,并且可以快速实现捕获细胞的分离(通过外加磁场1min内即可分离出捕获的癌细胞);
(3)本发明通过引入核酸酶分解dna适配体,实现捕获癌细胞的快速、无损释放,便于后续对ctcs的检测分析;
(4)本发明将静电纺纳米纤维和磁分离技术相结合,与商业化磁珠相比,本发明中制备功能化磁性纳米短纤维不仅可以实现ctcs的高效捕获,而且能够快速、无损释放捕获的癌细胞,在循环肿瘤细胞的分离和检测分析方面具有广阔的应用前景。
附图说明
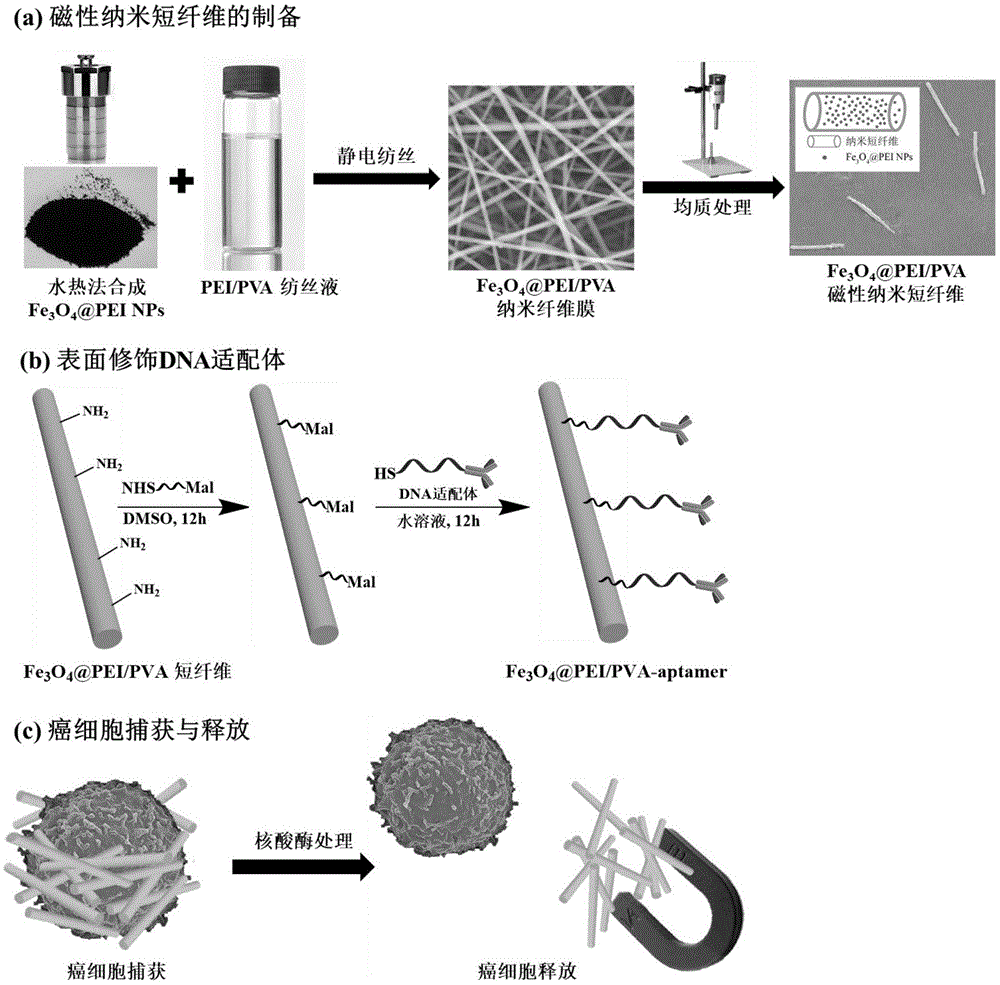
图1为本发明中磁性纳米短纤维的制备、表面修饰及其用于癌细胞捕获和释放示意图,其中(a)为磁性纳米短纤维的制备示意图,(b)为磁性纳米短纤维表面修饰示意图,(c)为磁性纳米短纤维用于癌细胞捕获和释放示意图;
图2为本发明中fe3o4@pei纳米颗粒和fe3o4@pei磁性纳米短纤维的透射电子显微镜(sem)照片和粒径分布直方图,其中(a)为fe3o4@pei纳米颗粒的tem图,(b)为fe3o4@pei纳米颗粒的粒径分布直方图,(c)为fe3o4@pei纳米颗粒的高分辨tem图,(d)为fe3o4@pei磁性纳米短纤维的tem图;
图3为本发明中fe3o4@pei/pva纳米纤维膜和fe3o4@pei/pva磁性纳米短纤维的扫描电子显微镜照片,其中(a)为fe3o4@pei/pva纳米纤维膜的sem图,(b)为fe3o4@pei/pva磁性纳米短纤维的sem图;
图4为本发明中fe3o4@pei纳米颗粒和fe3o4@pei/pva纳米短纤维的磁性表征测试结果,其中(a)为通过振动样品磁强计在室温(26.8℃)下获得的fe3o4@pei纳米颗粒和fe3o4@pei/pva纳米短纤维的磁滞曲线,(b)为分散在去离子水中的fe3o4@pei/pva纳米短纤维在外部磁场作用30s前后的数码照片;
图5为本发明中fe3o4@pei/pva磁性纳米短纤维修饰前后的红外光谱图和热重分析图,其中(a)为红外光谱图,(b)为热重分析图;
图6为本发明中功能化磁性纳米短纤维对mcf-7癌细胞的捕获效果,其中(a)为不同孵育时间下磁性纳米短纤维对mcf-7的捕获效率,(b)为磁性纳米短纤维捕获癌细胞后的磁分离照片,(c)为不同浓度的磁性纳米短纤维对癌细胞的捕获效率,(d)为磁性纳米短纤维对掺入血液样品中的不同数量癌细胞的捕获效率;
图7为本发明中经核酸酶处理后磁性纳米短纤维对捕获癌细胞的释放效果和释放后癌细胞的活性评价,其中(a)为核酸酶处理不同时间后的释放效率,(b)为核酸酶处理不同时间后释放癌细胞的活性测试,(c)为释放后癌细胞再培养不同时间点的相差显微镜照片;
图8为本发明中功能化磁性纳米短纤维与商业化磁珠对癌细胞的捕获效率和释放效果对比分析,其中(a)为不同孵育时间下功能化磁性纳米短纤维与商业化磁珠对mcf-7细胞的捕获效率对比图,(b)为核酸酶处理不同时间后功能化磁性纳米短纤维与商业化磁珠对mcf-7细胞的释放效率对比图,(c)为功能化磁性纳米短纤维与商业化磁珠对mcf-7细胞捕获和释放后细胞的sem图。
图9为本发明对比例中商业化磁珠修饰前后的sem图和dna适配体的紫外-可见光分光光度计测试结果,其中(a)为商业化磁珠修饰前的sem图,(b)为商业化磁珠修饰后的sem图,(c)为dna适配体的紫外吸收曲线,(d)为dna适配体的浓度-吸光度拟合直线。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
实施例1
(1)依据已授权专利的技术方案(专利号:zl201210277624.9):将0.5gfecl2·4h2o溶解在25.5ml超纯水中,剧烈搅拌条件下加入2.5ml氨水nh3·h2o,继续在空气中磁力搅拌10min,然后在搅拌条件下加入10ml含有0.1g聚乙烯亚胺pei的水溶液得到混合溶液,随后将混合液移入50ml高压反应釜中,134℃保持3h,随后取出反应釜,冷却至室温。收集反应后的黑色沉淀,利用磁分离的方法水洗5次,每次水洗用40ml超纯水,除去多余的试剂和副产物,冷冻干燥后得到pei稳定的磁性四氧化三铁纳米颗粒fe3o4@pei。
(2)将0.5g聚乙烯亚胺(pei)和1.5g聚乙烯醇(pva)加入18g去离子水中,90℃下磁力搅拌4h,得到质量分数为10wt%的pei/pva纺丝液,随后取200mg步骤(1)中得到的fe3o4@pei加入纺丝液中,剧烈搅拌2-3天,保证fe3o4@pei在纺丝液中均匀分散,得到fe3o4@pei/pva混合纺丝液。之后进行静电纺丝,真空干燥24h后,得到fe3o4@pei/pva复合纳米纤维膜;所述静电纺丝的条件为:纺丝电压23.5kv,注射泵流速为0.3ml/h,接收距离为20cm,环境温度24℃,湿度45%;将得到的fe3o4@pei/pva纳米纤维膜,放入真空干燥器中进行戊二醛蒸汽交联处理18h,得到交联处理后的fe3o4@pei/pva纳米纤维膜。
(3)参照已申请专利的技术方案(申请号:201710121150.1):将步骤(2)得到的fe3o4@pei/pva纳米纤维膜在水中浸泡5-10min后,从铝箔纸上揭下,并剪成面积大约为1cm2的正方形碎片,然后浸泡在质量分数为0.25wt%的聚乙烯醇溶液中,之后利用均质机在转速为16800rpm条件下均质80min;均质完成后,对均质后的溶液进行离心处理,1000rpm离心1min,弃沉淀,此时沉淀多为未均质分散的纤维碎片;接着在转速为4500rpm条件下对上层溶液离心1min,收集沉淀,此时沉淀主要为目标产物fe3o4@pei/pva纳米短纤维;随后将得到的沉淀分散于超纯水中、磁分离,再次分散、磁分离,如此重复五次,以去除纤维表面少量的pva分散剂,冷冻干燥后得到fe3o4@pei/pva磁性纳米短纤维,如图1(a)所示。
(4)取50mg步骤(3)得到的fe3o4@pei/pva磁性纳米短纤维分散于10ml二甲基亚砜(dmso)中,然后加入5ml含有675μg3-马来酰亚胺基丙酸(n-羟基琥珀酰亚胺)酯(nhs-mal)的dmso溶液,搅拌条件下加入17.6μl三乙胺作为催化剂,室温条件下搅拌12h;反应完成后,磁分离、超纯水分散水洗3次,除去过量的反应试剂;随后将短纤维重分散于10ml超纯水中,加入50μg三(2-羧乙基)膦作为催化剂和还原剂,随后加入5ml浓度为15μm的dna适配体水溶液,室温搅拌反应12h;反应完成后,磁分离、水洗3次,得到dna适配体功能化的磁性纳米短纤维fe3o4@pei/pva-aptamer,即用于分离循环肿瘤细胞的磁性纳米短纤维,如图1(b)所示。
实施例2
本发明以透射电子显微镜(tem)、扫描电子显微镜(sem)、衰减全反射-傅里叶变换红外光谱(atr-ftir)、热重(tg)、紫外-可见光分光光度计、振动样品磁强计(vsm)以及癌细胞的捕获和释放试验表征本发明中制备的功能化磁性纳米短纤维的各项性能及其在循环肿瘤细胞分选中的应用潜能。
透射电子显微镜测试:
通过tem测试表征实施例1步骤(1)中得到的fe3o4@pei纳米颗粒和实施例1步骤(3)中得到的fe3o4@pei/pva磁性纳米短纤维的尺寸和结构,结果如图2所示,通过一步水热法制备的fe3o4@pei颗粒为圆形或者近似圆形,纳米颗粒分散性良好、尺寸均一,平均尺寸在22.6nm,由高分辨tem可以看出,fe3o4@pei呈现核壳结构,内核fe3o4的晶面间距为
扫描电子显微镜测试:
通过sem表征实施例1步骤(2)中得到的fe3o4@pei/pva纳米纤维膜和实施例1步骤(3)中得到的fe3o4@pei/pva磁性纳米短纤维的形貌和尺寸,sem结果如图3所示,fe3o4@pei/pva纳米纤维表面光滑、形貌均匀,纤维直径在350nm左右(参考图3a);均质处理后得到的fe3o4@pei/pva磁性纳米短纤维的平均长度为9.6μm(参考图3b)。
样品磁性测试:
利用振动样品磁强计(vsm)对实施例1步骤(1)中fe3o4@pei纳米颗粒和实施例1步骤(3)中得到的fe3o4@pei/pva纳米短纤维的磁性和磁响应能力进行表征,vsm测试结果如图4a所示,fe3o4@pei纳米颗粒的饱和磁化强度为21.5emug-1,fe3o4@pei/pva纳米短纤维的饱和磁化强度为12.3emug-1;同时可以看出,在外加磁场处理30s时就可以实现fe3o4@pei/pva纳米短纤维的磁分离,说明制备的磁性纳米短纤维具有快速的磁响应能力(参考图4b)。
衰减全反射-傅里叶变换红外光谱测试:
通过atr-ftir对实施例1步骤(3)中得到的fe3o4@pei/pva磁性纳米短纤维和实施例1步骤(4)中得到的dna适配体功能化的fe3o4@pei/pva-aptamer磁性纳米短纤维进行测试,atr-ftir测试结果如图5a所示,与修饰前的fe3o4@pei/pva磁性纳米短纤维相比,fe3o4@pei/pva-aptamer的红外曲线在1710、1260和1066cm-1处出现了属于dna适配体的p-o和p=o基团的红外吸收峰,表明dna适配体成功修饰在纳米纤维表面。
热重测试:
通过tga检测实施例1步骤(4)中得到的dna适配体功能化的fe3o4@pei/pva-aptamer磁性纳米短纤维中dna适配体的质量百分比,tga测试结果如图5b所示,在100℃~900℃fe3o4@pei/pva磁性纳米短纤维的质量损失为82.1%,fe3o4@pei/pva-aptamer磁性纳米短纤维的质量损失为76.9%,进而可以通过计算得出修饰到fe3o4@pei/pva磁性纳米短纤维上的dna适配体所占质量百分比为5.2wt.%。
实施例3
癌细胞捕获试验测试:
采用实施例1步骤(4)中得到的磁性纳米短纤维fe3o4@pei/pva-aptamer研究功能化磁性纳米短纤维对癌细胞的捕获和分离效果。首先,研究不同孵育时间对癌细胞捕获效率的影响。将500μl含有4',6-二脒基-2-苯基吲哚(dapi)预先染色标记的人乳腺癌mcf-7细胞的磷酸盐缓冲溶液(pbs)与1mg的fe3o4@pei/pva-aptamer在500μl离心管中充分共混,得到mcf-7细胞浓度为105/ml,fe3o4@pei/pva-aptamer的浓度为2mg/ml的混悬液,随后将离心管置于转速为165rpm的恒温摇床中,37℃条件下保持不同时间(10,20,30,45,60,90min);之后,取出离心管,在离心管底部通过外加磁场处理1min,吸取上清液,离心管底部磁分离的沉淀物用500μl新鲜的pbs溶液清洗一次,重复上述磁分离过程,分别收集上清液和磁分离沉淀物,然后将底部磁分离的沉淀物重悬浮于100μl的pbs溶液中;利用倒置荧光显微镜对捕获分离出的癌细胞进行计数,每次取出5μl细胞悬液,涂抹于载玻片上,显微镜下计数,重复3次取平均值;上清液中未被捕获的细胞用同样的方法进行计数,随后计算癌细胞的捕获效率。
不同孵育时间下磁性纳米短纤维对癌细胞的捕获效率测试结果如图6a所示:随着共同孵育时间延长,磁性纳米短纤维对癌细胞的捕获效率逐渐增大,孵育时间超过60min后,捕获效率不再提高,在共同孵育60min时捕获效率可以达到87%,同时由图6b可以看出,捕获后的癌细胞可以在1min内完全实现磁分离,说明实施例1中制备的功能化磁性纳米短纤维可以实现目标癌细胞的高效捕获和快速磁分离。
随后,研究不同浓度的磁性纳米短纤维对癌细胞的捕获效率。将500μlpbs重悬浮的mcf-7细胞与不同质量(0.125mg,0.25mg,0.5mg,1mg,2mg)fe3o4@pei/pva-aptamer在500μl离心管中充分共混,mcf-7细胞经dapi预先染色,便于后续观察计数,mcf-7细胞浓度为105/ml;随后将离心管置于恒温摇床中,37℃条件下保持60min;之后,采用与上述操作相同的步骤进行磁分离、pbs洗涤、显微镜计数,计算捕获效率;
不同浓度的磁性纳米短纤维对癌细胞捕获效率的测试结果如图6c所示:在短纤维浓度超过1mg/ml时,磁性纳米短纤维对癌细胞的捕获效率不再增加,因此磁性纳米短纤维的浓度应以1mg/ml为宜。
在上述实验的基础上,模拟癌症患者血液样品,研究功能化磁性纳米短纤维对不同数量癌细胞在血液样品中的捕获效率。首先将不同数量经dapi预先染色的mcf-7细胞掺入到裂解红细胞后的健康志愿者血液当中,得到mcf-7细胞浓度依次为10/ml,20/ml,50/ml,100/ml,200/ml的混合细胞悬液;之后取500μl混合细胞悬液,并加入0.5mgfe3o4@pei/pva-aptamer在500μl离心管中充分共混,随后将离心管置于恒温摇床中,37℃条件下保持60min;之后,采用与上述操作相同的步骤进行磁分离、pbs洗涤、显微镜计数,计算捕获效率;
功能化磁性纳米短纤维对不同数量癌细胞在血液样品中的捕获效率测试结果如图6(d)所示:fe3o4@pei/pva-aptamer对在血液样品中的少量癌细胞仍具有较好的捕获效率,通过线性拟合结果可知,功能化磁性纳米短纤维对低浓度癌细胞(10~200/ml)的捕获效率仍可以达到78.8%,这与商业化cellsearch系统的捕获效率相当。
实施例4
癌细胞释放试验测试:
在完成癌细胞捕获和磁分离以后,向磁分离的沉淀物中加入浓度为25u/ml的
核酸酶处理不同时间后的释放效率测试结果如图7a所示,核酸酶处理20min后,癌细胞释放效率就可以达到90%以上,说明通过核酸酶处理可以实现捕获癌细胞的快速释放。
为了探究释放细胞的活性,采用未经dapi预先染色的mcf-7癌细胞与0.5mg的fe3o4@pei/pva-aptamer在500μl离心管中充分共混,得到mcf-7细胞浓度为105/ml与fe3o4@pei/pva-aptamer的浓度为1mg/ml的混悬液,之后采用相同的操作完成癌细胞捕获、磁分离和癌细胞释放过程,吸取磁分离后的上层细胞悬液,并进行活死细胞染色,向上层细胞悬液中加入5μl浓度为8μm的碘化丙啶pi溶液和5μl浓度为2μm的钙黄绿素am溶液,室温下染色20min,离心处理去除染色液,随后用荧光显微镜观察并统计活(绿色)死(红色)细胞的数目,进而计算出不同处理时间后释放癌细胞的活性;此外,将释放后的癌细胞转移至含有10%胎牛血清完全培养基的培养皿中,置于37℃,5%二氧化碳培养箱中进行再培养,不同培养时间(12h,24h,48h)后,取出培养皿,相差显微镜下拍照并观察癌细胞在培养后的细胞形貌和状态。
核酸酶处理不同时间后释放的癌细胞活性测试结果如图7b所示,核酸酶处理20min后释放的癌细胞活性仍可以达到86%,说明核酸酶处理不会损伤癌细胞活性,可以实现捕获癌细胞的无损释放;释放癌细胞的再培养情况测试结果如图7c所示,释放后的癌细胞能够快速黏附和增殖,说明释放的癌细胞具有较高的活性,能够再次培养和增殖。
实施例5
为了进一步说明本发明中功能化磁性纳米短纤维对癌细胞的捕获和释放性能,将本发明中实施例1中制得的功能化磁性纳米短纤维与对比例1制得的功能化磁珠对癌细胞的捕获效率和释放效果进行了对比分析,以相同浓度的功能化短纤维和磁珠分别与mcf-7细胞悬液共同孵育一段时间(10,20,30,45,60,90min),之后磁分离、计数、计算捕获效率,对比不同孵育时间下功能化磁性纳米短纤维与商业化磁珠对mcf-7细胞的捕获效率;另外,完成捕获和磁分离以后,通过核酸酶对磁分离沉淀物处理不同时间(10min,20min,30min,45min,60min),之后取出离心管,再次磁分离处理,吸取上层溶液,然后利用倒置荧光显微镜分别对上层溶液中释放下来的癌细胞和磁分离沉淀物中未释放的癌细胞进行计数,计算癌细胞的释放效率,对比两种材料对mcf-7细胞的释放效率;
不同孵育时间下功能化磁性纳米短纤维与商业化磁珠对mcf-7细胞的捕获效率对比结果如图8a所示,在与癌细胞共同孵育60min时,短纤维的捕获效率为87%,磁珠捕获效率为91%,说明本发明中制备的功能化磁性纳米短纤维具有与商业化磁珠相当的癌细胞捕获能力;核酸酶处理不同时间后功能化磁性纳米短纤维与商业化磁珠对mcf-7细胞的释放效率如图8b所示,在核酸酶处理不同时间后,磁性纳米短纤维对癌细胞的释放效率明显优于商业化磁珠对癌细胞的释放效果。
实施例6
通过sem观察功能化磁性纳米短纤维和磁珠与mcf-7细胞捕获和释放前后的结合情况,向捕获癌细胞后的磁分离沉淀中加入2.5~3%的戊二醛溶液,置于4℃冰箱中保持2.5~3h,固定细胞形态;对于释放后的癌细胞悬液,需要2000rpm离心5min,弃上清,然后加入2.5~3%的戊二醛溶液,置于4℃保持3h;之后,缓慢吸弃戊二醛溶液,依次用浓度为30%,50%,70%,80%,90%,95%的乙醇溶液浸泡细胞10min进行梯度脱水处理,然后用100%乙醇浸泡三次,每次15min;将100%乙醇分散的样品均匀涂抹在铝箔纸上,室温下自然晾干;之后sem制样、喷金、上机观察和拍照;
功能化磁性纳米短纤维与商业化磁珠对mcf-7细胞捕获和释放前后的sem图如图8c所示,商业化磁珠捕获的癌细胞表面有大量磁珠多层包覆,磁性纳米纤维由于具有较好的柔韧性和形变能力也可以紧密缠绕在癌细胞表面,因此两者都具有良好的癌细胞捕获能力;但是商业化磁珠释放后的癌细胞表面仍有少量的磁珠粘附或者嵌入,而磁性纳米短纤维释放后的癌细胞表面不存在材料粘附的情况,因而利用磁性纳米短纤维分离ctcs将更有利于对细胞进行后续的检测和分析。
对比例1
本对比例提供了一种商业化磁珠表面修饰dna适配体的制备方法:首先,对表面氨基化磁珠(mb-nh2)进行磁分离、dmso洗涤3次,之后将mb-nh2重新分散于10ml的dmso中,磁珠浓度为5mg/ml,加入5ml含有675μgnhs-mal的dmso溶液,搅拌条件下加入17.6μl三乙胺作为催化剂,室温条件下搅拌12h;反应完成后,磁分离、超纯水分散水洗3次,除去过量的反应试剂;随后将磁珠重分散于10ml超纯水中,加入50μg三(2-羧乙基)膦作为催化剂和还原剂,加入5ml浓度为15μm的dna适配体水溶液,室温搅拌反应12h;反应完成后,磁分离、水洗3次,得到dna适配体功能化的磁珠mb-aptamer。
通过sem和紫外-可见光分光光度计测试表征商业化磁珠修饰前后的形貌变化和dna适配体的负载量,sem测试结果如图9a-b所示,修饰前的磁珠表面光滑、尺寸均一、分散性较好,平均粒径为2μm,经dna适配体修饰后,磁珠的结构和形貌无明显变化,仍具有良好的分散性,说明dna适配体修饰不影响磁珠的形貌和分散性;dna适配体的紫外吸收曲线和浓度-吸光度拟合直线如图9c-d所示,260nm处为dna适配体的特征紫外吸收峰,通过测定系列浓度dna适配体在260nm处的吸光值,可以拟合出dna适配体的浓度-吸光度方程,从而换算出反应后上清液中dna适配体的浓度;对比例1中反应前dna适配体浓度为10μm,反应后上清液中dna适配体的浓度为1.75μm,从而可以计算出磁珠表面dna适配体的上载率为82.5%,磁珠表面dna适配体的负载量为37.2μg/mg;实施例1步骤(4)中,反应前dna适配体浓度为10μm,反应后上清液中dna适配体的浓度为1.53μm,可以计算出磁性纳米短纤维表面dna适配体的上载率为84.7%,磁性纳米短纤维表面dna适配体的负载量为38.2μg/mg。
- 还没有人留言评论。精彩留言会获得点赞!