锂的萃取方法与流程
1.本发明涉及锂提取技术领域,特别是涉及锂的萃取方法。
背景技术:
2.目前,锂资源主要来源于盐湖和矿物,随着近年来废弃资源再利用的推进,废旧锂电池也成为锂资源的重要来源。从这些原料中获取锂资源的方法主要有沉淀法、萃取法和吸附法等。其中,萃取法作为获取锂资源的新技术,是利用有机溶剂对锂的特殊萃取性能达到的提锂目的,主要包括萃取和反萃两个步骤。
3.传统的反萃步骤中,主要使用工业盐酸作为反萃取剂,而工业盐酸的质量百分数一般为31%-33%,所以,反萃得到的反萃液中的锂离子的浓度约为70g/l左右,进而在结晶过程中需要蒸发大量的水,能耗较高。
技术实现要素:
4.基于此,有必要针对上述问题,提供一种锂的萃取方法,该萃取方法能耗低,锂的收率高。
5.一种锂的萃取方法,包括:
6.提供负载锂的有机相;
7.将所述负载锂的有机相、氯化氢气体以及水混合,进行反萃和分相,得到含氯化锂的反萃液;以及
8.从所述反萃液中分离得到含锂化合物。
9.在其中一个实施例中,所述氯化氢气体通过以下方法制备得到:
10.将氯化钠溶解于水中得到氯化钠溶液;
11.将所述氯化钠溶液经电解得到氢氧化钠、氯气和氢气;以及
12.将所述氯气和氢气反应得到所述氯化氢气体。
13.在其中一个实施例中,在将所述负载锂的有机相、所述氯化氢气体以及所述水混合的步骤中,以所述负载锂的有机相中的锂离子的摩尔比计,每1mol所述锂离子通入1mol-2mol的所述氯化氢气体。
14.在其中一个实施例中,在通入所述氯化氢气体时,压力小于或等于2mpa,温度为-30℃至50℃;所述氯化氢气体与所述水的体积比为4:1-15:1。
15.在其中一个实施例中,所述从所述反萃液中分离得到含锂化合物的步骤包括:将所述反萃液与碳酸钠混合,得到含锂化合物,所述含锂化合物为碳酸锂。
16.在其中一个实施例中,在将所述反萃液与碳酸钠混合时,温度为70℃-90℃。
17.在其中一个实施例中,所述从所述反萃液中分离得到含锂化合物的步骤包括:将二氧化碳、所述反萃液和所述氢氧化钠混合,并进行加热反应得到含锂化合物,其中所述加热反应的温度为50℃-100℃,所述含锂化合物为碳酸锂。
18.在其中一个实施例中,所述将所述反萃液、所述氢氧化钠和所述二氧化碳混合并
进行加热反应时,还得到新生成的二氧化碳。
19.在其中一个实施例中,所述新生成的二氧化碳循环用于与所述反萃液、所述氢氧化钠混合并进行所述加热反应。
20.在其中一个实施例中,在所述从所述反萃液中分离得到所述含锂化合物的步骤中,还得到氯化钠。
21.在其中一个实施例中,所述氯化钠循环利用,用于制备所述氯化氢气体。
22.在其中一个实施例中,所述从所述反萃液中分离得到含锂化合物的步骤包括:将所述反萃液的温度控制在20℃-50℃,对所述反萃液进行降温,得到所述含锂化合物,其中所述降温的温差为10℃-40℃,所述含锂化合物为氯化锂。
23.在其中一个实施例中,所述负载锂的有机相的制备方法包括:
24.提供含锂溶液;
25.将所述含锂溶液与萃取液混合,进行萃取和分相,得到所述负载锂的有机相。
26.在其中一个实施例中,所述含锂溶液中还包括有镁离子、钙离子中的至少一种,
27.在将所述含锂溶液与所述萃取液混合的步骤之前,还将所述含锂溶液与碱性物质混合,得到沉淀物。
28.在其中一个实施例中,所述碱性物质包括所述氢氧化钠。
29.在其中一个实施例中,所述得到沉淀物之后,还包括将所述沉淀物与所述氯化氢气体以及水混合,反应得到混合液。
30.在其中一个实施例中,所述萃取液与所述含锂溶液的体积比为4:1-1:4,所述萃取的次数大于或等于1,每次萃取的时间为1分钟-10分钟。
31.在其中一个实施例中,所述萃取液包括萃取剂和稀释剂,所述萃取剂为疏水型液体,包括三氧噻吩氧化物、1,1,1-三氟-5,5-二甲基-2,4-己二酮、1,1,1,2,2-五氟-6,6二甲基-3,5-庚二酮、1,1,1,2,2,3,3-七氟-7,7-二甲基-4,6-辛二酮、苯甲酰三氟丙酮、1-苯基-1,3-丁二酮、1-苯甲酰-2-壬酮、三烷基磷酸酯、三烷基氧化膦、三辛基氧化膦、三己基氧化膦、二烷基磷酸酯、甲基异丁基甲酮、1-苯基偶氮-2-萘酚、正辛醇、异辛醇、2-乙基己醇、14-冠-4醚丁基膦酸二丁酯、二丁基磷酸丁酯、甲撑四丁基双磷酸酯、三辛基氧化胺、1,10-菲罗啉、季铵盐n
263
、二甲基二(n-十八烷基)氯化铵、氯化甲基二辛基锍盐、1-羟基乙基-3-甲基咪唑双(三氟甲基磺酰基)酰亚胺中至少一种。
32.在其中一个实施例中,从所述反萃液中分离得到所述含锂化合物后,还得到沉锂母液,所述沉锂母液循环并与所述含锂溶液混合。
33.在其中一个实施例中,在将所述负载锂的有机相、氯化氢气体以及水混合,进行反萃和分相,得到含氯化锂的反萃液的步骤中,还得到空载萃取液;
34.所述空载萃取液循环利用,用于与所述萃取液混合,进行萃取和分相,得到所述负载锂的有机相;
35.和/或,在将所述负载锂的有机相、氯化氢气体以及水混合,进行反萃和分相,得到含氯化锂的反萃液的步骤中,部分所述反萃液继续循环,与所述负载锂的有机相、所述氯化氢气体以及所述水混合,进行反萃和分相。
36.本发明锂的萃取方法中,使用氯化氢气体与水的组合作为反萃取剂,在反萃的过程中,制酸和反萃同时进行,使得氯化氢气体和盐酸共存,以使氯化氢气体不断转化为盐酸
补充已经反应掉的盐酸,所以,可以有效提高负载锂的有机相、氯化氢气体以及水混合得到的反萃体系中的氯化氢的浓度,从而使得到的反萃液中的锂离子的浓度提高至96g/l左右,进而有效提高了锂的收率,同时降低了结晶过程中所需要的能耗。
附图说明
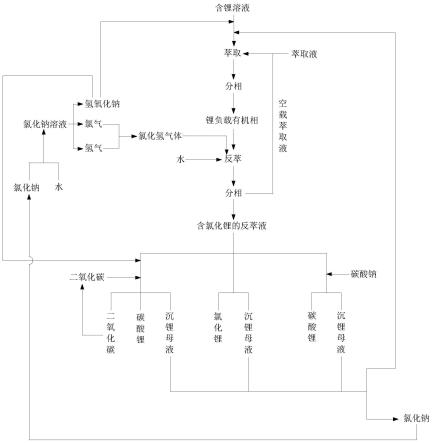
37.图1为本发明锂的萃取方法的工艺流程图。
具体实施方式
38.以下将结合附图说明对本发明提供的锂的萃取方法作进一步说明。
39.如图1所示,为本发明提供的锂的萃取方法,包括:
40.(1)、提供负载锂的有机相;
41.(2)、将所述负载锂的有机相、氯化氢气体以及水混合,进行反萃和分相,得到含氯化锂的反萃液;
42.(3)、从所述反萃液中分离得到含锂化合物。
43.步骤(1)中,所述负载锂的有机相通过萃取液萃取得到,制备方法包括:
44.(11)、提供含锂溶液;
45.(12)、将所述含锂溶液与萃取液混合,进行萃取和分相,得到所述负载锂的有机相。
46.步骤(11)中,所述含锂溶液包括盐湖卤水、锂矿石浸出液、锂电池废料浸出液、沉锂母液中的至少一种。
47.由于盐湖卤水中cl-、so
42-、hco
3-、co
32-、na
+
、k
+
、mg
2+
、ca
2+
等浓度都很高,其中,大量存在的mg
2+
、ca
2+
给锂的分离造成一定的困难,所以,当含锂溶液为盐湖卤水时,可进一步将含锂溶液与氢氧化钠、氢氧化钾、碳酸钠、氧化钙、氢氧化锂等碱性物质混合,以使其中的mg
2+
转化为氢氧化镁沉淀,ca
2+
转化为氢氧化钙沉淀,以基本去除mg
2+
和ca
2+
。
48.当盐湖卤水mg
2+
和/或ca
2+
得含量较高时,可先采用吸附等方法去除部分mg
2+
,降低mg
2+
的含量,然后再将其与碱性物质混合,去除mg
2+
和ca
2+
。
49.所述盐湖卤水包括碳酸盐型盐湖卤水、硫酸盐型盐湖卤水、氯化物型盐湖卤水中的至少一种。当盐湖卤水为氯化物型的盐湖卤水或硫酸盐型的盐湖卤水时,将其与碱性物质混合去除mg
2+
和ca
2+
的同时还能将ph调至碱性,以使其更有利于萃取步骤的进行。
50.应予说明的是,当锂矿石浸出液、锂电池废料浸出液、沉锂母液等含锂溶液中的含有mg
2+
和/或ca
2+
,均可以采用上述方法去除mg
2+
和/或ca
2+
,同时将含锂溶液的ph调至碱性。
51.步骤(12)中,所述萃取液包括萃取剂和稀释剂。其中,所述萃取剂为疏水型液体,包括三氧噻吩氧化物、1,1,1-三氟-5,5-二甲基-2,4-己二酮、1,1,1,2,2-五氟-6,6二甲基-3,5-庚二酮、1,1,1,2,2,3,3-七氟-7,7-二甲基-4,6-辛二酮、苯甲酰三氟丙酮、1-苯基-1,3-丁二酮、1-苯甲酰-2-壬酮、三烷基磷酸酯、三烷基氧化膦、三辛基氧化膦、三己基氧化膦、二烷基磷酸酯、甲基异丁基甲酮、1-苯基偶氮-2-萘酚、正辛醇、异辛醇、2-乙基己醇、14-冠-4醚丁基膦酸二丁酯、二丁基磷酸丁酯、甲撑四丁基双磷酸酯、三辛基氧化胺、1,10-菲罗啉、季铵盐n
263
、二甲基二(n-十八烷基)氯化铵、氯化甲基二辛基锍盐、1-羟基乙基-3-甲基咪唑双(三氟甲基磺酰基)酰亚胺中至少一种,其中,三烷基磷酸酯包括有磷酸三丁酯等。所述稀
释剂包括正己烷、正十二烷、环己烷、d70特种溶剂油、d80特种溶剂油、120号溶剂油、160号溶剂油、200号溶剂油、普通煤油、航空煤油、磺化煤油中的至少一种。
52.进一步地,所述萃取液中萃取剂的体积比为不限,具体根据所述萃取剂和所述稀释剂的选择进行调整,在一实施方式中,所述萃取剂在所述萃取液中得体积百分数为40%-50%。
53.将所述含锂溶液与萃取液混合时,所述萃取液与所述含锂溶液的体积比为4:1-1:4,所述萃取的次数大于或等于1,每次萃取的时间为1分钟-10分钟。
54.萃取过程中,含锂溶液和萃取液中的锂离子与氢离子互换,从而,萃取结束后,通过分相即可得到负载锂的有机相和与其不相容的萃余液,萃余液可以经环保处理后进行排放,方法简单。
55.当萃取次数大于1次时,即,进行多级萃取时,可以将萃余液代替含锂溶液,在所述萃取的条件下,继续与萃取液混合进行萃取。如进行三级萃取时,含锂溶液与萃取液混合进行萃取得到的可以为一级的负载锂的有机相和一级的萃余液,一级的萃余液再与萃取液进行混合,进行第二次萃取,得到二级的负载锂的有机相和二级的萃余液,二级的萃余液继续与萃取液进行,进行第三次萃取,得到三级的负载锂的有机相和三级的萃余液,合并一级至三级的负载锂的有机相,进入步骤(2)进行反萃,三级的萃余液经环保处理后进行排放。
56.步骤(2)中,使用氯化氢气体与水的组合作为反萃取剂,将所述负载锂的有机相、氯化氢气体以及水混合进行反萃时,制酸和反萃同时进行,使得氯化氢气体和盐酸共存,以使氯化氢气体不断转化为盐酸补充已经反应掉的盐酸,所以,可以有效提高负载锂的有机相、氯化氢气体以及水混合得到的反萃体系中的氯化氢的浓度。
57.所述负载锂的有机相、所述氯化氢气体以及所述水混合的步骤包括:将氯化氢气体和水连续通入负载锂的有机相中,同时与负载锂的有机相混合。
58.在将所述负载锂的有机相、所述氯化氢气体以及所述水混合的步骤中,以所述负载锂的有机相中的锂离子的摩尔比计,每1mol所述锂离子通入1mol-2mol的所述氯化氢气体,优选为1mol-1.5mol。在通入所述氯化氢气体时,压力小于或等于2mpa,优选为0-1mpa,温度为-30℃至50℃,优选为-20℃至30℃,所述氯化氢气体与所述水的体积比为4:1-15:1,优选为4:1-10:1。
59.具体的,所述反萃的次数大于或等于1,每次反萃的时间为1分钟-10分钟,优选为5分钟-10分钟。
60.从而,使分相得到的反萃液中的锂离子的浓度提高至96g/l左右,进而有效提高了锂的收率,同时,反萃液中锂离子浓度越高,在结晶过程中所需要的能耗越低。
61.步骤(2)中,反萃结束后,分相得到含氯化锂的反萃液时,还得到空载萃取液,所述空载萃取液可以回收利用,如,回收后循环至步骤(12)与所述萃取液混合,再次用于萃取含锂溶液,得到负载锂的有机相。
62.考虑到空载萃取液中,可能还存在有未被完全反萃的锂离子,所以,可以参照萃取时的多级萃取方案,对空载萃取液进行多级的反萃。
63.另外,当分相得到的反萃液中锂离子的浓度较低时,可以继续将反萃液循环,与负载锂的有机相混合进行反萃,循环时,向反萃液中通入水和/或氯化氢气体,循环的次数可以为1次以上。
64.进一步地,当反萃液中锂离子的浓度达到平衡时,也可以使部分反萃液进入步骤(3),部分反萃液继续循环,与所述负载锂的有机相、所述氯化氢气体以及所述水混合,进行反萃和分相,优选地,循环时,向反萃液中通入水和/或氯化氢气体。
65.步骤(3)中,所述从所述反萃液中分离得到含锂化合物的方法众多,采用不同方法时,所获得的含锂化合物不同,包括有碳酸锂、氯化锂等。
66.在一实施方法中,所述从所述反萃液中分离得到含锂化合物的步骤包括:将所述反萃液与碳酸钠混合,得到含锂化合物沉淀,所述含锂化合物为碳酸锂。为了提高碳酸锂的收率,所述将所述反萃液与碳酸钠混合时的温度优选为70℃-90℃,混合时,将所述反萃液缓慢滴入所述碳酸钠溶液中,锂离子与碳酸根离子的摩尔比为2:1-2:1.1。
67.在一实施方法中,所述从所述反萃液中分离得到含锂化合物的步骤包括:将所述反萃液、所述氢氧化钠和二氧化碳混合,并进行加热反应,所述加热反应的温度为50℃-100℃,优选为70℃-90℃,得到含锂化合物沉淀,所述含锂化合物为碳酸锂。
68.所述反萃液、所述氢氧化钠和二氧化碳混合时,当锂离子、碳酸根离子与二氧化碳的摩尔比为1:1:1时,反应直接得到碳酸锂。
69.考虑到二氧化碳的溶解性能,为了使二氧化碳能够充分溶解进入溶液中,可先将所述反萃液、所述氢氧化钠和二氧化碳进行混合,然后进行加热反应,混合时的温度优选不高于30℃,进一步优选直接于常温下进行。当然,也可以在通入二氧化碳的同时进行加热反应,以使通入的二氧化碳能够立即反应掉,保证二氧化碳能够持续溶解进入溶液中。
70.为了提高碳酸锂的收率,可使二氧化碳过量,优选二氧化碳的摩尔百分数为锂离子的摩尔百分数的110%以内,此时,氯化锂、氢氧化钠与二氧化碳反应先生成碳酸氢锂,而碳酸氢锂在加热的条件下分解为碳酸锂和二氧化碳,所述二氧化碳可循环用于与所述反萃液、所述氢氧化钠混合并进行所述加热反应。
71.在一实施方式中,所述从所述反萃液中分离得到含锂化合物的步骤包括:将所述反萃液的温度控制在20℃-50℃,对所述反萃液进行降温,降温的温差为10℃-40℃,优选为20℃-40℃,如,分相得到的所述反萃液的温度为30℃,将所述反萃液的温度降低至0℃或者-10℃,此时,氯化锂由于过饱和而析出。
72.该实施方式中,如果所述反萃液中还含有mg
2+
和/或ca
2+
,为避免mg
2+
和/或ca
2+
的影响,在降温之前,可先对所述反萃液进行吸附处理,以去除mg
2+
和/或ca
2+
。
73.应予说明的是,该实施方式中析出的氯化锂中还含有部分氯化钠,可重新将氯化锂溶解于水中,然后加入碳酸钠,得到碳酸锂沉淀和氯化钠溶液。
74.本发明各实施方式所获得的碳酸锂为纯度较高的碳酸锂,纯度可达到98.5%以上。
75.步骤(3)中,从所述反萃液中分离得到含锂化合物后,还得到沉锂母液,所述沉锂母液可以循环至步骤(11),与所述含锂溶液混合,重新进入萃取步骤。
76.考虑到沉锂母液中mg
2+
和/或ca
2+
等离子已经基本去除,对锂的萃取影响较小,所以,所述沉锂母液可以单独与所述萃取液混合,进行萃取和反萃,即以沉锂母液作为新的含锂溶液,进行萃取和反萃,以获得纯度更高的含锂化合物。
77.如图1所示,本发明所述氯化氢气体可以通过以下方法制备得到:
78.(21)、将氯化钠溶解于水中得到氯化钠溶液;
79.(22)、将所述氯化钠溶液经电解得到氢氧化钠、氯气和氢气;
80.(23)、将所述氯气和氢气反应得到所述氯化氢气体。
81.从而,可以采用氯碱工艺制备得到氯化氢气体和氢氧化钠,然后,再将所述氯化氢气体用于步骤(2),与所述负载锂的有机相和水混合进行反萃,所述氢氧化钠用于与步骤(11)中的含锂溶液混合,将mg
2+
转化为氢氧化镁沉淀,ca
2+
转化为氢氧化钙沉淀,去除mg
2+
和ca
2+
,并调整含锂溶液的ph值,以及,用于步骤(3)中,与所述反萃液和二氧化碳混合,制备所述碳酸锂。
82.当含锂溶液为盐湖卤水时,以从盐湖卤水中萃取锂为例,盐湖卤水中含有大量氯化钠,所以,可以直接从盐湖卤水中获取氯化钠用于制备氯化氢气体和氢氧化钠。
83.而用氢氧化钠沉淀出的氢氧化镁和氢氧化钙等沉淀物,可再次与所述氯化氢气体以及水混合,反应得到混合液,混合液中包含cl-、na
+
、mg
2+
和ca
2+
等。因此,该混合液可直接排入盐湖卤水中。
84.从离子守恒角度分析,以该工艺从盐湖卤水中循环萃取锂时,仅从盐湖卤水中提取了锂离子,cl-、na
+
、mg
2+
和ca
2+
等离子均能够循环回盐湖卤水中,因此,可以极大保护盐湖的生态。
85.同时,当使用二氧化碳与氢氧化钠制备碳酸锂时,除萃取液和二氧化碳外,整个萃取和反萃步骤无需使用任何其他化学试剂,且萃取剂与二氧化碳还可以循环使用,无需往盐湖地区运送任何酸性和/或碱性化学试剂,一方面,极大保护了盐湖的生态环境,另一方面,极大降低了生产成本,同时,可对工业废气二氧化碳进行二次利用。
86.同理,当使用碳酸钠进行制备碳酸锂时,除萃取液和碳酸钠外,整个萃取和反萃步骤也无需使用任何其他化合试剂;当直接制备氯化锂时,除萃取液外,整个萃取和反萃也无需使用任何其他化学试剂。
87.应予说明的是,本发明步骤(3)除得到含锂化合物外,还能从沉锂母液中得到氯化钠,所述氯化钠可循环至步骤(21),用于溶解于所述水中得到所述氯化钠溶液,并制备所述氯化氢气体,从而使得整个萃取和反萃步骤的试剂均可以循环利用。
88.由于本发明步骤(3)能得到氯化钠,可以理解,当含锂溶液为锂矿石浸出液、锂电池废料浸出液、沉锂母液时,所述氯化氢气体也可以由步骤(21)至步骤(24)获得,使整个制备工艺中氯化钠能够循环使用,降低成本。
89.应予说明的是,此时如果用氢氧化钠沉淀出的氢氧化镁和氢氧化钙等沉淀物,可直接作为附属产品。
90.以下,将通过以下具体实施例对所述锂的萃取方法做进一步的说明。
91.实施例1:
92.取1.96g氯化钠溶解于7.84g水中,得到氯化钠溶液,将该氯化钠溶液经电解得到氢氧化钠溶液、氯气和氢气,然后将氯气和氢气通过燃烧反应得到氯化氢气体,同时,通过蒸发浓缩从氢氧化钠溶液中得到氢氧化钠。
93.取盐湖卤水102ml(密度约为1.11g/ml),盐湖卤水中锂的浓度为2g/l、镁的浓度为0.15g/l、钙的浓度为0.08g/l,向该盐湖卤水中加入上述制备得到的氢氧化钠0.57g,过滤得到沉淀物和100ml左右的预处理后的盐湖卤水,ph为12.80。沉淀物可以与上述氯化氢气体、水混合,反应得到混合液,混合液直接排入盐湖卤水中。
94.先分别取定量甲基异丁基甲酮和煤油,于分液漏斗中混合均匀得到萃取液,甲基异丁基甲酮的体积占比为40%。取萃取液100ml,再加入上述预处理后的盐湖卤水,振荡萃取5分钟后分离出水相和负载锂的有机相,萃取三次,合并负载锂的有机相。
95.取100ml负载锂的有机相,向该负载锂的有机相中通入上述氯化氢气体和纯水进行混合,其中,氯化氢气体通入时的温度为25℃,压力为0.1mpa,氯化氢气体与水体积比为7.5:1,氯化氢气体与负载锂的有机相中的锂的摩尔比约为1.11:1,反萃三次,单次反萃时间为5分钟,反萃后收集水相即得到含氯化锂的反萃液和空载萃取液,空载萃取液循环至萃取阶段继续使用。
96.反萃液经过上述条件的若干次循环使用后,通过icp(电感耦合等离子光谱发生仪)分析,所获得的含氯化锂的反萃液中,锂的浓度为95.5g/l,密度约1.29g/ml。
97.取398g碳酸钠溶液(79.54g碳酸钠,20wt%)放入油浴中80℃加热,当水温升至80℃左右时开始缓慢滴入128.97g上述反萃液,20min滴加完毕。接着继续加热反应90min,趁热过滤得到481g沉锂母液(锂含量约2.05g/l)和碳酸锂白色晶体,碳酸锂白色晶体用100℃超纯水洗涤两遍,每次100g水量(锂含量约1.516g/l),最后将碳酸锂晶体100℃干燥一晚,得到43.41g碳酸锂白色粉末,锂回收率约为86.00%。
98.实施例2:
99.取2.22g氯化钠溶解于8.88g水中,得到氯化钠溶液,将该氯化钠溶液经电解得到氢氧化钠溶液、氯气和氢气,然后将氯气和氢气通过燃烧反应得到氯化氢气体,同时,通过蒸发浓缩从氢氧化钠溶液中得到氢氧化钠。
100.取盐湖卤水102ml(密度约为1.11g/ml),盐湖卤水中锂的浓度为2g/l、镁的浓度为0.002g/l、钙的浓度为0.002g/l,向该盐湖卤水中加入上述制备得到的氢氧化钠0.57g,过滤得到沉淀物和100ml左右的预处理后的盐湖卤水,ph为12.80。沉淀物可以与上述氯化氢气体、水混合,反应得到混合液,混合液直接排入盐湖卤水中。
101.先分别取定量1,1,1-三氟-5,5-二甲基-2,4-己二酮和煤油,于分液漏斗中混合均匀得到萃取液,1,1,1-三氟-5,5-二甲基-2,4-己二酮的体积占比为40%。取萃取液100ml,再加入上述预处理后的盐湖卤水,振荡萃取5分钟后分离出水相和负载锂的有机相,萃取三次,合并负载锂的有机相。
102.取100ml负载锂的有机相,向该负载锂的有机相中通入上述氯化氢气体和纯水进行混合,其中,氯化氢气体通入时的温度为25℃,压力为0.1mpa,氯化氢气体与水的体积比为8.5:1,氯化氢气体与负载锂的有机相中的锂的摩尔比为1.25:1,反萃三次,单次反萃时间为5分钟,反萃后收集水相即得到含氯化锂的反萃液和空载萃取液,空载萃取液循环至萃取阶段继续使用。
103.反萃液经过上述条件的若干次循环使用后,通过icp(电感耦合等离子光谱发生仪)分析,所获得的含氯化锂的反萃液中,锂的浓度为95.8g/l,密度约1.29g/ml。
104.取398g碳酸钠溶液(79.54g碳酸钠,20wt%)放入油浴中80℃加热,当水温升至80℃左右时开始缓慢滴入128.98g上述反萃液,20min滴加完毕。接着继续加热反应90min,趁热过滤得到478g沉锂母液(锂含量约2.112g/l)和碳酸锂白色晶体,碳酸锂白色晶体用100℃超纯水洗涤两遍,每次100g水量(锂含量约1.525g/l),最后将碳酸锂晶体100℃干燥一晚,得到约43.60g碳酸锂白色粉末,锂回收率约为86.10%。
105.实施例3:
106.取2.60g氯化钠溶解于10.4g水中,得到氯化钠溶液,将该氯化钠溶液经电解得到氢氧化钠溶液、氯气和氢气,然后将氯气和氢气通过燃烧反应得到氯化氢气体,同时,通过蒸发浓缩从氢氧化钠溶液中得到氢氧化钠。
107.取盐湖卤水102ml(密度约为1.11g/ml),盐湖卤水中锂的浓度为2g/l、镁的浓度为0.002g/l、钙的浓度为0.002g/l,向该盐湖卤水中加入上述制备得到的氢氧化钠0.57g,过滤得到沉淀物和100ml左右的预处理后的盐湖卤水,ph为12.80。沉淀物可以与上述氯化氢气体、水混合,反应得到混合液,混合液直接排入盐湖卤水中。
108.先分别取定量二甲基二(n-十八烷基)氯化铵和煤油,于分液漏斗中混合均匀得到萃取液,二甲基二(n-十八烷基)氯化铵的体积占比为40%。取萃取液100ml,再加入上述预处理后的盐湖卤水,振荡萃取5分钟后分离出水相和负载锂的有机相,萃取三次,合并负载锂的有机相。
109.取100ml负载锂的有机相,向该负载锂的有机相中通入上述氯化氢气体和纯水进行混合,其中,氯化氢气体通入时的温度为25℃,压力为0.1mpa,氯化氢气体与水的体积比为10:1,氯化氢气体与负载锂的有机相中的锂的摩尔比为1.5:1,反萃三次,单次反萃时间为5分钟,反萃后收集水相即得到含氯化锂的反萃液和空载萃取液,空载萃取液循环至萃取阶段继续使用。
110.反萃液经过上述条件的若干次循环使用后,通过icp(电感耦合等离子光谱发生仪)分析,所获得的含氯化锂的反萃液中,锂的浓度为96.0g/l,密度约1.29g/ml。
111.取375g氢氧化钠溶液(60g氢氧化钠,16wt%),常温下向氢氧化钠溶液中开始缓慢滴入128.92g上述反萃液,并同时通入17l二氧化碳,经过20min后,二氧化碳与反萃液同时加入完毕。接着加热至90℃反应90min,趁热过滤得到482g沉锂母液(锂含量约2.065g/l)和碳酸锂白色晶体,碳酸锂白色晶体用100℃超纯水洗涤两遍,每次100g水量(锂含量约1.471g/l),最后将碳酸锂晶体100℃干燥一晚,得到43.88g碳酸锂白色粉末,锂回收率约为86.48%。
112.实施例4:
113.取2.60g氯化钠溶解于10.4g水中,得到氯化钠溶液,将该氯化钠溶液经电解得到氢氧化钠溶液、氯气和氢气,然后将氯气和氢气通过燃烧反应得到氯化氢气体,同时,通过蒸发浓缩从氢氧化钠溶液中得到氢氧化钠。
114.取盐湖卤水102ml(密度约为1.11g/ml),盐湖卤水中锂的浓度为2g/l、镁的浓度为0.002g/l、钙的浓度为0.002g/l,向该盐湖卤水中加入上述制备得到的氢氧化钠0.57g,过滤得到沉淀物和100ml左右的预处理后的盐湖卤水,ph为12.80。沉淀物可以与上述氯化氢气体、水混合,反应得到混合液,混合液直接排入盐湖卤水中。
115.先分别取定量三烷基氧化膦和煤油,于分液漏斗中混合均匀得到萃取液,三烷基氧化膦的体积占比为40%。取萃取液100ml,再加入上述预处理后的盐湖卤水,振荡萃取5分钟后分离出水相和负载锂的有机相,萃取三次,合并负载锂的有机相。
116.取100ml负载锂的有机相,向该负载锂的有机相中通入上述氯化氢气体和纯水进行混合,其中,氯化氢气体通入时的温度为25℃,压力为0.1mpa,氯化氢气体与水的体积比为10:1,氯化氢气体与负载锂的有机相中的锂的摩尔比为1.5:1,反萃三次,单次反萃时间
为5分钟,反萃后收集水相即得到含氯化锂的反萃液和空载萃取液,空载萃取液循环至萃取阶段继续使用。
117.反萃液经过上述条件的若干次循环使用后,通过icp(电感耦合等离子光谱发生仪)分析,所获得的含氯化锂的反萃液中,锂的浓度为95.7g/l,密度约1.29g/ml。
118.取375g氢氧化钠溶液(60g氢氧化钠,16wt%),常温下向氢氧化钠溶液开始缓慢滴入128.92g上述反萃液,并同时通入20l二氧化碳,经过20min后,二氧化碳与反萃液同时加入完毕。接着加热至80℃反应90min,趁热过滤得到485g沉锂母液(锂含量约1.987g/l)和碳酸锂白色晶体,碳酸锂白色晶体用100℃超纯水洗涤两遍,每次100g水量(锂含量约1.463g/l),最后将碳酸锂晶体100℃干燥一晚,得到43.79g碳酸锂白色粉末,锂回收率约为86.57%。
119.实施例5:
120.取2.60g氯化钠溶解于10.4g水中,得到氯化钠溶液,将该氯化钠溶液经电解得到氢氧化钠溶液、氯气和氢气,然后将氯气和氢气通过燃烧反应得到氯化氢气体,同时,通过蒸发浓缩从氢氧化钠溶液中得到氢氧化钠。
121.取盐湖卤水102ml(密度约为1.11g/ml),盐湖卤水中锂的浓度为2g/l、镁的浓度为0.002g/l、钙的浓度为0.002g/l,向该盐湖卤水中加入上述制备得到的氢氧化钠0.57g,过滤得到沉淀物和100ml左右的预处理后的盐湖卤水,ph为12.80。沉淀物可以与上述氯化氢气体、水混合,反应得到混合液,混合液直接排入盐湖卤水中。
122.先分别取定量三己基氧化膦和煤油,于分液漏斗中混合均匀得到萃取液,三己基氧化膦的体积占比为40%。取萃取液100ml,再加入上述预处理后的盐湖卤水,振荡萃取5分钟后分离出水相和负载锂的有机相,萃取三次,合并负载锂的有机相。
123.取100ml负载锂的有机相,向该负载锂的有机相中通入上述氯化氢气体和纯水进行混合,其中,氯化氢气体通入时的温度为25℃,压力为0.1mpa,氯化氢气体与水的体积比为10:1,氯化氢气体与负载锂的有机相中的锂的摩尔比为1.5:1,反萃三次,单次反萃时间为5分钟,反萃后收集水相即得到含氯化锂的反萃液和空载萃取液,空载萃取液循环至萃取阶段继续使用。
124.反萃液经过上述条件的若干次循环使用后,通过icp(电感耦合等离子光谱发生仪)分析,所获得的含氯化锂的反萃液中,锂的浓度为95.5g/l,密度约1.29g/ml。
125.取128.96g反萃液,将其温度控制在30℃,开启搅拌10min,然后对反萃液快速降温至0℃,得到46.31g氯化锂,锂回收率约为79.87%。
126.实施例6:
127.取2.60g氯化钠溶解于10.4g水中,得到氯化钠溶液,将该氯化钠溶液经电解得到氢氧化钠溶液、氯气和氢气,然后将氯气和氢气通过燃烧反应得到氯化氢气体,同时,通过蒸发浓缩从氢氧化钠溶液中得到氢氧化钠。
128.取盐湖卤水102ml(密度约为1.11g/ml),盐湖卤水中锂的浓度为2g/l、镁的浓度为0.002g/l、钙的浓度为0.002g/l,向该盐湖卤水中加入上述制备得到的氢氧化钠0.57g,过滤得到沉淀物和100ml左右的预处理后的盐湖卤水,ph为12.80。沉淀物可以与上述氯化氢气体、水混合,反应得到混合液,混合液直接排入盐湖卤水中。
129.先分别取定量二甲基二(n-十八烷基)氯化铵和煤油,于分液漏斗中混合均匀得到
萃取液,二甲基二(n-十八烷基)氯化铵的体积占比为40%。取萃取液100ml,再加入上述预处理后的盐湖卤水,振荡萃取5分钟后分离出水相和负载锂的有机相,萃取三次,合并负载锂的有机相。
130.取100ml负载锂的有机相,向该负载锂的有机相中通入上述氯化氢气体和纯水进行混合,其中,氯化氢气体通入时的温度为25℃,压力为0.1mpa,氯化氢气体与水的体积比为10:1,氯化氢气体与负载锂的有机相中的锂的摩尔比为1.5:1,反萃三次,单次反萃时间为5分钟,反萃后收集水相即得到含氯化锂的反萃液和空载萃取液,空载萃取液循环至萃取阶段继续使用。
131.反萃液经过上述条件的若干次循环使用后,通过icp(电感耦合等离子光谱发生仪)分析,所获得的含氯化锂的反萃液中,锂的浓度为95.8g/l,密度约1.29g/ml。
132.取128.97g反萃液,将其温度控制在30℃,开启搅拌10min,然后将反萃液快速降温至-10℃,得到51.55g氯化锂,锂回收率约为88.91%。
133.实施例7:
134.取1.54g氯化钠溶解于6.16g水中,得到氯化钠溶液,将该氯化钠溶液经电解得到氢氧化钠溶液、氯气和氢气,然后将氯气和氢气通过燃烧反应得到氯化氢气体,同时,通过蒸发浓缩从氢氧化钠溶液中得到氢氧化钠。
135.取锂矿石浸出液105ml(密度约为1.09g/ml),锂矿石浸出液中锂的浓度为1.2g/l、镁的浓度为0.1g/l、钙的浓度为0.08g/l,向该锂矿石浸出液中加入上述制备得到的氢氧化钠0.68g,过滤得到沉淀物和100ml的预处理后的锂矿石浸出液,ph为12.80。
136.先分别取定量1,1,1,2,2-五氟-6,6二甲基-3,5-庚二酮、正辛醇和煤油,于分液漏斗中混合均匀得到萃取液,1,1,1,2,2-五氟-6,6二甲基-3,5-庚二酮、正辛醇和煤油的体积比为1:1:2。取萃取液100ml,再加入上述预处理后的盐湖卤水,振荡萃取5分钟后分离出水相和负载锂的有机相,萃取三次,合并负载锂的有机相。
137.取100ml负载锂的有机相,向该负载锂的有机相中通入上述氯化氢气体和纯水进行混合,其中,氯化氢气体通入时的温度为25℃,压力为0.1mpa,氯化氢气体与水的体积比为6:1,氯化氢气体与负载锂的有机相中的锂的摩尔比为1:1.5:1,反萃三次,单次反萃时间为5分钟,反萃后收集水相即得到含氯化锂的反萃液和空载萃取液,空载萃取液循环至萃取阶段继续使用。
138.反萃液经过上述条件的若干次循环使用后,通过icp(电感耦合等离子光谱发生仪)分析,所获得的含氯化锂的反萃液中,锂的浓度为95.9g/l,密度约1.29g/ml。
139.取375g氢氧化钠溶液(60g氢氧化钠,16wt%),常温下向氢氧化钠溶液中开始缓慢滴入128.92g上述反萃液,并同时通入20l二氧化碳,经过20min后,二氧化碳与反萃液同时加入完毕。接着加热至85℃反应90min,趁热过滤得到476g沉锂母液(锂含量约1.965g/l)和碳酸锂白色晶体,碳酸锂白色晶体用100℃超纯水洗涤两遍,每次100g水量(锂含量约1.498g/l),最后将碳酸锂晶体100℃干燥一晚,得到44.04g碳酸锂白色粉末,锂回收率约为86.90%。
140.实施例8:
141.取1.2g氯化钠溶解于4.8g水中,得到氯化钠溶液,将该氯化钠溶液经电解得到氢氧化钠溶液、氯气和氢气,然后将氯气和氢气通过燃烧反应得到氯化氢气体,同时,通过蒸
发浓缩从氢氧化钠溶液中得到氢氧化钠。
142.取锂电池废料浸出液103ml(密度约为1.02g/ml),锂电池废料浸出液中锂的浓度为0.850g/l、镁的浓度为0.003g/l、钙的浓度为0.001g/l,向该锂电池废料浸出液中加入上述制备得到的氢氧化钠0.60g,过滤得到沉淀物和100ml的预处理后的锂电池废料浸出液,ph为12.8。
143.先分别取定量磷酸三丁酯和煤油,于分液漏斗中混合均匀得到萃取液,磷酸三丁酯的体积占比为40%。取萃取液100ml,再加入上述预处理后的盐湖卤水,振荡萃取5分钟后分离出水相和负载锂的有机相,萃取三次,合并负载锂的有机相。
144.取100ml负载锂的有机相,向该负载锂的有机相中通入上述氯化氢气体和纯水进行混合,其中,氯化氢气体通入时的温度为25℃,压力为0.1mpa,氯化氢气体与水的体积比为4:1,氯化氢气体与负载锂的有机相中的锂的摩尔比为1.5:1,反萃三次,单次反萃时间为5分钟,反萃后收集水相即得到含氯化锂的反萃液和空载萃取液,空载萃取液循环至萃取阶段继续使用。
145.反萃液经过上述条件的若干次循环使用后,通过icp(电感耦合等离子光谱发生仪)分析,所获得的含氯化锂的反萃液中,锂的浓度为95.6g/l,密度约1.29g/ml。
146.取375g氢氧化钠溶液(60g氢氧化钠,16wt%),常温下向氢氧化钠溶液中开始缓慢滴入128.92g上述反萃液,并同时通入20l二氧化碳,经过20min后,二氧化碳与反萃液同时加入完毕。接着加热至90℃反应90min,趁热过滤得到488g沉锂母液(锂含量约1.911g/l)和碳酸锂白色晶体,碳酸锂白色晶体用100℃超纯水洗涤两遍,每次100g水量(锂含量约1.459g/l),最后将碳酸锂晶体100℃干燥一晚,得到43.95g碳酸锂白色粉末,锂回收率约为86.97%。
147.实施例9:
148.取2.60g氯化钠溶解于10.4g水中,得到氯化钠溶液,将该氯化钠溶液经电解得到氢氧化钠溶液、氯气和氢气,然后将氯气和氢气通过燃烧反应得到氯化氢气体,同时,通过蒸发浓缩从氢氧化钠溶液中得到氢氧化钠。
149.取实施例1的沉锂母液102ml,沉锂母液中锂的浓度为2.05g/l、镁的浓度为0.001g/l、钙的浓度为0.002g/l,向该沉锂母液中加入上述制备得到的氢氧化钠0.54g,过滤得到沉淀物和100ml的预处理后的沉锂母液,ph为12.80。
150.先分别取定量1-苯基-1,3-丁二酮和环己烷,于分液漏斗中混合均匀得到萃取液,1-苯基-1,3-丁二酮的体积占比为40%。取萃取液100ml,再加入上述预处理后的盐湖卤水,振荡萃取5分钟后分离出水相和负载锂的有机相,萃取三次,合并负载锂的有机相。
151.取100ml负载锂的有机相,向该负载锂的有机相中通入上述氯化氢气体和纯水进行混合,其中,氯化氢气体通入时的温度为25℃,压力为0.1mpa,氯化氢气体与水的体积比为10:1,氯化氢气体与负载锂的有机相中的锂的摩尔比为1.5:1,反萃三次,单次反萃时间为5分钟,反萃后收集水相即得到含氯化锂的反萃液和空载萃取液,空载萃取液循环至萃取阶段继续使用。
152.反萃液经过上述条件的若干次循环使用后,通过icp(电感耦合等离子光谱发生仪)分析,所获得的含氯化锂的反萃液中,锂的浓度为95.9g/l,密度约1.29g/ml。
153.取375g氢氧化钠溶液(60g氢氧化钠,16wt%),常温下向氢氧化钠溶液中开始缓慢
滴入128.92g上述反萃液,并同时通入20l二氧化碳,经过20min后,二氧化碳与反萃液同时加入完毕。接着加热至80℃反应90min,趁热过滤得到483g沉锂母液(锂含量约2.011g/l)和碳酸锂白色晶体,碳酸锂白色晶体用100℃超纯水洗涤两遍,每次100g水量(锂含量约1.478g/l),最后将碳酸锂晶体100℃干燥一晚,得到43.98g碳酸锂白色粉末,锂回收率约为86.77%。
154.实施例10:
155.取盐湖卤水102ml(密度约为1.11g/ml),盐湖卤水中锂的浓度为2g/l、镁的浓度为0.002g/l、钙的浓度为0.002g/l,向该盐湖卤水中加入上述制备得到的氢氧化钠0.57g,过滤得到沉淀物和100ml左右的预处理后的盐湖卤水,ph为12.80。
156.先分别取定量二丁基磷酸丁酯和煤油,于分液漏斗中混合均匀得到萃取液,二丁基磷酸丁酯的体积占比为40%。取萃取液100ml,再加入上述预处理后的盐湖卤水,振荡萃取5分钟后分离出水相和负载锂的有机相,萃取三次,合并负载锂的有机相。
157.取100ml负载锂的有机相,向该负载锂的有机相中通入市场购买的氯化氢气体和纯水进行混合,其中,氯化氢气体通入时的温度为25℃,压力为0.1mpa,氯化氢气体与水的体积比为10:1,氯化氢气体与负载锂的有机相中的锂的摩尔比为1.5:1,反萃三次,单次反萃时间为5分钟,反萃后收集水相即得到含氯化锂的反萃液和空载萃取液,空载萃取液循环至萃取阶段继续使用。
158.反萃液经过上述条件的若干次循环使用后,通过icp(电感耦合等离子光谱发生仪)分析,所获得的含氯化锂的反萃液中,锂的浓度为95.8g/l,密度约1.29g/ml。
159.取375g氢氧化钠溶液(60g氢氧化钠,16wt%),向氢氧化钠溶液中开始缓慢滴入128.92g上述反萃液,并同时通入20l二氧化碳,经过20min后,二氧化碳与反萃液同时加入完毕。接着加热至85℃反应90min,趁热过滤得到475g沉锂母液(锂含量约2.056g/l)和碳酸锂白色晶体,碳酸锂白色晶体用100℃超纯水洗涤两遍,每次100g水量(锂含量约1.458g/l),最后将碳酸锂晶体100℃干燥一晚,得到43.90g碳酸锂白色粉末,锂回收率约为86.70%。
160.对比例1
161.对比例1与实施例1的区别在于,负载锂的有机相采用盐酸进行反萃,步骤包括:取100ml实施例1制得的负载锂的有机相,向该负载锂的有机相中加入工业盐酸(31%质量分数)进行混合,工业盐酸与负载锂的有机相中的锂的摩尔比为1.5:1,反萃三次,单次反萃时间为5分钟,反萃后收集水相即得到含氯化锂的反萃液和空载萃取液,空载萃取液循环至萃取阶段继续使用。
162.反萃液经过上述条件的若干次循环使用后,通过icp(电感耦合等离子光谱发生仪)分析,所获得的含氯化锂的反萃液中,锂的浓度为68.7g/l,密度约1.25g/ml。
163.取260g碳酸钠溶液(42.67g氢氧化钠,16.43wt%)放入油浴中80℃加热,当水温升至80℃左右时开始缓慢滴入124.6g上述反萃液,并同时通入14.0l二氧化碳,经过20min后,二氧化碳与反萃液同时加入完毕。接着升温至90℃加热反应90min,趁热过滤得到371.3g沉锂母液(锂含量约1.958g/l)和碳酸锂白色晶体,碳酸锂白色晶体用100℃超纯水洗涤两遍,每次100g水量(锂含量约1.472g/l),最后将碳酸锂晶体100℃干燥一晚,得到30.80g碳酸锂白色粉末,锂回收率约为84.82%。
164.以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
165.以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1