一种合金及其电极与电池
1.本发明涉及电池技术领域,具体涉及一种合金及其电极与电池。
背景技术:
2.锂离子电池在便携电子设备、电动汽车等领域已经实现大规模应用。目前商用的负极材料为石墨和钛酸锂,具有比容量较低和循环性能稳定的特点,但是由于嵌入式储能机制使其能量密度逐渐接近极限。所以,为了满足日益增长的能源需求,获得高容量、高稳定性的储能器件,负极材料的进一步开发就显得尤为重要。
3.锂金属作为锂电池负极材料中的“圣杯”材料,具有超高理论容量 (3860 mah
·
g-1
) 和极低的电化学电位 (3.04 v vs. she),能够实现高放电电压和高能量密度。早在1913年就有科学家对锂金属作为负极材料进行了研究,但由于锂金属在重复的充放电过程中的枝晶生长导致了严重的安全问题,使锂金属负极的研究告一段落。随着科研水平的进步以及对提高能量密度的迫切需求,锂金属负极又一次成为研究热点。目前对于锂金属负极的研究,旨在解决以下几个关键性问题:(1) 锂的不均匀沉积行为导致的枝晶生长;(2) sei膜(固体电解质界面膜,solid electrolyte interface)的稳定性较差;(3) 锂金属与电解质之间的副反应。
4.构建锂合金可以有效实现锂的均匀沉积,抑制锂枝晶的生长,进而改善电化学性能,提高安全性。同时,相比于锂金属,锂合金的反应活性较低,可以在一定程度上减少电极与电解质之间的副反应。此外,锂合金中锂的离子扩散系数较高,有助于形成良好的电极/电解质界面,有利于实现长循环稳定。在形成合金的同时会原位产生骨架结构,可以有效提高负极材料的机械稳定性。对于未来的产业化而言,锂合金的制备方法较为简单,并且与价格友好的金属形成合金能够减轻成本负担。
5.然而,现有的锂金属电池存在循环性能差和界面稳定性差等问题。
技术实现要素:
6.根据第一方面,在一实施例中,提供一种合金,所述合金含有锂、锡、x、氮元素,所述x包括但不限于铝、硼、硅、镁中的至少一种。
7.根据第二方面,在一实施例中,提供一种含有第一方面所述合金的电极。
8.根据第三方面,在一实施例中,提供第二方面所述电极的制备方法,包括:熔融步骤,包括将锂、锡、氮化物组成的混合物熔融,得到混合均匀的熔融态合金;压制步骤,包括将所述熔融态合金压制于基底的至少部分表面,形成合金层,得到包含所述合金层的电极。
9.根据第四方面,在一实施例中,提供一种电池,所述电池包含第一方面所述合金,或第二方面所述电极。
10.依据上述实施例的一种合金及其电极与电池,该合金可用于制备电池的负极,附着至金属基底,显著提升电池的循环性能和界面稳定性。
附图说明
11.图1是含氮超薄锂-锡-x合金(x = 铝、硼、硅或镁)的制备流程图。
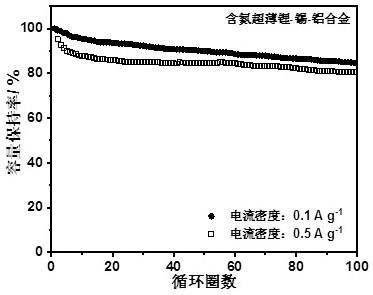
12.图2是实施例1中含氮超薄锂-锡-铝合金的循环性能图。
13.图3是实施例2中含氮超薄锂-锡-硼合金的循环性能图。
14.图4是实施例3中含氮超薄锂-锡-硅合金的循环性能图。
15.图5是实施例4中含氮超薄锂-锡-镁合金的循环性能图。
16.图6是对比例1中超薄锂-锡-铝合金的循环性能图。
17.图7是对比例2中超薄锂-锡-镁合金的循环性能图。
18.图8是实施例1中含氮超薄锂-锡-铝合金制得的对称电池的时间-电压图。
19.图9是实施例2中含氮超薄锂-锡-硼合金制得的对称电池的时间-电压图。
20.图10是实施例3中含氮超薄锂-锡-硅合金制得的对称电池的时间-电压图。
21.图11是实施例4中含氮超薄锂-锡-镁合金制得的对称电池的时间-电压图。
22.图12是对比例1中超薄锂-锡-铝合金制得的对称电池的时间-电压图。
23.图13是对比例2中超薄锂-锡-镁合金制得的对称电池的时间-电压图。
具体实施方式
24.下面通过具体实施方式结合附图对本发明作进一步详细说明。其中不同实施方式中类似元件采用了相关联的类似的元件标号。在以下的实施方式中,很多细节描述是为了使得本技术能被更好的理解。然而,本领域技术人员可以毫不费力的认识到,其中部分特征在不同情况下是可以省略的,或者可以由其他元件、材料、方法所替代。在某些情况下,本技术相关的一些操作并没有在说明书中显示或者描述,这是为了避免本技术的核心部分被过多的描述所淹没,而对于本领域技术人员而言,详细描述这些相关操作并不是必要的,他们根据说明书中的描述以及本领域的一般技术知识即可完整了解相关操作。
25.另外,说明书中所描述的特点、操作或者特征可以以任意适当的方式结合形成各种实施方式。同时,方法描述中的各步骤或者动作也可以按照本领域技术人员所能显而易见的方式进行顺序调换或调整。因此,说明书和附图中的各种顺序只是为了清楚描述某一个实施例,并不意味着是必须的顺序,除非另有说明其中某个顺序是必须遵循的。
26.本文中为部件所编序号本身,例如“第一”、“第二”等,仅用于区分所描述的对象,不具有任何顺序或技术含义。
27.如本文所用,“室温”是指23
±
2℃。
28.锂金属负极在长期的电镀/剥离过程中使锂金属内部疏松,死锂大量堆积,从而造成循环性能降低。锂金属非常活泼,与电解液处于热力学不稳定状态,反应生成sei膜,阻止反应继续进行。但是sei膜致密性差,容易破碎,使电解液与暴露出的锂继续反应,过度消耗电解液与金属锂,造成库伦效率降低,循环寿命缩短。
29.针对锂金属电池中锂金属负极在重复的电镀/剥离过程中存在锂枝晶的生长、sei膜的不稳定、副反应的发生导致循环稳定性和倍率性能差的问题,在一实施例中,本发明制备了一种含氮超薄锂-锡-x合金(x = 铝、硼、硅或镁)并应用于固态锂金属电池,展现出优异的循环稳定性,有利于促进锂金属电池的商业化发展。
30.根据第一方面,在一实施例中,提供一种合金,所述合金含有锂、锡、x、氮元素,所
述x包括但不限于铝、硼、硅、镁中的至少一种。该合金可用于制备电池的负极,附着于金属基底,显著提升电池的循环性能和界面稳定性。
31.在一实施例中,所述合金是由锂、锡、x、氮元素组成,所述x包括但不限于铝、硼、硅、镁中的至少一种。
32.在一实施例中,所述x包括但不限于铝、硼、硅、镁中的任意一种。
33.在一实施例中,所述合金是由锂、锡、氮化物组成的混合物制备得到,所述氮化物包括但不限于氮化铝、氮化硼、氮化硅、氮化镁中的至少一种。
34.在一实施例中,所述混合物中,含有如下质量百分比的组分:90~99% 锂、0.5~9.5% 锡、0.5~9.5% 氮化物。
35.在一实施例中,所述混合物中,含有如下质量百分比的组分:95~96% 锂、2.5~3% 锡、1~2.5% 氮化物。
36.在一实施例中,所述氮化物包括但不限于氮化铝、氮化硼、氮化硅、氮化镁中的任意一种。
37.在一实施例中,所述合金是由锂、锡、氮化物组成的混合物熔融制得。
38.在一实施例中,熔融温度为200~300℃。
39.在一实施例中,将锂、锡、氮化物组成的混合物加热至熔融温度后,在熔融温度下保持30~60min,得到混合均匀的熔融态合金。
40.在一实施例中,对锂、锡、氮化物进行加热时,升温速率为5~30℃/min,优选为10℃/min。
41.在一实施例中,得到混合均匀的熔融态合金后,冷却至室温,得到所述合金。
42.根据第二方面,在一实施例中,提供一种含有第一方面所述合金的电极。
43.在一实施例中,所述电极为负极。
44.在一实施例中,所述电极还包含基底。
45.在一实施例中,所述基底包括但不限于铜箔、镀锡铜箔、镀铜聚对苯二甲酸乙二醇酯(pet)膜等等中的至少一种。
46.在一实施例中,所述合金附着于所述基底的至少部分表面,形成合金层。
47.在一实施例中,所述合金层的厚度为10~100
ꢀµ
m,优选为20~50
ꢀµ
m。
48.根据第三方面,在一实施例中,提供第二方面所述电极的制备方法,包括:熔融步骤,包括将锂、锡、氮化物组成的混合物熔融,得到混合均匀的熔融态合金;压制步骤,包括将所述熔融态合金压制于基底的至少部分表面,形成合金层,得到包含所述合金层的电极。
49.在一实施例中,熔融温度为200~300℃。
50.在一实施例中,混合物在熔融温度下保持30~60min。保持时间包括但不限于30min、40min、50min、60min。
51.在一实施例中,将锂、锡、氮化物加热至熔融温度后,在熔融温度下保持30~60min,得到混合均匀的熔融态合金。
52.在一实施例中,将所述熔融态合金压制于基底的至少部分表面后,冷却至室温,得到包含所述合金层的电极。
53.在一实施例中,所述合金层的厚度为10~100
ꢀµ
m。
54.在一实施例中,所述基底包括但不限于铜箔、镀锡铜箔、镀铜聚对苯二甲酸乙二醇酯(pet)膜等等中的至少一种。
55.根据第四方面,在一实施例中,提供一种电池,所述电池包含第一方面所述合金,或第二方面所述电极。
56.在一实施例中,所述电池包括锂电池。
57.在一实施例中,所述锂电池包括但不限于纽扣电池、圆柱电池、软包电池、方形铝壳电池中的至少一种。
58.在一实施例中,本发明提供一种含氮超薄锂-锡-x合金,其中 x = 铝、硼、硅或镁,进而开发具备高循环稳定性、倍率性能的锂金属电池。熔融法得到锂、锡、x、氮均匀分布的三元合金材料,其中氮化锂具有较高的离子电导率,可提供快速的离子传输并且对锂金属稳定,有利于提高界面稳定性。同时原位反应生成的三维锂-锡-x合金可以提供丰富的锂沉积位点,进而提高循环稳定性。
59.在一实施例中,含氮超薄锂-锡-x合金(x = 铝、硼、硅或镁)的制备流程如图1所示,首先将金属锂、金属锡、氮化物(包括氮化铝、氮化硼、氮化硅和氮化镁)熔融,然后将均匀的熔融态金属按压在铜箔上。具体制备步骤如下:(1)在高纯氩气环境下,按照(90~99):(0.5~9.5):(0.5~9.5)的质量比准确称取金属锂、金属锡和氮化物(包括氮化铝、氮化硼、氮化硅和氮化镁),置于不锈钢容器中;(2)将不锈钢容器置于加热板上,以10 ℃/min的升温速度加热至200~300℃,保持30~60分钟,得到混合均匀的熔融态金属;(3)将铜制的块体蘸取上述熔融态金属并将其按压在铜箔上,自然冷却至室温,得到厚度为10~100
ꢀµ
m的含氮超薄锂-锡-x合金(x = 铝、硼、硅或镁)。
60.在一实施例中,选取锂、锡、氮化物(包括氮化铝、氮化硼、氮化硅或氮化镁)三组材料,通过简单的熔融就能得到混合均匀的含氮三元锂-锡-x合金材料,其中x = 铝、硼、硅或镁。同时,氮化物与锂反应生成的氮化锂具有超高离子电导率。熔融态合金材料流动性好,不仅能通过铜块蘸取-按压得到超薄合金材料,也可通过刮涂工艺实现大规模制备。
61.在一实施例中,三种组分的配比会直接影响锂金属电池的电化学性能。三元锂-锡-x合金能降低锂的反应活性,并且抑制与电解液的副反应,得到稳定的锂/电解质界面。合金中均匀分布的氮化锂能够提高电极的离子电导率。而过多的掺入则会降低锂金属电池的容量、能量密度,所以合适的配比至关重要。
62.在一实施例中,熔融金属时的升温速度、保持温度、保温时间会对合金中金属分布的均匀性产生影响,均匀的金属分布有利于保证均匀的电位分布,进而实现电镀过程中锂的均匀沉积。
63.在一实施例中,本发明以简单的熔融法将金属锂、金属锡和氮化物(包括氮化铝、氮化硼、氮化硅或氮化镁)三种材料按一定比例熔融,原位合金化反应得到锂、锡、x均匀分布的三维合金结构,其中x = 铝、硼、硅或镁,其中氮化硅与金属锂原位生成的氮化锂具有超高的离子电导率,可提供快速的离子传输并作为金属锂的保护材料。这种独特的三维结构可以为锂沉积提供均匀的位点,提高离子传输速度,并且在重复的电镀/剥离过程中能够保持优良的机械稳定性。同时锂-锡、锂-x合金之间的协同效应能够促进离子传输,进而提高电化学性能。此外,超薄锂-锡-x合金减小了锂的用量,在降低成本的同时提高了锂的利
用率。制备的超薄锂-锡-硅合金应用于锂金属电池和软包电池中将极大提高电化学性能和安全性能,通过刮涂的方法将熔融的锂合金均匀的涂敷在铜箔上有望实现大规模生产。
64.实施例1在手套箱中(氩气气氛,水和氧含量低于10 ppm) 按95:2.5:2.5的质量比准确称取金属锂、金属锡和氮化铝,并将其置于不锈钢容器中,加热至250℃,保持30~60min(本实施例具体为30min),得到混合均匀的熔融态合金。使用铜制块体均匀蘸取熔融的金属并将其压制在铜箔上,冷却至室温后得到含氮超薄锂-锡-铝合金,裁剪后得到直径为12 mm的圆形极片,厚度约为20~50
ꢀµ
m,即为含氮超薄锂-锡-铝合金。
65.制作固态电池的所有操作均在手套箱中,具体操作流程如下:将六氟磷酸锂加入到碳酸乙烯酯:碳酸二乙酯=1:1(体积比)的混合溶剂中搅拌溶解,配得溶液浓度为1.3mol/l(即六氟磷酸锂在溶液中的浓度为1.3mol/l),随后在溶液中加入1,3-二氧戊环单体,其体积分数为30%(即1,3-二氧戊环单体体积占最终混合溶液体积的30%),然后混合均匀。在干燥箱中,负极使用含氮超薄锂-锡-铝合金,正极使用商业化磷酸铁锂,将含有1,3-二氧戊环单体和六氟磷酸锂的上述溶液,添加进所组装的电池中。之后将电池封口并静置2天,即可得到固态电池。图2为该固态电池在0.1 a
·
g-1
、0.5 a
·
g-1
的电流密度下的循环性能。在0.1a
·
g-1
与0.5a
·
g-1
的电流密度下,100个循环后容量保持率分别为84.25%和80.47%,可见其在100个循环后仍具有较高的容量保持率。
66.实施例2在手套箱中(氩气气氛,水和氧含量低于10 ppm) 按95:2.5:2.5的质量比准确称取金属锂、金属锡和氮化硼,并将其置于不锈钢容器中,加热至250℃,得到混合均匀的熔融态合金。使用铜制块体均匀蘸取熔融的金属并将其压制在铜箔上,冷却至室温后得到含氮超薄锂-锡-硼合金,裁剪后得到直径为12 mm的圆形极片,即为含氮超薄锂-锡-铝合金。
67.制作固态电池的所有操作均在手套箱中,具体操作流程如下:将六氟磷酸锂加入到碳酸乙烯酯:碳酸二乙酯=1:1的混合溶剂中搅拌溶解,配得溶液浓度为1.3mol/l(即六氟磷酸锂在溶液中的浓度为1.3mol/l),随后在溶液中加入1,3-二氧戊环单体,其体积分数为30%(即1,3-二氧戊环单体体积占最终混合溶液体积的30%),然后混合均匀。在干燥箱中,负极使用含氮超薄锂-锡-硼合金,正极使用商业化磷酸铁锂,将含有1,3-二氧戊环单体和六氟磷酸锂的上述溶液,添加进所组装的电池中。之后将电池封口并静置2天,即可得到固态电池。图3为该固态电池在0.1 a
·
g-1
、0.5 a
·
g-1
的电流密度下的循环性能。在0.1a
·
g-1
与0.5a
·
g-1
的电流密度下,100个循环后容量保持率分别为84.13%和77.85%。可见其在循环100圈后具有较高的容量保持率。
68.实施例3在手套箱中(氩气气氛,水和氧含量低于10 ppm) 按96:3:1的质量比准确称取金属锂、金属锡和氮化硅,并将其置于不锈钢容器中,加热至250℃,得到混合均匀的熔融态合金。使用铜制块体均匀蘸取熔融的金属并将其压制在铜箔上,冷却至室温后得到含氮超薄锂-锡-硅合金,裁剪后得到直径为12 mm的圆形极片,即为含氮超薄锂-锡-铝合金。
69.制作固态电池的所有操作均在手套箱中,具体操作流程如下:将六氟磷酸锂加入到碳酸乙烯酯:碳酸二乙酯=1:1(体积比)的混合溶剂中搅拌溶解,配得溶液浓度为1.3mol/l(即六氟磷酸锂在溶液中的浓度为1.3mol/l),随后在溶液中加入1,3-二氧戊环单体,其体
镁合金,作为对照样品2。具体制备方法与实施例4相同,只是将氮化镁替换为金属镁。具体步骤如下:在手套箱中(氩气气氛,水和氧含量低于10 ppm) 按96:3:1的质量比准确称取金属锂、金属锡和金属镁,并将其置于不锈钢容器中,加热至250℃,得到混合均匀的熔融态合金。使用铜制块体均匀蘸取熔融的金属并将其压制在铜箔上,冷却至室温后得到超薄锂-锡-镁合金,裁剪后得到12 mm的极片。
75.制作固态电池的所有操作均在手套箱中,具体操作流程如下:将六氟磷酸锂加入到碳酸乙烯酯:碳酸二乙酯=1:1(体积比)的混合溶剂中搅拌溶解,配得溶液浓度为1.3mol/l(即六氟磷酸锂在溶液中的浓度为1.3mol/l),随后在溶液中加入1,3-二氧戊环单体,其体积分数为30%(即1,3-二氧戊环单体体积占最终混合溶液体积的30%),然后混合均匀。在干燥箱中,负极使用超薄锂-锡-镁合金,正极使用商业化磷酸铁锂,将含有1,3-二氧戊环单体和六氟磷酸锂的上述溶液,添加进所组装的电池中。之后将电池封口并静置2天,即可得到固态电池。图7为该固态电池在0.1a
·
g-1
的电流密度下的循环性能。在0.1a
·
g-1
的电流密度下,100个循环后容量保持率为79.57%。可见其在循环100圈后的容量保持率低于实施例1~4。从循环性能图可以反映出各实施例电池的界面稳定性较好。
76.通过对称电池中的极化电压也可反映界面稳定性。
77.对称电池的制备方法如下:在手套箱中,依次按照正极壳、含氮超薄锂-锡-x合金(x 铝、硼、硅和镁)、隔膜、含氮超薄锂-锡-x合金(x 铝、硼、硅和镁)、垫片、弹片、负极壳的顺序组装电池,电解液为商用电解液,电解液中,溶质为lipf6、fec(氟代碳酸乙烯酯,fluoroethylene carbonate),溶剂为ec(碳酸乙烯酯)与dmc(碳酸二甲酯)的混合液,按体积计,ec:dmc=1:1,电解液中lipf6的浓度1.0mol/l,fec的质量百分浓度为5%。
78.从图8~图11可以看出,在100个小时的恒电流充放电下,电压保持稳定,波动较小,说明了实施例1~4制得的合金材料的界面稳定性良好。
79.从图12、图13可以看出,在100个小时的恒电流充放电下,电压出现较大波动,说明对比例1、2制得的合金材料的界面稳定性较差。
80.以上应用了具体个例对本发明进行阐述,只是用于帮助理解本发明,并不用以限制本发明。对于本发明所属技术领域的技术人员,依据本发明的思想,还可以做出若干简单推演、变形或替换。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1