一种利用钙源浓度控制方解石与球霰石相互转变的方法与流程
本发明属于仿生材料的技术领域,尤其涉及一种利用钙源浓度控制方解石与球霰石相互转变的方法。
背景技术:
在自然界中,碳酸钙是一种最常见的生物矿化材料,是动物骨骼、贝壳、珊瑚等的重要组成部分。碳酸钙在工业中应用非常广泛,是一种重要的无机工业添加剂,在食品、造纸、涂料、橡胶等领域可以改善产品的膨松度、光泽度、亮度、流动性、强度等性能。
碳酸钙的结构很多,按照是否含有结晶水可以分为无水碳酸钙和含水碳酸钙。无水碳酸钙晶体具有三种晶型:方解石、文石和球霰石。不同晶型碳酸钙的物理力学性能差异较大,与方解石相比,球霰石具有比表面积大、比重小、生物相容性好等优点。在微生物诱导碳酸钙修复混凝土裂缝以及岩土文物裂隙过程中,球霰石比方解石具有更高的流动性和填充性,并且能够与水泥的水化产物—水化硅酸钙形成复合凝胶,显著提高混凝土的强度和耐久性。球霰石属于亚稳相,在潮湿环境中球霰石经过较短时间可以转化为方解石,进一步提高修复裂隙的力学强度。因此,通过改变方解石和球霰石的相对含量,能够调节浆体的流动性、填充率和力学强度,从而显著提高混凝土裂隙和岩土文物裂隙的修复效果。这就需要研究一种能够控制方解石与球霰石转变的方法,实现对方解石与球霰石的含量进行连续调控。
现有文献或专利,大多通过加入表面活性剂、有机大分子等添加剂,获得具有单一形貌的球霰石微纳米颗粒。目前,关于利用钙源浓度控制方解石与球霰石相互转变的方法还未见报道。
技术实现要素:
基于以上现有技术的不足,本发明所解决的技术问题在于提供一种利用钙源浓度控制方解石与球霰石相互转变的方法,获得能够连续调控方解石与球霰石的相对含量和形貌的方法。
为了解决上述技术问题,本发明通过以下技术方案来实现:本发明提供一种利用钙源浓度控制方解石与球霰石相互转变的方法,包括以下步骤:
s10:将巴氏芽孢八叠球菌(s.pasteurii)接种于培养基上,在30℃,100r/min的振荡培养箱中培养48h,得到菌液;
s20:配置尿素和一水乙酸钙的混合溶液为营养盐溶液,其中尿素浓度为0.5mol/l,一水乙酸钙浓度范围为0.025mol/l~1mol/l;
s30:配置0.2g/l脲酶溶液,脲酶活性为92~137u/mg,将脲酶溶液加入营养盐溶液中,营养盐溶液与脲酶溶液体积比为8~9:1;
s40:将菌液加入到脲酶和营养盐混合溶液中,菌液与混合溶液体积比为1:9~10,震荡均匀,10~30℃下静置72h;
s50:在20~40℃下超声波处理30min~1h,获得悬浮液;
s60:将悬浮液倒入离心管中,4000rpm离心后,倒掉上层清液,加入去离子水水洗;
s70:重复步骤s50和步骤s60三次,清洗掉未反应的一水乙酸钙;
s80:将离心后的白色颗粒沉淀物置于60℃烘干箱内烘干24h,得到不同组成和形貌的碳酸钙。
优选的,所述步骤1中的培养基的组成包括:酵母提取物10~30g/l、硫酸铵15g/l,培养基的ph为7~9.5。
进一步的,当一水乙酸钙浓度≤0.025mol/l时,获得的碳酸钙颗粒为单一的菱面体状方解石;
当一水乙酸钙浓度≥1mol/l时,获得的碳酸钙颗粒为单一的球形球霰石;
当一水乙酸钙浓度在两者之间时,获得的碳酸钙颗粒为方解石和球霰石的混合物,颗粒形貌为菱面体状、球形、纺锤型三种形貌共存。
由上,本发明的利用钙源浓度控制方解石与球霰石相互转变的方法至少具有如下有益效果:
1、只改变钙源的浓度,实现了碳酸钙由方解石结构向球霰石结构连续转变,钙源浓度很低时碳酸钙晶体结构为单一的方解石,钙源浓度很高时碳酸钙晶体结构为单一的球霰石。
2、在钙源浓度一定范围内,方解石和球霰石共存,菱面体状、球形、纺锤型的三种形貌颗粒共存,所形成的整体更加致密,比单一组分的碳酸钙力学强度更高。为微生物砂浆在混凝土裂隙修复和石质文物裂隙修复中的应用奠定了基础。
3、同时使用产脲酶微生物和脲酶,产脲酶微生物有利于晶体的形核,脲酶与钙源等物质在短时间内形成大量方解石和球霰石,有利于快速填充裂隙,产脲酶微生物经过长时间后仍然具有活性,可以进一步填充孔隙和裂隙,更加适合于混凝土裂隙修复和石质文物裂隙修复中。
4、本发明中所用微生物为土壤中广泛分布的微生物,对环境条件要求低,所用其它试剂对环境友好,并且反应速度快、工艺简单,实验结果可重复性高。
上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,而可依照说明书的内容予以实施,并且为了让本发明的上述和其他目的、特征和优点能够更明显易懂,以下结合优选实施例,并配合附图,详细说明如下。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例的附图作简单地介绍。
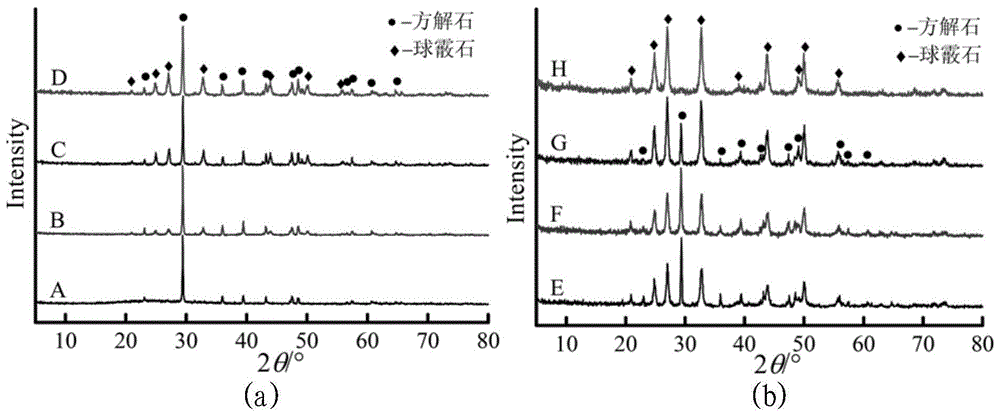
图1为本发明实施例1~8制备出的不同形貌碳酸钙样品的xrd谱图,其中(a)中a、b、c、d衍射谱线分别对应实施例1、2、3、4所得到的样品的xrd谱图;(b)中e、f、g、h衍射谱线分别对应实施例5、6、7、8所得到的样品的xrd谱图;
图2为本发明实施例1~8制备的不同形貌碳酸钙样品的红外光谱图,其中(a)中a、b、c、d衍射谱线分别对应实施例1、2、3、4所得到样品的红外光谱图;(b)中e、f、g、h衍射谱线分别对应实施例5、6、7、8所得到样品的红外光谱图;
图3为本发明实施例1~8制备的不同形貌碳酸钙样品的sem图片,其中图(a)、(b)、(c)、(d)、(e)、(f)、(g)、(h)分别为实施例1、2、3、4、5、6、7、8制备的碳酸钙的sem图片;
图4为本发明的利用钙源浓度控制方解石与球霰石相互转变的方法的流程图。
具体实施方式
下面结合附图详细说明本发明的具体实施方式,其作为本说明书的一部分,通过实施例来说明本发明的原理,本发明的其他方面、特征及其优点通过该详细说明将会变得一目了然。在所参照的附图中,不同的图中相同或相似的部件使用相同的附图标号来表示。
本发明实施例中采用的巴氏芽孢八叠球菌来源于美国菌种保藏中心,编号为atcc11859。巴氏芽孢八叠球菌,呈革兰氏阳性,外观椭圆杆状,有芽孢,无荚膜。在温度4℃~37℃和ph7~9.5的范围内,该菌能够生长。
采用的尿素为麦克林公司生产,分子式为ch4n2o,分析纯,纯度为99%。
采用的一水乙酸钙为麦克林公司生产,分子式为c4h8cao5,分析纯,纯度为98%。
采用的脲酶为日本toyobo公司生产,活度为148u/mg。
采用的酵母提取物为上海博微生物科技有限公司生产,总氮为11.57%,干燥失重4.8%,灰分9.5%,氯化物小于6%,ph值6.8(2%溶液)。
采用的硫酸铵为国药集团化学试剂有限公司生产,分子式为(nh4)2so4分析纯,纯度99%。
本发明的利用钙源浓度控制方解石与球霰石相互转变方法,试样的组成成分为球霰石和方解石,球霰石在其中的含量范围为0%~100%。
本发明利用钙源浓度控制方解石与球霰石相互转变,当一水乙酸钙的浓度≤0.025mol/l时,球霰石的含量为0%,方解石的含量为100%,组成颗粒的形貌为菱面体状,尺寸为小于15μm;当一水乙酸钙的浓度在0.025mol/l至1mol/l之间时,球霰石的含量在0%~100%之间连续变化,组成颗粒的形貌为菱面体状和球形共存,尺寸小于25μm;当一水乙酸钙的浓度≥1mol/l时,球霰石的含量为100%,方解石的含量为0%,组成颗粒的形貌为球形,尺寸小于10μm。
以下结合附图及具体实施例对本发明进行具体的详细说明。
实施例1
步骤1:将巴氏芽孢八叠球菌(s.pasteurii)接种于培养基上,在30℃,100r/min的振荡培养箱中培养48h,得到菌液;其中,培养基包括酵母提取物10~30g/l、硫酸铵15g/l,培养基的ph为7~9.5;
步骤2:配置尿素和一水乙酸钙的混合溶液为营养盐溶液,其中尿素浓度为0.5mol/l,一水乙酸钙浓度为0.025mol/l;
步骤3:配置0.2g/l脲酶溶液(脲酶活性为137u/mg),将脲酶溶液加入营养盐溶液中,营养盐溶液与脲酶溶液体积比为9:1;
步骤4:将菌液加入到脲酶和营养盐混合溶液中,菌液与混合溶液体积比为1:10,震荡均匀,在20℃静置72h;
步骤5:在20~40℃下超声波处理30min~1h,获得悬浮液;
步骤6:将悬浮液倒入离心管中,4000rpm离心后,倒掉上层清液,加入去离子水水洗;
步骤7:重复步骤5、6三次,清洗掉未反应的一水乙酸钙;
步骤8:将离心后的白色颗粒沉淀物置于60℃烘干箱内烘干24h,得到不同组成和形貌的碳酸钙。
本实施例1制备的碳酸钙通过xrd结果,如图1中的图谱a,2θ值在23.3°、29.7°、36.3°、39.8°、43.5°、47.8°、48.9°存在方解石晶型特征衍射峰,样品中含有100%的方解石型碳酸钙;通过红外图谱,图2中的图谱a中可也观察到在712cm-1和876cm-1处有—c—o—c—的特征吸收峰。通过sem观察,如图3中的图(a),颗粒形貌为菱面体状,颗粒尺寸小于15μm。
实施例2
步骤1:将巴氏芽孢八叠球菌(s.pasteurii)接种于培养基上,在30℃,100r/min的振荡培养箱中培养48h,得到菌液;其中,培养基包括酵母提取物10~30g/l、硫酸铵15g/l,培养基的ph为7~9.5;
步骤2:配置尿素和一水乙酸钙的混合溶液为营养盐溶液,其中尿素浓度为0.5mol/l,一水乙酸钙浓度为0.1mol/l;
步骤3:配置0.2g/l脲酶溶液(脲酶活性为137u/mg),将脲酶溶液加入营养盐溶液中,营养盐溶液与脲酶溶液体积比为8:1;
步骤4:将菌液加入到脲酶和营养盐混合溶液中,菌液与混合溶液体积比为1:10,震荡均匀,在20℃静置72h;
步骤5:在20~40℃下超声波处理30min~1h,获得悬浮液;
步骤6:将悬浮液倒入离心管中,4000rpm离心后,倒掉上层清液,加入去离子水水洗;
步骤7:重复步骤5、6三次,清洗掉未反应的一水乙酸钙;
步骤8:将离心后的白色颗粒沉淀物置于60℃烘干箱内烘干24h,得到不同组成和形貌的碳酸钙。
本实施例2制备的碳酸钙通过xrd结果,如图1中的图谱b,2θ值在23.3°、29.7°、36.3°、39.8°、43.5°、47.8°、48.9°存在方解石晶型特征衍射峰,同时2θ值在25.0°、27.3°、33.0°、44.1°、50.3°存在球霰石晶型特征的衍射峰,含有82%的方解石型碳酸钙、18%的球霰石型碳酸钙;通过红外图谱中,图2中的图谱b,可也观察到在712cm-1和876cm-1处有方解石的吸收峰,在745cm-1和872cm-1处有球霰石的吸收峰。通过sem观察,如图3(b)中的颗粒形貌为菱面体状和球形形貌共存,颗粒尺寸小于20μm。
实施例3
步骤1:将巴氏芽孢八叠球菌(s.pasteurii)接种于培养基上,在30℃,100r/min的振荡培养箱中培养48h,得到菌液;其中,培养基包括酵母提取物10~30g/l、硫酸铵15g/l,培养基的ph为7~9.5;
步骤2:配置尿素和一水乙酸钙的混合溶液为营养盐溶液,其中尿素浓度为0.5mol/l,一水乙酸钙浓度为0.3mol/l;
步骤3:配置0.2g/l脲酶溶液(脲酶活性为110u/mg),将脲酶溶液加入营养盐溶液中,营养盐溶液与脲酶溶液体积比为9:1;
步骤4:将菌液加入到脲酶和营养盐混合溶液中,菌液与混合溶液体积比为1:10,震荡均匀,在10℃静置72h;
步骤5:在20~40℃下超声波处理30min~1h,获得悬浮液;
步骤6:将悬浮液倒入离心管中,4000rpm离心后,倒掉上层清液,加入去离子水水洗;
步骤7:重复步骤5、6三次,清洗掉未反应的一水乙酸钙;
步骤8:将离心后的白色颗粒沉淀物置于60℃烘干箱内烘干24h,得到不同组成和形貌的碳酸钙。
将本实施例3制备的碳酸钙通过xrd结果,如图1中的图谱c,2θ值在23.3°、29.7°、36.3°、39.8°、43.5°、47.8°、48.9°存在方解石晶型特征衍射峰,同时2θ值在25.0°、27.3°、33.0°、44.1°、50.3°存在球霰石晶型特征的衍射峰,含有56%的方解石型碳酸钙、44%的球霰石型碳酸钙;通过红外图谱中,图2中的图谱c,可也观察到在712cm-1和876cm-1处有方解石的吸收峰,在745cm-1和872cm-1处有球霰石的吸收峰。通过sem观察,如图3(c)中的颗粒形貌为菱面体状和球形形貌共存,颗粒尺寸小于25μm。
实施例4
步骤1:将巴氏芽孢八叠球菌(s.pasteurii)接种于培养基上,在30℃,100r/min的振荡培养箱中培养48h,得到菌液;其中,培养基包括酵母提取物10~30g/l、硫酸铵15g/l,培养基的ph为7~9.5;
步骤2:配置尿素和一水乙酸钙的混合溶液为营养盐溶液,其中尿素浓度为0.5mol/l,一水乙酸钙浓度为0.5mol/l;
步骤3:配置0.2g/l脲酶溶液(脲酶活性为100u/mg),将脲酶溶液加入营养盐溶液中,营养盐溶液与脲酶溶液体积比为9:1;
步骤4:将菌液加入到脲酶和营养盐混合溶液中,菌液与混合溶液体积比为1:9,震荡均匀,在20℃静置72h;
步骤5:在20~40℃下超声波处理30min~1h,获得悬浮液;
步骤6:将悬浮液倒入离心管中,4000rpm离心后,倒掉上层清液,加入去离子水水洗;
步骤7:重复步骤5、6三次,清洗掉未反应的一水乙酸钙;
步骤8:将离心后的白色颗粒沉淀物置于60℃烘干箱内烘干24h,得到不同组成和形貌的碳酸钙。
将本实施例4制备的碳酸钙通过xrd结果,如图1中的图谱d,2θ值在23.3°、29.7°、36.3°、39.8°、43.5°、47.8°、48.9°存在方解石晶型特征衍射峰,同时2θ值在25.0°、27.3°、33.0°、44.1°、50.3°存在球霰石晶型特征的衍射峰,含有50%的方解石型碳酸钙、50%的球霰石型碳酸钙;通过红外图谱中,图2中的图谱d,可也观察到在712cm-1和876cm-1处有方解石的吸收峰,在745cm-1和872cm-1处有球霰石的吸收峰。通过sem观察,如图3(d)中的颗粒形貌为菱面体状和球形形貌共存,颗粒尺寸小于25μm。
实施例5
步骤1:将巴氏芽孢八叠球菌(s.pasteurii)接种于培养基上,在30℃,100r/min的振荡培养箱中培养48h,得到菌液;其中,培养基包括酵母提取物10~30g/l、硫酸铵15g/l,培养基的ph为7~9.5;
步骤2:配置尿素和一水乙酸钙的混合溶液为营养盐溶液,其中尿素浓度为0.5mol/l,一水乙酸钙浓度为0.6mol/l;
步骤3:配置0.2g/l脲酶溶液(脲酶活性为120u/mg),将脲酶溶液加入营养盐溶液中,营养盐溶液与脲酶溶液体积比为8:1;
步骤4:将菌液加入到脲酶和营养盐混合溶液中,菌液与混合溶液体积比为1:10,震荡均匀,在30℃静置72h;
步骤5:在20~40℃下超声波处理30min~1h,获得悬浮液;
步骤6:将悬浮液倒入离心管中,4000rpm离心后,倒掉上层清液,加入去离子水水洗;
步骤7:重复步骤5、6三次,清洗掉未反应的一水乙酸钙;
步骤8:将离心后的白色颗粒沉淀物置于60℃烘干箱内烘干24h,得到不同组成和形貌的碳酸钙。
将本实施例5制备的碳酸钙通过xrd结果,如图1中的图谱e,2θ值在23.3°、29.7°、36.3°、39.8°、43.5°、47.8°、48.9°存在方解石晶型特征衍射峰,同时2θ值在25.0°、27.3°、33.0°、44.1°、50.3°存在球霰石晶型特征的衍射峰,含有33%的方解石型碳酸钙、67%的球霰石型碳酸钙;通过红外图谱中,可也观察到在712cm-1和876cm-1处有方解石的吸收峰,在745cm-1和872cm-1处有球霰石的吸收峰,如图2中的图谱e。通过sem观察,如图3(e)中的颗粒形貌为菱面体状、球形、纺锤型三种形貌共存,颗粒尺寸小于20μm。
实施例6
步骤1:将巴氏芽孢八叠球菌(s.pasteurii)接种于培养基上,在30℃,100r/min的振荡培养箱中培养48h,得到菌液;其中,培养基包括酵母提取物10~30g/l、硫酸铵15g/l,培养基的ph为7~9.5;
步骤2:配置尿素和一水乙酸钙的混合溶液为营养盐溶液,其中尿素浓度为0.5mol/l,一水乙酸钙浓度为0.8mol/l;
步骤3:配置0.2g/l脲酶溶液(脲酶活性为130u/mg),将脲酶溶液加入营养盐溶液中,营养盐溶液与脲酶溶液体积比为9:1;
步骤4:将菌液加入到脲酶和营养盐混合溶液中,菌液与混合溶液体积比为1:10,震荡均匀,在10℃静置72h;
步骤5:在20~40℃下超声波处理30min~1h,获得悬浮液;
步骤6:将悬浮液倒入离心管中,4000rpm离心后,倒掉上层清液,加入去离子水水洗;
步骤7:重复步骤5、6三次,清洗掉未反应的一水乙酸钙;
步骤8:将离心后的白色颗粒沉淀物置于60℃烘干箱内烘干24h,得到不同组成和形貌的碳酸钙。
将本实施例6制备的碳酸钙通过xrd结果,如图1中的图谱f,2θ值在23.3°、29.7°、36.3°、39.8°、43.5°、47.8°、48.9°存在方解石晶型特征衍射峰,同时2θ值在25.0°、27.3°、33.0°、44.1°、50.3°存在球霰石晶型特征的衍射峰,含有29%的方解石型碳酸钙、71%的球霰石型碳酸钙;通过红外图谱中,图2中的图谱f,可也观察到在712cm-1和876cm-1处有方解石的吸收峰,在745cm-1和872cm-1处有球霰石的吸收峰。通过sem观察,如图3(f)中的颗粒形貌为菱面体状、球形、纺锤型三种形貌共存,颗粒尺寸小于20μm。
实施例7
步骤1:将巴氏芽孢八叠球菌(s.pasteurii)接种于培养基上,在30℃,100r/min的振荡培养箱中培养48h,得到菌液;其中,培养基包括酵母提取物10~30g/l、硫酸铵15g/l,培养基的ph为7~9.5;
步骤2:配置尿素和一水乙酸钙的混合溶液为营养盐溶液,其中尿素浓度为0.5mol/l,一水乙酸钙浓度为0.9mol/l;
步骤3:配置0.2g/l脲酶溶液(脲酶活性为92u/mg),将脲酶溶液加入营养盐溶液中,营养盐溶液与脲酶溶液体积比为9:1;
步骤4:将菌液加入到脲酶和营养盐混合溶液中,菌液与混合溶液体积比为1:10,震荡均匀,在20℃静置72h;
步骤5:在20~40℃下超声波处理30min~1h,获得悬浮液;
步骤6:将悬浮液倒入离心管中,4000rpm离心后,倒掉上层清液,加入去离子水水洗;
步骤7:重复步骤5、6三次,清洗掉未反应的一水乙酸钙;
步骤8:将离心后的白色颗粒沉淀物置于60℃烘干箱内烘干24h,得到不同组成和形貌的碳酸钙。
将本实施例7制备的碳酸钙通过xrd结果,如图1中的图谱g,2θ值在23.3°、29.7°、36.3°、39.8°、43.5°、47.8°、48.9°存在方解石晶型特征衍射峰,同时2θ值在25.0°、27.3°、33.0°、44.1°、50.3°存在球霰石晶型特征的衍射峰,含有16%的方解石型碳酸钙、84%的球霰石型碳酸钙;通过红外图谱中,图2中的图谱g,可也观察到在712cm-1和876cm-1处有方解石的吸收峰,在745cm-1和872cm-1处有球霰石的吸收峰。通过sem观察,如图3(g)中的颗粒形貌为菱面体状、球形、纺锤型三种形貌共存,颗粒尺寸小于20μm。
实施例8
步骤1:将巴氏芽孢八叠球菌(s.pasteurii)接种于培养基上,在30℃,100r/min的振荡培养箱中培养48h,得到菌液;其中,培养基包括酵母提取物10~30g/l、硫酸铵15g/l,培养基的ph为7~9.5;
步骤2:配置尿素和一水乙酸钙的混合溶液为营养盐溶液,其中尿素浓度为0.5mol/l,一水乙酸钙浓度为1mol/l;
步骤3:配置0.2g/l脲酶溶液(脲酶活性为137u/mg),将脲酶溶液加入营养盐溶液中,营养盐溶液与脲酶溶液体积比为8:1;
步骤4:将菌液加入到脲酶和营养盐混合溶液中,菌液与混合溶液体积比为1:9,震荡均匀,在20℃静置72h;
步骤5:在20~40℃下超声波处理30min~1h,获得悬浮液;
步骤6:将悬浮液倒入离心管中,4000rpm离心后,倒掉上层清液,加入去离子水水洗;
步骤7:重复步骤5、6三次,清洗掉未反应的一水乙酸钙;
步骤8:将离心后的白色颗粒沉淀物置于60℃烘干箱内烘干24h,得到不同组成和形貌的碳酸钙。
将本实施例8制备的碳酸钙通过xrd结果,如图1中的图谱h,2θ值在25.0°、27.3°、33.0°、44.1°、50.3°存在球霰石晶型特征的衍射峰,含有100%的球霰石型碳酸钙;通过红外图谱中,图2中的图谱h,在745cm-1和872cm-1处有球霰石的吸收峰。通过sem观察,如图3(h)中的颗粒形貌为球形,颗粒尺寸小于10μm。
采用本发明方法可以通过增加钙离子的浓度实现碳酸钙由单一的方解石组分逐渐变成单一的球霰石组分,并且反应速度快、工艺简单,所用试剂环境友好。
以上所述是本发明的优选实施方式而已,当然不能以此来限定本发明之权利范围,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和变动,这些改进和变动也视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!