一种水热合成碱性砷酸-硫酸铁固溶体的方法与流程
本发明属于环保安全与技术领域,特别涉及一种水热合成碱性砷酸-硫酸铁固溶体的方法。
背景技术:
砷是一类对生物体有高度毒害作用的类重金属元素,其砷化合物对环境和人体健康造成严重影响,是国际公认的致癌、致畸、致突变作用因子。自然界中砷大多以硫化物的形式夹杂于金、铜、铅、锌、锡、镍、钴等有色金属矿物中,并随着矿床的采、选、冶炼环节分散到废气、废渣及废水中。这些含砷化合物长期露天堆存,经雨雪冲刷、淋溶释放出砷,渗入河流和土壤,进而对生态环境造成严重危害。另外,金属冶炼和有色金属加工等工业化水平提升,燃煤需求的增加,以及含砷颜料,原药和纸张的普遍使用,会生成大量的含砷废水,废渣和废气。因此,研究一种可行可靠且安全的方法处理含砷废水、废渣已迫在眉睫。
目前,化学沉淀法因处理砷污染技术成熟且经济成本较低而被广泛使用,其利用钙盐,作为沉淀剂与含砷污染物共沉淀形成难容的砷酸盐化合物,达到固化砷的目的。由于生成的难溶含砷沉淀作为最终的处置物,那么其在环境中的稳定性就显得十分重要。研究表明,砷酸钙盐化合物长期暴露与空气中的二氧化碳接触会转化成碳酸钙和砷酸,这一反应表明砷会因碳化而淋出,易对环境造成二次污染。目前,工业上最为常用的是石灰沉淀法,所得含砷废渣一般堆存于尾矿或堆场。因此,这一做法仍存在重大安全隐患,其原因是工业上对含砷废水的处理通常以沉砷率为目标,而对含砷废渣中砷化合物的稳定性关注较少,这使得砷渣的结晶度较低,砷往往以多种非晶态化合物形式存在,由于含砷沉淀物不稳定,在堆存过程中易溶出释放而造成二次污染。因此探究能稳定固砷的沉淀剂是解决砷二次污染的关键所在。
碱性砷酸-硫酸铁(fe(aso4)x(so4)y(oh)z∙wh2o)与碱式硫酸铁(feohso4)之间的关系在于so42-与aso43-之间的类质同象替换,已有研究表明生成的碱性砷酸-硫酸铁矿物在不同的环境条件下都能稳定存在,说明其能够为固砷提供一种稳定的材料。本发明旨在提供一种在含fe3+/aso43-/so42-的液相环境中,利用砷酸根和硫酸根之间的异价类质同象取代,采用水热合成碱性砷酸-硫酸铁系列混晶固溶体的方法,并实现砷在环境中长期固定化、稳定化堆存。
技术实现要素:
本发明的目的是提供一种水热合成碱性砷酸-硫酸铁固溶体(fe(aso4)x(so4)y(oh)z∙wh2o)的方法。对制备的固溶体进行物相结构和形貌特征进行表征,测试其在不同ph溶液条件下砷浸出浓度,为解决常规固砷方法中存在的砷二次污染问题提供一种制备方法简单、固砷稳定的材料。
本发明方法的思路:称取不同质量的硫酸铁制备不同浓度的含fe+so4前躯体溶液,并且加入砷酸溶液,在简单的水热条件下,利用砷酸根和硫酸根的异价类质同象取代合成结晶度高、稳定性好的碱性砷酸-硫酸铁系列混晶固溶体。
具体步骤为:
(1)配制1mol/l砷酸溶液。
(2)称取3.9988~7.9976g的硫酸铁至250ml烧杯中,并且量取50ml超纯水加入,搅拌30min溶解,制得硫酸铁前驱体溶液。
(3)按fe3+/aso43-=2或3的摩尔比加入步骤(1)配制的砷酸溶液于步骤(2)制得的硫酸铁前驱体溶液中,继续搅拌25~35min,制得均匀的fe3+/aso43-/so42-体系混合液,随后将其转移至200ml的聚四氟乙烯材质内胆的密闭反应釜中,将反应釜放入200℃烘箱中反应24h,然后自然冷却至常温,真空抽滤进行固液分离,然后再将固相沉淀物经超纯水洗涤3次,每次超纯水的用量为50ml,最后将洗涤后的产物置于瓷盘中,瓷盘放入105~110℃烘箱干燥24h,即制得碱性砷酸-硫酸铁固溶体。
本发明采用砷酸根和硫酸根之间的异价类质同象取代合成结晶度高的碱性砷酸-硫酸铁固溶体,相较于传统水热合成固砷方法具有材料制备易于操控、经济成本低、能实现砷在环境中长期固定化和稳定化堆存等优点。
附图说明
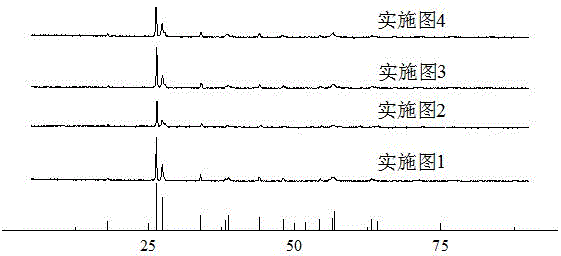
图1为本发明实施例1~4制得的碱性砷酸-硫酸铁固溶体的x射线衍射图(xrd)。
图2为本发明实施例1~4制得的碱性砷酸-硫酸铁固溶体的红外光谱图(ft-ir)。
图3为本发明实施例4制得的碱性砷酸-硫酸铁固溶体的扫描电镜图(sem)。
具体实施方式
以下实施例中的浸出实验步骤为:分别称取5.0g碱性砷酸-硫酸铁固溶体置于3组若干个100ml聚乙烯瓶中。并在每组瓶中分别加入100ml初始ph值2.00的hno3溶液、初始ph值6.00的超纯水和初始ph值10的naoh碱性溶液中。将这3组聚乙烯瓶密封,轻轻摇晃后置于振荡恒温水浴锅中溶解180d,水浴温度为25±1℃;并测试液相中浸出的砷浓度。
实施例1:
称取3.9988g硫酸铁(fe2(so4)3∙xh2o,399.88)置于装有50ml超纯水的烧杯中,搅拌30min;加入10ml1mol/l砷酸溶液和40ml超纯水于上述烧杯中,继续搅拌30min;将溶液转移至200ml反应釜中,于200℃烘箱中反应24h,取出反应釜,自然冷却至常温;然后将产物进行固液分离,固相沉淀物经超纯水洗涤3次,每次超纯水用量为50ml,洗涤产物置于瓷盘中在110℃烘箱中干燥24h,得到fe3+/aso43-=2的碱性砷酸-硫酸铁固溶体。
浸出测试:ph为2条件下溶解180d,砷浸出浓度0.0671mmol/l。
ph为6条件下溶解180d,砷浸出浓度0.0076mmol/l。
ph为10条件下溶解180d,砷浸出浓度0.0115mmol/l。
实施例2:
称取5.9982g硫酸铁(fe2(so4)3∙xh2o,399.88)置于装有50ml超纯水的烧杯中,搅拌30min;加入10ml1mol/l砷酸溶液和40ml超纯水于述烧杯中,继续搅拌30min;将溶液转移至200ml反应釜中,于200℃烘箱中反应24h,取出反应釜,自然冷却至常温;然后将产物进行固液分离,固相沉淀物经超纯水洗涤3次,每次超纯水用量为50ml,洗涤产物置于瓷盘中在110℃烘箱中干燥24h,得到fe3+/aso43-=3的碱性砷酸-硫酸铁固溶体。
浸出测试:ph为2条件下溶解180d,砷浸出浓度0.0751mmol/l。
ph为6条件下溶解180d,砷浸出浓度0.0008mmol/l。
ph为10条件下溶解180d,砷浸出浓度0.0008mmol/l。
实施例3:
称取5.9982g硫酸铁(fe2(so4)3∙xh2o,399.88)置于装有50ml超纯水的烧杯中,搅拌30min;加入15ml1mol/l砷酸溶液和35ml超纯水于述烧杯中,继续搅拌30min;将溶液转移至200ml反应釜中,于200℃烘箱中反应24h,取出反应釜,自然冷却至常温;然后将产物进行固液分离,固相沉淀物经超纯水洗涤3次,每次超纯水用量为50ml,洗涤产物置于瓷盘中在110℃烘箱中干燥24h,得到fe3+/aso43-=2的碱性砷酸-硫酸铁固溶体。
浸出测试:ph为2条件下溶解180d,砷浸出浓度0.0613mmol/l。
ph为6条件下溶解180d,砷浸出浓度0.0126mmol/l。
ph为10条件下溶解180d,砷浸出浓度0.0157mmol/l。
实施例4:
称取7.9976g硫酸铁(fe2(so4)3∙xh2o,399.88)置于装有50ml超纯水的烧杯中,搅拌30min;加入20ml1mol/l砷酸溶液和30ml超纯水于述烧杯中,继续搅拌30min;将溶液转移至200ml反应釜中,于200℃烘箱中反应24h,取出反应釜,自然冷却至常温;然后将产物进行固液分离,固相沉淀物经超纯水洗涤3次,每次超纯水用量为50ml,洗涤产物置于瓷盘中在110℃烘箱中干燥24h,得到fe3+/aso43-=2的碱性砷酸-硫酸铁固溶体。
浸出测试:ph为2条件下溶解180d,砷浸出浓度0.0247mmol/l。
ph为6条件下溶解180d,砷浸出浓度0.0020mmol/l。
ph为10条件下溶解180d,砷浸出浓度0.0021mmol/l。
- 还没有人留言评论。精彩留言会获得点赞!