一种废旧磷酸铁锂正极材料中回收锂铁磷的方法与流程
[0001]
本发明涉及废旧锂电池综合回收利用技术领域,具体地,本发明涉及一种废旧磷酸铁锂正极材料中回收锂铁磷的方法。
背景技术:
[0002]
以磷酸铁锂为正极材料的锂电池因其具有较好的安全性能和循环性能,普遍应用于新能源汽车领域。随着新能源汽车行业的快速发展,动力型锂电池使用量不断快速增长,近几年锂电池的报废量也在快速增长。相较于三元电池中的具有较高回收价值的钴镍锰锂等元素,磷酸铁锂电池中除锂元素外,磷和铁的回收价值较低,若仅回收锂元素,将产生大量的磷铁渣,对土壤环境和水环境造成污染。实现各类锂电池材料的循环再生利用,不仅能够促进新能源汽车行业的健康发展,而且能够减轻废旧锂电池材料造成的环境污染问题。废旧三元锂电池材料中钴镍锰元素的回收主要通过比较成熟的萃取、反萃取工艺将钴镍锰元素分离后制备成相应的金属盐,然后根据需求制备成各种型号的三元前驱体,进而制备成正极材料、锂电池,实现锂电材料的再生利用。镍钴锰锂因价值较高,再生利用具有较好的经济性效益。而废旧磷酸铁锂材料的再生利用,因铁和磷的价值相对较低,造成经济效益较差,暂未开发出较好的再生利用工艺。
[0003]
申请号是202010138675.8的中国发明专利申请公开了一种废旧磷酸铁锂正极片的回收方法,包括:s1、将拆解废旧磷酸铁锂电池得到的正极片进行机械粉碎,得到正极碎片;s2、将所述正极碎片与固体强碱混匀后,通过焙烧处理使熔融态强碱与铝反应生成偏铝酸盐,收集焙烧处理后得到的混合粉末;s3、将步骤s2得到的混合粉末与水混合,固液分离后,收集固相部分并从中回收锂、铁和/或磷元素。该方法虽然实现了铁锂磷三种元素的同步回收,并直接得到了磷酸铁和碳酸锂两个产品,但是硫酸-磷酸铁锂混合溶液中制备磷酸铁的工艺与传统磷酸铁制备工艺存在较大差异,该方法制备的磷酸铁的性能有待进一步验证。
技术实现要素:
[0004]
为了解决上述全部或部分问题,本发明目的在于提供一种废旧磷酸铁锂正极材料中回收锂铁磷的方法。
[0005]
本发明通过以下技术方案实现以上目的:
[0006]
一种废旧磷酸铁锂正极材料回收方法,包括:
[0007]
(1)用碱将废旧磷酸铁锂正极材料的铝溶解,收集固体;
[0008]
(2)用硫酸溶解步骤(1)的固体,固液分离得到的溶液进行第一次蒸发浓缩,降温结晶得到液体和结晶,纯化结晶;
[0009]
(3)对步骤(2)得到的液体进行第二次蒸发浓缩,固液分离得到液体和固体,对固体进行除杂和碳化;
[0010]
(4)对步骤(3)得到的液体进行第三次蒸发浓缩。
[0011]
可选地,在步骤(1)中,碱是浓度为4.5mol/l~5.5mol/l的氢氧化钠溶液。
[0012]
可选地,在步骤(2)中,硫酸是浓度为2.0mol/l~2.5mol/l的硫酸溶液,固体与硫酸溶液的重量比是1:4~1:5。
[0013]
可选地,在步骤(2)中,在50℃~70℃,用硫酸溶解步骤(1)的固体,溶解后溶液的密度是1.30g/ml~1.35g/ml。
[0014]
可选地,在步骤(2)中,第一次蒸发浓缩在80℃~95℃进行,液体蒸发量控制在30%~40%之间,蒸发后溶液的密度在1.50g/ml以上;降温结晶在0℃~5℃进行0.5h~1h。
[0015]
可选地,在步骤(3)中,第二次蒸发浓缩在80℃~95℃进行,液体蒸发量控制在35%~50%之间,蒸发后溶液的密度在1.55g/ml之上。
[0016]
可选地,在步骤(3)中,除杂是将固体溶解在水中得到浓度是2.0mol/l~3.0mol/l的溶液,用1.0mol/l~2.0mol/l的氢氧化钠溶液调节ph至值8.0~10.0之间,然后进行固液分离,得到硫酸锂溶液。
[0017]
可选地,在步骤(3)中,碳化是将硫酸锂溶液加入到浓度为1.5mol/l~2.0mol/l碳酸钠溶液中,碳酸钠是硫酸锂摩尔量的1.0~1.1倍,碳化温度维持在90~95℃,反应2h~3h。
[0018]
可选地,在步骤(3)中,对固体进行除杂和碳化之后在0℃~5℃进行结晶。
[0019]
可选地,在步骤(4)中,第三次蒸发浓缩在80℃~95℃进行。
[0020]
相比于现有技术,本发明的废旧磷酸铁锂正极材料中回收锂铁磷的方法至少具有如下有益效果:
[0021]
实现了废旧磷酸铁锂材料中锂、铁、磷三种元素的分离,分别制备成了工业级碳酸锂、绿矾和磷酸,以及副产品芒硝。本发明的方法首先利用硫酸亚铁与硫酸锂溶解度的差异,蒸发浓缩后冷却结晶实现了铁与锂、磷的分离,再经过二次蒸发浓缩实现锂与磷的分离。本发明的方法消耗的辅料较少,可有效降低磷酸铁锂材料回收成本。
附图说明
[0022]
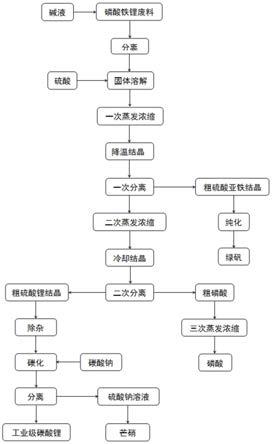
图1是本发明的废旧磷酸铁锂正极材料中回收锂铁磷的方法的工艺流程图。
具体实施方式
[0023]
为了充分了解本发明的目的、特征及功效,通过下述具体实施方式,对本发明作详细说明。本发明的工艺方法除下述内容外,其余均采用本领域的常规方法或装置。下述名词术语除非另有说明,否则均具有本领域技术人员通常理解的含义。
[0024]
为了实现同步回收废旧磷酸铁锂电池中锂、铁、磷三种元素,本发明的发明人通过研究,提出如下构思:首先利用硫酸亚铁与硫酸锂溶解度的差异,蒸发浓缩后冷却结晶得到硫酸亚铁,实现铁与锂、磷分离,然后再次蒸发浓缩实现锂和磷的分离。
[0025]
基于此,本发明的发明人提出了一种废旧磷酸铁锂正极材料中回收锂铁磷的方法,包括:(1)用碱将废旧磷酸铁锂正极材料的铝溶解,收集固体;(2)用硫酸溶解步骤(1)的固体,固液分离得到的溶液进行第一次蒸发浓缩,降温结晶得到液体和结晶,纯化结晶;(3)对步骤(2)得到的液体进行第二次蒸发浓缩,固液分离得到液体和固体,对固体进行除杂和碳化;(4)对步骤(3)得到的液体进行第三次蒸发浓缩。
[0026]
通过该方法,实现了废旧磷酸铁锂材料中锂、铁、磷三种元素的分离,分别制备成了工业级碳酸锂、绿矾(即七水硫酸亚铁)和磷酸,以及副产品芒硝(即十水硫酸钠)。此外,本发明的方法消耗的辅料较少,可有效降低磷酸铁锂材料回收成本。
[0027]
图1是本发明的废旧磷酸铁锂正极材料中回收锂铁磷的方法的工艺流程图,下面结合图1,对本发明一种优选方案进行详细说明:
[0028]
(1)去除废旧磷酸铁锂正极材料中的铝
[0029]
使用碱,例如浓度为4.5mol/l~5.5mol/l的氢氧化钠溶液,溶解拆解后的废旧磷酸铁锂材料以便将铝溶解,待反应完全之后进行固液分离,收集固体。随后,对固体进行洗涤,例如,采用浓度为0.05mol/l~0.15mol/l的氢氧化钠溶液对固体进行洗涤。本步骤得到的固体主要是铝含量较低的磷酸铁锂和隔膜、炭黑等。
[0030]
在本步骤中,主要发生了以下化学反应:
[0031]
2al+2naoh+2h2o=2naalo2+3h2↑
[0032]
(2)分离铁和锂、磷
[0033]
使用硫酸,例如浓度为2.0mol/l~2.5mol/l的硫酸溶液,溶解步骤(1)中经过洗涤之后的固体,固体与硫酸溶液的重量比是1:4~1:5。通过调节硫酸加入量,控制溶解终点的ph值为小于1.0。在溶解过程中,溶液的温度维持在50℃~70℃之间,在此温度区间,硫酸亚铁溶解度较高,溶解后溶液的密度在1.30g/ml~1.35g/ml之间,使溶液接近饱和。
[0034]
溶解反应完成之后,进行固液分离,以便去除隔膜、炭黑等酸不溶物。将得到的溶液升温至80℃~95℃进行第一次蒸发浓缩,在此过程中可适当减压以提高蒸发速度。液体蒸发量控制在30%~40%之间,蒸发后溶液的密度在1.50g/ml以上。将溶液降温至0℃~5℃之间,维持0.5h~1h以进行降温结晶。随后,进行固液分离,固体采用少量0℃~5℃的纯水在线淋洗,得到固体即为粗硫酸亚铁结晶。固液分离得到的液体进入步骤(3)。
[0035]
随后,对粗硫酸亚铁结晶进行纯化。可以采用如下方法对粗硫酸亚铁结晶进行纯化:按粗硫酸亚铁结晶重量的50%加入纯水,在50℃~70℃溶解后,将溶液降温至0℃~5℃之间,维持0.5h~1h后固液分离,得到绿矾。
[0036]
在本步骤中,主要发生了以下化学反应:
[0037]
2lifepo4+3h2so4=2li
+
+2fe
2+
+3so
42-+6h
+
+2po
43-2li
+
+2fe
2+
+3so
42-+6h
+
+2po
43-+14h2o=2feso4·
7h2o
↓
+2li
+
+so
42-+6h
+
+2po
43-[0038]
(3)分离锂和磷
[0039]
对步骤(2)中分离去除粗硫酸亚铁结晶之后的液体进行第二次蒸发浓缩。蒸发浓缩的温度控制在80℃~95℃之间,溶液蒸发量控制在35%~50%之间,蒸发后溶液的密度在1.55g/ml之上。然后,对溶液进行固液分离,得到的液体(即粗磷酸)进入步骤(4)。
[0040]
得到的固体用少量90℃~95℃的纯水在线淋洗,得到粗硫酸锂结晶(一水硫酸锂)。然后,对粗硫酸锂结晶进行除杂,具体是:将硫酸锂结晶用纯水溶解,溶解后硫酸锂浓度控制在2.0mol/l~3.0mol/l,用1.0mol/l~2.0mol/l的氢氧化钠溶液调节ph至值8.0~10.0之间,然后进行固液分离。得到的硫酸锂溶液进行碳化处理,具体是:将硫酸锂溶液加入到浓度为1.5mol/l~2.0mol/l碳酸钠溶液中,碳酸钠是硫酸锂摩尔量的1.0~1.1倍,碳化温度维持在90~95℃,反应2h~3h。
[0041]
碳化处理之后进行固液分离,得到的固体碳酸锂用90℃~95℃纯水洗涤,例如按
固液重量比1:3~1:4打浆两次,即可得到工业级碳酸锂。分离碳酸锂后的溶液冷却结晶,控制结晶温度在0℃~5℃,结晶后的固体即为芒硝。
[0042]
在本步骤中,主要发生了以下化学反应:
[0043]
2li
+
+so
42-+6h
+
+2po
43-+h2o(结晶)=li2so4·
h2o
↓
+6h
+
+2po
43-[0044]
fe
2+
+2naoh=fe(oh)2↓
+2na
+
[0045]
na2co3+li2so4(高温)=na2so4+li2co3↓
[0046]
(4)回收磷
[0047]
对步骤(3)分离的粗磷酸进行第三次蒸发浓缩,蒸发浓缩的温度控制在80℃~95℃之间,将溶液中的水分蒸发,少量硫酸亚铁和硫酸锂固体析出后,进行固液分离,得到的液体即为磷酸。
[0048]
实施例
[0049]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。下列实施例中涉及的原料均为常规市购获得。下列实施例中涉及的设备均为本领域常规设备。
[0050]
实施例1
[0051]
(1)称取废旧磷酸铁锂正极片约550g,用小型粉碎机粉碎后,缓慢加入到盛有2.5l浓度为5.0mol/l的naoh溶液的3l烧杯中,搅拌下直至不再有气体生成。过滤后用0.1mol/l的naoh溶液按固液比1:3打浆洗涤两次。过滤后固体用0.1mol/l的naoh溶液按固液比1:3打浆洗涤两次洗涤。
[0052]
(2)固体洗涤烘干后的粉料约506g,加入到含有2.25l浓度为2.0mol/l的硫酸溶液中,水浴下维持温度在50~70℃之间,反应4h后ph值为0.63,抽滤。抽滤后的溶液共计约1.975l,密度为1.31g/ml,滤饼重约277g,按固液比1:3打浆洗涤后固体折干约26g,洗液未与得到的1.975l溶液进行合并。将1.975l溶液约2579g至于90℃水浴下蒸发,减重至1692g,减重率为34.39%,溶液密度为1.58g/ml。将溶液冰浴下冷却至3~5℃之间有大量结晶析出,维持0.5h后抽滤,固体结晶采用约100ml 5℃的冷水淋洗得粗硫酸亚铁结晶约718g,结晶加入约360g纯水在60℃水浴下溶解,完全溶解后再次降温至3~5℃之间维持0.5h后抽滤得绿矾约493g。绿矾检测质量如下:
[0053]
表1:绿矾检测结果
[0054][0055]
(3)将一次蒸发浓缩冷却结晶分离固体后的溶液约705ml,重约966g,密度约1.37g/ml,90℃水浴下二次蒸发浓缩,减重至592g,减重率38.72%,密度1.55g/ml。将溶液冷却至室温后抽滤得到的固体用约50ml温度为90℃的热水进行洗涤,最终得到白色硫酸锂结晶约123g。将得到硫酸锂结晶用750ml水溶解后,用2.0mol/l的氢氧化钠溶液约76ml将溶液ph值调节至9.87,固液分离后,将硫酸锂溶液加入570ml浓度为1.98mol/l的碳酸钠溶液中碳化,维持95℃约1h后抽滤,固体用95℃纯水按固液比1:2打浆洗涤两次,最终得到工业
级碳酸锂约56g。碳化后溶液约1.3l蒸发提浓至600ml,冷却结晶得芒硝约319g。工业级碳酸锂和芒硝检测结果如下:
[0056]
表2:碳酸锂检测结果
[0057][0058]
表3:芒硝检测结果
[0059][0060]
(4)将二次蒸发浓缩分离硫酸锂结晶后的滤液约243ml,重量约378g,密度约1.55g/ml。进行三次蒸发浓缩,蒸发浓缩的温度控制在80~95℃之间,将溶液中的水分蒸发,少量固体析出后,分离得磷酸135ml,密度约1.63g/ml。
[0061]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的替代、修饰、组合、改变、简化等,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1