肝实质细胞及其制备、鉴定与应用方法与流程
本发明涉及肝实质细胞及其制备、鉴定与应用方法。
背景技术:
肝脏在人体内代谢过程中起到重要的作用,包括糖原合成,尿素合成,脂肪代谢调控,以及药物解毒等等。肝脏细胞的损伤包括肝炎,肝癌,肝硬化会对人体生命安全造成极大的危害。要解决这种问题,就要能在体外获得大量肝脏细胞,利用这些细胞进行移植。在各种细胞来源中,人多潜能干细胞(pluripotent stem cells,PSCs),包括人胚胎干细胞(embryonic stem cells,ESC)和人诱导多能性干细胞(induced pluripotent stem cells,iPSC),最具有应用潜力,人胚胎干细胞具有无限增殖的能力和分化的全能性,在合适的条件下可以分化为人体的各种细胞类型(Thomson et al.,Science.1998Nov 6;282(5391):1145-7),是治疗各种退行性疾病的较好的供体细胞来源。另外,考虑到肝脏毒性是新药设计和检测中最重要的问题之一,大量的肝实质细胞来源可以极大推动建立新的药物的筛选策略。
经过十多年来的研究,目前人们在诱导人多潜能干细胞向肝实质细胞分化方面已经取得一定的进展。2007年我们在诱导人干细胞向肝脏细胞分化方面获得了较大的突破(Cai et al.,Hepatology.2007May;45(5):1229-39)。我们首先将整个的分化过程按照体内发育的模式划成几个阶段。首先利用Activin A有效的将胚胎干细胞诱导成内胚层细胞。然后参照体内发育的信号通路,激活FGF和BMP两条信号通路,促使内胚层细胞转变为早期肝母细胞。然后通过HGF的刺激促进肝母细胞的进一步分化,最后利用OSM和Dexamethasone促进肝实质细胞的成熟。这样逐步诱导的方案可以非常高效的产生肝实质细胞,得到的肝脏细胞占全体诱导物的70%左右。并且,这些人胚胎干细胞来源的细胞表达肝脏特异的标志基因和参与肝脏代谢功能的酶,能够分泌白蛋白,储存糖原,吸收并代谢吲哚花青绿,分泌低密度脂蛋白,并且能被HCV假病毒感染。移植试验发现人胚胎干细胞来源的肝脏细胞可以在免疫缺陷型的小鼠肝内维持至少两周。这些实验证明人胚胎干细胞可以高效率的分化成具有一定功能的肝脏实质细胞,将胚胎干细胞向肝脏细胞的分化推向了一个新的高度。随后,我们还进一步证明该分化方案也可以适用于人诱导多能性干细胞向肝实质细胞分化(Song et al.,Cell Research 2009Nov;19(11):1233-42)。最近,其他的实验组也报道了高效分化人多潜能干细胞得到肝脏细胞的实验方案。Stephen A.Duncan,Ludovic Vallier和Ian Wilmu等小组利用类似的分步诱导方法都得到了分泌白蛋白的肝脏细胞,并且能初步的检测到成熟肝细胞表达细胞色素P450酶。此外,Hesham Basma等人利用肝细胞表面特异标志ASGPR分选纯化从人ESC分化的来的肝细胞并移植到小鼠体内能看到明显的人源细胞重建小鼠肝脏并分泌人源的白蛋白。
尽管人多潜能干细胞向肝实质细胞的分化已经取得了一些进展,但是,目前经分化获得的肝实质细胞仍然不完备,需要进一步优化,促进人多潜能干细胞分化得到的肝脏细胞最终成熟,使得人多潜能干细胞来源的肝实质细胞真正的具有可用性。尽管如前所述,分化得到的肝实质细胞已经表达了大量的功能基因,但是如果与原代分离的人成体肝实质细胞相比,还有一定的差异:首先是白蛋白的分泌量始终不能达到成体肝脏的水平,甚至是有数量级上的差别。其次,成体肝脏的功能非常复杂,从解毒功能来说,肝脏表达上百种不同亚型的解毒酶,具有第一相和第二相的代谢。目前还没有证明在哪一种分化条件下得到的肝实质细胞具有这些完整的解毒功能。再次,在适合的模型之下,人成体肝脏细胞可以高效率的整合到小鼠肝内形成人源化肝脏,目前整合效率已经超过80%。但是在分化细胞的肝脏移植实验中,目前只能在个别小鼠内检测到个别人源细胞的整合,效率十分低下。
因此,迫切需要一种新的分化方案,将人多潜能干细胞分化成为更成熟、具有更多功能的肝实质细胞,以满足研究和临床应用中对该细胞的需求。同时,也需要寻找到一种有效的鉴定方法,可以区分这些较成熟的肝实质细胞和那些不具有解毒活性、白蛋白分泌量较低的肝细胞,以便于在研究和临床应用对该细胞进行检测和鉴定。
技术实现要素:
本发明的目的是提供一种肝实质细胞及其制备、鉴定与应用方法。
本发明涉及以下多个方面:
1、制备肝实质细胞的方法,包括如下步骤:
1)将多潜能干细胞培养获得内胚层细胞;
2)将获自步骤1)的内胚层细胞培养获得原始肠管细胞;
3)将获自步骤2)的原始肠管细胞培养获得成肝细胞;
其特征在于:将获自步骤2)的细胞进行传代,并转入到在含有成纤维细胞生长因子(FGF)和骨形态形成蛋白(BMP)的肝细胞诱导培养基I中培养,获得成肝细胞;
4)将获自步骤3)的成肝细胞培养获得成熟的肝实质细胞,
其中所述多潜能干细胞为从商业途径获得的胚胎干细胞或诱导形成的多潜能干细胞。
上述步骤中的1)、4)可以参考本发明的具体公开并结合现有技术(例如背景技术中描述的那些)的教导容易地实施。
2、根据1所述的方法,其中所述步骤2)包括:将获自步骤1)的细胞转入到含有成纤维细胞生长因子(FGF)和转化生长因子(TGF-b)信号通路的小分子抑制剂的原始肠管诱导培养基中进行培养,从而获得原始肠管细胞。
3、根据1或2所述的方法,其中所述原始肠管诱导培养基包含成纤维细胞生长因子-7和转化生长因子信号通路的小分子抑制剂SB431542;其中所述肝细胞诱导培养基I包含成纤维细胞生长因子-7,骨成型蛋白-2和骨成型蛋白-4。
4、根据1-3中任一项所述的方法,其中在步骤3)中进一步包括检测所获得的成肝细胞的PROX1和HNF6的表达,优选地产生共表达HNF4A和PROX1的成肝细胞的效率大于60%。
5、根据1-4中任一项所述的方法,其中所述多潜能干细胞为从商业途径获得的胚胎干细胞或诱导形成的多潜能干细胞,优选是哺乳动物细胞,更优选为小鼠或人细胞,最优选人细胞,其中,所述从商业途径获得的胚胎干细胞优选为下述任一种细胞系:BG01,BG02,BG03,BG04,SA01,SA02,SA03,ES01,ES02,ES03,ES04,ES05,ES06,TE03,TE32,TE33,TE04,TE06,TE62,TE07,TE72,UC01,UC06,WA01,WA07,WA09,WA13和WA14;所述编号为NIH的编号。
6、根据1-5中任一项所述的方法获得的肝实质细胞。
7、根据6所述的肝实质细胞,所述细胞分泌白蛋白,所分泌的白蛋白水平达到人原代成体肝实质细胞分泌白蛋白的水平,优选地,所述细胞还具有选自合成尿素、储存糖原、产生细胞色素P450酶,进行一相、二相代谢,三相转运中的一项或多项功能。
8、根据6或7中所述的肝实质细胞在制备人工肝脏、药物代谢研究、药物的毒性测试或药物筛选中的应用。
9、由多潜能干细胞制备原始肠管细胞的培养基,所述培养基为含有成纤维细胞生长因子(FGF)和转化生长因子(TGF-b)信号通路的小分子抑制剂的原始肠管诱导培养基,优选地所述原始肠管诱导培养基包含成纤维细胞生长因子-7和转化生长因子信号通路的小分子抑制剂SB431542。
10、由多潜能干细胞制备肝实质细胞的培养基,所述培养基为含有成纤维细胞生长因子(FGF)和骨形态形成蛋白(BMP)的肝细胞诱导培养基I,优选地所述肝细胞诱导培养基I包含成纤维细胞生长因子-7,骨成型蛋白-2和骨成型蛋白-4。
11、鉴定具有代谢功能的肝实质细胞的方法,其特征在于所述方法包括检测PROX1或HNF6在肝实质细胞中的表达的步骤。在本发明这一方面的一个实施方案中,可以使用CYP酶的荧光底物DBOMF对肝实质细胞进行标记。
12、PROX1或HNF6在制备用于鉴定具有代谢功能的肝实质细胞的试剂盒中的应用。在本发明这一方面的一个实施方案中,所述试剂盒中可以包括CYP酶的荧光底物DBOMF,其用于对肝实质细胞进行标记。
13、鉴定具有代谢功能的肝实质细胞的方法,其特征在于使用CYP酶的荧光底物DBOMF对肝实质细胞进行标记。
14、CYP酶的荧光底物DBOMF在制备用于鉴定具有代谢功能的肝实质细胞的试剂盒中的应用。
本发明的各个方面及其优点进一步如下详述。
本发明所提供的肝实质细胞,优选地是由人多潜能干细胞(人PSC),包括从商业途径获得的人胚胎干细胞(人ESC)或人诱导的多潜能干细胞(人iPSC)分化获得的,分泌较高含量的白蛋白,并具有合成尿素、储存糖原、产生细胞色素P450酶,进行一相、二相代谢,三相转运等功能。
本发明制备肝实质细胞的方法可以包括以下示例性步骤:
1)将人多潜能干细胞在内胚层诱导培养基I上培养;
2)步骤1)获得的细胞在内胚层诱导培养基II上培养;
3)步骤2)获得的细胞在内胚层诱导培养基III上培养,获得内胚层细胞;
4)步骤3)获得的内胚层细胞在原始肠管诱导培养基上培养,获得原始肠管细胞;
5)对步骤4)获得的原始肠管细胞进行传代,在肝细胞诱导培养基I上进行培养;
6)步骤5)获得的细胞在肝细胞诱导培养基II上培养;
7)步骤6)获得的细胞在肝细胞诱导培养基III上培养,获得肝实质细胞。
所述内胚层诱导培养基I为含有质量百分含量0.01%-1%的牛血清白蛋白组分V和5-500ng/ml人活化素-A的基础细胞培养基;其中,牛血清白蛋白组分V的含量优选为0.05%;人活化素-A的含量优选为100ng/ml;
所述内胚层诱导培养基II为含有质量百分含量0.01%-1%的牛血清白蛋白组分V,体积百分含量0.1%-10%的胰岛素—转铁蛋白—亚硒酸钠混合补充液和5-500ng/ml人活化素-A的基础细胞培养基;其中,牛血清白蛋白组分V的含量优选为0.05%;人活化素-A的含量优选为100ng/ml;胰岛素—转铁蛋白—亚硒酸钠混合补充液的含量优选为0.1%;
所述内胚层诱导培养基III为含有质量百分含量0.01%-1%的牛血清白蛋白组分V,体积百分含量0.1%-10%的胰岛素—转铁蛋白—亚硒酸钠混合补充液和5-500ng/ml人活化素-A的基础细胞培养基;其中,牛血清白蛋白组分V的含量优选为0.05%;人活化素-A的含量优选为100ng/ml;胰岛素—转铁蛋白—亚硒酸钠混合补充液的含量优选为1%;
所述原始肠管诱导培养基为含有1-100ng/ml人成纤维细胞生长因子-7,1-100mM SB431542,质量百分含量0.01%-1%的牛血清白蛋白组分V和体积百分含量0.1%-10%的胰岛素—转铁蛋白—亚硒酸钠混合补充液的基础细胞培养基;其中,人成纤维细胞生长因子-7的含量优选为20ng/ml;SB431542的含量优选为10mM;牛血清白蛋白组分V的含量优选为0.05%;胰岛素—转铁蛋白—亚硒酸钠混合补充液的含量优选为1%;
所述肝细胞诱导培养基I为含有1-100ng/ml人成纤维细胞生长因子-7,1-100ng/ml人骨成型蛋白-2,2-200ng/ml人骨成型蛋白-4和体积百分含量0.1-10%B27补充液的基础细胞培养基;其中,人成纤维细胞生长因子-7的含量优选为20ng/ml;人骨成型蛋白-2的含量优选为20ng/ml;人骨成型蛋白-4的含量优选为50ng/ml;B27补充液的含量优选为1%。
所述肝细胞诱导培养基II为含有1-100ng/ml人肝细胞生长因子,2-200ng/ml人骨成型蛋白-4和体积百分含量0.1-10%B27补充液的基础细胞培养基;其中人肝细胞生长因子的含量优选为20ng/ml;人骨成型蛋白-4的含量优选为50ng/ml;B27补充液的含量优选为1%。
所述肝细胞诱导培养基III为含有1-100ng/ml人抑瘤素-M和0.01-10μM地塞米松的肝细胞培养基;其中人抑瘤素-M的含量优选为10ng/ml;地塞米松的含量优选为0.1μM。
上述内胚层诱导培养基I、内胚层诱导培养基II、内胚层诱导培养基III、原始肠管诱导培养基、肝细胞诱导培养基I、肝细胞诱导培养基II、肝细胞诱导培养基III的pH均可为培养哺乳动物细胞的常规pH,如pH7.2-7.6.
所述基础细胞培养基可为MEM、DMEM、BME、DMEM/F12、RPMI1640、William E或Fischers培养基。
所述方法中,人胚胎干细胞或诱导的多潜能干细胞在内胚层诱导培养基I中培养1-3天,优选为1天;步骤1)获得的细胞在内胚层诱导培养基II中培养1-3天,优选为1天;步骤2)获得的细胞在内胚层诱导培养基III中培养1-3天,优选为1天;步骤3)获得的内胚层细胞在原始肠管培养基中培养1-5天,优选为2天;步骤4)获得的原始肠管细胞经传代后,在肝细胞诱导培养基I中培养3-8天,优选为5天;步骤5)获得的细胞在肝细胞诱导培养基II上培养3-8天,优选为5天;步骤6)获得的细胞在肝细胞诱导培养基III上培养3-8天,优选为5天,获得肝实质细胞。
所述方法中,还包括将原始肠管细胞进行传代的步骤,原始肠管细胞的传代方法为将所述原始肠管细胞用Accutase消化液(美国Millipore公司)或胰酶-EDTA消化液(美国Invitrogen公司)消化,然后肝细胞培养基I上培养。
由上述内胚层诱导培养基I、上述内胚层诱导培养基II、上述内胚层诱导培养基III、上述原始肠管培养基、上述肝细胞诱导培养基I、上述肝细胞诱导培养基II和上述肝细胞诱导培养基III组成的用于由人胚胎干细胞或诱导的多潜能干细胞制备肝实质细胞的培养基也属于本发明的保护范围。
使用本文发明获得的人肝实质细胞具有很好的细胞色素P450酶活性,能够进行肝一相、二相代谢和三相转运,功能上优于以往通过其他方案分化得到的肝细胞。通过对获得的肝实质细胞进行鉴定分析,发现我们获得的细胞不仅仅在细胞色素P450活性以及白蛋白分泌等功能上优于以往的肝细胞,更重要的是在基因表达上,表达了以往通过其他方案获得的肝细胞所不表达的关键转录因子PROX1以及HNF6,从而导致了功能上的显著提高。
附图说明
图1为肝实质细胞的制备过程示意图。
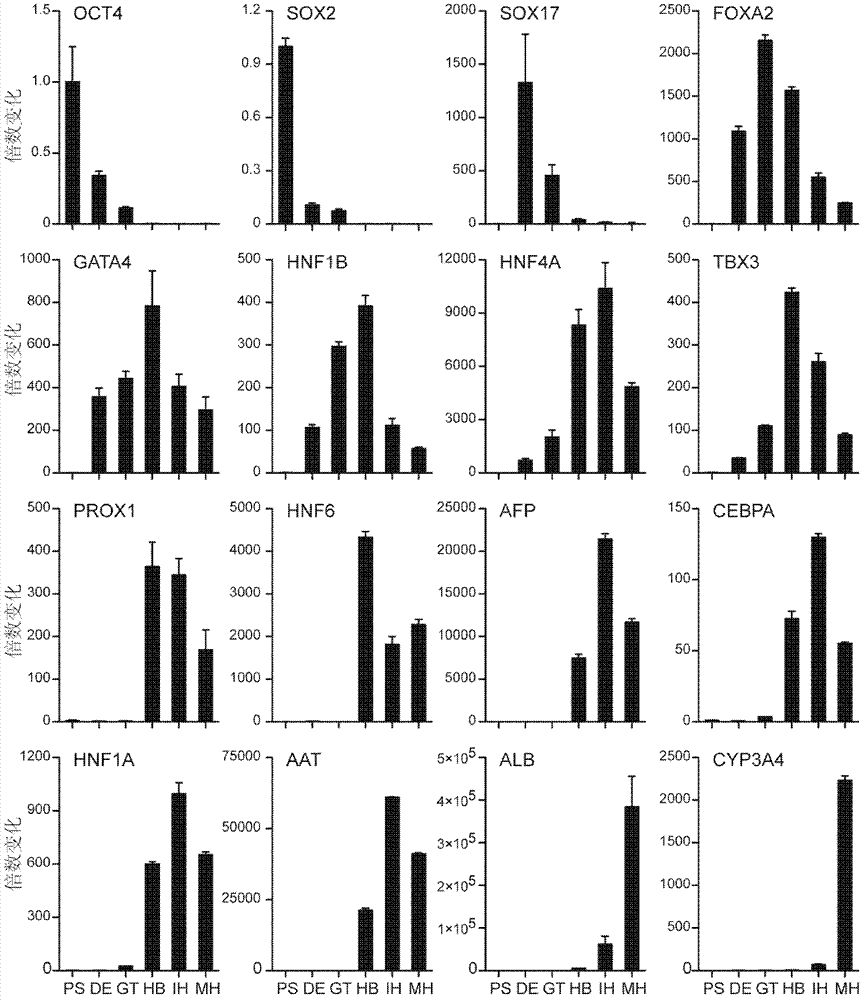
图2为制备肝实质细胞过程中关键基因的表达动态。
图3为第一阶段结束后,免疫荧光显示分化获得的细胞表达胚内内胚层标志基因SOX17、FOXA2和GATA4,但是不表达原始内胚层标志基因AFP,说明人多潜能干细胞已经分化为胚内内胚层细胞。
图4为第二阶段结束后,免疫荧光显示分化的细胞开始表达原始肠管标志转录因子HNF1B和HNF4A,同时维持着内胚层标志基因SOX17的表达。
图5为第三阶段结束后,免疫荧光显示有一群AFP阳性的细胞群出现,并且这些细胞同时表达HNF4A、HNF6、PROX1和TBX3。
图6为定量PCR结果。显示与第5天分化的细胞(d5)相比,在第6天是否进行传代处理(R)以及在第6-10天分化过程中是否加入细胞因子(F)后,关键基因表达的状况。
图7为流式细胞计数法分析分化到第10天后,PROX1和HNF4A双阳性的细胞比例。未分化的干细胞(day 0)作为阴性对照。
图8为第四阶段结束后,免疫荧光显示细胞群共表达AFP、PROX1、HNF6和HNF4A。在该阶段,细胞群也开始表达CEBPA和HNF1A,说明分化的细胞进一步向肝细胞命运特化。
图9为制备得到的肝实质细胞中含有小油滴。红色为小油滴被油红O特异着色。绿色为免疫荧光显示的CYP3A4的表达。可以发现,CYP3A4表达的区域和油红O着色的区域一致。
图10为制备得到的肝实质细胞中各种关键转录因子的表达情况。绿色为CYP3A4的染色,标识肝实质细胞,红色为转录因子的染色。
图11为CYP3A4、CYP1A2、ALB及AAT的免疫荧光染色。分化的细胞中大多数的区域共表达ALB和CYP3A4,以及CYP1A2,显示了高分化效率。同时,这些细胞还表达成熟功能基因AAT。
图12为流式细胞分析显示制备得到肝实质细胞的效率。分化得到的肝实质细胞表达特异的表面标志ASGPR。同时,还能够将CYP3A4的底物DBOMF代谢成为绿色荧光产物。
图13为荧光显微镜下确认制备得到的肝实质细胞将CYP3A4的底物DBOMF代谢成为绿色荧光产物。这个代谢过程可以被CYP3A4的特异抑制剂Ketoconazole(KC)所阻断。
图14为酶联免疫法检测白蛋白(ALB)和α-抗胰蛋白酶的分泌。hPS,人多潜能干细胞;F+R-,经过细胞因子诱导但未经过传代处理获得的分化细胞;F+R+,经过细胞因子诱导且经过传代处理获得的分化细胞;25w FL,25周胎肝细胞;AH,成体原代肝实质细胞。
图15为制备的肝实质细胞的功能检测。左图为PAS染色实验;右图为吲哚菁绿吸收实验。
图16为在移植后的小鼠中检测人白蛋白含量。
图17为色质联用分析获得的肝实质细胞进行一相和二相代谢的能力。
图18为在制备的肝实质细胞中典型药物对细胞色素P450酶抑制曲线。上图,Furafylline抑制CYP1A2的曲线;下图,Ketoconazole抑制CYP3A4的曲线。
图19为制备的肝实质细胞的三相转运活性检测。绿色荧光显示,小分子CLF(上图)或者CDF(下图)添加到培养基中之后,经过酯酶切割,形成荧光产物,特异地分泌到肝细胞周围胆小管结构中。
图20为利用本发明之前已报道的方式获得的肝细胞中一相代谢酶CYP3A4以及转录因子PROX1和HNF6的表达情况。其中A-C图显示的是在分化过程中成肝细胞阶段,D图和E图显示的是在终末肝实质细胞阶段。注意少量CYP3A4阳性的细胞均局限在PROX1或者HNF6表达的细胞团中。
图21为用shRNA干涉HNF6(A图下行)或者PROX1(B图下行)的表达时,免疫荧光显示代谢酶CYP3A4的表达也随之下调。干涉绿色荧光蛋白(EGFP)的实验(A图和B图的上行)作为对照。
图22为用shRNA干涉HNF6或者PROX1的表达时,定量PCR分析显示代谢酶CYP3A4和ALB的表达也随之下调,但HNF4A的表达不受影响。干涉绿色荧光蛋白(EGFP)的实验作为对照。
图23为用人诱导的多潜能干细胞制备得到的肝实质的免疫荧光检测,显示代谢酶CYP3A4与转录因子PROX1或者HNF6共表达。
具体实施方式
下述实施例中如无特殊说明所用方法均为常规方法,所用试剂均可从商业途径获得。其中,牛血清白蛋白组分V(美国Calbiochem公司,126579),人活化素-A(Activin A,美国Peprotech公司,120-14E),胰岛素—转铁蛋白—亚硒酸钠混合补充液(美国Invitrogen公司,51300-044),B27补充液(美国Invitrogen公司,12587-010),肝细胞培养基HCM(美国Lonza公司,CC-3198),人成纤维细胞生长因子-7(FGF7,美国Peprotech公司,100-19),SB431542(美国tocris公司,1614),人骨成型蛋白-2(BMP2,美国Peprotech公司,120-02),人骨成型蛋白-4(BMP4,美国R&D systems公司,314-BP),人肝细胞生长因子(HGF,美国Peprotech公司,100-39),人抑瘤素-M(OSM,美国R&D systems公司,295-OM),地塞米松(Dexamethasone,美国Sigma-Aldrich公司,D8893)。DBOMF购自Invitrogen公司,商品号:P2979或者P2974)
实施例中的图1-22为由人胚胎干细胞系H1(NIH的编号为WA01)获得的相应细胞,图23为由人诱导的多潜能干细胞(3U1,参考文献Song et al.,Cell Research,2009)获得的相应细胞,分别由人胚胎干细胞系H7(NIH的编号为WA07)、人胚胎干细胞系H9(NIH的编号为WA09)和其他人诱导的多潜能干细胞(人iPSC)获得的相应细胞与图9-19基本相同,没有实质差别。
一、肝实质细胞的获得
分化步骤可以分为五步,参照图1。
第一步(第1-3天):人多能性干细胞分化为内胚层细胞
第1天:
人胚胎干细胞H1、H7或者H9传代后2-3天开始诱导,选择生长状态好的细胞进行分化实验;
弃去人胚胎干细胞培养基(为基础细胞培养基DMEM/F12中添加20%血清替代物(Knock-out Serum Replacement,KSR,美国Invitrogen公司,10828028),1%GlutaMAX(美国Invitroge公司,35050-061),0.1mMβ-巯基乙醇(美国Invitrogen公司,21985-023),1%非必需氨基酸(Non-essential Amino Acids)(美国Invitrogen公司,11140-076),4ng/mL碱性成纤维细胞生长因子(bFGF,美国Peprotech公司,100-18B)),用PBS洗2遍;
换上内胚层诱导培养基I。内胚层诱导培养基I是在1640培养基中加入牛血清白蛋白组分V(美国Calbiochem公司,126579)和人活化素-A(Activin A,美国Peprotech公司,120-14E)得到的培养基。该培养基的pH7.2-7.6。内胚层诱导培养基I中,牛血清白蛋白组分V的终浓度为0.05%(质量百分含量)、人活化素-A(Activin A)的终浓度为100ng/ml。
第2天:
弃去昨天的培养基,换上内胚层诱导培养基II。内胚层诱导培养基II为在1640培养基中加入牛血清白蛋白组分V(美国Calbiochem公司,126579)、人活化素-A(Activin A)和胰岛素—转铁蛋白—亚硒酸钠混合补充液(美国Invitrogen公司,51300-044)得到的培养基。该培养基的pH7.2-7.6。内胚层诱导培养基II中,牛血清白蛋白组分V的终浓度为0.05%(质量百分含量)、人活化素-A(Activin A)的终浓度为100ng/ml、胰岛素—转铁蛋白—亚硒酸钠混合补充液的终浓度为0.1%(体积百分含量)。
第3天:
弃去昨天的培养基,换上内胚层诱导培养基III。内胚层诱导培养基III为在1640培养基中加入牛血清白蛋白组分V、人活化素-A(Activin A)和胰岛素—转铁蛋白—亚硒酸钠混合补充液(美国Invitrogen公司,51300-044)得到的培养基。该培养基的pH7.2-7.6。内胚层诱导培养基III中,牛血清白蛋白组分V的终浓度为0.05%(质量百分含量)、人活化素-A(Activin A)的终浓度为100ng/ml、胰岛素—转铁蛋白—亚硒酸钠混合补充液的终浓度为1%(体积百分含量)。
第二步(第4-5天):内胚层细胞分化为原始肠管细胞
第4天:
弃昨日的培养基,PBS洗三遍。换上原始肠管培养基。原始肠管培养基为在1640培养基中加入牛血清白蛋白组分V、人成纤维细胞生长因子-7(FGF7,美国Peprotech公司,100-19)、SB431542(美国tocris公司,1614)和胰岛素—转铁蛋白—亚硒酸钠混合补充液(美国Invitrogen公司,51300-044)得到的培养基。该培养基的pH7.2-7.6。原始肠管培养基中,牛血清白蛋白组分V的终浓度为0.05%(质量百分含量),人成纤维细胞生长因子-7的终浓度为20ng/ml、SB431542的终浓度为10mM,胰岛素—转铁蛋白—亚硒酸钠混合补充液的终浓度为1%(体积百分含量)。
第5天:
弃昨日的培养基,换上原始肠管培养基。
第三步(第6-10天):原始肠管细胞分化为成肝细胞
第6天:
准备Matrigel包被的培养皿:将Matrigel(美国BD公司,354230)在冰上融化,按1:33在冰预冷的DMEM/F12培养基中稀释,加入到培养皿中,量以充分没过培养皿为宜。37度孵育60分钟后弃去培养基,备用。
分化的细胞:弃昨日培养基,PBS洗一遍;用Accutase酶(美国Millipore公司,SCR005)进行消化,37度孵育5分钟后,用含有血清的培养基进行终止。将细胞轻轻吹散成为单细胞。1200转离心3分钟收集细胞,弃去上清,用肝细胞诱导培养基I重悬,并计数。
按每ml培养基含有2×105细胞数,在用Matrigel包被过的培养皿中用肝细胞诱导培养基I进行培养。
肝细胞诱导培养基I为在DMEM/F12培养基中加入B27补充液(美国Invitrogen公司,12587-010),GlutaMAX,非必须氨基酸,b-巯基乙醇,人成纤维细胞生长因子-7,人骨成型蛋白-2,人骨成型蛋白-4得到的培养基。该培养基的pH7.2-7.6。肝细胞诱导培养基I中,B27补充液的终浓度为1%(体积百分含量);人成纤维细胞生长因子-7的终浓度为20ng/ml;人骨成型蛋白-2的终浓度为20ng/ml;人骨成型蛋白-4的终浓度为50ng/ml;β-巯基乙醇的终浓度为0.1mM;非必需氨基酸的终浓度为1%(体积百分含量);GlutaMAX的终浓度为1%(体积百分含量)。
第7-10天每两天重复如下步骤:
弃昨日的培养基,PBS洗一遍;
换上肝细胞诱导培养基I,进行培养。
第四步(第11-15天):成肝细胞分化为不成熟的肝实质细胞
第11-15天每两天重复如下步骤:
弃昨日的培养基,PBS洗一遍;
换上肝细胞诱导培养基II,进行培养。肝细胞诱导培养基II为在DMEM/F12培养基中加入B27补充液(美国Invitrogen公司,12587-010),GlutaMAX,非必须氨基酸,b-巯基乙醇,人肝细胞生长因子,人骨成型蛋白-4得到的培养基。该培养基的pH7.2-7.6。肝细胞诱导培养基II中,B27补充液的终浓度为1%(体积百分含量);人肝细胞生长因子的终浓度为20ng/ml;人骨成型蛋白-4的终浓度为50ng/ml;β-巯基乙醇的终浓度为0.1mM;非必需氨基酸的终浓度为1%(体积百分含量);GlutaMAX的终浓度为1%(体积百分含量)。
第五步(第16-20天):不成熟的肝实质细胞进一步分化为成熟肝实质细胞
第16-20天每天重复如下步骤:
弃昨日的培养基,PBS洗一遍;
换上肝细胞诱导培养基III,进行培养。肝细胞诱导培养基II为在肝细胞培养基HCM(美国Lonza公司,CC-3198)中加入人抑瘤素-M和地塞米松得到的培养基。肝细胞诱导培养基III中,人抑瘤素-M的终浓度为10ng/ml;地塞米松的终浓度为0.1μM。
二、肝实质细胞分化过程中分化效率及细胞性质的鉴定
我们对分化过程中产生的细胞进行了基因表达的鉴定(图2)。干性基因OCT4和SOX2在胚胎干细胞中高表达,分化开始后则迅速下降,到成肝细胞形成及以后阶段则检测不到基因的表达。SOX17、FOXA2和GATA4从内胚层阶段开始高表达。HNF1B和HNF4A在原始肠管阶段有显著的上调。而成肝细胞阶段,AFP、PROX1、HNF6和TBX3的高表达则标志着细胞已经向肝脏谱系特化。在未成熟的肝实质细胞阶段,CEBPA和HNF1A的上调显示细胞进一步的成熟。在终末阶段,细胞高表达成熟的功能基因AAT、ALB和CYP3A4,说明细胞最终分化为成熟的肝实质细胞。
下面我们对分化过程中的每一步进行具体分析:
人胚胎干细胞首先分化成为内胚层细胞。在加入活化素-A之后,SOX17的表达迅速上调,同时人胚胎干细胞的标志基因OCT4和SOX2的表达显著下降(图2、图3)。然后,内胚层细胞通过成纤维细胞生长因子-7和Activin/TGF-b信号通路的抑制剂SB431542的联合作用,分化成为表达HNF1B和HNF4A的原始肠管细胞。在成纤维细胞生长因子-7和SB431542作用两天之后,HNF1B和HNF4A在mRNA和蛋白水平的表达均明显的上调了(图2、图4)。
在第三阶段,原始肠管细胞向肝脏谱系进行特化。在以前的报道中,通常通过调节BMP和FGF信号通路进行肝脏命运的特化。在本研究中,为了获得分化完全的成肝细胞,我们创新性的以PROX1和HNF6为标志,在分化培养基、生长因子等等方面进行尝试,最终确定最优条件为将肠管细胞按照2×105/毫升密度重铺在Matrigel包被的培养皿上,并加入人成纤维细胞生长因子-7、人骨成型蛋白-2和人骨成型蛋白-4并培养5天。在这样的条件下,出现了一群表达PROX1和HNF6的成肝细胞。这些细胞同时也表达AFP和HNF4A(图5)。通过定量PCR分析,我们发现只有在诱导信号(添加生长因子)和传代过程同时存在的情况下,才能有效的诱导PROX1和HNF6的表达(图6)。这说明,传代的过程模拟了体内诱导PROX1和HNF6的信号,并与BMP以及FGF信号通路平行作用,一同诱导了成肝细胞的产生。为了进一步鉴定这些表达PROX1和HNF6的成肝细胞,我们还检测了其他一些在成肝细胞命运决定过程中起到重要作用的转录因子。定量PCR和免疫荧光的结果显示,成肝细胞克隆中大多数的细胞还表达TBX3、FOXA2以及GATA4(图1和图6)。以上这些结果共同说明,我们在体外由干细胞分化得到的成肝细胞与体内的成肝细胞非常类似。通过胞内流式技术进行分析,在整个分化体系中,产生共表达HNF4A和PROX1的成肝细胞的效率约为63.7%(图7)。
在第四阶段,成肝细胞继续在含有肝细胞生长因子和人骨成型蛋白-4的培养基中进行培养,从而进一步向肝实质细胞命运特化。这些成肝细胞克隆扩增,并维持HNF4A、PROX1和HNF6的表达。经过了肝细胞生长因子的刺激,它们还开始表达肝实质细胞标志基因CEBPA和HNF1A(图1和图8)。除了CEBPA以及HNF1A的出现,HNF4A和ALB的表达也持续的上升了(图1),说明这些细胞进一步向肝实质细胞命运进行了特化。
在最终阶段,我们将分化培养基转换为肝细胞诱导培养基III,不仅其基础的肝实质细胞培养基HCM更适合成熟细胞的生长,而且还含有成熟因子人抑瘤素-M以及地塞米松。诱导5天之后,分化的细胞克隆变得扁平,并且一些细胞中含有了小油滴(图9)。我们进一步检测了肝脏转录因子和功能基因的表达。在分化的末期,肝细胞群中广泛的区域能检测到转录因子PROX1、HNF6、HNF1A、CEBPA、HNF4A、FOXA2、HNF1B和CEBPB的表达,并且与肝实质细胞标志基因CYP3A4共染;而TBX3和GATA4的表达则明显的下调了(图10)。这些结果与体内正常肝实质细胞的发育过程相吻合。更进一步,大多数的分化细胞表达ALB的同时还共表达CYP3A4、CYP1A2以及AAT(图11)。流式细胞计数分析的结果表明,大约有70%的细胞在表达成熟肝实质细胞的表面标记分子ASGPR的同时还能够将CYP3A4的底物DBOMF代谢成荧光产物(图12)。我们还用免疫荧光观察确认了代谢DBOMF的结果,并且,这个代谢过程是可以被CYP3A4的特异抑制剂ketoconazole所阻断的(图13)。
三、分化获得的肝实质细胞的功能
为了说明在本发明中通过分化获得的肝实质细胞具有正常肝实质细胞的功能,我们进了一系列的功能检测。通过酶联免疫法我们发现,分化得到的肝实质细胞分泌高量的白蛋白ALB以及α-抗胰蛋白酶AAT(图14)。分泌白蛋白的水平达到了15.9±2.8微克每毫克总蛋白每天,和人原代成体肝实质细胞的结果类似,并显著高于人25周胎肝细胞的水平。如果不标准化到总蛋白含量上,白蛋白在培养基中的含量高达5.1±0.9微克每毫升每天,高于报道中分化细胞分泌白蛋白能达到的水平。α-抗胰蛋白酶的分泌量水平也可以和成体肝实质细胞的分泌水平类似。另外,我们还通过油红O的染色证明分化的表达CYP3A4的肝实质细胞中含有小油滴(图9);通过PAS染色证明这些细胞能够储存糖原;通过与吲哚菁绿共孵育的实验证明这些细胞具有吸收这些染料的能力(图15)。将分化细胞注射到新生小鼠肝脏中,4周后我们还能在小鼠血清中检测到人白蛋白的存在,证明了这些细胞还具有整合到肝实质细胞中的能力(图16)。
我们还重点检测了这些细胞所具有的代谢功能。利用亚型特异性的探针和色谱质谱联用分析,我们检测了一相代谢中细胞色素P450单氧化酶的各个亚型以及二相代谢中结合酶的活性,并且用人25周胎肝细胞以及成体肝细胞作为对照(图17)。在人胚胎发育中,CYP3A4、2C9、2E1、UGT和SULT通常在4-9个月中起始表达。在我们分化的肝实质细胞中,尽管CYP3A4、2C9、2E1和二相代谢酶的表达还低于原代成体肝脏,但是高于或类似于胎肝细胞的酶活水平。在人发育过程中CYP2C19以及1A2在胚胎期表达水平极低,在出生后才开始出现。在我们分化的肝实质细胞中,这两个酶都能有一定的活性,而作为对照的25周胎肝细胞则只能检测到较低背景水平的表达。这些结果说明,本发明中分化获得的肝实质细胞与人围产期阶段的肝实质细胞类似。
为了评价分化获得的肝实质细胞是否能够用于药物相互作用的研究,我们进一步利用CYP3A4经典抑制剂Ketoconazole以及CYP1A2的经典抑制剂Furafylline进行细胞色素P450酶的抑制实验。我们发现,随着抑制剂剂量的提高,分化得到的肝实质细胞在相同条件下代谢产物的生成逐渐减少,显示出典型的剂量依赖性作用模式(图18)。利用我们分化获得的肝实质细胞进行测定,Ketoconazole的IC50值为0.29μM,Furafylline的IC50值为19μM,这和以前在人成体肝实质细胞中获得的结果类似。因此,这些实验说明本发明中通过分化获得的肝实质细胞可以用于药物代谢研究。
除了一相和二相代谢以外,我们还检测了三相转运活性。我们将小分子CDF(carboxy-dichloro-fluorescein diacetate)或者CLF(cholyl-lysl-fluorescein)加入培养基中,这两种小分子本身不发光,但一旦被肝细胞吸收,就会被肝细胞内的酯酶切割,形成荧光产物,特异地分泌到肝细胞周围胆小管结构中,指示肝脏的转运功能。从图19可以看到,CDF或者CLF的荧光产物均匀的分布在分化细胞的周边,并且只在团块样肝细胞中特异的表达,验证分化得到的肝实质细胞也具有三相转运功能。
四、PROX1和HNF6对获得具有代谢功能的肝实质细胞是至关重要的
在本发明以前,虽然人们也能通过分化获得一些肝实质细胞样的细胞,但是基本都不具备或者只有微弱的代谢功能。我们通过对这些分化细胞进行了详细的检测。我们发现,在以AFP表达为代表的成肝细胞阶段,尽管这些细胞表达了部分成肝细胞的转录因子,如HNF4A、FOXA2、GATA4和GATA6等,但是PROX1和HNF6的表达是缺失的。而且在以往干细胞向肝实质细胞分化的相关文献中,也没有这两个转录因子在分化过程中产生的成肝细胞中表达的报道。在分化终末获得肝实质细胞阶段,这两个转录因子在绝大多数以ALB阳性为代表的肝细胞群中也是缺失的。只有极少数的细胞偶然表达PROX1和HNF6,而且只有这些表达PROX1和HNF6细胞才表达代谢功能基因CYP3A4(图22)。因此,我们认为,在干细胞肝细胞分化的过程中,可以根据PROX1和HNF6的表达与否分为两个细胞群。缺少PROX1和HNF6表达的细胞群在命运特化中是不完全的,在分化终末所产生的功能细胞中也是缺少代谢功能的。
为了进一步证明这两个转录因子在调节细胞色素P450酶出现的重要性,我们还在本发明提出的肝实质细胞制备的过程中进行了PROX1和HNF6基因表达干涉实验(图23)。我们通过慢病毒将针对PROX1或者HNF6的shRNA转导进入分化细胞中,并用定量PCR实验以及免疫荧光实验确认了在转导了相应shRNA的细胞中PROX1或者HNF6表达缺失了。而作为对照,转导了针对绿色荧光蛋白的shRNA的细胞PROX1和HNF6的表达则没有变化。与对照相比,下调了PROX1或HNF6表达的细胞中CYP3A4的mRNA的水平显著下降,抗体也不能够检测到CYP3A4的蛋白的表达,说明这些细胞不能够再分化成为CYP3A4表达的肝实质细胞。而另外一个肝脏细胞的标志基因HNF4A的表达则不受影响。这些结果进一步的确认了PROX1和HNF6在调节肝实质细胞功能成熟中具有重要作用。
- 还没有人留言评论。精彩留言会获得点赞!