MTA1及其抑制剂的制药用途的制作方法
本发明涉及MTA1在制备维持干细胞干性的制剂中的用途以及MTA1的抑制剂在制备预防和/或治疗肿瘤的药物中的用途。
背景技术:
恶性肿瘤是一种严重危害人类健康的疾病。虽然目前肿瘤治疗手段不断更新,但这些治疗手段仍然不能从根本上治疗肿瘤的复发与转移。目前越来越多的证据显示肿瘤实际上是干细胞生长调控机制失调产生的异常组织器官。肿瘤中只有很小一部分细胞群具有自我更新并生成其他肿瘤细胞的能力,而大部分肿瘤细胞在经过有限的增殖后将停止生长。这一小部分具有自我更新能力并生成其他肿瘤细胞的细胞群称为肿瘤干细胞。驱动肿瘤体积不断增长的正是肿瘤干细胞,而不是其他肿瘤细胞。MTA1是一个在肿瘤转移过程中表达上调的基因,文献报道认为其表达与肿瘤的转移能力相关。它是Toh等用差异cDNA文库扫描技术从高转移大鼠乳腺腺癌细胞系中发现的,随后用同源方法发现了人的同源MTA1基因。该基因产物是核小体重塑与脱乙酰基复合体(nuclearremodelinganddeacetylationcomplex,NuRD)的成分,通过影响染色质的状态来调控基因转录,可见MTA1能发挥转录调节因子的作用广泛地影响下游基因的表达状态。MTA1过表达在许多人类的肿瘤中与其恶性进程有关。MTA1与肿瘤干细胞的关系以及与在以肿瘤干细胞为靶点的肿瘤治疗策略中的潜在应用价值尚未有报道。
技术实现要素:
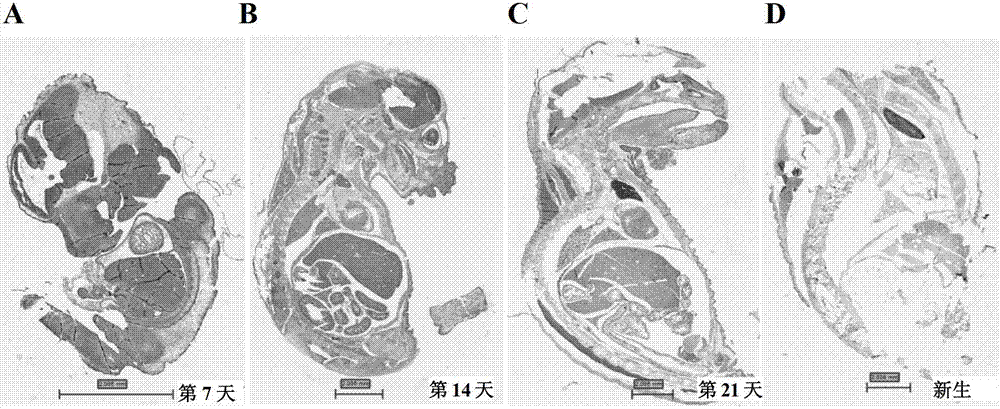
因此,本发明的技术目的在于探究MTA1与肿瘤干细胞的关系以及与在以肿瘤干细胞为靶点的肿瘤治疗策略中的潜在应用价值。因此,本发明的第一方面涉及一种MTA1在制备维持干细胞干性的制剂中的用途。优选地,所述干细胞为胚胎干细胞、成体干细胞或肿瘤干细胞,更优选地,所述肿瘤干细胞为结肠癌干细胞。优选地,所述MTA1为MTA1蛋白或MTA1重组表达载体。优选地,所述维持干细胞干性的制剂可以用于干细胞培养的领域。本发明的第二方面涉及一种MTA1的抑制剂在制备预防和/或治疗肿瘤的药物中的用途。优选地,所述MTA1的抑制剂为特异性抗MTA1的抗体和/或特异性敲降MTA1表达的siRNA和/或特异性降低MTA1表达的化学生物物质。更优选地,所述特异性抗MTA1的抗体为单克隆抗体或多克隆抗体,优选地,所述特异性抗MTA1的抗体为单克隆抗体。更优选地,所述特异性敲降MTA1表达的siRNA的序列如SEQIDNO:3所示。优选地,所述肿瘤为消化道肿瘤、黑色素瘤、妇科肿瘤或乳腺癌,优选地,所述消化道肿瘤为结肠癌。优选地,所述药物的剂型为注射剂或口服剂。换言之,本发明发现了MTA1维持干细胞干性及促进肿瘤干细胞的行为,并且可以是以肿瘤干细胞为靶点的肿瘤治疗策略的分子靶点。本发明发现,MTA1表达水平随胚胎发育的逐步进展而逐渐降低且MTA1可以促进肿瘤干细胞自我更新能力,抑制干细胞分化,维持肿瘤干细胞干性,提高肿瘤干细胞比例从而参与促进肿瘤发生、耐药、复发及侵袭转移等恶性表型,证明了MTA1作为肿瘤干细胞靶点治疗的分子靶点的价值。从这一点而言,任何高表达MTA1蛋白的肿瘤均可以利用MTA1的抑制剂进行预防和治疗。这样的肿瘤包括但不限于消化道肿瘤、黑色素瘤、妇科肿瘤或乳腺癌。利用MTA1可以维持干细胞干性的性质,MTA1蛋白或MTA1重组表达载体可以用于全能干细胞、多能干细胞和专能干细胞的干性维持。其中,MTA1蛋白不仅限于其天然形式,也包括保留了其生物活性的功能片段、修饰体,MTA1重组表达载体并无任何限制,只要能表达出有活性的MTA1蛋白即可,这样的表达载体在本领域是公知的,例如腺病毒表达载体、腺相关病毒表达载体、RNA病毒表达载体等。对于MTA1的抑制,众所周知,在核酸水平抑制靶基因的转录表达和在蛋白质水平中和靶蛋白均可以实现抑制靶蛋白生理功能的目的。因此,任何能降低靶蛋白在生物体内生理功能的化学生物物质均可以用于本发明。这样的化学生物物质包括能敲除或敲降MTA1表达的siRNA。本领域技术人员公知靶基因siRNA的设计方法及制备方法,其中的一条siRNA的序列如SEQIDNO:3所示。特异于MTA1蛋白的抗体可以特异性地中和掉体内的MTA1蛋白,从而实现降低MTA1蛋白生理功能的目的。特异性抗体的制备方法在本领域众所周知,包括天然形式的抗体如单克隆抗体、多克隆抗体,以及改造形式的抗体,如人源化抗体、嵌合抗体、单链抗体等。本领域技术人员公知如何利用siRNA或特异性抗体进行药物制备的方法。此外,利用高通量筛选也可以从化合物库尤其是小分子化合物库中筛选获得特异性抑制MTA1活性或表达的化合物。这样的化合物也落入本发明的范围。综上,本发明发现MTA1可以用于干细胞的干性维持,而其抑制剂可以用于制备治疗肿瘤的药物,从而为肿瘤的治疗开辟了一条新的治疗途径,具有显著的社会效益和经济效益。附图说明图1:GO分析结果显示MTA1相互作用蛋白主要富集于干细胞及肿瘤。图2A-D:依次显示了小鼠胚胎发育第7、14、21天和新生时,利用免疫组化技术获得的MTA1的表达水平示意图。图3A-B:分别显示高分化和低分化肿瘤组织MTA1表达情况。图4A-F:分别显示HCT116亲本、对照及稳定转染MTA1后细胞形态改变情况。图5:一个典型的呈干细胞克隆样生长的MTA1高表达细胞系。图6:在正常培养条件下高表达MTA1基因后细胞上清中呈现干细胞球样生长的细胞球,表明MTA1高表达促进了肿瘤细胞的干性状态图7A-B:干细胞培养基培养条件下从第1天至第8天(A、B图均为从左到右,从上往下排列),HCT116细胞干细胞球生长状态。高表达MTA1基因的细胞成球能力更强(B图),且形成的细胞球更致密。图8:高表达MTA1的HCT116细胞与亲本对照细胞相比,其形成干细胞球数量的定量分析。高表达MTA1的肿瘤细胞形成的数量显著高于亲本细胞。图9:HCT116亲本、对照及MTA1稳定转染后不同接种细胞数量下的成瘤率。图10:HCT116亲本、对照及MTA1稳定转染后在不同顺铂浓度下的细胞形态变化。说明过表达MTA1之后对顺铂具有明显的耐受能力。图11:流式检测不同顺铂浓度下HCT116亲本、对照及MTA1稳定转染后的凋亡细胞比例(水平方向的4幅图对应一组结果),高表达MTA1的细胞对化疗药物诱导的凋亡具有耐受能力,符合干细胞的生物学特性。图12:定量分析显示不同顺铂浓度下HCT116亲本、对照及MTA1稳定转染后凋亡百分率。表明MTA1高表达可提高肿瘤细胞对化疗药物诱导凋亡的耐受能力。图13:HCT116亲本,对照及HCT116+M3顺铂耐药生长曲线。图14A-D:MTA1过表达前后细胞侵袭转移能力比较,其中下部的C、D图是过表达MTA1的结果。图15A-D:利用Duo-link试剂盒证明MTA1与干细胞标志分子NANOG、OCT4和SOX2具有细胞内相互作用,表明其确实参与了干细胞的功能调控。图16A-C:分别显示MTA1敲降及稳定转染后细胞形态变化,其中siMTA1是指MTA1的siRNA,其序列如SEQIDNO:3所示。图17A-B:分别显示MTA1敲降、亲本及稳定转染后细胞的平板克隆形成能力。A图为平板的照片,B图为统计表格。MTA1沉默后细胞的克隆形成能力下降,而MTA1高表达后细胞的克隆形成能力提高。具体实施方式下面将通过下述非限制性实施例进一步说明本发明,本领域技术人员公知,在不背离本发明精神的情况下,可以对本发明做出许多修改,这样的修改也落入本发明的范围。下述实验方法如无特别说明,均为常规方法,所使用的实验材料如无特别说明,均可容易地从商业公司获取。实施例1利用免疫沉淀-质谱技术获得MTA1的相互作用蛋白分别利用鼠源及兔源MTA1抗体拉取相应相互作用蛋白,经浓缩、变性后进行SDS-PAGE电泳分离,将分离后的凝胶分割成5段,分别进行质谱鉴定,获得了一系列与MTA1发生相互作用的蛋白(MTA1蛋白相互作用组),通过对MTA1蛋白相互作用组的GO分析(DAVID数据库6.7,http://david.abcc.ncifcrf.gov/home.jsp,在“TISSUE-EXPRESSION”数据库进行数据分析),本发明发现MTA1的相互作用蛋白在组织特异性上主要富集于干细胞及肿瘤组织中,这提示MTA1可能在干细胞干性的维持上发挥重要作用(图1)。实施例2小鼠胚胎组织验证发现MTA1跟胚胎干细胞干性维持相关分别取受精后第7天、14天、21天的小鼠胚胎及新生胎儿小鼠,固定、石蜡包埋切片后,利用MTA1单克隆抗体进行免疫标记染色,检测MTA1表达量。结果表明,在正常小鼠胚胎发育进程中,从最初的全能干细胞至最终的各组织终末分化细胞进展过程中,干细胞的全能性逐渐降低,直至失去自我更新能力。随着小鼠胚胎的发育,细胞分化程度逐渐升高,MTA1的表达水平逐步降低,至小鼠发育为成熟个体,各组织中MTA1表达水平普遍较低。这一结果说明MTA1表达水平与细胞的干性状态密切相关,可能具有抑制胚胎干细胞的分化的作用,从而可能参与维持肿瘤干细胞的干性状态(图2A-D)。实施例3肿瘤组织中MTA1的表达水平与肿瘤组织分化程度呈负相关使用高密度结肠癌芯片(CO6161,购买于西安艾丽娜生物科技有限公司),利用MTA1单克隆抗体进行标记染色,对结肠癌组织中的MTA1表达水平进行分析,结果显示MTA1蛋白在分化较好的癌组织中表达较低,而在低分化的癌组织中存在高表达(图3A-B)。实施例4细胞水平发现结肠癌肿瘤细胞HCT116中过表达MTA1可抑制肿瘤细胞分化MTA1稳定过表达单克隆细胞系的构建:首先构建逆转录病毒表达载体pMXs-MTA1-flag-IRES-EGFP,该载体构建以质粒pMXs(来自CellBiolabs公司)为基础进行修饰改造。构建过程大致为:利用人MTA1编码序列(NCBI登记号:NM_004689.3)的前50个核苷酸合成探针,然后通过噬菌斑原位杂交筛选人肺噬菌体文库。以获得的27个阳性克隆为混合模板,用带酶切位点的克隆引物进行高保真PCR扩增,上下游引物分别为:MTA1-BamH-UP:5'-AGGATCCATGGCCGCCAACATGTACAG-3'(SEQIDNO:1),MTA1-Flag-DW:5'-GAATTCCTACTTGTCGTCGTCGTCCTTGTAGTCCTCGATGACGATGG-3'(SEQIDNO:2),PCR产物经DNA胶回收试剂盒纯化,并测序鉴定。将纯化的PCR产物及逆转录病毒表达载体pMXs用EcoRI/BamHI进行双酶切,酶切产物纯化后,利用T4DNA连接酶连接12小时以上。将连接产物pMXs-MTA1flag转化感受态细菌JM109,扩大培养后抽提质粒。将得到的质粒和pcDNA–IRES-EGFP(来自北京泛基诺科技有限公司)分别用EcoRI进行酶切,胶回收载体与IRES-EGFP片断,T4DNA连接酶连接,获得pMXs-MTA1flag-IRES-EGFP逆转录病毒表达载体。大量扩增后进行酶切和测序鉴定。将构建好的逆转录病毒表达载体与pVSV-G载体(来自Clontech公司)利用脂质体法共转染293-gag/pol细胞(来自Clontech公司),进行MTA1病毒颗粒包装,将包埋好的病毒颗粒感染HCT116细胞,利用GFP荧光进行单克隆亚细胞系分选并利用Westernblot技术进行鉴定,成功构建了一系列HCT116稳定转染MTA1的单克隆亚细胞系HCT116++M1、HCT116++M3、HCT116++M5、HCT116++M8等等,这些单克隆亚细胞系的MTA1表达水平处于不同表达水平,具体情况为:HCT116++M1<HCT116++M5<HCT116++M8<HCT116++M3。细胞培养过程中发现HCT116++M1、M5、M8(转染MTA1以后的不同细胞克隆)与亲本及空载对照相比,细胞均明显变得圆实,形态学上显示其分化程度明显降低(图4A-F),而HCT116++M3从细胞形态上观察,不如其他稳定转染的细胞系明显,但是在普通完全培养基培养过程中,HCT116++M3贴壁生长的肿瘤细胞有明显趋于聚集成球体生长的趋势(图5)。这些形态学的改变均是MTA1促进肿瘤干细胞干性状态、抑制肿瘤分化的直接证据。而且,甚至在正常培养过程中,其培养上清中往往会漂浮一些悬浮成球生长的肿瘤干细胞球样细胞球(图6),说明MTA1在很大程度上抑制了肿瘤细胞的分化程度。实施例5裸鼠成瘤实验分别将HCT116亲本细胞、HCT116-Vector空载对照细胞及MTA1稳定转染HCT116+M3、HCT116+M5、HCT116+M8亚细胞系按200万/只、100万/只、50万/只、10万/只的细胞数量接种于裸鼠,定期观察出瘤情况。成瘤后取瘤切片,做HE染色,结果证明过表达MTA1后HCT116细胞系分化程度明显降低(数据省略)。实施例6MTA1可以提高肿瘤细胞系中干细胞比例并参与维持其未分化状态研究证明肿瘤干细胞在无血清培养基中可以成球悬浮生长,而普通肿瘤细胞则逐渐死亡。利用肿瘤干细胞悬浮成球生长的特性,本发明检测了HCT116亲本及MTA1过表达后肿瘤干细胞成球比例以及所生成的干细胞球形态。分别将HCT116亲本、对照及HCT116+M3稳定转染细胞系按2万/孔接种于添加生长因子(重组人表皮生长因子EGF及成纤维细胞生长因子bFGF)的无血清DMEM培养基,培养一周左右观察干细胞球成球数量及大小。研究发现,MTA1过表达可以显著抑制肿瘤干细胞球的分化程度,并且可以提高干细胞球的数量(约提高5倍左右)(图7A-B、图8)。实施例7体内验证MTA1促进肿瘤干细胞干性状态的功能裸鼠成瘤实验发现HCT116亲本细胞及空载对照需要50万个细胞才能成瘤,而稳定转染MTA1后的HCT116结肠细胞系(HCT116+/+M5、M8、M3)均仅需要10万个细胞即可成瘤。并且MTA1可以显著提高肿瘤成瘤率,这说明MTA1显著提高了肿瘤细胞系中干细胞的比例和成瘤能力(表1和图9)。表1裸鼠成瘤实验所需的细胞数实施例8肿瘤干细胞是肿瘤耐药及复发转移的根源将接种HCT116亲本及HCT116+M3稳转细胞系按相同细胞数分别接种裸鼠皮下,2个月后检测成瘤小鼠的肿瘤胸壁侵袭情况及肺转移情况。本发明研究发现MTA1可以显著提高肿瘤细胞系HCT116的耐药(图10、11、12、13)及侵袭转移(图14A-D)能力,与MTA1促进肿瘤干细胞干性状态、抑制肿瘤细胞分化的功能相吻合。皮下注射裸鼠致瘤实验中发现,未转染MTA1的HCT116细胞系成瘤局限于皮下,未发现明显的胸腔侵袭和远处转移;而MTA1过表达之后,观察到明显的胸腔侵袭,并伴随着明显的肺转移(图14A-D)。实施例9MTA1有可能通过其辅调节子nanog、oct4、sox2等参与肿瘤干细胞干性维持在HCT116细胞中利用duolink试剂盒(OlinkBioscience公司)按说明书步骤检测MTA1与干细胞相关因子nanog、oct4及sox2的原位相互作用情况。nanog、oct4,sox2是维持细胞干性状态的关键分子,我们的研究中发现MTA1与这几个分子间存在着直接的相互作用(图15A-D),表明MTA1参与了这几个因子对干细胞性质的调控。实施例10MTA1敲降后表现出一定程度的恶性程度减弱的现象HCT116++亲本细胞及过表达细胞往往呈聚集式的生长,可见大量新分裂生成的细胞聚集在一起生长,细胞之间接触紧密,并且可以多层细胞密集生长,MTA1稳定转染后的细胞系表现尤为明显,甚至在正常培养条件下可见漂浮生长的肿瘤细胞球(图6),表现出非常强的肿瘤接触生长的特性。而且在MTA1敲降的细胞系中,细胞往往呈现分散式的生长,并且多层密集生长现象消失,表现出一定的接触抑制表型,当细胞即将铺满培养皿的时候即表现出一定的老化现象(图16A-C),出现大量死亡漂浮的细胞。说明敲降MTA1后细胞系恶性程度明显降低。同时,MTA1敲降后与亲本及过表达相比平板克隆形成能力明显降低(图17A-B)。平板克隆形成实验:将MTA1稳定敲降HCT116细胞系,HCT116亲本,及MTA1过表达稳转细胞系分别按2000/孔接种于六孔板,培养两周左右,经结晶紫染色后观察克隆形成情况。实施例11体内验证MTA1与5-FU耐药的关系分别将稳定敲除细胞系HCT116-sh9,HCT116亲本,及稳定过表达细胞系HCT116+M3接种于NOD/SCID小鼠,成瘤后挑选大小一致的小鼠进行5-氟尿嘧啶耐药实验,给药剂量为40mg/kg,每周两次,定期观察肿瘤生长情况,并计算相应抑瘤率。将MTA1过表达和应用RNA干扰技术(siRNA序列:5’-GAACAUCUACGACAUCUCC-3’(SEQIDNO:3))沉默MTA1表达后的HCT116细胞种植于NOD-SCID鼠。成瘤后,应用化疗药物5-FU进行治疗实验,检测MTA1的存在状态对细胞对5-FU耐药能力的影响。结果发现,过表达后肿瘤细胞耐5-FU能力明显增强,而MTA1表达沉默后肿瘤细胞耐药能力明显减弱。5-FU对不同MTA1表达水平的HCT116细胞克隆株在NOD-SCID鼠移植瘤生长的影响(已换算为抑瘤率)如表2所示。表2:5-FU对不同MTA1表达水平的HCT116细胞克隆株在NOD-SCID鼠移植瘤生长的影响细胞克隆抑瘤率HCT11665.94%HCT116-M3-23.82%HCT116-sh9(9号MTA1沉默克隆)74.87%实施例12体外验证MTA1与顺铂耐药的关系顺铂耐药凋亡率检测实验:将HCT116亲本、对照及稳转细胞系按20万/孔接种于六孔板,分别用流式及倒置显微镜检测0μm、10μm、30μm、60μm下的细胞形态(图10)及凋亡率(图11)。结果显示MTA1过表达后明显提高了细胞的耐受顺铂导致的凋亡能力。顺铂耐药生长曲线实验:分别将HCT116亲本、对照及HCT116+M3稳转细胞系按1万/孔接种于96孔板,MTS法分别检测0μm、20μm、40μm、60μm、80μm顺铂下从第1天到第7天的细胞生长情况,画出细胞生长曲线,并计算其IC50,结果显示HCT116亲本,对照IC50比较接近约在36μm,而HCT116+M3稳转细胞系IC50提高了约1.6倍,说明MTA1明显提高了细胞的顺铂耐药能力。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1