一种高产胞外多糖的基因工程菌及其制备方法和应用与流程
本发明属于生物领域,具体涉及一种高产胞外多糖的基因工程菌及其制备方法和应用。
背景技术:
乳酸菌(Lacticacidbacteria,LAB)是一类公认的具有较高经济价值的食品级微生物,其作为人和动物体内重要的正常生理菌群,常定殖于肠道等部位,起到维持体内微生态平衡和健康的作用,已广泛应用于食品、轻工业、医药、饲料等多个领域。乳酸菌胞外多糖(Exopolysaccharide,EPS)是在生长代谢过程中分泌到细胞壁外,常渗于培养基的一类糖类化合物,有的依附于微生物细胞壁形成荚膜多糖,有的则进入培养基中形成粘液多糖。不同的乳酸菌能产生多种化学组成和分子结构不同的胞外多糖,它们不但具有增稠、乳化、保湿和稳定等功能特性,而且还具有增强粘膜吸附作用、抗肿瘤、抗溃疡、免疫激活以及降低胆固醇等生理功能,因而近年来对其开展的研究较多。另外,乳酸菌是一般认为安全(generallyrecognizedassafe,GRAS)的食品级微生物,EPS作为其重要的次生代谢产物,具有很高的研究和利用价值。20世纪40年代开发出的由肠膜明串珠菌(Leuconostocmesenteroides)产生的右旋糖酐(dextrans)是最早被开发利用的乳酸菌胞外多糖,也是食品和药品管理局(FoodandDrugAdministration,FDA)批准的第一种食品级微生物胞外多糖。至今,人们已经筛选出了多株产EPS的LAB。然而乳酸菌胞外多糖的产量低,制约着它的大规模工业化应用。目前,对于培养基、培养条件、生长因子等外部因素影响EPS合成量的报道已经很多,而从LAB的遗传和生理角度对其EPS合成量影响的报道甚是少见。随着对EPS生物合成途径研究的增多和分子生物学技术的迅速发展,越来越多的学者期望利用基因工程方法调控多糖合成代谢来改变多糖的产量和结构。干酪乳杆菌LC2W(CGMCCNo.0828)是本实验室前期分离得到的一株功能性益生菌,其发酵液中具有能够降低血压的胞外多糖成分,然而该菌株的胞外多糖产量较低,不能满足工业化生产的需求。
技术实现要素:
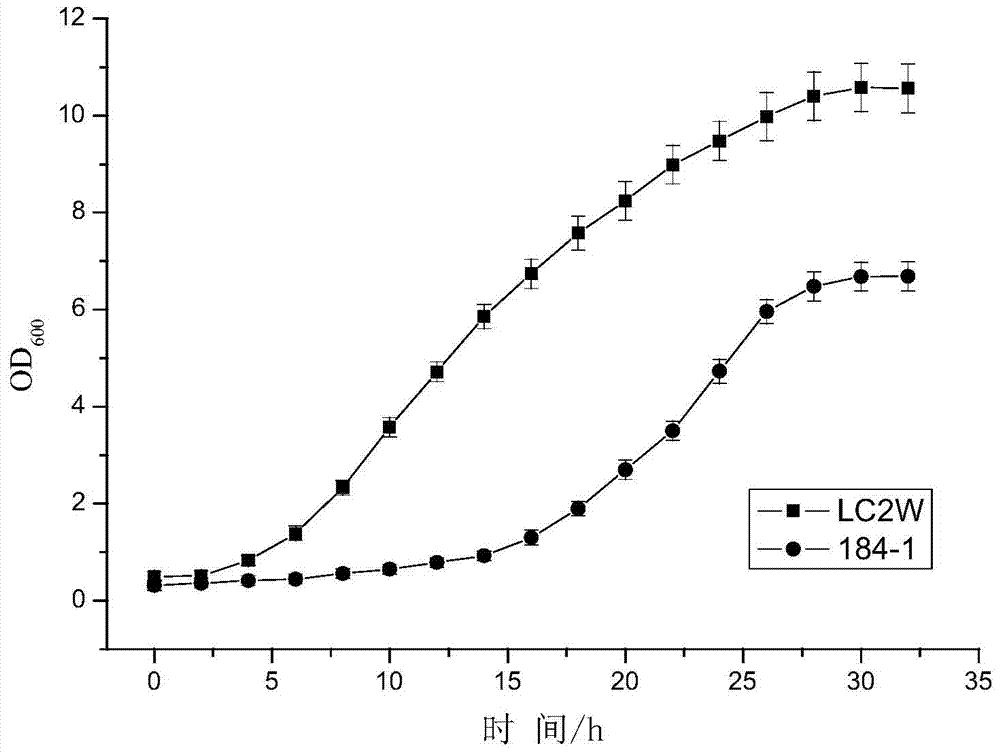
本发明要解决的技术问题是针对现有技术中乳酸菌胞外多糖产量不高,调控机理不明等问题,提供一种高产胞外多糖的基因工程菌及其制备方法和应用,以及利用所述基因工程菌制备胞外多糖的方法及其产品。本发明人发现,由于乳酸菌胞外多糖的产量低,制约着它的大规模工业化应用。目前,对于培养基、培养条件、生长因子等外部因素影响EPS合成量的报道已经很多,而从LAB的遗传和生理角度对其EPS合成量影响的报道非常少见。随着对EPS生物合成途径研究的增多和分子生物学技术的迅速发展,越来越多的学者期望利用基因工程方法调控多糖合成代谢来改变多糖的产量和结构。因此,为解决上述技术问题,本发明采取的技术方案之一是:一种高产胞外多糖的基因工程菌,其是在产胞外多糖的干酪乳杆菌(Lactobacilluscasei)中过表达nox基因的基因工程菌。本发明所述的产胞外多糖的干酪乳杆菌(Lactobacilluscasei)为本领域常规的干酪乳杆菌,只要该干酪乳杆菌能够产生胞外多糖即可。所述产胞外多糖的干酪乳杆菌菌株较佳地为干酪乳杆菌LC2W,该菌株的保藏编号为CGMCCNo.0828。本发明所述的表达载体为本领域常规的表达载体,只要在宿主菌中能够过表达所述外源基因nox即可,所述表达载体较佳地包括各种质粒、粘粒、噬菌体或病毒载体等,更佳地为pIB184质粒。本发明所述重组表达载体的构建方法为本领域常规质粒克隆方法。所述克隆方法较佳地包括以下步骤:将本发明所述nox基因的核酸分子与表达载体pIB184质粒分别用限制性内切酶SacⅠ和BamHⅠ双酶切,形成互补的粘性末端,经T4DNA连接酶连接,形成含有本发明所述重组表达载体,将所得重组表达载体命名为pIB184-nox。本发明所述nox基因为本领域常规的nox基因,所述nox基因的核苷酸序列较佳地如序列表中SEQIDNo:1所示。该基因的制备方法为本领域常规制备方法,较佳地为从变异链球菌(Streptococcusmutans)菌株(保藏编号为CGMCC1.2499)的基因组中分离获得,或者从含有该SEQIDNo:1所示核苷酸序列的重组表达载体中或重组转化体中分离获得,也可以全基因人工合成获得。所述nox基因的核苷酸序列还包括在SEQIDNo:1所示核苷酸序列的基础上,通过适当引入替换、缺失或插入形成的多聚核苷酸的同系物。所述多聚核苷酸的同系物可以通过对核酸序列SEQIDNo:1的一个或多个碱基在保持其酶活性范围内进行替换、缺失或增加来制得。所述SEQIDNo:1的同系物也指启动子变体,在所述的核酸序列之前的启动子或信号序列可通过一个或多个核酸的替换、插入或缺失而改变,但这些改变对启动子的功能没有负面影响。而且通过改变启动子的序列或甚至用来自不同种生物体的更有效的启动子完全替换,可提高目标蛋白的表达水平。所述SEQIDNo:1的同系物还包括一类具有在标准条件下能够与SEQIDNo:1所示序列的多聚核酸进行杂交的碱基序列的多聚核酸,所述标准条件下进行的杂交可根据《分子克隆》(ColdSpringHarborLaboratoryPress)记载的分子生物学中的通用方案(CurrentProtocolsinMolecularBiology)所述的方式进行。为解决上述技术问题,本发明采取的技术方案之二是:一种胞外多糖的制备方法,所述制备方法包括以下步骤:发酵培养本发明所述的高产胞外多糖的基因工程菌,收集发酵液,从发酵液中制得胞外多糖。其中所述发酵培养的温度较佳地为35℃-40℃,更佳地为37℃,所述发酵培养的时间为20-36小时,更佳地为24小时。其中所述从发酵液中制得胞外多糖的方法为本领域常规的制备方法,所述制备方法较佳地包括以下步骤:将所得发酵液煮沸后离心收集上清液,将所得上清液用三氯乙酸法沉淀,然后用醇沉淀,沉淀溶解于水后再用水透析即得。其中所述三氯乙酸法是除蛋白的常规方法,较佳的为添加三氯乙酸至终浓度8%,所述百分比为质量百分比,静置12小时,离心除去沉淀蛋白。醇沉淀法也是常规的方法,较佳的采用乙醇,加乙醇至终浓度75%,所述百分比为体积百分比,4℃静置12小时,离心的速度较佳地为8000-12000g,更佳地为10000g,离心的时间较佳地为15-25分钟,更佳地为20分钟,离心的温度较佳地为4℃。为解决上述技术问题,本发明采取的技术方案之三是:一种nox基因在制备胞外多糖中的应用。本发明所述的应用为本领域常规的应用方式,所述应用的一种应用方式较佳地为:将所述nox基因克隆到表达载体后制备重组表达载体,将所得重组表达载体导入干酪乳杆菌(Lactobacilluscasei)获得基因工程菌,利用所得基因工程菌制备胞外多糖。其中所述的nox基因为本领域常规,其核苷酸序列较佳地如序列表中SEQIDNo:1所示。为解决上述技术问题,本发明采取的技术方案之四是:一种如上所述的高产胞外多糖的基因工程菌在制备胞外多糖中的应用。本发明所述的应用为本领域常规的应用方式,所述应用的一种方式较佳地为发酵培养本发明所述基因工程菌,从发酵液中提取胞外多糖。为解决上述技术问题,本发明采取的技术方案之五是:一种高产胞外多糖的基因工程菌的制备方法,所述制备方法包括以下步骤:将nox基因克隆到表达载体获得重组表达载体,将所得重组表达载体导入产胞外多糖的干酪乳杆菌即得高产胞外多糖的基因工程菌,其中所述的nox基因的核苷酸序列如序列表中SEQIDNo:1所示。本发明所述将重组表达载体导入干酪乳杆菌的方法为本领域常规的导入方法,较佳地为化学转化法或者电击转化法,更佳地为电击转化法。在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。本发明所用试剂和原料均市售可得。本发明的积极进步效果在于:本发明提供的乳酸杆菌基因工程菌在发酵过程中乳酸产生量显著降低,在发酵过程中胞外多糖产量显著提高。所制备的胞外多糖在提高提高免疫力的药品、保健品或者食品的应用方面具有广阔的前景。附图说明图1为重组载体的双酶切及PCR验证结果图。其中泳道1:PCR扩增nox基因;泳道2:BamHI和SacI双酶切T-nox;泳道3:BamHI和SacI双酶切pIB184-nox;M1:DL2000marker;M2:1kbladdermarker。图2为菌体发酵培养的生长曲线图。具体实施方式下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。变异链球菌(Streptococcusmutans)CGMCC1.2499,购买自中国微生物菌种保藏管理委员会普通微生物保藏管理中心,地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,邮政编码100101;干酪乳杆菌(Lactobacilluscasei)LC2W,光明乳业股份有限公司,专利公开号:CN1566326A。实施例1NADH氧化酶基因nox的克隆为了克隆来源于变异链球菌CGMCC1.2499的NADH氧化酶基因,合成如下所述引物,所述引物序列如序列表中SEQIDNo:2和SEQIDNo:3所示。其中上游引物nox-F(BamHI):GGATCCATGAGTAAAATCGTTATTGTTGGAGC;下游引物nox-R(SacI):GAGCTCTCATTTAGCTTTTAATGCTGCTTTGG。所述引物都是由Invitrogen公司合成。以变异链球菌CGMCC1.2499基因组DNA为模板,进行如下PCR程序:(1)94℃,5min,(2)94℃,30s,(3)58℃,30s,(4)72℃,1min,步骤(2)~(4)重复30个循环,(5)72℃,10min,4℃保存。将所得PCR产物利用凝胶电泳分离并回收,与T载体以摩尔比3:1~5:1的比例混合,利用T4连接酶16℃连接3小时,所得连接产物命名为T-nox质粒。将所得产物转化大肠杆菌DH5α感受态细胞,涂布于LB平板(其中含100μg/mL氨苄青霉素)。挑取氨苄抗性平板上的单菌落,接种到装有5mLLB液体培养基(其中含100μg/mL氨苄青霉素)的50mL离心管中,37℃,220rpm下培养8-12小时。利用生工生物工程(上海)有限公司的质粒提取试剂盒提取质粒T-nox,并将质粒送Invitrogen公司测序。测序结果显示,克隆所得序列全长1374bp,如序列表中SEQIDNo:1所示。实施例2构建pIB184-nox表达载体采用BamHI和SacI双酶切实施例1所得T-nox质粒以及pIB184质粒(该质粒的构建方法请参见文献Biswasetal,ShuttleexpressionplasmidsforgeneticstudiesinStreptococcusmutans.Microbiology2008,154:2275-2282.),回收目的基因和线性化载体,以摩尔比10:1的比例混合,利用T4连接酶16℃连接6小时,用氯化钙法转化大肠杆菌DH5α感受态细胞,涂布LB平板(含200μg/mL红霉素)。挑取单菌落,接种到装有5mLLB液体培养基(含200μg/mL红霉素)的50mL离心管中,37℃,220rpm下培养8-12小时。抽提所得质粒pIB184-nox,利用PCR检测和双酶切验证。其中所述PCR检测的体系和PCR检测程序与实施例1所述完全相同。所述双酶切的条件为37℃水浴,酶切3小时。图1为重组载体的双酶切及PCR验证结果图。其中泳道1:PCR扩增nox基因;泳道2:BamHI和SacI双酶切T-nox;泳道3:BamHI和SacI双酶切pIB184-nox;M1:DL2000marker;M2:1kbladdermarker。经检测和测序确认重组质粒pIB184-nox的阅读框完全正确。实施例3构建干酪乳杆菌基因工程菌1、制备干酪乳杆菌LC2W感受态细胞:(1)平板活化,37℃,培养48h-72h;(2)挑单菌落至5mLMRS液体培养基,37℃,静置过夜;(3)按5%接种量转接至50mL含1%甘氨酸的MRS液体培养基,37℃,静置约6h;(4)OD600达到0.8-1时,将菌体放在冰上10min;(5)4℃,5000g离心10min,收集菌体;(6)用预冷的30%PEG1450重悬,冰浴10min;(7)4℃,5000g离心10min,收集菌体;(8)用1mL预冷的30%PEG1450重悬,每管分装100uL,制成感受态。2、电转重组质粒将100μL所得感受态细胞与不超过5μL的重组质粒pIB184-nox混合,转入预冷的2mm电转杯,2kV、25μF、400Ω电击。加入1mL复苏液(其配方为:MRS+20mMMgCl2+2mMCaCl2+0.5Msucrose),37℃静置3h,取100μL涂布含10μg/mL红霉素的MRS平板。37℃培养72h,红霉素抗性平板上长出菌落即为过表达nox基因的基因工程菌184-1。实施例4利用干酪乳杆菌及其基因工程菌发酵制备胞外多糖将干酪乳杆菌LC2W出发菌株与实施例3所得基因工程菌184-1接种于MRS培养基,37℃静置,进行发酵产胞外多糖实验。图2为菌体发酵培养的生长曲线图。过表达nox基因的工程菌184-1生长明显慢于出发菌株LC2W,最终的菌体浓度也显著降低。通过HPLC检测(HPLC方法请参考文献:葡萄酒苹果酸—乳酸发酵HPLC分析方法的研究。中国酿造,2006,154:64-66.),当24小时发酵结束时,LC2W出发菌株乳酸产量为47.7g/L,基因工程菌184-1乳酸产量为37.1g/L(乳酸产量的检测方法请参考文献:郎咏梅,王传芬,蒋文强葡萄酒苹果酸—乳酸发酵HPLC分析方法的研究。中国酿造,2006,154:64-66.),比出发菌株低22%。胞外多糖的提取方法包括以下步骤:收集发酵液在沸水浴中放置10分钟,冷却至室温后,离心(20min,10000×g,4℃)。收集上清液,加入3倍体积无水乙醇,4℃放置12小时。离心(20min,10000×g,4℃)后,沉淀溶于发酵液1/10体积的去离子水,加入三氯乙酸至终浓度为8%,4℃放置12小时。离心(20min,10000×g,4℃),上清液在去离子水中利用透析袋进行透析(所述透析袋的截留分子量为12000-14000Da),4℃放置3天,每8小时换一次水。用硫酸-苯酚法(硫酸-苯酚法请参考文献:DuboisM,GillesKA,HamiltonJK,etal.ColorimetricMethodforDeterminationofSugarsandRelatedSubstances.AnalChem,1956,28:350-356.)进行测定,测定结果为:LC2W出发菌株胞外多糖产量为150.3mg/L,基因工程菌184-1胞外多糖产量为219.4mg/L,提高46%。菌体经超声破碎后,进行NADH氧化酶酶活测定(NADH氧化酶酶活测定方法请参考文献:DeFelipeFL,KleerebezemM,DeVosWM,HugenholtzJ.Cofactorengineering:anovelapproachtometabolicengineeringinLactococcuslactisbycontrolledexpressionofNADHoxidase.JBacteriol1998;180:3804-3808.)。结果显示,LC2W出发菌株NADH氧化酶酶活为0.047U/mL,基因工程菌184-1NADH氧化酶酶活为0.854U/mL,比出发菌株高18.2倍。实施例5利用干酪乳杆菌及其基因工程菌发酵制备胞外多糖将干酪乳杆菌LC2W出发菌株与基因工程菌184-1接种于MRS培养基,35℃静置,进行发酵产胞外多糖实验。发酵20小时后,检测LC2W出发菌株乳酸产量为38.2g/L,基因工程菌184-1乳酸产量为33.5g/L(乳酸产量的检测方法如实施例4所述),比出发菌株低12%。胞外多糖的提取方法包括以下步骤:收集发酵液在沸水浴中放置10分钟,冷却至室温后,离心(15min,8000×g,4℃)。收集上清液,加入3倍体积无水乙醇,4℃放置12小时。离心(15min,8000×g,4℃)后,沉淀溶于发酵液1/10体积的去离子水,加入三氯乙酸至终浓度为8%,4℃放置12小时。离心(15min,8000×g,4℃),上清液在去离子水中利用透析袋进行透析(所述透析袋的截留分子量为12000Da),4℃放置3天,每8小时换一次水。用硫酸-苯酚法(方法如实施例4所示)进行测定,测定结果为:LC2W出发菌株胞外多糖产量为108.7mg/L,基因工程菌184-1胞外多糖产量为135.8mg/L,提高25%。菌体经超声破碎后,进行NADH氧化酶酶活测定(NADH氧化酶酶活测定方法如实施例4所示)。结果显示,LC2W出发菌株NADH氧化酶酶活为0.032U/mL,基因工程菌184-1NADH氧化酶酶活为0.627U/mL,比出发菌株高19.6倍。实施例6利用干酪乳杆菌及其基因工程菌发酵制备胞外多糖将干酪乳杆菌LC2W出发菌株与基因工程菌184-1接种于MRS培养基,40℃静置,进行发酵产胞外多糖实验。发酵36小时后,检测LC2W出发菌株乳酸产量为42.9g/L,基因工程菌184-1乳酸产量为38.3g/L(乳酸产量的检测方法如实施例4所述),比出发菌株低11%。胞外多糖的提取方法包括以下步骤:收集发酵液在沸水浴中放置10分钟,冷却至室温后,离心(25min,12000×g,4℃)。收集上清液,加入3倍体积无水乙醇,4℃放置12小时。离心(25min,12000×g,4℃)后,沉淀溶于发酵液1/10体积的去离子水,加入三氯乙酸至终浓度为8%,4℃放置12小时。离心(25min,12000×g,4℃),上清液在去离子水中利用透析袋进行透析(所述透析袋的截留分子量为14000Da),4℃放置3天,每8小时换一次水。用硫酸-苯酚法(方法如实施例4所示)进行测定,测定结果为:LC2W出发菌株胞外多糖产量为110.2mg/L,基因工程菌184-1胞外多糖产量为146.0mg/L,提高32%。菌体经超声破碎后,进行NADH氧化酶酶活测定(NADH氧化酶酶活测定方法如实施例4所示)。结果显示,LC2W出发菌株NADH氧化酶酶活为0.039U/mL,基因工程菌184-1NADH氧化酶酶活为0.736U/mL,比出发菌株高18.9倍。应理解,在阅读了本发明的上述内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1