使用统治型gRNA的CRISPR相关方法和组合物与流程
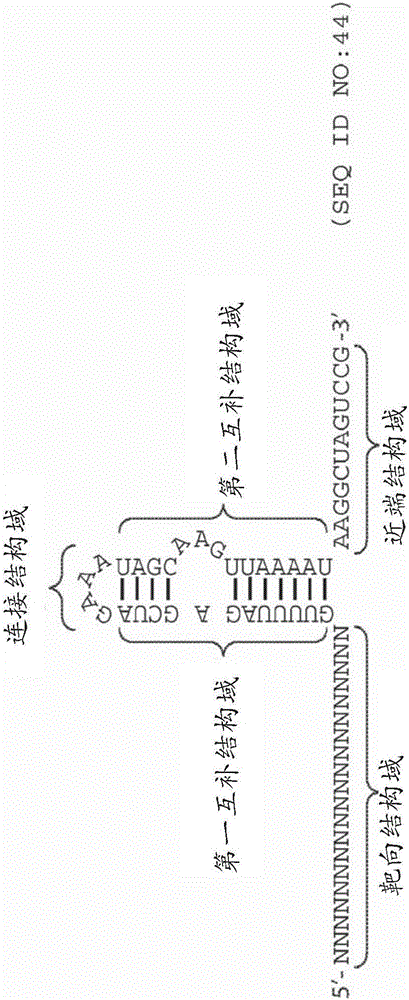
本申请要求2013年11月7日提交的美国临时申请号61/901,215的权益,将其内容通过引用以其全文结合在此。发明领域本发明涉及用于编辑靶核酸序列或将有效载荷递送到靶核酸序列的CRISPR相关方法和组分。发明背景CRISPR(规律间隔成簇短回文重复)在细菌中进化为用于抵御病毒攻击的适应性免疫系统。在暴露于病毒后,病毒DNA的短区段被整合进CRISPR基因座中。RNA是从包括病毒序列的CRISPR基因座的一部分转录来的。该RNA含有与病毒基因组互补的序列,介导将Cas9蛋白靶向病毒基因组中的靶序列。Cas9蛋白切割病毒靶标并且由此使其沉默。最近,CRISPR/Cas系统已经被改适成用于在真核细胞中进行基因组编辑。位点特异性双链断裂(DSB)的引入允许通过两种内源DNA修复机制之一(非同源末端连接(NHEJ)或同源定向修复(HDR))改变靶序列。CRISPR/Cas系统还已经用于基因调节,包括在不改变靶序列的情况下的转录抑制和激活。基于CRISPR/Cas系统的靶向的基因调节使用无酶促活性的Cas9(又称催化上失活的Cas9)。尽管改适CRISPR/Cas系统用于在真核细胞中进行基因组编辑最近取得了进展,但是仍然需要改进这些系统的调节和控制用于在真核细胞中使用。发明概述在此披露了可以用于靶向靶DNA中的特定位置的方法和组合物,例如与gRNA分子复合的Cas9分子。取决于在披露的方法和组合物中使用的Cas9分子/gRNA分子复合物,可以实现靶核酸的特异性编辑或有效载荷的递送。使用或包括编码Cas9分子或gRNA分子的核酸(例如,DNA)的方法和组合物可以另外使用或包括“统治型(governing)gRNA分子”。统治型gRNA分子可以与Cas9分子复合,以使Cas9系统的组分失活或沉默。在一个方面中,本披露的特征是一种包含靶向结构域的gRNA分子(在此称为统治型gRNA分子),该靶向结构域靶向Cas9系统的组分。在一个实施例中,统治型gRNA分子靶向以下项并使其沉默:(1)编码Cas9分子的核酸(即,靶向Cas9的gRNA分子),(2)编码gRNA分子的核酸(即,靶向gRNA的gRNA分子),或(3)被设计成与细胞中的其他核酸序列具有最小同源性以最小化脱靶切割的被工程化到Cas9组分中的核酸序列(即,靶向工程化的控制序列的gRNA分子)。可以对统治型gRNA的靶向序列进行选择,以增加Cas9系统的调节或控制和/或以减小或最小化该系统的脱靶效应,例如,统治型gRNA可以通过使编码Cas9分子的核酸失活(例如,切割)而最小化不希望的切割,例如,Cas9介导的靶核酸改变或Cas9的脱靶切割之后的“再切割”。在一个实施例中,统治型gRNA对Cas9分子/gRNA分子复合物的表达或活性水平施加将时间限制或其他一种或多种限制。在一个实施例中,统治型gRNA减少脱靶或其他不想要的活性。统治型gRNA的靶序列可以被布置在Cas9编码序列的控制区或编码区中。这可以是Cas9序列或非Cas9序列,例如被选择用于减小或最小化脱靶效应或导致脱靶效应减小或最小化的序列。沉默或失活可以通过切割靶向的核酸序列或通过将Cas9分子/统治型gRNA分子复合物与靶向的核酸序列结合来实现。在一个方面中,本披露的特征是一种靶向Cas9分子(任选地使其失活)的gRNA分子。在一个实施例中,gRNA分子靶向编码Cas9分子的核酸序列。例如,编码Cas9分子的序列可以包括以下项中的一项或多项:编码Cas9分子的氨基酸序列的序列,编码Cas9分子的氨基酸序列、包括非翻译序列的序列,或编码Cas9分子的氨基酸序列、包括非转录序列的序列。在一个实施例中,Cas9分子是eaCas9分子。在另一个实施例中,Cas9分子是eiCas9分子。在一个实施例中,gRNA被配置成在编码Cas9分子的核酸序列中提供Cas9分子介导的切割事件。在一个实施例中,gRNA分子包含靶向结构域,该靶向结构域被配置成在编码Cas9分子的核酸序列中提供Cas9分子介导的切割事件。在一个实施例中,gRNA分子:靶向核酸序列的Cas9分子-氨基酸编码序列;被配置成在核酸序列的Cas9分子-氨基酸编码序列中提供Cas9分子介导的切割事件;或包含靶向结构域,该靶向结构域被配置成在核酸序列的Cas9分子-氨基酸编码序列中提供Cas9分子介导的切割事件。在一个实施例中,gRNA分子:靶向核酸序列的非编码序列;被配置成在核酸序列的非编码序列中提供Cas9分子介导的切割事件;或包含靶向结构域,该靶向结构域被配置成在核酸序列的非编码序列中提供Cas9分子介导的切割事件。在一个实施例中,gRNA分子:靶向核酸序列的非翻译序列;被配置成在核酸序列的非翻译序列中提供Cas9分子介导的切割事件;或包含靶向结构域,该靶向结构域被配置成在核酸序列的非翻译序列中提供Cas9分子介导的切割事件。在一个实施例中,gRNA分子:靶向Cas9分子-氨基酸编码区的5’核酸序列;被配置成在Cas9分子-编码区的5’核酸序列中提供Cas9分子介导的切割事件;或包含靶向结构域,该靶向结构域被配置成在核酸序列的Cas9分子-编码区的5’中提供Cas9分子介导的切割事件。在一个实施例中,gRNA分子:靶向编码Cas9分子-编码区的Cas9分子3’的核酸序列;被配置成在Cas9分子-编码区的3’核酸序列中提供Cas9分子介导的切割事件;或包含靶向结构域,该靶向结构域被配置成在核酸序列的Cas9分子-编码区的3’中提供Cas9分子介导的切割事件。在一个实施例中,gRNA分子:靶向核酸序列的启动子区;被配置成在核酸序列的启动子区中提供Cas9分子介导的切割事件;或包含靶向结构域,该靶向结构域被配置成在核酸序列的启动子区中提供Cas9分子介导的切割事件,其中该启动子区与Cas9分子氨基酸编码区功能性地连接。在一个实施例中,gRNA分子:靶向核酸序列的Cas9分子内含子序列;被配置成在核酸序列的Cas9分子内含子序列中提供Cas9分子介导的切割事件;或包含靶向结构域,该靶向结构域被配置成在核酸序列的Cas9分子内含子序列中提供Cas9分子介导的切割事件。在一个实施例中,Cas9分子是化脓链球菌(S.pyogenes)Cas9分子。在另一个实施例中,Cas9分子是金黄色葡萄球菌(S.aureus)Cas9分子。在一个实施例中,gRNA分子选自表E1-E6。在另一个实施例中,gRNA分子选自表E7-E12。在一个实施例中,gRNA是嵌合gRNA。在另一个实施例中,gRNA是模块化gRNA。在一个实施例中,统治型gRNA分子靶向有待负向调节的Cas9系统组分的编码序列或控制区(例如,启动子)。例如,gRNA可以靶向Cas9的编码序列,或调节Cas9编码序列的表达的控制区(例如,启动子)。在一个实施例中,统治型gRNA(例如,靶向Cas9的gRNA分子)或编码它的核酸被单独地引入,例如晚于Cas9分子或编码它的核酸。例如,第一载体(例如病毒载体,例如AAV载体)可以引入编码Cas9和一种或多种gRNA的核酸,并且第二载体(例如病毒载体,例如AAV载体)可以引入编码统治型gRNA分子(例如,靶向Cas9的gRNA分子)的核酸。第二载体可以在第一载体之后引入。在一个实施例中,统治型gRNA(例如,靶向Cas9的gRNA分子)或编码它的核酸可以与Cas9分子或编码它的核酸一起引入,例如同时或在同一载体中,但是例如在转录控制元件(例如启动子或增强子)控制下,这些转录控制元件稍后被激活,例如这样使得在一段时间之后,Cas9的转录被沉默。在一个实施例中,转录控制元件被内在地激活。在一个实施例中,转录元件经由引入外触发被激活。在一个方面中,本披露的特征是一种包含编码统治型gRNA分子的序列的核酸。在一个实施例中,统治型gRNA分子包括靶向Cas9分子的gRNA分子。在一个实施例中,核酸包含编码在此描述的gRNA分子的序列。在一个实施例中,核酸是纯化的。在另一个方面中,本披露的特征是一种核酸,例如一种或多种载体,例如一种或多种病毒载体,例如一种或多种AAV载体,该核酸包含:a)第一核酸序列,其编码统治型gRNA分子,例如靶向Cas9分子的gRNA分子或靶向gRNA分子的gRNA分子;和b)第二核酸序列,其编码Cas9分子,例如eaCas9或eiCas9分子。在一个实施例中,统治型gRNA分子包括靶向Cas9分子的gRNA分子。在另一个实施例中,统治型gRNA分子包括靶向gRNA分子的gRNA分子。在一个实施例中,统治型gRNA分子包括靶向Cas9分子的gRNA分子并且该靶向Cas9分子的gRNA分子靶向编码Cas9分子的第二核酸序列。在一个实施例中,Cas9分子是eaCas9分子。在另一个实施例中,Cas9分子是eiCas9分子。在一个实施例中,gRNA分子被配置成在第二核酸序列中提供Cas9分子介导的切割事件。在一个实施例中,gRNA分子包含靶向结构域,该靶向结构域被配置成在第二核酸序列中提供Cas9分子介导的切割事件。在一个实施例中,gRNA分子是在此描述的gRNA分子并且靶向第二核酸序列。在一个实施例中,核酸是纯化的。在一个实施例中,组分a)和组分b)被提供在同一核酸(例如同一载体,例如同一病毒载体,例如同一AAV载体)上。在另一个实施例中,组分a)和组分b)被提供在不同核酸(例如不同载体,例如不同病毒载体,例如不同AAV载体)上。在一个实施例中,核酸被配置成这样,使得由所述核酸转录的靶向Cas9分子的gRNA与产生自所述核酸的Cas9分子形成复合物。在一个实施例中,所述复合物能够例如通过切割使核酸序列失活或沉默,该核酸序列包括或编码所述Cas9分子序列。在一个实施例中,失活包括切割。在一个实施例中,所述第一核酸序列在第一控制区(例如,启动子)的控制下,并且所述第二核酸序列在第二控制区(例如,启动子)的控制下,并且所述第一和第二控制区(例如,启动子)是不同的,例如一个是组成型启动子并且一个是诱导型启动子。在一个实施例中,第一和第二控制区中的一个是组成型启动子并且一个是诱导型启动子。在一个实施例中,所述第一核酸序列和所述第二核酸序列被差异性表达,例如,就表达水平而言是差异性表达的或在时间上是差异性表达的,例如,第一序列的表达晚于所述第二序列,或第一序列的表达水平低于所述第二序列。在一个实施例中,核酸进一步包含:c)第三核酸序列,其编码gRNA分子(例如,第二gRNA分子),该gRNA分子包含与靶核酸互补的靶向结构域,例如其中第二gRNA不靶向b)。在一个实施例中,在此披露了靶核酸,例如来自以下项的序列:在此描述的基因或通路,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,所述第一核酸序列在第一控制区(例如,启动子)的控制下,所述第二核酸序列在所述第二控制区(例如,启动子)或第三控制区(例如,启动子)的控制下,所述第三核酸序列在所述第二控制区(例如,启动子)或所述第三控制区(例如,启动子)的控制下,并且所述第一控制区(例如,启动子)不同于所述第二和/或所述第三控制区(例如,启动子)。在一个实施例中,所述第一核酸序列和所述第三核酸序列被差异性表达,例如,就表达水平而言是差异性表达的或在时间上是差异性表达的,例如,第一序列的表达晚于所述第三序列,或第一序列的表达水平低于所述第三序列。在一个实施例中,核酸进一步包含模板核酸(在此可互换地称为交换(swap)核酸序列),例如,具有被一种或多种统治型gRNA识别的5’和3’侧翼区序列。在一个实施例中,包括或编码Cas9分子序列或gRNA分子序列(例如,被如在此描述的统治型gRNA所靶向)的核酸序列进一步包含以下核酸序列,其能够被用作模板核酸,例如在从包括或编码Cas9分子序列或gRNA分子序列的核酸序列切割或切除(例如,通过在此描述的方法)之后,例如作为用于同源重组的供体DNA。在一个实施例中,第一统治型gRNA分子靶向包含模板核酸序列的核酸序列的5’区,并且第二统治型gRNA分子靶向包含模板核酸序列的核酸序列的3’区。例如,至少两种(例如,两种、三种、四种、五种或更多种)统治型gRNA可以用来产生一种或多种(例如,两种、三种、四种或更多种)模板核酸。在另一个实施例中,单个统治型gRNA分子靶向包含模板核酸序列的核酸序列的5'区和3’区两者。例如,包含模板核酸序列的核酸序列的5’区(例如,被统治型gRNA分子所靶向)可以与包含模板核酸序列的核酸序列的3’区(例如,被统治型gRNA分子所靶向)相同或基本上相同。在一个实施例中,包含模板核酸序列的核酸序列在载体(例如,在此描述的载体)中。在一个实施例中,载体是病毒载体,例如AAV载体。在一个方面中,本披露的特征是一种包含在此描述的核酸的载体。在一个实施例中,载体是病毒载体。在一个实施例中,病毒载体是AAV载体。在一个方面中,本披露的特征是一种组合物(例如,药物组合物),其包含:a)统治型gRNA分子,例如在此描述的统治型gRNA分子,或编码统治型gRNA分子的核酸,例如在此描述的核酸。在一个实施例中,组合物包含以下项中的一项或多项(例如,2项或全部):b)Cas9分子,例如在此描述的Cas9分子,或编码Cas9分子的核酸序列,例如在此描述的核酸序列;c)第二gRNA分子或编码第二gRNA分子的核酸;或d)模板核酸。在一个实施例中,统治型gRNA分子包括靶向Cas9分子的gRNA分子。在一个实施例中,靶向Cas9分子的gRNA包括在此描述的gRNA分子。在一个实施例中,gRNA分子被配置成在编码Cas9分子的核酸序列中提供Cas9分子介导的切割事件。在一个实施例中,组合物包含靶向Cas9分子的gRNA分子和编码Cas9分子的核酸。在另一个实施例中,组合物包含靶向Cas9分子的gRNA分子和Cas9分子。在一个实施例中,组合物进一步包含:c)第二gRNA分子或编码第二gRNA分子的核酸。在一个实施例中,第二gRNA将Cas9分子靶向靶核酸。在一个实施例中,组合物进一步包含:d)模板核酸。在一个实施例中,组合物包含第二gRNA或编码第二gRNA的核酸。在一个实施例中,模板核酸被配置成介导由第二gRNA定位的断裂的修复。在一个实施例中,a)、b)、c)和d)中的每者作为核酸存在并且在同一核酸分子上进行编码。在一个实施例中,选自a)、b)、c)和d)的第一序列在第一核酸分子上进行编码,并且选自a)、b)、c)和d)的第二序列在第二核酸分子上进行编码。在另一个方面中,本披露的特征是一种包含在此描述的核酸的组合物,例如药物组合物。例如,核酸(例如一种或多种载体,例如一种或多种病毒载体,例如一种或多种AAV载体)可以包含:a)第一核酸序列,其编码统治型gRNA分子,例如靶向Cas9的gRNA分子或靶向gRNA的gRNA分子;和b)第二核酸序列,其编码Cas9分子,例如eaCas9或eiCas9分子。在一个实施例中,所述核酸包括AAV载体。在一个方面中,本披露的特征是一种组合物(例如,药物组合物),其包含编码统治型gRNA分子(例如,靶向Cas9的gRNA分子或靶向gRNA的gRNA分子)的核酸序列(例如,DNA),以及以下项中的一项或多项a)Cas9分子,b)第二Cas9分子,c)gRNA分子,以及d)第二gRNA分子。在一个实施例中,存在的a)、b)、c)和d)中的每者在同一核酸分子上进行编码。在一个实施例中,选自a、b、c和d的第一序列在第一核酸分子上进行编码,并且选自a、b、c和d的第二序列在第二核酸分子上进行编码。在一个实施例中,所述核酸编码:a和c;a、c和d;或a、b、c和d。在一个方面中,本披露的特征是一种药物制剂,其包含:在此描述的gRNA分子;在此描述的核酸;在此描述的载体;或在此所述的组合物。在一个方面中,本披露的特征是一种细胞,其包含:在此描述的gRNA分子;在此描述的核酸;在此描述的载体;或在此所述的组合物。在一个实施例中,细胞包含:编码Cas9分子的核酸序列,其中编码Cas9分子的序列可以包括以下项中的一项或多项:编码Cas9分子的氨基酸序列的序列,编码Cas9分子的氨基酸序列、包括非翻译序列的序列,和编码Cas9分子的氨基酸序列、包括非转录序列的序列;和统治型gRNA分子。在一个实施例中,统治型gRNA分子包括靶向编码Cas9分子的核酸序列的gRNA分子。在一个实施例中,gRNA分子是在此描述的gRNA分子。在一个实施例中,细胞进一步包含Cas9分子。在一个实施例中,细胞进一步包含第二gRNA分子或编码第二gRNA分子的核酸。在一个实施例中,第二gRNA将Cas9分子靶向靶核酸。在一个实施例中,细胞进一步包含模板核酸。在一个实施例中,模板核酸被配置成介导靶核酸中由第二gRNA分子定位的断裂的修复。在一个实施例中,细胞包含被第二gRNA分子切割的靶核酸,该第二gRNA分子介导Cas9分子的靶向。在一个实施例中,细胞包含已经被切割和修复的靶核酸。在一个实施例中,修复包括模板核酸介导的修复。在一个实施例中,编码Cas9分子的核酸序列尚未被切割。在一个实施例中,编码Cas9分子的核酸序列可以表达Cas9分子。在一个实施例中,编码Cas9分子的核酸序列已经被gRNA切割,该gRNA介导Cas9分子的靶向。在一个实施例中,与尚未被切割的相同分子相比,经切割的编码Cas9分子的核酸序列具有降低的表达Cas9分子的能力。在一个实施例中,经切割的编码Cas9分子的核酸序列基本上不能表达Cas9分子。在一个实施例中,细胞包含以下项中的一项或两项:经切割的编码Cas9分子的核酸序列;或具有经修复的Cas9分子介导的切割事件的靶核酸。在一个实施例中,细胞是脊椎动物、哺乳动物、啮齿动物、山羊、猪、鸟、鸡、火鸡、牛、马、绵羊、鱼、灵长类动物或人类细胞。在另一个实施例中,细胞是植物细胞。在一个实施例中,植物细胞是单子叶植物或双子叶植物细胞。在一个实施例中,细胞是人类细胞。在一个实施例中,细胞是体细胞、生殖细胞或产前细胞。在一个实施例中,细胞是合子、囊胚或胚细胞、干细胞、有丝分裂感受态细胞、减数分裂感受态细胞。在一个方面中,本披露的特征是一种改变细胞(例如,改变细胞的靶核酸的结构,例如序列)的方法,该方法包括使所述细胞与在此描述的核酸接触。例如,核酸(例如一种或多种载体,例如一种或多种病毒载体,例如一种或多种AAV载体)可以包含:a)第一核酸序列,其编码统治型gRNA分子,例如靶向Cas9的gRNA分子或靶向gRNA的gRNA分子;和b)第二核酸序列,其编码Cas9分子,例如eaCas9或eiCas9分子。在一个实施例中,细胞是哺乳动物、灵长类动物或人类细胞。在一个实施例中,细胞是人类细胞,例如在此描述的细胞,例如在第VIIA部分中。在一个实施例中,细胞是:体细胞、生殖细胞、产前细胞(例如,合子、囊胚或胚细胞)、干细胞、有丝分裂感受态细胞或减数分裂感受态细胞。在一个实施例中,靶核酸是染色体核酸。在另一个方面中,本披露的特征是一种改变细胞(例如,改变细胞的靶核酸的结构,例如序列)的方法,该方法包括使该细胞与有效量的以下项接触:在此描述的gRNA分子;在此描述的核酸;在此描述的载体;或在此所述的组合物。在一个实施例中,细胞是脊椎动物、哺乳动物、啮齿动物、山羊、猪、鸟、鸡、火鸡、牛、马、绵羊、鱼、灵长类动物或人类细胞。在另一个实施例中,细胞是植物细胞。在一个实施例中,植物细胞是单子叶植物或双子叶植物细胞。在一个实施例中,细胞是人类细胞。在一个实施例中,细胞是体细胞、生殖细胞或产前细胞。在一个实施例中,细胞是合子、囊胚或胚细胞、干细胞、有丝分裂感受态细胞、减数分裂感受态细胞。在一个实施例中,受试者是哺乳动物、灵长类动物或人。在一个实施例中,靶核酸是染色体核酸。在另一个方面中,本披露的特征是一种例如通过改变靶核酸的结构(例如,改变其序列)来治疗受试者的方法,该方法包括向该受试者施用有效量的在此描述的核酸。例如,核酸(例如一种或多种载体,例如一种或多种病毒载体,例如一种或多种AAV载体)可以包含:a)第一核酸序列,其编码统治型gRNA分子,例如靶向Cas9的gRNA分子或靶向gRNA的gRNA分子;和b)第二核酸序列,其编码Cas9分子,例如eaCas9或eiCas9分子。在一个实施例中,受试者是哺乳动物、灵长类动物或人。在一个实施例中,靶核酸是人类细胞(例如在此描述的细胞,例如在第VIIA部分中)的核酸。在一个实施例中,靶核酸是以下项的核酸:体细胞、生殖细胞、产前细胞(例如,合子、囊胚或胚细胞)、干细胞、有丝分裂感受态细胞或减数分裂感受态细胞。在一个实施例中,靶核酸是染色体核酸。在另一个方面中,本披露的特征是一种例如通过改变受试者细胞中的靶核酸的结构(例如,改变其序列)来治疗该受试者的方法,该方法包括使该细胞或该受试者与有效量的以下项的核酸接触:在此描述的gRNA分子;在此描述的核酸;在此描述的载体;或在此所述的组合物。在一个实施例中,细胞是脊椎动物、哺乳动物、啮齿动物、山羊、猪、鸟、鸡、火鸡、牛、马、绵羊、鱼、灵长类动物或人类细胞。在另一个实施例中,细胞是植物细胞。在一个实施例中,植物细胞是单子叶植物或双子叶植物细胞。在一个实施例中,细胞是人类细胞。在一个实施例中,细胞是体细胞、生殖细胞或产前细胞。在一个实施例中,细胞是合子、囊胚或胚细胞、干细胞、有丝分裂感受态细胞、减数分裂感受态细胞。在一个实施例中,受试者是哺乳动物、灵长类动物或人。在一个实施例中,靶核酸是染色体核酸。在一个方面中,本披露的特征是一种反应混合物,其包含细胞和:在此描述的gRNA分子;在此描述的核酸;在此描述的载体;或在此所述的组合物。在另一个方面中,本披露的特征是一种反应混合物,其包含在此描述的组合物和细胞,例如在此描述的细胞。在一个方面中,本披露的特征是一种试剂盒,其包含:在此描述的gRNA分子;在此描述的核酸;在此描述的载体;或在此所述的组合物。在一个实施例中,试剂盒包含用于在于此描述的方法中使用gRNA分子、核酸、载体或组合物的说明书。在另一个方面中,本披露的特征是一种包含在此描述的统治型gRNA分子的组合物,例如药物组合物。在一个实施例中,组合物进一步包含Cas9分子,例如eaCas9或eiCas9分子。在一个实施例中,所述Cas9分子是eaCas9分子。在一个实施例中,所述Cas9分子是eiCas9分子。在一个实施例中,组合物进一步包含gRNA分子,其包含与来自在此披露的靶核酸的靶序列互补的靶向结构域,例如来自以下项的序列:在此描述的基因或通路,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在另一个方面中,本披露的特征是一种包含在此描述的gRNA分子的组合物,例如药物组合物。在一个实施例中,组合物进一步包含Cas9分子,例如eaCas9或eiCas9分子。在一个实施例中,所述Cas9分子是eaCas9分子。在另一个实施例中,所述Cas9分子是eiCas9分子。在一个实施例中,所述组合物包含有效载荷,例如在此描述的有效载荷,例如在第VI部分中,例如在表VI-1、VI-2、VI-3、VI-4、VI-5或VI-6中。在一个实施例中,有效载荷包含:表观遗传修饰剂,例如修饰DNA或染色质的分子;组分,例如修饰组蛋白的分子,例如在此描述的表观遗传修饰剂,例如在第VI部分中;转录因子,例如在此描述的转录因子,例如在第VI部分中;转录激活因子结构域;转录因子抑制剂,例如抗转录因子抗体,或其他抑制剂;小分子;抗体;酶;与DNA相互作用的酶,例如解旋酶、限制性内切酶、连接酶或聚合酶;和/或核酸,例如具酶促活性的核酸,例如核糖核酸酶,或反义寡核苷酸的mRNA,siRNA。在一个实施例中,组合物进一步包含Cas9分子,例如eiCas9分子。在一个实施例中,所述有效载荷偶联(例如,共价地或非共价地)至Cas9分子,例如eiCas9分子。在一个实施例中,所述有效载荷通过接头偶联至所述Cas9分子。在一个实施例中,所述接头是或包括在生理(例如,核)条件下可切割的键。在一个实施例中,所述接头是或包括在此描述的键,例如在第XI部分中。在一个实施例中,所述接头是或包括酯键。在一个实施例中,所述有效载荷包含融合至Cas9分子(例如,eaCas9分子或eiCas9分子)的融合配偶体。在一个实施例中,所述有效载荷偶联(例如,共价地或非共价地)至gRNA分子。在一个实施例中,所述有效载荷通过接头偶联至所述gRNA分子。在一个实施例中,所述接头是或包括在生理(例如,核)条件下可切割的键。在一个实施例中,所述接头是或包括在此描述的键,例如在第XI部分中。在一个实施例中,所述接头是或包括酯键。在一个实施例中,组合物包含eaCas9分子。在一个实施例中,组合物包含eaCas9分子,该分子在靶核酸中形成双链断裂。在一个实施例中,组合物包含eaCas9分子,该分子在靶核酸中形成单链断裂。在一个实施例中,所述单链断裂形成在靶核酸的互补链中。在一个实施例中,所述单链断裂形成在不是靶核酸的互补链的链中。在一个实施例中,组合物包含HNH样结构域切割活性,但没有或具有不显著的N-末端RuvC样结构域切割活性。在一个实施例中,组合物包含N-末端RuvC样结构域切割活性,但没有或具有不显著的HNH样结构域切割活性。在一个实施例中,所述双链断裂是在靶位置的核苷酸的10、20、30、40、50、100、150或200个核苷酸之内。在一个实施例中,所述单链断裂是在靶位置的核苷酸的10、20、30、40、50、100、150或200个核苷酸之内。在一个实施例中,组合物进一步包含模板核酸,例如在此描述的模板核酸,例如在第IV部分中。在一个实施例中,模板核酸包含对应于靶位置的核苷酸的核苷酸。在一个实施例中,所述模板核酸包含对应于来自以下项的序列的靶位置的核苷酸的核苷酸:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,模板核酸是或包括来自以下项的序列的长度为10至500、10至400、10至300、10至200个核苷酸的片段:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,模板核酸是或包括长度为10至500、10至400、10至300、10至200个核苷酸的片段,其与以下项的对应序列相差至少1个核苷酸,但是不超过其核苷酸的5%、10%、20%或30%:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,组合物进一步包含第二gRNA分子,例如在此描述的第二gRNA分子。在一个实施例中,所述gRNA分子和所述第二gRNA分子在靶核酸中在例如侧翼于靶位置的不同位点处介导断裂。在一个实施例中,所述gRNA分子和所述第二gRNA分子与靶标的同一条链互补。在一个实施例中,所述gRNA分子和所述第二gRNA分子与靶标的不同链互补。在一个实施例中,所述Cas9分子介导双链断裂。在一个实施例中,所述gRNA分子和所述第二gRNA分子被配置成这样,使得由Cas9分子造成的第一和第二断裂侧翼于靶位置。在一个实施例中,所述双链断裂是在靶位置的核苷酸的10、20、30、40、50、100、150或200个核苷酸之内。在一个实施例中,组合物进一步包含模板核酸。在一个实施例中,模板核酸包含对应于靶位置的核苷酸的核苷酸。在一个实施例中,所述模板核酸包含对应于来自以下项的序列的靶位置的核苷酸的核苷酸:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,模板核酸是来自以下项的序列的长度为10至500、10至400、10至300、10至200个核苷酸的片段:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,模板核酸是长度为10至500、10至400、10至300、10至200个核苷酸的片段,其与以下项的对应序列相差至少1个核苷酸,但是不超过其核苷酸的5%、10%、20%或30%:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,所述Cas9分子介导单链断裂。在一个实施例中,所述gRNA分子和所述第二gRNA分子被配置成这样,使得第一和第二断裂形成在核酸靶标的同一条链中,例如在转录序列的情况下,是模板链或非模板链。在一个实施例中,所述第一和第二断裂侧翼于靶位置。在一个实施例中,所述第一和第二单链断裂之一或两者独立地在靶位置的核苷酸的10、20、30、40、50、100、150或200个核苷酸内。在一个实施例中,组合物进一步包含模板核酸。在一个实施例中,模板核酸包含对应于靶位置的核苷酸的核苷酸。在一个实施例中,所述模板核酸包含对应于来自以下项的序列的靶位置的核苷酸的核苷酸:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,模板核酸是或包括来自以下项的序列的长度为10至500、10至400、10至300、10至200个核苷酸的片段:在此描述的基因或来自通路的基因,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,模板核酸是或包括长度为10至500、10至400、10至300、10至200个核苷酸的片段,其与以下项的对应序列相差至少1个核苷酸,但是不超过其核苷酸的5%、10%、20%或30%:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,所述gRNA分子和所述第二gRNA分子被配置成这样,使得第一和第二断裂形成在靶标的不同链中。在一个实施例中,所述第一和第二断裂侧翼于靶位置。在一个实施例中,所述第一和第二单链断裂之一或两者独立地在靶位置的核苷酸的10、20、30、40、50、100、150或200个核苷酸内。在一个实施例中,组合物进一步包含模板核酸。在一个实施例中,模板核酸包含对应于靶位置的核苷酸的核苷酸。在一个实施例中,所述模板核酸包含对应于来自以下项的序列的靶位置的核苷酸的核苷酸:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,模板核酸是或包括来自以下项的序列的长度为10至500、10至400、10至300、10至200个核苷酸的片段:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,模板核酸是或包括长度为10至500、10至400、10至300、10至200个核苷酸的片段,其与以下项的对应序列相差至少1个核苷酸,但是不超过其核苷酸的5%、10%、20%或30%:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,组合物包含第二Cas9分子。在一个实施例中,所述Cas9分子和所述第二Cas9分子中的一者或两者是eiCas9分子。在一个实施例中,所述eiCas9分子通过接头偶联至有效载荷并且所述第二eiCas9分子通过第二接头偶联至第二有效载荷。在一个实施例中,所述有效载荷和所述第二有效载荷是相同的。在一个实施例中,所述有效载荷和所述第二有效载荷是不同的。在一个实施例中,所述接头和所述第二接头是相同的。在一个实施例中,所述接头和所述第二接头是不同的,例如具有不同的释放特性,例如不同的释放率。在一个实施例中,各自在此描述了所述有效载荷和所述第二有效载荷,例如在第VI部分中,例如在表VI-1、VI-2、VI-3、VI-4、VI-5或VI-6中。在一个实施例中,所述有效载荷和所述第二有效载荷可以相互作用,例如它们是蛋白质的亚基。在一个实施例中,所述Cas9分子和所述第二Cas9分子中之一或两者是eaCas9分子。在一个实施例中,所述eaCas9分子包括第一切割活性并且所述第二eaCas9分子包括第二切割活性。在一个实施例中,所述切割活性和所述第二切割活性是相同的,例如,两者都是N-末端RuvC样结构域活性或都是HNH样结构域活性。在一个实施例中,所述切割活性和所述第二切割活性是不同的,例如,一个是N-末端RuvC样结构域活性并且一个是HNH样结构域活性。在一个实施例中,所述Cas9分子和所述第二Cas9分子对不同的PAM具有特异性,例如一个对NGG具有特异性并且另一个对例如NGGNG、NNAGAAW(W=A或T)或NAAR(R=A或G)具有特异性。在一个实施例中,金黄色葡萄球菌的所述Cas9分子识别序列基序NNGRR(R=A或G)并且指导从该序列上游1至10(例如,3至5)个碱基对切割靶核酸序列。在一个实施例中,所述Cas9分子和所述第二Cas9分子之一识别金黄色葡萄球菌PAM。在一个实施例中,脑膜炎奈瑟氏菌(N.meningitidis)的所述Cas9分子识别序列基序NNNNGATT并且指导从该序列上游1至10(例如,3至5)个碱基对切割靶核酸序列。在一个实施例中,所述Cas9分子和所述第二Cas9分子之一识别脑膜炎奈瑟氏菌PAM。在一个实施例中,所述Cas9分子和所述第二Cas9分子两者都介导双链断裂。在一个实施例中,所述Cas9分子和所述第二Cas9分子对不同PAM具有特异性,例如,一个对NGG具有特异性并且另一个对另一个PAM(例如,在此描述的另一个PAM)具有特异性。在一个实施例中,所述gRNA分子和所述第二gRNA分子被配置成这样,使得第一和第二断裂侧翼于靶位置。在一个实施例中,所述第一和第二双链断裂之一或两者独立地在靶位置的核苷酸的10、20、30、40、50、100、150或200个核苷酸内。在一个实施例中,组合物进一步包含模板核酸。在一个实施例中,模板核酸包含对应于靶位置的核苷酸的核苷酸。在一个实施例中,所述模板核酸包含对应于来自以下项的序列的靶位置的核苷酸的核苷酸:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3、XII-1或第VIII部分中。在一个实施例中,模板核酸是或包括来自以下项的序列的长度为10至500、10至400、10至300、10至200个核苷酸的片段:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,模板核酸是或包括长度为10至500、10至400、10至300、10至200个核苷酸的片段,其与以下项的对应序列相差至少1个核苷酸,但是不超过其核苷酸的5%、10%、20%或30%:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,所述Cas9分子和所述第二Cas9分子之一介导双链断裂并且另一个介导单链断裂。在一个实施例中,所述Cas9分子和所述第二Cas9分子对不同PAM具有特异性,例如,一个对NGG具有特异性并且另一个对另一个PAM(例如,在此描述的另一个PAM)具有特异性。在一个实施例中,所述gRNA分子和所述第二gRNA分子被配置成这样,使得第一和第二断裂侧翼于靶位置。在一个实施例中,所述第一和第二断裂侧翼于靶位置。在一个实施例中,所述第一和第二断裂之一或两者独立地在靶位置的核苷酸的10、20、30、40、50、100、150或200个核苷酸内。在一个实施例中,组合物进一步包含模板核酸。在一个实施例中,模板核酸包含对应于靶位置的核苷酸的核苷酸。在一个实施例中,所述模板核酸包含对应于来自以下项的序列的靶位置的核苷酸的核苷酸:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,模板核酸是或包括来自以下项的序列的长度为10至500、10至400、10至300、10至200个核苷酸的片段:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,模板核酸是或包括长度为10至500、10至400、10至300、10至200个核苷酸的片段,其与以下项的对应序列相差至少1个核苷酸,但是不超过其核苷酸的5%、10%、20%或30%:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,所述Cas9分子和所述第二Cas9分子两者都介导单链断裂。在一个实施例中,所述Cas9分子和所述第二Cas9分子对不同PAM具有特异性,例如,一个对NGG具有特异性并且另一个对另一个PAM(例如,在此描述的另一个PAM)具有特异性。在一个实施例中,所述第一和第二断裂侧翼于靶位置。在一个实施例中,所述第一和第二单链断裂之一或两者独立地在靶位置的核苷酸的10、20、30、40、50、100、150或200个核苷酸内。在一个实施例中,组合物进一步包含模板核酸。在一个实施例中,模板核酸包含对应于靶位置的核苷酸的核苷酸。在一个实施例中,所述模板核酸包含对应于来自以下项的序列的靶位置的核苷酸的核苷酸:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,模板核酸是或包括来自以下项的序列的长度为10至500、10至400、10至300、10至200个核苷酸的片段:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,模板核酸是或包括长度为10至500、10至400、10至300、10至200个核苷酸的片段,其与以下项的对应序列相差至少1个核苷酸,但是不超过其核苷酸的5%、10%、20%或30%:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,所述gRNA分子、所述第二gRNA分子被配置成这样,使得第一和第二断裂在同一条链中。在一个实施例中,所述Cas9分子和所述第二Cas9分子对不同PAM具有特异性,例如,一个对NGG具有特异性并且另一个对另一个PAM(例如,在此描述的另一个PAM)具有特异性。在一个实施例中,所述gRNA分子、所述第二gRNA分子被配置成这样,使得第一和第二断裂侧翼于靶位置。在一个实施例中,所述第一和第二单链断裂之一或两者独立地在靶位置的核苷酸的10、20、30、40、50、100、150或200个核苷酸内。在一个实施例中,组合物进一步包含模板核酸。在一个实施例中,模板核酸包含对应于靶位置的核苷酸的核苷酸。在一个实施例中,所述模板核酸包含对应于来自以下项的序列的靶位置的核苷酸的核苷酸:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,模板核酸是或包括来自以下项的序列的长度为10至500、10至400、10至300、10至200个核苷酸的片段:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,模板核酸是或包括长度为10至500、10至400、10至300、10至200个核苷酸的片段,其与以下项的对应序列相差至少1个核苷酸,但是不超过其核苷酸的5%、10%、20%或30%:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,所述第一和第二断裂在不同链上。在一个实施例中,所述Cas9分子和所述第二Cas9分子对不同PAM具有特异性,例如,一个对NGG具有特异性并且另一个对另一个PAM(例如,在此描述的另一个PAM)具有特异性。在一个实施例中,所述gRNA分子、所述第二gRNA分子被配置成这样,使得第一和第二断裂在不同链上。在一个实施例中,所述gRNA分子、所述第二gRNA分子被配置成这样,使得第一和第二断裂侧翼于靶位置。在一个实施例中,所述第一和第二断裂侧翼于靶位置。在一个实施例中,所述第一和第二单链断裂之一或两者独立地在靶位置的核苷酸的10、20、30、40、50、100、150或200个核苷酸内。在一个实施例中,组合物进一步包含模板核酸。在一个实施例中,模板核酸包含对应于靶位置的核苷酸的核苷酸。在一个实施例中,所述模板核酸包含对应于来自以下项的序列的靶位置的核苷酸的核苷酸:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,模板核酸是或包括来自以下项的序列的长度为10至500、10至400、10至300、10至200个核苷酸的片段:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,模板核酸是或包括长度为10至500、10至400、10至300、10至200个核苷酸的片段,其与以下项的对应序列相差至少1个核苷酸,但是不超过其核苷酸的5%、10%、20%或30%:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1或第VIII部分中。在又另一个方面中,本披露的特征是一种组合物(例如,药物组合物),其包含统治型gRNA分子(例如,靶向Cas9的gRNA分子或靶向gRNA的gRNA分子)、在此描述的gRNA分子和第二gRNA分子。在一个实施例中,组合物进一步包含编码在此描述的Cas9分子的核酸,例如DNA或mRNA。在一个实施例中,组合物进一步包含编码在此描述的第二Cas9分子的核酸,例如DNA或RNA。在一个实施例中,组合物进一步包含在此描述的模板核酸。在一个方面中,本披露的特征是一种组合物(例如,药物组合物),其包含编码统治型gRNA分子(例如,靶向Cas9的gRNA分子或靶向gRNA的gRNA分子)的核酸序列(例如,DNA),以及一种或多种在此描述的gRNA分子。在一个实施例中,所述核酸包含启动子,该启动子可操作地连接至编码gRNA分子的序列,例如在此描述的启动子。在一个实施例中,所述核酸包含第二启动子,该启动子可操作地连接至编码第二gRNA分子的序列,例如在此描述的启动子。在一个实施例中,启动子和第二启动子是不同的启动子。在一个实施例中,启动子和第二启动子是相同的。在一个实施例中,核酸进一步编码在此描述的Cas9分子。在一个实施例中,核酸进一步编码在此描述的第二Cas9分子。在一个实施例中,所述核酸包含启动子,该启动子可操作地连接至编码Cas9分子的序列,例如在此描述的启动子。在一个实施例中,所述核酸包含第二启动子,该启动子可操作地连接至编码第二Cas9分子的序列,例如在此描述的启动子。在一个实施例中,启动子和第二启动子是不同的启动子。在一个实施例中,启动子和第二启动子是相同的。在一个实施例中,组合物进一步包含模板核酸,例如在此描述的模板核酸,例如在第IV部分中。在另一个方面中,本披露的特征是一种组合物(例如,药物组合物),其包含编码以下项中的一项或多项的核酸序列:a)Cas9分子,b)第二Cas9分子,c)gRNA分子,d)第二gRNA分子以及e)统治型gRNA分子,例如靶向Cas9的gRNA分子或靶向gRNA的gRNA分子。在一个实施例中,存在的a)、b)、c)、d)和e)中的每者在同一核酸分子上进行编码。在一个实施例中,选自a)、b)、c)、d)和e)的第一序列在第一核酸分子上进行编码,并且选自a)、b)、c)、d)和e)的第二序列在第二核酸分子上进行编码。在一个实施例中,所述核酸编码:a)、c)和e);a)、c)、d)和e);或a)、b)、c)、d)和e)。在一个实施例中,组合物进一步包含Cas9分子,例如包含Cas9分子中的一种或多种,其中所述核酸不编码Cas9分子。在一个实施例中,组合物进一步包含编码Cas9分子的mRNA,例如包含一种或多种编码Cas9分子中的一种或多种的mRNA,其中所述核酸不编码Cas9分子。在一个实施例中,组合物进一步包含模板核酸,例如在此描述的模板核酸,例如在第IV部分中。在又另一个方面中,本披露的特征是一种在此描述的核酸。在一个方面中,本披露的特征是一种组合物,其包含:a)gRNA分子(或gRNA分子的组合,例如gRNA分子和第二gRNA分子);b)eaCas9分子(或eaCas9分子的组合,例如eaCas9分子;和第二eaCas9分子);以及c)任选地模板核酸,例如在此描述的模板核酸,例如在第IV部分中。在另一个方面中,本披露的特征是一种组合物,其包含:a)gRNA分子(或gRNA分子的组合,例如gRNA分子和第二gRNA分子);b)核酸,例如DNA或mRNA,其编码eaCas9分子(或eaCas9分子的组合,例如eaCas9分子和第二eaCas9分子);c)任选地模板核酸,例如在此描述的模板核酸,例如在第IV部分中;以及d)统治型gRNA分子,例如靶向Cas9的gRNA分子。在又另一个方面中,本披露的特征是一种组合物,其包含:a)核酸,例如DNA,其编码gRNA分子(或gRNA分子的组合,例如gRNA分子和第二gRNA分子);b)eaCas9分子(或eaCas9分子的组合,例如eaCas9分子和第二eaCas9分子);c)任选地模板核酸,例如在此描述的模板核酸,例如在第IV部分中;以及d)统治型gRNA分子,例如靶向gRNA的gRNA分子。在仍另一个方面中,本披露的特征是一种组合物,其包含:a)核酸,例如DNA,其编码gRNA分子(或gRNA分子的组合,例如gRNA分子和第二gRNA分子);b)核酸,例如DNA或mRNA,其编码eaCas9分子(或eaCas9分子的组合,例如eaCas9分子和第二eaCas9分子)(其中编码gRNA分子的核酸和编码eaCas9分子的核酸可以在相同或不同分子上);c)任选地模板核酸,例如在此描述的模板核酸,例如在第IV部分中;以及d)统治型gRNA分子,例如靶向Cas9的gRNA分子或靶向gRNA的gRNA分子。在一个方面中,本披露的特征是一种改变细胞(例如,改变细胞的靶核酸的结构,例如序列)的方法,该方法包括使所述细胞与以下项接触:1)组合物,其包含:a)gRNA分子(或gRNA分子的组合,例如gRNA分子和第二gRNA分子);b)eaCas9分子(或eaCas9分子的组合,例如eaCas9分子;和第二eaCas9分子);和c)任选地模板核酸,例如在此描述的模板核酸,例如在第IV部分中;2)组合物,其包含:a)gRNA分子(或gRNA分子的组合,例如gRNA分子和第二gRNA分子);b)核酸,例如DNA或mRNA,其编码eaCas9分子(或eaCas9分子的组合,例如eaCas9分子和第二eaCas9分子);和c)任选地模板核酸,例如在此描述的模板核酸,例如在第IV部分中;和d)统治型gRNA分子,例如靶向Cas9的gRNA分子;3)组合物,其包含:a)核酸,例如DNA,其编码gRNA分子(或gRNA分子的组合,例如gRNA分子和第二gRNA分子);b)eaCas9分子(或eaCas9分子的组合,例如eaCas9分子和第二eaCas9分子);和c)任选地模板核酸,例如在此描述的模板核酸,例如在第IV部分中;和d)统治型gRNA分子,例如靶向Cas9的gRNA分子或靶向gRNA的gRNA分子;和/或4)组合物,其包含:a)核酸,例如DNA,其编码gRNA分子(或gRNA分子的组合,例如gRNA分子和第二gRNA分子);b)核酸,例如DNA或mRNA,其编码eaCas9分子(或eaCas9分子的组合,例如eaCas9分子和第二eaCas9分子)(其中编码gRNA分子的核酸和编码eaCas9分子的核酸可以在相同或不同分子上);和c)任选地模板核酸,例如在此描述的模板核酸,例如在第IV部分中;和d)统治型gRNA分子,例如靶向Cas9的gRNA分子或靶向gRNA的gRNA分子。在一个实施例中,以或通过一种剂型、递送方式或配方递送gRNA分子或编码gRNA分子的核酸以及eaCas9分子或编码eaCas9分子的核酸。在一个实施例中,a)以或通过第一剂型、第一递送方式或第一配方递送gRNA分子或编码gRNA分子的核酸;并且b)以或通过第二剂型、第二递送方式或第二配方递送eaCas9分子或编码eaCas9分子的核酸。在一个实施例中,将统治型gRNA分子(或编码它的核酸)(例如,靶向Cas9的gRNA分子或靶向gRNA的gRNA分子)以包含其失活的组分的剂型提供,或以另一种剂型、递送方式或配方提供。在一个实施例中,细胞是动物或植物细胞。在一个实施例中,细胞是哺乳动物、灵长类动物或人类细胞。在一个实施例中,细胞是人类细胞,例如来自在此描述的细胞,例如在第VIIA部分中。在一个实施例中,细胞是:体细胞、生殖细胞、产前细胞(例如,合子、囊胚或胚细胞、囊胚细胞)、干细胞、有丝分裂感受态细胞、减数分裂感受态细胞。在一个实施例中,细胞是人类细胞,例如癌细胞或由疾病或障碍表征的其他细胞。在一个实施例中,靶核酸是染色体核酸。在一个实施例中,靶核酸是细胞器核酸。在一个实施例中,靶核酸是线粒体核酸。在一个实施例中,靶核酸是叶绿体核酸。在一个实施例中,细胞是致病生物的细胞,该致病生物是例如病毒、细菌、真菌、原生动物或寄生虫。在一个实施例中,靶核酸是致病生物的核酸,该致病生物是例如病毒、细菌、真菌、原生动物或寄生虫。在一个实施例中,所述方法包括:调节基因表达或使疾病生物失活。在一个实施例中,所述细胞是由不想要的增殖表征的细胞,例如癌细胞。在一个实施例中,所述细胞是由不想要的基因组组分(例如,病毒基因组组分)表征的细胞。在一个实施例中,细胞是在此描述的细胞,例如在第IIA部分中。在一个实施例中,至少2、3、4、5或6个或更多个基因的控制或结构序列被改变。在一个实施例中,靶核酸是重排体,包含激酶基因的重排体或包含肿瘤抑制基因的重排体。在一个实施例中,靶核酸包含激酶基因或肿瘤抑制基因。在一个实施例中,该方法包括切割靶位置的核苷酸的10、20、30、40、50、100、150或200个核苷酸内的靶核酸。在一个实施例中,所述组合物包含模板核酸。在一个实施例中,模板核酸包含对应于靶位置的核苷酸的核苷酸。在一个实施例中,所述模板核酸包含对应于来自以下项的序列的靶位置的核苷酸的核苷酸:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,模板核酸是或包括来自以下项的序列的长度为10至500、10至400、10至300、10至200个核苷酸的片段:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,模板核酸是或包括长度为10至500、10至400、10至300、10至200个核苷酸的片段,其与以下项的对应序列相差至少1个核苷酸,但是不超过其核苷酸的5%、10%、20%或30%:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,a)基因的控制区(例如,顺式作用或反式作用控制区)被切割;b)基因的控制区(例如,顺式作用或反式作用控制区)的序列被改变,例如通过调节(例如,增加或降低)处于控制区的控制下的基因的表达的改变,例如,控制序列被破坏或插入新的控制序列;c)基因的编码序列被切割;d)基因的转录区的序列(例如,编码序列)被改变,例如校正或引入突变,实现增加基因产物的表达或增加基因产物的活性的改变,例如校正突变;和/或e)基因的转录区的序列(例如,编码序列)被改变,例如校正或引入突变,实现减少基因产物的表达或减少基因产物的活性的改变,例如插入突变,例如改变一个或多个核苷酸的序列以便插入终止密码子。在一个实施例中,至少2、3、4、5或6个或更多个基因的控制区或转录区(例如,编码序列)被改变。在另一个方面中,本披露的特征是一种例如通过改变靶核酸的结构(例如,改变其序列)来治疗受试者的方法,该方法包括向该受试者施用有效量的以下项:1)组合物,其包含:a)gRNA分子(或gRNA分子的组合,例如gRNA分子和第二gRNA分子);b)eaCas9分子(或eaCas9分子的组合,例如eaCas9分子;和第二eaCas9分子);和c)任选地模板核酸,例如在此描述的模板核酸,例如在第IV部分中;2)组合物,其包含:a)gRNA分子(或gRNA分子的组合,例如gRNA分子和第二gRNA分子);b)核酸,例如DNA或mRNA,其编码eaCas9分子(或eaCas9分子的组合,例如eaCas9分子和第二eaCas9分子);和c)任选地模板核酸,例如在此描述的模板核酸,例如在第IV部分中;和d)统治型gRNA分子,例如靶向Cas9的gRNA分子;3)组合物,其包含:a)核酸,例如DNA,其编码gRNA分子(或gRNA分子的组合,例如gRNA分子和第二gRNA分子);b)eaCas9分子(或eaCas9分子的组合,例如eaCas9分子和第二eaCas9分子);和c)任选地模板核酸,例如在此描述的模板核酸,例如在第IV部分中;和d)统治型gRNA分子,例如靶向gRNA的gRNA分子;和/或4)组合物,其包含:a)核酸,例如DNA,其编码gRNA分子(或gRNA分子的组合,例如gRNA分子和第二gRNA分子);b)核酸,例如DNA或mRNA,其编码eaCas9分子(或eaCas9分子的组合,例如eaCas9分子和第二eaCas9分子)(其中编码gRNA分子的核酸和编码eaCas9分子的核酸可以在相同或不同分子上);和c)任选地模板核酸,例如在此描述的模板核酸,例如在第IV部分中;和d)统治型gRNA分子,例如靶向Cas9的gRNA分子或靶向gRNA的gRNA分子。在一个实施例中,以或通过一种剂型、递送方式或配方递送gRNA分子或编码gRNA分子的核酸以及eaCas9分子或编码eaCas9分子的核酸。在一个实施例中,将统治型gRNA分子(或编码它的核酸)(例如,靶向Cas9的gRNA分子或靶向gRNA的gRNA分子)以包含其失活的组分的剂型提供,或以另一种剂型、递送方式或配方提供。在一个实施例中,以或通过第一剂型、以第一递送方式或第一配方递送gRNA分子或编码gRNA分子的核酸;并且以或通过第二剂型、第二递送方式或第二配方递送eaCas9分子或编码eaCas9分子的核酸。在一个实施例中,可以将统治型gRNA分子(或编码它的核酸)(例如,靶向Cas9的gRNA分子或靶向gRNA的gRNA分子)以包含其失活的组分的剂型提供,或以另一种剂型、递送方式或配方提供。在一个实施例中,受试者是动物或植物。在一个实施例中,受试者是哺乳动物、灵长类动物或人。在一个实施例中,靶核酸是人类细胞(例如在此描述的细胞,例如在第VIIA部分中)的核酸。在一个实施例中,靶核酸是以下项的核酸:体细胞、生殖细胞、产前细胞(例如,合子、囊胚或胚细胞、囊胚细胞)、干细胞、有丝分裂感受态细胞、减数分裂感受态细胞。在一个实施例中,靶核酸是染色体核酸。在一个实施例中,靶核酸是细胞器核酸。在一个实施例中,核酸是线粒体核酸。在一个实施例中,核酸是叶绿体核酸。在一个实施例中,靶核酸是致病生物的核酸,该致病生物是例如病毒、细菌、真菌、原生动物或寄生虫。在一个实施例中,所述方法包括调节基因表达或使疾病生物失活。在一个实施例中,靶核酸是由不想要的增殖表征的细胞(例如,癌细胞)的核酸。在一个实施例中,所述靶核酸包含不想要的基因组组分,例如病毒基因组组分。在一个实施例中,至少2、3、4、5或6个或更多个基因的控制或结构序列被改变。在一个实施例中,靶核酸是重排体,包含激酶基因的重排体或包含肿瘤抑制基因的重排体。在一个实施例中,靶核酸包含激酶基因或肿瘤抑制基因。在一个实施例中,该方法包括切割靶位置的核苷酸的10、20、30、40、50、100、150或200个核苷酸内的靶核酸。在一个实施例中,所述组合物包含模板核酸。在一个实施例中,模板核酸包含对应于靶位置的核苷酸的核苷酸。在一个实施例中,所述模板核酸包含对应于来自以下项的序列的靶位置的核苷酸的核苷酸:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,模板核酸是或包括来自以下项的序列的长度为10至500、10至400、10至300、10至200个核苷酸的片段:在此描述的基因或来自通路的基因,例如在第VIIB部分中,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3或XII-1中,或在第VIII部分中。在一个实施例中,模板核酸是或包括长度为10至500、10至400、10至300、10至200个核苷酸的片段,其与以下项的对应序列相差至少1个核苷酸,但是不超过其核苷酸的5%、10%、20%或30%:在一个实施例中,a)基因的控制区(例如,顺式作用或反式作用控制区)被切割;b)基因的控制区(例如,顺式作用或反式作用控制区)的序列被改变,例如通过调节(例如,增加或降低处于控制区的控制下的基因的表达)的改变,例如,控制序列被破坏或插入新的控制序列;c)基因的编码序列被切割;d)基因的转录区的序列(例如,编码序列)被改变,例如校正或引入突变,实现增加基因产物的表达或活性的改变,例如校正突变;e)基因的非编码序列或基因之间的基因间区被切割;和/或f)基因的转录区的序列(例如,编码序列)被改变,例如校正或引入突变,实现减少基因产物的表达或活性的改变,例如插入突变,例如改变一个或多个核苷酸的序列以便插入终止密码子。在一个实施例中,至少2、3、4、5或6个或更多个基因的控制区或转录区(例如,编码序列)被改变。在一个方面中,本披露的特征是一种组合物,其包含:a)gRNA分子(或gRNA分子的组合,例如gRNA分子和第二gRNA分子);b)Cas9分子,例如eiCas9分子(或Cas9分子的组合,例如eiCas9分子和第二eiCas9分子);以及c)有效载荷,其共价地或非共价地偶联至gRNA分子和Cas9分子的复合物,例如偶联至Cas9分子或gRNA分子。在另一个方面中,本披露的特征是一种组合物,其包含:a)gRNA分子(或gRNA分子的组合,例如gRNA分子和第二gRNA分子);b)核酸,例如DNA或mRNA,其编码Cas9分子,例如eiCas9分子(或Cas9分子的组合,例如eiCas9分子和第二eiCas9分子);以及c)有效载荷,其共价地或非共价地偶联至gRNA分子;或是与Cas9分子的融合配偶体。在又另一个方面中,本披露的特征是一种组合物,其包含:a)核酸,例如DNA,其编码gRNA分子(或gRNA分子的组合,例如gRNA分子和第二gRNA分子);b)Cas9分子,例如eiCas9分子(或Cas9分子的组合,例如eiCas9分子和第二eiCas9分子);c)有效载荷,其共价地或非共价地偶联至Cas9分子;以及d)统治型gRNA分子,例如靶向gRNA的gRNA分子。在仍另一个方面中,本披露的特征是一种组合物,其包含:a)核酸,例如DNA,其编码gRNA分子(或gRNA分子的组合,例如gRNA分子和第二gRNA分子);b)核酸,例如DNA或mRNA,其编码Cas9分子,例如eiCas9分子(或Cas9分子的组合,例如eiCas9分子和第二eiCas9分子),其中编码gRNA分子的核酸和编码eaCas9分子的核酸可以在相同或不同分子上;c)有效载荷,其是与Cas9分子的融合配偶体;以及d)统治型gRNA分子,例如靶向Cas9的gRNA分子或靶向gRNA的gRNA分子。在一个方面中,本披露的特征是一种将有效载荷递送至细胞的方法,例如通过将有效载荷靶向靶核酸,该方法包括使所述细胞与以下项接触:1)组合物,其包含:a)gRNA分子(或gRNA分子的组合,例如gRNA分子和第二gRNA分子);b)Cas9分子,例如eiCas9分子(或Cas9分子的组合,例如eiCas9分子和第二eiCas9分子);和c)有效载荷,其共价地或非共价地偶联至gRNA分子和Cas9分子的复合物,例如偶联至Cas9分子或gRNA分子;2)组合物,其包含:a)gRNA分子(或gRNA分子的组合,例如gRNA分子和第二gRNA分子);b)核酸,例如DNA或mRNA,其编码Cas9分子,例如eiCas9分子(或Cas9分子的组合,例如eiCas9分子和第二eiCas9分子);c)有效载荷,其共价地或非共价地偶联至gRNA分子;或是与Cas9分子的融合配偶体;3)组合物,其包含:a)核酸,例如DNA,其编码gRNA分子(或gRNA分子的组合,例如gRNA分子和第二gRNA分子);b)Cas9分子,例如eiCas9分子(或Cas9分子的组合,例如eiCas9分子和第二eiCas9分子);c)有效载荷,其共价地或非共价地偶联至Cas9分子;和d)统治型gRNA分子,例如靶向gRNA的gRNA分子;和/或4)组合物,其包含:a)核酸,例如DNA,其编码gRNA分子(或gRNA分子的组合,例如gRNA分子和第二gRNA分子);b)核酸,例如DNA或mRNA,其编码Cas9分子,例如eiCas9分子(或Cas9分子的组合,例如eiCas9分子和第二eiCas9分子),其中编码gRNA分子的核酸和编码eaCas9分子的核酸可以在相同或不同分子上;c)有效载荷,其是与Cas9分子的融合配偶体;和d)统治型gRNA分子,例如靶向Cas9的gRNA分子或靶向gRNA的gRNA分子。在一个实施例中,以或通过一种剂型、递送方式或配方递送gRNA分子或编码gRNA分子的核酸以及eaCas9分子或编码eaCas9分子的核酸。在一个实施例中,将统治型gRNA分子(或编码它的核酸)(例如,靶向Cas9的gRNA分子或靶向gRNA的gRNA分子)以包含其失活的组分的剂型提供,或以另一种剂型、递送方式或配方提供。在一个实施例中,以或通过第一剂型、第一递送方式或第一配方递送gRNA分子或编码gRNA分子的核酸;并且以或通过第二剂型、第二递送方式或第二配方递送Cas9分子或编码Cas9分子的核酸。在一个实施例中,将统治型gRNA分子(或编码它的核酸)(例如,靶向Cas9的gRNA分子或靶向gRNA的gRNA分子)以包含它使其失活的组分的剂型提供,或以另一种剂型、递送方式或配方提供。在一个实施例中,细胞是动物或植物细胞。在一个实施例中,细胞是哺乳动物、灵长类动物或人类细胞。在一个实施例中,细胞是人类细胞,例如在此描述的人类细胞,例如在第VIIA部分中。在一个实施例中,细胞是:体细胞、生殖细胞、产前细胞(例如,合子、囊胚或胚细胞、囊胚细胞)、干细胞、有丝分裂感受态细胞、减数分裂感受态细胞。在一个实施例中,细胞是人类细胞,例如癌细胞、包含不想要的遗传元件(例如,全部或部分的病毒基因组)的细胞。在一个实施例中,gRNA介导染色体核酸的靶向。在一个实施例中,gRNA介导所选基因组标签的靶向。在一个实施例中,gRNA介导细胞器核酸的靶向。在一个实施例中,gRNA介导线粒体核酸的靶向。在一个实施例中,gRNA介导叶绿体核酸的靶向。在一个实施例中,细胞是致病生物的细胞,该致病生物是例如病毒、细菌、真菌、原生动物或寄生虫。在一个实施例中,gRNA介导致病生物的核酸的靶向,该致病生物是例如病毒、细菌、真菌、原生动物或寄生虫。在一个实施例中,有效载荷包括在此描述的有效载荷,例如在第VI部分中。在一个实施例中,所述细胞是由不想要的增殖表征的细胞,例如癌细胞。在一个实施例中,所述细胞由不想要的基因组组分(例如,病毒基因组组分)表征。在一个实施例中,至少2、3、4、5或6个或更多个基因的控制或结构序列被改变。在一个实施例中,gRNA靶向所选基因组标签,例如突变,例如种系的或获得性体细胞突变。在一个实施例中,靶核酸是重排体,包含激酶基因的重排体或包含肿瘤抑制基因的重排体。在一个实施例中,靶核酸包含激酶基因或肿瘤抑制基因。在一个实施例中,gRNA靶向癌细胞,例如在此披露的癌细胞,例如在第VIIA部分中。在一个实施例中,gRNA靶向已经被病毒感染的细胞。在另一个方面中,本披露的特征是一种例如通过将有效载荷靶向靶核酸来治疗受试者的方法,该方法包括向该受试者施用有效量的以下项:1)组合物,其包含:a)gRNA分子(或gRNA分子的组合,例如gRNA分子和第二gRNA分子);b)Cas9分子,例如eiCas9分子(或Cas9分子的组合,例如eiCas9分子和第二eiCas9分子);和c)有效载荷,其共价地或非共价地偶联至gRNA分子和Cas9分子的复合物,例如偶联至Cas9分子;2)组合物,其包含:a)gRNA分子(或gRNA分子的组合,例如gRNA分子和第二gRNA分子);b)核酸,例如DNA或mRNA,其编码Cas9分子,例如eiCas9分子(或Cas9分子的组合,例如eiCas9分子和第二eiCas9分子);c)有效载荷,其:共价地或非共价地偶联至gRNA分子;或是与Cas9分子的融合配偶体;和d)统治型gRNA分子,例如靶向Cas9的gRNA分子;3)组合物,其包含:a)核酸,例如DNA,其编码gRNA分子(或gRNA分子的组合,例如gRNA分子和第二gRNA分子);b)Cas9分子,例如eiCas9分子(或Cas9分子的组合,例如eiCas9分子和第二eiCas9分子);和c)有效载荷,其共价地或非共价地偶联至Cas9分子;和d)统治型gRNA分子,例如靶向gRNA的gRNA分子;和/或4)组合物,其包含:a)核酸,例如DNA,其编码gRNA分子(或gRNA分子的组合,例如gRNA分子和第二gRNA分子);b)核酸,例如DNA或mRNA,其编码Cas9分子,例如eiCas9分子(或Cas9分子的组合,例如eiCas9分子和第二eiCas9分子)(其中编码gRNA分子的核酸和编码eaCas9分子的核酸可以在相同或不同分子上);c)有效载荷,其是与Cas9分子的融合配偶体;和d)统治型gRNA分子,例如靶向Cas9的gRNA分子或靶向gRNA的gRNA分子。在一个实施例中,以或通过一种剂型、递送方式或配方递送gRNA分子或编码gRNA分子的核酸以及eaCas9分子或编码eaCas9分子的核酸。在一个实施例中,可以将统治型gRNA分子(或编码它的核酸)(例如,靶向Cas9的gRNA分子或靶向gRNA的gRNA分子)以包含它使其失活的组分的剂型提供,或以另一种剂型、递送方式或配方提供。在一个实施例中,以或通过第一剂型、递送方式或配方递送gRNA分子或编码gRNA分子的核酸;并且以或通过第二剂型、递送方式或配方递送Cas9分子或编码Cas9分子的核酸。在一个实施例中,可以将统治型gRNA分子(或编码它的核酸)(例如,靶向Cas9的gRNA分子或靶向gRNA的gRNA分子)以包含其失活的组分的剂型提供,或以另一种剂型、递送方式或配方提供。在一个实施例中,受试者是动物或植物细胞。在一个实施例中,受试者是哺乳动物、灵长类动物或人类细胞。在一个实施例中,gRNA介导人类细胞的靶向,例如在此描述的人类细胞,例如在第VIIA部分中。在一个实施例中,gRNA介导以下项的靶向:体细胞、生殖细胞、产前细胞(例如,合子、囊胚或胚细胞、囊胚细胞)、干细胞、有丝分裂感受态细胞、减数分裂感受态细胞。在一个实施例中,gRNA介导癌细胞或包含不想要的基因组元件(例如,全部或部分的病毒基因组)的细胞的靶向。在一个实施例中,gRNA介导染色体核酸的靶向。在一个实施例中,gRNA介导所选基因组标签的靶向。在一个实施例中,gRNA介导细胞器核酸的靶向。在一个实施例中,gRNA介导线粒体核酸的靶向。在一个实施例中,gRNA介导叶绿体核酸的靶向。在一个实施例中,gRNA介导致病生物的核酸的靶向,该致病生物是例如病毒、细菌、真菌、原生动物或寄生虫。在一个实施例中,gRNA靶向由不想要的增殖表征的细胞,例如癌细胞,例如来自第VIIA部分的癌细胞,例如来自表VII-11。在一个实施例中,gRNA靶向由不想要的基因组组分(例如,病毒基因组组分)表征的细胞。在一个实施例中,靶向控制元件,例如启动子或增强子。在一个实施例中,靶核酸是重排体,包含激酶基因的重排体或包含肿瘤抑制基因的重排体。在一个实施例中,靶核酸包含激酶基因或肿瘤抑制基因。在一个实施例中,gRNA靶向所选基因组标签,例如突变,例如种系的或获得性体细胞突变。在一个实施例中,gRNA靶向癌细胞。在一个实施例中,gRNA靶向已经被病毒感染的细胞。在一个实施例中,施用至少一种eaCas9分子与有效载荷。在一个实施例中,有效载荷包括在此描述的有效载荷,例如在第VI部分中。除非另外定义,在此使用的全部技术术语和科学术语具有与本发明所属领域内的普通技术人员通常所理解的相同含义。尽管可以在本发明的实践或测试中使用类似于或等效于在此描述的那些的方法和材料,但是下文描述了适合的方法和材料。在此提及的所有出版物、专利申请、专利和其他参考文献通过引用以其全文而结合。另外,材料、方法和实例仅是说明性的并不旨在是限制性的。标题(包括数字和按字母顺序排列标题和副标题)用于组织和呈现并且不旨在是限制性的。本发明的其他特征和优势从详细说明、附图以及从权利要求书将变得显而易见。附图说明共同构成附图的下述图仅出于说明目的,并非限制目的。图1A-G是若干示例性gRNA的表示。图1A描绘了部分来源于(或部分地在序列上建模)化脓链球菌(Streptococcuspyogenes,S.pyogenes)呈双链体结构的模块化gRNA分子(按照出现次序分别是SEQIDNO42和43);图1B描绘了部分来源于化脓链球菌呈双链体结构的单分子(或嵌合)gRNA分子(SEQIDNO:44);图1C描绘了部分来源于化脓链球菌呈双链体结构的单分子gRNA分子(SEQIDNO:45);图1D描绘了部分来源于化脓链球菌呈双链体结构的单分子gRNA分子(SEQIDNO:46);图1E描绘了部分来源于化脓链球菌呈双链体结构的单分子gRNA分子(SEQIDNO:47);图1F描绘了部分来源于嗜热链球菌(Streptococcusthermophilus,S.thermophilus)呈双链体结构的模块化gRNA分子(按照出现次序分别是SEQIDNO48和49);图1G描绘了化脓链球菌和嗜热链球菌的模块化gRNA分子(按照出现次序分别是SEQIDNO50-53)的比对。图2描绘了来自吉林斯基(Chylinski)等人,RNA生物学(RNABIOL.)2013;10(5):726-737的Cas9序列的比对。N-末端RuvC样结构域加框并且以“Y”指示。其他两个RuvC样结构域加框并且以“B”指示。HNH样结构域加框并且以“G”指示。Sm:变异链球菌(Smutans)(SEQIDNO:1);Sp:化脓链球菌(Spyogenes)(SEQIDNO:2);St:嗜热链球菌(Sthermophiles)(SEQIDNO:3);Li:无害利斯特菌(Linnocua)(SEQIDNO:4)。Motif:这是基于四个序列的基序:在所有四个序列中保守的残基通过单字母氨基酸缩写指示;“*”指示在四个序列的任一者的相应位置中发现的任何氨基酸;并且“-”指示任何氨基酸,例如20种天然发生的氨基酸中的任一种。图3A示出了来自披露于吉林斯基(Chylinski)等人中的Cas9分子的N-末端RuvC-样结构域(按照出现次序分别是SEQIDNO54-103)的比对。图3A的最后一行鉴定了3个高度保守的残基。图3B示出了来自披露于吉林斯基(Chylinski)等人中的除去序列异常值的Cas9分子的N-末端RuvC-样结构域(按照出现次序分别是SEQIDNO104-177)的比对。图3B的最后一行鉴定了4个高度保守的残基。图4A示出了来自披露于吉林斯基(Chylinski)等人中的Cas9分子的HNH样结构域(按照出现次序分别是SEQIDNO178-252)的比对。图4A的最后一行鉴定了保守残基。图4B示出了来自披露于吉林斯基(Chylinski)等人中的除去序列异常值的Cas9分子的HNH样结构域(按照出现次序分别是SEQIDNO253-302)的比对。图4B的最后一行鉴定了3个高度保守的残基。图5描绘了来自化脓链球菌和脑膜炎奈瑟氏菌(Neisseriameningitidis,N.meningitidis)的Cas9序列的比对。N-末端RuvC样结构域加框并且以“Y”指示。其他两个RuvC样结构域加框并且以“B”指示。HNH样结构域加框并且以“G”指示。Sp:化脓链球菌;Nm:脑膜炎奈瑟氏菌。Motif:这是基于两个序列的基序:在两个序列中保守的残基通过单个氨基酸名称指示;“*”指示在两个序列的任一者的相应位置中发现的任何氨基酸;“-”指示任何氨基酸,例如20种天然发生的氨基酸中的任一种,并且“-”指示任何氨基酸,例如20种天然发生的氨基酸中的任一种或不存在。图6示出了编码脑膜炎奈瑟氏菌的Cas9的核酸序列(SEQIDNO:303)。以“R”指示的序列是SV40NLS;作为“G”指示的序列是HA标签;以“O”指示的序列是合成的NLS序列。剩余的(未标记的)序列是开放阅读框(ORF)。图7描绘了在转染后1、2、3、6和9天时用靶向Cas9的统治型gRNA中的每者转染的细胞中的Cas9蛋白质表达水平。定义如在此使用的,“统治型gRNA分子”是指一种gRNA分子,该分子可以与Cas9分子复合,以使Cas9系统的组分失活或沉默。在一个实施例中,统治型gRNA分子使一种包括编码Cas9分子的序列的核酸失活或沉默。在一个实施例中,它使包括编码gRNA分子的序列的核酸失活或沉默。在一个实施例中,统治型gRNA(例如,靶向Cas9的gRNA分子或靶向gRNA的gRNA分子)限制Cas9分子/gRNA分子复合物介导的基因靶向的作用。在一个实施例中,它将对Cas9分子/gRNA分子复合物的活性施加时间限制、表达水平限制、或其他限制。在一个实施例中,它减少脱靶或其他不想要的活性。统治型gRNA分子可以起到抑制(例如,完全或基本上抑制)Cas9系统的组分的生产(例如,Cas9分子)、并且由此限制或控制其活性的作用。统治型gRNA分子可以靶向包含编码有待负向调节的组分的序列的核酸的任何区域,在该组分的转录或翻译区之内或之外,只要该组分的生产是减少的。在一个实施例中,统治型gRNA分子包括一种靶向序列,该靶向序列与核酸上的靶序列互补,在该核酸上序列编码有待负向调节的组分。在一个实施例中,统治型gRNA分子包括一种靶向序列,该靶向序列与有待负向调节的组分的序列互补。在一个实施例中,靶向Cas9的gRNA分子可以包括靶向序列,该靶向序列靶向核酸,在该核酸上序列编码Cas9分子残基。在一个实施例中,靶向Cas9的gRNA分子可以包括靶向序列,该靶向序列靶向Cas9分子序列。在一个实施例中,靶向gRNA的gRNA分子可以包括靶向序列,该靶向序列靶向核酸,在该核酸上序列编码gRNA分子残基。在一个实施例中,靶向gRNA的gRNA分子可以包括靶向序列,该靶向序列靶向gRNA分子序列。如在此使用的,“结构域”是用于描述蛋白或核酸的区段。除非另外指明,结构域不需要具有任何特定功能特性。“同源性”或两个序列之间的“序列一致性”(这些术语在此可互换地使用)的计算进行如下。将这些序列进行比对用于最优比较的目的(例如,用于最优比对,可以在第一和第二氨基酸或核酸序列中一个或两个中引入空位,并且出于比较的目的,可以不考虑非同源序列)。使用具有Blosum62打分矩阵(其中空位罚分为12,空位延伸罚分为4,并且移码空位罚分为5)的GCG软件包中的GAP程序,将最优比对确定为该最佳评分。然后比较相应的氨基酸位置或核苷酸位置处的氨基酸残基或核苷酸。当第一序列中的位置被与在第二序列中的相应位置相同的氨基酸残基或核苷酸占据时,则这些分子在那个位置是一致的(如在此使用的,在一个实施例中,氨基酸或核酸“一致性”等同于氨基酸或核酸“同源性”)。两个序列之间的百分比一致性是这些序列共享的一致位置的数目的函数。如在此使用的,“调节剂”是指可改变受试分子或遗传序列的活性(例如,酶活性、转录活性、或翻译活性)、量、分布、或结构的实体(例如,药物)。在一个实施例中,调节包括切割,例如,共价或非共价键的断裂、或共价或非共价键的形成,例如,将部分附接至受试分子。在一个实施例中,调节剂改变受试分子的三维、二级、三级、或四级结构。调节剂可以增加、降低、引发、或消除受试活性。如在此使用的,“大分子”是指具有分子量为至少2、3、5、10、20、30、40、50、60、70、80、90、或100kD的分子。大分子包括蛋白质、多肽、核酸、生物制剂、和碳水化合物。如在此使用的,“多肽”是指具有少于100个氨基酸残基的氨基酸的聚合物。在一个实施例中,它具有少于50、20、或10个氨基酸残基。如在此使用的,“参比分子”(例如,参比Cas9分子或参比gRNA)是指与受试分子(例如,受试gRNA分子的受试Cas9分子(例如,修饰的或候选Cas9分子))进行比较的分子。例如,可以将Cas9分子表征为具有不多于参比Cas9分子的核酸酶活性的10%。参比Cas9分子的实例包括天然发生的未修饰的Cas9分子(例如,天然发生的Cas9分子,如化脓链球菌或嗜热链球菌的Cas9分子)。在实一个施例中,参比Cas9分子是具有和与其进行比较的Cas9分子最接近序列一致性或同源性的天然发生的Cas9分子。在一个实施例中,参比Cas9分子是一种序列(例如,天然发生的或已知序列),其是其上已经发生改变(例如,突变)的亲代类型。如在此关于分子的修饰所使用的“替换”或“替换的”不需要方法限制,但仅表明替换实体是存在的。如在此使用的,“小分子”是指一种具有小于约2kD(例如,小于约2kD、小于约1.5kD、小于约1kD、或小于约0.75kD)的分子量的化合物。如在此使用的,“受试者”可以意指人或非人动物。该术语包括但不局限于,哺乳动物(例如,人类、其他灵长类动物、猪、啮齿动物(例如,小鼠和大鼠或仓鼠)、兔、豚鼠、奶牛、马、猫、狗、绵羊、以及山羊)。在一个实施例中,该受试者是人。在一个实施例中,该受试者是家禽。如在此使用的,“治疗(treat、treating和treatment)”意指治疗哺乳动物中(例如,在人类中)的疾病,包括(a)抑制该疾病,即抑制或防止其发展;(b)缓解该疾病,即,导致疾病状态的消退;或(c)治愈该疾病。如在此使用的在氨基酸序列的语境下的“X”是指任何氨基酸(例如,二十种天然氨基酸中的任何一种),除非另外说明。详细说明I.gRNA分子gRNA分子,如该术语在此所使用,是指一种核酸,该核酸促进gRNA分子/Cas9分子复合物特异性靶向或归巢至靶核酸。gRNA分子可以是单分子的(具有单个RNA分子),有时在此被称为“嵌合的”gRNA、或模块化(包括多于一个,并且典型地两个,单独的RNA分子)。gRNA分子包括多个结构域。以下更详细地描述了该gRNA分子结构域。典型地,gRNA将合并crRNA和tracrRNA二者的功能或结构,例如,加工的或成熟的crRNA与加工的或成熟的tracrRNA的功能。嵌合或单分子的gRNA分子可以具有单个的RNA分子,例如,其合并crRNA功能或结构与tracrRNA功能或结构两者。模块化gRNA分子可以包括合并crRNA功能或结构的RNA分子,另一种合并该tracrRNA功能或结构。若干示例性gRNA结构,结构域在其上所指示,被提供在图1中。虽然不希望受理论束缚,但对于gRNA的该三维形式、或活化形式的内-或间-链相互作用,高度互补的区域有时显示为双链体在图1和在此提供的其他描绘中。在一个实施例中,单分子的、或嵌合的gRNA包含,优选地从5’到3':靶向结构域,例如,包括15、16、17、18、19、或20个核苷酸(其与靶核酸互补);第一互补结构域;连接结构域;第二互补结构域(其与该第一互补结构域互补);近端结构域;以及任选地,尾部结构域。在一个实施例中,模块化gRNA包括:第一链,包括优选地从5’到3’:靶向结构域(其与来自在此披露的靶核酸的靶序列是互补的,例如,序列来自:在此描述的基因或通路,例如在第VIIB部分,例如在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3、或XII-1、或在第VIII部分中);以及第一互补结构域;以及第二链,包括优选地从5’到3’:任选地,5’延伸结构域;第二互补结构域;以及近端结构域;以及任选地,尾部结构域。这些结构域简要讨论如下:1)靶向结构域:图1A-1G提供了靶向结构域的布局的实例。该靶向结构域包括核苷酸序列,该核苷酸序列与该靶核酸上的靶序列是互补的,例如至少80%、85%、90%、或95%互补,例如,完全互补。该靶向结构域是RNA分子的一部分并且因此将包括碱基尿嘧啶(U),同时任何编码该gRNA分子的DNA将包括碱基胸腺嘧啶(T)。虽然不希望受理论束缚,但认为该靶向结构域与该靶序列的互补性有利于该gRNA分子/Cas9分子复合物与靶核酸的相互作用的特异性。应当理解,在靶向结构域和靶序列对中,该靶向结构域中的尿嘧啶碱基将与该靶序列中腺嘌呤碱基配对。在一个实施例中,该靶结构域自身包含,以5’到3’方向,任选的第二结构域、和核心结构域。在一个实施例中,该核心结构域与该靶序列完全互补。在一个实施例中,该靶向结构域在长度上是5至50,例如,10至40,例如,10至30,例如,15至30,例如,15至25个核苷酸。在一个实施例中,该靶向结构域在长度上是15、16、17、18、19、20、21、22、23、24、25、或26个核苷酸。与靶向结构域互补的靶核酸的链在此称为互补链。该结构域的一些或所有核苷酸可以具有修饰,例如,在此处第X部分中发现的修饰。在一个实施例中,该靶向结构域在长度上是15个核苷酸。在一个实施例中,该靶向结构域在长度上是16个核苷酸。在一个实施例中,该靶向结构域在长度上是17个核苷酸。在一个实施例中,该靶向结构域在长度上是18个核苷酸。在一个实施例中,该靶向结构域在长度上是19个核苷酸。在一个实施例中,该靶向结构域在长度上是20个核苷酸。在一个实施例中,该靶向结构域在长度上是21个核苷酸。在一个实施例中,该靶向结构域在长度上是22个核苷酸。在一个实施例中,该靶向结构域在长度上是23个核苷酸。在一个实施例中,该靶向结构域在长度上是24个核苷酸。在一个实施例中,该靶向结构域在长度上是25个核苷酸。在一个实施例中,该靶向结构域在长度上是26个核苷酸。在一个实施例中,该靶向结构域包含15个核苷酸。在一个实施例中,该靶向结构域包含16个核苷酸。在一个实施例中,该靶向结构域包含17个核苷酸。在一个实施例中,该靶向结构域包含18个核苷酸。在一个实施例中,该靶向结构域包含19个核苷酸。在一个实施例中,该靶向结构域包含20个核苷酸。在一个实施例中,该靶向结构域包含21个核苷酸。在一个实施例中,该靶向结构域包含22个核苷酸。在一个实施例中,该靶向结构域包含23个核苷酸。在一个实施例中,该靶向结构域包含24个核苷酸。在一个实施例中,该靶向结构域包含25个核苷酸。在一个实施例中,该靶向结构域包含26个核苷酸。以下更详细地论述了靶向结构域。2)第一互补结构域:图1A-1G提供了第一互补结构域的实例。该第一互补结构域与该第二互补结构域是互补的,并且在一个实施例中,与该第二互补结构域具有足够的互补性以在至少一些生理条件下形成双链体区域。在一个实施例中,该第一互补结构域在长度上是5至30个核苷酸。在一个实施例中,该第一互补结构域在长度上是5至25个核苷酸。在一个实施例中,该第一互补结构域在长度上是7至25个核苷酸。在一个实施例中,该第一互补结构域在长度上是7至22个核苷酸。在一个实施例中,该第一互补结构域在长度上是7至18个核苷酸。在一个实施例中,该第一互补结构域在长度上是7至15个核苷酸。在一个实施例中,该第一互补结构域在长度上是5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、或25个核苷酸。在一个实施例中,该第一互补结构域包含3个亚结构域,其按5’到3’方向是:5’亚结构域、中央亚结构域、和3’亚结构域。在一个实施例中,该5’亚结构域在长度上是4-9(例如,4、5、6、7、8或9)个核苷酸。在一个实施例中,该中央亚结构域在长度上是1、2、或3(例如,1)个核苷酸。在一个实施例中,该3’亚结构域在长度上是3至25(例如,4-22、4-18、或4至10、或3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、或25)个核苷酸。该第一互补结构域可以与天然发生的第一互补结构域共享同源性,或衍生自其。在一个实施例中,它与在此披露的第一互补结构域具有至少50%同源性,例如,化脓链球菌、或嗜热链球菌第一互补结构域。该结构域的一些或所有核苷酸可以具有修饰,例如,在此处第X部分中发现的修饰。以下更详细地论述了第一互补结构域。3)连接结构域图1B-1E提供了连接结构域的实例。连接结构域用于连接单分子gRNA的该第一互补结构域与该第二互补结构域。该连接结构域可以共价地或非共价地连接该第一和第二互补结构域。在一个实施例中,该连接是共价的。在一个实施例中,该连接结构域共价地偶联该第一和第二互补结构域,参见,例如图1B-1E。在一个实施例中,该连接结构域是或者包括置于该第一互补结构域和该第二互补结构域之间的共价键。典型地,该连接结构域包含一或多个(例如2、3、4、5、6、7、8、9、或10个)核苷酸。在模块化gRNA分子中,这两个分子可以借助这些互补结构域的杂交而相关联,参见例如图1A。多种多样的连接结构域适于在单分子gRNA分子中使用。连接结构域可以由共价键组成,或在长度上短一个或几个核苷酸,例如1、2、3、4、或5个核苷酸。在一个实施例中,连接结构域在长度上是2、3、4、5、6、7、8、9、10、15、20、或25或更多个核苷酸。在一个实施例中,连接结构域在长度上是2至50、2至40、2至30、2至20、2至10、或2至5个核苷酸。在一个实施例中,连接结构域与天然发生的序列共享同源性,或衍生自其,例如,第二互补结构域5’的tracrRNA的序列。在一个实施例中,该连接结构域与在此披露的连接结构域具有至少50%同源性。该结构域的一些或所有核苷酸可以具有修饰,例如,在此处第X部分中发现的修饰。以下更详细地论述了连接结构域。4)5’延伸结构域在一个实施例中,模块化gRNA可以包括另外的序列,其在该第二互补结构域的5’,在此被称为5’延伸结构域,参见例如图1A。在一个实施例中,该5’延伸结构域在长度上是2-10、2-9、2-8、2-7、2-6、2-5、2-4个核苷酸。在一个实施例中,该5’延伸结构域在长度上是2、3、4、5、6、7、8、9、或10或更多个核苷酸。5)第二互补结构域:图1A-1F提供了第二互补结构域的实例。该第二互补结构域与该第一互补结构域是互补的,并且在一个实施例中,与该第二互补结构域具有足够的互补性以在至少一些生理条件下形成双链体区域。在一个实施例中,例如,如图1A或图1B中所示,该第二互补结构域可以包括与该第一互补结构域缺乏互补性的序列(例如,从该双链体区域中环出的序列)。在一个实施例中,该第二互补结构域在长度上是5至27个核苷酸。在一个实施例中,它长于该第一互补区域。在一个实施例中,该第二互补结构域在长度上是7至27个核苷酸。在一个实施例中,该第二互补结构域在长度上是7至25个核苷酸。在一个实施例中,该第二互补结构域在长度上是7至20个核苷酸。在一个实施例中,该第二互补结构域在长度上是7至17个核苷酸。在一个实施例中,该互补结构域在长度上是5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25个核苷酸。在一个实施例中,该第二互补结构域包含3个亚结构域,其按5’到3’方向是:5’亚结构域、中央亚结构域、和3’亚结构域。在一个实施例中,该5’亚结构域在长度上是3至25(例如,4至22、4至18、或4至10、或3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、或25)个核苷酸。在一个实施例中,该中央亚结构域在长度上是1、2、3、4或5(例如,3)个核苷酸。在一个实施例中,该3’亚结构域在长度上是4至9(例如,4、5、6、7、8或9)个核苷酸。在一个实施例中,该第一互补结构域的该5’亚结构域和该3’亚结构域与该第二互补结构域的该3’亚结构域和该5’亚结构域分别互补(例如,完全互补)。该第二互补结构域可以与天然发生的第二互补结构域共享同源性,或衍生自其。在一个实施例中,它与在此披露的第二互补结构域具有至少50%同源性,例如,化脓链球菌、或嗜热链球菌第一互补结构域。该结构域的一些或所有核苷酸可以具有修饰,例如,在此处第X部分中发现的修饰。6)近端结构域:图1A-1F提供了近端结构域的实例。在一个实施例中,该近端结构域在长度上是5至20个核苷酸。在一个实施例中,该近端结构域可以与天然发生的近端结构域共享同源性,或衍生自其。在一个实施例中,它与在此披露的近端结构域具有至少50%同源性,例如,化脓链球菌、或嗜热链球菌近端结构域。该结构域的一些或所有核苷酸可以具有修饰,例如,在此处第X部分中发现的修饰。7)尾部结构域:图1A以及图1C-1F提供了尾部结构域的实例。如可以通过检查在图1A以及图1C-1F中的尾部结构域所见,广谱的尾部结构域适于在gRNA分子中使用。在一个实施例中,该尾部结构域在长度上是0(不存在)、1、2、3、4、5、6、7、8、9、或10个核苷酸。在一个实施例中,该尾部结构域核苷酸来自或者与来自天然发生的尾部结构域的5’端的序列共享同源性,参见例如图1D或图1E。在一个实施例中,该尾部结构域包括彼此互补、并且在至少一些生理条件下形成双链体区域的序列。在一个实施例中,该尾部结构域是不存在的或在长度上是1至50个核苷酸。在一个实施例中,该尾部结构域可以与天然发生的近端尾部结构域共享同源性,或衍生自其。在一个实施例中,它与在此披露的尾部结构域具有至少50%同源性,例如,化脓链球菌、或嗜热链球菌尾部结构域。该结构域的一些或所有核苷酸可以具有修饰,例如,在此处第X部分中发现的修饰。在一个实施例中,该尾部结构域包括在3’端与体外或体内转录方法相关的核苷酸。当将T7启动子用于gRNA的体外转录时,这些核苷酸可以是该DNA模板的3’端前存在的任何核苷酸。当将U6启动子用于体内转录时,这些核苷酸可以是序列UUUUUU。当使用替代的pol-III启动子时,这些核苷酸可以是不同数目或尿嘧啶碱基或可以包括替代的碱基。以下更详细地描述了gRNA分子的结构域。靶向结构域gRNA的“靶向结构域”与靶核酸上的“靶结构域”是互补的。包括与该gRNA的核心结构域互补的核苷酸序列的靶核酸的链在此称为该靶核酸的“互补链”。对靶向结构域的选择的指导可以在例如付(Fu)Y等人,自然生物技术(NATBIOTECHNOL)2014(doi:10.1038/nbt.2808)以及斯腾伯格(Sternberg)SH等人,自然(NATURE)2014(doi:10.1038/nature13011)中找到。在一个实施例中,该靶向结构域在长度上是15、16、17、18、19、20、21、22、23、24、25、或26个核苷酸。在一个实施例中,该靶向结构域在长度上包含15、16、17、18、19、20、21、22、23、24、25、或26个核苷酸。在一个实施例中,该靶向结构域在长度上是15个核苷酸。在一个实施例中,该靶向结构域在长度上是16个核苷酸。在一个实施例中,该靶向结构域在长度上是17个核苷酸。在一个实施例中,该靶向结构域在长度上是18个核苷酸。在一个实施例中,该靶向结构域在长度上是19个核苷酸。在一个实施例中,该靶向结构域在长度上是20个核苷酸。在一个实施例中,该靶向结构域在长度上是21个核苷酸。在一个实施例中,该靶向结构域在长度上是22个核苷酸。在一个实施例中,该靶向结构域在长度上是23个核苷酸。在一个实施例中,该靶向结构域在长度上是24个核苷酸。在一个实施例中,该靶向结构域在长度上是25个核苷酸。在一个实施例中,该靶向结构域在长度上是26个核苷酸。在一个实施例中,该靶向结构域包含15个核苷酸。在一个实施例中,该靶向结构域包含16个核苷酸。在一个实施例中,该靶向结构域包含17个核苷酸。在一个实施例中,该靶向结构域包含18个核苷酸。在一个实施例中,该靶向结构域包含19个核苷酸。在一个实施例中,该靶向结构域包含20个核苷酸。在一个实施例中,该靶向结构域包含21个核苷酸。在一个实施例中,该靶向结构域包含22个核苷酸。在一个实施例中,该靶向结构域包含23个核苷酸。在一个实施例中,该靶向结构域包含24个核苷酸。在一个实施例中,该靶向结构域包含25个核苷酸。在一个实施例中,该靶向结构域包含26个核苷酸。在一个实施例中,该靶向结构域在长度上是10+/-5、20+/-5、30+/-5、40+/-5、50+/-5、60+/-5、70+/-5、80+/-5、90+/-5、或100+/-5个核苷酸。在一个实施例中,该靶向结构域在长度上是20+/-5个核苷酸。在一个实施例中,该靶向结构域在长度上是20+/-10、30+/-10、40+/-10、50+/-10、60+/-10、70+/-10、80+/-10、90+/-10、或100+/-10个核苷酸。在一个实施例中,该靶向结构域在长度上是30+/-10个核苷酸。在一个实施例中,该靶向结构域在长度上是10至100、10至90、10至80、10至70、10至60、10至50、10至40、10至30、10至20或10至15个核苷酸。在一个实施例中,该靶向结构域在长度上是20至100、20至90、20至80、20至70、20至60、20至50、20至40、20至30、或20至25个核苷酸。典型地,该靶向结构域与该靶序列具有完全互补性。在一个实施例中,该靶向结构域具有或包括1、2、3、4、5、6、7或8个与该靶向结构域的相应核苷酸不互补的核苷酸。在一个实施例中,该靶结构域在其5’端的5个核苷酸内包括1、2、3、4或5个与该靶向结构域的相应核苷酸互补的核苷酸。在一个实施例中,该靶结构域在其3’端的5个核苷酸内包括1、2、3、4或5个与该靶向结构域的相应核苷酸互补的核苷酸。在一个实施例中,该靶结构域在其5’端的5个核苷酸内包括1、2、3或4个与该靶向结构域的相应核苷酸不互补的核苷酸。在一个实施例中,该靶结构域在其3’端的5个核苷酸内包括1、2、3或4个与该靶向结构域的相应核苷酸不互补的核苷酸。在一个实施例中,互补程度连同gRNA的其他特性足以允许Cas9分子靶向该靶核酸。在一个实施例中,该靶向结构域包括两个与该靶结构域不互补的连续核苷酸(“非互补核苷酸”),例如,该靶向结构域的5’端的5个核苷酸内、该靶向结构域的3’端的5个核苷酸内、或远离该靶向结构域的一端或两端超过5个核苷酸的两个连续非互补核苷酸。在一个实施例中,在该靶向结构域的5’端的5个核苷酸内、该靶向结构域的3’端的5个核苷酸内、或在远离该靶向结构域的一端或两端超过5个核苷酸的区域内没有两个连续核苷酸与该靶向结构域不互补。在一个实施例中,在该靶向结构域的5’端的5个核苷酸内、该靶向结构域的3’端的5个核苷酸内、或在远离该靶向结构域的一端或两端超过5个核苷酸的区域内没有非互补核苷酸。在一个实施例中,这些靶向结构域核苷酸不包括修饰,例如,提供于第X部分中的类型的修饰。然而,在一个实施例中,该靶向结构域包括一个或多个修饰,例如,使其较不易受降解影响或更具有生物相容性(例如,较低免疫原性)的修饰。作为举例,该靶向结构域的骨架可以用硫代磷酸酯、或其他来自第X部分的修饰来修饰。在一个实施例中,该靶向结构域的核苷酸可以包括2’修饰(例如,在核糖的2’位置上的修饰),例如,2’乙酰化,例如,2’甲基化,或来自第X部分的其他修饰。在一个实施例中,该靶向结构域包括1、2、3、4、5、6、7或8或更多个修饰。在一个实施例中,该靶向结构域在其5’端的5个核苷酸内包括1、2、3、或4个修饰。在一个实施例中,该靶向结构域在其3’端的5个核苷酸内包括多达1、2、3、或4个修饰。在一个实施例中,该靶向结构域包括在两个连续核苷酸处的修饰,例如,该靶向结构域的5’端的5个核苷酸内、该靶向结构域的3’端的5个核苷酸内、或远离该靶向结构域的一端或两端超过5个核苷酸的两个连续核苷酸。在一个实施例中,在该靶向结构域的5’端的5个核苷酸内、该靶向结构域的3’端的5个核苷酸内、或在远离该靶向结构域的一端或两端超过5个核苷酸的区域内没有两个连续核苷酸被修饰。在一个实施例中,在该靶向结构域的5’端的5个核苷酸内、该靶向结构域的3’端的5个核苷酸内、或在远离该靶向结构域的一端或两端超过5个核苷酸的区域内没有核苷酸被修饰。可以选择该靶向结构域中的修饰以便不干扰靶向功效,这可以通过测试描述于第III部分中的系统中的候选修饰来进行评估。具有候选靶向结构域的gRNA可以在第III部分中的系统中进行评估,该候选靶向结构域具有选定的长度、序列、互补程度,或修饰程度。该候选靶向结构域可以被单独地或与一种或多种其他候选变化放置在已知与选定的靶具有功能性的gRNA分子/Cas9分子系统中并且进行评估。在一个实施例中,所有的这些修饰核苷酸互补于并且能够杂交到该靶结构域中存在的相应核苷酸上。在一个实施例中,1、2、3、4、5、6、7或8或更多个修饰核苷酸不互补于或不能够杂交到该靶结构域中存在的相应核苷酸上。在一个实施例中,该靶向结构域包含,优选地以5’→3’方向:第二结构域和核心结构域。以下更详细地论述了这些结构域。靶向结构域的核心结构域和第二结构域该靶向结构域的“核心结构域”与该靶核酸上的“核心结构域靶”是互补的。在一个实施例中,该核心结构域从该靶向结构域的3’端包括约8至约13个核苷酸(例如,该靶向结构域最3’的8至13个核苷酸)。在一个实施例中,该核心结构域在长度上是6+/-2、7+/-2、8+/-2、9+/-2、10+/-2、11+/-2、12+/-2、13+/-2、14+/-2、15+/-2、或16+/-2个核苷酸。在一个实施例中,该核心结构域在长度上是10+/-2个核苷酸。在一个实施例中,该核心结构域在长度上是10+/-4个核苷酸。在一个实施例中,该核心结构域在长度上是6、7、8、9、10、11、12、13、14、15、或16个核苷酸。在一个实施例中,该核心结构域在长度上是8至13(例如,8至12、8至11、8至10、8至9、9至13、9至12、9至11、或9至10)个核苷酸。在一个实施例中,该核心结构域在长度上是6至16(例如,6至15、6至14、6至13、7至14、7至13、7至12、7至11、7至10、8至14、8至13、8至12、8至11、8至10、或8至9)个核苷酸。该核心结构域与该核心结构域靶是互补的。典型地,该核心结构域具有与该核心结构域靶精确的互补性。在一个实施例中,该核心结构域可以具有1、2、3、4或5个与该核心结构域的相应核苷酸不互补的核苷酸。在一个实施例中,互补程度连同gRNA的其他特性足以允许Cas9分子靶向该靶核酸。该gRNA的该靶向结构域的该“第二结构域”与该靶核酸的“第二结构域靶”是互补的。在一个实施例中,该第二结构域被定位在该核心结构域的5’。在一个实施例中,该第二结构域是不存在的或任选的。在一个实施例中,如果该靶向结构域在长度上是,或至少是,26个核苷酸并且该核心结构域(从该靶向结构域的3’端计数)在长度上是8至13个核苷酸,则该第二结构域在长度上是12至17个核苷酸。在一个实施例中,如果该靶向结构域在长度上是,或至少是,25个核苷酸并且该核心结构域(从该靶向结构域的3’端计数)在长度上是8至13个核苷酸,则该第二结构域在长度上是12至17个核苷酸。在一个实施例中,如果该靶向结构域在长度上是,或至少是,24个核苷酸并且该核心结构域(从该靶向结构域的3’端计数)在长度上是8至13个核苷酸,则该第二结构域在长度上是11至16个核苷酸。在一个实施例中,如果该靶向结构域在长度上是,或至少是,23个核苷酸并且该核心结构域(从该靶向结构域的3’端计数)在长度上是8至13个核苷酸,则该第二结构域在长度上是10至15个核苷酸。在一个实施例中,如果该靶向结构域在长度上是,或至少是,22个核苷酸并且该核心结构域(从该靶向结构域的3’端计数)在长度上是8至13个核苷酸,则该第二结构域在长度上是9至14个核苷酸。在一个实施例中,如果该靶向结构域在长度上是,或至少是,21个核苷酸并且该核心结构域(从该靶向结构域的3’端计数)在长度上是8至13个核苷酸,则该第二结构域在长度上是8至13个核苷酸。在一个实施例中,如果该靶向结构域在长度上是,或至少是,20个核苷酸并且该核心结构域(从该靶向结构域的3’端计数)在长度上是8至13个核苷酸,则该第二结构域在长度上是7至12个核苷酸。在一个实施例中,如果该靶向结构域在长度上是,或至少是,19个核苷酸并且该核心结构域(从该靶向结构域的3’端计数)在长度上是8至13个核苷酸,则该第二结构域在长度上是6至11个核苷酸。在一个实施例中,如果该靶向结构域在长度上是,或至少是,18个核苷酸并且该核心结构域(从该靶向结构域的3’端计数)在长度上是8至13个核苷酸,则该第二结构域在长度上是5至10个核苷酸。在一个实施例中,如果该靶向结构域在长度上是,或至少是,17个核苷酸并且该核心结构域(从该靶向结构域的3’端计数)在长度上是8至13个核苷酸,则该第二结构域在长度上是4至9个核苷酸。在一个实施例中,如果该靶向结构域在长度上是,或至少是,16个核苷酸并且该核心结构域(从该靶向结构域的3’端计数)在长度上是8至13个核苷酸,则该第二结构域在长度上是3至8个核苷酸。在一个实施例中,该第二结构域在长度上是0、1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个核苷酸。该第二结构域与该第二结构域靶是互补的。典型地,该第二结构域具有与该第二结构域靶具有精确的互补性。在一个实施例中,该第二结构域可以具有1、2、3、4或5个与该第二结构域的相应核苷酸不互补的核苷酸。在一个实施例中,互补程度连同gRNA的其他特性足以允许Cas9分子靶向该靶核酸。在一个实施例中,这些核心结构域核苷酸不包括修饰,例如,提供于第X部分中的类型的修饰。然而,在一个实施例中,该核心结构域包括一个或多个修饰,例如,使其较不易受降解影响或更具有生物相容性(例如,较低免疫原性)的修饰。作为举例,该核心结构域的骨架可以用硫代磷酸酯、或其他来自第X部分的修饰来修饰。在一个实施例中,该核心结构域的核苷酸可以包括2’修饰(例如,在核糖的2’位置处的修饰),例如,2’乙酰化,例如,2’甲基化,或来自第X部分的其他修饰。典型地,核心结构域将含有不多于1、2、或3个修饰。可以选择该核心结构域中的修饰以便不干扰靶向功效,这可以通过测试描述于第III部分中的系统中的候选修饰来进行评估。具有候选核心结构域的gRNA可以在第III部分中描述的系统中进行评估,该候选核心结构域具有选定的长度、序列、互补程度,或修饰程度。该候选核心结构域可以被单独地或与一种或多种其他候选变化放置在已知与选定的靶具有功能性的gRNA分子/Cas9分子系统中并且进行评估。在一个实施例中,这些第二结构域核苷酸不包括修饰,例如,提供于第X部分中的类型的修饰。然而,在一个实施例中,该第二结构域包括一个或多个修饰,例如,使其较不易受降解影响或更具有生物相容性(例如,较低免疫原性)的修饰。作为举例,该第二结构域的骨架可以用硫代磷酸酯、或其他来自第X部分的修饰来修饰。在一个实施例中,该第二结构域的核苷酸可以包括2’修饰(例如,在核糖的2’位置处的修饰),例如,2’乙酰化,例如,2’甲基化,或来自第X部分的其他修饰。典型地,第二结构域将含有不多于1、2、或3个修饰。可以选择该第二结构域中的修饰以便不干扰靶向功效,这可以通过测试描述于第III部分中的系统中的候选修饰来进行评估。具有候选第二结构域的gRNA可以在第III部分中描述的系统中进行评估,该候选第二结构域具有选定的长度、序列、互补程度,或修饰程度。该候选第二结构域可以被单独地或与一种或多种其他候选变化放置在已知与选定的靶具有功能性的gRNA分子/Cas9分子系统中并且进行评估。在一个实施例中,(1)核心结构域与其靶之间的互补程度,和(2)第二结构域与其靶之间的互补程度可以不同。在一个实施例中,(1)可以大于(2)。在一个实施例中,(1)可以小于(2)。在一个实施例中,(1)和(2)可以是相同的(例如,各自与其靶可以是完全互补的)。在一个实施例中,(1)核心结构域的核苷酸的修饰(例如,来自第X部分的修饰)的数目和(2)第二结构域的核苷酸的修饰(例如,来自第X部分的修饰)的数目可以不同。在一个实施例中,(1)可以小于(2)。在一个实施例中,(1)可以大于(2)。在一个实施例中,(1)和(2)可以是相同的(例如,各自可以不含修饰)。第一和第二互补结构域该第一互补结构域与该第二互补结构域是互补的。典型地,该第一结构域不具有与该第二互补结构域靶精确的互补性。在一个实施例中,该第一互补结构域可以具有1、2、3、4或5个与该第二互补结构域的相应核苷酸不互补的核苷酸。在一个实施例中,1、2、3、4、5或6(例如,3)个核苷酸将不在双链体中配对,并且例如形成非双链体或环出区域。在一个实施例中,不成对的、或环出区域(例如,环出3个核苷酸)存在于第二互补结构域上。在一个实施例中,不成对的区域从第二互补结构域的5’端的1、2、3、4、5、或6(例如,4)个核苷酸处开始。在一个实施例中,互补程度连同gRNA的其他特性足以允许Cas9分子靶向该靶核酸。在一个实施例中,该第一和第二互补结构域:在长度上独立地是6+/-2、7+/-2、8+/-2、9+/-2、10+/-2、11+/-2、12+/-2、13+/-2、14+/-2、15+/-2、16+/-2、17+/-2、18+/-2、19+/-2、或20+/-2、21+/-2、22+/-2、23+/-2、或24+/-2个核苷酸;在长度上独立地是6、7、8、9、10、11、12、13、14、14、16、17、18、19、20、21、22、23、24、25、或26个核苷酸;或在长度上独立地是5至24、5至23、5至22、5至21、5至20、7至18、9至16、或10至14个核苷酸。在一个实施例中,该第二互补结构域长于该第一互补结构域(例如,长出2、3、4、5、或6(例如,6)个核苷酸)。在一个实施例中,该第一和第二互补结构域独立地不包括修饰,例如,提供于第X部分中的类型的修饰。在一个实施例中,该第一和第二互补结构域独立地包括一个或多个修饰,例如,使结构域较不易受降解影响或更具有生物相容性(例如,较低免疫原性)的修饰。作为举例,该结构域的骨架可以用硫代磷酸酯、或其他来自第X部分的修饰来修饰。在一个实施例中,该结构域的一个核苷酸可以包括2’修饰(例如,在核糖的2’位置处的修饰),例如,2’乙酰化,例如,2’甲基化,或来自第X部分的其他修饰。在一个实施例中,该第一和第二互补结构域独立地包括1、2、3、4、5、6、7或8或更多个修饰。在一个实施例中,该第一和第二互补结构域在其5’端的5个核苷酸内独立地包括1、2、3、或4个修饰。在一个实施例中,该第一和第二互补结构域在其3’端的5个核苷酸内独立地包括多达1、2、3、或4个修饰。在一个实施例中,该第一和第二互补结构域独立地包括在两个连续核苷酸处的修饰,例如,该结构域的5’端的5个核苷酸内、该结构域的3’端的5个核苷酸内、或远离该结构域的一端或两端超过5个核苷酸的两个连续核苷酸。在一个实施例中,第一和第二互补结构域独立地没有包括在该结构域的5’端的5个核苷酸内、该结构域的3’端的5个核苷酸内、或在远离该结构域的一端或两端超过5个核苷酸的区域内被修饰的两个连续核苷酸。在一个实施例中,第一和第二互补结构域独立地没有包括在该结构域的5’端的5个核苷酸内、该结构域的3’端的5个核苷酸内、或在远离该结构域的一端或两端超过5个核苷酸的区域内的被修饰的核苷酸。可以选择互补结构域中的修饰以便不干扰靶向功效,这可以通过测试描述于第III部分中的系统中的候选修饰来进行评估。具有候选互补结构域的gRNA可以在第III部分中描述的系统中进行评估,该候选互补结构域具有选定的长度、序列、互补程度,或修饰程度。该候选互补结构域可以被单独地或与一种或多种其他候选变化放置在已知与选定的靶具有功能性的gRNA分子/Cas9分子系统中并且进行评估。在一个实施例中,该第一互补结构域与参比第一互补结构域(例如,天然发生的(例如,化脓链球菌、或嗜热链球菌)第一互补结构域)或在此描述的第一互补结构域(例如,来自图1A-1F)具有至少60%、70%、80%、85%、90%、或95%同源性,或与之相差不多于1、2、3、4、5、或6个核苷酸。在一个实施例中,该第二互补结构域与参比第二互补结构域(例如,天然发生的(例如,化脓链球菌、或嗜热链球菌)第二互补结构域)或在此描述的第二互补结构域(例如,来自图1A-1F)具有至少60%、70%、80%、85%、90%、或95%同源性,或与之相差不多于1、2、3、4、5、或6个核苷酸。由第一和第二互补结构域形成的双链体区域在长度上典型地是6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21或22个碱基对(排除任何环出或未配对的核苷酸)。在一个实施例中,该第一和第二互补结构域,当成双链体时,包括11个成对的核苷酸,例如在该gRNA序列中(一条成对的链加下划线,一条粗体):NNNNNNNNNNNNNNNNNNNNGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC(SEQIDNO:5)。在一个实施例中,该第一和第二互补结构域,当成双链体时,包括15个成对的核苷酸,例如在该gRNA序列中(一条成对的链加下划线,一条粗体):NNNNNNNNNNNNNNNNNNNNGUUUUAGAGCUAUGCUGAAAAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC(SEQIDNO:27)。在一个实施例中,该第一和第二互补结构域,当成双链体时,包括16个成对的核苷酸,例如在该gRNA序列中(一条成对的链加下划线,一条粗体):NNNNNNNNNNNNNNNNNNNNGUUUUAGAGCUAUGCUGGAAACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC(SEQIDNO:28)。在一个实施例中,该第一和第二互补结构域,当成双链体时,包括21个成对的核苷酸,例如在该gRNA序列中(一条成对的链加下划线,一条粗体):NNNNNNNNNNNNNNNNNNNNGUUUUAGAGCUAUGCUGUUUUGGAAACAAAACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC(SEQIDNO:29)。在一个实施例中,核苷酸被交换以去除聚-U段,例如在这些gRNA序列中(被交换的核苷酸加下划线):NNNNNNNNNNNNNNNNNNNNGUAUUAGAGCUAGAAAUAGCAAGUUAAUAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC(SEQIDNO:30);NNNNNNNNNNNNNNNNNNNNGUUUAAGAGCUAGAAAUAGCAAGUUUAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC(SEQIDNO:31);以及NNNNNNNNNNNNNNNNNNNNGUAUUAGAGCUAUGCUGUAUUGGAAACAAUACAGCAUAGCAAGUUAAUAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC(SEQIDNO:32)。5’延伸结构域在一个实施例中,模块化gRNA可以包括另外的序列,在该第二互补结构域的5’。在一个实施例中,该5’延伸结构域在长度上是2至10、2至9、2至8、2至7、2至6、2至5、或2至4个核苷酸。在一个实施例中,该5’延伸结构域在长度上是2、3、4、5、6、7、8、9、或10或更多个核苷酸。在一个实施例中,该5’延伸结构域核苷酸不包括修饰,例如,提供于第X部分中的类型的修饰。然而,在一个实施例中,该5’延伸结构域包括一个或多个修饰,例如,使其较不易受降解影响或更具有生物相容性(例如,较低免疫原性)的修饰。作为举例,该5’延伸结构域的骨架可以用硫代磷酸酯、或其他来自第X部分的修饰来修饰。在一个实施例中,该5’延伸结构域的核苷酸可以包括2’修饰(例如,在核糖的2’位置处的修饰),例如,2’乙酰化,例如,2’甲基化,或来自第X部分的其他修饰。在一个实施例中,该5’延伸结构域可以包括多达1、2、3、4、5、6、7或8个修饰。在一个实施例中,该5’延伸结构域在其5’端的5个核苷酸内包括多达1、2、3、或4个修饰,例如,在模块化gRNA分子中。在一个实施例中,该5’延伸结构域在其3’端的5个核苷酸内包括多达1、2、3、或4个修饰,例如,在模块化gRNA分子中。在一个实施例中,该5’延伸结构域包括在两个连续核苷酸处的修饰,例如,该5’延伸结构域的5’端的5个核苷酸内、该5’延伸结构域的3’端的5个核苷酸内、或远离该5’延伸结构域的一端或两端超过5个核苷酸的两个连续核苷酸。在一个实施例中,在该5’延伸结构域的5’端的5个核苷酸内、该5’延伸结构域的3’端的5个核苷酸内、或在远离该5’延伸结构域的一端或两端超过5个核苷酸的区域内没有两个连续核苷酸被修饰。在一个实施例中,在该5’延伸结构域的5’端的5个核苷酸内、该5’延伸结构域的3’端的5个核苷酸内、或在远离该5’延伸结构域的一端或两端超过5个核苷酸的区域内没有核苷酸被修饰。可以选择该5’延伸结构域中的修饰以便不干扰gRNA分子功效,这可以通过测试描述于第III部分中的系统中的候选修饰来进行评估。具有候选5’延伸结构域的gRNA可以在第III部分中描述的系统中进行评估,该候选5’延伸结构域具有选定的长度、序列、互补程度,或修饰程度。该候选5’延伸结构域可以被单独地或与一种或多种其他候选变化放置在已知与选定的靶具有功能性的gRNA分子/Cas9分子系统中并且进行评估。在一个实施例中,该5’延伸结构域与参比5’延伸结构域(例如,天然发生的(例如,化脓链球菌、或嗜热链球菌)5’延伸结构域)或在此描述的5’延伸结构域(例如,来自图1A和图1F)具有至少60%、70%、80%、85%、90%或95%同源性,或与之相差不多于1、2、3、4、5、或6个核苷酸。连接结构域在单分子gRNA分子中,该连接结构域被布置在该第一和第二互补结构域之间。在模块化gRNA分子中,这两种分子通过互补结构域彼此关联。在一个实施例中,该连接结构域在长度上是10+/-5、20+/-5、30+/-5、40+/-5、50+/-5、60+/-5、70+/-5、80+/-5、90+/-5、或100+/-5个核苷酸。在一个实施例中,该连接结构域在长度上是20+/-10、30+/-10、40+/-10、50+/-10、60+/-10、70+/-10、80+/-10、90+/-10、或100+/-10个核苷酸。在一个实施例中,该连接结构域在长度上是10至100、10至90、10至80、10至70、10至60、10至50、10至40、10至30、10至20或10至15个核苷酸。在一个实施例中,该靶向结构域在长度上是20至100、20至90、20至80、20至70、20至60、20至50、20至40、20至30、或20至25个核苷酸。在一个实施例中,该连接结构域在长度上是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、或20个核苷酸。在一个实施例中,该连接结构域是共价键。在一个实施例中,该连接结构域包括典型地邻近于第一互补结构域的3’端和/或第二互补结构域的5’端或在其1、2、或3个核苷酸之内的双链体区域。在一个实施例中,双链体区域在长度上可以是20+/-10、30+/-10、40、+/-10或50+/-10个碱基对。在一个实施例中,双链体区域在长度上可以是10+/-5、15+/-5、20+/-5、或30+/-5个碱基对。在一个实施例中,双链体区域在长度上可以是1、2、3、4、5、6、7、8、9、10、11、12、13、14、或15个碱基对。典型地,形成双链体区域的序列彼此之间具有精确的互补性,尽管在一个实施例中,多达1、2、3、4、5、6、7或8个核苷酸与相应的核苷酸不互补。在一个实施例中,该连接结构域核苷酸不包括修饰,例如,提供于第X部分中的类型的修饰。然而,在一个实施例中,该连接结构域包括一个或多个修饰,例如,使其较不易受降解影响或更具有生物相容性(例如,较低免疫原性)的修饰。作为举例,该连接结构域的骨架可以用硫代磷酸酯、或其他来自第X部分的修饰来修饰。在一个实施例中,该连接结构域的核苷酸可以包括2’修饰(例如,在核糖的2’位置处的修饰),例如,2’乙酰化,例如,2’甲基化,或来自第X部分的其他修饰。在一个实施例中,该连接结构域可以包括多达1、2、3、4、5、6、7或8个修饰。可以选择连接结构域中的修饰以便不干扰靶向功效,这可以通过测试描述于第III部分中的系统中的候选修饰来进行评估。具有候选连接结构域的gRNA可以在第III部分中描述的系统中进行评估,该候选连接结构域具有选定的长度、序列、互补程度,或修饰程度。候选连接结构域可以被单独地或与一种或多种其他候选变化放置在已知与选定的靶具有功能性的gRNA分子/Cas9分子系统中并且进行评估。在一个实施例中,该连接结构域与参比连接结构域(例如,在此描述的连接结构域(例如,来自图1B-1E))具有至少60%、70%、80%、85%、90%或95%同源性,或与之相差不多于1、2、3、4、5、或6个核苷酸。近端结构域在一个实施例中,该近端结构域在长度上是6+/-2、7+/-2、8+/-2、9+/-2、10+/-2、11+/-2、12+/-2、13+/-2、14+/-2、14+/-2、16+/-2、17+/-2、18+/-2、19+/-2、或20+/-2个核苷酸。在一个实施例中,该近端结构域在长度上是6、7、8、9、10、11、12、13、14、14、16、17、18、19、或20个核苷酸。在一个实施例中,该近端结构域在长度上是5至20、7至18、9至16、或10至14个核苷酸。在一个实施例中,该近端结构域核苷酸不包括修饰,例如,提供于第X部分中的类型的修饰。然而,在一个实施例中,该近端结构域包括一个或多个修饰,例如,使其较不易受降解影响或更具有生物相容性(例如,较低免疫原性)的修饰。作为举例,该近端结构域的骨架可以用硫代磷酸酯、或其他来自第X部分的修饰来修饰。在一个实施例中,该近端结构域的核苷酸可以包括2’修饰(例如,在核糖的2’位置处的修饰),例如,2’乙酰化,例如,2’甲基化,或来自第X部分的其他修饰。在一个实施例中,该近端结构域可以包括多达1、2、3、4、5、6、7或8个修饰。在一个实施例中,该近端结构域在其5’端的5个核苷酸内包括多达1、2、3、或4个修饰,例如,在模块化gRNA分子中。在一个实施例中,该靶结构域在其3’端的5个核苷酸内包括多达1、2、3、或4个修饰,例如,在模块化gRNA分子中。在一个实施例中,该近端结构域包括在两个连续核苷酸处的修饰,例如,该近端结构域的5’端的5个核苷酸内、该近端结构域的3’端的5个核苷酸内、或远离该近端结构域的一端或两端超过5个核苷酸的两个连续核苷酸。在一个实施例中,在该近端结构域的5’端的5个核苷酸内、该近端结构域的3’端的5个核苷酸内、或在远离该近端结构域的一端或两端超过5个核苷酸的区域内没有两个连续核苷酸被修饰。在一个实施例中,在该近端结构域的5’端的5个核苷酸内、该近端结构域的3’端的5个核苷酸内、或在远离该近端结构域的一端或两端超过5个核苷酸的区域内没有核苷酸被修饰。可以选择该近端结构域中的修饰以便不干扰gRNA分子功效,这可以通过测试描述于第III部分中的系统中的候选修饰来进行评估。具有候选近端结构域的gRNA可以在第III部分中描述的系统中进行评估,该候选近端结构域具有选定的长度、序列、互补程度,或修饰程度。该候选近端结构域可以被单独地或与一种或多种其他候选变化放置在已知与选定的靶具有功能性的gRNA分子/Cas9分子系统中并且进行评估。在一个实施例中,该近端结构域与参比近端结构域(例如,天然发生的(例如,化脓链球菌、或嗜热链球菌)近端结构域)或在此描述的近端结构域(例如,来自图1A-1F)具有至少60%、70%、80%、85%、90%、或95%同源性,或与之相差不多于1、2、3、4、5、或6个核苷酸。尾部结构域在一个实施例中,该尾部结构域在长度上是10+/-5、20+/-5、30+/-5、40+/-5、50+/-5、60+/-5、70+/-5、80+/-5、90+/-5、或100+/-5个核苷酸。在一个实施例中,该尾部结构域在长度上是20+/-5个核苷酸。在一个实施例中,该尾部结构域在长度上是20+/-10、30+/-10、40+/-10、50+/-10、60+/-10、70+/-10、80+/-10、90+/-10、或100+/-10个核苷酸。在一个实施例中,该尾部结构域在长度上是25+/-10个核苷酸。在一个实施例中,该尾部结构域在长度上是10至100、10至90、10至80、10至70、10至60、10至50、10至40、10至30、10至20或10至15个核苷酸。在一个实施例中,该尾部结构域在长度上是20至100、20至90、20至80、20至70、20至60、20至50、20至40、20至30、或20至25个核苷酸。在一个实施例中,该尾部结构域在长度上是1至20、1至1、1至10、或1至5个核苷酸。在一个实施例中,该尾部结构域核苷酸不包括修饰,例如,提供于第X部分中的类型的修饰。然而,在一个实施例中,该尾部结构域包括一个或多个修饰,例如,使其较不易受降解影响或更具有生物相容性(例如,较低免疫原性)的修饰。作为举例,该尾部结构域的骨架可以用硫代磷酸酯、或其他来自第X部分的修饰来修饰。在一个实施例中,该尾部结构域的核苷酸可以包括2’修饰(例如,在核糖的2’位置处的修饰),例如,2’乙酰化,例如,2’甲基化,或来自第X部分的其他修饰。在一个实施例中,该尾部结构域可以具有多达1、2、3、4、5、6、7或8个修饰。在一个实施例中,该靶结构域在其5’端的5个核苷酸内包括多达1、2、3、或4个修饰。在一个实施例中,该靶结构域在其3’端的5个核苷酸内包括多达1、2、3、或4个修饰。在一个实施例中,该尾部结构域包括尾部双链体结构域,其可以形成尾部双链体区域。在一个实施例中,该尾部双链体区域在长度上可以是3、4、5、6、7、8、9、10、11、或12个碱基对。在一个实施例中,一个另外的单链结构域存在于该尾部双链体结构域的3’。在一个实施例中,该结构域在长度上是3、4、5、6、7、8、9、或10个核苷酸。在一个实施例中,它在长度上是4至6个核苷酸。在一个实施例中,该尾部结构域与参比尾部结构域(例如,天然发生的(例如,化脓链球菌、或嗜热链球菌)尾部结构域)或在此描述的尾部结构域(例如,来自图1A和图1C-1F)具有至少60%、70%、80%、或90%同源性,或与之相差不多于1、2、3、4、5、或6个核苷酸。在一个实施例中,该近端和尾部结构域一起包括以下序列:AAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCU(SEQIDNO:33);AAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGGUGC(SEQIDNO:34);AAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCGGAUC(SEQIDNO:35);AAGGCUAGUCCGUUAUCAACUUGAAAAAGUG(SEQIDNO:36);AAGGCUAGUCCGUUAUCA(SEQIDNO:37);或AAGGCUAGUCCG(SEQIDNO:38)。在一个实施例中,该尾部结构域包括3’序列UUUUUU,例如,如果将U6启动子用于转录。在一个实施例中,该尾部结构域包括3’序列UUUU,例如,如果将H1启动子用于转录。在一个实施例中,尾部结构域包括数目取决于例如所使用的pol-III启动子的终止信号而变化的3’U。在一个实施例中,如果使用T7启动子,该尾部结构域包括衍生自该DNA模板的可变的3’序列。在一个实施例中,该尾部结构域包括衍生自该DNA模板的可变的3’序列,例如,如果将体外转录用于生成该RNA分子。在一个实施例中,该尾部结构域包括衍生自该DNA模板的可变的3’序列,例如,如果将pol-II启动子用于驱动转录。可以选择该尾部结构域中的修饰以便不干扰靶向功效,这可以通过测试描述于第III部分中的系统中的候选修饰来进行评估。具有候选尾部结构域的gRNA可以在第III部分中描述的系统中进行评估,该候选尾部结构域具有选定的长度、序列、互补程度,或修饰程度。该候选尾部结构域可以被单独地或与一种或多种其他候选变化放置在已知与选定的靶具有功能性的gRNA分子/Cas9分子系统中并且进行评估。在一个实施例中,该尾部结构域包括在两个连续核苷酸处的修饰,例如,该尾部结构域的5’端的5个核苷酸内、该尾部结构域的3’端的5个核苷酸内、或远离该尾部结构域的一端或两端超过5个核苷酸的两个连续核苷酸。在一个实施例中,在该尾部结构域的5’端的5个核苷酸内、该尾部结构域的3’端的5个核苷酸内、或在远离该尾部结构域的一端或两端超过5个核苷酸的区域内没有两个连续核苷酸被修饰。在一个实施例中,在该尾部结构域的5’端的5个核苷酸内、该尾部结构域的3’端的5个核苷酸内、或在远离该尾部结构域的一端或两端超过5个核苷酸的区域内没有核苷酸被修饰。在一个实施例中,gRNA具有以下结构:5’[靶向结构域]-[第一互补结构域]-[连接结构域]-[第二互补结构域]-[近端结构域]-[尾部结构域]-3'其中,该靶向结构域包括核心结构域和任选地第二结构域,并且在长度上是10至50个核苷酸;该第一互补结构域在长度上是5至25个核苷酸,并且,在一个实施例中,与在此披露的参比第一互补结构域具有至少50%、60%、70%、80%、85%、90%、或95%同源性;该连接结构域在长度上是1至5个核苷酸;该近端结构域在长度上是5至20个核苷酸,并且,在一个实施例中,与在此披露的参比近端结构域具有至少50%、60%、70%、80%、85%、90%、或95%同源性;并且该尾部结构域是不存在的或是在长度上是1至50个核苷酸的核苷酸序列,并且,在一个实施例中,与在此披露的参比尾部结构域具有至少50%、60%、70%、80%、85%、90%、或95%同源性。示例性嵌合gRNA在一个实施例中,单分子的、或嵌合的gRNA包含,优选地从5’到3’:靶向结构域,例如,包括15、16、17、18、19、或20个核苷酸(其与靶核酸互补);第一互补结构域;连接结构域;第二互补结构域(其与该第一互补结构域互补);近端结构域;以及尾部结构域,其中,(a)当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸;(b)该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸;或(c)与该第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸。在一个实施例中,来自(a)、(b)、或(c)的序列与天然发生的gRNA在此描述的gRNA的相应序列或与具有至少60%、75%、80%、85%、90%、95%、或99%同源性。在一个实施例中,当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸;在一个实施例中,与该第一互补结构域的相应核苷酸互补第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由16、17、18、19、20、21、22、23、24或25个与该靶结构域具有互补性的核苷酸(例如,16、17、18、19、20、21、22、23、24或25个连续核苷酸)组成,例如,该靶向结构域在长度上是16、17、18、19、20、21、22、23、24或25个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由16个与该靶结构域具有互补性的核苷酸(例如,16个连续核苷酸)组成,例如,该靶向结构域在长度上是16个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由17个与该靶结构域具有互补性的核苷酸(例如,17个连续核苷酸)组成,例如,该靶向结构域在长度上是17个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由18个与该靶结构域具有互补性的核苷酸(例如,18个连续核苷酸)组成,例如,该靶向结构域在长度上是18个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由19个与该靶结构域具有互补性的核苷酸(例如,19个连续核苷酸)组成,例如,该靶向结构域在长度上是19个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由20个与该靶结构域具有互补性的核苷酸(例如,20个连续核苷酸)组成,例如,该靶向结构域在长度上是20个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由21个与该靶结构域具有互补性的核苷酸(例如,21个连续核苷酸)组成,例如,该靶向结构域在长度上是21个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由22个与该靶结构域具有互补性的核苷酸(例如,22个连续核苷酸)组成,例如,该靶向结构域在长度上是22个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由23个与该靶结构域具有互补性的核苷酸(例如,23个连续核苷酸)组成,例如,该靶向结构域在长度上是23个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由24个与该靶结构域具有互补性的核苷酸(例如,24个连续核苷酸)组成,例如,该靶向结构域在长度上是24个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由25个与该靶结构域具有互补性的核苷酸(例如,25个连续核苷酸)组成,例如,该靶向结构域在长度上是25个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由26个与该靶结构域具有互补性的核苷酸(例如,26个连续核苷酸)组成,例如,该靶向结构域在长度上是26个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由16个与该靶结构域具有互补性的核苷酸(例如,16个连续核苷酸)组成,例如,该靶向结构域在长度上是16个核苷酸;并且当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由16个与该靶结构域具有互补性的核苷酸(例如,16个连续核苷酸)组成,例如,该靶向结构域在长度上是16个核苷酸;并且该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由16个与该靶结构域具有互补性的核苷酸(例如,16个连续核苷酸)组成,例如,该靶向结构域在长度上是16个核苷酸;并且与该第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由17个与该靶结构域具有互补性的核苷酸(例如,17个连续核苷酸)组成,例如,该靶向结构域在长度上是17个核苷酸;并且当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由17个与该靶结构域具有互补性的核苷酸(例如,17个连续核苷酸)组成,例如,该靶向结构域在长度上是17个核苷酸;并且该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由17个与该靶结构域具有互补性的核苷酸(例如,17个连续核苷酸)组成,例如,该靶向结构域在长度上是17个核苷酸;并且与该第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由18个与该靶结构域具有互补性的核苷酸(例如,18个连续核苷酸)组成,例如,该靶向结构域在长度上是18个核苷酸;并且当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由18个与该靶结构域具有互补性的核苷酸(例如,18个连续核苷酸)组成,例如,该靶向结构域在长度上是18个核苷酸;并且该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由18个与该靶结构域具有互补性的核苷酸(例如,18个连续核苷酸)组成,例如,该靶向结构域在长度上是18个核苷酸;并且与第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸其。在一个实施例中,该靶向结构域包括、具有、或由19个与该靶结构域具有互补性的核苷酸(例如,19个连续核苷酸)组成,例如,该靶向结构域在长度上是19个核苷酸;并且当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由19个与该靶结构域具有互补性的核苷酸(例如,19个连续核苷酸)组成,例如,该靶向结构域在长度上是19个核苷酸;并且该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由19个与该靶结构域具有互补性的核苷酸(例如,19个连续核苷酸)组成,例如,该靶向结构域在长度上是19个核苷酸;并且与第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由20个与该靶结构域具有互补性的核苷酸(例如,20个连续核苷酸)组成,例如,该靶向结构域在长度上是20个核苷酸;并且当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由20个与该靶结构域具有互补性的核苷酸(例如,20个连续核苷酸)组成,例如,该靶向结构域在长度上是20个核苷酸;并且该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由20个与该靶结构域具有互补性的核苷酸(例如,20个连续核苷酸)组成,例如,该靶向结构域在长度上是20个核苷酸;并且与第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸其。在一个实施例中,该靶向结构域包括、具有、或由21个与该靶结构域具有互补性的核苷酸(例如,21个连续核苷酸)组成,例如,该靶向结构域在长度上是21个核苷酸;并且当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由21个与该靶结构域具有互补性的核苷酸(例如,21个连续核苷酸)组成,例如,该靶向结构域在长度上是21个核苷酸;并且该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由21个与该靶结构域具有互补性的核苷酸(例如,21个连续核苷酸)组成,例如,该靶向结构域在长度上是21个核苷酸;并且与第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸其。在一个实施例中,该靶向结构域包括、具有、或由22个与该靶结构域具有互补性的核苷酸(例如,22个连续核苷酸)组成,例如,该靶向结构域在长度上是22个核苷酸;并且当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由22个与该靶结构域具有互补性的核苷酸(例如,22个连续核苷酸)组成,例如,该靶向结构域在长度上是22个核苷酸;并且该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由22个与该靶结构域具有互补性的核苷酸(例如,22个连续核苷酸)组成,例如,该靶向结构域在长度上是22个核苷酸;并且与该第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸其。在一个实施例中,该靶向结构域包括、具有、或由23个与该靶结构域具有互补性的核苷酸(例如,23个连续核苷酸)组成,例如,该靶向结构域在长度上是23个核苷酸;并且当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由23个与该靶结构域具有互补性的核苷酸(例如,23个连续核苷酸)组成,例如,该靶向结构域在长度上是23个核苷酸;并且该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由23个与该靶结构域具有互补性的核苷酸(例如,23个连续核苷酸)组成,例如,该靶向结构域在长度上是23个核苷酸;并且与该第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由24个与该靶结构域具有互补性的核苷酸(例如,24个连续核苷酸)组成,例如,该靶向结构域在长度上是24个核苷酸;并且当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由24个与该靶结构域具有互补性的核苷酸(例如,24个连续核苷酸)组成,例如,该靶向结构域在长度上是24个核苷酸;并且该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由24个与该靶结构域具有互补性的核苷酸(例如,24个连续核苷酸)组成,例如,该靶向结构域在长度上是24个核苷酸;并且与第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由25个与该靶结构域具有互补性的核苷酸(例如,25个连续核苷酸)组成,例如,该靶向结构域在长度上是25个核苷酸;并且当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域具有、或由25个与该靶结构域具有互补性的核苷酸(例如,25个连续核苷酸)组成,例如,该靶向结构域在长度上是25个核苷酸;并且该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由25个与该靶结构域具有互补性的核苷酸(例如,25个连续核苷酸)组成,例如,该靶向结构域在长度上是25个核苷酸;并且与该第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由26个与该靶结构域具有互补性的核苷酸(例如,26个连续核苷酸)组成,例如,该靶向结构域在长度上是26个核苷酸;并且当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由26个与该靶结构域具有互补性的核苷酸(例如,26个连续核苷酸)组成,例如,该靶向结构域在长度上是26个核苷酸;并且该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由26个与该靶结构域具有互补性的核苷酸(例如,26个连续核苷酸)组成,例如,该靶向结构域在长度上是26个核苷酸;并且与该第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸。示例性模块化gRNA在一个实施例中,模块化gRNA包括:第一链,包括优选地从5’到3’:靶向结构域,例如,包括15、16、17、18、19、或20个核苷酸;第一互补结构域;以及第二链,包括优选地从5’到3’:任选地,5’延伸结构域;第二互补结构域;近端结构域;以及尾部结构域,其中:(a)当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸;(b)该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸;或(c)与该第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸。在一个实施例中,来自(a)、(b)、或(c)的序列与天然发生的gRNA的相应序列或与在此描述的gRNA具有至少60%、75%、80%、85%、90%、95%、或99%同源性。在一个实施例中,当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,与该第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由16、17、18、19、20、21、22、23、24、25、或26个与该靶结构域具有互补性的核苷酸(例如,16、17、18、19、20、21、22、23、24、25、或26个连续核苷酸)组成,例如,该靶向结构域在长度上是16、17、18、19、20、21、22、23、24、25、或26个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由16个与该靶结构域具有互补性的核苷酸(例如,16个连续核苷酸)组成,例如,该靶向结构域在长度上是16个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由17个与该靶结构域具有互补性的核苷酸(例如,17个连续核苷酸)组成,例如,该靶向结构域在长度上是17个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由18个与该靶结构域具有互补性的核苷酸(例如,18个连续核苷酸)组成,例如,该靶向结构域在长度上是18个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由19个与该靶结构域具有互补性的核苷酸(例如,19个连续核苷酸)组成,例如,该靶向结构域在长度上是19个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由20个与该靶结构域具有互补性的核苷酸(例如,20个连续核苷酸)组成,例如,该靶向结构域在长度上是20个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由21个与该靶结构域具有互补性的核苷酸(例如,21个连续核苷酸)组成,例如,该靶向结构域在长度上是21个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由22个与该靶结构域具有互补性的核苷酸(例如,22个连续核苷酸)组成,例如,该靶向结构域在长度上是22个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由23个与该靶结构域具有互补性的核苷酸(例如,23个连续核苷酸)组成,例如,该靶向结构域在长度上是23个核苷酸。在一个实施例中,该靶向结构域具有、或由24个与该靶结构域具有互补性的核苷酸(例如,24个连续核苷酸)组成,例如,该靶向结构域在长度上是24个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由25个与该靶结构域具有互补性的核苷酸(例如,25个连续核苷酸)组成,例如,该靶向结构域在长度上是5个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由26个与该靶结构域具有互补性的核苷酸(例如,26个连续核苷酸)组成,例如,该靶向结构域在长度上是5个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由16个与该靶结构域具有互补性的核苷酸(例如,16个连续核苷酸)组成,例如,该靶向结构域在长度上是16个核苷酸;并且当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由16个与该靶结构域具有互补性的核苷酸(例如,16个连续核苷酸)组成,例如,该靶向结构域在长度上是16个核苷酸;并且该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由16个与该靶结构域具有互补性的核苷酸(例如,16个连续核苷酸)组成,例如,该靶向结构域在长度上是16个核苷酸;并且与该第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由17个与该靶结构域具有互补性的核苷酸(例如,17个连续核苷酸)组成,例如,该靶向结构域在长度上是17个核苷酸;并且当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由17个与该靶结构域具有互补性的核苷酸(例如,17个连续核苷酸)组成,例如,该靶向结构域在长度上是17个核苷酸;并且该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由17个与该靶结构域具有互补性的核苷酸(例如,17个连续核苷酸)组成,例如,该靶向结构域在长度上是17个核苷酸;并且与该第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由18个与该靶结构域具有互补性的核苷酸(例如,18个连续核苷酸)组成,例如,该靶向结构域在长度上是18个核苷酸;并且当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由18个与该靶结构域具有互补性的核苷酸(例如,18个连续核苷酸)组成,例如,该靶向结构域在长度上是18个核苷酸;并且该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由18个与该靶结构域具有互补性的核苷酸(例如,18个连续核苷酸)组成,例如,该靶向结构域在长度上是18个核苷酸;并且与该第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由19个与该靶结构域具有互补性的核苷酸(例如,19个连续核苷酸)组成,例如,该靶向结构域在长度上是19个核苷酸;并且当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由19个与该靶结构域具有互补性的核苷酸(例如,19个连续核苷酸)组成,例如,该靶向结构域在长度上是19个核苷酸;并且该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由19个与该靶结构域具有互补性的核苷酸(例如,19个连续核苷酸)组成,例如,该靶向结构域在长度上是19个核苷酸;并且与该第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由20个与该靶结构域具有互补性的核苷酸(例如,20个连续核苷酸)组成,例如,该靶向结构域在长度上是20个核苷酸;并且当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由20个与该靶结构域具有互补性的核苷酸(例如,20个连续核苷酸)组成,例如,该靶向结构域在长度上是20个核苷酸;并且该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由20个与该靶结构域具有互补性的核苷酸(例如,20个连续核苷酸)组成,例如,该靶向结构域在长度上是20个核苷酸;并且与该第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由21个与该靶结构域具有互补性的核苷酸(例如,21个连续核苷酸)组成,例如,该靶向结构域在长度上是21个核苷酸;并且当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由21个与该靶结构域具有互补性的核苷酸(例如,21个连续核苷酸)组成,例如,该靶向结构域在长度上是21个核苷酸;并且该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由21个与该靶结构域具有互补性的核苷酸(例如,21个连续核苷酸)组成,例如,该靶向结构域在长度上是21个核苷酸;并且与该第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由22个与该靶结构域具有互补性的核苷酸(例如,22个连续核苷酸)组成,例如,该靶向结构域在长度上是22个核苷酸;并且当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由22个与该靶结构域具有互补性的核苷酸(例如,22个连续核苷酸)组成,例如,该靶向结构域在长度上是22个核苷酸;并且该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由22个与该靶结构域具有互补性的核苷酸(例如,22个连续核苷酸)组成,例如,该靶向结构域在长度上是22个核苷酸;并且与该第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由23个与该靶结构域具有互补性的核苷酸(例如,23个连续核苷酸)组成,例如,该靶向结构域在长度上是23个核苷酸;并且当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由23个与该靶结构域具有互补性的核苷酸(例如,23个连续核苷酸)组成,例如,该靶向结构域在长度上是23个核苷酸;并且该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由23个与该靶结构域具有互补性的核苷酸(例如,23个连续核苷酸)组成,例如,该靶向结构域在长度上是23个核苷酸;并且与该第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由24个与该靶结构域具有互补性的核苷酸(例如,24个连续核苷酸)组成,例如,该靶向结构域在长度上是24个核苷酸;并且当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由24个与该靶结构域具有互补性的核苷酸(例如,24个连续核苷酸)组成,例如,该靶向结构域在长度上是24个核苷酸;并且该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由24个与该靶结构域具有互补性的核苷酸(例如,24个连续核苷酸)组成,例如,该靶向结构域在长度上是24个核苷酸;并且与该第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由25个与该靶结构域具有互补性的核苷酸(例如,25个连续核苷酸)组成,例如,该靶向结构域在长度上是25个核苷酸;并且当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由25个与该靶结构域具有互补性的核苷酸(例如,25个连续核苷酸)组成,例如,该靶向结构域在长度上是25个核苷酸;并且该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由25个与该靶结构域具有互补性的核苷酸(例如,25个连续核苷酸)组成,例如,该靶向结构域在长度上是25个核苷酸;并且与该第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由26个与该靶结构域具有互补性的核苷酸(例如,26个连续核苷酸)组成,例如,该靶向结构域在长度上是26个核苷酸;并且当一起考虑时,该近端和尾部结构域包括至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由26个与该靶结构域具有互补性的核苷酸(例如,26个连续核苷酸)组成,例如,该靶向结构域在长度上是26个核苷酸;并且该第二互补结构域的最后一个核苷酸的3’存在至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸。在一个实施例中,该靶向结构域包括、具有、或由26个与该靶结构域具有互补性的核苷酸(例如,26个连续核苷酸)组成,例如,该靶向结构域在长度上是26个核苷酸;并且与该第一互补结构域的相应核苷酸互补的第二互补结构域的最后一个核苷酸的3’存在至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸。用于设计gRNA的方法在此描述了用于设计gRNA的方法,包括用于选择、设计和验证靶结构域的方法。还在此提供了示例性靶向结构域。可以将在此所论述的靶向结构域掺入在此描述的gRNA中。用于选择和验证靶顺序连同脱靶分析的方法和验证描述于,例如,在玛丽(Mali)等人,2013科学(Science)339(6121):823-826;徐(Hsu)等人,2013自然生物技术(NATBIOTECHNOL),31(9):827-32;付(Fu)等人,2014自然生物技术(NATBIOTECHNOL),doi:10.1038/nbt.2808.PubMedPMID:24463574;黑格威尔(Heigwer)等人,2014自然方法(NATMETHODS)11(2):122-3.doi:10.1038/nmeth.2812.PubMedPMID:24481216;贝(Bae)等人,2014生物信息学(BIOINFORMATICS)PubMedPMID:24463181;肖(Xiao)A等人,2014生物信息学(BIOINFORMATICS)PubMedPMID:24389662中。例如,一种软件工具可以用来优化在使用者的靶序列之内的gRNA的选择,例如,以跨基因组最小化总脱靶活性。脱靶活性可以不同于切割。对于每个可能的gRNA选择(例如,使用化脓链球菌Cas9),该工具可以鉴别跨基因组所有脱靶序列(例如,以上的NAG或NGGPAM),这些脱靶序列含有高达一定数量(例如,1、2、3、4、5、6、7、8、9、或10)的错配碱基对。在每个脱靶序列处的切割效率是可以预测的,例如,使用实验衍生的加权方案。进而根据每个可能的gRNA的总的预测的脱靶切割进行排序;最高排名的gRNA表示可能具有最大中靶和最少脱靶切割的那些。其他功能(例如,用于CRISPR构建的自动化试剂设计、用于中靶Surveyor测定的引物设计、和用于高通量检测以及经由下一代测序对脱靶切割进行定量的引物设计)也可以被包括在该工具中。候选gRNA分子可以通过本领域已知的方法或如在此第IV部分中所描述的进行评估。II.Cas9分子多个物种的Cas9分子可以用于在此描述的方法和组合物中。尽管化脓链球菌和嗜热链球菌Cas9分子是本披露的大部分的主题,也可以使用在此列出的其他物种的Cas9蛋白质的、从中衍生的、或基于其的Cas9分子。换言之,尽管本文大部分使用化脓链球菌和嗜热链球菌Cas9分子,来自其他物种的Cas9分子可以替代它们(例如,金黄色葡萄球菌和脑膜炎奈瑟菌Cas9分子)。另外的Cas9物种包括:燕麦食酸菌(Acidovoraxavenae)、胸膜肺炎放线杆菌(Actinobacilluspleuropneumoniae)、琥珀酸放线杆菌(Actinobacillussuccinogenes)、猪放线杆菌(Actinobacillussuis)、放线菌属(Actinomycessp.)、Alicycliphilusdenitrificans、Aminomonaspaucivorans、蜡样芽胞杆菌(Bacilluscereus)、史氏芽孢杆菌(Bacillussmithii)、苏云金芽孢杆菌(Bacillusthuringiensis)、拟杆菌属(Bacteroidessp.)、Blastopirellulamarina、慢生根瘤菌属(Bradyrhizobiumsp.)、侧孢短芽孢杆菌(Brevibacilluslaterosporus)、结肠弯曲菌(Campylobactercoli)、空肠弯曲菌(Campylobacterjejuni)、红嘴鸥弯曲杆菌(Campylobacterlari)、CandidatusPuniceispirillum、解纤维梭菌(Clostridiumcellulolyticum)、产气荚膜梭菌(Clostridiumperfringens)、拥挤棒杆菌(Corynebacteriumaccolens)、白喉棒状杆菌(Corynebacteriumdiphtheria)、Corynebacteriummatruchotii、恒雄芝氏沟鞭藻玫瑰杆菌(Dinoroseobactershibae)、细长真杆菌(Eubacteriumdolichum)、γ-变形菌纲(gammaproteobacterium)、重氮营养葡糖酸醋杆菌(Gluconacetobacterdiazotrophicus)、副流感嗜血杆菌(Haemophilusparainfluenzae)、嗜血弯曲杆菌(Haemophilussputorum)、Helicobactercanadensis、同性恋螺杆菌(Helicobactercinaedi)、鼬鼠螺杆菌(Helicobactermustelae)、Ilyobacterpolytropus、金氏金氏菌(Kingellakingae)、卷曲乳酸杆菌(Lactobacilluscrispatus)、伊氏李斯特菌(Listeriaivanovii)、单核细胞增生李斯特菌(Listeriamonocytogenes)、李斯特氏菌科菌(Listeriaceaebacterium)、甲基孢囊菌属(Methylocystissp.)、甲烷氧化菌(Methylosinustrichosporium)、羞怯动弯杆菌(Mobiluncusmulieris)、奈瑟氏杆菌(Neisseriabacilliformis)、灰色奈瑟球菌(Neisseriacinerea)、浅黄色奈瑟氏菌(Neisseriaflavescens)、乳糖奈瑟氏菌(Neisserialactamica)、奈瑟氏菌属(Neisseriasp.)、瓦茨瓦尔西奈瑟氏菌(Neisseriawadsworthii)、亚硝化单胞菌属(Nitrosomonassp.)、食清洁剂细小棒菌(Parvibaculumlavamentivorans)、出血败血性巴士杆菌(Pasteurellamultocida)、Phascolarctobacteriumsuccinatutens、Ralstoniasyzygii、沼泽红假单胞菌(Rhodopseudomonaspalustris)、小红卵菌属(Rhodovulumsp.)、米氏西蒙斯氏菌(Simonsiellamuelleri)、鞘氨醇单胞菌属(Sphingomonassp.)、Sporolactobacillusvineae、路邓葡萄球菌(Staphylococcuslugdunensis)、链球菌属(Streptococcussp.)、Subdoligranulumsp.、运动替斯崔纳菌(Tistrellamobilis)、密螺旋体属(Treponemasp.)或Verminephrobactereiseniae。Cas9分子,如该术语在此使用的,是指一种分子,该分子可以与gRNA分子相互作用并且与gRNA分子协调,并定位(例如,靶向或归巢)至包括靶结构域和PAM序列的部位。在一个实施例中,该Cas9分子能够切割靶核酸分子。能够切割靶核酸分子的Cas9分子在此被称为eaCas9(酶促活性Cas9)分子。在一个实施例中,eaCas9分子包括以下活性中的一种或多种:切口酶活性,即,切割核酸分子的单链(例如,非互补链或互补链)的能力;双链核酸酶活性,即,切割双链核酸的两条链并且产生双链断裂的能力,其在一个实施例中存在两种切口酶活性;内切核酸酶活性;外切核酸酶活性;以及解旋酶活性,即,解旋双链核酸的螺旋结构的能力。在一个实施例中,酶促活性Cas9或eaCas9分子切割两条DNA链,并且产生双链断裂。在一个实施例中,eaCas9分子仅切割一条链(例如,gRNA杂交到的链、或互补于与gRNA杂交的链的链)。在一个实施例中,eaCas9分子包括与HNH样结构域相关的切割活性。在一个实施例中,eaCas9分子包括与N端RuvC样结构域相关的切割活性。在一个实施例中,eaCas9分子包括与HNH样结构域相关的切割活性以及与N端RuvC样结构域相关的切割活性。在一个实施例中,eaCas9分子包括活性、或有切割能力、HNH样结构域和无活性、或无切割能力、N端RuvC-样结构域。在一个实施例中,eaCas9分子包括无活性、或无切割能力、HNH样结构域和活性、或有切割能力、N端RuvC-样结构域。在一个实施例中,eaCas9分子与靶核酸相互作用并且切割靶核酸的能力是PAM序列依赖性的。PAM序列是在靶核酸中的序列。在一个实施例中,靶核酸的切割发生在PAM序列的上游。来自不同细菌物种的eaCas9分子可以识别不同序列基序(例如,PAM序列)。在一个实施例中,化脓链球菌的eaCas9分子识别序列基序NGG并且指导切割靶核酸序列上游的1至10(例如,3至5)个碱基对的该序列。参见,例如,玛丽(Mali)等人,科学(Science)2013;339(6121):823-826。在一个实施例中,嗜热链球菌的eaCas9分子识别序列基序NGGNG和NNAGAAW(W=A或T)并且指导切割这些序列上游的1至10(例如,3至5)个碱基对的核心靶核酸序列。参见,例如,霍瓦特(Horvath)等人,科学(Science)2010;327(5962):167-170,以及德沃(Deveau)等人,细菌学杂志(JBACTERIOL)2008;190(4):1390-1400。在一个实施例中,变异链球菌的eaCas9分子识别序列基序NGG或NAAR(R=A或G)并且指导切割核心靶核酸序列在该序列上游的1至10(例如,3至5)个碱基对。参见,例如,德沃(Deveau)等人,细菌学杂志(JBACTERIOL)2008;190(4):1390-1400。在一个实施例中,金黄色葡萄球菌的eaCas9分子识别序列基序NNGRR(R=A或G)并且指导切割靶核酸序列在该序列上游的1至10(例如,3至5)个碱基对。在一个实施例中,脑膜炎奈瑟氏菌的eaCas9分子识别序列基序NNNNGATT并且指导切割靶核酸序列在该序列上游的1至10(例如,3至5)个碱基对。参见,例如,侯(Hou)等人,PNAS早期版2013,1-6。Cas9分子识别PAM序列的能力可以通过使用例如,描述于季聂克(Jinek)等人,科学(Science)2012,337:816中的转化测定来确定。一些Cas9分子具有与gRNA分子相互作用、并且结合该gRNA分子归巢(例如,靶向或定位)至核心靶结构域的能力,但不能切割靶核酸、或不能以有效的速率进行切割。不具有或实质上不具有切割活性的Cas9分子在此被称为eiCas9(无酶促活性的Cas9)分子。例如,eiCas9分子可以缺乏切割活性或具有实质上小于参比Cas9分子,例如,小于20%、10%、5%、1%或0.1%的切割活性,如在此描述的测定中所测量。示例性天然发生的Cas9分子描述于吉林斯基(Chylinski)等人,RNA生物学(RNABiology)2013;10:5,727-737中。此类Cas9分子包括簇1细菌家族、簇2细菌家族、簇3细菌家族、簇4细菌家族、簇5细菌家族、簇6细菌家族、簇7细菌家族、簇8细菌家族、簇9细菌家族、簇10细菌家族、簇11细菌家族、簇12细菌家族、簇13细菌家族、簇14细菌家族、簇15细菌家族、簇16细菌家族、簇17细菌家族、簇18细菌家族、簇19细菌家族、簇20细菌家族、簇21细菌家族、簇22细菌家族、簇23细菌家族、簇24细菌家族、簇25细菌家族、簇26细菌家族、簇27细菌家族、簇28细菌家族、簇29细菌家族、簇30细菌家族、簇31细菌家族、簇32细菌家族、簇33细菌家族、簇34细菌家族、簇35细菌家族、簇36细菌家族、簇37细菌家族、簇38细菌家族、簇39细菌家族、簇40细菌家族、簇41细菌家族、簇42细菌家族、簇43细菌家族、簇44细菌家族、簇45细菌家族、簇46细菌家族、簇47细菌家族、簇48细菌家族、簇49细菌家族、簇50细菌家族、簇51细菌家族、簇52细菌家族、簇53细菌家族、簇54细菌家族、簇55细菌家族、簇56细菌家族、簇57细菌家族、簇58细菌家族、簇59细菌家族、簇60细菌家族、簇61细菌家族、簇62细菌家族、簇63细菌家族、簇64细菌家族、簇65细菌家族、簇66细菌家族、簇67细菌家族、簇68细菌家族、簇69细菌家族、簇70细菌家族、簇71细菌家族、簇72细菌家族、簇73细菌家族、簇74细菌家族、簇75细菌家族、簇76细菌家族、簇77细菌家族、或簇78细菌家族的Cas9分子。示例性天然发生的Cas9分子包括簇1细菌家族的Cas9分子。实例包括以下各项的Cas9分子:化脓链球菌(例如,菌株SF370、MGAS10270、MGAS10750、MGAS2096、MGAS315、MGAS5005、MGAS6180、MGAS9429、NZ131以及SSI-1)、嗜热链球菌(例如,菌株LMD-9)、假豕链球菌(S.pseudoporcinus)(例如,菌株SPIN20026)、变异链球菌(例如,菌株UA159、NN2025)、猕猴链环菌(S.macacae)(例如,菌株NCTC11558)、解没食子酸链球菌(S.gallolyticus)(例如,菌株UCN34、ATCCBAA-2069)、马链球菌(S.equinus)(例如,菌株ATCC9812、MGCS124)、停乳链球菌(S.dysgalactiae)(例如,菌株GGS124)、牛链球菌(S.bovis)(例如,菌株ATCC700338)、咽峡炎链球菌(S.anginosus)(例如,菌株F0211)、无乳链球菌(S.agalactiae)(例如,菌株NEM316、A909)、单核细胞增生李斯特菌(Listeriamonocytogenes)(例如,菌株F6854)、无害利斯特菌(Listeriainnocua)(无害利斯特菌(L.innocua)(例如,菌株Clip11262))、意大利肠道球菌(Enterococcusitalicus)(例如,菌株DSM15952)、或屎肠球菌(Enterococcusfaecium)(例如,菌株1,231,408)。另外的示例性Cas9分子是脑膜炎奈瑟菌(侯(Hou)等人,PNAS早期版2013,1-6)的Cas9分子和金黄色葡萄球菌Cas9分子。在一个实施例中,Cas9分子(例如,eaCas9分子或eiCas9分子)包括以下氨基酸序列:与在此描述的任何Cas9分子序列或天然发生的Cas9分子序列(例如,在此列出的或描述于吉林斯基(Chylinski)等人,RNA生物学(RNABiology)2013,10:5,727-737;侯(Hou)等人,PNAS早期版2013,1-6中的物种的Cas9分子)相比具有60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%、或99%同源性;与之相差不多于2%、5%、10%、15%、20%、30%、或40%的氨基酸残基;与之相差至少1、2、5、10或20个氨基酸但相差不多于100、80、70、60、50、40或30个氨基酸;或与之相同。在一个实施例中,Cas9分子包括以下活性中的一种或多种:切口酶活性;双链切割活性(例如,内切核酸酶和/或外切核酸酶活性);解旋酶活性;或连同gRNA分子定位靶核酸的能力。在一个实施例中,Cas9分子包括图2的共有序列的氨基酸序列,其中“*”指示在化脓链球菌、嗜热链球菌、变异链球菌以及无害利斯特菌的Cas9分子的氨基酸序列中的对应位置中发现的任何氨基酸,并且“-”指示任何氨基酸。在一个实施例中,Cas9分子与披露于图2中的共有序列的序列相差至少1个但不超过2、3、4、5、6、7、8、9、或10个氨基酸残基。在一个实施例中,Cas9分子包括图5的SEQIDNO:7的氨基酸序列,其中“*”指示在化脓链球菌或脑膜炎奈瑟菌的Cas9分子的氨基酸序列中的对应位置中发现的任何氨基酸,“-”指示任何氨基酸,并且“-”指示任何氨基酸或不存在。在一个实施例中,Cas9分子与SEQIDNO:6或7的序列相差至少1个但不超过2、3、4、5、6、7、8、9、或10个氨基酸残基。比较多个Cas9分子的序列表明某些区域是保守的。这些鉴定如下:区域1(残基1至180,或在区域1’情况下,残基120至180)区域2(残基360至480);区域3(残基660至720);区域4(残基817至900);以及区域5(残基900至960)。在一个实施例中,Cas9分子包括区域1-5,连同足够的另外的Cas9分子序列以提供生物活性分子(例如,具有至少一种在此描述的活性的Cas9分子)。在一个实施例中,区域1-6中的每一个,独立地,与在此描述的Cas9分子(来自图2或来自图5的序列)的相应残基具有50%、60%、70%、80%、85%、90%、95%、96%、97%、98%或99%同源性。在一个实施例中,Cas9分子(例如,eaCas9分子或eiCas9分子)包括被称为区域1的氨基酸序列:与化脓链球菌的Cas9的氨基酸序列的氨基酸1-180具有50%、60%、70%、80%、85%、90%、95%、96%、97%、98%或99%同源性(编号是根据图2中的基序序列;图2中的四种Cas9序列中的52%的残基是保守的);与化脓链球菌、嗜热链球菌、变异链球菌、无害利斯特菌、脑膜炎奈瑟氏菌、或金黄色葡萄球菌的Cas9的氨基酸序列的氨基酸1-180相差至少1、2、5、10或20个氨基酸但相差不多于90、80、70、60、50、40或30个氨基酸;或与化脓链球菌、嗜热链球菌、变异链球菌、无害利斯特菌、脑膜炎奈瑟氏菌、或金黄色葡萄球菌的Cas9的氨基酸序列的1-180相同。在一个实施例中,Cas9分子(例如,eaCas9分子或eiCas9分子)包括被称为区域1’的氨基酸序列:与化脓链球菌、嗜热链球菌、变异链球菌、或无害利斯特菌、脑膜炎奈瑟氏菌、或金黄色葡萄球菌的Cas9的氨基酸序列的氨基酸120-180具有55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同源性(图2中的四种Cas9序列中的55%的残基是保守的);与化脓链球菌、嗜热链球菌、变异链球菌、或无害利斯特菌、脑膜炎奈瑟氏菌、或金黄色葡萄球菌的Cas9的氨基酸序列的氨基酸120-180相差至少1、2、或5个氨基酸但相差不多于35、30、25、20或10个氨基酸;或与化脓链球菌、嗜热链球菌、变异链球菌、或无害利斯特菌、脑膜炎奈瑟氏菌、或金黄色葡萄球菌的Cas9的氨基酸序列的120-180相同。在一个实施例中,Cas9分子(例如,eaCas9分子或eiCas9分子)包括被称为区域2的氨基酸序列:与化脓链球菌、嗜热链球菌、变异链球菌、或无害利斯特菌、脑膜炎奈瑟氏菌、或金黄色葡萄球菌的Cas9的氨基酸序列的氨基酸360-480具有50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同源性(图2中的四种Cas9序列中的52%的残基是保守的);与化脓链球菌、嗜热链球菌、变异链球菌、或无害利斯特菌、脑膜炎奈瑟氏菌、或金黄色葡萄球菌的Cas9的氨基酸序列的氨基酸360-480相差至少1、2、或5个氨基酸但相差不多于35、30、25、20或10个氨基酸;或与化脓链球菌、嗜热链球菌、变异链球菌、或无害利斯特菌、脑膜炎奈瑟氏菌、或金黄色葡萄球菌的Cas9的氨基酸序列的360-480相同。在一个实施例中,Cas9分子(例如,eaCas9分子或eiCas9分子)包括被称为区域3的氨基酸序列:与化脓链球菌、嗜热链球菌、变异链球菌、或无害利斯特菌、脑膜炎奈瑟氏菌、或金黄色葡萄球菌的Cas9的氨基酸序列的氨基酸660-720具有55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同源性(图2中的四种Cas9序列中的56%的残基是保守的);与化脓链球菌、嗜热链球菌、变异链球菌、或无害利斯特菌、脑膜炎奈瑟氏菌、或金黄色葡萄球菌的Cas9的氨基酸序列的氨基酸660-720相差至少1、2、或5个氨基酸但相差不多于35、30、25、20或10个氨基酸;或与化脓链球菌、嗜热链球菌、变异链球菌、或无害利斯特菌、脑膜炎奈瑟氏菌、或金黄色葡萄球菌的Cas9的氨基酸序列的660-720相同。在一个实施例中,Cas9分子(例如,eaCas9分子或eiCas9分子)包括被称为区域4的氨基酸序列:与化脓链球菌、嗜热链球菌、变异链球菌、或无害利斯特菌、脑膜炎奈瑟氏菌、或金黄色葡萄球菌的Cas9的氨基酸序列的氨基酸817-900具有50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同源性(图2中的四种Cas9序列中的55%的残基是保守的);与化脓链球菌、嗜热链球菌、变异链球菌、或无害利斯特菌、脑膜炎奈瑟氏菌、或金黄色葡萄球菌的Cas9的氨基酸序列的氨基酸817-900相差至少1、2、或5个氨基酸但相差不多于35、30、25、20或10个氨基酸;或与化脓链球菌、嗜热链球菌、变异链球菌、或无害利斯特菌、脑膜炎奈瑟氏菌、或金黄色葡萄球菌的Cas9的氨基酸序列的817-900相同。在一个实施例中,Cas9分子(例如,eaCas9分子或eiCas9分子)包括被称为区域5的氨基酸序列:与化脓链球菌、嗜热链球菌、变异链球菌、或无害利斯特菌、脑膜炎奈瑟氏菌、或金黄色葡萄球菌的Cas9的氨基酸序列的氨基酸900-960具有50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%同源性(图2中的四种Cas9序列中的60%的残基是保守的);与化脓链球菌、嗜热链球菌、变异链球菌、或无害利斯特菌、脑膜炎奈瑟氏菌、或金黄色葡萄球菌的Cas9的氨基酸序列的氨基酸900-960相差至少1、2、或5个氨基酸但相差不多于35、30、25、20或10个氨基酸;或与化脓链球菌、嗜热链球菌、变异链球菌、或无害利斯特菌、脑膜炎奈瑟氏菌、或金黄色葡萄球菌的Cas9的氨基酸序列的900-960相同。RuvC样结构域和HNH样结构域在一个实施例中,Cas9分子包括HNH样结构域和RuvC样结构域。在一个实施例中,切割活性取决于RuvC样结构域和HNH样结构域。Cas9分子(例如,eaCas9分子或eiCas9分子)可以包括以下结构域中的一者或多者:RuvC样结构域和HNH样结构域。在一个实施例中,cas9分子是eaCas9分子并且eaCas9分子包括RuvC样结构域(例如,如下所述的RuvC样结构域)和/或HNH样结构域(例如,如下所述的HNH样结构域)。在一个实施例中,Cas9分子是eiCas9分子,该eiCas9分子与参比Cas9分子相比包括一个或多个RuvC样结构域和/或HNH样结构域中的差异,并且该eiCas9分子不切割核酸、或以显著低于野生型的效率进行切割,例如,当与野生型在切割测定(例如,如在此描述的)中相比时,切割少于参比Cas9分子的50%、25%、10%、或1%,如通过在此描述的测定所测量。RuvC样结构域在实施例中,RuvC样结构域切割靶核酸分子的单链(例如,非互补链)。Cas9分子可以包括多于一个RuvC样结构域(例如,一个、两个、三个或更多个RuvC样结构域)。在实施例中,RuvC样结构域在长度上是至少5、6、7、8个氨基酸但在长度上不多于20、19、18、17、16或15个氨基酸。在实施例中,cas9分子包括在长度上是约10至20个氨基酸(例如,约15个氨基酸)的N端RuvC样结构域。N端RuvC样结构域一些天然发生的Cas9分子包括多于一个RuvC样结构域,其中切割取决于N端RuvC样结构域。因此,Cas9分子可以包括N端RuvC样结构域。示例性的N端RuvC样结构域如下所述。在实施例中,eaCas9分子包括N端RuvC样结构域,该N端RuvC样结构域包括式I的氨基酸序列:D-X1-G-X2-X3-X4-X5-G-X6-X7-X8-X9(SEQIDNO:8),其中,X1选自I、V、M、L和T(例如,选自I、V、和L);X2选自T、I、V、S、N、Y、E和L(例如,选自T、V、和I);X3选自N、S、G、A、D、T、R、M和F(例如,A或N);X4选自S,Y、N和F(例如,S);X5选自V、I、L、C、T和F(例如,选自V、I和L);X6选自W、F、V、Y、S和L(例如,W);X7选自A、S、C、V和G(例如,选自A和S);X8选自V、I、L、A、M和H(例如,选自V、I、M和L);并且X9选自任何氨基酸或是不存在的(例如,选自T、V、I、L、Δ、F、S、A、Y、M和R,或例如,选自T、V、I、L和Δ)。在实施例中,N端RuvC样结构域与SEQIDNO:8的序列相差多达1个但不超过2、3、4、或5个残基。在实施例中,N端RuvC样结构域是有切割能力的。在实施例中,N端RuvC样结构域是无切割能力的。在实施例中,eaCas9分子包括N端RuvC样结构域,该N端RuvC样结构域包括式II的氨基酸序列:D-X1-G-X2-X3-S-X5-G-X6-X7-X8-X9(SEQIDNO:9),其中X1选自I、V、M、L和T(例如,选自I、V、和L);X2选自T、I、V、S、N、Y、E和L(例如,选自T、V、和I);X3选自N、S、G、A、D、T、R、M和F(例如,A或N);X5选自V、I、L、C、T和F(例如,选自V、I和L);X6选自W、F、V、Y、S和L(例如,W);X7选自A、S、C、V和G(例如,选自A和S);X8选自V、I、L、A、M和H(例如,选自V、I、M和L);并且X9选自任何氨基酸或是不存在的(例如,选自T、V、I、L、Δ、F、S、A、Y、M和R,或选自例如,T、V、I、L和Δ)。在实施例中,N端RuvC样结构域与SEQIDNO:9的序列相差多达1个但不超过2、3、4、或5个残基。在实施例中,N端RuvC样结构域包括式III的氨基酸序列:D-I-G-X2-X3-S-V-G-W-A-X8-X9(SEQIDNO:10),其中X2选自T、I、V、S、N、Y、E和L(例如,选自T、V、和I);X3选自N、S、G、A、D、T、R、M和F(例如,A或N);X8选自V、I、L、A、M和H(例如,选自V、I、M和L);并且X9选自任何氨基酸或是不存在的(例如,选自T、V、I、L、Δ、F、S、A、Y、M和R,或选自例如,T、V、I、L和Δ)。在实施例中,N端RuvC样结构域与SEQIDNO:10的序列相差多达1个但不超过2、3、4、或5个残基。在实施例中,N端RuvC样结构域包括式III的氨基酸序列:D-I-G-T-N-S-V-G-W-A-V-X(SEQIDNO:11),其中X是非极性烷基氨基酸或羟基氨基酸,例如,X选自V、I、L和T(例如,eaCas9分子可以包括示于图2中的N端RuvC样结构域(描绘为“Y”))。在实施例中,N端RuvC样结构域与SEQIDNO:11的序列相差多达1个但不超过2、3、4、或5个残基。在实施例中,N端RuvC样结构域与在此披露(例如,在图3A或图5中)的N端RuvC样结构域的序列相差多达1个但不超过2、3、4、或5个残基。在实施例中,在图3A或图5中鉴定出的高度保守残基中的1、2、或所有3个是存在的。在实施例中,N端RuvC样结构域与在此披露(例如,在图3B中)的N端RuvC样结构域的序列相差多达1个但不超过2、3、4、或5个残基。在实施例中,在图3B中鉴定出的高度保守残基中的1、2、3、或所有4个是存在的。另外的RuvC样结构域除了N端RuvC样结构域之外,Cas9分子(例如,eaCas9分子)可以包括一种或多种另外的RuvC样结构域。在实施例中,Cas9分子可以包括两种另外的RuvC样结构域。优选地,另外的RuvC样结构域在长度上是至少5个氨基酸,并且例如在长度上是小于15个氨基酸,例如在长度上是5至10个氨基酸,例如,在长度上是8个氨基酸。另外的RuvC样结构域可以包括如下氨基酸序列:I-X1-X2-E-X3-A-R-E(SEQIDNO:12),其中X1是V或H,X2是I、L或V(例如,I或V);并且X3是M或T。在实施例中,另外的RuvC样结构域包括如下氨基酸序列:I-V-X2-E-M-A-R-E(SEQIDNO:13),其中X2是I、L或V(例如,I或V)(例如,eaCas9分子可以包括示于图2或图5中的另外的RuvC样结构域(描绘为“B”))。另外的RuvC样结构域可以包括如下氨基酸序列:H-H-A-X1-D-A-X2-X3(SEQIDNO:14),其中X1是H或L;X2是R或V;并且X3是E或V。在实施例中,另外的RuvC样结构域包括如下氨基酸序列:H-H-A-H-D-A-Y-L(SEQIDNO:15)。在实施例中,另外的RuvC样结构域与SEQIDNO:13、15、12或14的序列相差多达1个但不超过2、3、4、或5个残基。在实施例中,在N端RuvC样结构域侧翼的序列是式V的序列:K-X1’-Y-X2’-X3’-X4’-Z-T-D-X9’-Y(SEQIDNO:16),其中X1’选自K和P,X2’选自V、L、I、和F(例如,V、I和L);X3’选自G、A和S(例如,G),X4’选自L、I、V和F(例如,L);X9’选自D、E、N和Q;并且Z是N端RuvC样结构域,例如,如以上所描述的。HNH样结构域在实施例中,HNH样结构域切割单链互补结构域(例如,双链核酸分子的互补链)。在实施例中,HNH样结构域在长度上是至少15、20、25个氨基酸但在长度上不多于40、35或30个氨基酸,例如在长度上是20至35个氨基酸,例如,在长度上是25至30个氨基酸。示例性的HNH样结构域如下所述。在实施例中,eaCas9分子包括HNH样结构域,该HNH样结构域具有式VI的氨基酸序列:X1-X2-X3-H-X4-X5-P-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-N-X16-X17-X18-X19-X20-X21-X22-X23-N(SEQIDNO:17),其中X1选自D、E、Q和N(例如,D和E);X2选自L、I、R、Q、V、M和K;X3选自D和E;X4选自I、V、T、A和L(例如,A、I和V);X5选自V、Y、I、L、F和W(例如,V、I和L);X6选自Q、H、R、K、Y、I、L、F和W;X7选自S、A、D、T和K(例如,S和A);X8选自F、L、V、K、Y、M、I、R、A、E、D和Q(例如,F);X9选自L、R、T、I、V、S、C、Y、K、F和G;X10选自K、Q、Y、T、F、L、W、M、A,E,G和S;X11选自D、S、N、R、L和T(例如,D);X12选自D、N和S;X13选自S、A、T、G和R(例如,S);X14选自I,L、F、S、R、Y、Q、W、D,K和H(例如,I、L和F);X15选自D、S、I、N、E、A、H、F、L、Q、M、G、Y和V;X16选自K、L、R、M、T和F(例如,L、R和K);X17选自V、L、I、A和T;X18选自L、I、V和A(例如,L和I);X19选自T、V、C、E、S和A(例如,T和V);X20选自R、F、T、W、E、L、N、C、K、V、S、Q、I,Y、H和A;X21选自S、P、R、K、N,A、H、Q、G和L;X22选自D、G、T、N、S、K、A、I、E、L、Q、R和Y;并且X23选自K、V、A、E、Y、I、C、L、S、T、G、K、M、D、和F。在实施例中,HNH样结构域与SEQIDNO:17的序列相差至少1个但不超过2、3、4、或5个残基。在实施例中,HNH样结构域是有切割能力的。在实施例中,HNH样结构域是无切割能力的。在实施例中,eaCas9分子包括HNH样结构域,该HNH样结构域包括式VII的氨基酸序列:X1-X2-X3-H-X4-X5-P-X6-S-X8-X9-X10-D-D-S-X14-X15-N-K-V-L-X19-X20-X21-X22-X23-N(SEQIDNO:18),其中X1选自D和E;X2选自L、I、R、Q、V、M和K;X3选自D和E;X4选自I、V、T、A和L(例如,A、I和V);X5选自V、Y、I、L、F和W(例如,V、I和L);X6选自Q、H、R、K、Y、I、L、F和W;X8选自F、L、V、K、Y、M、I、R、A、E、D和Q(例如,F);X9选自L、R、T、I、V、S、C、Y、K、F和G;X10选自K、Q、Y、T、F、L、W、M、A,E,G和S;X14选自I,L、F、S、R、Y、Q、W、D,K和H(例如,I、L和F);X15选自D、S、I、N、E、A、H、F、L、Q、M、G、Y和V;X19选自T、V、C、E、S和A(例如,T和V);X20选自R、F、T、W、E、L、N、C、K、V、S、Q、I,Y、H和A;X21选自S、P、R、K、N,A、H、Q、G和L;X22选自D、G、T、N、S、K、A、I、E、L、Q、R和Y;并且X23选自K、V、A、E、Y、I、C、L、S、T、G、K、M、D、和F。在实施例中,HNH样结构域与SEQIDNO:18的序列相差1、2、3、4、或5个残基。在实施例中,eaCas9分子包括HNH样结构域,该HNH样结构域包括式VII的氨基酸序列:X1-V-X3-H-I-V-P-X6-S-X8-X9-X10-D-D-S-X14-X15-N-K-V-L-T-X20-X21-X22-X23-N(SEQIDNO:19),其中X1选自D和E;X3选自D和E;X6选自Q、H、R、K、Y、I、L和W;X8选自F、L、V、K、Y、M、I、R、A、E、D和Q(例如,F);X9选自L、R、T、I、V、S、C、Y、K、F和G;X10选自K、Q、Y、T、F、L、W、M、A,E,G和S;X14选自I,L、F、S、R、Y、Q、W、D,K和H(例如,I、L和F);X15选自D、S、I、N、E、A、H、F、L、Q、M、G、Y和V;X20选自R、F、T、W、E、L、N、C、K、V、S、Q、I,Y、H和A;X21选自S、P、R、K、N,A、H、Q、G和L;X22选自D、G、T、N、S、K、A、I、E、L、Q、R和Y;并且X23选自K、V、A、E、Y、I、C、L、S、T、G、K、M、D、和F。在实施例中,HNH样结构域与SEQIDNO:19的序列相差1、2、3、4、或5个残基。在实施例中,eaCas9分子包括HNH样结构域,该HNH样结构域具有式VIII的氨基酸序列:D-X2-D-H-I-X5-P-Q-X7-F-X9-X10-D-X12-S-I-D-N-X16-V-L-X19-X20-S-X22-X23-N(SEQIDNO:20),其中X2选自I和V;X5选自I和V;X7选自A和S;X9选自I和L;X10选自K和T;X12选自D和N;X16选自R、K和L;X19选自T和V;X20选自S和R;X22选自K、D和A;并且X23选自E、K、G和N(例如,eaCas9分子可以包括如在此描述的HNH样结构域)。在实施例中,HNH样结构域与SEQIDNO:20的序列相差多达1个但不超过2、3、4、或5个残基。在实施例中,eaCas9分子包括式IX的氨基酸序列:L-Y-Y-L-Q-N-G-X1’-D-M-Y-X2’-X3’-X4’-X5’-L-D-I-X6’-X7’-L-S-X8’-Y-Z-N-R-X9’-K-X10’-D-X11’-V-P(SEQIDNO:21),其中X1’选自K和R;X2’选自V和T;X3’选自G和D;X4’选自E、Q和D;X5’选自E和D;X6’选自D、N和H;X7’选自Y、R和N;X8’选自Q、D和N;X9’选自G和E;X10’选自S和G;X11’选自D和N;并且Z是HNH样结构域,例如,如以上所描述的。在实施例中,eaCas9分子包括氨基酸序列,该氨基酸序列与SEQIDNO:21的序列相差多达1个但不超过2、3、4、或5个残基。在实施例中,HNH样结构域与在此披露(例如,在图4A或图5中)的HNH样结构域的序列相差多达1个但不超过2、3、4、或5个残基。在实施例中,HNH样结构域与在此披露(例如,在图4B中)的HNH样结构域的序列相差多达1个但不超过2、3、4、或5个残基。在实施例中,在图4B中鉴定出的高度保守残基中的1、2、所有3个是存在的。改变的Cas9分子天然发生的Cas9分子具有多种特性,包括:切口酶活性、核酸酶活性(例如,内切核酸酶和/或外切核酸酶活性);解旋酶活性;在功能上与gRNA分子相关联的能力;以及靶向(或定位至)核酸上的位点(例如,PAM识别和特异性)的能力。在实施例中,Cas9分子可以包括这些特性的全部或一个子集。在典型的实施例中,Cas9分子具有与gRNA分子相互作用、并且与该gRNA分子一起定位至核酸中的位点的能力。其他活性(例如,PAM特异性、切割活性、或解旋酶活性)在Cas9分子中可更广泛地变化。具有所希望特性的Cas9分子可以通过多种方式制成,例如,通过改变亲本,例如天然发生的Cas9分子以提供具有所希望特性的改变的Cas9分子。例如,可以引入一个或多个相对于亲本Cas9分子的突变或差异。此类突变和差异包括:取代(例如,保守取代或非必需氨基酸的取代);插入;或缺失。在实施例中,Cas9分子相对于参比Cas9分子可以包括一个或多个突变或差异,例如,至少1、2、3、4、5、10、15、20、30、40或50个突变但少于200、100、或80个突变。在实施例中,一个突变或多个突变对Cas9活性(例如,在此描述的Cas9活性)不具有实质影响。在实施例中,一个突变或多个突变对Cas9活性(例如,在此描述的Cas9活性)具有实质影响。在实施例中,示例性的活性包括PAM特异性、切割活性、和解旋酶活性中的一项或多项。突变可以存在于,例如,一种或多种RuvC样结构域(例如,N端RuvC样结构域)中;HNH样结构域中;RuvC样结构域和HNH样结构域之外的区域中。在实施例中,突变存在于N端RuvC样结构域中。在实施例中,突变存在于HNH样结构域中。在实施例中,突变存在于N端RuvC样结构域和HNH样结构域二者中。无论特定序列(例如,取代)是否可以影响一种或多种活性(如靶向活性、切割活性等),例如,可以通过评价该突变是否是保守的或通过第III部分中所描述的方法来评价或预测。在实施例中,“非必需”氨基酸残基,如在Cas9分子的背景下所使用的,是可以改变自Cas9分子的野生型序列(例如,天然发生的Cas9分子(例如,eaCas9分子))的残基,不会消除或更优选地不会实质上改变Cas9活性(例如,切割活性),而改变“必需”氨基酸残基导致活性(例如,切割活性)的实质性损失。在实施例中,改变的Cas9分子是eaCas9分子,该eaCas9分子包括示于披露于图2中的共有序列中的化脓链球菌的固定氨基酸残基,并且与化脓链球菌的氨基酸序列相比在由披露于图2或SEQIDNO:7中的共有序列中的“-”表示的一个或多个残基(例如,2、3、5、10、15、20、30、50、70、80、90、100、200个氨基酸残基)处具有不同的一个或多个氨基酸(例如,具有取代)。在实施例中,改变的Cas9分子是eiCas9分子,其中示于披露于图2中的共有序列中的化脓链球菌的固定氨基酸残基中的一个或多个(例如,2、3、5、10、15、20、30、50、70、80、90、100、200个氨基酸残基)发生突变。在实施例中,改变的Cas9分子包括一种序列,其中:对应于披露于图2中的共有序列的固定序列的序列与披露于图2中的共有序列中的固定残基的不多于1%、2%、3%、4%、5%、10%、15%、或20%有区别;对应于披露于图2中的共有序列中由“*”鉴别的残基的序列与来自天然发生的Cas9分子(例如,化脓链球菌Cas9分子)的对应序列的“*”残基的不多于1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、或40%有区别;并且,对应于披露于图2中的共有序列中由“-”鉴别的残基的序列与来自天然发生的Cas9分子(例如,化脓链球菌Cas9分子)的对应序列的“-”残基的不多于5%、10%、15%、20%、25%、30%、35%、40%、45%、55%、或60%有区别。在实施例中,改变的Cas9分子是eaCas9分子,该eaCas9分子包括示于披露于图2中的共有序列中的嗜热链球菌的固定氨基酸残基,并且与嗜热链球菌的氨基酸序列相比在由披露于图2中的共有序列中的“-”表示的一个或多个残基(例如,2、3、5、10、15、20、30、50、70、80、90、100、200个氨基酸残基)处具有一个或多个不同的氨基酸(例如,具有取代)。在实施例中,改变的Cas9分子是eiCas9分子,其中示于披露于图2中的共有序列中的嗜热链球菌的固定氨基酸残基中的一个或多个(例如,2、3、5、10、15、20、30、50、70、80、90、100、200个氨基酸残基)发生突变。在实施例中,改变的Cas9分子包括一种序列,其中:对应于披露于图2中的共有序列的固定序列的序列与披露于图2中的共有序列中的固定残基的不多于1%、2%、3%、4%、5%、10%、15%、或20%有区别;对应于披露于图2中的共有序列中由“*”鉴别的残基的序列与来自天然发生的Cas9分子(例如,嗜热链球菌Cas9分子)的对应序列的“*”残基的不多于1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、或40%有区别;并且,对应于披露于图2中的共有序列中由“-”鉴别的残基的序列与来自天然发生的Cas9分子(例如,嗜热链球菌Cas9分子)的对应序列的“-”残基的不多于5%、10%、15%、20%、25%、30%、35%、40%、45%、55%、或60%有区别。在实施例中,改变的Cas9分子是eaCas9分子,该eaCas9分子包括示于披露于图2中的共有序列中的变异链球菌的固定氨基酸残基,并且与变异链球菌的氨基酸序列相比在由披露于图2中的共有序列中的“-”表示的一个或多个残基(例如,2、3、5、10、15、20、30、50、70、80、90、100、200个氨基酸残基)处具有一个或多个不同的氨基酸(例如,具有取代)。在实施例中,改变的Cas9分子是eiCas9分子,其中示于披露于图2中的共有序列中的变异链球菌的固定氨基酸残基中的一个或多个(例如,2、3、5、10、15、20、30、50、70、80、90、100、200个氨基酸残基)发生突变。在实施例中,改变的Cas9分子包括一种序列,其中:对应于披露于图2中的共有序列的固定序列的序列与披露于图2中的共有序列中的固定残基的不多于1%、2%、3%、4%、5%、10%、15%、或20%有区别;对应于披露于图2中的共有序列中由“*”鉴别的残基的序列与来自天然发生的Cas9分子(例如,变异链球菌Cas9分子)的对应序列的“*”残基的不多于1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、或40%有区别;并且,对应于披露于图2中的共有序列中由“-”鉴别的残基的序列与来自天然发生的Cas9分子(例如,变异链球菌Cas9分子)的对应序列的“-”残基的不多于5%、10%、15%、20%、25%、30%、35%、40%、45%、55%、或60%有区别。在实施例中,改变的Cas9分子是eaCas9分子,该eaCas9分子包括示于披露于图2中的共有序列中的无害利斯特菌的固定氨基酸残基,并且与无害利斯特菌的氨基酸序列相比在由披露于图2中的共有序列中的“-”表示的一个或多个残基(例如,2、3、5、10、15、20、30、50、70、80、90、100、200个氨基酸残基)处具有一个或多个不同的氨基酸(例如,具有取代)。在实施例中,改变的Cas9分子是eiCas9分子,其中示于披露于图2中的共有序列中的无害利斯特菌的固定氨基酸残基中的一个或多个(例如,2、3、5、10、15、20、30、50、70、80、90、100、200个氨基酸残基)发生突变。在实施例中,改变的Cas9分子包括一种序列,其中:对应于披露于图2中的共有序列的固定序列的序列与披露于图2中的共有序列中的固定残基的不多于1%、2%、3%、4%、5%、10%、15%、或20%有区别;对应于披露于图2中的共有序列中由“*”鉴别的残基的序列与来自天然发生的Cas9分子(例如,无害利斯特菌Cas9分子)的对应序列的“*”残基的不多于1%、2%、3%、4%、5%、10%、15%、20%、25%、30%、35%、或40%有区别;并且,对应于披露于图2中的共有序列中由“-”鉴别的残基的序列与来自天然发生的Cas9分子(例如,无害利斯特菌Cas9分子)的对应序列的“-”残基的不多于5%、10%、15%、20%、25%、30%、35%、40%、45%、55%、或60%有区别。在实施例中,改变的Cas9分子(例如,eaCas9分子或eiCas9分子)可以是,例如,多种不同Cas9分子(例如,不同物种的两种或更多种天然发生的Cas9分子)中的两种的融合。例如,可以将一个物种的天然发生的Cas9分子的片段融合到第二物种的Cas9分子的片段上。作为一个实例,可以将含有N端RuvC样结构域的化脓链球菌的Cas9的片段融合至含有HNH样结构域的除化脓链球菌外的物种(例如,嗜热链球菌)的Cas9的片段上。具有改变的PAM识别或无PAM识别的Cas9分子天然发生的Cas9分子可以识别特异性PAM序列,例如,如上针对化脓链球菌、嗜热链球菌、变异链球菌、金黄色葡萄球菌(S.aureus)以及脑膜炎奈瑟氏菌(N.meningitidis)所描述的PAM识别序列。在实施例中,Cas9分子具有与天然发生的Cas9分子相同的PAM特异性。在实施例中,Cas9分子具有与天然发生的Cas9分子不相关的PAM特异性、或与天然发生的Cas9分子不相关的PAM特异性,其中Cas9分子与天然发生的Cas9分子具有最接近序列同源性。例如,可以改变天然发生的Cas9分子,例如,以改变PAM识别,例如,以改变Cas9分子识别以减少脱靶位点和/或改进特异性或消除PAM识别需要的PAM序列。在实施例中,可以改变Cas9分子,例如,以增加PAM识别序列的长度和/或将Cas9特异性改进至高水平的一致性从而减少脱靶位点并增加特异性。在实施例中,PAM识别序列的长度是至少4、5、6、7、8、9、10或15个氨基酸的长度。可以使用定向进化产生识别不同PAM序列和/或具有降低的脱靶活性的Cas9分子。可以用于Cas9分子定向进化的示例性方法和系统描述于,例如,埃斯维尔特(Esvelt)等人,自然(Nature)2011,472(7344):499-503中。可以通过例如描述于第III部分中的方法对候选Cas9分子进行评价。非切割和修饰-切割Cas9分子在实施例中,Cas9分子包括不同于天然发生的Cas9分子(例如,不同于具有最接近同源性的天然发生的Cas9分子)的切割特性。例如,Cas9分子可以与天然发生的Cas9分子(例如,化脓链球菌的Cas9分子)有如下区别:例如,相比于天然发生的Cas9分子(例如,化脓链球菌的Cas9分子),它调节(例如,降低或增加)对双链断裂(内切核酸酶和/或外切核酸酶活性)切割的能力;例如,相比于天然发生的Cas9分子(例如,化脓链球菌的Cas9分子),它调节(例如,降低或增加)对核酸的单链(例如,核酸分子的非互补链或核酸分子的互补链)切割的能力(切口酶活性);或切割核酸分子(例如,双链或单链核酸分子)的能力可以被消除。修饰的切割eaCas9分子在实施例中,eaCas9分子包括以下活性中的一种或多种:与N端RuvC样结构域相关的切割活性;与HNH样结构域相关的切割活性;与HNH结构域相关的切割活性以及与N端RuvC样结构域相关的切割活性。在实施例中,eaCas9分子包括活性、或有切割能力、HNH样结构域(例如,在此描述的HNH样结构域(例如,SEQIDNO:17、SEQIDNO:18、SEQIDNO:19、SEQIDNO:20或SEQIDNO:21))以及无活性、或无切割能力、N端RuvC样结构域。示例性无活性、或无切割能力、N端RuvC样结构域可以具有N端RuvC样结构域中天冬氨酸的突变(例如,披露于图2中的共有序列在位置9处的天冬氨酸或SEQIDNO:7在位置10处的天冬氨酸,例如,可以被丙氨酸取代)。在实施例中,eaCas9与野生型的区别在于N端RuvC样结构域并且不切割靶核酸、或以显著低于参比Cas9分子的切割活性(例如,低于20%、10%、5%、1%或0.1%)的效率进行切割,如通过在此描述的测定所测量的。参比Cas9分子可以是天然发生的未修饰的Cas9分子(例如,天然发生的Cas9分子,如化脓链球菌或嗜热链球菌的Cas9分子)。在实施例中,参比Cas9分子是具有最接近序列一致性或同源性的天然发生的Cas9分子。在实施例中,eaCas9分子包括无活性、或无切割能力、HNH样结构域以及活性、或有切割能力、N端RuvC样结构域(例如,在此描述的HNH样结构域(例如,SEQIDNO:8、SEQIDNO:9、SEQIDNO:10、SEQIDNO:11、SEQIDNO:12、SEQIDNO:13、SEQIDNO:14或SEQIDNO:15))。示例性无活性、或无切割能力的HNH样结构域可以具有在以下一处或多处的突变:HNH样结构域中的组氨酸(例如,在披露于图2中的共有序列位置856处的组氨酸,例如,可以被丙氨酸取代);以及HNH样结构域中的一个或多个天冬酰胺(例如,在披露于图2中的共有序列位置870处和/或在披露于图2中的共有序列位置879处的天冬酰胺,例如,可以被丙氨酸取代)。在实施例中,eaCas9与野生型的区别在于HNH样结构域并且不切割靶核酸、或以显著低于参比Cas9分子的切割活性(例如,低于20%、10%、5%、1%或0.1%)的效率进行切割,如通过在此描述的测定所测量的。参比Cas9分子可以是天然发生的未修饰的Cas9分子(例如,天然发生的Cas9分子,如化脓链球菌或嗜热链球菌的Cas9分子)。在实施例中,参比Cas9分子是具有最接近序列一致性或同源性的天然发生的Cas9分子。非切割eiCas9分子在实施例中,改变的Cas9分子是不切割核酸分子(双链或单链核酸分子)或以显著低于参比Cas9分子的切割活性(如通过在此描述的测定所测量的)(例如,低于20%、10%、5%、1%或0.1%)的效率切割核酸分子的eiCas9分子。参比Cas9分子可以是天然发生的未修饰的Cas9分子(例如,天然发生的Cas9分子,如化脓链球菌、嗜热链球菌、金黄色葡萄球菌或脑膜炎奈瑟氏菌的Cas9分子)。在实施例中,参比Cas9分子是具有最接近序列一致性或同源性的天然发生的Cas9分子。在实施例中,eiCas9分子缺少与N端RuvC样结构域相关的实质切割活性以及与HNH样结构域相关的切割活性。在实施例中,eiCas9分子包括无活性、或无切割能力的N端RuvC样结构域。示例性无活性、或无切割能力、N端RuvC样结构域可以具有N端RuvC样结构域中天冬氨酸的突变(例如,披露于图2中的共有序列的位置9处的天冬氨酸或SEQIDNO:7的位置10处的天冬氨酸,例如,可以被丙氨酸取代)。在实施例中,eiCas9分子包括无活性、或无切割能力、HNH样结构域(例如,在此描述的HNH样结构域(例如,SEQIDNO:8、SEQIDNO:9、SEQIDNO:10、SEQIDNO:11、SEQIDNO:12、SEQIDNO:13、SEQIDNO:14或SEQIDNO:15))。示例性无活性、或无切割能力的HNH样结构域可以具有在以下一处或多处的突变:HNH样结构域中的组氨酸(例如,在披露于图2中的共有序列位置856处的组氨酸,例如,可以被丙氨酸取代);以及HNH样结构域中的一个或多个天冬酰胺(例如,在披露于图2中的共有序列位置870处和/或在披露于图2中的共有序列位置879处的天冬酰胺,例如,可以被丙氨酸取代)。无催化活性Cas9分子可以与转录阻抑物融合。eiCas9融合蛋白与gRNA复合并且定位至由gRNA的靶向结构域指定的DNA序列,但与eaCas9不同,它将不切割靶DNA。将效应子结构域(如转录抑制结构域)融合至eiCas9能够将效应子募集至任何由gRNA指定的DNA位点。eiCas9或eiCas9融合蛋白位点特异性靶向基因的启动区,可以阻断RNA聚合酶结合至该启动区、转录因子(例如,转录激活因子)和/或转录增强子以抑制转录激活。可替代地,融合至转录阻抑物的eiCas9位点特异性靶向基因的启动区,可以用于降低转录激活。可融合至eiCas9分子的转录阻抑物或转录阻抑物结构域可以包括克鲁拜尔(Krüppel)相关盒(KRAB或SKD)、MadmSIN3相互作用结构域(SID)或ERF阻抑物结构域(ERD)。在另一个实施例中,eiCas9分子可以与修饰染色质的蛋白融合。例如,eiCas9分子可以融合至异染色质蛋白1(HP1)、组蛋白赖氨酸甲基转移酶(例如,SUV39H1、SUV39H2、G9A、ESET/SETDB1、Pr-SET7/8、SUV4-20H1、RIZ1)、组蛋白赖氨酸脱甲基酶(例如,LSD1/BHC110、SpLsd1/Sw、1/Saf110、Su(var)3-3、JMJD2A/JHDM3A、JMJD2B、JMJD2C/GASC1、JMJD2D、Rph1、JARID1A/RBP2、JAR1D1B/PLU-1、JAR1D1C/SMCX、JARID1D/SMCY、Lid、Jhn2、Jmj2)、组蛋白赖氨酸脱乙酰酶(例如,HDAC1、HDAC2、HDAC3、HDAC8、Rpd3、Hos1、Cir6、HDAC4、HDAC5、HDAC7、HDAC9、Hda1、Cir3、SIRT1、SIRT2、Sir2、Hst1、Hst2、Hst3、Hst4、HDAC11)以及DNA甲基化酶(DNMT1、DNMT2a/DMNT3b、MET1)上。eiCas9-染色质修饰分子融合蛋白可以用于改变染色质状态以减少靶基因的表达。异源序列(例如,转录阻抑物结构域)可以融合至eiCas9蛋白的N-或C-末端。在替代实施例中,异源序列(例如,转录阻抑物结构域)可以融合至eiCas9蛋白的内部部分(即,除N-末端或C-末端外的部分)。可以通过例如描述于此处第III部分中的方法对Cas9分子/gRNA分子复合物结合至并且切割靶核酸的能力进行评价。也可以通过本领域中熟知的方法对Cas9分子(eaCas9或eiCas9)的活性(单独地或在与gRNA分子的复合物中)进行评价,方法包括基因表达测定和基于染色质的测定(例如,染色质免疫沉淀反应(ChiP)和染色质体内测定(CiA))。核酸编码Cas9分子在此提供了编码Cas9分子(例如,eaCas9分子或eiCas9分子)的核酸。编码Cas9分子的示例性核酸描述于丛(Cong)等人,科学(SCIENCE)2013,399(6121):819-823;王(Wang)等人,细胞(CELL)2013,153(4):910-918;玛丽(Mali)等人,科学(SCIENCE)2013,399(6121):823-826;季聂克(Jinek)等人,科学(SCIENCE)2012,337(6096):816-821中。编码脑膜炎奈瑟氏菌的Cas9分子的另一种示例性核酸示于图6中。在实施例中,编码Cas9分子的核酸可以是合成的核酸序列。例如,合成的核酸分子可以进行化学修饰,例如,如在第X部分中所描述的。在实施例中,Cas9mRNA具有以下特性中的一种或多种(例如,所有):它被加帽、聚腺苷酸化、被5-甲基胞苷和/或假尿苷取代。另外或可替代地,可以对合成的核酸序列进行密码子优化(例如,至少一个非常见密码子或不太常见密码子已经被常见密码子取代)。例如,合成的核酸可以引导优化的信使mRNA的合成(例如,对于在哺乳动物表达系统(例如,在此描述的)中的表达进行优化)。另外或可替代地,编码Cas9分子的核酸可以包括核定位序列(NLS)。核定位序列在本领域中是已知的。下面提供了编码化脓链球菌的Cas9分子的示例性密码子优化核酸序列。(SEQIDNO:22)下面提供了化脓链球菌Cas9分子的对应氨基酸序列。MDKKYSIGLDIGTNSVGWAVITDEYKVPSKKFKVLGNTDRHSIKKNLIGALLFDSGETAEATRLKRTARRRYTRRKNRICYLQEIFSNEMAKVDDSFFHRLEESFLVEEDKKHERHPIFGNIVDEVAYHEKYPTIYHLRKKLVDSTDKADLRLIYLALAHMIKFRGHFLIEGDLNPDNSDVDKLFIQLVQTYNQLFEENPINASGVDAKAILSARLSKSRRLENLIAQLPGEKKNGLFGNLIALSLGLTPNFKSNFDLAEDAKLQLSKDTYDDDLDNLLAQIGDQYADLFLAAKNLSDAILLSDILRVNTEITKAPLSASMIKRYDEHHQDLTLLKALVRQQLPEKYKEIFFDQSKNGYAGYIDGGASQEEFYKFIKPILEKMDGTEELLVKLNREDLLRKQRTFDNGSIPHQIHLGELHAILRRQEDFYPFLKDNREKIEKILTFRIPYYVGPLARGNSRFAWMTRKSEETITPWNFEEVVDKGASAQSFIERMTNFDKNLPNEKVLPKHSLLYEYFTVYNELTKVKYVTEGMRKPAFLSGEQKKAIVDLLFKTNRKVTVKQLKEDYFKKIECFDSVEISGVEDRFNASLGTYHDLLKIIKDKDFLDNEENEDILEDIVLTLTLFEDREMIEERLKTYAHLFDDKVMKQLKRRRYTGWGRLSRKLINGIRDKQSGKTILDFLKSDGFANRNFMQLIHDDSLTFKEDIQKAQVSGQGDSLHEHIANLAGSPAIKKGILQTVKVVDELVKVMGRHKPENIVIEMARENQTTQKGQKNSRERMKRIEEGIKELGSQILKEHPVENTQLQNEKLYLYYLQNGRDMYVDQELDINRLSDYDVDHIVPQSFLKDDSIDNKVLTRSDKNRGKSDNVPSEEVVKKMKNYWRQLLNAKLITQRKFDNLTKAERGGLSELDKAGFIKRQLVETRQITKHVAQILDSRMNTKYDENDKLIREVKVITLKSKLVSDFRKDFQFYKVREINNYHHAHDAYLNAVVGTALIKKYPKLESEFVYGDYKVYDVRKMIAKSEQEIGKATAKYFFYSNIMNFFKTEITLANGEIRKRPLIETNGETGEIVWDKGRDFATVRKVLSMPQVNIVKKTEVQTGGFSKESILPKRNSDKLIARKKDWDPKKYGGFDSPTVAYSVLVVAKVEKGKSKKLKSVKELLGITIMERSSFEKNPIDFLEAKGYKEVKKDLIIKLPKYSLFELENGRKRMLASAGELQKGNELALPSKYVNFLYLASHYEKLKGSPEDNEQKQLFVEQHKHYLDEIIEQISEFSKRVILADANLDKVLSAYNKHRDKPIREQAENIIHLFTLTNLGAPAAFKYFDTTIDRKRYTSTKEVLDATLIHQSITGLYETRIDLSQLGGD*(SEQIDNO:23)下面提供了编码脑膜炎奈瑟氏菌的Cas9分子的示例性密码子优化核酸序列。ATGGCCGCCTTCAAGCCCAACCCCATCAACTACATCCTGGGCCTGGACATCGGCATCGCCAGCGTGGGCTGGGCCATGGTGGAGATCGACGAGGACGAGAACCCCATCTGCCTGATCGACCTGGGTGTGCGCGTGTTCGAGCGCGCTGAGGTGCCCAAGACTGGTGACAGTCTGGCTATGGCTCGCCGGCTTGCTCGCTCTGTTCGGCGCCTTACTCGCCGGCGCGCTCACCGCCTTCTGCGCGCTCGCCGCCTGCTGAAGCGCGAGGGTGTGCTGCAGGCTGCCGACTTCGACGAGAACGGCCTGATCAAGAGCCTGCCCAACACTCCTTGGCAGCTGCGCGCTGCCGCTCTGGACCGCAAGCTGACTCCTCTGGAGTGGAGCGCCGTGCTGCTGCACCTGATCAAGCACCGCGGCTACCTGAGCCAGCGCAAGAACGAGGGCGAGACCGCCGACAAGGAGCTGGGTGCTCTGCTGAAGGGCGTGGCCGACAACGCCCACGCCCTGCAGACTGGTGACTTCCGCACTCCTGCTGAGCTGGCCCTGAACAAGTTCGAGAAGGAGAGCGGCCACATCCGCAACCAGCGCGGCGACTACAGCCACACCTTCAGCCGCAAGGACCTGCAGGCCGAGCTGATCCTGCTGTTCGAGAAGCAGAAGGAGTTCGGCAACCCCCACGTGAGCGGCGGCCTGAAGGAGGGCATCGAGACCCTGCTGATGACCCAGCGCCCCGCCCTGAGCGGCGACGCCGTGCAGAAGATGCTGGGCCACTGCACCTTCGAGCCAGCCGAGCCCAAGGCCGCCAAGAACACCTACACCGCCGAGCGCTTCATCTGGCTGACCAAGCTGAACAACCTGCGCATCCTGGAGCAGGGCAGCGAGCGCCCCCTGACCGACACCGAGCGCGCCACCCTGATGGACGAGCCCTACCGCAAGAGCAAGCTGACCTACGCCCAGGCCCGCAAGCTGCTGGGTCTGGAGGACACCGCCTTCTTCAAGGGCCTGCGCTACGGCAAGGACAACGCCGAGGCCAGCACCCTGATGGAGATGAAGGCCTACCACGCCATCAGCCGCGCCCTGGAGAAGGAGGGCCTGAAGGACAAGAAGAGTCCTCTGAACCTGAGCCCCGAGCTGCAGGACGAGATCGGCACCGCCTTCAGCCTGTTCAAGACCGACGAGGACATCACCGGCCGCCTGAAGGACCGCATCCAGCCCGAGATCCTGGAGGCCCTGCTGAAGCACATCAGCTTCGACAAGTTCGTGCAGATCAGCCTGAAGGCCCTGCGCCGCATCGTGCCCCTGATGGAGCAGGGCAAGCGCTACGACGAGGCCTGCGCCGAGATCTACGGCGACCACTACGGCAAGAAGAACACCGAGGAGAAGATCTACCTGCCTCCTATCCCCGCCGACGAGATCCGCAACCCCGTGGTGCTGCGCGCCCTGAGCCAGGCCCGCAAGGTGATCAACGGCGTGGTGCGCCGCTACGGCAGCCCCGCCCGCATCCACATCGAGACCGCCCGCGAGGTGGGCAAGAGCTTCAAGGACCGCAAGGAGATCGAGAAGCGCCAGGAGGAGAACCGCAAGGACCGCGAGAAGGCCGCCGCCAAGTTCCGCGAGTACTTCCCCAACTTCGTGGGCGAGCCCAAGAGCAAGGACATCCTGAAGCTGCGCCTGTACGAGCAGCAGCACGGCAAGTGCCTGTACAGCGGCAAGGAGATCAACCTGGGCCGCCTGAACGAGAAGGGCTACGTGGAGATCGACCACGCCCTGCCCTTCAGCCGCACCTGGGACGACAGCTTCAACAACAAGGTGCTGGTGCTGGGCAGCGAGAACCAGAACAAGGGCAACCAGACCCCCTACGAGTACTTCAACGGCAAGGACAACAGCCGCGAGTGGCAGGAGTTCAAGGCCCGCGTGGAGACCAGCCGCTTCCCCCGCAGCAAGAAGCAGCGCATCCTGCTGCAGAAGTTCGACGAGGACGGCTTCAAGGAGCGCAACCTGAACGACACCCGCTACGTGAACCGCTTCCTGTGCCAGTTCGTGGCCGACCGCATGCGCCTGACCGGCAAGGGCAAGAAGCGCGTGTTCGCCAGCAACGGCCAGATCACCAACCTGCTGCGCGGCTTCTGGGGCCTGCGCAAGGTGCGCGCCGAGAACGACCGCCACCACGCCCTGGACGCCGTGGTGGTGGCCTGCAGCACCGTGGCCATGCAGCAGAAGATCACCCGCTTCGTGCGCTACAAGGAGATGAACGCCTTCGACGGTAAAACCATCGACAAGGAGACCGGCGAGGTGCTGCACCAGAAGACCCACTTCCCCCAGCCCTGGGAGTTCTTCGCCCAGGAGGTGATGATCCGCGTGTTCGGCAAGCCCGACGGCAAGCCCGAGTTCGAGGAGGCCGACACCCCCGAGAAGCTGCGCACCCTGCTGGCCGAGAAGCTGAGCAGCCGCCCTGAGGCCGTGCACGAGTACGTGACTCCTCTGTTCGTGAGCCGCGCCCCCAACCGCAAGATGAGCGGTCAGGGTCACATGGAGACCGTGAAGAGCGCCAAGCGCCTGGACGAGGGCGTGAGCGTGCTGCGCGTGCCCCTGACCCAGCTGAAGCTGAAGGACCTGGAGAAGATGGTGAACCGCGAGCGCGAGCCCAAGCTGTACGAGGCCCTGAAGGCCCGCCTGGAGGCCCACAAGGACGACCCCGCCAAGGCCTTCGCCGAGCCCTTCTACAAGTACGACAAGGCCGGCAACCGCACCCAGCAGGTGAAGGCCGTGCGCGTGGAGCAGGTGCAGAAGACCGGCGTGTGGGTGCGCAACCACAACGGCATCGCCGACAACGCCACCATGGTGCGCGTGGACGTGTTCGAGAAGGGCGACAAGTACTACCTGGTGCCCATCTACAGCTGGCAGGTGGCCAAGGGCATCCTGCCCGACCGCGCCGTGGTGCAGGGCAAGGACGAGGAGGACTGGCAGCTGATCGACGACAGCTTCAACTTCAAGTTCAGCCTGCACCCCAACGACCTGGTGGAGGTGATCACCAAGAAGGCCCGCATGTTCGGCTACTTCGCCAGCTGCCACCGCGGCACCGGCAACATCAACATCCGCATCCACGACCTGGACCACAAGATCGGCAAGAACGGCATCCTGGAGGGCATCGGCGTGAAGACCGCCCTGAGCTTCCAGAAGTACCAGATCGACGAGCTGGGCAAGGAGATCCGCCCCTGCCGCCTGAAGAAGCGCCCTCCTGTGCGCTAA(SEQIDNO:24)下面提供了脑膜炎奈瑟氏菌Cas9分子的对应氨基酸序列。MAAFKPNPINYILGLDIGIASVGWAMVEIDEDENPICLIDLGVRVFERAEVPKTGDSLAMARRLARSVRRLTRRRAHRLLRARRLLKREGVLQAADFDENGLIKSLPNTPWQLRAAALDRKLTPLEWSAVLLHLIKHRGYLSQRKNEGETADKELGALLKGVADNAHALQTGDFRTPAELALNKFEKESGHIRNQRGDYSHTFSRKDLQAELILLFEKQKEFGNPHVSGGLKEGIETLLMTQRPALSGDAVQKMLGHCTFEPAEPKAAKNTYTAERFIWLTKLNNLRILEQGSERPLTDTERATLMDEPYRKSKLTYAQARKLLGLEDTAFFKGLRYGKDNAEASTLMEMKAYHAISRALEKEGLKDKKSPLNLSPELQDEIGTAFSLFKTDEDITGRLKDRIQPEILEALLKHISFDKFVQISLKALRRIVPLMEQGKRYDEACAEIYGDHYGKKNTEEKIYLPPIPADEIRNPVVLRALSQARKVINGVVRRYGSPARIHIETAREVGKSFKDRKEIEKRQEENRKDREKAAAKFREYFPNFVGEPKSKDILKLRLYEQQHGKCLYSGKEINLGRLNEKGYVEIDHALPFSRTWDDSFNNKVLVLGSENQNKGNQTPYEYFNGKDNSREWQEFKARVETSRFPRSKKQRILLQKFDEDGFKERNLNDTRYVNRFLCQFVADRMRLTGKGKKRVFASNGQITNLLRGFWGLRKVRAENDRHHALDAVVVACSTVAMQQKITRFVRYKEMNAFDGKTIDKETGEVLHQKTHFPQPWEFFAQEVMIRVFGKPDGKPEFEEADTPEKLRTLLAEKLSSRPEAVHEYVTPLFVSRAPNRKMSGQGHMETVKSAKRLDEGVSVLRVPLTQLKLKDLEKMVNREREPKLYEALKARLEAHKDDPAKAFAEPFYKYDKAGNRTQQVKAVRVEQVQKTGVWVRNHNGIADNATMVRVDVFEKGDKYYLVPIYSWQVAKGILPDRAVVQGKDEEDWQLIDDSFNFKFSLHPNDLVEVITKKARMFGYFASCHRGTGNINIRIHDLDHKIGKNGILEGIGVKTALSFQKYQIDELGKEIRPCRLKKRPPVR*(SEQIDNO:25)下面提供了金黄色葡萄球菌Cas9分子的氨基酸序列。MKRNYILGLDIGITSVGYGIIDYETRDVIDAGVRLFKEANVENNEGRRSKRGARRLKRRRRHRIQRVKKLLFDYNLLTDHSELSGINPYEARVKGLSQKLSEEEFSAALLHLAKRRGVHNVNEVEEDTGNELSTKEQISRNSKALEEKYVAELQLERLKKDGEVRGSINRFKTSDYVKEAKQLLKVQKAYHQLDQSFIDTYIDLLETRRTYYEGPGEGSPFGWKDIKEWYEMLMGHCTYFPEELRSVKYAYNADLYNALNDLNNLVITRDENEKLEYYEKFQIIENVFKQKKKPTLKQIAKEILVNEEDIKGYRVTSTGKPEFTNLKVYHDIKDITARKEIIENAELLDQIAKILTIYQSSEDIQEELTNLNSELTQEEIEQISNLKGYTGTHNLSLKAINLILDELWHTNDNQIAIFNRLKLVPKKVDLSQQKEIPTTLVDDFILSPVVKRSFIQSIKVINAIIKKYGLPNDIIIELAREKNSKDAQKMINEMQKRNRQTNERIEEIIRTTGKENAKYLIEKIKLHDMQEGKCLYSLEAIPLEDLLNNPFNYEVDHIIPRSVSFDNSFNNKVLVKQEENSKKGNRTPFQYLSSSDSKISYETFKKHILNLAKGKGRISKTKKEYLLEERDINRFSVQKDFINRNLVDTRYATRGLMNLLRSYFRVNNLDVKVKSINGGFTSFLRRKWKFKKERNKGYKHHAEDALIIANADFIFKEWKKLDKAKKVMENQMFEEKQAESMPEIETEQEYKEIFITPHQIKHIKDFKDYKYSHRVDKKPNRELINDTLYSTRKDDKGNTLIVNNLNGLYDKDNDKLKKLINKSPEKLLMYHHDPQTYQKLKLIMEQYGDEKNPLYKYYEETGNYLTKYSKKDNGPVIKKIKYYGNKLNAHLDITDDYPNSRNKVVKLSLKPYRFDVYLDNGVYKFVTVKNLDVIKKENYYEVNSKCYEEAKKLKKISNQAEFIASFYNNDLIKINGELYRVIGVNNDLLNRIEVNMIDITYREYLENMNDKRPPRIIKTIASKTQSIKKYSTDILGNLYEVKSKKHPQIIKKG*(SEQIDNO:26)如果任何上述Cas9序列与肽或多肽在C-末端(例如,eiCas9与转录阻抑物在C-末端处融合)处融合,应理解为终止密码子将被去除。其他Cas分子不同类型的Cas分子可以用来实践在此所披露的发明。在实施例中,使用II型Cas系统的Cas分子。在实施例中,使用其他Cas系统的Cas分子。例如,可以使用I型或III型Cas分子。示例性的Cas分子(和Cas系统)描述于例如,哈夫特(Haft)等人,PLoS计算生物学(PLoSCOMPUTATIONALBIOLOGY)2005,1(6):e60以及马卡洛娃(Makarova)等人,自然综述微生物学(NATUREREVIEWMICROBIOLOGY)2011,9:467-477中,将二者的内容通过引用以其全文结合在此。示例性的Cas分子(和Cas系统)也示于表II-1中。III.候选分子的功能分析可以通过本领域已知或如在此描述的方法来评价候选Cas9分子、候选gRNA分子,候选Cas9分子/gRNA分子复合物。例如,用于评价Cas9分子的内切核酸酶活性的示例性方法描述于,例如,季聂克(Jinek)等人,科学(SCIENCE)2012;337(6096):816-821中。结合和切割测定:测试Cas9分子的内切核酸酶活性可以在质粒切割测定中对Cas9分子/gRNA分子复合物结合至并且切割靶核酸的能力进行评价。在这个测定中,在反应之前通过加热至95℃并且缓慢冷却至室温,将合成或体外转录的gRNA分子预退火。在37℃下,将天然或限制酶切消化-线性化的质粒DNA(300ng(~8nM))用纯化的Cas9蛋白分子(50-500nM)和gRNA(50-500nM,1:1)在具有或不具有10mMMgCl2的Cas9质粒切割缓冲液(20mMHEPESpH7.5,150mMKCl,0.5mMDTT,0.1mMEDTA)中孵育60min。用5XDNA加样缓冲液(30%甘油、1.2%SDS、250mMEDTA)终止反应,通过0.8%或1%琼脂糖凝胶电泳进行解析并且通过溴化乙锭染色进行可视化。所得切割产物指示Cas9分子是否切割两条DNA链、或仅切割两条链中的一条。例如,线状DNA产物指示切割了两条DNA链。带切口的开环产物指示仅切割了两条链中的一条。可替代地,可以在寡核苷酸DNA切割测定中对Cas9分子/gRNA分子复合物结合至并且切割靶核酸的能力进行评价。在这个测定中,在37℃下,在50μL反应中,通过用在1XT4多核苷酸激酶反应缓冲液中的5单位T4多核苷酸激酶以及~3-6pmol(~20-40mCi)[γ-32P]-ATP孵育30min,对DNA寡核苷酸(10pmol)进行放射性标记。在热灭活后(65℃持续20min),通过柱对反应进行纯化以去除未掺入的标签。通过在95℃下用等摩尔量的未标记的互补寡核苷酸退火标记的寡核苷酸持续3min,随后缓慢冷却至室温而生成双链体底物(100nM)。对于切割测定,通过加热至95℃持续30s,随后缓慢冷却至室温对gRNA分子进行退火。在9μl的总体积中,将Cas9(500nM终浓度)与退火的gRNA分子(500nM)在切割测定缓冲液(20mMHEPESpH7.5,100mMKCl,5mMMgCl2,1mMDTT,5%甘油)中进行预孵育。通过添加1μl靶DNA(10nM)开始反应并在37℃下孵育1h。通过添加20μl的加样染料(在甲酰胺中5mMEDTA、0.025%SDS、5%甘油)淬灭反应并且加热至95℃持续5min。将切割产物在含有7M脲的12%变性聚丙烯酰胺凝胶上进行解析并且通过感光成像(phosphorimaging)进行可视化。所得切割产物指示互补链、非互补链、或两者是否被切割。这些测定中的一个或两个可以用于评价候选gRNA分子或候选Cas9分子的适合性。结合测定:测试Cas9分子与靶DNA的结合用于评价Cas9分子与靶DNA的结合的示例性方法描述于,例如,季聂克(Jinek)等人,科学(Science)2012;337(6096):816-821中。例如,在电泳迁移率变动分析中,通过在去离子水中混合每条链(10nmol)、加热至95℃持续3min并且缓慢冷却至室温而形成靶DNA双链体。将所有DNA在含有1XTBE的8%非变性凝胶上进行纯化。将DNA条带通过UV遮蔽进行可视化、切除、并且通过将凝胶片浸泡在DEPC处理的H2O中进行洗脱。将洗脱的DNA进行乙醇沉淀并且溶解在DEPC处理的H2O中。在37℃下,使用T4多核苷酸激酶将DNA样品用[γ-32P]-ATP进行5’端标记持续30min。将多核苷酸激酶在65℃下热变性持续20min,并且使用柱去除未掺入的放射性标记。在10μl的总体积中,在含有20mMHEPESpH7.5、100mMKCl、5mMMgCl2、1mMDTT以及10%甘油的缓冲剂中进行结合测定。用等摩尔量的预退火的gRNA分子对Cas9蛋白分子进行程序化,并且从100pM滴定至1μM。将放射性标记的DNA添加至20pM的终浓度。将样品在37℃下孵育1h并且在4℃下在含有1XTBE和5mMMgCl2的8%非变形聚丙烯酰胺凝胶上进行解析。将凝胶干燥并且通过感光成像进行DNA可视化。IV.模板核酸(基因组编辑途径)术语“模板核酸”和“交换核酸”可互换地使用,并且在本文件及其优先权文件中具有相同的含义。可以使用在此讨论的这些方法中一种来校正在此描述的基因或通路中的突变(例如,在第VIIB部分中(例如,在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3、或XII-1中)、或在第VIII部分中)。在实施例中,使用模板核酸通过同源定向修复(HDR)来校正在此描述的基因或通路中的突变(例如,在第VIIB部分中(例如,在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3、或XII-1中)、或在第VIII部分中)(参见第IV.1部分)。在实施例中,使用模板核酸通过非同源末端连接(NHEJ)修复来校正在此描述的基因或通路中的突变(例如,在第VIIB部分中(例如,在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3、或XII-1中)、或在第VIII部分中)(参见第IV.2部分)。IV.1HDR修复以及模板核酸如在此描述的,核酸酶诱导的同源定向修复(HDR)可以用于改变靶序列和校正(例如,修复或编辑)基因组中的突变。虽然不希望受理论束缚,但认为靶序列的改变通过用供体模板或模板核酸进行同源定向修复(HDR)而发生。例如,供体模板或模板核酸提供了靶序列的改变。在此考虑了可以将质粒供体用作用于同源重组的模版。在此进一步考虑了可以将单链供体模板用作通过在靶序列和供体模板之间同源定向修复(例如,单链退火)的替代方法用于改变靶序列的模板。通过供体模板实现的靶序列改变取决于Cas9分子的切割。经由Cas9切割可以包括双链断裂或2个单链断裂。在实施例中,突变可以通过单个双链断裂或两个单链断裂进行校正。在实施例中,突变可以通过以下方式进行校正:(1)单个双链断裂、(2)两个单链断裂、(3)两个双链断裂,其中靶序列的每一侧上各发生一个断裂、(4)一个双链断裂和两个单链断裂,其中靶序列的每一侧上各发生该双链断裂和两个单链断裂或(5)四个单链断裂,其中靶序列的每一侧上各发生一对单链断裂。双链断裂介导的校正在实施例中,双链切割是由具有与HNH样结构域相关的切割活性以及与RuvC样结构域(例如,N端RuvC样结构域)相关的切割活性的Cas9分子(例如,野生型Cas9)实现的。这样一个实施例仅需要单一gRNA。单链断裂介导的校正在实施例中,两个单链断裂或切口是由具有切口酶活性(例如,与HNH样结构域相关的切割活性或与N端RuvC样结构域相关的切割活性)的Cas9分子实现的。这样一个实施例需要两个gRNA,各用于布置每个单链断裂。在实施例中,具有切口酶活性的Cas9分子切割gRNA所杂交的链,但不是互补于与gRNA杂交的链的链。在实施例中,具有切口酶活性的Cas9分子不切割gRNA所杂交的链,而是切割互补于与gRNA杂交的链的链。在实施例中,该切口酶具有HNH活性,例如,具有RuvC活性失活的Cas9分子(例如,在D10处具有突变(例如,D10A突变)的Cas9分子)。D10A使RuvC失活;因此,Cas9切口酶(仅)具有HNH活性并且将切割gRNA所杂交的链(例如,互补链,其上并不具有NGGPAM)。在实施例中,具有H840(例如,H840A)突变的Cas9分子可以用作切口酶。H840A使HNH失活;因此,Cas9切口酶(仅)具有RuvC活性并且切割非互补链(例如,具有NGGPAM并且其序列与gRNA相同的链)。在实施例中,其中将一种切口酶和两种gRNA用于定位两个单链切口,一个切口在靶核酸的+链上而一个切口在-链上。这些PAM面向外部。可以选择gRNA,这样使得gRNA隔开约0-50、0-100、或0-200个核苷酸。在实施例中,互补于两个gRNA的靶向结构域的靶序列之间没有重叠。在实施例中,这些gRNA不重叠并且相隔多至50、100、或200个核苷酸。在实施例中,使用两个gRNA可以增加特异性,例如,通过降低脱靶结合(兰(Ran)等人,细胞(CELL)2013)。在实施例中,单一切口可以用于诱导HDR。在此考虑了可以将单一切口用于增加HR与NHEJ在给定切割位点的比率。双链断裂或单链断裂相对于靶位置的布置在这些链中一条中的双链断裂或单链断裂应当足够接近于靶位置使得校正得以发生。在实施例中,距离不多于50、100、200、300、350或400个核苷酸。虽然希望不受理论束缚,但认为断裂应当足够接近于靶位置,以使得断裂在末端切除过程中在经受外切核酸酶介导的去除的区域内。如果靶位置与断裂之间的距离太大,则突变可能不会被包括在末端切除中,并且因此可能无法进行校正,作为供体序列可能仅被用于校正末端切除区域之内的序列。在实施例中,为了诱导HDR介导的校正的目的,其中gRNA(单分子(或嵌合)或模块化gRNA)和Cas9核酸酶诱导双链断裂,切割位点在远离靶位置0-200bp(例如,0至175、0至150、0至125、0至100、0至75、0至50、0至25、25至200、25至175、25至150、25至125、25至100、25至75、25至50、50至200、50至175、50至150、50至125、50至100、50至75、75至200、75至175、75至150、75至125、75至100bp)之间处。在实施例中,切割位点在远离靶位置0-100bp(例如,0至75、0至50、0至25、25至100、25至75、25至50、50至100、50至75或75至100bp)之间处。在实施例中,为了诱导HDR介导的校正的目的,其中与Cas9切口酶复合的两个gRNA(独立地为单分子(或嵌合)或模块化gRNA)诱导两个单链断裂,较近的切口在远离靶位置0-200bp(例如,0至175、0至150、0至125、0至100、0至75、0至50、0至25、25至200、25至175、25至150、25至125、25至100、25至75、25至50、50至200、50至175、50至150、50至125、50至100、50至75、75至200、75至175、75至150、75至125、75至100bp)之间处,并且理想地这两个切口彼此将在25-55bp之内(例如,25至50、25至45、25至40、25至35、25至30、30至55、30至50、30至45、30至40、30至35、35至55、35至50、35至45、35至40、40至55、40至50、40至45bp)并且彼此远离不超过100bp(例如,彼此远离不超过90、80、70、60、50、40、30、20、10或5bp)。在实施例中,切割位点在远离靶位置0-100bp(例如,0至75、0至50、0至25、25至100、25至75、25至50、50至100、50至75或75至100bp)之间处。在一个实施例中,两个gRNA(例如,独立地为单分子(或嵌合)或模块化gRNA)被配置成将双链断裂定位在靶位置的两侧。在替代实施例中,三个gRNA(例如,独立地为单分子(或嵌合)或模块化gRNA)被配置成将双链断裂(即,一个gRNA与cas9核酸酶复合)和两个单链断裂或成对单链断裂(即,两个gRNA与Cas9切口酶复合)定位在靶位置的任一侧(例如,将第一gRNA用于靶向靶位置的上游(即,5’)并且将第二gRNA用于靶向靶位置的下游(即,3’))。在另一个实施例中,四个gRNA(例如,独立地为单分子(或嵌合)或模块化gRNA)被配置成在靶位置的任一侧(例如,将第一gRNA用于靶向靶位置的上游(即,5’)并且将第二gRNA用于靶向靶位置的下游(即,3’))生成两对单链断裂(即,两对两个gRNA与Cas9切口酶复合)。理想地,双链断裂或成对的两个单链切口中更近者将在靶位置的0-500bp(例如,离靶位置不超过450、400、350、300、250、200、150、100、50或25bp)之内。当使用切口酶时,成对的两个切口彼此在25-55bp(例如,在25至50、25至45、25至40、25至35、25至30、50至55、45至55、40至55、35至55、30至55、30至50、35至50、40至50、45至50、35至45、或40至45bp之间)之内并且彼此远离不超过100bp(例如、不超过90、80、70、60、50、40、30、20或10bp)。在一个实施例中,两个gRNA(例如,独立地为单分子(或嵌合)或模块化gRNA)被配置成将双链断裂定位在靶位置的两侧。在替代实施例中,三个gRNA(例如,独立地为单分子(或嵌合)或模块化gRNA)被配置成将双链断裂(即,一个gRNA与cas9核酸酶复合)和两个单链断裂或成对单链断裂(即,两个gRNA与Cas9切口酶复合)定位在靶位置的任一侧(例如,将第一gRNA用于靶向在此描述的基因或通路中的突变(例如,在第VIIB部分中(例如,在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3、或XII-1中)、或在第VIII部分中)的上游(即,5’)并且将第二gRNA用于靶向在此描述的基因或通路中的突变(例如,在第VIIB部分中(例如,在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3、或XII-1中)、或在第VIII部分中)的下游(即,3’))。在另一个实施例中,四个gRNA(例如,独立地为单分子(或嵌合)或模块化gRNA)被配置成在靶位置的任一侧(例如,将第一gRNA用于靶向在此描述的基因或通路中的突变的上游(即,5’)并且将第二gRNA用于靶向在此描述的基因或通路中的突变的下游(即,3’))生成两对单链断裂(即,两对两个gRNA与Cas9切口酶复合)。理想地,双链断裂或成对的两个单链切口中更近者将在靶位置的0-500bp(例如,离靶位置不超过450、400、350、300、250、200、150、100、50或25bp)之内。当使用切口酶时,成对的两个切口彼此在25-55bp(例如,在25至50、25至45、25至40、25至35、25至30、50至55、45至55、40至55、35至55、30至55、30至50、35至50、40至50、45至50、35至45、或40至45bp之间)之内并且彼此远离不超过100bp(例如、不超过90、80、70、60、50、40、30、20或10bp)。同源臂的长度同源臂应该至少延伸远至可发生末端切除的区域,例如,以便允许所切除的单链突出端在供体模板内找到互补区域。总长度可由如质粒大小或病毒包装限制之类的参数进行限制。在实施例中,同源臂不延伸到重复元件(例如,ALU重复、LINE重复)中。示例性同源臂长度包括至少50、100、250、500、750或1000个核苷酸。如在此使用的,靶位置是指由Cas9分子依赖性方法修饰的靶核酸(例如,染色体)上的位点。例如,靶位置可以是修饰的Cas9分子切割靶位置的靶核酸和模板核酸定向修饰(例如,校正)。在实施例中,靶位置可以是在其中添加进一个或多个核苷酸的靶核酸上两个核苷酸(例如,相邻的核苷酸)之间的位点。靶位置可以包括一个或多个通过模板核酸改变的(例如,校正的)核苷酸。在实施例中,靶位置在靶序列(例如,gRNA结合至的序列)之内。在实施例中,靶位置是靶序列(例如,gRNA结合至的序列)的上游或下游。模板核酸,如该术语在此使用的,是指可以与Cas9分子和gRNA分子结合用于改变靶位置的结构的核酸序列。术语“模板核酸”与用于优先权文件和此处的术语“交换核酸”同义。术语“模板核酸”和“交换核酸”具有完全相同的含义并且可以互换地使用。在实施例中,对靶核酸进行修饰以具有模板核酸的一些或全部序列,典型地在切割位点处或附近。在实施例中,模板核酸是单链的。在一个替代实施例中,模板核酸是双链的。在实施例中,模板核酸是DNA(例如,双链DNA)。在替代实施例中,模板核酸是单链DNA。在实施例中,模板核酸通过参与同源定向修复事件来改变靶位置的结构。在实施例中,模板核酸改变靶位置的序列。在实施例中,模板核酸导致修饰的或非天然发生的核苷酸掺入靶核酸中。典型地,模板序列经历断裂介导或催化的与靶序列的重组。在实施例中,模板核酸包括与通过eaCas9介导的切割事件切割的靶序列上的位点相对应的序列。在实施例中,模板核酸包括与以下二者相对应的序列:在第一Cas9介导的事件中被切割的靶序列上的第一位点、以及在第二Cas9介导的事件中被切割的靶序列上的第二位点。在实施例中,模板核酸可以包括导致所翻译序列的编码序列改变的序列(例如,导致蛋白产物中一种氨基酸取代另一种的序列(例如,将突变体等位基因转化成野生型等位基因、将野生型等位基因转化成突变体等位基因、和/或引入终止密码子、氨基酸残基的插入、氨基酸残基的缺失、或无意义突变))。在实施例中,模板核酸可以包括导致非编码序列改变的序列(例如,外显子或5’或3’非翻译区或非转录区中的改变)。此类改变包括控制元件(例如,启动子、增强子)中的改变、以及顺式作用或反式作用控制元件中的改变。可以将与在此描述的基因或通路中的靶位置(例如,在第VIIB部分中(例如,在表表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3、或XII-1)、或在第VIII部分中)具有同源性的模板核酸用以改变靶序列的结构。可以将模板序列用于改变不想要的结构(例如,不想要的或突变型核苷酸)。模板核酸可以包括当进行整合时导致以下效果的序列:降低正控制元件的活性;增加正控制元件的活性;降低负控制元件的活性;增加负控制元件的活性;降低基因的表达;增加基因的表达;增加对病症或疾病的抗性;增加对病毒进入的抗性;校正突变或改变不想要的氨基酸残基赋予、增加、消除或减少基因产物的生物学特性(例如,增加酶的酶活性、或增加基因产物与另一种分子相互作用的能力)。模板核酸可以包括导致以下效果的序列:靶序列的1、2、3、4、5、6、7、8、9、10、11、12或更多个核苷酸的序列的改变。在实施例中,模板核酸在长度上是20+/-10、30+/-10、40+/-10、50+/-10、60+/-10、70+/-10、80+/-10、90+/-10、100+/-10、110+/-10、120+/-10、130+/-10、140+/-10、150+/-10、160+/-10、170+/-10、180+/-10、190+/-10、200+/-10、210+/-10、或220+/-10个核苷酸。在实施例中,模板核酸在长度上是30+/-20、40+/-20、50+/-20、60+/-20、70+/-20、80+/-20、90+/-20、100+/-20、110+/-20、120+/-20、130+/-20、140+/-20、150+/-20、160+/-20、170+/-20、180+/-20、190+/-20、200+/-20、210+/-20、或220+/-20个核苷酸。在实施例中,模板核酸在长度上是10至1,000、20至900、30至800、40至700、50至600、50至500、50至400、50至300、50至200,或50至100个核苷酸。模板核酸包括以下组分:[5’同源臂]-[替换序列]-[3’同源臂]。同源臂提供用于重组到染色体中,因此用替换序列替换了不希望的元件(例如,突变或标签)。在实施例中,同源臂侧翼于最远端切割位点。在实施例中,5’同源臂的3’端是紧邻替换序列的5’端的位置。在实施例中,5’同源臂可以从替换序列的5’端5’延伸至少10、20、30、40、50、100、200、300、400、500、600、700、800、900、1000、1500、或2000个核苷酸。在实施例中,3’同源臂的5’端是紧邻替换序列的3’端的位置。在实施例中,3’同源臂可以从替换序列的3’端3’延伸至少10、20、30、40、50、100、200、300、400、500、600、700、800、900、1000、1500、或2000个核苷酸。在此考虑了可以将一个或两个同源臂缩短以避免包括某些序列重复元件(例如,Alu重复、LINE元件)。例如,可以将5’同源臂缩短以避免序列重复元件。在实施例中,可以将3’同源臂缩短以避免序列重复元件。在实施例中,可以将5’和3’同源臂均缩短以避免包括某些序列重复元件。在此考虑了可以将用于校正突变的模板核酸设计成用作单链寡核苷酸(ssODN)。当使用ssODN时,5’和3’同源臂在长度上范围可以高达约200个碱基对(bp)(例如,在长度上至少25、50、75、100、125、150、175、或200bp)。针对ssODN还考虑了更长的同源臂作为继续有待完成的寡核苷酸合成中的改进。在实施例中,可以将ssODN用于校正在此描述的基因或通路中的突变(例如,在第VIIB部分中(例如,在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3、或XII-1中)、或在第VIII部分中)。IV.2用于基因靶向的NHEJ方法如在此描述的,核酸酶诱导的非同源末端连接(NHEJ)可以用于靶向基因特异性敲除。核酸酶诱导的NHEJ还可以用于去除(例如,删除)感兴趣的基因中的序列。虽然希望不受理论束缚,但认为在实施例中,与在此描述的这些方法相关的基因组改变依赖于核酸酶诱导的NHEJ以及NHEJ修复通路的易错性质。NHEJ通过将两端连接在一起修复DNA中的双链断裂;然而,通常地,只有两个配伍未端(完全如它们通过双链断裂所形成)完全连接,才恢复原始序列。双链断裂的DNA末端经常经受酶处理,由此导致在末端再结合之前,在一条或两条链上添加或去除核苷酸。这导致在DNA序列的NHEJ修复的位点处存在插入和/或缺失(indel)突变。这些突变的三分之二典型地改变阅读框,并且因此,产生非功能性蛋白。另外,维护阅读框、但插入或删除大量序列的突变可破坏蛋白的功能性。这是基因座依赖性的,因为关键功能结构域中的突变可能比蛋白的非关键区域中的突变更不可容许。实质上,由NHEJ产生的indel突变是不可预测的;然而,在给定的断裂位点处某些indel序列是有利的并且在群体中过度表达,这可能归因于微同源性的小区域。缺失的长度可以广泛变化;最常见地在1-50bp范围内,但是它们可以容易达到大于100-200bp。插入倾向于较短并且通常包括直接围绕断裂位点的序列的短复制。然而,有可能获得大插入,并且在这些情况中,插入序列通常已经被追溯至基因组的其他区域或至存在于细胞中的质粒DNA。因为NHEJ是诱变的过程,它还可以用于删除小序列基序,只要不需要产生特异性最终序列。如果将双链断裂靶向短靶序列附近,由NHEJ修复引起的缺失突变通常跨越,并且因此移除不想要的核苷酸。对于较大DNA片段的缺失,引入两个双链断裂(序列的每一侧上各一个)可以在末端之间导致NHEJ并去除整个插入序列。这两种方法都可以用于删除特异性DNA序列;然而,NHEJ的易错性质仍可以在修复位点处产生indel突变。双链切割性eaCas9分子和单链、或切口酶,eaCas9分子均可以用于在此所描述的方法和组合物以产生NHEJ介导的indel。靶向基因的NHEJ介导的indel(例如,编码区(例如,感兴趣的基因的早期编码区))可以用于敲除感兴趣的基因(即,消除其表达)。例如,感兴趣的基因的早期编码区包括紧跟着转录起始位点、在编码序列的第一外显子之内、或在转录起始位点的500bp之内(例如,小于500、450、400、350、300、250、200、150、100或50bp)的序列。双链或单链断裂相对于靶位置的布置在实施例中,为了诱导NHEJ介导的indel的目的,其中gRNA和Cas9核酸酶生成双链断裂,gRNA(例如,单分子(或嵌合)或模块化gRNA分子)被配置成将一个双链断裂定位在极接近于靶位置的核苷酸之处。在实施例中,切割位点在远离靶位置0-500bp(例如,离靶位置小于500、400、300、200、100、50、40、30、25、20、15、10、9、8、7、6、5、4、3、2或1bp)之间处。在实施例中,为了诱导NHEJ介导的indel的目的,其中与Cas9切口酶复合的两个gRNA诱导两个单链断裂,两个gRNA(例如,独立地为单分子(或嵌合)或模块化gRNA)被配置成将两个单链断裂定位以提供NHEJ修复靶位置的核苷酸。在实施例中,这些gRNA被配置成将切口定位在相同位置、或彼此相距在几个核苷酸之内、在不同链上,实质上模拟了双链断裂。在实施例中,较近的切口在远离靶位置0-30bp(例如,离靶位置小于30、25、20、15、10、9、8、7、6、5、4、3、2或1bp)之间处,并且这两个切口彼此在25-55bp之内(例如,在25至50、25至45、25至40、25至35、25至30、50至55、45至55、40至55、35至55、30至55、30至50、35至50、40至50、45至50、35至45、或40至45bp之间)并且彼此远离不超过100bp(例如,不超过90、80、70、60、50、40、30、20、或10bp)。在实施例中,这些gRNA被配置成将单链断裂布置在靶位置的核苷酸的任一侧上。双链切割性eaCas9分子和单链、或切口酶,eaCas9分子均可以用于在此所描述的方法和组合物中以在靶位置的两侧均产生断裂。可以在(例如,在此描述的基因或通路的(例如,在第VIIB部分中(例如,在表VII-13、VII-14、VII-15、VII-16、VII-17、VII-18、VII-19、VII-20、VII-21、VII-22、VII-23、VII-24、IX-1、IX-1A、IX-3、或XII-1)、或在第VIII部分中))靶位置的两侧产生双链或成对单链断裂,以去除两个切口之间的核酸序列(例如,两个断裂之间的区域被删除)。在一个实施例中,两个gRNA(例如,独立地为单分子(或嵌合)或模块化gRNA)被配置成将双链断裂定位在靶位置的两侧(例如,将第一gRNA用于靶向在此描述的基因或通路中的突变的上游(即,5’)并且将第二gRNA用于靶向在此描述的基因或通路中的突变的下游(即,3’))。在替代实施例中,三个gRNA(例如,独立地为单分子(或嵌合)或模块化gRNA)被配置成将双链断裂(即,一个gRNA与cas9核酸酶复合)和两个单链断裂或成对单链断裂(即,两个gRNA与Cas9切口酶复合)定位在靶位置的任一侧(例如,将第一gRNA用于靶向在此描述的基因或通路中的突变的上游(即,5’)并且将第二gRNA用于靶向在此描述的基因或通路中的突变的下游(即,3’))。在另一个实施例中,四个gRNA(例如,独立地为单分子(或嵌合)或模块化gRNA)被配置成在靶位置的任一侧(例如,将第一gRNA用于靶向在此描述的基因或通路中的突变的上游(即,5’)并且将第二gRNA用于靶向在此描述的基因或通路中的突变的下游(即,3’))生成两对单链断裂(即,两对两个gRNA与Cas9切口酶复合)。理想地,双链断裂或成对的两个单链切口中更近的将在靶位置的0-500bp(例如,离靶位置不超过450、400、350、300、250、200、150、100、50或25bp)之内。当使用切口酶时,成对的两个切口彼此在25-55bp(例如,在25至50、25至45、25至40、25至35、25至30、50至55、45至55、40至55、35至55、30至55、30至50、35至50、40至50、45至50、35至45、或40至45bp之间)之内并且彼此远离不超过100bp(例如、不超过90、80、70、60、50、40、30、20或10bp)。IV.3靶向的敲低与CRISPR/Cas介导的基因敲除不同(其通过在DNA水平使基因突变而永久消除表达),CRISPR/Cas敲低通过使用人工转录因子允许基因表达暂时减少。使Cas9蛋白的两个DNA切割结构域中的关键残基突变(例如,D10A以及H840A突变)导致生成无催化活性Cas9(eiCas9其又称为失活的Cas9或dCas9)。无催化活性Cas9与gRNA复合并且定位至由gRNA的靶向结构域指定的DNA序列,然而,它不切割靶DNA。将dCas9融合至效应子结构域(例如,转录抑制结构域)能够将效应子募集至任何由gRNA指定的DNA位点。尽管已经显示,当被募集到编码序列中的早期区时eiCas9本身可以阻断转录,可以通过将转录抑制结构域(例如,KRAB、SID或ERD)融合至Cas9并且将其募集至基因的启动区来实现更稳健的抑制。很可能靶向启动子的DNA酶I超敏区域可产生更有效的基因抑制或激活,因为这些区域更有可能接触到Cas9蛋白并且也更有可能携带内源转录因子的位点。尤其针对基因抑制,在此考虑了阻断内源转录因子的结合位点将有助于下调基因表达。在另一个实施例中,eiCas9可以融合至染色质修饰蛋白上。改变染色质状态可以导致靶基因的表达降低。在实施例中,可以将gRNA分子靶向已知的转录应答元件(例如,启动子、增强子等)、已知的上游激活序列(UAS)、和/或具有怀疑能够控制靶DNA表达的未知或已知功能的序列。CRISPR/Cas介导的基因敲低可以用于减少不想要的等位基因或转录物的表达。在此考虑的是其中永久破坏基因是不理想的情形。在这些情形中,位点特异性抑制可以用于暂时降低或消除表达。在此还考虑了Cas阻遏物的脱靶效应可能比Cas核酸酶的脱靶效应更不严重,因为核酸酶可以切割任何DNA序列并且造成突变,而Cas阻抑物仅在其靶向转录活跃基因的启动区时才可具有效应。然而,尽管核酸酶介导的敲除是永久的,只有Cas阻抑物存在于细胞中时,抑制才可以持续。一旦阻抑物不再存在,很可能内源转录因子和基因调节元件将使表达恢复至它的天然状态。IV.4基因组编辑方法中gRNA的实例如在此描述的gRNA分子可以与产生双链断裂或单链断裂的Cas9分子一起使用,以改变靶核酸的序列,例如,靶位置或靶基因标签。下面描述了有用于这些方法中的gRNA分子。在实施例中,该gRNA(例如,嵌合gRNA)被配置成使得它包括以下特性中的一种或多种:a)例如,当靶向产生双链断裂的Cas9分子时,它可以将双链断裂定位(i)在靶位置的50、100、150或200个核苷酸内、或(ii)足够接近使得该靶位置处于是末端切除的区域内;b)它具有至少15、16、17、18、19或20个核苷酸的靶向结构域,例如(i)17、(ii)18、或(iii)20个核苷酸的靶向结构域;以及c)(i)当一起考虑时,该近端和尾部结构域包括来自以下项的至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸,例如至少15、18、20、25、30、31、35、40、45、49、50,或53个核苷酸:天然发生的化脓链球菌、嗜热链球菌、金黄色葡萄球菌、或脑膜炎奈瑟氏菌尾部和近端结构域、或与之相差不多于1、2、3、4、5、6、7、8、9或10个核苷酸的序列;(ii)该第二互补结构域的最后一个核苷酸的3’存在来自以下项的至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸,例如至少15、18、20、25、30、31、35、40、45、49、50,或53个核苷酸:天然发生的化脓链球菌、嗜热链球菌、金黄色葡萄球菌、或脑膜炎奈瑟氏菌gRNA的相应序列、或与之相差不多于1、2、3、4、5、6、7、8、9或10个核苷酸的序列;(iii)该第二互补结构域的最后一个核苷酸的3’存在来自以下项的至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸(第二互补结构域的最后一个核苷酸与第一互补结构域的相应核苷酸互补)例如至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸:天然发生的化脓链球菌、嗜热链球菌、金黄色葡萄球菌、或脑膜炎奈瑟氏菌gRNA的相应序列、或与之相差不多于1、2、3、4、5、6、7、8、9或10个核苷酸的序列;iv)该尾部结构域在长度上是至少10、15、20、25、30、35或40个核苷酸,例如,它包括来自以下项的至少10、15、20、25、30、35或40个核苷酸:天然发生的化脓链球菌、嗜热链球菌、金黄色葡萄球菌、或脑膜炎奈瑟氏菌尾部结构域;或与之相差不多于1、2、3、4、5、6、7、8、9或10个核苷酸的序列;或(v)该尾部结构域包括天然发生的尾部结构域(例如,天然发生的化脓链球菌、嗜热链球菌、金黄色葡萄球菌、或脑膜炎奈瑟氏菌尾部结构域)的相应部分的15、20、25、30、35、40个或所有核苷酸。在实施例中,该gRNA被配置成使得它包括特性:a和b(i)。在实施例中,该gRNA被配置成使得它包括特性:a和b(ii)。在实施例中,该gRNA被配置成使得它包括特性:a和b(iii)。在实施例中,该gRNA被配置成使得它包括特性:a和c。在实施例中,该gRNA被配置成使得它包括特性:a、b、和c。在实施例中,该gRNA被配置成使得它包括特性:a(i)、b(i)、以及c(i)。在实施例中,该gRNA被配置成使得它包括特性:a(i)、b(i)、以及c(ii)。在实施例中,该gRNA被配置成使得它包括特性:a(i)、b(iii)、以及c(i)。在实施例中,该gRNA被配置成使得它包括特性:a(i)、b(iii)、以及c(ii)。在实施例中,该gRNA(例如,嵌合gRNA)被配置成使得它包括以下特性中的一种或多种:a)例如,当靶向产生单链断裂的Cas9分子时,它可以将单链断裂定位(i)在靶位置的50、100、150或200个核苷酸内、或(ii)足够接近使得该靶位置处于是末端切除的区域内;b)它具有至少15、16、17、18、19或20个核苷酸的靶向结构域,例如(i)17、(ii)18、或(iii)20个核苷酸的靶向结构域;以及c)(i)当一起考虑时,该近端和尾部结构域包括来自以下项的至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸,例如至少15、18、20、25、30、31、35、40、45、49、50,或53个核苷酸:天然发生的化脓链球菌、嗜热链球菌、金黄色葡萄球菌、或脑膜炎奈瑟氏菌尾部和近端结构域、或与之相差不多于1、2、3、4、5、6、7、8、9或10个核苷酸的序列;(ii)该第二互补结构域的最后一个核苷酸的3’存在来自以下项的至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸,例如至少15、18、20、25、30、31、35、40、45、49、50,或53个核苷酸:天然发生的化脓链球菌、嗜热链球菌、金黄色葡萄球菌、或脑膜炎奈瑟氏菌gRNA的相应序列、或与之相差不多于1、2、3、4、5、6、7、8、9或10个核苷酸的序列;(iii)该第二互补结构域的最后一个核苷酸的3’存在来自以下项的至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸(第二互补结构域的最后一个核苷酸与第一互补结构域的相应核苷酸互补)例如至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸:天然发生的化脓链球菌、嗜热链球菌、金黄色葡萄球菌、或脑膜炎奈瑟氏菌gRNA的相应序列、或与之相差不多于1、2、3、4、5、6、7、8、9或10个核苷酸的序列;iv)该尾部结构域在长度上是至少10、15、20、25、30、35或40个核苷酸,例如,它包括来自以下项的至少10、15、20、25、30、35或40个核苷酸:天然发生的化脓链球菌、嗜热链球菌、金黄色葡萄球菌、或脑膜炎奈瑟氏菌尾部结构域;或与之相差不多于1、2、3、4、5、6、7、8、9或10个核苷酸的序列;或(v)该尾部结构域包括天然发生的尾部结构域(例如,天然发生的化脓链球菌、嗜热链球菌、金黄色葡萄球菌、或脑膜炎奈瑟氏菌尾部结构域)的相应部分的15、20、25、30、35、40个或所有核苷酸。在实施例中,该gRNA被配置成使得它包括特性:a和b(i)。在实施例中,该gRNA被配置成使得它包括特性:a和b(ii)。在实施例中,该gRNA被配置成使得它包括特性:a和b(iii)。在实施例中,该gRNA被配置成使得它包括特性:a和c。在实施例中,该gRNA被配置成使得它包括特性:a、b、和c。在实施例中,该gRNA被配置成使得它包括特性:a(i)、b(i)、以及c(i)。在实施例中,该gRNA被配置成使得它包括特性:a(i)、b(i)、以及c(ii)。在实施例中,该gRNA被配置成使得它包括特性:a(i)、b(iii)、以及c(i)。在实施例中,该gRNA被配置成使得它包括特性:a(i)、b(iii)、以及c(ii)。在实施例中,该gRNA与具有HNH活性的Cas9切口酶分子一起使用,例如,具有失活RuvC活性的Cas9分子(例如,在D10处具有突变(例如,D10A突变)的Cas9分子)。在实施例中,该gRNA与具有RuvC活性的Cas9切口酶分子一起使用,例如,具有失活HNH活性的Cas9分子(例如,在H840处具有突变(例如,H840A)的Cas9分子)。在实施例中,一对gRNA(例如,一对嵌合gRNA),其包括第一和第二gRNA,被配置成使得它们包括以下特性中的一种或多种:a)例如,当靶向产生单链断裂的Cas9分子时,gRNA中的一者或两者可以将单链断裂定位(i)在靶位置的50、100、150或200个核苷酸内、或(ii)足够接近使得该靶位置处于末端切除的区域内;b)一者或两者具有至少17个核苷酸的靶向结构域,例如(i)17或(ii)18个核苷酸的靶向结构域;c)一者或两者:(i)当一起考虑时,该近端和尾部结构域包括来自以下项的至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸,例如至少15、18、20、25、30、31、35、40、45、49、50,或53个核苷酸:天然发生的化脓链球菌、嗜热链球菌、金黄色葡萄球菌、或脑膜炎奈瑟氏菌尾部和近端结构域、或与之相差不多于1、2、3、4、5、6、7、8、9或10个核苷酸的序列;(ii)该第二互补结构域的最后一个核苷酸的3’存在来自以下项的至少15、18、20、25、30、31、35、40、45、49、50、或53个核苷酸,例如至少15、18、20、25、30、31、35、40、45、49、50,或53个核苷酸:天然发生的化脓链球菌、嗜热链球菌、金黄色葡萄球菌、或脑膜炎奈瑟氏菌gRNA的相应序列、或与之相差不多于1、2、3、4、5、6、7、8、9或10个核苷酸的序列;(iii)该第二互补结构域的最后一个核苷酸的3’存在来自以下项的至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸(第二互补结构域的最后一个核苷酸与该第一互补结构域的相应核苷酸互补)例如至少16、19、21、26、31、32、36、41、46、50、51、或54个核苷酸:天然发生的化脓链球菌、嗜热链球菌、金黄色葡萄球菌、或脑膜炎奈瑟氏菌gRNA的相应序列、或与之相差不多于1、2、3、4、5、6、7、8、9或10个核苷酸的序列;iv)该尾部结构域在长度上是至少10、15、20、25、30、35或40个核苷酸,例如,它包括来自以下项的至少10、15、20、25、30、35或40个核苷酸:天然发生的化脓链球菌、嗜热链球菌、金黄色葡萄球菌、或脑膜炎奈瑟氏菌尾部结构域;或与之相差不多于1、2、3、4、5、6、7、8、9或10个核苷酸的序列;或(v)该尾部结构域包括天然发生的尾部结构域(例如,天然发生的化脓链球菌、嗜热链球菌、金黄色葡萄球菌、或脑膜炎奈瑟氏菌尾部结构域)的相应部分的15、20、25、30、35、40个或所有核苷酸。d)这些gRNA被配置成使得,当杂交到靶核酸上时,它们被0-50、0-100、0-200、至少10、至少20、至少30或至少50个核苷酸分开;e)由该第一gRNA和第二gRNA产生的断裂在不同的链上;以及f)这些PAM面向外部。在实施例中,这些gRNA中的一者或两者被配置成使得它包括特性:a和b(i)。在实施例中,这些gRNA中的一者或两者被配置成使得它包括特性:a和b(ii)。在实施例中,这些gRNA中的一者或两者被配置成使得它包括特性:a和b(iii)。在实施例中,这些gRNA中的一者或两者被配置成使得它包括特性:a和c。在实施例中,这些gRNA中的一者或两者被配置成使得它包括特性:a、b和c。在实施例中,这些gRNA中的一者或两者被配置成使得它包括特性:a(i)、b(i)、以及c(i)。在实施例中,这些gRNA中的一者或两者被配置成使得它包括特性:a(i)、b(i)、以及c(ii)。在实施例中,这些gRNA中的一者或两者被配置成使得它包括特性:a(i)、b(i)、c、以及d。在实施例中,这些gRNA中的一者或两者被配置成使得它包括特性:a(i)、b(i)、c、以及e。在实施例中,这些gRNA中的一者或两者被配置成使得它包括特性:a(i)、b(i)、c、d、以及e。在实施例中,这些gRNA中的一者或两者被配置成使得它包括特性:a(i)、b(iii)、以及c(i)。在实施例中,这些gRNA中的一者或两者被配置成使得它包括特性:a(i)、b(iii)、以及c(ii)。在实施例中,这些gRNA中的一者或两者被配置成使得它包括特性:a(i)、b(iii)、c、以及d。在实施例中,这些gRNA中的一者或两者被配置成使得它包括特性:a(i)、b(iii)、c、以及e。在实施例中,这些gRNA中的一者或两者被配置成使得它包括特性:a(i)、b(iii)、c、d、以及e。在实施例中,这些gRNA与具有HNH活性的Cas9切口酶分子一起使用,例如,具有失活RuvC活性的Cas9分子(例如,在D10处具有突变(例如,D10A突变)的Cas9分子)。在实施例中,这些gRNA与具有RuvC活性的Cas9切口酶分子一起使用,例如,具有失活HNH活性的Cas9分子(例如,在H840处具有突变(例如,H840A)的Cas9分子)。V.构建体/组分可以多种形式递送、配制、或施用这些组分(例如,Cas9分子或gRNA分子或两者),参见例如表V-1a以及表V-1b。当递送一种组分被编码在DNA中时,该DNA将典型地包括控制区(例如,包括启动子)以实现表达。对于Cas9分子序列有用的启动子包括CMV、EF-1a、MSCV、PGK、CAG控制启动子。对于gRNA有用的启动子包括H1、EF-1a和U6启动子。可以选择具有类似或不同强度的启动子来调节组分的表达。编码Cas9分子的序列可以包括核定位信号(NLS),例如,SV40NLS。在实施例中,用于Cas9分子或gRNA分子的启动子可以独立地是诱导型、组织特异性、或细胞特异性的。表V-1a和表V-1b提供了可以如何配制、递送、或施用这些组分的实例。表V-1a表V-1b在实施例中,例如利用在此描述的方法对Cas系统的这些组分进行体内递送。在另一个实施例中,例如利用在此描述的方法对Cas系统的这些组分进行体外递送。表V-2概括了Cas系统的这些组分的不同递送方法(例如,在此描述的该Cas9分子组分和该gRNA分子组分(例如,在表V-2中))。表V-2基于DNA的Cas9分子和或gRNA分子的递送可以通过本领域已知或如在此描述的方法将编码Cas9分子的DNA(例如,eaCas9分子或eiCas9分子)、gRNA分子、和/或模板核酸施用受试者或递送到细胞中。例如,编码Cas9和/或编码gRNA的DNA可以通过,例如,通过载体(例如,病毒或非病毒载体)、非基于载体的方法(例如,使用裸DNA或DNA复合物)、或其组合进行递送。在实施例中,DNA包括编码统治型gRNA分子的核酸。统治型gRNA分子可以与Cas9分子复合,以使系统的组分失活或沉默(例如,编码Cas9分子的核酸或编码gRNA分子的核酸)。在任一情况下,统治型gRNA(例如,靶向Cas9的gRNA分子或靶向gRNA的gRNA分子)限制Cas9/gRNA复合物介导的基因靶向的作用,并且可以对活性施加临时限制或减少脱靶活性。在实施例中,编码Cas9和/或gRNA的DNA是通过载体(例如,病毒载体/病毒或质粒)进行递送的。载体可以包括编码Cas9分子和/或gRNA分子的序列。载体还可以包括编码融合到例如Cas9分子序列上的信号肽(例如,用于核定位、核仁定位、线粒体定位)的序列。例如,载体可以包括融合到编码Cas9分子的序列上的核定位序列(例如,来自SV40)。一个或多个调节/控制元件(例如,启动子、增强子、内含子、多聚腺苷酸化信号、Kozak共有序列、内部核糖体进入位点(IRES)、2A序列、以及剪接受体或供体)可以被包括在载体中。在实施例中,启动子由RNA聚合酶II识别(例如,CMV启动子)。在实施例中,启动子由RNA聚合酶III识别(例如,U6启动子)。在实施例中,启动子是受调节的启动子(例如,诱导型启动子)。在实施例中,启动子是组成型启动子。在实施例中,启动子是组织特异性启动子。在实施例中,启动子是病毒启动子。在实施例中,启动子是非病毒启动子。在实施例中,载体或递送运载体是病毒载体(例如,用于产生重组病毒)。在实施例中,病毒是DNA病毒(例如,dsDNA或ssDNA病毒)。在实施例中,病毒是RNA病毒(例如,ssRNA病毒)。示例性病毒载体/病毒包括,例如,逆转录病毒、慢病毒、腺病毒、腺相关病毒(AAV)、痘苗病毒、痘病毒、以及单纯疱疹病毒。在实施例中,病毒载体(例如,AAV)包括编码统治型gRNA分子(例如,靶向Cas9的gRNA分子或靶向gRNA的gRNA分子)的序列。在实施例中,病毒载体具有识别细胞类型和/或组织类型的能力。例如,病毒载体可以用不同/替代的病毒包膜糖蛋白进行假病毒化;用细胞类型特异性受体进行工程化(例如,对病毒包膜糖蛋白进行遗传修饰以结合靶向配体(如肽配体、单链抗体、生长因子));和/或进行工程化以具有双重特异性的分子桥,其中一端识别病毒糖蛋白而另一端识别靶细胞表面的部分(例如,配体-受体、单克隆抗体、亲和素-生物素和化学缀合)。在实施例中,病毒载体实现细胞类型特异性表达。例如,可以构建组织特异性启动子以仅在靶细胞中限制转基因(Cas9和gRNA)的表达。载体的特异性也可以由转基因表达的微小RNA依赖性控制所介导。在实施例中,病毒载体具有增加的病毒载体和靶细胞膜的融合效率。例如,可以结合融合蛋白(例如,融合感受态血球凝集素(HA))以增加病毒摄取进入细胞中。在实施例中,病毒载体具有核定位的能力。例如,某些需要分解细胞壁(在细胞分裂期间)的病毒将不感染非分裂细胞。掺入进病毒的基质蛋白中的核定位肽允许转导到非增殖细胞中。在实施例中,病毒感染分裂细胞。在实施例中,病毒感染非分裂细胞。在实施例中,病毒感染分裂和非分裂细胞两者。在实施例中,病毒可以整合到宿主基因组中。在实施例中,病毒被工程化以具有减少的免疫性(例如,在人类中)。在实施例中,病毒是有复制能力的。在实施例中,病毒是复制缺陷型的(例如,基因在另外多轮病毒粒子复制和/或包装时所需的一个或多个编码区被其他基因替换或缺失)。在实施例中,病毒引起Cas9分子和/或gRNA分子的瞬时表达。在实施例中,病毒引起Cas9分子和/或gRNA分子的持久(例如,至少1周、2周、1个月、2个月、3个月、6个月、9个月、1年、2年、或永久)表达。病毒的包装能力可以在,例如,至少约4kb到至少约30kb(例如,至少约5kb、10kb、15kb、20kb、25kb、30kb、35kb、40kb、45kb、或50kb)之间变化。在实施例中,编码Cas9和/或gRNA的DNA是通过重组逆转录病毒进行递送的。在实施例中,逆转录病毒(例如,莫洛尼鼠白血病病毒)包括(例如,允许整合进宿主基因组中的)逆转录酶。在实施例中,逆转录病毒是有复制能力的。在实施例中,逆转录病毒是复制缺陷型的(例如,基因在另外多轮的病毒粒子复制以及包装时所需的一个或多个编码区被其他基因替换或缺失)。在实施例中,编码Cas9和/或gRNA的DNA是通过重组慢病毒进行递送的。例如,慢病毒是复制缺陷型的(例如,不包含一种或多种病毒复制所需的基因)。在实施例中,编码Cas9和/或gRNA的DNA是通过重组腺病毒进行递送的。在实施例中,腺病毒被工程化以在人类中具有减少的免疫性。在实施例中,编码Cas9和/或gRNA的DNA是通过重组AAV进行递送的。在实施例中,AAV可以将它的基因组合并到宿主细胞(例如,如在此所描述的靶细胞)的基因组中。在实施例中,AAV是自我互补腺相关病毒(scAAV)(例如,对一起退火以形成双链DNA的两条链进行包装的scAAV)。可以在所披露的方法中使用的AAV血清型包括,例如,AAV1、AAV2、修饰的AAV2(例如,在Y444F、Y500F、Y730F和/或S662V处修饰)、AAV3、修饰的AAV3(例如,在Y705F、Y731F和/或T492V处修饰)、AAV4、AAV5、AAV6、修饰的AAV6(例如,在S663V和/或T492V处修饰)、AAV8、AAV8.2、AAV9、AAVrh10,并且假型AAV(如AAV2/8、AAV2/5和AAV2/6)也可以在所披露的方法中使用。在实施例中,编码Cas9和/或gRNA的DNA是通过混合病毒(例如,在此描述的一种或多种病毒的混合物)进行递送的。使用包装细胞形成能够感染宿主或靶细胞的病毒粒子。这样的细胞包括可以包装腺病毒的293细胞和可以包装逆转录病毒的ψ2细胞或PA317细胞。在基因疗法中使用的病毒载体通常由将核酸载体包装进病毒粒子的生产者细胞系产生。载体典型地包含包装以及随后整合进宿主或靶细胞(如果适用的话)所需的最低量病毒序列,而其他病毒序列由编码有待表达的蛋白的表达盒替换。例如,在基因疗法中使用的AAV载体典型地仅具有来自AAV基因组的反向末端重复(ITR)序列,这些序列为包装并在宿主或靶细胞中基因表达所需。失去的病毒功能由包装细胞系反式地提供。此后,将病毒DNA包装进以下细胞系中,该细胞系包含编码辅助质粒的其他AAV基因,即rep和cap,但缺少ITR序列。该细胞系还被作为辅助者的腺病毒感染。该辅助病毒促进AAV载体的复制和从辅助质粒表达AAV基因。由于缺少ITR序列,未以显著的量包装该辅助质粒。可以通过例如与AAV相比腺病毒更加敏感的热处理减少腺病毒的污染。在实施例中,病毒载体具有识别细胞类型和/或组织类型的能力。例如,病毒载体可以用不同/替代的病毒包膜糖蛋白进行假病毒化;用细胞类型特异性受体进行工程化(例如,对病毒包膜糖蛋白进行遗传修饰以结合靶向配体(如肽配体、单链抗体、生长因子));和/或进行工程化以具有双重特异性的分子桥,其中一端识别病毒糖蛋白而另一端识别靶细胞表面的部分(例如,配体-受体、单克隆抗体、亲和素-生物素和化学缀合)。在实施例中,病毒载体实现细胞类型特异性表达。例如,可以构建组织特异性启动子以仅在靶细胞中限制转基因(Cas9和gRNA)的表达。载体的特异性也可以由转基因表达的微小RNA依赖性控制所介导。在实施例中,病毒载体具有增加的病毒载体和靶细胞膜的融合效率。例如,可以结合融合蛋白(例如,融合感受态血球凝集素(HA))以增加病毒摄取进入细胞中。在实施例中,病毒载体具有核定位的能力。例如,可以将需要分解细胞壁(在细胞分裂期间)并且因此将不感染非分裂细胞的病毒改变,从而结合病毒的基质蛋白中的核定位肽,由此能够实现非增殖细胞的转导。在实施例中,编码Cas9和/或gRNA的DNA是通过非病毒载体或非基于载体的方法(例如,使用裸DNA或DNA复合物)进行递送的。例如,可以通过例如有机改性二氧化硅或硅酸盐(Ormosil)、电穿孔、基因枪、声致穿孔、磁转染、脂质介导的转染、树状聚合物、无机纳米颗粒、磷酸钙、或其组合递送DNA。在实施例中,DNA是通过无机纳米颗粒(例如,附接至有效载荷至纳米颗粒的表面)进行递送的。示例性无机纳米颗粒包括,例如,磁性纳米颗粒(例如,Fe3MnO2)、二氧化硅(例如,可以整合多功能性(例如,将纳米颗粒的外表面与带正电荷的聚合物(例如,聚乙烯亚胺、聚赖氨酸、聚丝氨酸)缀合,这允许有效载荷和内部磁性组分的附接(例如,缀合或截留))、介孔二氧化硅纳米颗粒(其具有加载氯喹的带正电荷的聚合物以增强非病毒载体在体外的转染)、高密度脂蛋白和金纳米颗粒(金纳米颗粒涂覆有有效载荷,当通过暴露于近红外光将纳米颗粒暴露于增加的温度时,有效载荷被释放)、金、铁或银纳米颗粒(具有用聚赖氨酸或另一种电荷聚合物修饰的表面,以便捕获核酸负荷物)。在实施例中,DNA是通过有机纳米颗粒(例如,截留纳米颗粒内的有效载荷)进行递送的。示例性有机纳米颗粒包括,例如,包含阳离子脂质连同中性辅助脂质的SNALP脂质体,其涂覆有聚乙二醇(PEG)和鱼精蛋白以及涂覆有脂质包衣的核酸复合物。在实施例中,递送运载体是物理运载体。在实施例中,运载体是低密度超声。例如,可以使用包含有效载荷的微泡(例如,由生物相容性材料如蛋白、表面活性剂、或生物相容性聚合物或脂质壳制成)并且在微血管转运期间这些微泡可以被聚焦超声豆(focusedultrasoundbean)所破坏。在实施例中,运载体是电穿孔。例如,可以通过电穿孔将裸核酸或蛋白递送至,例如,细胞悬浮液或组织环境(例如,视网膜和胚胎组织)中。在实施例中,运载体是针或喷射注射。例如,可以将裸核酸或蛋白注射进,例如,肌肉、肝、皮肤、脑或心脏组织中。在实施例中,编码Cas9和/或gRNA的DNA是通过载体和非基于载体的方法的组合进行递送的。例如,病毒体包括与灭活病毒(例如,HIV或流感病毒)组合的脂质体,这可以导致比单独的病毒或脂质体方法更有效的基因转移(例如,在呼吸道上皮细胞中)。在实施例中,递送运载体是非病毒载体。在实施例中,非病毒载体是无机纳米颗粒(例如,附接至有效载荷至纳米颗粒的表面)。示例性无机纳米颗粒包括,例如,磁性纳米颗粒(例如,Fe3MnO2)、或二氧化硅。可以将纳米颗粒的外表面与带正电荷的聚合物(例如,聚乙烯亚胺、聚赖氨酸、聚丝氨酸)缀合,这允许有效载荷的附接(例如,缀合或截留)。在实施例中,非病毒载体是有机纳米颗粒(例如,截留纳米颗粒内的有效载荷)。示例性有机纳米颗粒包括,例如,包含阳离子脂质连同中性辅助脂质的SNALP脂质体,其涂覆有聚乙二醇(PEG)和鱼精蛋白以及涂覆有脂质包衣的核酸复合物。用于基因转移的示例性脂质示于表V-3中。表V-3:用于基因转移的脂质用于基因转移的示例性聚合物示于下表V-4中。表V-4:用于基因转移的聚合物在实施例中,载体具有靶向修饰以增加靶细胞摄入纳米颗粒和脂质体(例如,细胞特异性抗原、单克隆抗体、单链抗体、适体、聚合物、糖、和细胞穿透肽)。在实施例中,载体使用融合肽和内体去稳定肽/聚合物。在实施例中,载体经历酸触发的构象变化(例如,以加速负荷物的内体逃逸)。在实施例中,使用刺激可切割的聚合物,例如,用于在细胞区室中释放。例如,可以使用在还原性细胞环境中被切割的基于二硫化物的阳离子型聚合物。在实施例中,将脂质体用于递送,例如,至血液或骨髓,例如,作为靶向造血干细胞(HSC)和祖细胞的方式。例如,对于难以获得HSC的条件(例如,HSC是不稳定的或HSC是稀有的),通过使用脂质体直接递送使得能够进行长期治疗。这些条件可以包括,例如,镰状细胞贫血、范科尼贫血、以及再生障碍性贫血。在实施例中,经由静脉递送或经由局部注射至靶器官或其血流将脂质体用于递送至局部特定组织(例如,至肝或肺)。例如,长期治疗可以使该特定器官或组织类型中的效果集中。这些条件可以包括尿素循环障碍、α-1-抗胰蛋白酶或囊性纤维化。在实施例中,递送运载体是生物非病毒递送运载体。在实施例中,运载体是减毒细菌(例如,天然或人工工程化成侵入性的,但减毒以防止发病原和表达转基因(例如,单核细胞增生李斯特菌Listeriamonocytogenes、某些沙门氏菌Salmonella菌株、长双歧杆菌BifidobacteriumLongum、和修饰的大肠杆菌Escherichiacoli)、具有营养和组织特异性向性以靶向特定组织的细菌、具有修饰的表面蛋白以改变靶组织特异性的细菌)。在实施例中,运载体是转基因修饰的噬菌体(例如,具有大包装能力、较少免疫原性、含有哺乳动物质粒维持序列并且具有结合的靶向配体的工程化噬菌体)。在实施例中,运载体是哺乳动物病毒样颗粒。例如,可以产生修饰的病毒颗粒(例如,通过纯化“空心”颗粒,随后用希望的负荷物离体组装病毒)。运载体也可以被工程化以结合靶向配体从而改变靶组织特异性。在实施例中,运载体是生物脂质体。例如,生物脂质体是衍生自人类细胞的基于磷脂的颗粒(例如,红细胞血影,其是该红血细胞分解成衍生自受试者的球状结构(例如,可以通过附接不同组织或细胞特异性配体来实现组织靶向)、或分泌外泌体-受试者(即,患者)衍生的内吞起源的膜结合纳米运载体(30-100nm)(例如,可以产生自不同细胞类型并且因此可以被细胞吸收,而不需要靶向配体)。在实施例中,通过骨髓中的纳米颗粒递送Cas9组分是治愈血液和免疫疾病的体内方法。在实施例中,Cas系统的这些组分(例如,Cas9分子组分以及在此描述的gRNA分子组分)是通过核转染进行递送的。例如,NucleofectorTM(龙沙公司(Lonza)CologneAG)是可以用于递送至原代细胞和难以转染的细胞系中的转染技术。它是基于电参数和细胞类型特异性溶液的组合的非病毒方法。它允许转染的核酸直接进入核中(例如,无需依赖细胞分裂将核酸转移进入核中),提供了转染非分裂细胞(例如,神经元和静止血细胞)的能力。在实施例中,核转染被用作离体递送方法。在实施例中,Cas系统的这些组分(例如,Cas9分子组分以及在此描述的gRNA分子组分)是通过利用内源受体介导的转运体的方法进行递送的(例如,基于抗体的分子特洛伊木马(ArmaGen))。此类方法可以允许将治疗剂非侵入性递送至难以达到的位置(例如,脑(例如,以穿过血脑屏障(BBB),例如,经由内源受体介导的转运体方法))。在实施例中,递送除了Cas系统的这些组分(例如,Cas9分子组分和/或在此描述的gRNA分子组分)外的一种或多种核酸分子(例如,DNA分子)。在实施例中,该核酸分子是在递送Cas系统一个或多个组分的同时进行递送的。在实施例中,该核酸分子是在递送Cas系统一个或多个组分之前或之后(例如,小于约30分钟、1小时、2小时、3小时、6小时、9小时、12小时、1天、2天、3天、1周、2周、或4周)进行递送的。在实施例中,该核酸分子是通过不同于递送Cas系统的一个或多个组分(例如,Cas9分子组分和/或gRNA分子组分)的方式进行递送的。该核酸分子可以通过任何在此描述的递送方法进行递送。例如,该核酸分子可以通过病毒载体(例如,整合缺陷型慢病毒)进行递送,并且Cas9分子组分和/或gRNA分子组分可以通过电穿孔(例如,这样可以降低由核酸(例如,DNA)引起的毒性)进行递送。在实施例中,该核酸分子编码治疗性蛋白质(例如,在此描述的蛋白质)。在实施例中,该核酸分子编码RNA分子(例如,在此描述的RNA分子)。编码Cas9分子的RNA的递送可以通过本领域已知或如在此描述的方法将编码Cas9分子的RNA(例如,eaCas9分子、eiCas9分子或eiCas9融合蛋白)和/或gRNA分子递送到细胞(例如,在此描述的靶细胞)中。例如,可以通过例如,微注射、电穿孔、脂质介导的转染、肽介导的递送、或其组合递送编码Cas9和/或编码gRNA的RNA。递送Cas9分子蛋白可以通过本领域已知或如在此描述的方法将Cas9分子(例如,eaCas9分子、eiCas9分子或eiCas9融合蛋白)递送到细胞中。例如,可以通过例如,微注射、电穿孔、脂质介导的转染、肽介导的递送、或其组合递送Cas9蛋白分子。递送可以与编码gRNA的DNA或与gRNA相伴。施用途径全身施用模式包括口服和肠胃外途径。肠胃外途径包括,作为举例,静脉内、动脉内、骨内、肌内、皮内、皮下、鼻内以及腹膜内途径。全身性施用的组分可以被修饰或配制成靶向特定器官或细胞类型的组分。局部施用模式包括,作为举例,鞘内、脑室内、实质内(例如,局部实质内递送至纹状体(例如,进入尾状核或进入壳核中))、大脑皮层、中央前回、海马体(例如,进入齿状回或CA3区域)、颞皮质、扁桃体、额皮质、丘脑、小脑、髓质、下丘脑、顶盖、大脑脚盖或黑质眼内、眼眶内、结膜下、玻璃体内、视网膜下或经巩膜途径。在实施例中,相比于当全身施用(例如,静脉内)时,当局部施用(例如,实质内或玻璃体内)时,显著更少量的组分(相比于全身性方法)可以发挥效果。局部施用模式可以降低或消除潜在毒副作用的发生率,当全身性施用治疗有效量的组分时可能发生毒副作用。在实施例中,在此描述的组分通过实质内注射被递送到脑的离散区域(包括,例如,包括中棘神经元的区域、或包含皮层神经元的区域)。注射液可以直接进入脑的多于一个区域中。在实施例中,在此描述的组分是通过视网膜下进行递送的(例如,通过视网膜下注射)。视网膜下注射可以直接进入黄斑(例如,黄斑下注射)。在实施例中,在此描述的组分是通过玻璃体内注射进行递送的。玻璃体内注射具有相对较低的视网膜脱离风险。在实施例中,纳米颗粒或病毒载体(例如,AAV载体(例如,AAV2载体(例如,修饰的AAV2载体)))经玻璃体内递送。在实施例中,纳米颗粒或病毒载体(例如,AAV载体)是经由实质内注射进行递送的。用于将试剂施用至眼的方法是医学领域中已知的并且可以用于施用在此描述的组分。示例性的方法包括眼球内注射(例如,眼球后、视网膜下、黄斑下、玻璃体内和脉络膜内)、离子电渗、滴眼剂、以及眼内植入(例如,玻璃体内、榫体下(sub-Tenons)和结膜下)。施用可以被提供为周期性推注(例如,视网膜下、静脉内或玻璃体内)或作为来自内部储存器的连续输注(例如,来自布置在眼内或眼外位置处的植入物(参见,美国专利号5,443,505和5,766,242))或来自外部储存器(例如,来自静脉袋)。可以局部施用组分,例如,通过从固定至眼的内壁的缓释药物递送装置中持续释放或经由定向经巩膜控制释放进入脉络膜中(参见,例如,PCT/US00/00207、PCT/US02/14279,Ambati等人,(2000)眼科学和视觉科学研究(INVEST.OPHTHALMOL.VIS.SCI.)41:1181-1185,以及Ambati等人,(2000)眼科学和视觉科学研究(INVEST.OPHTHALMOL.VIS.SCI.)41:1186-1191)。多种适合用于将组分局部施用至眼睛内部的装置在本领域中是已知的。参见,例如,美国专利号6,251,090、6,299,895、6,416,777、6,413,540、以及PCT/US00/28187。此外,可以将组分配制成允许在延长时段内释放。释放系统可以包括生物降解材料或通过扩散释放所结合的组分的材料的基质。组分可以在释放系统中均匀或者非均匀分布。多种释放系统可以是有用的,然而,选择适当的系统将取决于具体应用所需要的释放速率。不可降解和可降解的释放系统均可以被使用。适合的释放系统包括聚合物和聚合物基质、非聚合物基质、或无机和有机赋形剂和稀释剂(如,但不局限于,碳酸钙和糖(例如,海藻糖))。释放系统可以是天然的或合成的。然而,合成的释放系统是优选的,因为它们通常更可靠、更具可重现性并且产生更明确的释放曲线。可以选择释放系统材料以使得具有不同分子量的组分是通过扩散或通过材料的降解而释放的。代表性合成的、可生物降解的聚合物包括,例如:聚酰胺(例如,聚(氨基酸)和聚(肽));聚酯(如聚(乳酸)、聚(乙醇酸)、聚(乳酸-共-乙醇酸)、以及聚(己内酯));聚(酸酐);聚原酸酯;聚碳酸酯;及其化学衍生物(化学基团的取代、添加,例如,烷基、亚烷基、羟化、氧化、以及其他由本领域的技术人员常规做出的修饰)、共聚物及其混合物。代表性合成的,不可降解聚合物包括,例如:聚醚(例如,聚(氧化乙烯)、聚(乙二醇)、以及聚(四氢呋喃二醇));乙烯基聚合物-聚丙烯酸酯和聚甲基丙烯酸酯(如甲基、乙基、其他烷基、甲基丙烯酸羟基乙酯、丙烯酸和甲基丙烯酸、以及其他例如聚(乙烯醇)、聚(乙烯基吡咯烷酮)、以及聚(乙酸乙烯酯);聚(氨酯);纤维素及其衍生物(如烷基、羟烷基、醚、酯、硝化纤维素、以及不同的醋酸纤维素);聚硅氧烷;及其任何化学衍生物(化学基团的取代、添加,例如,烷基、亚烷基、羟化、氧化、以及其他由本领域的技术人员常规做出的修饰)、共聚物及其混合物。聚丙交酯乙交酯共聚物微球也可以用于眼球内注射。典型地,微球是由乳酸和乙醇酸的聚合物构成的,其被结构化形成空心球体。球体的直径可以是大约15-30微米并且可以加载有此描述的组分。组分的双模或差别递送Cas系统的组分(例如,Cas9分子组分和gRNA分子组分)的分别递送,并且更具体地,通过不同模式递送这些组分,可以通过例如改善组织特异性和安全性来增强性能。在实施例中,Cas9分子和gRNA分子是通过不同模式(或有时在此称为差别模式)进行递送的。如在此使用的,不同或差别模式是指递送的模式,该递送模式赋予受试组分分子(例如,Cas9分子、gRNA分子、或模板核酸)不同的药效动力学或药物代谢动力学特性。例如,递送的模式可以导致不同的组织分布,不同的半衰期、或不同的时间分布(例如,在选定的区室、组织、或器官中)。一些递送的模式(例如,通过例如通过自主复制或插入进细胞核酸中而持续存在于细胞、或细胞子代中的核酸载体的递送)导致组分更为持续的表达和存在。实例包括病毒(例如,腺相关病毒或慢病毒)递送。通过举例,这些组分(例如,Cas9分子和gRNA分子)可以按照所递送组分在体内、或在特定区室、组织、或器官中的所得半衰期或持续性方面不同的模式进行递送。在实施例中,gRNA分子可以通过此类模式进行递送。Cas9分子组分可以通过这样一种模式进行递送,该模式导致更少持久性或更少将其暴露于身体或特定区室或组织或器官。更一般地说,在实施例中,第一递送模式被用于递送第一组分并且第二递送模式被用于递送第二组分。第一递送模式赋予第一药效动力学或药物代谢动力学特性。第一药效动力学特性可以是,例如,组分或编码该组分的核酸在体内、区室、组织、或器官中的分布、持久性、或暴露。第二递送模式赋予第二药效动力学或药物代谢动力学特性。第二药效动力学特性可以是,例如,组分或编码该组分的核酸在体内、区室、组织、或器官中的分布、持久性、或暴露。在实施例中,第一药效动力学或药物代谢动力学特性(例如,分布、持久性或暴露)比第二药效动力学或药物代谢动力学特性更为有限。在实施例中,选择第一递送模式以优化(例如,最小化)药效动力学或药物代谢动力学特性(例如,分布、持久性或暴露)。在实施例中,选择第二递送模式以优化(例如,最大化)药效动力学或药物代谢动力学特性(例如,分布、持久性或暴露)。在实施例中,第一递送模式包括使用较为持久的元件(例如,核酸(例如,质粒或病毒载体(例如,AAV或慢病毒)))。由于此类载体是较为持久的,从它们中转录的产物将是较为持久的。在实施例中,第二递送模式包括较为瞬时的元件(例如,RNA或蛋白)。在实施例中,第一组分包含gRNA,并且该递送模式是较为持久的(例如,gRNA转录自质粒或病毒载体(例如,AAV或慢病毒))。这些基因的转录将具有很小的生理学意义,因为基因并不编码蛋白产物,并且这些gRNA不能够单独起作用。第二组分(Cas9分子)是以瞬时方式进行递送的(例如,作为mRNA或作为蛋白),从而确保完全Cas9分子/gRNA分子复合物仅在短时段内存在和有活性。此外,这些组分可以不同的分子形式或用不同的互为补充以增强安全性和组织特异性的递送载体进行递送。使用差别递送模式可以增强性能、安全性和功效。例如,可以降低最终脱靶修饰的可能性。通过较不持久的模式递送免疫原性组分(例如,Cas9分子)可以降低免疫原性,因为来自细菌衍生的Cas酶的肽通过MHC分子被展示在细胞表面上。两部分式递送系统可以改善这些缺点。差别递送模式可以用于将组分递送至不同,但是重叠的靶区域。在靶区域的重叠之外形成活性复合物被最小化。因此,在实施例中,第一组分(例如,gRNA分子)通过第一递送模式进行递送,其导致第一空间(例如,组织)分布。第二组分(例如,Cas9分子)通过第二递送模式进行递送,其导致第二空间(例如,组织)分布。在实施例中,第一模式包括选自脂质体、纳米颗粒(例如,聚合物纳米颗粒)、以及核酸(例如,病毒载体)的第一元件。第二模式包括选自所述组的第二元件。在实施例中,第一递送模式包括第一靶向元件(例如,细胞特异性受体或抗体),并且第二递送模式不包括该元件。在实施例中,第二递送模式包括第二靶向元件(例如,第二细胞特异性受体或第二抗体)。当Cas9分子在病毒递送载体、脂质体、或聚合物纳米颗粒中进行递送时,存在递送至多个组织并且在多个组织具有治疗活性的可能性,这是当可能希望仅靶向单个组织时。两部分式递送系统可以解决这一挑战并且增强组织特异性。如果gRNA分子和Cas9分子被包装在具有不同但重叠的组织嗜性的分离的递送运载体中,完全功能性复合物仅在被两种载体靶向的组织中形成。VI.有效载荷Cas9分子(典型地eiCas9分子和gRNA分子(例如,eiCas9分子/gRNA分子复合物))可以用于递送多种多样的有效载荷。在实施例中,有效载荷被递送至靶核酸或至染色质、或其他组分、靶核酸附近或与之相关。虽然希望不受理论束缚,但认为eiCas9分子/gRNA分子复合物的gRNA分子的序列特异性有助与靶序列的特异性相互作用,由此实现与(例如,共价地或非共价地偶联到)Cas9分子/gRNA分子复合物相关的有效载荷的递送。在实施例中,有效载荷共价地或非共价地偶联到Cas9(例如,eiCas9分子)上。在实施例中,有效载荷共价地或非共价地偶联到gRNA分子上。在实施例中,有效载荷通过接头(例如,包括在生理条件下可切割的键的接头)连接至Cas9分子、或gRNA分子。在实施例中,键在生理条件下是不可切割的或仅是难切割的。在实施例中,“共价地偶联”意指作为含有Cas9分子的融合蛋白的一部分。多重有效载荷的递送在实施例中,第一有效载荷分子通过第一Cas9分子进行递送并且第二有效载荷分子通过第二Cas9分子进行递送。在实施例中,第一和第二有效载荷是相同的。在实施例中,第一和第二Cas9分子是相同的(例如,来自相同物种、具有相同的PAM、和/或具有相同的序列)。在实施例中,第一和第二Cas9分子是不同的(例如,来自不同物种、具有不同的PAM、和/或具有不同的序列)。配置的实例提供于表VI-1中。典型地,表VI-1的Cas9分子是eiCas9分子。在实施例中,选择Cas9分子使得有效载荷递送和切割都得以实现。在实施例中,多重有效载荷(例如,两个有效载荷)与单个Cas9分子进行递送。表VI-1:通过多于一种Cas9分子/gRNA分子复合物递送有效载荷的配置在实施例中,递送两种不同的药物。在实施例中,递送通过第一接头偶联至第一Cas9分子的第一有效载荷(例如,药物)和通过第二接头偶联至第二Cas9分子的第二有效载荷(例如,药物)。在实施例中,第一和第二有效载荷是相同的,并且,在实施例中,通过不同的接头(例如,具有不同的释放动力学)偶联至对应的Cas9分子上。在实施例中,第一和第二有效载荷是不同的,并且,在实施例中,通过相同的接头偶联至对应的Cas9分子上。在实施例中,第一和第二有效载荷相互作用。例如,第一和第二有效载荷形成复合物(例如,二聚体或多聚体复合体(例如,二聚体蛋白))。在实施例中,第一有效载荷可以活化第二有效载荷(例如,第一有效载荷可以修饰(例如,切割或磷酸化)第二有效载荷)。在实施例中,第一有效载荷与第二有效载荷相互作用从而修饰(例如,增加或降低)第二有效载荷的活性。可以在体外、离体或体内递送有效载荷。有效载荷的类别有效载荷可以包括大分子或生物制剂(例如,抗体分子)、融合蛋白、作为融合配偶体融合至Cas9分子(例如,eiCas9分子)的氨基酸序列、酶、小分子(例如,HDAC和其他染色质改性剂/抑制剂、外显子跳跃分子、转录抑制剂)、微卫星延伸抑制剂、碳水化合物、以及DNA降解剂(例如,在传染性疾病或“外源”DNA环境中)、核酸(例如,DNA、RNA、mRNA、siRNA、RNAi、或反义寡核苷酸)。表VI-2提供了示例性的有效载荷的类别。表VI-2大分子在实施例中,有效载荷包括聚合物(例如,生物聚合物(例如,蛋白、核酸、或碳水化合物))。在实施例中,有效载荷包括蛋白、生物制剂或其他大分子(即,具有分子量为至少3、5、10、20、30、40、50、60、70、80、90、或100kD的分子)。在实施例中,有效载荷包括聚合物(例如,生物聚合物(例如,蛋白、核酸、或碳水化合物))。聚合物可以是天然发生或非天然发生的聚合物。在实施例中,有效载荷是天然产物。例如,天然产物可以是大分子或小分子。多肽、蛋白在实施例中,有效载荷包括蛋白或多肽(例如,共价地或非共价地偶联到Cas9分子上的蛋白或多肽)。在实施例中,蛋白或多肽是二聚体或多聚体,并且每个亚单元是通过Cas9分子进行递送的。在实施例中,第一蛋白和第二蛋白是通过一种或多种Cas9分子(例如,各自通过单独的Cas9分子或两者均是通过相同的Cas9分子)进行递送的。在实施例中,蛋白或多肽通过接头(例如,包括在生理条件下可切割的键的接头)连接至Cas9分子。在实施例中,接头是来自此处第XI部分的接头。在实施例中,键在生理条件下是不可切割的。特异性结合配体、抗体在实施例中,有效载荷包括对反(counter)配体具有特异亲和力的配体(例如,蛋白)。在实施例中,配体可以是受体(或针对受体的配体)、或抗体。在实施例中,有效载荷包括抗体分子。示例性抗体分子包括,例如包括至少一个免疫球蛋白可变结构域的蛋白或多肽。例如,抗体可以包括重(H)链可变区(在此缩写为VH)和轻(L)链可变区(在此缩写为VL)。在另一个实例中,抗体包括两个重(H)链链的可变区以及两个轻(L)链可变区。术语“抗体”涵盖抗体的抗原结合片段(例如,单链抗体、Fab和sFab片段、F(ab’)2、Fd片段、Fv片段、scFv、以及结构域抗体(dAb)片段(德维尔特(deWildt)等人,欧洲免疫学杂志(EURJIMMUNOL.)1996;26(3):629-639))。例如,抗体的抗原结合片段可以包括,例如,(i)Fab片段(一种由VL、VH、CL和CH1结构域组成的单价片段);(ii)F(ab’)2片段(一种在铰链区包括由二硫桥键连接的两个Fab片段的二价片段);(iii)Fd片段,由VH和CH1结构域组成;(iv)Fv片段,由抗体的单臂的VL和VH结构域组成;(v)dAb片段(沃德(Ward)等人,(1989)自然(Nature)341:544-546),其由VH结构域组成;以及(vi)分离的互补决定区(CDR),其保持功能性。此外,尽管Fv片段的两个结构域VL和VH是由单独的基因编码的,但是它们可以使用重组方法经由合成接头来连接,其中这个合成接头使它们能够被制备为单一的蛋白链,其中VL和VH区组成一对以形成单价分子(被称为单链Fv(scFv))。参见,例如,美国专利5,260,203、4,946,778、以及4,881,175;伯德(Bird)等人,(1988)科学(Science)242:423-426;以及休斯顿(Huston)等人,(1988)美国国家科学院院刊(PROC.NATL.ACAD.SCI.USA)85:5879-5883。抗体可以具有IgA、IgG、IgE、IgD、IgM(连同其亚型)的结构特征。抗体可以来自任何来源,但灵长类(人和非人类灵长动物)并且灵长化是优选的。在实施例中,抗体是人抗体或人源化抗体。在实施例中,抗体分子是单域抗体(例如,sdAb(例如,纳米抗体)),例如,由单个单体可变抗体结构域组成的抗体片段。在实施例中,单域抗体的分子量是约12-15kDa。例如,单域抗体可以从发现于骆驼科动物中重链抗体中工程化得到(例如,VHH片段)。软骨鱼类也具有重链抗体(IgNAR,‘免疫球蛋白新抗原受体’),从中可以获得被称为VNAR片段的单域抗体。一种替代方法是从常见免疫球蛋白G(IgG)(例如,从人类或小鼠中)中分离二聚体可变结构域成单体。可以获得衍生自重链或轻链的单域抗体以特异性结合至靶表位。例如,单域抗体可以是长约110个氨基酸的肽链,其包括重链抗体、或常见IgG的可变结构域(VH)。单域抗体作为全抗体对抗原可以具有类似的亲和性。它们还可以是更加耐热的和/或对洗涤剂以及高浓度脲更加稳定的。例如,衍生自骆驼科动物和鱼的抗体的那些可以具有较低亲脂性并且更易溶于水,这归因于它们的互补决定区3(CDR3),其形成覆盖通常结合至轻链的亲脂位点的延伸环。在实施例中,单域抗体不显示补体系统触发的细胞毒性,例如,因为它们缺乏Fc区。单域抗体(例如,骆驼科动物和鱼衍生的sdAb)可以结合至对全抗体(例如,对酶的活性位点)可能不可及的隐藏抗原。这种特性可能起因于它们的延伸CDR3环,其能够穿透这类位点。可以通过对例如具有所希望的抗原的单峰骆驼、骆驼、美洲驼、羊驼或鲨进行免疫接种作用并且随后分离编码重链抗体的mRNA而获得单域抗体。通过反转录以及聚合酶链反应,产生含有数百万克隆的单域抗体的基因文库。筛选技术像噬菌体展示和核糖体展示有助于鉴别结合抗原的克隆。一种不同的方法使用来自未事先免疫的动物的基因文库。此类天然文库通常仅含有对所希望的抗原具有低亲和性的抗体,使得必须通过随机诱变应用亲和性成熟作为另外的步骤。当已经鉴定出最有效力的克隆时,可以优化它们的DNA序列,例如以改进它们对酶的稳定性。另一个目标是人源化以防止人类生物对抗抗体的免疫反应。最终步骤是翻译大肠杆菌、酿酒酵母Saccharomycescerevisiae或其他适合生物中优化的单域抗体。可替代地,单域抗体可以由具有四条链的常见鼠或人IgG制成。方法是类似的,其包括来自免疫或天然供体的基因文库以及用于鉴别最特异性抗原的展示技术。单体化通常通过由亲水性氨基酸替换亲脂性氨基酸来实现。如果可以保留亲和性,在大肠杆菌、酿酒酵母或其他生物中同样可以产生单域抗体。在实施例中,有效载荷包括转录激活蛋白或结构域(例如,VP16蛋白或结构域、或转录抑制蛋白或结构域)。融合蛋白和融合配偶体在实施例中,有效载荷包括融合蛋白。示例性融合蛋白包括第一和第二融合配偶体,其可以具有不同的功能特性或其可以来源于不同的蛋白。在实施例中,融合蛋白可以包括结合核酸的第一融合配偶体和包括酶活性或促进或抑制基因表达的第二融合配偶体。在实施例中,有效载荷本身是融合蛋白。在实施例中,有效载荷融合至Cas9分子上。例如,融合蛋白可以含有一种区段,该区段增加融合蛋白的稳定性和/或可递送性。在实施例中,融合蛋白可以是融合至免疫球蛋白片段(例如,Fc片段)、运铁蛋白或血浆蛋白(例如,白蛋白)上的在此描述的蛋白质(例如,受体)。融合蛋白还可以包含一种区段,该区段增加融合蛋白的毒性(例如,通过毒素、酶或细胞因子运送的)。融合蛋白还可以用于实现递送和/或靶向途径(例如,通过HIV-1TAT蛋白)。其他实例包括,例如,允许多价的融合物,如链霉亲和素融合物、或两种活性组分的融合物(例如,其间具有或不具有可切割接头)。在实施例中,蛋白或多肽是具有Cas9分子(例如,eiCas9分子)的融合配偶体。在实施例中,有效载荷包括具有Cas9分子的融合配偶体,该融合配偶体包括转录激活蛋白或结构域(例如,VP16蛋白或结构域、或转录抑制蛋白或结构域)。酶在实施例中,有效载荷包括酶。示例性的酶包括,例如,氧化还原酶(例如,催化氧化/还原反应)、转移酶(例如,转移官能团(例如,甲基或磷酸基团))、水解酶(例如,催化不同键的水解)、裂解酶(例如,通过除了水解和氧化的方式切割不同键)、异构酶(催化单分子内的异构化变化)、以及连接酶(例如,用共价键连接两个分子)。在实施例中,酶介导细胞核中的一种或多种功能或与其相关,例如,DNA合成、转录、DNA和组蛋白的表观遗传修饰、RNA转录后修饰、细胞周期控制、DNA损伤修复、或基因组不稳定性。小分子在实施例中,有效载荷包括小分子化合物。在实施例中,小分子是生物过程的调节剂。例如,小分子可以结合至第二分子(例如,生物聚合物(例如,碳水化合物、蛋白质、多肽、或核酸)),并且在实施例中,改变第二分子的结构、分布、活性、或功能中的一种或多种。在实施例中,小分子的尺寸在10-9m的数量级上。在实施例中,小分子的分子量在例如200amu与500amu之间、300amu与700amu之间、500amu与700amu之间、700amu与900amu之间或500amu和900amu之间。示例性小分子包括组蛋白脱乙酰酶(HDAC)抑制剂(例如,辛二酰苯胺异羟肟酸(SAHA)、或罗米地新)、组蛋白甲基转移酶抑制剂(DNA甲基转移酶抑制剂(例如,阿扎胞苷(或5-阿扎胞苷)、地西他滨(或5-氮杂-2’-脱氧胞苷)))、或DNA复制抑制剂。小分子还可以包括,例如,小核酸分子(取决于,例如,低于2kD的碱基的1-4个碱基)和肽。微卫星延伸抑制剂在实施例中,有效载荷包括微卫星延伸抑制剂。在实施例中,微卫星延伸抑制剂是DNA错配修复蛋白。可以通过在此描述的分子和方法进行递送的示例性DNA错配修复蛋白,包括,例如MSH2、MSH3、MSH6、MLH1、MLH3、PMS1、PMS2。信号发生器、放射性核素、报道分子、诊断探针在实施例中,有效载荷包括产生信号的分子。此类有效载荷可以用于,例如,研究、治疗(例如,癌症治疗)和诊断应用中。在实施例中,该信号包括:电磁辐射,例如,在红外、可见、或紫外线范围中;粒子,例如,放射性衰变的产品,例如,α、β、或γ粒子;可检测底物,例如,有色底物;反应产物,例如,酶促反应的产物;或可通过特异性结合剂检测的配体,例如,抗体;或染料。在实施例中,该信号包括荧光发射,例如,通过荧光蛋白。示例性荧光蛋白包括蓝/UV蛋白(例如,TagBFP、mTagBFP、Azurite、EBFP2、mKalama1、Sirius、Sapphire、T-Sapphire)、青色蛋白(例如,ECFP、Cerulean、SCFP3A、mTurquoise、mTurquoise2、Midoriishi-青、TagCFP、mTFP1)、绿色蛋白(例如,EGFP、Emerald、SuperfolderGFP、单体Azami绿、TagGFP2、mUKG、mWasabi、Clover、mNeonGreen)、黄色蛋白(例如,EYFP、Citrine、Venus、SYFP2、TagYFP)、橙色蛋白(例如,单体Kusabira-橙色、mKOκ、mKO2、mOrange、mOrange2)、红色蛋白(mRaspberry、mCherry、mStrawberry、mTangerine、tdTomato、TagRFP、TagRFP-T、mApple、mRuby、mRuby2)、远红蛋白(例如,mPlum、HcRed-Tandem、mKate2、mNeptune、NirFP、TagRFP657、IFP1.4、iRFP)、长斯托克斯频移蛋白(例如,mKeimaRed、LSS-mKate1、LSS-mKate2、mBeRFP)、光活化蛋白(例如,PA-GFP、PAmCherry1、PATagRFP)、光转化蛋白(例如,Kaede(绿色)、Kaede(红色)、KikGR1(绿色)、KikGR1(红色)、PS-CFP2、mEos2(绿色)、mEos2(红色)、mEos3.2(绿色)、mEos3.2(红色)、PSmOrange)、光开关蛋白(例如,Dronpa)。在实施例中,信号产生部分被提供为Cas9分子(例如,eiCas9分子)的融合配偶体。可用于例如标记多肽的信号发生器或报道分子包括但不限于以下:放射性同位素或放射性核素(例如,铟(111In)、碘(131I或125I)、钇(90Y)、镥(177Lu)、锕(225Ac)、铋(212Bi或213Bi)、硫(35S)、碳(14C)、氚(3H)、铑(188Rh)、锝(99mTc)、镨、或磷(32P)或正电子发射放射性核素(例如,碳-11(11C)、钾-40(40K)、氮-13(13N)、氧-15(15O)、氟-18(18F)、以及碘-121(121I)))、荧光标记(例如,FITC、罗丹明、镧化物磷光体(lanthanidephosphors))、酶标记(例如,辣根过氧化物酶、β-半乳糖苷酶、萤虫素酶、碱性磷酸酯酶)、化学发光、生物素基(其可以通过标记的亲和素(例如,含有链霉亲和素部分和荧光标记物的分子)检测出来或者可以通过光学或量热法检测出的酶活性)、以及被第二报道分子识别的预先确定的多肽表位(例如,亮氨酸拉链对序列、第二抗体的结合位点、金属结合结构域、表位标签)。在实施例中,标签通过不同长度的间隔臂连接以降低潜在立体位阻。在实施例中,有效载荷包括放射性核素。可以将放射性核素掺入gRNA分子、Cas9分子中、或掺入有效载荷分子中。示例性放射性核素包括,例如,β发射体、α发射体或γ发射体。在实施例中,该放射性核素是碘(例如,131I或125I)、钇(例如,90Y)、镥(例如,177Lu)、锕(例如,225Ac)、铋(例如,212Bi或213Bi)、硫(例如,35S)、碳(例如,14C)、氚(3H)、铑(例如,188Rh)、锝(例如,99Tc)、镨、或磷(例如,32P)。DNA和染色质结构的调节剂在实施例中,有效载荷包括DNA结构的内源或外源调节剂。可以在体外、离体或体内递送调节剂(其是典型的有效载荷)。在实施例中,有效载荷包括DNA的表观遗传状态或特征的调节剂。在实施例中,可以改变表观遗传状态或特征以治疗病症、或影响细胞的发育或其他状态。在实施例中,表观遗传状态或特征包括DNA甲基化。例如,在此描述的有效载荷可以调节将甲基添加至DNA,例如,以将胞嘧啶转化为5-甲基胞嘧啶,例如,在CpG位点处。异常DNA甲基化模式(例如,相比于正常组织的过度甲基化和甲基化不足)与不同疾病和病症(例如,癌症)相关。在此描述的调节剂可以用于再活化转录沉默基因或抑制转录过度活跃基因,例如以治疗疾病(例如,癌症)。DNA甲基化可以影响基因转录。具有高水平的5-甲基胞嘧啶(例如,在它们的启动区)的基因可以是转录较不活跃或沉默的。因此,在此所描述的方法可以用于靶向并且抑制(例如,在此描述的基因的)转录活性。在实施例中,调节剂促进DNA甲基化的维持。例如,调节剂可以具有DNA甲基转移酶(DNMT)活性或调节DNMT活性,例如,以维持DNA甲基化或减少被动的DNA脱甲基化(例如,在DNA复制之后)。在实施例中,调节剂促进从新DNA甲基化。例如,在此描述的调节剂可以具有从新DNA甲基转移酶(DNMT)(例如,DNMT3a、DNMT3b、DNMT3L)活性或调节从新DNMT(例如,DNMT3a、DNMT3b、DNMT3L)活性,例如,以产生DNA甲基化模式(例如,在发育早期)。DNA中的表观遗传改变(例如,甲基化)可以通过本领域已知或如在此描述的方法进行评估。用于检测DNA甲基化的示例性方法包括,例如甲基化特异性PCR(MSP)、全基因组亚硫酸氢盐测序(BS-Seq)、HELP(通过连接介导的PCR的HpaII小片断富集(HpaIItinyfragmentEnrichmentbyLigation-mediatedPCR))测定、芯片上芯片(ChIP-on-chip)测定、限制性标记的基因组扫描、甲基化DNA免疫沉淀反应(MeDIP)、亚硫酸氢盐处理的DNA的焦磷酸测序、针对DNA腺嘌呤甲基转移酶活性的分子断裂光测定(molecularbreaklightassayforDNAadeninemethyltransferaseactivity)、甲基化灵敏性Southern印迹(methylsensitiveSouthernBlotting)、使用仅含有甲基结合结构域(MBD)的甲基化CpG结合蛋白(MBP)和融合蛋白将天然DNA分离成甲基化和未甲基化部分。在实施例中,调节剂切割DNA。例如,调节剂可以催化DNA骨架中磷酸二酯键的水解切割。在实施例中,调节剂(例如,DNA酶I)优先地在邻近嘧啶核苷酸的磷酸二酯键处切割DNA,由此产生5’-磷酸盐/酯-封端的多核苷酸,在3’位置上有游离羟基基团。在实施例中,调节剂(例如,DNA酶II)水解DNA中的脱氧核糖核苷酸连接,由此产生具有3’-磷酸盐/酯的产物。在实施例中,调节剂包括脱氧核糖核酸内切酶活性。在实施例中,调节剂包括外切脱氧核糖核酸酶活性(例如,具有3'至5'或5'至3'外切脱氧核糖核酸酶活性)。在实施例中,调节剂识别特异性DNA序列(例如,限制性酶)。在实施例中,调节剂不以序列特异性方式切割DNA。调节剂可以切割单链DNA(例如,具有切口酶活性)、双链DNA、或两者。在实施例中,调节剂影响(例如,改变或保持)三级或四级DNA结构。例如,在此描述的调节剂可以调节三级结构(例如,偏手性(右或左)、螺旋转角的长度、每周的碱基对数目、和/或大沟和小沟之间的尺寸差异)。在实施例中,调节剂介导B-DNA、A-DNA、和/或Z-DNA的形成。在此描述的调节剂还可以调节四级结构(例如,DNA与其他分子(DNA或非DNA分子(例如,组蛋白))的相互作用,例如,以染色质的形式)。在实施例中,介导或修饰三级或四级DNA结构的调节剂包括DNA解旋酶活性或调节DNA解旋酶活性。在实施例中,调节剂促进或抑制DNA损伤响应和/或修复。例如,调节剂可以促进一种或多种DNA损伤响应和修复机制(例如,直接逆转、碱基切除修复(BER)、核苷酸切除修复(NER)(例如,全基因组修复(GG-NER)、转录-偶联修复(TC-NER))、错配修复(MMR)、非同源末端连接(NHEJ)、微同源性介导的末端连接(MMEJ)、同源重组、和/或跨损伤合成(TLS))。在实施例中,调节剂促进损伤识别的步骤。在实施例中,调节剂促进DNA修复的步骤。异常DNA损伤修复与各种疾病和病症(例如,老化、遗传性DNA修复障碍、以及癌症)相关。例如,可增加癌症风险的DNA修复基因突变包括,例如,BRCA1和BRCA2(例如,参与双链断裂和子链缺口的同源重组修复(HRR),例如,在乳癌和卵巢癌中);ATM(例如,不同突变降低HRR、单链退火(SSA)、NHEJ或同源定向DSBR(HDR),例如,在白血病、淋巴瘤以及乳癌中)、NBS(例如,参与NHEJ,例如,在淋巴性恶性肿瘤中);MRE11(例如,参与HRR,例如,在乳癌中);BLM(例如,参与HRR,例如,在白血病、淋巴瘤、结肠、乳房、皮肤、外耳、舌、食道、胃、扁桃体、喉、肺、以及子宫癌中);WRN(例如,参与HRR、NHEJ、长补丁BER,例如,在软组织肉瘤、结肠直肠、皮肤、甲状腺、和胰腺癌中);RECQ4(RECQL4)(例如,参与HRR,例如,引起罗-汤二氏综合征(RTS)、RAPADILINO综合征或巴-格综合征(BallerGeroldsyndrome)、皮肤癌(包括基底细胞癌、鳞状细胞癌、和博文氏病);FANCA、FANCB、FANCC、FANCD1、FANCD2、FANCE、FANCF、FANCG、FANCI、FANCJ、FANCL、FANCM、以及FANCN(例如,参与HRR和TLS,例如,在白血病、肝肿瘤、在许多位置的实体瘤中),XPC和XPE(DDB2)(例如,参与NER(GGR类型),例如,在皮肤癌(黑素瘤和非黑色素瘤)中);XPA、XPB、XPD、XPF、以及XPG(例如,参与NER(GGR类型和TCR类型两者),例如,在皮肤癌(黑素瘤和非黑色素瘤)和中枢神经系统中);XPV(POLH)(例如,参与TLS,例如,在皮肤癌(黑素瘤和非黑色素瘤)中);hMSH2、hMSH6、hMLH1、和hPMS2(参与MMR,例如,在结肠直肠癌、子宫内膜癌和卵巢癌中);MUTYH(例如,参与A的BER与8OH-dG错配,连同与G、FapydG和C错配,例如,在结肠癌中)。例如,通过调节在此描述的一种或多种DNA损伤修复机制可以将调节剂用于治疗与异常DNA损伤修复相关的疾病或病症。在实施例中,调节剂选自或调节参与直接逆转的一种或多种蛋白(例如,甲基鸟嘌呤甲基转移酶(MGMT))。在实施例中,调节剂选自或调节参与BER的一种或多种蛋白(例如,DNA糖基化酶、AP内切核酸酶、DNA聚合酶、DNA连接酶)。在实施例中,调节剂选自或调节参与GG-NER的一种或多种蛋白(例如,XPC、HR23b、CAK、TFIIH、XPA、RPA、XPG、XPF、ERCC1、TFIIH、PCNA、RFC、ADNPol、以及连接酶I)。在实施例中,调节剂选自或调节参与TC-NER的一种或多种蛋白(例如,CSB、XPA、RPA、XPG、XPF、ERCC1、CSA-CNS、TFIIH、CAK、PCNA、RFC、连接酶I、以及RNA聚合酶II)。在实施例中,调节剂选自或调节一种或多种DNA错配修复蛋白。在实施例中,调节剂选自或调节参与NHEJ的一种或多种蛋白(例如,Ku70/80、DNA-PKcs、DNA连接酶IV、XRCC4、XLF、Artemis、DNA聚合酶μ、DNA聚合酶λ、PNKP、Aprataxin、以及APLF)。在实施例中,调节剂选自或调节参与同源重组的一种或多种蛋白(例如,如在此所描述的)。在实施例中,调节剂选自或调节参与TLS的一种或多种蛋白(例如,DNA聚合酶η、ι、κ、ζ、以及PCNA)。在实施例中,调节剂可以调节对DNA损伤的整体应答(例如、DNA损伤检查点和/或对DNA损伤的转录应答)。例如,DNA损伤检查点可以发生在G1/S和G2/M边界处。还可以存在内-S检查点。可以通过两种主激酶(ATM和ATR)调节检查点激活。ATM可以响应于DNA双链断裂以及染色质结构中的破坏,并且ATR可以响应于停滞的复制叉。这些激酶可以磷酸化信号转导级联系统中的下游靶,例如,由此导致细胞周期停滞。可以调节一类检查点介质蛋白(例如,BRCA1、MDC1、以及53BP1)(其将检查点激活信号传递至下游蛋白)。可以被调节的示例性下游蛋白包括,例如,p53、p21、和细胞周期蛋白/细胞周期蛋白依赖性激酶复合物。在实施例中,调节剂调节核DNA损伤响应和修复。在实施例中,调节剂调节线粒体DNA损伤响应和修复。在实施例中,调节剂促进或抑制DNA复制。例如,调节剂可以促进或抑制DNA复制的一个或多个阶段(例如,起始(例如,前复制复合物和/或起始复合物的装配)、延伸(例如,复制叉的形成)、以及终止(例如,复制叉屏障的形成))。在实施例中,调节剂选自或调节参与起始的一种或多种蛋白(例如,复制起始识别复合体(ORC)、CDC6、CDT1)、微染色体维持蛋白(例如,MCM2、MCM3、MCM4、MCM5、MCM6、MCM7、以及MCM10)、CDC45、CDK、DDK、CDC101、CDC102、CDC103、以及CDC105。在实施例中,调节剂选自或调节参与延伸的一种或多种蛋白(例如,DNA螺旋酶、DNA聚合酶、PCNA、CDC45-MCM-GINS螺旋酶复合物、以及复制因子C复合物)。在实施例中,调节剂选自或调节参与终止的一种或多种蛋白(例如,II型拓扑异构酶和端粒末端转移酶)。在实施例中,调节剂选自或调节一种或多种复制检查点蛋白(例如,ATM、ATR、ATRIP、TOPBP1、RAD9、HUS1、Rad1、以及CHK1)。在实施例中,有效载荷包括核DNA复制的调节剂。在实施例中,调节剂促进或抑制线粒体DNA复制。DNA复制的缺陷可以与不同疾病和病症(例如,癌症和神经疾病(例如,阿尔茨海默病))相关。线粒体DNA复制的缺陷也可以与疾病和病症(例如,mtDNA缺失综合征(例如,阿尔佩斯病(Alpers)或早期婴儿型肝脑综合征)以及mtDNA缺失障碍(例如,进行性眼外肌麻痹(PEO)、共济失调-神经病变、或线粒体神经消化道脑肌病(MNGIE)))相关。例如,通过调节如在此描述的DNA复制,可以将调节剂用于治疗与异常DNA复制相关的疾病或病症。在此描述了示例性的DNA结构的内源或外源调节剂,例如在表VI-3中。表VI-3在实施例中,有效载荷包括染色质组分的表观遗传状态或特征的调节剂(例如,染色质相关蛋白质(例如,组蛋白))。例如,表观遗传状态或特征可以包括组蛋白乙酰化、脱乙酰作用、甲基化(例如,单、二、或三甲基化)、脱甲基化、磷酸化、去磷酸化、泛素化(例如,单或聚泛素化)、去泛素化、苏素化、ADP-核糖基化、脱氨基作用、或其组合。在实施例中,调节剂选自或调节一种或多种组蛋白修饰酶。在实施例中,组蛋白修饰酶是组蛋白甲基转移酶(HMT)。在实施例中,组蛋白修饰酶是组蛋白去甲基转移酶(HDMT)。在实施例中,组蛋白修饰酶是组蛋白乙酰转移酶(HAT)。在实施例中,组蛋白修饰酶是组蛋白脱乙酰酶(HDAC)。在实施例中,组蛋白修饰酶是激酶。在实施例中,组蛋白修饰酶是磷酸酶。在实施例中,组蛋白修饰酶是泛素激活酶(E1)、泛素缀合酶(E2)、或泛素连接酶(E3)。在实施例中,组蛋白修饰酶是去泛素化(DUB)酶。在实施例中,基因转录的调节中涉及的组蛋白修饰被调制。例如,H3K4、H3K9、H3K27、H3K79、H4K20、H2BK5的单甲基化、H3K79的二甲基化、H3K4、H3K79、H3K36的三甲基化、和H3K9、H3K14、H3K27的乙酰化可以与转录激活相关联。作为另一个实例,H3K9、H3K27的二甲基化和H3K9、H3K27、H3K79、H2BK5的三甲基化可以与转录抑制相关联。在实施例中,调节剂(例如,在活性基因中)调节H3赖氨酸4(H3K4Me3)的三甲基化和/或H3赖氨酸36(H3K36Me3)的三甲基化。在实施例中,调节剂(例如,在抑制基因中)调节H3赖氨酸27(H3K27Me3)的三甲基化、H3赖氨酸9(H3K9Me2/3)的二和三甲基化、和/或H4赖氨酸20(H4K20Me3)的三甲基化。在实施例中,调节剂(例如,在干细胞中)调节活化(例如,H3K4Me3)和抑制(例如,H3K27Me3)标记二者。在实施例中,DNA损伤响应和修复中涉及的组蛋白修饰被调节。例如,在此描述的调节剂可以调节H2AX在丝氨酸139处的磷酸化和/或H3赖氨酸56的乙酰化(H3K56Ac)。异常组蛋白修饰与不同疾病和病症(例如,癌症、心血管疾病、以及神经退行性障碍)相关联。例如通过调控一种或多种组蛋白修饰(如在此所描述的),在此描述的调节剂可以用于治疗在此描述的疾病或病症。组蛋白中的表观遗传改变可以通过本领域已知或如在此描述的方法进行评估。用于检测组蛋白修饰的示例性方法包括,例如,使用抗体对抗修饰的组蛋白的染色质免疫沉淀反应(ChIP),例如,随后进行定量PCR。在此描述了示例性的染色质结构的内源或外源调节剂,例如在表VI-4中。表VI-4基因表达的调节剂在实施例中,有效载荷包括基因表达的调节剂。可以在体外、离体或体内递送基因表达的调节剂。在实施例中,有效载荷包括转录因子。转录因子可以结合至与它们所调节的基因相邻的特异DNA序列(例如,增强子或启动区)。例如,转录因子可以稳定或抑制RNA聚合酶与DNA结合、催化组蛋白的乙酰化或脱乙酰作用(例如,直接或通过用此类催化活性募集其他蛋白)、或募集辅激活因子或协阻抑蛋白至转录因子/DNA复合物。基因表达的调节剂还包括,例如,任何与转录因子直接或间接相互作用的蛋白。在实施例中,转录因子是通用转录因子,例如,是普遍存在的,并且与围绕许多、大多数或所有II类基因的转录起始位点的核心启动区相互作用。示例性通用转录因子包括,例如TFIIA、TFIIB、TFIID、TFIIE、TFIIF、以及TFIIH。在实施例中,转录因子是上游转录因子,例如,结合起始位点的上游以刺激或抑制转录。在实施例中,转录因子是特异性转录因子(例如,依赖于存在于基因附近的识别序列的转录因子)。示例性特异性转录因子包括,例如、SP1、AP-1、C/EBP、热休克因子、ATF/CREB、-Myc、OCT-1、以及NF-1。在实施例中,转录因子是组成型活性的(例如,通用转录因子、SP1、NF-1、或CCAAT)。在实施例中,转录因子是条件性活性的,例如,它需要激活例如发育的(例如,GATA、HNF、PIT-1、MyoD、Myf5、Hox、有翼螺旋(WingedHelix)、信号依赖性的(例如,细胞外配体(内分泌或旁分泌)依赖性的、细胞内配体(自分泌)依赖性的(例如,SREBP、p53、孤儿核受体)、细胞膜受体依赖性的(例如,常驻核因子(例如,CREB、AP-1、Mef2))或潜在细胞质因子(例如,STAT、R-SMAD、NF-κB、Notch、TUBBY、NFAT)。在此描述了其他示例性转录因子,例如在表VI-5中。表VI-5所选的转录因子,伴注解可变剪接的调节剂在实施例中,基因表达的调节剂调节剪接。例如,调节剂可以调节外显子跳跃或盒外显子、互斥的外显子、替代供体位点、替代受体位点、内含子保留或其组合。在实施例中,调节剂选自或调节一种或多种通用或可变剪接因子(例如,ASF1)。在实施例中,调节剂以浓度依赖性方式调节可变剪接(例如,影响剪接位点选择)。转录后修饰的调节剂在实施例中,基因表达的调节剂调节转录后修饰。例如,在此描述的调节剂可以促进或抑制5'加帽、3'多聚腺苷酸化、和RNA剪接。在实施例中,调节剂选自或调节参与5’加帽的一个或多个因子(例如,磷酸酶和鸟嘌呤核苷(guanosyl)转移酶)。在实施例中,调节剂选自或调节参与3’多聚腺苷酸化的一个或多个因子(例如,多聚腺苷酸聚合酶、切割和多聚腺苷酸化特异因子(CPSF)、以及多聚(A)结合蛋白)。在实施例中,调节剂选自或调节参与RNA剪接(例如,通用或可变剪接因子)的一个或多个因子。在此描述了示例性的转录后修饰的内源或外源调节剂,例如在表VI-6中。表VI-6抑制剂在实施例中,有效载荷包括以上所描述的有效载荷的抑制剂(例如,酶转录因子的抑制剂)。在实施例中,有效载荷包括任何上述有效载荷分子、方法、活性或机制的抑制剂。在实施例中,抑制剂是对在此描述的有效载荷分子之一具有特异性的抗体分子(例如,完整抗体或其抗原结合片段)。在实施例中,抑制剂是小分子化合物。在实施例中,抑制剂是核酸(例如,siRNA、shRNA、核酶、反义寡核苷酸、以及适体)。例如,有效载荷是靶(例如,转录因子、翻译后修饰酶、转录后修饰酶等,或编码前述各项中任一项的核酸序列)的抑制剂。直向同源物(Orthologs)如果在此叙述非人类基因或蛋白,应理解,本发明还包括人类对应物或直向同源物及其用途。VIIA.靶:细胞在多种细胞中,可以将Cas9分子和gRNA分子(例如,Cas9分子/gRNA分子复合物)用于操纵细胞(例如,动物细胞或植物细胞),例如,以递送有效载荷、或编辑靶核酸。典型地,eiCas9分子/gRNA分子复合物用于递送有效载荷并且eaCas9分子/gRNA复合物用于编辑或改变靶核酸的结构。可以在体外、离体地或在体内进行递送或编辑。在实施例中,通过编辑(例如,引入突变或校正)一个或多个(例如,如在此描述的)靶基因来操纵细胞。在实施例中,通过将包含一种或多种调节剂(例如,如在此描述的)的有效载荷递送至细胞(例如,至细胞基因组中的靶序列)来操纵细胞。在实施例中,(例如,在体内)调节一个或多个靶基因(例如,在此描述的一个或多个靶基因)的表达。在实施例中,(例如,在离体)调节一个或多个靶基因(例如,在此描述的一个或多个靶基因)的表达。在实施例中,操纵细胞从一种细胞类型至另一种细胞类型(例如,转化或分化)。在实施例中,操纵胰细胞成为β胰岛细胞。在实施例中,操纵成纤维细胞成为iPS细胞。在实施例中,操纵前脂肪细胞成为棕脂肪细胞。其他示例性细胞包括,例如,肌细胞、神经细胞、白细胞和淋巴细胞。在实施例中,细胞是患病或携带突变的细胞。可以操纵此类细胞以治疗疾病(例如,以校正突变、或改变细胞的表型(例如,以抑制癌细胞的生长))。例如,细胞与在此描述的一种或多种疾病或病症相关。在实施例中,细胞是癌症干细胞。例如,可以通过调节一种或多种选自下组的基因的表达来操纵癌症干细胞:TWIST(TF)、HIF-1α、HER2/neu、Snail(TF)、或Wnt。在实施例中,受操纵的细胞是正常细胞。在实施例中,受操纵的细胞是干细胞或祖细胞(例如,iPS、胚胎、造血、脂肪、生殖、肺、或神经干细胞或祖细胞)。在实施例中,受操纵的细胞适用于生产重组生物产品。例如,细胞可以是CHO细胞或成纤维细胞。在实施例中,受操纵的细胞是已经被工程化以表达蛋白的细胞。在实施例中,受操纵的细胞选自成纤维细胞、单核细胞前体、B细胞、外分泌细胞、胰祖细胞、内分泌祖细胞、成肝细胞、成肌细胞、或前脂肪细胞。在实施例中,操控(例如,转化或分化)细胞成为肌细胞、红细胞-巨核细胞、嗜酸性粒细胞、iPS细胞、巨噬细胞、T细胞、胰岛素β-细胞、神经元、心肌细胞、血细胞、内分泌祖细胞、外分泌祖细胞、导管细胞、腺泡细胞、α细胞、β细胞,δ细胞、PP细胞、肝细胞、胆管上皮细胞、或棕色脂肪细胞。在实施例中,细胞是肌细胞、红细胞-巨核细胞、嗜酸性粒细胞、iPS细胞、巨噬细胞、T细胞、胰岛β-细胞、神经元、心肌细胞、血细胞、内分泌祖细胞、外分泌祖细胞、导管细胞、腺泡细胞、α细胞、β细胞,δ细胞、PP细胞、肝细胞、胆管上皮细胞、或白色或棕色脂肪细胞。可以将在此描述的Cas9和gRNA分子递送至靶细胞。在实施例中,靶细胞是正常细胞。在实施例中,靶细胞是干细胞或祖细胞(例如,iPS、胚胎、造血、脂肪、生殖、肺、或神经干细胞或祖细胞)。在实施例中,靶细胞是CHO细胞。在实施例中,靶细胞是成纤维细胞、单核细胞前体、B细胞、外分泌细胞、胰祖细胞、内分泌祖细胞、成肝细胞、成肌细胞、或前脂肪细胞。在实施例中,靶细胞是肌细胞、红细胞-巨核细胞、嗜酸性粒细胞、iPS细胞、巨噬细胞、T细胞、胰岛β-细胞、神经元(例如,脑中的神经元(例如,纹状体(例如,中棘神经元)、大脑皮层、中央前回、海马体(例如,海马体的齿状回或CA3区域中的神经元)、颞皮质、扁桃体、额皮质、丘脑、小脑、髓质、壳核、下丘脑、顶盖、大脑脚盖或黑质中的神经元))、心肌细胞、血细胞、内分泌祖细胞、外分泌祖细胞、导管细胞、腺泡细胞、α细胞、β细胞,δ细胞、PP细胞、肝细胞、胆管上皮细胞、或棕色脂肪细胞。在实施例中,通过编辑(例如,引入突变或校正)一个或多个靶基因和/或调节一个或多个靶基因的表达来离体操纵靶细胞,并且施用于受试者。可以被操纵的示例性细胞以及可以被调节的示例性基因描述于表VII-8中。表VII-8表VII-9:示例性用于操纵的细胞胰细胞(例如,β细胞)肌细胞脂肪细胞前脂肪细胞神经细胞血细胞白细胞淋巴细胞B细胞T细胞表VII-10:示例性用于操纵的干细胞胚胎干细胞非胚胎干细胞造血干细胞脂肪干细胞生殖干细胞肺干细胞神经干细胞表VII-11:示例性用于操纵的癌细胞肺癌细胞乳癌细胞皮肤癌细胞脑癌细胞胰腺癌细胞造血细胞癌细胞肝癌细胞肾癌细胞卵巢癌细胞表VII-12:示例性用于操纵的非人类细胞植物细胞,例如,作物细胞,例如,玉米、小麦、大豆、柑橘或蔬菜细胞动物细胞,例如,奶牛、猪、马、山羊、狗或猫细胞在此描述了示例性的癌症干细胞(CSC)的内源或外源调节剂,例如在表VII-13中。表VII-13Cas9分子和gRNA分子(例如,Cas9分子/gRNA分子复合物)可以用于操纵细胞(例如,在此描述的细胞),例如,以递送有效载荷、或编辑靶核酸,例如,以增加细胞移植,例如,以实现细胞稳定移植入天然微环境中。可以操纵移植细胞、天然微环境中的细胞、或二者。典型地,eiCas9分子/gRNA分子复合物用于递送有效载荷并且eaCas9分子/gRNA复合物用于编辑或改变靶核酸的结构。例如,可以通过以下方式来实现细胞移植效率的增加:增加在此描述的一种或多种基因(例如,归巢基因、粘附基因、存活基因、增殖基因、免疫逃避基因、和/或细胞保护基因)的表达、和/或减少在此描述的一种或多种基因(例如,静止基因、死亡/细胞凋亡基因、和/或免疫识别基因)的表达。在实施例中,基因编码归巢受体或粘附分子(例如,参与指导细胞朝向与组织表达的配体相关联的组织或富含可溶性细胞因子的区域迁移)。在实施例中,归巢受体或粘附分子在淋巴细胞(例如,淋巴细胞或造血干细胞)上表达。在实施例中,组织是骨髓(例如,细胞外基质或基质细胞)。在实施例中,归巢受体或粘附分子是C-X-C趋化因子受体类型4(CXCR4,又称为融合素或CD184)。例如,上调CXCR4在造血干细胞上的表达。在实施例中,配体是基质衍生因子-1(SDF-1,又称为CXCL12)。在实施例中,归巢受体或粘附分子是CD34。在实施例中,配体是地址素(又称为粘膜血管地址素细胞粘附分子1(MAdCAM-1))。在实施例中,基因编码结合至配体(例如,趋化因子或细胞因子)的受体(例如,在干细胞或祖细胞上表达的)。例如,受体可以与细胞的干细胞性(stemness)和/或将细胞吸引至所希望的微环境中相关联。在实施例中,受体在造血干细胞上表达。在实施例中,受体在神经干细胞上表达。在实施例中,受体是肥大/干细胞生长因子受体(SCFR,又称为原癌基因c-Kit或酪氨酸-蛋白激酶盒或CD117)。在实施例中,配体是干细胞因子(SCF,又称为青灰因子或c-kit配体)。在实施例中,受体是骨髓增生性白血病病毒癌基因(MPL,又称为CD110)。在实施例中,配体是促血小板生成素(TPO)。在实施例中,基因编码标志物(例如,其促进表达该标志物的细胞的存活或增殖、或允许表达该标志物的细胞逃避免疫应答或被保护免受不良环境(例如,导致细胞死亡)的影响)。例如,表达CD47(又称为整联蛋白相关蛋白(IAP))的细胞可以避免吞噬作用(例如,在细胞迁移过程中)。作为另一个实例,可以保护表达BCL2的细胞防止细胞凋亡。在实施例中,细胞是血细胞(例如,红细胞或白细胞)。在实施例中,细胞是造血干细胞或祖细胞。在实施例中,上调CXCR4、SDF1、CD117、MPL、CD47、或BCL2中的一种或多种在干细胞或祖细胞(例如,造血干细胞或祖细胞中)的表达。Cas9分子和gRNA分子(例如,Cas9分子/gRNA分子复合物)可以用于操纵细胞(例如,在此描述的细胞),例如,以递送有效载荷、或编辑靶核酸,例如,以操纵(例如,指示)靶细胞的命运(例如,以更好靶向感兴趣的特异性细胞类型和/或作为一种自杀机制)。典型地,将eiCas9分子/gRNA分子复合物用于递送有效载荷和/或将eaCas9分子/gRNA复合物用于编辑或改变靶核酸的结构。可以被调节的示例性基因包括,例如,化疗抗性基因、化疗敏感基因、抗生素抗性基因、抗生素敏感基因、以及细胞表面受体基因(例如,如在此描述的)中的一种或多种。在实施例中,调节化疗抗性基因、化疗敏感基因、抗生素抗性基因、和/或抗生素敏感基因,例如,这样使得可以(例如,通过化学治疗或抗生素治疗)减少或去除修饰或不希望的细胞(例如,修饰的或不希望的造血干细胞(HSC)(例如,在骨髓中))。例如,可以将调节(例如,增加)化疗抗性或抗生素抗性的基因或基因产物递送到细胞中。在化学治疗或抗生素治疗之后,通过化疗或抗生素抗性基因或基因产物修饰的细胞相比未经过这种修饰的细胞可以具有更高(例如,至少高出约2、3、4、5、6、7、8、9、10、25、50、75、或100倍)的存活率。在实施例中,在体内进行化学治疗或抗生素治疗。在实施例中,在体外或离体进行化学治疗或抗生素治疗。在实施例中,化疗抗性基因是编码O6-烷基鸟嘌呤DNA烷基转移酶(MGMT)的基因。在实施例中,化疗包括替莫唑胺。作为另一个实例,可以将调节(例如,增加)化疗敏感性或抗生素敏感性的基因或基因产物递送到细胞中。赋予化疗敏感性或抗生素敏感性的基因或基因产物可以被用作自杀信号,例如,引起细胞的细胞凋亡。在化学治疗或抗生素治疗之后,通过化疗或抗生素敏感性基因或基因产物修饰的细胞相比未经过这种修饰的细胞可以具有更低(例如,至少低约2、3、4、5、6、7、8、9、10、25、50、75、或100倍)的存活率。在实施例中,在体内进行化学治疗或抗生素治疗。在实施例中,在体外或离体进行化学治疗或抗生素治疗。可以将在此描述的方法用于选择或富集具有修饰或所希望的表型(例如,化疗抗性和/或抗生素抗性)的细胞。也可以将在此描述的方法用于去除或减少具有修饰的或不希望的表型(例如,化疗敏感性和/或抗生素敏感性)的细胞数目。例如,可以去除表现出不希望的效果(例如,脱靶效应或癌症表型(例如,由在不希望的基因组位置或细胞类型中核酸的编辑引起的))的细胞。在实施例中,调节细胞表面受体基因(例如,增加或降低细胞表面受体的表达),这样使得可以将治疗剂(例如,治疗性抗体)用于靶向细胞表面受体表达增加或降低的细胞(例如,以杀死细胞)中。在实施例中,细胞表面受体是CD20。在实施例中,治疗性抗体是利妥昔单抗。在实施例中,细胞表面受体选自,例如,CD52、VEGFR、CD30、EGFR、CD33、或ErbB2。在实施例中,治疗性抗体选自,例如,阿仑单抗、利妥昔单抗、西妥昔单抗、帕尼单抗(Panitumumab)、吉妥珠单抗、和曲妥珠单抗。在实施例中,细胞表面受体是CD52并且治疗性抗体是阿仑单抗。在实施例中,基因编码VEGF并且治疗性抗体是利妥昔单抗。在实施例中,细胞表面受体是EGFR并且治疗性抗体是西妥昔单抗或帕尼单抗。在实施例中,细胞表面受体是CD33并且治疗性抗体是吉妥珠单抗。在实施例中,细胞表面受体是ErbB2并且治疗性抗体是曲妥珠单抗。在实施例中,诱导或阻抑Cas9分子和/或gRNA分子的表达或活性,例如,当用药物(例如,抗生素)处理细胞时(例如,在体内)。例如,对Cas9分子和/或gRNA分子表达或活性的诱导或阻抑可以被用来减少毒性和/或脱靶效应(例如,在某些组织中)。在实施例中,Cas9分子、gRNA分子或两者的表达是由诱导型启动子所驱动的。在实施例中,药物(例如,抗生素)与Cas9分子和/或gRNA分子的结合活化或抑制Cas9分子和/或gRNA分子的活性。在实施例中,局部施用药物(例如,抗生素)。在实施例中,用药物(例如,抗生素)治疗的细胞位于眼、耳、鼻、口腔、或皮肤中。Cas9分子和gRNA分子(例如,Cas9分子/gRNA分子复合物)可以用于操纵细胞(例如,在此描述的细胞),例如,以递送有效载荷、或编辑靶核酸,例如,在定向酶前药疗法(DEPT)中。典型地,eiCas9分子/gRNA分子复合物用于递送有效载荷并且eaCas9分子/gRNA复合物用于编辑或改变靶核酸的结构。定向酶前药疗法(DEPT)使用人工引入身体中的酶以将处于体内所希望的位置的前药(这些前药没有或具有低生物活性)转化成活性形式。例如,可以通过仅在所希望的位点实现高水平的活性药物,将定向酶前药疗法用于减少药物的全身性毒性。在实施例中,将前药转化所需的酶或编码此类酶的基因递送至靶细胞(例如,癌细胞)。例如,可以通过在此描述的方法递送酶或基因。在实施例中,通过病毒载体递送编码前药转化所需酶的基因。Cas9分子和gRNA分子(例如,Cas9分子/gRNA分子复合物)可以用于操纵细胞(例如,在此描述的细胞),例如,以递送有效载荷、或编辑靶核酸,例如,以改进免疫疗法(例如,癌症免疫疗法)。典型地,eiCas9分子/gRNA分子复合物用于递送有效载荷并且eaCas9分子/gRNA复合物用于编辑或改变靶核酸的结构。可以被调节的示例性基因包括,例如在此描述的一种或多种基因,例如,PD-L1和/或PD-L2基因。VIIB.靶标:通路和基因Cas9分子和gRNA分子(例如,Cas9分子/gRNA分子复合物)可以用来操纵一种、两种、三种或更多种元件或通路,例如通过靶向编码通路的RNA或蛋白质的序列、或靶向控制通路的RNA或蛋白质表达的序列。在实施例中,操纵第一通路的元件和第二通路的元件。在实施例中,操纵包括将有效载荷递送至靶核酸或编辑靶核酸。典型地,eiCas9分子/gRNA分子复合物用于递送有效载荷并且eaCas9分子/gRNA复合物用于编辑或改变靶核酸的结构。可以在体外、离体地或在体内进行递送或编辑。可以上调或下调通路的元件,例如可以增加或降低编码通路的蛋白质的基因的表达。增加或降低可以通过以下方式实现:递送有效载荷(例如,转录因子或转录因子抑制剂)或编辑靶核酸(例如,使用模板核酸来改变序列,例如在例如控制区或编码区中校正或引入突变)。示例性通路包括与以下相关的通路:细胞增殖;细胞周期;碳代谢;能量代谢;糖酵解,厌氧呼吸,厌氧呼吸;跨膜信号转导,血管生成,DNA复制或修复或者疼痛。在此讨论了示例性通路和基因。应当理解的是,通路或基因可以与细胞或生物功能的一个或多个方面相关,例如,通路或基因可以涉及癌症和能量代谢两者。通路或基因的操纵不限于以下列出的细胞或生物功能。在实施例中,通路与一种或多种疾病或病症相关。在实施例中,该通路与癌症相关,例如与增殖(例如,RAF通路)、逃避生长阻抑物、抵抗细胞死亡、使能复制型永生/衰老、诱导血管生成、激活侵袭和转移、能量代谢和逃避、癌干细胞、细胞因子-受体相互作用或肿瘤抑制因子相关。在实施例中,该通路与细胞周期控制相关。在实施例中,该通路与血管生成相关。在此描述了与癌症相关的通路和基因,例如包括以下项:表VII-14.来自所选通路的靶基因表VII-15可以靶向提供于表VII-16中的任何以下癌症相关基因。表VII-16与能量代谢相关的示例性通路和基因提供于表VII-17中。可以使用如在此描述的CRISPR/Cas9调节在此披露的示例性代谢靶标。调节可以用来敲低感兴趣的基因,校正基因中的缺陷或突变,或者用来激活感兴趣的基因。表VII-17在实施例中,在此(例如,在表VII-17中)描述的通路和基因还与糖尿病、肥胖症和/或胆固醇和脂质相关。与细胞周期相关的示例性通路和基因提供于表VII-18中。表VII-18通过其功能表征的示例性细胞周期基因提供于表VII-19中。表VII-19与血管生成相关的示例性通路和基因描述、提供于表VII-20中。表VII-20与线粒体功能相关的示例性通路和基因提供于表VII-24中。表VII-24与DNA损伤和基因组不稳定性相关的通路和基因包括提供于表VII-21中的以下甲基转移酶、组蛋白甲基化、解旋酶活性、核苷酸切除修复、重组修复或错配修复。还参见表VI-22。表VII-21表VII-22可以通过编辑或有效载荷递送来靶向此表中的与疼痛相关的基因(包括受体和离子载体)。在此描述了与疼痛相关的通路和基因,例如包括表VII-23中的以下那些。表VII-23VIII.靶标:与致病生物相关的障碍Cas9分子(典型地是eiCas9分子或eaCas9分子)和gRNA分子(例如eiCas9分子/gRNA分子复合物,例如eaCas9分子/gRNA分子复合物)可以用来治疗或控制与致病生物相关的疾病,例如用来治疗感染性疾病。在实施例中,通过编辑(例如,校正)例如生物或受试者的一个或多个靶基因来治疗该感染性疾病。在实施例中,通过向致病生物的细胞或向受试者的受感染细胞(例如,向靶基因)递送一种或多种有效载荷(例如,如在此描述的)来治疗该感染性疾病。在实施例中,靶基因在感染性病原体中。示例性的传染性病原体包括例如病毒、细菌、真菌、原生动物或多细胞寄生虫。在实施例中,靶基因在宿主细胞中。例如,宿主细胞中的靶基因的调节可以产生对感染性病原体的抗性。可以调节感染性病原体的生命周期的任何阶段(例如,进入、复制、潜伏期)中涉及的宿主基因。在实施例中,靶基因编码感染性病原体的细胞受体或辅助受体。在实施例中,感染性病原体是病毒,例如在此描述的病毒,例如HIV。在实施例中,靶基因编码HIV的辅助受体,例如CCR5或CXCR4。可以通过在此描述的分子和方法治疗的示例性的感染性疾病包括例如AIDS、甲型肝炎、乙型肝炎、丙型肝炎、单纯性疱疹、HPV感染或流感。示例性靶标提供于表VIII-1中。提供了疾病和致病生物。表VIII-1AIDS/HIVHIV基因组结构元件长末端重复(LTR)是指侧翼于整合的前病毒的基因组的DNA序列。它包含重要的调节区,尤其是用于转录起始和聚腺苷酸化的那些。病毒反式激活的靶序列(TAR),即Tat蛋白和细胞蛋白的结合位点;由HIV-1中的病毒mRNA的大约前45个核苷酸(或HIV-2和SIV中的前100个核苷酸)组成。TARRNA与侧部凸起形成发夹茎环结构;凸起是Tat结合和功能所必需的。Rev响应元件(RPE)是指在HIV-1的env区内编码的RNA元件。它由大约200个核苷酸组成(从HIV-1中的转录开始,位置7327至7530,跨越gp120和gp41的边界)。RRE是Rev功能所必需的;它包含Rev的高亲和性位点;总计,在RRERNA中存在Rev的大约七个结合位点。其他慢病毒(HIV-2、SIV、visna、CAEV)在env内在类似位置中具有类似的RRE元件,同时HTLV在其LTR内具有用于相同目的的类似RNA元件(RXRE);RRE是Rev蛋白的结合位点,而RXRE是Rex蛋白的结合位点。RRE(和RXRE)形成复杂的二级结构,这是特异性蛋白质结合所必需的。Psi元件(PE)是一组在Gag起始密码子之前并且与之重叠的4个茎环结构,它们是由存在于Gagp7MC蛋白中的半胱氨酸组氨酸盒所识别的位点,该半胱氨酸组氨酸盒是具有规范序列CysX2CysX4HisX4Cys(SEQIDNO:41)的保守基序。Psi元件存在于非剪接的基因组转录物中,但是不存在于剪接的病毒mRNA中。SLIP(一个TTTTTT滑动位点(slipperysite))随后是茎环结构,负责将Gag阅读框外的-1核糖体移码调节进Pol阅读框。顺式作用抑制序列(CRS)在不存在Rev情况下被假定抑制结构蛋白表达。在HIV-1的pol区内标定出一个这样的位点。确切功能尚未被限定;剪接位点已经被假定充当CRS序列。在HIV-1和其他复杂逆转录病毒的结构基因内发现了抑制性/不稳定性RNA序列(INS)。多种INS元件存在于基因组内并且可以独立地发挥作用;被最佳表征的元件之一跨越HIV-1的gag区中的核苷酸414至631。已经通过功能测定将INS元件定义为在转录后抑制表达的元件。显示RNA元件的突变可导致INS失活和基因表达的上调。基因和基因产物复制所必不可少的基因组区(GAG)编码衣壳蛋白(群特异性抗原)。前体是p55肉豆蔻基化(myristylated)蛋白,该蛋白被病毒蛋白酶加工为p17(基质)、p24(衣壳)、p7(核壳)和p6蛋白。Gag与进行病毒装配的质膜缔合。55kDaGag前体被叫做组装蛋白(assemblin),用以指示其在病毒装配中的作用。基因组区POL编码病毒酶蛋白酶、逆转录酶、RNA酶以及整合酶。这些酶是作为Gag-Pol前体多蛋白产生的,该多蛋白由病毒蛋白酶进行加工;Gag-Pol前体通过核糖体移码在gag的末端附近产生。病毒糖蛋白(例如,ENV)作为前体(gp160)而产生,该前体被加工以给出外部糖蛋白gp120和跨膜糖蛋白gp41的非共价复合物。成熟的gp120-gp41蛋白通过非共价相互作用而结合并且在细胞表面上缔合为三聚体。可以发现在培养基中大量释放的gp120。gp120包含CD4受体以及充当HIV-1的辅助受体的七个跨膜结构域趋化因子受体的结合位点。HIV基因表达的反式激活因子(TAT)是HIV基因表达的两个必需病毒调节因子(Tat和Rev)之一。已知两种形式,72个氨基酸的Tat-1外显子(次要形式)和86个氨基酸的Tat-2外显子(主要形式)。在持久受感染的细胞中发现了低水平的两种蛋白。通过免疫荧光已经将Tat主要定位在核仁/细胞核。它通过与TARRNA元件结合并且激活从LTR启动子的转录起始和延长而起作用,从而防止LTRAATAAA聚腺苷酸化信号导致转录提前终止和聚腺苷酸化。它是已知与RNA而非DNA相互作用的第一个真核转录因子并且可能与原核抗终止因子具有相似性。可以发现胞外Tat并且其可以被培养中的细胞吸收。HIV表达的第二个必需调节因子是REV。作为主要定位在核仁/细胞核中的19kDa磷蛋白,Rev通过与RRE结合并且促进核输出、含有RRE的未剪接的病毒mRNA的稳定和利用起作用。Rev被认为是慢病毒的在功能上最具保守性的调节蛋白。Rev在细胞核与细胞质之间快速循环。其他病毒感染性因子(VIF)是典型地23kDa的碱性蛋白。促进感染性但是不促进病毒粒子的产生。在不存在Vif的情况下,产生的病毒粒子是有缺陷的,然而病毒的细胞间传输并不受显著影响。发现于几乎所有慢病毒中,Vif是一种胞浆蛋白,以可溶性胞质形式和膜相关形式两者存在。Vif的后一形式是一种外周膜蛋白,该蛋白与细胞膜的胞质侧紧密缔合。在2003年,发现Vif阻止细胞APOBEC-3G蛋白的作用,该蛋白使细胞质中的DNA:RNA异源双链体脱氨基。病毒蛋白R(VPR)是一种96氨基酸(14kDa)蛋白,其被掺入病毒体中。它与Pr55Gag前体的p6Gag部分相互作用。在细胞中检测到的Vpr被定位到细胞核。Vpr的建议功能包括以预整合复合物的核输入、细胞生长停滞、细胞基因的反式激活以及细胞分化的诱导为靶标。在HIV-2、SIV-SMM、SIV-RCM、SIV-MND-2和SIV-DRL中,Vpx基因显然是Vpr基因复制事件的结果,可能是通过重组。病毒蛋白U(VPU)对于HIV-1、SIVcpz(相对HIV-1最接近的SIV)、SIV-GSN、SIV-MUS、SIV-MON和SIV-DEN而言是独特的。在HIV-2、SIV-SMM或其他SIV中不存在类似基因。Vpu是一种16kDa(81氨基酸)的I型整合膜蛋白,具有至少两种不同的生物功能:(a)降解内质网中的CD4,以及(b)增强病毒体从受HIV-1感染的细胞的质膜中的释放。Env和Vpu由双顺反子mRNA表达而来。Vpu可能具有N-末端疏水性膜锚定点和亲水性部分。它在位置Ser52和Ser56处被酪蛋白激酶II磷酸化。Vpu涉及在Env成熟中并且未在病毒体中发现。已经发现Vpu增加受HIV-1感染的细胞对Fas杀伤的敏感性。NEF是一种由位于灵长类动物慢病毒的30端的ORF产生的多功能27-kDa肉豆蔻基化蛋白。其他形式的Nef是已知的,包括非肉豆蔻基化变体。Nef主要是胞浆的并且经由连接至第二个保守氨基酸(Gly)的肉豆蔻基残基与质膜缔合。也已经在细胞核中鉴定了Nef并且发现其在一些实验中与细胞骨架缔合。作为有待在受感染的细胞中产生的前几种HIV蛋白之一,它是辅助蛋白中最具免疫原性的。HIV和SIV的nef基因在体外是可有可无的,但是为体内的有效病毒传播和疾病进展所必需。Nef是高病毒载荷的维持和AIDS在猕猴中的发展所必需的,并且已经在一些长期受HIV-1感染的存活体中检测到具有缺陷Nef的病毒。Nef下调CD4(主要的病毒受体)和MHCI类分子,并且这些功能与该蛋白的不同部分映射。Nef与宿主细胞信号转导和网格蛋白依赖性蛋白分选通路的组分相互作用。它增加病毒感染性。Nef包含PxxP基序,这些基序与Src激酶的子集的SH3结构域结合并且为HIV的增强的生长所需但是不为CD4的下调所需。VPX是发现于HIV-2、SIV-SMM、SIV-RCM、SIV-MND-2和SIV-DRL中的并且未发现于HIV-1或其他SIV中的12kDa的病毒体蛋白。这个辅助基因是HIV-1vpr的同系物,并且具有Vpx的病毒携带vpr和vpx两者。Vpx功能相对于Vpr并未完全阐明;两者都通过与Gagp6相互作用以与Gag蛋白可比较的水平掺入病毒体中。Vpx是SIV-SMM在PBMC中有效复制所必需的。在受SIV感染的动物中发展成AIDS和死亡可以发生在不存在Vpr或Vpx的情况下。缺乏vpr和vpx两者的双突变型病毒被减毒,而单突变体并未被减毒,表明Vpr和Vpx的涉及病毒致病性的功能是冗余的。甲型肝炎病毒靶序列5’非翻译区包含IRES-内部核糖体进入位点基因组的P1区-衣壳蛋白VP1VP2VP3VP4基因组的P2区2A2B2C基因组的P3区3A3B3C-病毒蛋白酶3D-RNA聚合酶乙型肝炎病毒靶序列产生编码全部HCV蛋白的前体多肽并且然后将其剪接成功能蛋白。以下是编码的蛋白(编码区):C-核心蛋白-编码区由Pre-C和核心编码区组成X-功能不清楚,但是怀疑在病毒转录过程的激活中发挥作用P-RNA聚合酶S-表面抗原-编码区由Pre-S1、Pre-S2和表面抗原编码区组成丙型肝炎病毒靶序列产生编码全部HCV蛋白的前体多肽并且然后将其剪接成功能蛋白。以下是编码的蛋白(编码区):RES-非编码内部核糖体进入位点(在多蛋白编码序列的5’)3’非编码序列-C区-编码p22核壳蛋白E1区-编码gp35包膜糖蛋白-在细胞进入中是重要的E2区-编码gp70包膜糖蛋白-在细胞进入中是重要的NS1-编码p7-不是复制所必需的但是在病毒形态发生中是关键的NS2-编码p23,一种具有蛋白酶活性的跨膜蛋白NS3-编码具有丝氨酸蛋白酶和RNA解旋酶活性两者的p70NS4A-编码p8辅因子NS4B-编码p27辅因子-在其他病毒蛋白的募集中是重要的NS5A-编码p56/58,一种干扰素抗性蛋白-在病毒复制中是重要的NS5B-编码RNA聚合酶单纯性疱疹病毒靶序列HPV靶序列甲型流感病毒靶序列甲型流感病毒是感染人类的最常见流感病毒。甲型流感病毒体由编码11-14种蛋白的8种不同的单链RNA区段构成。这些区段的序列可以变化,其中大多数变化发生在血球凝集素(H或HA)表面蛋白和神经氨酸酶(NA或N)中。这八个RNA区段(和它们编码的蛋白质)是:HA-编码血球凝集素(需要约500分子的血球凝集素构成一个病毒体)。NA-编码神经氨酸酶(需要约100分子的神经氨酸酶构成一个病毒体)。NP编码核蛋白。M通过使用来自同一RNA区段的不同阅读框编码两种基质蛋白(M1和M2)(需要约3000个基质蛋白分子构成一个病毒体)。M42通过可变剪接产生而来,并且可以部分地代替M2。NS通过使用来自同一RNA区段的不同阅读框编码两种不同的非结构蛋白(NS1和NEP)。PA编码RNA聚合酶;有时通过核糖体跳跃以+1移码读到下一个终止密码子而形成替代形式。PB1通过使用来自同一RNA区段的不同阅读框编码RNA聚合酶,加上从替代起始位点读取的两种其他转录物,被称为PB1-N40和PB1-F2蛋白(诱导凋亡)。PB2编码RNA聚合酶。结核分枝杆菌靶序列在此描述的方法和组合物可以用于靶向结核分枝杆菌和治疗患有结核分枝杆菌感染的受试者。其他在实施例中,靶基因与多重耐药(MDR)相关,例如在细菌感染中。感染性病原体在获得多重耐药中可以使用多种机制,例如不再依赖糖蛋白细胞壁、抗生素的酶失活、对抗生素的细胞壁渗透性降低、抗生素的靶位点改变、用于除去抗生素的外排泵、作为应激应答的突变率增加或其组合。IX.靶标:基因编辑/校正候选Cas9分子、候选gRNA分子和/或候选Cas9分子/gRNA分子复合物可以用来调节负责疾病的基因(例如,突变的基因)。在实施例中,通过编辑或校正靶基因来调节该基因,例如,如在此描述的。在实施例中,通过向靶基因递送细胞内的一种或多种调节剂/效应物(例如,如在此描述的)来调节人类基因。例如,可以在体外、离体地或在体内调节在此描述的基因。表IX-1.可以在治疗上靶向基因的所选疾病。三核苷酸重复病(又称三联体重复病、三核苷酸重复扩增障碍、三联体重复扩增障碍或密码子重复障碍)是一组由三核苷酸重复扩增引起的遗传性障碍,例如,某些基因中的三核苷酸重复超过正常和/或稳定阈值的突变类型。突变可以是发生在多个或所有基因组序列中的不稳定微卫星重复序列的子集。突变可以增加重复计数(例如,导致额外的或扩增的重复)并且产生缺陷基因,例如产生异常蛋白。三核苷酸重复可以被分类为插入突变或单独类别的突变。候选Cas9分子、候选gRNA分子和/或候选Cas9分子/gRNA分子复合物可以用来调节一种或多种与三核苷酸重复病相关的基因(例如,突变的基因),例如通过降低(例如,去除)额外的或扩增的重复的数目,这样使得可以产生正常的或野生型基因产物(例如,蛋白质)。示例性三核苷酸重复病和三核苷酸重复病中所涉及的靶基因示于表IX-1A中。表IX-1A.示例性三核苷酸重复病和三核苷酸重复病中所涉及的靶基因示例性靶基因包括在多种疾病或病症中所涉及的那些基因,例如,癌症(例如,激酶)、能量代谢、囊性纤维化(例如,CFTR)、色盲、血色病、血友病、苯丙酮尿症、多囊肾病、镰状细胞病、泰萨二氏病、Siderius型X连锁智力低下综合征、溶酶体贮积症(例如,α-半乳糖苷酶A缺乏)、安德森-法布里病、弥漫性体血管角质瘤、CADASIL综合征、迟发性、多发性羧化酶缺乏、家族性小脑视网膜血管瘤、脑动脉病伴皮质下梗死和脑白质病、常染色体显性脑动脉病伴皮质下梗死和脑白质病、脑苷脂沉积综合征、舞蹈手足徐动自残高尿酸血症综合征、典型半乳糖血症、克罗恩病、纤维性狭窄、苯丙氨酸羟化酶缺乏病、法布里病、遗传性粪卟啉症、色素失调症、小头畸形、多囊肾病、雷特病、α-1抗胰蛋白酶缺乏、威尔森氏病、酪氨酸血症、移码相关疾病以及三联体重复病。另外的示例性靶基因包括与以下疾病相关的基因,包括例如,克里格勒-纳贾尔综合征(Crigler-Najjersyndrome)、糖原贮积病IV型(GSDIV型)、家族性噬血细胞性淋巴组织细胞增多症(FHL-穿孔素缺乏)、鸟氨酸氨甲酰转移酶缺乏(OTC缺乏)或其他尿素循环障碍、原发性高草酸尿症、莱伯(Leber)先天性黑朦(LCA)、巴藤病(Battendisease)、慢性肉芽肿病、威斯科特-奥尔德里奇综合征、亚瑟综合征(UsherSyndrome)以及血红蛋白病。克里格勒-纳贾尔综合征。克里格勒-纳贾尔综合征是一种由血液中的高水平胆红素表征的严重病症(高胆红素血症)。当红血细胞被分解时产生胆红素。只有在它在肝中经历化学反应之后这种物质才从体内去除,该化学反应将有毒形式的胆红素(未结合胆红素)转化为无毒形式(结合胆红素)。患有克里格勒-纳贾尔综合征的人在其血液中积累未结合胆红素(非结合性高胆红素血症)。克里格勒-纳贾尔综合征被分成两种类型。1型(CN1)是非常严重的而2型(CN2)是不太严重的。UGT1A1基因的突变可以引起克里格勒-纳贾尔综合征。这个基因提供用于制备胆红素尿苷二磷酸葡萄糖醛酸基转移酶(胆红素-UGT)酶的指令,该酶主要在肝细胞中发现,并且是将胆红素从体内去除所必需的。胆红素-UGT酶牵涉葡糖醛酸化,在葡糖醛酸化中该酶将葡糖醛酸传递给未结合胆红素,从而将它转化为结合胆红素。葡糖醛酸化使得胆红素在水中可溶,这样使得可以将它从体内去除。引起克里格勒-纳贾尔综合征的UGT1A1基因的突变导致胆红素-UGT酶的功能减少或缺失。患有CN1的人不具有酶功能,而患有CN2的人可以具有不到20%的正常功能。胆红素-UGT功能的损失降低未结合胆红素的葡糖醛酸化。这种有毒物质接着在体内积累,从而引起非结合性高胆红素血症和黄疸。糖原贮积病IV型。糖原贮积病IV型(又称GSDIV型、糖原病IV型、糖原分支酶缺乏症(GBED)、葡聚糖体病或支链淀粉病)是一种由称为糖原的复糖在身体的细胞中积累引起的遗传性障碍。累积的糖原在结构上是异常的并且损害某些器官和组织(尤其是肝脏和肌肉)的功能。GBE1基因的突变引起GSDIV。GBE1基因提供用于制备糖原分支酶的指令。这种酶牵涉糖原的生产,糖原是体内的储存能量的主要来源。引起GSDIV的GBE1基因突变导致糖原分支酶的短缺(缺乏)。其结果是,不适当地形成糖原。称为葡聚糖体的异常糖原分子在细胞中累积,导致损伤和细胞死亡。在GSDIV中,葡聚糖体在遍及全身的细胞中累积,但是肝细胞和肌细胞受影响最严重。肝脏中的糖原累积导致肝肿大并且干扰肝脏发挥功能。肌细胞不能分解糖原以产生能量导致肌无力和消瘦。通常,该障碍的严重性与产生的功能性糖原分支酶的量有关。具有致命的围产期神经肌肉类型的个体倾向于产生不到5%的可用酶,而具有儿童期神经肌肉类型的那些个体可以具有大约20%的酶功能。其他类型的GSDIV通常与5%至20%的工作酶相关。然而,这些估算值在不同类型之间会变化。家族性噬血细胞性淋巴组织细胞增多症。家族性噬血细胞性淋巴组织细胞增多症(FHL)是这样一种障碍,即其中免疫系统产生太多激活的免疫细胞(淋巴细胞),例如T细胞、自然杀伤细胞、B细胞以及巨噬细胞(组织细胞)。还产生了过量的细胞因子。免疫系统的这种过度激活引起发热并且损害肝脏和脾脏,导致这些器官增大。家族性噬血细胞性淋巴组织细胞增多症还破坏骨髓中的产血细胞,一种称为噬血细胞的过程。在家族性噬血细胞性淋巴组织细胞增多症中脑也可以受影响。除神经学问题之外,家族性噬血细胞性淋巴组织细胞增多症还可以引起心脏、肾脏和其他器官和组织的异常。受影响的个体还具有增加的患上造血细胞癌(白血病和淋巴瘤)的风险。家族性噬血细胞性淋巴组织细胞增多症可以由若干基因中的任何基因的突变引起。这些基因提供用于制备帮助破坏不再需要的淋巴细胞或使其失活的蛋白质的指令。通过控制激活的淋巴细胞的数目,这些基因帮助调节免疫系统功能。大约40%至60%的家族性噬血细胞性淋巴组织细胞增多症病例由PRF1或UNC13D基因的突变引起。数量较少的病例由其他已知基因(如STX11或STXBP2)的突变引起。引起家族性噬血细胞性淋巴组织细胞增多症的基因突变可以损害身体调节免疫系统的能力。这些变化导致这种病症的过度(exaggerated)免疫应答特征。鸟氨酸氨甲酰转移酶缺乏。鸟氨酸氨甲酰转移酶缺乏(OTC)是一种导致氨累积在血液中的遗传性障碍。OTC基因的突变引起鸟氨酸氨甲酰转移酶缺乏。鸟氨酸氨甲酰转移酶缺乏症属于一类称为尿素循环障碍的遗传病。尿素循环是发生在肝细胞中的一系列反应。它产生过量的氮(当身体使用蛋白质时其会生成),以制备由肾脏排泄的称为尿素的化合物。在鸟氨酸氨甲酰转移酶缺乏中,在尿素循环内开始特定反应的酶被损或丢失。尿素循环不能正常地进行,并且氮以氨的形式累积在血流中。氨对神经系统尤其具有破坏性,因此鸟氨酸氨甲酰转移酶缺乏引起神经学问题并且最终对肝脏造成损害。其他尿素循环障碍和相关基因包括例如N-乙酰谷氨酸合酶缺乏(NAGS)、氨基甲酰磷酸合成酶I缺乏(CPS1)、“AS缺乏”或瓜氨酸血症(ASS)、“AL缺乏”或精氨基琥珀酸尿症(ASL)以及“精氨酸酶缺乏”或精氨酸血症(ARG)。原发性高草酸尿症。原发性高草酸尿症(例如,原发性高草酸尿症1型(PH1))是一种罕见的常染色体隐性遗传性遗传病,其中肝脏中的乙醛酸代谢通路中的错误导致过度产生草酸,其在软组织(包括肾脏、骨髓和眼睛)中结晶。该疾病表现为肾脏的进行性衰竭,并且治疗是复杂的肾脏(受损器官)和肝脏(患病器官)双移植。原发性高草酸尿症由正常地阻止草酸积累的酶的缺乏引起。存在两种类型的原发性高草酸尿症,其区别在于缺陷的酶。患有1型原发性高草酸尿症的人的称为丙氨酸-乙醛酸转氨酶(AGXT)的肝酶短缺。2型原发性高草酸尿症通过称为乙醛酸还原酶/羟基丙酮酸还原酶(GRHPR)的酶的短缺表征。AGXT和GRHPR基因的突变引起原发性高草酸尿症。某些糖和氨基酸的分解和加工产生乙醛酸。正常地,乙醛酸通过两种酶(丙氨酸-乙醛酸转氨酶和乙醛酸还原酶/羟基丙酮酸还原酶)的作用分别被转化为氨基酸甘氨酸或被转化为乙醇酸。AGXT或GRHPR基因的突变引起这些酶短缺,这阻止了乙醛酸向甘氨酸或乙醇酸的转化。随着乙醛酸的水平逐渐积累,它被转化为草酸。草酸与钙组合以形成草酸钙沉积物,它可以损害肾脏和其他器官。在实施例中,使用在此描述的Cas9分子和gRNA分子例如通过同源重组校正AGXT的遗传缺陷。例如,可以将由经校正的AGXT基因编码的功能酶重新定向至其正确的亚细胞器。尽管已经在该基因中鉴定出>50个突变,但是最常见的(在白种人中,是40%)是错义G170R突变。这种突变导致AGT酶被定位至线粒体而非被定位至过氧化物酶体,它必须留在过氧化物酶体中以执行其功能。其他常见突变包括例如I244T(加那利群岛)、F152I、G41R、G630A(意大利)以及G588A(意大利)。在实施例中,使用在此描述的Cas9分子和gRNA分子靶向一种或多种编码乙醛酸代谢通路上游的酶的基因。示例性靶标包括例如乙醇酸氧化酶(基因HAO1,OMIMID605023)。乙醇酸氧化酶将乙醇酸转化为AGT的底物乙醛酸。由于其过氧化物酶体定位,乙醇酸氧化酶仅在肝脏中进行表达,使得它成为这个代谢通路中的适合靶标。在实施例中,在HAO1基因中引入双链断裂并且在通过NHEJ修复之后,在截短的蛋白中导致移码。在实施例中,将转录阻抑物(例如,在此描述的转录阻抑物)作为有效载荷递送到HAO1基因以减少HAO1的表达。莱伯先天性黑朦。莱伯先天性黑朦(LCA)是一种主要影响视网膜的眼障碍。患有这种障碍的人典型地具有在婴儿期开始的严重的视力损害。视力损害倾向于稳定,但是它可能随着时间非常缓慢地恶化。已经描述了至少13种类型的莱伯先天性黑朦。这些类型的区别在于其遗传原因、视力减退方式以及相关眼异常。莱伯先天性黑朦可以由至少14个基因的突变引起,所有这些基因都是正常视力所必需的。这些基因在视网膜的发育和功能中发挥多种作用。例如,一些与这种障碍相关的基因是光感受器的正常发育所必需的。其他基因牵涉光转导。仍有其他基因在纤毛的功能中发挥一定作用,纤毛是感知若干类型的感官输入(包括视力)所必需的。与莱伯先天性黑朦相关的基因(例如,AIPL1、CEP290、CRB1、CRX、GUCY2D、IMPDH1、LCA5、LRAT、RD3、RDH12、RPE65、RPGRIP1、SPATA7、TULP1)中任一者的突变都可以破坏视网膜的发育和功能,导致早期视力减退。CEP290、CRB1、GUCY2D和RPE65基因的突变是该障碍的最常见原因,而其他基因的突变在病例中通常所占比例较小。巴藤病。巴藤病或青少年巴藤病是一种主要影响神经系统的遗传性障碍。在几年的正常发育之后,患有这种病症的儿童患上进行性视力减退、智力残疾和运动性残疾以及癫痫。青少年巴藤病是一组称为神经元蜡样质脂褐质沉积症(NCL)的障碍之一。这些障碍全部影响神经系统并且典型地引起视力、运动和思维能力的进行性问题。一些人将整个NCL组称为巴藤病,而其他人将该名称局限于该障碍的青少年形式。不同类型的NCL的区别在于体征和症状第一次出现时的年龄。大多数病例的青少年巴藤病由CLN3基因的突变引起。这些突变可以破坏称为溶酶体的细胞结构的功能。溶酶体故障导致脂色素(lipopigment)积累在这些细胞结构内。这些累积发生在遍及全身的细胞中,但是脑中的神经元似乎特别易受由脂色素引起的损害的攻击。细胞(尤其在脑中)的进行性死亡在患有青少年巴藤病的人中导致视力减退、癫痫和智力下降。小百分比的青少年巴藤病病例由其他基因(例如,ATP13A2、CLN5、PPT1、TPP1)的突变引起。许多这些基因牵涉溶酶体功能,并且当突变时,可以引起这种或其他形式的NCL。慢性肉芽肿病。慢性肉芽肿病是一种引起免疫系统故障从而导致免疫缺陷形式的障碍。患有慢性肉芽肿病的个体具有复发性细菌和真菌感染。患有这种病症的人通常在多种组织中具有炎症区域(肉芽肿),这些炎症区域对于那些组织是具有破坏性的。慢性肉芽肿病的特征通常首先出现在儿童期,但是一些个体直到以后的生活中也不显示出症状。CYBA、CYBB、NCF1、NCF2或NCF4基因的突变可以引起慢性肉芽肿病。存在五种类型的这种病症,其区别在于所牵涉的基因。由受影响的基因产生的蛋白质是NADPH氧化酶的亚基,该氧化酶在免疫系统中发挥重要作用。确切地说,NADPH氧化酶主要在吞噬细胞中具有活性。在吞噬细胞内,NADPH氧化酶牵涉超氧化物的产生,超氧化物在杀伤外来侵入物和阻止它们在体内繁殖以及引起疾病中发挥一定作用。NADPH氧化酶还调节嗜中性粒细胞的活性,这些嗜中性粒细胞在调节炎症应答以优化愈合并且减轻对身体的损伤中发挥一定作用。CYBA、CYBB、NCF1、NCF2和NCF4基因的突变导致产生具有很少或没有功能的蛋白质或根本不产生蛋白质。在没有其亚基蛋白中任一者的情况下,NADPH氧化酶不能正常地装配或起作用。其结果是,吞噬细胞不能杀伤外来侵入物并且无法调节嗜中性粒细胞活性。NADPH氧化酶的缺乏使得受的影响个体易受许多类型的感染和过度炎症的攻击。威斯科特-奥尔德里奇综合征。威斯科特-奥尔德里奇综合征通过异常的免疫系统功能(免疫缺陷)和降低的形成血凝块的能力表征。这种病症主要影响男性。患有威斯科特-奥尔德里奇综合征的个体患有微血小板减少症(microthrombocytopenia),所述微血小板减少症中牵涉凝血的血细胞(血小板)的数目和大小减少,这可以导致容易挫伤或轻微外伤之后出现延长的出血。威斯科特-奥尔德里奇综合征导致许多类型的白细胞异常或无功能,使得若干免疫障碍和炎性障碍的风险增加。患有这种病症的许多人患上湿疹,一种由异常的成片的发红、发炎皮肤表征的炎性皮肤病。受影响的个体还对感染具有增加的敏感性。患有威斯科特-奥尔德里奇综合征的人患上自身免疫性障碍的风险较高。患有威斯科特-奥尔德里奇综合征的人患上一些类型的癌症(如免疫系统细胞的癌症(淋巴瘤))的几率也更大。WAS基因的突变引起威斯科特-奥尔德里奇综合征。WAS基因提供用于制备造WASP蛋白的指令,在所有血细胞中均发现了这种蛋白。WASP牵涉将来自血细胞表面的信号转播到肌动蛋白细胞骨架。当需要时,WASP信号传导激活细胞并且触发其移动和附接到其他细胞和组织(粘附)。在白细胞中,这种信号传导允许肌动蛋白细胞骨架在细胞与它们所靶向的外来侵入物之间建立相互作用(免疫突触)。引起威斯科特-奥尔德里奇综合征的WAS基因突变导致缺乏任何功能性WASP。WASP信号传导的损失破坏肌动蛋白细胞骨架在发育血细胞中的功能。缺乏WASP的白细胞具有减少的对其环境做出响应和形成免疫突触的能力。其结果是,白细胞不太能对外来侵入物做出响应,从而引起许多与威斯科特-奥尔德里奇综合征相关的免疫问题。类似地,在血小板中缺乏功能性WASP损害了其发育,从而导致大小减小和早期细胞死亡。亚瑟综合征。亚瑟综合征是一种由听力损失或耳聋和进行性视力减退表征的病症。视力减退由色素性视网膜炎(RP)引起,色素性视网膜炎影响眼睛后面的光敏组织层(视网膜)。当视网膜的光感细胞逐渐退化时,出现视力减退。已经鉴定了三种主要类型的亚瑟综合征,被指定为I型(亚型IA到IG)、II型(亚型IIA、IIB和IIC)和III型。这些类型的区别在于其严重性和体征和症状出现时的年龄。CDH23、CLRN1、GPR98、MYO7A、PCDH15、USH1C、USH1G和USH2A基因的突变可以引起亚瑟综合征。与亚瑟综合征相关的基因提供用于制备在正常听力、平衡和视力中发挥重要作用的蛋白质的指令。它们在毛细胞的发育和维持中发挥作用,毛细胞(haircells)是内耳中的帮助将声音和动作信号传送至脑的感觉细胞。在视网膜中,这些基因还牵涉决定称为视杆和视锥的光感细胞的结构和功能。在一些情况下,这些基因在听力和视力中的确切作用是未知的。造成亚瑟综合征的大多数突变导致内耳中的毛细胞的损失以及视网膜中的视杆和视锥的逐渐损失。这些感觉细胞的退化导致这种病症的听力损失、平衡问题和视力减退特征。亚瑟综合征I型可以由CDH23、MYO7A、PCDH15、USH1C或USH1G基因的突变引起。亚瑟综合征II型可以由例如USH2A或GPR98(也称为VLGR1)基因的突变引起。亚瑟综合征III型可以由例如CLRN1的突变引起。血红蛋白病。血红蛋白病是一组导致血红蛋白分子的珠蛋白链之一的结构异常的遗传缺陷。示例性血红蛋白病包括例如镰状细胞病、α地中海贫血和β地中海贫血。在实施例中,使用在此描述的Cas9分子和gRNA分子例如通过同源重组校正α球蛋白或β球蛋白的遗传缺陷。在实施例中,使用在此描述的Cas9分子和gRNA分子靶向血红蛋白病相关基因。示例性靶标包括例如与γ-珠蛋白基因的控制相关的基因。在实施例中,靶标是BCL11A。胎儿血红蛋白(也是血红蛋白F或HbF或α2γ2)是两个成体α-珠蛋白多肽和两个胎儿β-样γ-珠蛋白多肽的四聚体。HbF是人类胎儿在子宫中发育的最后七个月期间的以及在新生儿直到大约6月龄的主要氧转运蛋白。在功能上,胎儿血红蛋白与成人血红蛋白的最大不同之处在于它能够以比成人形式更大的亲和性结合氧,从而使得发育中的胎儿从母亲的血流中更好地获得氧。在新生儿中,在出生后大约6个月时,胎儿血红蛋白几乎完全被成人血红蛋白代替。在成人中,胎儿血红蛋白产生可以通过药理学方法再激活,这在疾病如血红蛋白病的治疗中是有用的。例如,在某些患有血红蛋白病的患者中,较高水平的γ-珠蛋白表达可以部分地补偿缺陷的或受损的β-珠蛋白基因产生,这可以改善这些疾病的临床严重性。增加的HbF水平或F-细胞(包含HbF的红细胞)数目可以改善血红蛋白病(例如,β-重型地中海贫血和镰状细胞贫血)的疾病严重性。增加的HbF水平或F-细胞可以与细胞中的减少的BCL11A表达相关。BCL11A基因编码多锌指转录因子。在实施例中,调节(例如,下调)BCL11A的表达。在实施例中,编辑BCL11A基因。在实施例中,细胞是造血干细胞或祖细胞。镰状细胞病镰状细胞病是一组影响血红蛋白的障碍。患有这种障碍的人具有非典型血红蛋白分子(血红蛋白S),它可以将红细胞扭曲成镰状或新月形状。这种障碍的表征特征包括低数目的红血细胞(贫血)、重复感染和疼痛的周期性发作。HBB基因的突变引起镰状细胞病。HBB基因提供用于制备β-珠蛋白的指令。不同形式的β-珠蛋白由HBB基因的不同突变引起。一个具体的HBB基因突变产生称为血红蛋白S(HbS)的异常形式的β-珠蛋白。HBB基因的其他突变导致另外的异常形式的β-珠蛋白,如血红蛋白C(HbC)和血红蛋白E(HbE)。HBB基因突变还可以导致β-珠蛋白的水平异常地低,即β地中海贫血。在患有镰状细胞病的人中,血红蛋白中的至少一种β-珠蛋白亚基被血红蛋白S替换。在作为镰状细胞病的常见形式的镰状细胞贫血中,血红蛋白S代替血红蛋白中的两种β-珠蛋白亚基。在其他类型的镰状细胞病中,血红蛋白中只有一种β-珠蛋白亚基被血红蛋白S替换。另一种β-珠蛋白亚基被不同的异常变体(如血红蛋白C)替换。例如,患有镰状-血红蛋白C(HbSC)疾病的人具有含血红蛋白S和血红蛋白C而非β-珠蛋白的血红蛋白分子。如果产生血红蛋白S和β地中海贫血的突变一起存在,则个体患有血红蛋白S-β地中海贫血(HbSβThal)疾病。α地中海贫血α地中海贫血是一种减少血红蛋白产生的血液障碍。在具有α地中海贫血的表征特征的人中,血红蛋白量的减少阻止足够的氧气到达身体的组织。受影响的个体的红细胞也短缺(贫血),这可以引起皮肤苍白、虚弱、疲劳以及更严重的并发症。两种类型的α地中海贫血可以引起健康问题。较严重的类型是血红蛋白巴氏胎儿水肿综合征(Barthydropsfetalissyndrome)或Hb巴氏综合征。较轻的形式是HbH疾病。Hb巴氏综合征例如通过胎儿水肿表征,胎儿水肿是一种在出生之前过量的流体积累在体内的病症。HbH疾病可以引起例如轻度至中度贫血、肝脾肿大以及眼睛和皮肤黄化(黄疸)。α地中海贫血典型地由涉及HBA1和HBA2基因的缺失引起。这两种基因都提供用于制备作为血红蛋白亚基的α-珠蛋白的指令。不同类型的α地中海贫血由一些或所有这些等位基因的缺失引起。Hb巴氏综合征可以由所有四种α-珠蛋白等位基因的缺失引起。HbH疾病可以由四种α-珠蛋白等位基因中的三种的缺失引起。在这两种病症中,α-珠蛋白的短缺阻止细胞制备正常的血红蛋白。相反,细胞产生异常形式的血红蛋白,即血红蛋白Bart(Hb巴氏)或血红蛋白H(HbH),这些异常形式不能有效地将氧带向身体的组织。Hb巴氏或HbH对正常血红蛋白的取代可以引起贫血和其他与α地中海贫血相关的严重的健康问题。两种另外的α地中海贫血的变体与减少量的α-珠蛋白有关。四种α-珠蛋白等位基因中的两种的缺失可以导致α地中海贫血性状。具有α地中海贫血性状的人可能具有异常小的、浅的红细胞并且患有轻度贫血。α-珠蛋白等位基因的缺失可以发现于α地中海贫血沉默载体中。β地中海贫血β地中海贫血是一种减少血红蛋白产生的血液障碍。在患有β地中海贫血的人体内,低水平的血红蛋白导致身体的许多部分中缺乏氧。受影响的个体的红细胞也短缺(贫血),这可以引起皮肤苍白、虚弱、疲劳以及更严重的并发症。患有β地中海贫血的人出现异常血凝块的风险增加。取决于症状的严重性,β地中海贫血被分成两种类型:重型地中海贫血(又称库利氏贫血(Cooley'sanemia))和中间型地中海贫血。在这两种类型中,重型地中海贫血是更严重的。HBB基因的突变引起β地中海贫血。HBB基因提供用于制备β-珠蛋白的指令。HBB基因的一些突变阻止产生任何β-珠蛋白。不存在β-珠蛋白被称为β-零(B0)地中海贫血。其他HBB基因突变允许产生一些β-珠蛋白但是量是减少的,即β-加(B+)地中海贫血。患有两种类型的人都已经被诊断患有重型地中海贫血和中间型地中海贫血。在实施例中,靶向第一基因的Cas9分子/gRNA分子复合物用于治疗由第二基因(例如,第二基因的突变)表征的障碍。通过举例,例如通过编辑或有效载荷递送靶向第一基因可以补偿第二基因(例如,突变型第二基因)的影响或抑制来自第二基因(例如,突变型第二基因)的进一步损害。在实施例中,受试者携带的第一基因的一个或多个等位基因不是该障碍的病因。表IX-3.所选障碍和用于进行补偿性靶向的靶标在实施例中,Cas9分子、gRNA分子和/或Cas9分子/gRNA分子复合物可以用来激活调节生长因子的基因,如上调Epo以驱动RBC产生。在实施例中,Cas9分子、gRNA分子和/或Cas9分子/gRNA分子复合物可以用来靶向关键转录因子的启动子(例如,导致其抑制、敲除或改变),如用于上调胎儿血红蛋白的BCL11A和KLF1,例如用于治愈镰状细胞贫血和地中海贫血。如在此描述的候选Cas9分子、候选gRNA分子和/或候选Cas9分子/gRNA分子复合物可以用来编辑/校正靶基因或用来将调节剂/效应物递送至细胞内的不同亚细胞位置,例如,如在此描述的。在实施例中,位置在细胞核内。在实施例中,位置是亚核结构域,例如染色体领域、核仁、核小点(nuclearspeckles)、卡哈尔体(Cajalbody)、Gems(卡哈尔体的二价染色体)或早幼粒细胞白血病(PML)核体。在实施例中,位置在线粒体内。如在此描述的候选Cas9分子、候选gRNA分子和/或候选Cas9分子/gRNA分子复合物可以在不同时间点用来编辑/校正靶基因或用来将调节剂/效应物递送至细胞内,如在此描述的。例如,编辑/校正或递送可以发生在细胞周期的不同阶段,例如G0期、间期(例如,G1期、S期、G2期)或M期。作为另一个实例,编辑/校正或递送可以发生在疾病进展的不同阶段,例如,在障碍(例如,病毒感染)的潜伏期或活跃期,或在障碍(例如,癌症)的任何阶段或次级分类。本发明的方法允许治疗由不想要的细胞增殖表征的障碍,例如癌症。在实施例中,操纵癌细胞,以使得它们对治疗或对内源免疫监视更敏感。在实施例中,调节癌细胞,以使得它对治疗剂更敏感。在实施例中,操纵癌细胞,以便增加基因的表达,该基因增加免疫系统识别或杀伤该癌细胞的能力。例如,Cas9分子/gRNA分子复合物可以用于递送有效载荷或编辑靶核酸,以便增加抗原的表达,例如在癌细胞已经下调该抗原的表达的情况下。在实施例中,将有效载荷(例如,包含转录因子或表达的其他激活剂的有效载荷)递送到癌细胞。在实施例中,通过切割靶核酸(例如,通过模板核酸切割和校正或改变该靶核酸)来实现表达的增加。在实施例中,递送覆盖(overrides)表观遗传沉默的有效载荷,例如甲基化调节剂。在实施例中,治疗进一步包括施用第二抗癌疗法,例如免疫疗法,例如结合被上调的抗原的抗体。在实施例中,在此描述的方法(例如靶向基因组标签,例如体易位(somatictranslocation))可以用来将Cas9分子/gRNA分子靶向癌细胞。在另一个方面中,本发明的特征是一种用抗原免疫受试者的方法。该方法包括使用在此所描述的方法以促进抗原从细胞(例如血细胞)的表达,这样使得该抗原促进免疫应答。在实施例中,离体体操纵细胞并且然后将其返回或引入受试者。X.修饰的核苷、核苷酸和核酸修饰的核苷和修饰的核苷酸可以存在于核酸中,例如特别是gRNA,但是还有其他形式的RNA,例如mRNA、RNAi或siRNA。如在此描述的,“核苷”被定义为包含五碳糖分子(戊糖或核糖)或其衍生物以及有机碱(嘌呤或嘧啶)或其衍生物的化合物。如在此描述的“核苷酸”被定义为进一步包含磷酸基团的核苷。修饰的核苷和核苷酸可以包括以下项中的一项或多项:(i)磷酸二酯骨架键联中的一个或两个非连接磷酸氧和/或一个或多个连接磷酸氧的改变,例如替换;(ii)核糖的组分(例如,核糖上的2’羟基)的改变,例如替换;(iii)“脱磷酸(dephospho)”接头对磷酸部分的完全替换;(iv)天然存在的核碱基的修饰或替换;(v)核糖-磷酸骨架的替换或修饰;(vi)寡核苷酸的3’端或5’端的修饰,例如,末端磷酸基团的去除、修饰或替换或部分的结合;以及(vii)糖的修饰。以上列出的修饰可以组合,以提供可以具有两种、三种、四种或更多种修饰的经修饰的核苷和核苷酸。例如,修饰的核苷或核苷酸可以具有修饰的糖和修饰的核碱基。在实施例中,修饰gRNA或模板核酸的每个核苷酸,例如,所有核苷酸都具有修饰的磷酸基团,例如,所有修饰的磷酸基团都是硫代磷酸酯基团。在实施例中,单分子或模块化gRNA分子或模板核酸的所有或基本上所有磷酸基团被硫代磷酸酯基团替换。在实施例中,可以将修饰的核苷酸(例如,具有如在此描述的修饰的核苷酸)掺入核酸中,例如“修饰的核酸”。在实施例中,修饰的核酸包括一个、两个、三个或更多个修饰的核苷酸。在实施例中,修饰的核酸中的至少5%(例如,至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%或约100%)的位置是修饰的核苷酸。未修饰的核酸可以易于被例如细胞核酸酶降解。例如,核酸酶可以水解核酸磷酸二酯键。因此,在一个方面中,在此描述的修饰的核酸可以含有一个或多个修饰的核苷或核苷酸,例如,以引入对核酸酶的稳定性。在实施例中,在此描述的修饰的核苷、修饰的核苷酸和修饰的核酸当被在体内和离体地引入细胞群体中时都可以展现出减少的先天性免疫应答。术语“先天性免疫应答”包括对外源核酸的细胞应答,外源核酸包括通常是病毒或细菌来源的单链核酸,所述细胞应答涉及细胞因子(特别是干扰素)表达与释放以及细胞死亡的诱导。在实施例中,在此描述的修饰的核苷、修饰的核苷酸和修饰的核酸可以破坏大沟相互作用配偶体与核酸的结合。在实施例中,在此描述的修饰的核苷、修饰的核苷酸和修饰的核酸当被在体内和离体地引入细胞群体中时都可以展现出减少的先天性免疫应答,并且还破坏大沟相互作用配偶体与核酸的结合。在实施例中,统治型gRNA包含修饰,例如,修饰的核苷酸、对骨架的修饰以及在此描述的其他修饰。在实施例中,模板核酸包含修饰,例如,修饰的核苷酸、对骨架的修饰以及在此描述的其他修饰。在实施例中,修饰例如通过增加模板核酸对内切核酸酶和/或外切核酸酶的抗性来改善其稳定性。在实施例中,包含修饰的模板核酸是双链的,例如是双链DNA。在这样的实施例中,所有修饰被约束在一条链上。在实施例中,修饰存在于两条链上。修饰可以存在于5’同源臂、3’同源臂或替换序列或其任何组合中。在实施例中,修饰存在于一个或两个同源臂中,但是不存在于替换序列中。在实施例中,包含修饰的模板核酸是单链的,例如是单链DNA。化学基团的定义如在此使用的,“烷基”意在指直链的或支链的饱和烃基。示例性烷基基团包括甲基(Me)、乙基(Et)、丙基(例如,正丙基和异丙基)、丁基(例如,正丁基、异丁基、叔丁基)、戊基(例如,正戊基、异戊基、新戊基)等。烷基基团可以包含从1至约20、从2至约20、从1至约12、从1至约8、从1至约6、从1至约4或从1至约3个碳原子。如在此使用的,“芳基”是指单环或多环(例如,具有2、3或4个稠环)的芳香烃,例如像苯基、萘基、蒽基(anthracenyl)、菲基(phenanthrenyl)、茚满基、茚基等。在实施例中,芳基基团具有从6至约20个碳原子。如在此使用的,“烯基”是指包含至少一个双键的脂肪族基团。如在此使用的,“炔基”是指含有2-12个碳原子并且特征在于具有一个或多个三键的直链的或支链的烃链。炔基基团的实例包括但不限于乙炔基、炔丙基和3-己炔基(3-hexynyl)。如在此使用的,“芳基烷基”或“芳烷基”是指烷基氢原子被芳基基团替换的烷基部分。芳烷基包括一个以上氢原子已经被芳基基团替换的基团。“芳基烷基”或“芳烷基”的实例包括苄基、2-苯基乙基、3-苯基丙基、9-芴基、二苯甲基以及三苯甲基基团。如在此使用的,“环烷基”是指具有3至12个碳的环状的、二环的、三环的或多环的非芳香烃基团。环烷基部分的实例包括但不限于环丙基、环戊基和环己基。如在此使用的,“杂环基(heterocyclyl)”是指杂环系统的单价基(monovalentradical)。代表性杂环基包括但不限于四氢呋喃基、四氢噻吩基、吡咯烷基、吡咯烷酮基(pyrrolidonyl)、哌啶基、吡咯啉基、哌嗪基、二噁烷基、二氧戊环基、二氮杂卓基、氧氮杂卓基(oxazepinyl)、硫氮杂卓基(thiazepinyl)以及吗啉基。如在此使用的,“杂芳基”是指杂芳香环系统的单价基。杂芳基部分的实例包括但不限于咪唑基、噁唑基、噻唑基、三唑基、吡咯基、呋喃基、吲哚基、苯硫基、吡唑基、吡啶基、吡嗪基、哒嗪基、嘧啶基、吲嗪基(indolizinyl)、嘌呤基、萘啶基(naphthyridinyl)、喹啉基以及蝶啶基。磷酸骨架修饰磷酸基团在实施例中,可以通过用不同取代基替换一个或更多个氧来修饰经修饰的核苷酸的磷酸基团。此外,修饰的核苷酸(例如,存在于修饰的核酸中的修饰的核苷酸)可以包括如在此描述的修饰的磷酸酯对未修饰的磷酸部分的完全替换。在实施例中,磷酸骨架的修饰可以包括产生不带电接头或具有不对称电荷分布的带电接头的改变。修饰的磷酸基团的实例包括硫代磷酸酯、硒代磷酸酯(phosphoroselenate)、硼磷酸酯(boranophosphate)、硼磷酸酯(boranophosphateester)、氢膦酸酯(hydrogenphosphonate)、磷酰胺酯(phosphoroamidate)、烷基或芳基膦酸酯和磷酸三酯。在实施例中,磷酸骨架部分中的非桥连磷酸氧原子之一可以被以下基团中的任一项替换:硫(S)、硒(Se)、BR3(其中R可以是例如氢、烷基或芳基)、C(例如,烷基基团、芳基基团等)、H、NR2(其中R可以是例如氢、烷基或芳基)或OR(其中R可以是例如烷基或芳基)。未修饰的磷酸基团中的磷原子是非手性的。然而,以上原子或原子的基团之一对非桥连氧之一的替换可以使得磷原子是手性的;也就是说以这种方式修饰的磷酸基团中的磷原子是立构中心(stereogeniccenter)。立构磷原子可以具有“R”构型(在此是Rp)或“S”构型(在此是Sp)。二硫代磷酸酯具有两个被硫替换的非桥连氧。二硫代磷酸酯中的磷中心是非手性的,这阻止寡核糖核苷酸非对映异构体的形成。在实施例中,对一个或两个非桥连氧的修饰还可以包括用以下基团替换非桥连氧,该基团独立地选自S、Se、B、C、H、N以及OR(R可以是例如烷基或芳基)。还可以通过用氮(桥连的磷酰胺酯)、硫(桥连的硫代磷酸酯)和碳(桥连的亚甲基膦酸酯)替换桥连氧(即,将磷酸连接至核苷的氧)来修饰磷酸酯接头。替换可以发生在连接氧或发生在两个连接氧处。磷酸基团的替换磷酸基团可以被不含磷连接物替换。在实施例中,带电磷酸基团可以被中性部分替换。可以替换磷酸基团的部分的实例可以包括但不限于例如甲基膦酸酯、羟氨基、硅氧烷、碳酸酯、羧甲基、氨基甲酸酯、酰胺、硫醚、环氧乙烷接头、磺酸酯、磺酰胺、硫代甲缩醛(thioformacetal)、甲缩醛(formacetal)、肟、亚甲基亚氨基、亚甲基甲基亚氨基、亚甲基肼基、亚甲基二甲基肼基以及亚甲基氧基甲基亚氨基。核糖磷酸(Ribophosphate)骨架的替换还可以构建可以模拟核酸的支架,其中磷酸酯接头和核糖被核酸酶抗性核苷或核苷酸替代物替换。在实施例中,可以通过替代骨架拴住核碱基。实例可以包括但不限于吗啉代、环丁基、吡咯烷和肽核酸(PNA)核苷替代物。糖修饰修饰的核苷和修饰的核苷酸可以包括对糖基的一种或多种修饰。例如,2’羟基基团(OH)可以被多种不同的“氧基”或“脱氧”取代基修饰或替换。在实施例中,对2’羟基基团的修饰可以增强核酸的稳定性,因为羟基不再可以被去质子化以形成2’-醇盐离子。2’-醇盐可以通过接头磷原子上的分子内亲核攻击而催化降解。“氧基”-2’羟基基团修饰的实例可以包括烷氧基或芳氧基(OR,其中R可以是例如烷基、环烷基、芳基、芳烷基、杂芳基或糖);聚乙二醇(PEG),O(CH2CH2O)nCH2CH2OR,其中R可以是例如H或任选取代的烷基,并且n可以是从0至20的整数(例如,从0至4、从0至8、从0至10、从0至16、从1至4、从1至8、从1至10、从1至16、从1至20、从2至4、从2至8、从2至10、从2至16、从2至20、从4至8、从4至10、从4至16以及从4至20)。在实施例中,“氧基”-2’羟基基团修饰可以包括“锁”核酸(LNA),其中2’羟基可以例如通过C1-6亚烷基或C1-6杂亚烷基桥连接至同一核糖的4’碳,其中示例性桥可以包括亚甲基、亚丙基(propylene)、醚或氨基桥;O-氨基(其中氨基可以是例如NH2;烷氨基、二烷氨基、杂环基、芳氨基(arylamino)、二芳氨基、杂芳氨基或二杂芳氨基、乙二胺或聚氨基)和氨基烷氧基O(CH2)n-氨基(其中氨基可以是例如NH2;烷氨基、二烷氨基、杂环基、芳氨基、二芳氨基、杂芳氨基或二杂芳氨基、乙二胺或聚氨基)。在实施例中,“氧基”-2’羟基基团修饰可以包括甲氧基乙基基团(MOE)(OCH2CH2OCH3,例如PEG衍生物)。“脱氧”修饰可以包括氢(即脱氧核糖,例如在部分dsRNA的突出端部分);卤素(halo)(例如,溴、氯、氟或碘);氨基(其中氨基可以是例如NH2;烷氨基、二烷氨基、杂环基、芳氨基、二芳氨基、杂芳氨基、二杂芳氨基或氨基酸);NH(CH2CH2NH)nCH2CH2-氨基(其中氨基可以是例如如在此描述的),-NHC(O)R(其中R可以是例如烷基、环烷基、芳基、芳烷基、杂芳基或糖),氰基;巯基;烷基-硫代-烷基;硫代烷氧基;以及烷基、环烷基、芳基、烯基和炔基,其可以任选地被例如如在此描述的氨基取代。糖基还可以包含一个或多个具有与核糖中的对应碳相反的立体化学构型的碳。因此,修饰的核酸可以包括含有例如阿拉伯糖(arabinose)作为糖的核苷酸。核苷酸“单体”可以在糖的1’位置处具有α键联,例如α-核苷。修饰的核酸还可以包括“无碱基”糖,其在C-1’处缺乏核碱基。这些无碱基糖还可以在一个或多个构成性糖原子处被进一步修饰。修饰的核酸还可以包括一种或多种处于L型的糖,例如L-核苷。通常,RNA包括糖基核糖,它是具有氧的五元环。示例性修饰的核苷和修饰的核苷酸可以包括但不限于核糖中氧的替换(例如,用硫(S)、硒(Se)或亚烷基,例如像亚甲基或亚乙基);双键的添加(例如,以用环戊烯基或环己烯基替换核糖);核糖的缩环(例如,以形成环丁烷或氧杂环丁烷的四元环);核糖的扩环(例如,以形成具有另外的碳或杂原子的六元或七元环,例如像脱水己糖醇、阿卓糖醇、甘露醇、环己烷基(cyclohexanyl)、环己烯基以及吗啉代,其也具有氨基磷酸酯骨架)。在实施例中,修饰的核苷酸可以包括多环形式(例如,三环;和“解锁”形式,如二醇核酸(GNA)(例如,R-GNA或S-GNA,其中核糖被附接至磷酸二酯键的二醇单元替换),苏糖核酸(TNA,其中核糖被α-L-苏呋喃糖基(threofuranosyl)-(3’→2’)替换)。核碱基上的修饰能够被掺入修饰的核酸中的在此描述的修饰的核苷和修饰的核苷酸可以包括修饰的核碱基。核碱基的实例包括但不限于腺嘌呤(A)、鸟嘌呤(G)、胞嘧啶(C)以及尿嘧啶(U)。这些核碱基可以被修饰或全部替换,以提供可以被掺入修饰的核酸中的修饰的核苷和修饰的核苷酸。核苷酸的核碱基可以独立地选自嘌呤、嘧啶、嘌呤或嘧啶类似物。在实施例中,核碱基可以包括例如天然存在的碱基及碱基的合成的衍生物。尿嘧啶在实施例中,修饰的核碱基是修饰的尿嘧啶。具有修饰的尿嘧啶的示例性核碱基和核苷包括但不限于假尿苷(ψ)、吡啶-4-酮核糖核苷(pyridin-4-oneribonucleoside)、5-氮杂-尿苷(5-aza-uridine)、6-氮杂-尿苷、2-硫代-5-氮杂-尿苷、2-硫代-尿苷(s2U)、4-硫代-尿苷(s4U)、4-硫代-假尿苷、2-硫代-假尿苷、5-羟基-尿苷(ho5U)、5-氨基烯丙基-尿苷、5-卤代-尿苷(例如,5-碘代-尿苷或5-溴代-尿苷)、3-甲基-尿苷(m3U)、5-甲氧基-尿苷(mo5U)、尿苷5-氧基乙酸(cmo5U)、尿苷5-氧基乙酸甲酯(mcmo5U)、5-羧甲基-尿苷(cm5U)、1-羧甲基-假尿苷、5-羧基羟甲基-尿苷(chm5U)、5-羧基羟甲基-尿苷甲酯(mchm5U)、5-甲氧基羰基甲基-尿苷(mcm5U)、5-甲氧基羰基甲基-2-硫代-尿苷(mcm5s2U)、5-氨甲基-2-硫代-尿苷(nm5s2U)、5-甲基氨甲基-尿苷(mnm5U)、5-甲基氨甲基-2-硫代-尿苷(mnm5s2U)、5-甲基氨甲基-2-硒代-尿苷(mnm5se2U)、5-氨甲酰基甲基-尿苷(ncm5U)、5-羧甲基氨甲基-尿苷(cmnm5U)、5-羧甲基氨甲基-2-硫代-尿苷(cmnm5s2U)、5-丙炔基-尿苷、1-丙炔基-假尿苷、5-牛磺酸甲基-尿苷(5-taurinomethyl-uridine,τcm5U)、1-牛磺酸甲基-假尿苷、5-牛磺酸甲基-2-硫代-尿苷(τm5s2U)、1-牛磺酸甲基-4-硫代-假尿苷、5-甲基-尿苷(m5U,即具有核碱基脱氧胸腺嘧啶)、1-甲基-假尿苷(m1ψ)、5-甲基-2-硫代-尿苷(m5s2U)、1-甲基-4-硫代-假尿苷(m1s4ψ)、4-硫代-1-甲基-假尿苷、3-甲基-假尿苷(m3ψ)、2-硫代-1-甲基-假尿苷、1-甲基-1-去氮杂-假尿苷(1-methyl-1-deaza-pseudouridine)、2-硫代-1-甲基-1-去氮杂-假尿苷、二氢尿苷(D)、二氢假尿苷、5,6-二氢尿苷、5-甲基-二氢尿苷(m5D)、2-硫代-二氢尿苷、2-硫代-二氢假尿苷、2-甲氧基-尿苷、2-甲氧基-4-硫代-尿苷、4-甲氧基-假尿苷、4-甲氧基-2-硫代-假尿苷、N1-甲基-假尿苷、3-(3-氨基-3-羧丙基)尿苷(acp3U)、1-甲基-3-(3-氨基-3-羧丙基)假尿苷(acp3ψ)、5-(异戊烯基氨甲基)尿苷(inm5U)、5-(异戊烯基氨甲基)-2-硫代-尿苷(inm5s2U)、α-硫代-尿苷、2'-O-甲基-尿苷(Um)、5,2'-O-二甲基-尿苷(m5Um)、2'-O-甲基-假尿苷(ψm)、2-硫代-2'-O-甲基-尿苷(s2Um)、5-甲氧基羰基甲基-2'-O-甲基-尿苷(mcm5Um)、5-氨甲酰基甲基-2'-O-甲基-尿苷(ncm5Um)、5-羧甲基氨甲基-2'-O-甲基-尿苷(cmnm5Um)、3,2'-O-二甲基-尿苷(m3Um)、5-(异戊烯基氨甲基)-2'-O-甲基-尿苷(inm5Um)、1-硫代-尿苷、脱氧胸苷、2'-F-阿糖-尿苷(2'-F-ara-uridine)、2'-F-尿苷、2'-OH-阿糖-尿苷、5-(2-甲酯基乙烯基)尿苷(5-(2-carbomethoxyvinyl)uridine)、5-[3-(1-E-丙烯基氨基)尿苷、吡唑并[3,4-d]嘧啶(pyrazolo[3,4-d]pyrimidines)、黄嘌呤以及次黄嘌呤。胞嘧啶在实施例中,修饰的核碱基是修饰的胞嘧啶。具有修饰的胞嘧啶的示例性核碱基和核苷包括但不限于5-氮杂-胞苷、6-氮杂-胞苷、假异胞苷(pseudoisocytidine)、3-甲基-胞苷(m3C)、N4-乙酰基-胞苷(act)、5-甲酰基-胞苷(f5C)、N4-甲基-胞苷(m4C)、5-甲基-胞苷(m5C)、5-卤代-胞苷(例如,5-碘代-胞苷)、5-羟甲基-胞苷(hm5C)、1-甲基-假异胞苷、吡咯并-胞苷、吡咯并-假异胞苷、2-硫代-胞苷(s2C)、2-硫代-5-甲基-胞苷、4-硫代-假异胞苷、4-硫代-1-甲基-假异胞苷、4-硫代-1-甲基-1-去氮杂-假异胞苷、1-甲基-1-去氮杂-假异胞苷、泽布拉林(zebularine)、5-氮杂-泽布拉林、5-甲基-泽布拉林、5-氮杂-2-硫代-泽布拉林、2-硫代-泽布拉林、2-甲氧基-胞苷、2-甲氧基-5-甲基-胞苷、4-甲氧基-假异胞苷、4-甲氧基-1-甲基-假异胞苷、赖西丁(lysidine,k2C)、α-硫代-胞苷、2'-O-甲基-胞苷(Cm)、5,2'-O-二甲基-胞苷(m5Cm)、N4-乙酰基-2'-O-甲基-胞苷(ac4Cm)、N4,2'-O-二甲基-胞苷(m4Cm)、5-甲酰基-2'-O-甲基-胞苷(f5Cm)、N4,N4,2'-O-三甲基-胞苷(m42Cm)、1-硫代-胞苷、2'-F-阿糖-胞苷、2'-F-胞苷以及2'-OH-阿糖-胞苷。腺嘌呤在实施例中,修饰的核碱基是修饰的腺嘌呤。具有修饰的腺嘌呤的示例性核碱基和核苷包括但不限于2-氨基-嘌呤、2,6-二氨基嘌呤、2-氨基-6-卤代-嘌呤(例如,2-氨基-6-氯代-嘌呤)、6-卤代-嘌呤(例如,6-氯代-嘌呤)、2-氨基-6-甲基-嘌呤、8-叠氮基-腺苷、7-去氮杂-腺嘌呤、7-去氮杂-8-氮杂-腺嘌呤、7-去氮杂-2-氨基-嘌呤、7-去氮杂-8-氮杂-2-氨基-嘌呤、7-去氮杂-2,6-二氨基嘌呤、7-去氮杂-8-氮杂-2,6-二氨基嘌呤、1-甲基-腺苷(m1A)、2-甲基-腺嘌呤(m2A)、N6-甲基-腺苷(m6A)、2-甲硫基-N6-甲基-腺苷(ms2m6A)、N6-异戊烯基-腺苷(i6A)、2-甲硫基-N6-异戊烯基-腺苷(ms2i6A)、N6-(顺羟基异戊烯基)腺苷(io6A)、2-甲硫基-N6-(顺羟基异戊烯基)腺苷(ms2io6A)、N6-缩水甘油基氨甲酰基-腺苷(g6A)、N6-苏氨酰基氨甲酰基-腺苷(t6A)、N6-甲基-N6-苏氨酰基氨甲酰基-腺苷(m6t6A)、2-甲硫基-N6-苏氨酰基氨甲酰基-腺苷(ms2g6A)、N6,N6-二甲基-腺苷(m62A)、N6-羟基正缬氨酰基氨甲酰基-腺苷(hn6A)、2-甲硫基-N6-羟基正缬氨酰基氨甲酰基-腺苷(ms2hn6A)、N6-乙酰基-腺苷(ac6A)、7-甲基-腺嘌呤、2-甲硫基-腺嘌呤、2-甲氧基-腺嘌呤、α-硫代-腺苷、2'-O-甲基-腺苷(Am)、N6,2'-O-二甲基-腺苷(m6Am)、N6-甲基-2'-脱氧腺苷、N6,N6,2'-O-三甲基-腺苷(m62Am)、1,2'-O-二甲基-腺苷(m1Am)、2'-O-核糖基腺苷(磷酸酯)(Ar(p))、2-氨基-N6-甲基-嘌呤、1-硫代-腺苷、8-叠氮基-腺苷、2'-F-阿糖-腺苷、2'-F-腺苷、2'-OH-阿糖-腺苷以及N6-(19-氨基-五氧杂十九烷基)-腺苷(N6-(19-amino-pentaoxanonadecyl)-adenosine)。鸟嘌呤在实施例中,修饰的核碱基是修饰的鸟嘌呤。具有修饰的鸟嘌呤的示例性核碱基和核苷包括但不限于肌苷(I)、1-甲基-肌苷(m1I)、怀俄苷(wyosine,imG)、甲基怀俄苷(mimG)、4-去甲基-怀俄苷(imG-14)、异怀俄苷(imG2)、怀丁苷(wybutosine,yW)、过氧怀丁苷(o2yW)、羟基怀丁苷(OHyW)、修饰不足的羟基怀丁苷(undermodifiedhydroxywybutosine,OHyW*)、7-去氮杂-鸟苷、辫苷(queuosine,Q)、环氧辫苷(oQ)、半乳糖基-辫苷(galQ)、甘露糖基-辫苷(manQ)、7-氰基-7-去氮杂-鸟苷(preQ0)、7-氨甲基-7-去氮杂-鸟苷(preQ1)、古嘌苷(G+)、7-去氮杂-8-氮杂-鸟苷、6-硫代-鸟苷、6-硫代-7-去氮杂-鸟苷、6-硫代-7-去氮杂-8-氮杂-鸟苷、7-甲基-鸟苷(m7G)、6-硫代-7-甲基-鸟苷、7-甲基-肌苷、6-甲氧基-鸟苷、1-甲基-鸟苷(m'G)、N2-甲基-鸟苷(m2G)、N2,N2-二甲基-鸟苷(m22G)、N2,7-二甲基-鸟苷(m2,7G)、N2,N2,7-二甲基-鸟苷(m2,2,7G)、8-氧代-鸟苷、7-甲基-8-氧代-鸟苷、1-甲硫基-鸟苷、N2-甲基-6-硫代-鸟苷、N2,N2-二甲基-6-硫代-鸟苷、α-硫代-鸟苷、2'-O-甲基-鸟苷(Gm)、N2-甲基-2'-O-甲基-鸟苷(m2Gm)、N2,N2-二甲基-2'-O-甲基-鸟苷(m22Gm)、1-甲基-2'-O-甲基-鸟苷(m'Gm)、N2,7-二甲基-2'-O-甲基-鸟苷(m2,7Gm)、2'-O-甲基-肌苷(Im)、1,2'-O-二甲基-肌苷(m'Im)、O6-苯基-2’-脱氧肌苷、2'-O-核糖基鸟苷(磷酸酯)(Gr(p))、1-硫代-鸟苷、O6-甲基-鸟苷、O6-甲基-2’-脱氧鸟苷、2'-F-阿糖-鸟苷以及2'-F-鸟苷。修饰的gRNA在实施例中,修饰的核酸可以是修饰的gRNA。在实施例中,gRNA可以在3’端被修饰。在这个实施例中,gRNA可以在3’末端U核糖处被修饰。例如,U核糖的两个末端羟基基团可以被氧化为醛基基团和核糖环的伴随开口,以提供如下所示的修饰的核苷:其中“U”可以是未修饰的或修饰的尿苷。在另一个实施例中,可以用如下所示的2’3’环状磷酸酯修饰3’末端U:其中“U”可以是未修饰的或修饰的尿苷。在实施例中,gRNA分子可以包含3’核苷酸,其可以例如通过掺入在此描述的一种或多种修饰的核苷酸而对降解进行稳定化。在这个实施例中,例如,尿苷可以被修饰的尿苷(例如,5-(2-氨基)丙基尿苷和5-溴代尿苷)或被在此描述的任何修饰的尿苷替换;腺苷和鸟苷可以被修饰的腺苷和鸟苷(例如,在8-位具有修饰,例如8-溴代鸟苷)或被在此描述的任何修饰的腺苷和鸟苷替换。在实施例中,可以将去氮杂核苷酸(例如,7-去氮杂-腺苷)掺入gRNA中。在实施例中,可以将O-和N-烷基化的核苷酸(例如,N6-甲基腺苷)掺入gRNA中。在实施例中,可以掺入糖-修饰的核糖核苷酸,例如其中2’OH-基团被选自以下项的基团替换:H、-OR、-R(其中R可以是例如烷基、环烷基、芳基、芳烷基、杂芳基或糖)、卤素、-SH、-SR(其中R可以是例如烷基、环烷基、芳基、芳烷基、杂芳基或糖)、氨基(其中氨基可以是例如NH2;烷氨基、二烷氨基、杂环基、芳氨基、二芳氨基、杂芳氨基、二杂芳氨基或氨基酸);或氰基(-CN)。在实施例中,可以如在此描述的修饰磷酸骨架,例如用硫代磷酸酯基团。在实施例中,gRNA的突出端区中的核苷酸可以各自独立地是修饰或未修饰的核苷酸,包括但不限于2’-糖修饰的(如2-F2’-O-甲基)、胸苷(T)、2'-O-甲氧基乙基-5-甲基尿苷(Teo)、2'-O-甲氧基乙基腺苷(Aeo)、2'-O-甲氧基乙基-5-甲基胞苷(m5Ceo)及其任何组合。在实施例中,RNA分子(例如,gRNA分子)的单链突出端中的一个或多个或所有核苷酸是脱氧核苷酸。XI.接头在实施例中,有效载荷可以例如通过共价接头连接至Cas9分子或gRNA。这个接头可以是可切割的或不可切割的。在实施例中,可切割的接头可以在运到希望的靶标之后用于释放有效载荷。接头可以包括直接键或原子(例如像氧(O)或硫(S))、单元(如-NR-其中R是氢或烷基,-C(O)-,-C(O)O-,-C(O)NH-,SO,SO2,-SO2NH-)或一串原子(如取代的或未取代的烷基、取代的或未取代的烯基、取代的或未取代的炔基、芳基烷基、杂芳基烷基)。在实施例中,这串原子中的一种或多种亚甲基可以被以下项中的一项或多项替换:O、S、S(O)、SO2、-SO2NH-、-NR-、-C(O)-、-C(O)O-、-C(O)NH-、可切割的连接基团、取代的或未取代的芳基、取代的或未取代的杂芳基以及取代的或未取代的杂环。不可切割的键联在实施例中,有效载荷通过以下接头附接至Cas9分子或gRNA,该接头本身在生理条件下是稳定的,如亚烷基链,并且当给予给受试者时不会导致该有效载荷从该Cas9分子和/或gRNA中释放,持续至少2、3、4、5、10、15、24或48小时或持续至少1、2、3、4、5或10天。在实施例中,有效载荷和Cas9分子和/或gRNA包括官能团的残基,通过这些官能团实现有效载荷与Cas9的分子或gRNA的反应和键联。在实施例中,有效载荷或Cas9分子和/或gRNA的末端或内部官能团(其可以是相同的或不同的)包括氨基、酸、咪唑、羟基、硫代、酰卤、-HC=CH-、-C≡C-基团或其衍生物。在实施例中,接头包含亚烃基基团,其中一个或多个亚甲基基团任选地被基团Y替换(其条件是这些Y基团彼此都不相邻),其中对于每次出现,每个Y独立地选自取代的或未取代的芳基、杂芳基、环烷基、杂环烷基,或-O-、-C(=X)-(其中X是NR1、O或S)、-NR1-、-NR1C(O)-、-C(O)NR1-、-S(O)n-、-NR1S(O)n-、-S(O)nNR1-、-NR1C(O)-NR1-;并且对于每次出现,R1独立地表示H或低级烷基,并且其中n是0、1或2。在实施例中,接头包含亚烷基部分或杂亚烷基部分(例如,亚烷基二醇部分,如乙二醇)。在实施例中,接头包含聚-L-谷氨酸、聚乳酸、聚(乙烯亚胺)、寡糖、氨基酸(例如,甘氨酸)、氨基酸链或任何其他适合的键联。接头基团可以是生物上无活性的,如PEG、聚乙醇酸或聚乳酸链。在实施例中,接头基团表示衍生或非衍生的氨基酸(例如,甘氨酸)。可切割的键联可切割的连接基团在细胞外是足够稳定的,但它在进入靶细胞时被切割,以释放接头结合在一起的两个部分。在一个实施例中,可切割的连接基团在靶细胞中或在第一参比条件下(可以例如将其选择成模拟或代表胞内条件)的切割比在受试者的血液中或在第二参比条件下(可以例如将其选择成模拟或代表血液或血清中发现的条件)快至少10倍或更多或至少100倍。可切割的连接基团对切割剂(例如,pH、氧化还原电位或降解分子的存在)是敏感的。此类降解剂的实例包括:氧化还原剂,针对特定底物对其进行选择或其没有底物特异性,包括例如存在于细胞中的氧化酶或还原酶或还原剂(如硫醇),可以通过还原降解氧化还原可切割的连接基团;酯酶;可以产生酸性环境的内含体或试剂,例如使得pH为五或更低的那些;可以通过充当广义酸而水解或降解酸可切割的连接基团的酶、肽酶(其可以是底物特异性的)和磷酸酶。可切割的键联基团(如二硫键(-S-S-))对pH可以是敏感的。人血清的pH是7.4,而平均细胞内pH稍低,范围从约7.1-7.3。内含体具有更酸的pH(范围在5.5-6.0),并且溶酶体具有甚至更酸的pH(在5.0左右)。一些接头具有在优选pH下被切割的可切割的连接基团。接头可以包括可被特定酶切割的可切割的连接基团。通常,候选的可切割连接基团的适合性可以通过测试降解剂(或条件)切割该候选连接基团的能力来进行评估。还可以在血液中或当与其他非靶标组织接触时抵抗切割的能力对候选的可切割连接基团进行测试。因此,可以确定在第一条件与第二条件之间进行切割的相对敏感性,其中该第一条件被选择为指示在靶细胞中的切割并且该第二条件被选择为指示在其他组织或生物流体(例如,血液或血清)中的切割。评估可以在无细胞系统中、在细胞中、在细胞培养物中、在器官或组织培养物中或在整个动物中进行。可能有用的是,在无细胞或培养条件下做出初步评估并且通过在整个动物中进行进一步评估来证实。在实施例中,可切割的接头包括氧化还原可切割的接头(如二硫基(-S-S-),以及磷酸酯可切割的接头,例如像-O-P(O)(OR)-O-、-O-P(S)(OR)-O-、-O-P(S)(SR)-O-、-S-P(O)(OR)-O-、-O-P(O)(OR)-S-、-S-P(O)(OR)-S-、-O-P(S)(OR)-S-、-S-P(S)(OR)-O-、-O-P(O)(R)-O-、-O-P(S)(R)-O-、-S-P(O)(R)-O-、-S-P(S)(R)-O-、-S-P(O)(R)-S-、-OP(S)(R)-S-,其中R是氢或烷基。酸可切割的连接基团酸可切割的连接基团是在酸性条件下被切割的连接基团。在实施例中,酸可切割的连接基团在pH约6.5或更低(例如,约6.0、5.5、5.0或更低)的酸性环境下被切割或被可以充当广义酸的试剂(如酶)切割。酸可切割的连接基团的实例包括但不限于腙、酯和氨基酸的酯。酸可切割的基团可以具有通式-C(=N-)N-、-C(O)O-或-OC(O)-。基于酯的连接基团基于酯的可切割的连接基团被细胞中的酶(如酯酶和酰胺酶)切割。基于酯的可切割的连接基团的实例包括但不限于亚烷基、亚烯基和亚炔基基团的酯。酯可切割的连接基团具有通式-C(O)O-或-OC(O)-。XII.基因组标签的靶向Cas9分子、gRNA分子,并且特别是Cas9分子/gRNA分子复合物可以借助与包含所选基因组标签的靶核酸的序列特异性相互作用而用来靶向细胞。这提供了具有所选基因组标签的细胞的靶向破坏。在此披露的方法和组合物可以用于治疗由所选基因组标签表征的障碍,例如存在于种系中的基因组标签或作为基因组中的散发性或体细胞变化的结果而产生的基因组标签,例如癌细胞中的种系或获得性突变、病毒感染或基因组的其他种系或获得性变化。虽然不希望被理论所束缚,据信gRNA分子的靶向结构域与靶核酸的靶序列之间的互补性介导Cas9分子/gRNA分子复合物与该靶序列的靶序列特异性相互作用。这允许靶向特异性序列或基因组标签,例如重排,例如易位、插入、缺失和倒位以及其他突变。Cas9分子/gRNA分子复合物可以用来靶向特异性序列,例如种系的、线粒体的或体细胞的突变。取决于所使用的Cas9分子/gRNA分子复合物,可以实现特异性编辑、有效载荷递送或二者。在实施例中,实现了切割和有效载荷递送两者。在实施例中,在识别其靶基因组序列之后,Cas9分子/gRNA分子复合物促进细胞死亡。在实施例中,eaCas9分子/gRNA分子复合物切割靶核酸。在实施例中,它不递送有效载荷。虽然不希望被理论所束缚,据信内源性细胞元件(例如,DNA损伤凋亡信号传导级联的元件)在这些实施例中促进凋亡。在实施例中,eaCas9分子/gRNA分子复合物切割靶核酸并且递送有效载荷。有效载荷可以包含这样一种化合物,其抑制生长或细胞分裂,或促进凋亡,例如DNA损伤凋亡信号传导级联的元件。在实施例中,第二Cas9分子/gRNA分子复合物用于递送包含第二化合物的有效载荷,该第二化合物抑制生长或细胞分裂,或促进凋亡,例如DNA损伤凋亡信号传导级联的元件。递送第二有效载荷的Cas9分子/gRNA分子复合物可以包含eiCas9分子或eaCas9分子。另外的(例如,第三或第四)Cas9分子/gRNA分子复合物可以用于递送另外的有效载荷,例如抑制生长或细胞分裂或者促进凋亡的另外的化合物,例如DNA损伤凋亡信号传导级联的另外的元件促进。在实施例中,Cas9分子/gRNA分子复合物递送包含以下化合物的有效载荷,该化合物抑制生长或细胞分裂,或促进凋亡,例如DNA损伤凋亡信号传导级联的元件,但是不切割靶核酸。虽然不希望被理论所束缚,据信内源性细胞元件(例如,DNA损伤凋亡信号传导级联的元件)在这些实施例中促进凋亡。在此描述了抑制生长或细胞分裂,或促进凋亡的示例性化合物(例如,DNA损伤凋亡信号传导级联的元件),例如在表XII-1中。表XII-1ATM激酶(双链断裂)ATR激酶(单链断裂)RF-C相关蛋白(RAD17)9-1-1复合物:RAD1、RAD9和HUS1检查点蛋白CHK1、CHK2P53ZIP激酶(ZIPK)快速死亡结构域相关蛋白XX(DAXX)早幼粒细胞白血病蛋白(PML)凋亡诱导因子(AIF)半胱天冬酶激活的DNA酶(CAD)(在不存在其抑制剂ICAD的情况下)在实施例中,Cas9分子/gRNA分子复合物靶向以下序列,其包括或在重排(例如,易位、倒位、插入或缺失)的断点附近。在实施例中,重排对细胞赋予不想要的特性,例如不想要的增殖。在实施例中,具有重排的细胞是癌细胞。在实施例中,重排包括激酶基因并且导致不想要的、增加的或组成型表达的激酶活性。在实施例中,重排破坏肿瘤抑制因子的表达。在实施例中,Cas9分子/gRNA分子复合物:特异性靶向并且例如切割细胞的基因组,该细胞包含重排,例如通过靶向突变,例如重排的断点或接点;或靶向(例如,用于切割或有效载荷递送)突变(例如,重排断点)的200、100、150、100、50、25、10或5个核苷酸内的核苷酸序列。本发明包括一种操纵包含基因组标签的细胞的方法,该方法包括:施用靶向所述基因组标签的Cas9分子/gRNA分子复合物,由此操纵所述细胞。在实施例中,操纵包括抑制所述细胞的生长或分裂,或杀死所述细胞。在实施例中,所述细胞是癌细胞或具有病毒感染的细胞。在实施例中,该方法包括治疗受试者(例如,人类受试者)的障碍,该障碍由具有所述基因组标签的细胞表征,例如癌症或病毒感染。在实施例中,Cas9分子/gRNA分子复合物破坏重排,例如通过引入来自模板核酸的终止密码子,例如将终止密码子插入融合蛋白中,例如包含激酶活性的融合蛋白。本发明包括一种治疗具有激酶基因向非激酶基因易位的癌症的方法,易位将激酶结构域置于非激酶基因的控制下,该方法包括:施用靶向易位的Cas9分子/gRNA分子复合物。在实施例中,编辑激酶易位的控制区(例如,启动子)或编码序列,以减少表达。XIII.组合疗法Cas9分子,gRNA分子并且特别是Cas9分子/gRNA分子复合物可以与第二治疗剂(例如,癌症药物)组合使用。在实施例中,第二治疗剂(例如,癌症药物)和Cas9分子、gRNA分子并且特别是Cas9分子/gRNA分子复合物靶向不同(例如,不重叠的)通路。在实施例中,第二治疗剂(例如,癌症药物)和Cas9分子、gRNA分子并且特别是Cas9分子/gRNA分子复合物靶向相同的或重叠的通路。示例性组合疗法包括例如:-mTOR抑制剂(例如,坦西莫司或依维莫司)与AKT特异性Cas9/gRNA分子一起;-酪氨酸激酶抑制剂,如甲磺酸伊马替尼达沙替尼博舒替尼曲妥珠单抗帕妥珠单抗(PerjetaTM);拉帕替尼吉非替尼埃罗替尼与HDAC特异性Cas9/gRNA分子一起;以及-任何化疗剂与一种或多种针对多重耐药基因(如MDR1基因)的Cas9/gRNA一起。XIV.遗传性障碍(例如,杜氏肌营养不良(DMD))的治疗在另一个方面中,本发明的特征是一种改变细胞(例如,减少或消除遗传标签的影响,例如终止密码子,例如提前终止密码子)的方法。该方法包括使所述细胞与以下项接触:在遗传标签(例如,提前终止密码子)处或上游进行切割的Cas9分子/gRNA分子复合物,由此改变该细胞。虽然不希望被理论所束缚,据信在实施例中,切割和后续外切核酸酶活性以及非同源末端连接导致序列改变,其中遗传标签(例如,提前终止密码子)被消除,例如通过将其置于不同的框中。在实施例中,同一系列的事件将适当的阅读框恢复到标签(例如,提前终止密码子)之后的序列处。当进行该方法以校正移码突变以便去除提前终止密码子时,修复可以在DNA的不同位点处进行。可以指导突变处的切割,由此完全校正移码并且将蛋白质变回其野生型(或几乎野生型)序列。还可以指导在提前终止密码子处或接近提前终止密码子处的切割,这样使得实现修复的密码子的C-末端的蛋白质的所有(或几乎所有)氨基酸是野生型的。在后一种情况下,得到的蛋白质在突变与修复位点之间可以具有一个或多个移码的氨基酸;然而,蛋白质仍可能是有功能的,因为它是全长的并且在其大部分长度上具有野生型序列。遗传标签是基因组的特定部分处的特定DNA序列,其引起表型(例如遗传病或其症状)。例如,遗传标签可以是阻止蛋白质表达的提前终止密码子。在这个情景中,提前终止密码子可以由直接产生终止密码子的突变或由导致移码的突变引起,移码导致在下游形成提前终止密码子。遗传标签还可以是点突变,其改变蛋白质中重要氨基酸的身份,从而破坏该蛋白质的功能。在实施例中,Cas9分子/gRNA分子复合物在所述靶核酸中介导双链断裂。在实施例中,遗传标签(例如,提前终止密码子)由点突变、插入、缺失或重排引起。在实施例中,突变引起移码,从而在突变的下游产生遗传标签,例如提前终止密码子。在实施例中,提前终止密码子在靶核酸内。在实施例中,靶核酸在提前终止密码子的上游。突变可以在靶核酸的上游,在靶核酸内,或在靶核酸的下游。在实施例中,双链断裂在突变的500、200、100、50、30、20、10、5或2个核苷酸内。在实施例中,双链断裂在遗传标签(例如,提前终止密码子)的500、200、100、50、30、20、10、5或2个核苷酸内。在实施例中,Cas9分子/gRNA分子复合物介导靶核酸的外切核酸酶消化。在实施例中,Cas9分子/gRNA分子复合物除去双链断裂处的1、2、3、4或5个核苷酸。在实施例中,通过非同源末端连接解决(resolved)双链断裂。在实施例中,突变和/或遗传标签(例如,提前终止密码子)在肌营养不良蛋白基因中,例如在外显子51中或在外显子51之前或之后的内含子中。提前终止密码子还可以由肌营养不良蛋白基因的密码子54、645、773、3335和3340中的一个或多个的突变引起。在实施例中,肌营养不良蛋白基因中的提前终止密码子由密码子2305到2366的缺失引起。在实施例中,使细胞与Cas9分子/gRNA分子复合物接触包括使细胞与编码Cas9分子的核酸接触。在实施例中,使细胞与Cas9分子/gRNA分子复合物接触包括用核酸(例如,质粒)或者使用病毒载体(如腺相关病毒(AAV))转染细胞。在实施例中,该方法导致遗传标签(例如,提前终止密码子)先前位于其中的蛋白质的水平增加。例如,细胞中或组织中的蛋白质水平(例如,肌营养不良蛋白水平)可以增加至少3%、4%、5%、10%、15%、20%、25%或30%。在实施例中,该方法导致提前终止密码子先前位于其中的mRNA的水平增加,例如通过阻止该mRNA经历无义介导的mRNA降解。在实施例中,靶核酸、遗传标签(例如,提前终止密码子)和突变中的一者或多者位于肌营养不良蛋白基因(其在DMD中是突变的)中。靶核酸、遗传标签(例如,提前终止密码子)和突变中的一者或多者还可以位于以下基因中:COL7A1基因(在VII型相关营养不良型大疱性表皮松解症中是突变的)、FKTN基因(在福山型先天性肌营养不良中是突变的)、dysferlin基因(在肢带型肌营养不良2B型中是突变的)、CFTR基因(在囊性纤维化中是突变的)、HEXA(在泰-萨二氏病中是突变的)、IDS基因(在亨特综合征中是突变的)、FVIII基因(在血友病中是突变的)、IDUA基因(在贺勒综合征中是突变的)、PPT1基因(在婴儿神经元蜡样质脂褐质沉积症中是突变的)、肿瘤抑制因子如ATM基因(在癌症像神经胶质瘤和B细胞慢性淋巴细胞性白血病中是突变的)、RP2(在X连锁视网膜色素变性中是突变的)、CTNS基因(在肾病性胱氨酸病中是突变的)以及AVPR2基因(在先天性肾性尿崩症中是突变的)。在实施例中,在培养的细胞中进行该方法。在实施例中,该方法进一步包括向受试者施用细胞。细胞可以是例如诱导型多能干细胞、骨髓源性祖细胞、骨骼肌祖细胞、CD133+细胞、成血管细胞(mesoangioblast)或MyoD转导的真皮成纤维细胞。在实施例中,该方法包括使细胞与模板核酸在以下条件下接触,这些条件允许在靶核酸与模板核酸之间进行同源定向修复,以校正突变或提前终止密码子。在另一个方面中,本发明的特征是一种治疗患有与遗传标签(例如提前终止密码子)相关的障碍(例如DMD)的人类受试者的方法,该方法包括向该人类受试者提供:1)在提前终止密码子处或上游进行切割的Cas9分子/gRNA分子复合物或2)已经与这样的复合物进行接触的细胞,由此治疗该受试者。在实施例中,Cas9分子/gRNA分子复合物在所述靶核酸中介导双链断裂。在实施例中,遗传标签(例如,提前终止密码子)由点突变、插入、缺失或重排引起。在实施例中,突变引起移码,从而在突变的下游产生提前终止密码子。在实施例中,双链断裂在突变的500、200、100、50、30、20、10、5或2个核苷酸内。在实施例中,双链断裂在提前终止密码子的500、200、100、50、30、20、10、5或2个核苷酸内。在实施例中,遗传标签(例如,提前终止密码子)在Cas9分子/gRNA分子复合物的靶核酸内。在实施例中,靶核酸在遗传标签(例如,提前终止密码子)的上游。突变可以在靶核酸的上游,在靶核酸内,或在靶核酸的下游。在实施例中,Cas9分子/gRNA分子复合物介导靶核酸的外切核酸酶消化。在实施例中,Cas9分子/gRNA分子复合物除去双链断裂处的1、2、3、4或5个核苷酸。在实施例中,通过非同源末端连接解决双链断裂。在实施例中,突变和/或遗传标签(例如,提前终止密码子)在肌营养不良蛋白基因中,例如在外显子51中或在外显子51之前或之后的内含子中。提前终止密码子还可以由肌营养不良蛋白基因的密码子54、645、773、3335和3340中的一个或多个的突变引起。在实施例中,肌营养不良蛋白基因中的提前终止密码子由密码子2305到2366的缺失引起。在实施例中,使细胞与Cas9分子/gRNA分子复合物接触包括使细胞与编码Cas9分子的核酸接触。在实施例中,使细胞与Cas9分子/gRNA分子复合物接触包括用核酸(例如,质粒)或者使用病毒载体(如腺相关病毒(AAV))转染细胞。在实施例中,该方法导致遗传标签(例如,提前终止密码子)先前位于其中的蛋白质的水平增加。例如,细胞中或组织中的蛋白质水平(例如,肌营养不良蛋白水平)可以增加至少3%、4%、5%、10%、15%、20%、25%或30%。在实施例中,该方法导致提前终止密码子先前位于其中的mRNA的水平增加,例如通过阻止该mRNA经历无义介导的mRNA降解。在实施例中,靶核酸、遗传标签(例如,提前终止密码子)和突变中的一者或多者位于肌营养不良蛋白基因(其在DMD中是突变的)中。靶核酸、遗传标签(例如,提前终止密码子)和突变中的一者或多者还可以位于以下基因中:COL7A1基因(在VII型相关营养不良型大疱性表皮松解症中是突变的)、FKTN基因(在福山型先天性肌营养不良中是突变的)、dysferlin基因(在肢带型肌营养不良2B型中是突变的)、CFTR基因(在囊性纤维化中是突变的)、HEXA(在泰-萨二氏病中是突变的)、IDS基因(在亨特综合征中是突变的)、FVIII基因(在血友病中是突变的)、IDUA基因(在贺勒综合征中是突变的)、PPT1基因(在婴儿神经元蜡样质脂褐质沉积症中是突变的)、肿瘤抑制因子如ATM基因(在癌症像神经胶质瘤和B细胞慢性淋巴细胞性白血病中是突变的)、RP2(在X连锁视网膜色素变性中是突变的)、CTNS基因(在肾病性胱氨酸病中是突变的)以及AVPR2基因(在先天性肾性尿崩症中是突变的)。在实施例中,在培养的细胞中进行该方法。在实施例中,该方法进一步包括向受试者施用细胞。细胞可以是例如诱导型多能干细胞、骨髓源性祖细胞、骨骼肌祖细胞、CD133+细胞、成血管细胞或MyoD转导的真皮成纤维细胞。在实施例中,该方法包括使细胞与模板核酸在以下条件下接触,这些条件允许在靶核酸与模板核酸之间进行同源定向修复,以校正突变或提前终止密码子。在实施例中,受试者患有选自以下项的障碍:杜氏肌营养不良(DMD)、胶原VII型相关营养不良型大疱性表皮松解症、福山型先天性肌营养不良和肢带型肌营养不良2B型、囊性纤维化、溶酶体贮积症(如泰-萨二氏病、亨特综合征和肾病性胱氨酸病)、血友病、贺勒综合征、婴儿神经元蜡样质脂褐质沉积症、X连锁视网膜色素变性(RP2)、癌症(如神经胶质瘤和B细胞慢性淋巴细胞性白血病)以及先天性肾性尿崩症。XV.治疗由成熟特化细胞的缺乏表征的障碍,例如由毛细胞、支持细胞或神经节神经元的损失造成的听力受损;或由β胰岛细胞的损失造成的糖尿病在另一个方面中,本发明的特征是一种改变细胞的方法,例如以促进其他成熟特化细胞的发育,例如在再生疗法中。例如,可以上调增殖基因和/或可以抑制检查点抑制剂,例如以向下驱动一种或多种分化通路。在实施例中,该方法包括增殖和指定谱系成熟的诱导。在实施例中,该方法包括,例如用于恢复或改善听力,使所述细胞与以下项接触:Cas9分子/gRNA分子复合物,其上调促进毛细胞发育的基因或下调抑制毛细胞发育的基因,由此改变该细胞。在实施例中,Cas9分子/gRNA分子递送有效载荷,所述有效载荷上调促进毛细胞发育的基因。在实施例中,Cas9分子/gRNA分子递送有效载荷,所述有效载荷下调抑制毛生长的基因。在实施例中,Cas9分子/gRNA分子复合物编辑细胞的基因组,以上调促进毛生长的基因。在实施例中,使用模板核酸来实现Cas9分子/gRNA分子复合物对基因组的改变,该改变上调促进毛生长的基因。在实施例中,Cas9分子/gRNA分子复合物编辑细胞的基因组,以下调抑制毛生长的基因。在实施例中,使用模板核酸来实现Cas9分子/gRNA分子复合物对基因组的改变,该改变下调促进毛生长的基因。在实施例中,所述细胞是iPS细胞、天然毛细胞祖细胞或成熟毛细胞。在实施例中,Cas9分子/gRNA分子例如通过改变基因的结构(例如,通过编辑基因组)或通过递送调节基因的有效载荷来修饰基因的表达。在实施例中,基因是转录因子或其他调节基因。在实施例中,用于毛细胞或其他成熟细胞再生,该方法包括以下项中的一项或多项或所有项:使细胞与Cas9分子/gRNA分子复合物接触,使得上调细胞增殖的以下项中的一项或多项:c-Myc、GATA3、Oct4、Sox2、Wnt、TCF3;使细胞与Cas9分子/gRNA分子复合物接触,使得下调检查点的以下项中的一项或多项:BCL2、BMP、Hes1、Hes5、Notch、p27、Prox1、TGFβ;以及使细胞与Cas9分子/gRNA分子复合物接触,使得打开成熟通路。对于毛细胞,这将包括以下项中的一项或多项:Atoh1(Math1)、Barhl1、Gfi1、Myo7a、p63、PAX2、PAX8、Pou4f3,并且对于神经元,这将包括以下项中的一项或多项:NEFH、Neurod1、Neurog1、POU4F1。在实施例中,该方法包括内耳毛细胞、外耳毛细胞、螺旋神经节神经元和耳支持细胞的产生。在实施例中,可以调节(例如,上调)一种或多种生长因子,例如,可以上调TPO用于产生血小板并且可以上调GCSF用于产生嗜中性粒细胞。在另一个方面中,本发明提供了在此描述的改变的细胞,例如在第XV部分中。在另一个方面中,本发明的特征是一种治疗听力受损的方法。该方法包括向所述受试者施用在此描述的改变的细胞,例如在第XV部分中。在实施例中,细胞是自体的。在实施例中,细胞是同种异体的。在实施例中,细胞是异种异体的。在另一个方面中,本发明的特征是一种治疗受试者(例如听力受损)的方法。该方法包括向所述受试者施用:Cas9分子/gRNA分子复合物,其上调促进毛生长的基因或下调抑制毛生长的基因,由此改变该细胞。在实施例中,Cas9分子/gRNA分子递送有效载荷,所述有效载荷上调促进毛生长的基因。在实施例中,Cas9分子/gRNA分子递送有效载荷,所述有效载荷下调抑制毛生长的基因。在实施例中,Cas9分子/gRNA分子复合物编辑细胞的基因组,以上调促进毛生长的基因。在实施例中,使用模板核酸来实现Cas9分子/gRNA分子复合物对基因组的改变,该改变上调促进毛生长的基因。在实施例中,Cas9分子/gRNA分子复合物编辑细胞的基因组,以下调抑制毛生长的基因。在实施例中,使用模板核酸来实现Cas9分子/gRNA分子复合物对基因组的改变,该改变下调促进毛生长的基因。在实施例中,Cas9分子/gRNA分子例如通过改变基因的结构(例如,通过编辑基因组)或通过递送调节基因的有效载荷来修饰基因的表达。在实施例中,基因是转录因子或其他调节基因。在实施例中,该方法包括以下项中的一项或多项或所有项:施用Cas9分子/gRNA分子复合物,使得上调以下项中的一项或多项:c-Myc、GATA3、Oct4、Sox2、Wnt或TCF3;施用Cas9分子/gRNA分子复合物,使得打开成熟通路。对于毛细胞,这将包括以下项中的一项或多项:Atoh1(Math1)、Barhl1、Gfi1、Myo7a、p63、PAX2、PAX8或Pou4f3,并且对于神经元,这将包括以下项中的一项或多项:NEFH、Neurod1、Neurog1或POU4F1。XVI.统治型gRNA分子及其用于限制Cas9系统的活性的用途如在此所讨论的,使用或包括编码Cas9分子或gRNA分子的核酸(例如,DNA)的方法和组合物可以另外使用或包括统治型gRNA分子。统治型gRNA分子可以与Cas9分子复合,以使该系统的组分失活或沉默,例如编码Cas9分子的核酸或编码gRNA分子的核酸。在任一情况下,统治型gRNA(例如,靶向Cas9的gRNA分子或靶向gRNA的gRNA分子)都限制Cas9/gRNA复合物介导的基因靶向的作用,并且可以对活性产生时间限制或减少脱靶活性。统治型gRNA分子可以起作用,以抑制(例如,完全或基本上抑制)Cas9系统的组分的产生并且由此限制或控制其活性。典型地,编码统治型gRNA分子(例如,靶向Cas9的gRNA分子)的核苷酸序列处于与统治型gRNA分子负调节的组分(例如,编码Cas9分子的核酸)不同的控制区(例如,启动子)的控制之下。在实施例中,不同仅仅是指未处于在功能上与两个受控序列偶联的一个控制区(例如,启动子)的控制之下。在实施例中,不同是指种类或类型不同。例如,编码统治型gRNA分子(例如,靶向Cas9的gRNA分子)的序列处于具有较低水平的表达的控制区(例如,启动子)的控制之下,或者其表达晚于编码统治型gRNA分子负调节的组分的序列(例如,编码Cas9分子的核酸)。通过举例,编码统治型gRNA分子(例如,靶向Cas9的gRNA分子)的序列可以处于在此描述的控制区(例如启动子)的控制之下,例如人类U6小核启动子或人类H1启动子。在实施例中,编码统治型gRNA分子负调节的组分的序列(例如,编码Cas9分子的核酸)可以处于在此描述的控制区(例如启动子)的控制之下,例如人类U6小核启动子、人类H1启动子,或PolII启动子,例如CMV启动子、CAGGS启动子或CB启动子。实例以下实例仅仅是说明性的,并不旨在以任何方式限制本发明的范围或内容。实例1:靶向化脓链球菌和金黄色葡萄球菌Cas9的统治型gRNA序列的生物信息学(insilico)设计使用DNA序列检索算法鉴定靶向化脓链球菌和金黄色葡萄球菌Cas9的统治型指导RNA(gRNA)。除鉴定与PAM序列邻近的潜在gRNA位点之外,该软件还在人类基因组中鉴定与所选gRNA位点相差1、2、3个或更多个核苷酸的所有PAM邻近序列。从UCSC基因组浏览器获得每个Cas9基因的基因组DNA序列,并且使用可公开获得的RepeatMasker程序针对重复元件对序列进行筛选。RepeatMasker针对重复元件和具有低复杂性的区域对输入DNA序列进行检索。输出是存在于给定查询序列中的重复的详细注释。鉴定后,基于统治型gRNA在Cas9编码序列内的切割位置、其正交性以及5’G的存在(基于人类基因组中的包含PAM的相近匹配的鉴定),将统治型gRNA按等级排列(rankedintotiers)。正交性是指在人类基因组中包含与靶序列最小数目的错配的序列的数目。“高水平的正交性”或“良好的正交性”可以例如是指20-mergRNA,其除预期靶标之外在人类基因组中既没有一致序列,又没有包含靶序列中的一个或两个错配的任何序列。具有良好正交性的靶向结构域被选择用于最小化脱靶DNA切割。等级1包括靶向Cas9的编码序列的前500个核苷酸、具有良好正交性并且以5’G开始的所有gRNA。等级2包括靶向Cas9的编码序列的前500个核苷酸、具有良好正交性但是不以5’G开始的所有gRNA。等级3包括靶向Cas9的编码序列的前500个核苷酸、具有不良正交性并且以5’G开始的所有gRNA。等级4包括靶向Cas9的编码序列的前500个核苷酸、具有不良正交性但是不以5’G开始的所有gRNA。等级5包括靶向剩余编码序列的所有gRNA。在金黄色葡萄球菌的情况下,第6等级包括其靶标具有NNGRRV的非最佳PAM的所有gRNA。针对所有化脓链球菌靶标,设计了17-mer或20-mergRNA。针对所有金黄色葡萄球菌靶标,设计了20-mergRNA。针对单-gRNA核酸酶切割并且针对双-gRNA配对“切口酶”策略对gRNA进行鉴定。设计的统治型gRNA列于表E-1至E-12中。表E-1表E-2表E-3表E-4表E-5表E-6表E-7表E-8表E-9表E-10表E-11表E-12实例2:与靶向VEGF的gRNA共转染的靶向Cas9的统治型gRNA在293T细胞中的功效在这项研究中,将293T细胞(120,000个细胞/孔,在24孔板中)用750ng的表达表位标记的(3XFlag标记的)化脓链球菌Cas9的质粒与125ng的表达靶向VEGF基因的gRNA的构建体一起进行转染(gRNA序列GGTGAGUGAGUGUGUGCGUG(SEQIDNO:1510),参见来自付(Fu)等人使用截短的指导RNA改进CIRSPR-Cas核酸酶的特异性(ImprovingCIRSPR-CasnucleasespecificityusingtruncatedguideRNAs).自然生物技术(NatBiotechnol)32,279-284(2014)的图1d的20mer的VEGFA位点3(靶位点3))。同时,将这些细胞用125ng的三种gRNA表达构建体之一进行转染:表达靶向CCR5基因的gRNA的构建体(用作对照),表达靶向化脓链球菌Cas9的统治型gRNA抗-SPCas9-175(参见实例1)的构建体,或表达靶向化脓链球菌Cas9的统治型gRNA抗-SPCas9-1(参见实例1)的构建体。在转染后一天、两天、三天、六天和九天收获细胞用于分析。为了定量内源VEGF和质粒携带的Cas9基因的突变率,在每个时间点分离总基因组DNA,并且通过PCR扩增涵盖VEGFgRNA和Cas9统治型gRNA靶向序列的区域。将扩增的PCR产物变性并且再退火,随后用T7E1核酸酶进行处理。使用如在雷荣·D.(Reyon,D.)等人(用于高通量基因组编辑的TALEN的FLASH组件(FLASHassemblyofTALENsforhigh-throughputgenomeediting).自然生物技术(NatBiotechnol)30,460-465(2012))描述的毛细管电泳仪测量突变率(插入缺失频率(indelfrequency))。三个处理组的VEGF和Cas9的突变频率(%插入缺失±标准差)示于表E-13中。这些结果确认,两种Cas9靶向的统治型gRNA都在Cas9基因中诱导突变,并且内源VEGF座位在存在或不存在共转染的Cas9靶向的统治型gRNA的情况下的突变程度类似。为了评估实验时程期间的Cas9蛋白水平,在每个时间点从每个处理组制备总蛋白溶解产物。通过SDS-PAGE分离蛋白质样品(15ug),将其印迹到PVDF膜上,并且用对3XFlag表位标签具有特异性的抗体进行探测。将对细胞骨架肌动蛋白具有特异性的抗体用作加样对照。如图7所示的,用Cas9靶向的统治型gRNA的每者进行共转染导致Cas9蛋白水平减少,尤其是在转染后六天和九天时。表E-13.VEGF和Cas9突变率实例3:不同长度的金黄色葡萄球菌gRNA的活性比较在这项研究中,将稳定表达GFP的HEK-293T细胞用表达具有不同长度(从15-20个核苷酸)的靶向结构域的gRNA的构建体与表达金黄色葡萄球菌Cas9的构建体一起进行共转染。gRNA靶向若干不同基因:VEGF(总计22个gRNA)、CCR5(总计15个gRNA)和GFP(总计10个gRNA)。所有经测试的gRNA的靶向结构域都以G核苷酸开始,并且所有gRNA靶位点都与NNGRRTPAM序列相关。为了定量VEGF和CCR5靶向gRNA的活性,在转染后两天从细胞中分离总基因组DNA,并且通过PCR扩增涵盖VEGF和CCR5gRNA靶位点的区域。将扩增的PCR产物变性并且再退火,随后用T7E1核酸酶进行处理。使用如在雷荣·D.(Reyon,D.)等人(用于高通量基因组编辑的TALEN的FLASH组件(FLASHassemblyofTALENsforhigh-throughputgenomeediting).自然生物技术(NatBiotechnol)30,460-465(2012))描述的毛细管电泳仪测量突变率(插入缺失频率)。为了定量GFP靶向gRNA的活性,转染后三天收获细胞,并且通过流式细胞术测量GFP阴性细胞(指示GFP基因的突变)的百分比。计算每个靶向结构域长度的所有gRNA的平均活性并且将其与具有20个核苷酸的靶向结构域的gRNA的平均活性进行比较。如表E-14所示,具有较短靶向结构域的gRNA与具有20个核苷酸的靶向结构域的那些相比平均活性较低。表E-14.与具有20个核苷酸的靶向结构域的gRNA相比,具有不同长度靶向结构域的金黄色葡萄球菌gRNA的平均活性。通过引用结合在此提及的所有出版物、专利和专利申请都通过以其全文引用而特此结合,如同每一单独的出版物、专利或专利申请具体且单独地指明通过引用而结合一样。在有冲突的情况下,以本申请(包括在此的任何定义)为准。等效物本领域的普通技术人员仅使用常规实验就应认识到或能够确定在此描述的本发明的具体实施例的许多等效物。虽然已经参照具体方面对本发明进行了披露,但是显而易见的是在不偏离本发明的真实精神和范围的情况下可以由本领域的普通技术人员设计本发明的其他方面和变化。所附权利要求书意在被解释为包括所有此类方面和等效变化。其他实施例在以下权利要求内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1