诱变方法与流程
本申请根据35U.S.C.§119要求于2014年1月14日提交的美国临时申请序列号61/927,458的优先权,其全部内容并入本文。
背景技术:
使用位点特异性指导RNA(guide RNA)可将RNA指导的核酸酶(RNA-guided nuclease)(例如,Cas9)靶向目的特定基因组靶位点。位点特异性指导RNA可被设计为包含i)与目的基因组靶位点的一条链互补的靶区段和ii)与RNA指导的核酸酶相互作用的核酸酶相互作用区段。使用时,所述指导RNA的靶向区段与靶基因组位点的互补序列结合,而且所述指导RNA的核酸酶相互作用区段将RNA指导的核酸酶募集到基因组靶位点,从而导致在该位点处的靶向核酸切割(例如,双链切割)。在许多细胞中,通过可在切割位点处引入突变的细胞内修复机制修复基因组位点的切割。因此,RNA指导的核酸酶可用于在已知的目的位点处引入基因组突变。
技术实现要素:
使用RNA指导的核酸酶来产生基因组突变的当前系统受限于需要鉴定靶位点并通过设计将其并入指导RNA中。相反,本文所述的系统可用于向任何表达的基因组位点引入突变,而不需为每个基因组位点设计特异性合成指导RNA或编码特异性合成指导RNA的DNA构建体。更确切地说,本文所述的系统以可剪接至由基因组基因座转录的外显子上(在外显子下游)的构造提供核酸酶相互作用区段以产生嵌合的剪接RNA,所述嵌合的剪接RNA可使核酸酶靶向基因组基因座。在一些实施方案中,将编码剪接受体位点下游核酸酶相互作用RNA区段的插入核酸构建体整合到基因(例如,基因的内含子)中。因此,基因的转录,随后剪接转录的RNA,产生了嵌合的剪接RNA,所述嵌合的剪接RNA包含至少一个剪接至核酸酶相互作用RNA区段的基因的外显子。该嵌合的剪接RNA可以i)靶向对应基因组基因座的一个或更多个等位基因(通过嵌合的剪接RNA的一个或更多个外显子与对应的基因组基因座的互补链之间的碱基配对)和ii)将RNA指导的核酸酶募集至一个或更多个等位基因(通过与嵌合的剪接RNA的核酸酶相互作用区段的相互作用),从而促进在基因组基因座的一个或更多个等位基因处基于核酸酶的切割。在一些实施方案中,RNA指导的核酸酶在被嵌合的剪接RNA分子所靶向的外显子的3’端或附近切割基因组基因座(经由与嵌合的剪接RNA分子的靶向部分进行互补碱基配对,通过与外显子结合的嵌合的剪接RNA分子将RNA指导的核酸酶指导到该位置)。应理解,在细胞中嵌合的剪接RNA分子可与基因组基因座的每个等位基因(例如,在二倍体细胞中的两个等位基因)上的对应外显子结合。因此,通过RNA指导的核酸酶可在相同位置处靶向表达的基因组基因座的每个等位基因,结果可在表达的基因组基因座之每个等位基因中的相同位置处引入突变。因此,应理解,如本文所述可突变两个或更多个等位基因(例如,多倍体细胞的3、4、5、6或更多个等位基因)。
在一些实施方案中,本文所述的组合物和方法可用于在表达的多个基因座的两个等位基因中均产生突变,其中每个基因座均产生具有剪接供体位点的转录物,并且其中表达在能够进行RNA剪接的宿主细胞内发生。例如,本文所述的组合物和方法在真核宿主细胞中是可用的。在一些实施方案中,宿主细胞是体外的。在一些实施方案中,宿主细胞是体内的。在一些实施方案中,宿主细胞是生物体(例如哺乳动物,如小鼠、非人灵长类动物或人)中的细胞。真核宿主细胞的非限制性实例包括哺乳动物、鸟类、昆虫、酵母、植物和其他真核宿主细胞。在一些实施方案中,宿主细胞是人宿主细胞。宿主细胞的非限制性实例包括但不限于:干细胞、上皮细胞、内皮细胞等。在一些实施方案中,宿主细胞是人干细胞。
本文所述的组合物和方法可用于产生在多个不同的表达的基因组基因座之每个基因座处均具有突变的宿主细胞文库。可通过以下方法产生文库:将本公开内容的插入核酸构建体递送(例如,通过转染)至宿主细胞,然后分离含有其中已插入一个或更多个核酸构建体之DNA的细胞。通过调节转染过程中与细胞混合的插入核酸构建体的比可产生具有不同数目突变的宿主细胞。在一些实施方案中,文库中的每个突变细胞在二倍体细胞的一个或两个等位基因(或在更高倍性(例如3n、4n、5n、6n、7n、8n等倍性)的细胞的多个等位基因)的仅一个基因组基因座处平均具有一个突变。应理解,当二倍体细胞的两个等位基因均发生DNA断裂修复时,在每个等位基因中引入的突变可以不同。然而,在一些实施方案中,二倍体细胞文库中的每个突变细胞在一个或两个等位基因的两个或更多个不同基因组基因座处平均具有一个突变。在一些实施方案中,二倍体细胞文库中的每个突变细胞在单个基因组基因座的两个等位基因处平均具有一个突变。还应理解,在给定的基因组基因座处可产生不同的突变并且其可存在于文库中的不同宿主细胞中。例如,本文所述的插入构建体可整合到表达的基因组基因座的不同位置(例如,内含子)中,并因此在基因组基因座的不同外显子中(例如,在每个不同外显子的3’端)产生突变。在一些实施方案中,产生具有许多不同细胞的文库,所述细胞各自具有不同的整合位点。在一些实施方案中,产生具有许多细胞的文库,所述细胞多至103、102至104、102至105、102至106、102至107、102至109、103至106、103至107、104至106、104至107或104至108,其各自具有不同的整合位点。
在一些实施方案中,可通过选择出在特定种类的基因内具有插入(随机或靶向)的细胞来构建并设置文库以使其包含不同种类的基因。例如,文库的细胞可在编码调控因子、代谢因子、发育因子、受体(例如,免疫检查点受体、G-蛋白偶联受体)、酶(例如,激酶、磷酸酶)、转录因子、结构蛋白、动力蛋白的基因以及其他种类基因,包括编码调控RNA(例如miRNA,非编码RNA(例如,IncRNA)等)的基因内具有插入。
在一些实施方案中,可筛选基因组突变的文库以鉴定对用一种或更多种候选化合物的处理敏感的一个或更多个基因座。然而,应理解,可使用任何测定来筛选突变的文库以鉴定与目的表型或性质相关的一个或更多个基因座。
本发明的一些方面涉及在能够进行剪接的细胞(例如真核细胞)中产生能够指导DNA核酸酶到基因组靶标之靶特异性RNA分子的方法。在一些实施方案中,所述方法包括将重组核酸引入到真核细胞中,其中所述重组核酸包含第一核酸区域,所述第一核酸区域编码第二核酸区域上游的剪接受体位点,所述第二核酸区域编码能够与RNA指导的DNA核酸酶相互作用的RNA区段。在一些实施方案中,所述方法包括将重组核酸整合到真核细胞的基因组基因座中,其中所述重组核酸包含第一核酸区域,所述第一核酸区域编码第二核酸区域上游的剪接受体位点,所述第二核酸区域编码能够与RNA指导的DNA核酸酶相互作用的RNA区段。
本发明的一些方面提供了促进细胞内基因组DNA的RNA指导之切割的方法。在一些实施方案中,所述方法包括在细胞中产生包含剪接至第二RNA区段之第一RNA区段的RNA分子,其中所述第一RNA区段包含由基因组基因座转录的外显子序列且所述第二RNA区段包含能够与RNA指导的DNA核酸酶相互作用的RNA区段。在一些实施方案中,所述方法还包括在细胞中表达RNA指导的DNA核酸酶。
本发明的一些方面涉及在真核细胞中产生指导DNA修饰酶的靶特异性核酸的方法。在一些实施方案中,所述方法包括将重组核酸引入真核细胞中,其中所述重组核酸包含第一核酸区域,所述第一核酸区域编码第二核酸区域上游的剪接受体位点,所述第二核酸区域编码能够与DNA修饰酶相互作用的RNA区段。在一些实施方案中,所述DNA修饰酶是RNA指导的DNA核酸酶。在一些实施方案中,所述真核细胞是干细胞。
本发明的一些方面涉及核酸,所述核酸包含第一核酸区域,所述第一核酸区域编码第二核酸区域上游的剪接受体位点,所述第二核酸区域编码能够与DNA修饰酶相互作用的RNA区段。在一些实施方案中,所述DNA修饰酶是RNA指导的DNA核酸酶。
在一些实施方案中,所述重组核酸是DNA分子。在一些实施方案中,所述重组核酸包含转座子末端序列(例如,在线性重组核酸的5’端和3’端)。在一些实施方案中,转座子末端序列包含反向末端重复序列(inverted terminal repeat sequences,ITRs)。在一些实施方案中,转座子末端序列包含同向末端重复序列。在一些实施方案中,同向末端重复序列在ITRs的侧翼。在一些实施方案中,转座子末端序列包含5’末端CCY和3’末端GGG。在一些实施方案中,转座子末端序列包含5’末端CCC和3’末端GGG。在一些实施方案中,转座子末端序列靶向TTAA插入位点。在一些实施方案中,转座子末端序列包含PiggyBac转座子特异性反向末端重复序列(ITRs)。在一些实施方案中,转座子末端序列包含Tagalong转座子特异性反向末端重复序列(ITRs)。在一些实施方案中,重组核酸还包含编码选择或筛选标志物的第三核酸区域。在一些实施方案中,选择或筛选标志物是抗生素抗性蛋白或者荧光蛋白或生物发光蛋白。
在一些实施方案中,剪接受体位点包含如5’-X1X2X3-3’所示的序列,其中:X1是A;X2是G或C;并且X3是A、G、C或U,其中3’剪接点在X2和X3之间。在一些实施方案中,X2是G。在一些实施方案中,X3是A、G或C。在一些实施方案中,所述剪接受体位点包含如5’-X1X2X3X4X5-3’所示的序列,其中:X1是A、C或U;X2是A;X3是G;X4是A、G或C;并且X5是A、U或C,其中3’剪接点在X3和X4之间。在一些实施方案中,所述剪接受体位点包含如5′-X1X2X3X4X5X6X7X8X9X10X11X12X13X14X15X16X17X18X19X20X21X22-3′(SEQ ID NO:18)所示的序列,其中:X1、X3、X5,X7、X9、X12、X15、X16和X17各自独立地选自:A、G、C和U;X2是C或G;X4是U;X6、X8、X10、X11、X13、X14各自独立地选自:G、C和U;X18是A、C或U;X19是A;X20是G;X21是A、C或G;并且X22是A、U或C,其中3’剪接位点在X20和X21之间。
在一些实施方案中,核酸酶相互作用区段包含至少一个与RNA指导的DNA核酸酶相互作用的茎部。在一些实施方案中,核酸酶相互作用区段包含由非互补RNA核苷酸分开的第一和第二茎部。在一些实施方案中,所述第一茎部包含具有如5’-GUUGUAGC-3’所示核苷酸序列的链。在一些实施方案中,所述第二茎部包含如5’-UUCUC-3’所示的核苷酸序列。在一些实施方案中,所述第二茎部的两条链的互补碱基对通过环结构共价连接。在一些实施方案中,核酸酶相互作用区段包含如5’-GUUUUAGAGCUAGAAAUAGCAAGUUAAAAU-3’(SEQ ID NO:1)所示的序列。
在一些实施方案中,真核细胞是哺乳动物细胞。在一些实施方案中,真核细胞是植物细胞。在一些实施方案中,哺乳动物细胞是人细胞。
在一些实施方案中,重组核酸编码RNA指导的DNA核酸酶。在一些实施方案中,RNA指导的DNA核酸酶是CRISPR相关的(Cas)核酸酶。在一些实施方案中,Cas核酸酶是II型Cas核酸酶。在一些实施方案中,Cas核酸酶是Cas9核酸酶。在一些实施方案中,Cas9核酸酶是脑膜炎奈瑟氏球菌(Neisseria meningitidis)Cas9核酸酶。在一些实施方案中,Cas9核酸酶是嗜热链球菌(Streptococcus thermophiles)Cas9核酸酶。在一些实施方案中,RNA指导的DNA核酸酶在DNA中引入单链断裂。在一些实施方案中,RNA指导的DNA核酸酶在DNA中引入双链断裂。在一些实施方案中,RNA指导的DNA核酸酶在以下条件下表达,所述条件促进i)RNA指导的DNA核酸酶和RNA分子的第二RNA区段之间的相互作用,和ii)在编码外显子序列的一个或更多个基因组基因座处的DNA切割。在一些实施方案中,在外显子序列的剪接供体位点上游5个碱基对之内发生DNA切割。
在一些实施方案中,一个或更多个基因组基因座是编码外显子序列的两个或更多个等位基因。在一些实施方案中,两个或更多个等位基因是哺乳动物细胞中的两个等位基因。
本文更详细地描述了这些方面和另一些方面。
附图简述
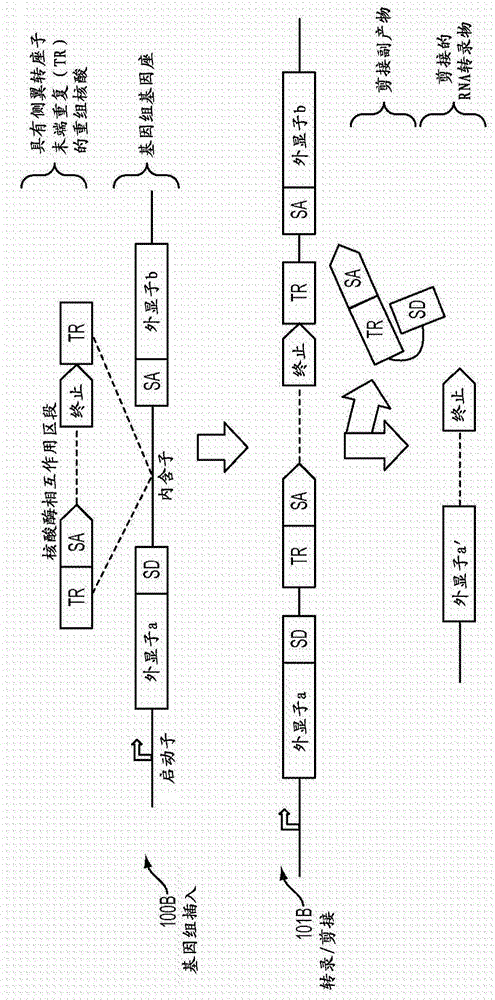
图1A和1B示出了生成嵌合的剪接RNA分子(含外显子a’)的非限制性实施方案;
图2A和2B示出了由靶向多个等位基因的嵌合的剪接RNA分子(含外显子a’)指导的核酸切割系统,以及在靶向的核酸切割之后DNA修复诱导的诱变的非限制性实施方案;
图3示出了在DNA修复诱导的诱变之后转座子切除的非限制性实施方案;
图4A-C示出了包含来自脑膜炎奈瑟氏球菌的靶向CRISPR相关的RNA(crRNA)和反式激活crRNA(tracrRNA)的序列之核酸酶相互作用区段的非限制性实施方案。SEQ ID NO:2在图4A中列出;SEQ ID NO:3在图4B中列出;SEQ ID NO:4在图4C中列出;
图4D示出了利用插入重组核酸的II型CRISPR系统,所述插入重组核酸包含含有来自脑膜炎奈瑟氏球菌的靶向crRNA和tracrRNA的序列的核酸酶相互作用区段和侧翼的PiggyBac转座子序列;
图4E示出了人肌养蛋白(dystrophin)基因的两个外显子/内含子边界,外显子13是SEQ ID NO:5且外显子24是SEQ ID NO:6;
图5A示出了共有剪接供体和受体位点的非限制性实施方案;
图5B示出了嵌合RNA的非限制性实施方案。SEQ ID NO:7在图5B中列出;
图6A示出了核酸构建体的非限制性实施方案,所述核酸构建体包含装有前间区序列邻近基序(protospacer adjacent motif,PAM)的外显子以及编码包含剪接受体和核酸酶相互作用区段的RNA的部分;
图6B示出了编码RNA指导的核酸酶之核酸构建体的非限制性实施方案;
图7示出了用于评估CRISPR活性的工作流程的非限制性实施方案;
图8示出了用于使经修饰的核酸酶靶向基因组位点的系统的非限制性实施方案,其中外显子a’表示经剪接的RNA分子;
图9提供了插入重组核酸的序列(SEQ ID NO:19)的非限制性实例。所述重组核酸包含核酸区域上游的剪接受体位点,所述核酸区域编码能够与RNA指导的核酸酶相互作用的RNA区段;和
图10提供了经改造以表达Cas9核酸酶的核酸序列的非限制性实例。DNA序列对应于SEQ ID NO:20,而蛋白质序列从左至右对应于SEQ IDNO:21、22和23。
发明详述
在一些实施方案中,本公开内容的一些方面提供了可用于对细胞内基因组基因座的一个或更多个等位基因进行修饰(例如,突变)的方法和组合物。在某些实施方案中,本文所述的方法和组合物涉及产生嵌合的剪接RNA分子,其包含剪接至核酸酶相互作用RNA区段的经转录外显子。
本公开内容的一些方面涉及用于细胞内修饰靶核酸的方法和组合物。在一些实施方案中,通过核酸酶对靶核酸进行细胞内修饰,所述核酸酶通过包含第一靶向区段的嵌合剪接RNA分子被指导到靶核酸,所述第一靶向区段与靶核酸(例如,在靶位点与双链DNA分子的一条链)互补且被剪接至能够与核酸酶相互作用的第二区段。在一些实施方案中,第一区段包含至少一个外显子,而第二区段包含能够与CRISPR相关核酸酶(例如,Cas9核酸酶)相互作用的RNA。
在一些实施方案中,细胞内产生嵌合的剪接RNA分子,并且其包含对应于剪接至重组RNA区段的经转录基因组区域(例如,包含一个或更多个外显子)的RNA区段,其中在整合到经转录基因组区域之内含子中的重组核酸上编码所述重组RNA区段。因此,在一些实施方案中,本公开内容的一些方面涉及在细胞内提供包含与能够跟核酸酶相互作用之RNA连接的剪接受体位点的RNA。在一些实施方案中,通过将构建体整合到基因组位点中提供RNA。
在一些实施方案中,嵌合的剪接RNA分子与表达的基因组基因座结合(例如,通过表达的基因座处靶向区段和基因组DNA的互补链之间的互补碱基配对)以及与嵌合的剪接RNA分子之核酸酶相互作用区段结合的核酸酶结合。因此,所述核酸酶被指导到基因组基因座。在一些实施方案中,核酸酶在具有与嵌合的剪接RNA上的靶向区段互补之序列的基因组位点处或附近切割基因组DNA(例如,在一条链或两条链上)。在一些实施方案中,宿主细胞修复机制修复经切割的DNA并在修复过程中在切割位点处引入突变。应理解,即使编码核酸酶相互作用区段的重组核酸被整合到基因组基因座的仅一个等位基因中,该方法也可以靶向表达的基因组基因座的多个等位基因(例如,二倍体生物体中的两个等位基因)。因此,本文所述的方法和组合物可用于在细胞中将核酸酶活性靶向基因座的多个等位基因(例如,二倍体细胞中的两个等位基因)。在一些实施方案中,核酸酶在一个或更多个等位基因中引入双链断裂。
在一些实施方案中,本公开内容的一些方面可用于在表达的基因组基因座处(例如,在被靶向的每个表达的基因组基因座的两个或更多个等位基因处)产生具有一个或更多个修饰(例如,突变)的宿主细胞。在一些实施方案中,可以产生在不同基因座中具有突变的宿主细胞的文库并且可以筛选这些文库以鉴定一个或更多个目的基因座(例如,与疾病或对治疗的响应或另一些目的性质相关)。
在一些实施方案中,宿主细胞可以是具有一个或更多个突变的细胞,突变在修复过程中提高错误的频率,因此提高在本文所述的过程中所产生的突变的频率。
本文所公开的重组核酸可以以任何合适的载体进行递送。例如,重组核酸可以在任一端具有促进重组或靶向目的插入位点的序列。在一些实施方案中,重组核酸可以在病毒载体中进行递送,例如反转录病毒(如,慢病毒)、疱疹病毒(如,1型单纯疱疹病毒)等。
在一些实施方案中,重组核酸在转座子中进行递送。在一些实施方案中,重组核酸在包含TTAA-特异性转座子系统之短重复元件的载体中进行递送。在一些实施方案中,重组核酸在包含对TTAA靶位点表现出偏爱并在FP-基因座或在基因组的其他区域内插入之元件的载体中进行递送。
在一些实施方案中,重组核酸在包含PiggyBac(PB)转座子元件的载体中进行递送,PiggyBac(PB)转座子元件是通过“剪切和粘贴(cut andpaste)”机制有效转座的移动遗传元件。在一些实施方案中,在转座过程中,PB转座酶识别位于转座子载体两端的转座子特异性反向末端重复序列(ITRs)并有效地从原来的位点移动内容物(content)并将其有效地整合到TTAA染色体位点中。
在一些实施方案中,将经改造以表达适当转座酶(例如,Piggy Bac(PB)转座酶、睡美人(Sleeping Beauty,SB)转座酶、转座酶Tn5等)的重组核酸递送到宿主细胞以在细胞中实现所需类型的转座。
在一些实施方案中,重组核酸在这样的载体中进行递送,所述载体在杆状病毒AcMNPV或GmMNPV的few-polyhedra(FP)基因座内包含移动的宿主DNA插入元件的序列。在一些实施方案中,重组核酸在包含tagalong(或者称为TFP3)转座子之转座子序列的载体中进行递送。
在一些实施方案中,重组核酸在包含LOOPER元件的载体中进行递送,LOOPER元件具有与piggyBac同源的序列。在一些实施方案中,LOOPER元件是以5’CCY....GGG 3’终止的DNA元件并且靶向TTAA插入位点。
在一些实施方案中,重组核酸在包含TTAA特异性化石(fossil)重复元件(例如MER75和MER85)的载体中进行递送。在一些实施方案中,TTAA特异性化石重复元件以5’CCC....GGG 3’终止并靶向TTAA插入位点。
在一些实施方案中,重组核酸在包含玉米Ac/Ds系统的侧翼转座子序列的载体中进行递送。在一些实施方案中,重组核酸中在包含P元件的载体中进行递送。在一些实施方案中,重组核酸在包含属于Tn家族的细菌转座子之序列的载体中进行递送。在一些实施方案中,重组核酸在包含Alu序列的载体中进行递送。在一些实施方案中,重组核酸在包含水手样元件(Mariner-like element)的载体中进行递送。在一些实施方案中,重组核酸在包含促进Mu噬菌体转座之序列的载体中进行递送。在一些实施方案中,重组核酸在包含来自反转录转座子家族Ty1、Ty2、Ty3、Ty4或Ty5之转座子序列的载体中进行递送。在一些实施方案中,重组核酸中在包含helitron的转座子序列的载体中进行递送。在一些实施方案中,重组核酸在睡美人转座子中进行递送。
在一些实施方案中,重组核酸在T-DNA载体中进行递送(例如,用于递送至植物细胞)。
应理解,可使用任何适当的方法将重组核酸插入到基因组基因座中。在一些实施方案中,可将插入的重组核酸改造为包含与目的基因组基因座(例如,癌基因或整合的病毒基因)同源的侧翼序列以促进(例如通过同源重组)靶向插入到靶基因座中。在一些实施方案中,插入的重组核酸包含与目的基因组基因座同源的侧翼序列,其中所述侧翼序列为至多100bp、至多500bp、至多1kb、至多2kb、至多3kb或至多5kb。在一些实施方案中,所述侧翼序列为10bp至100bp、100bp至500bp、100bp至1kb、100bp至2kb、500bp至3kb或1kb至5kb。
在一些实施方案中,提供了编码在剪接受体位点下游的RNA分子之核酸酶相互作用区段的重组核酸。当将重组核酸引入到宿主细胞中时(例如,通过转染、病毒转导、电穿孔或其他技术),它可以整合到表达的模板核酸外显子的剪接供体位点下游之表达的模板核酸内(例如,基因组核酸的表达区的内含子内)。在一些实施方案中,所述重组核酸在有或没有促进转录的载体(例如,基于脂质的载体)的情况下通过转染递送至细胞。在一些实施方案中,所述重组核酸通过病毒转导递送至细胞。
可对来自该位点的所得转录物进行剪接以产生嵌合的剪接RNA分子,其包含剪接至核酸酶相互作用RNA区段上的表达的核酸上游的外显子。该嵌合的剪接分子可以充当靶向分子以将核酸酶靶向表达的模板核酸。嵌合的剪接RNA分子的外显子部分充当靶向序列,它与表达的模板核酸的一条链互补,并且可通过互补碱基配对结合。这通过将核酸酶募集到结合的嵌合剪接RNA位点的相互作用RNA区段将核酸酶靶向该模板核酸(例如,基因组核酸)。
因此,在一些实施方案中,本公开内容的一些方面涉及产生将核酸酶靶向核酸上的特定靶位点或区域之RNA分子的组合物和方法。在一些实施方案中,靶向RNA分子包含靶向区域和核酸酶相互作用区域二者。在一些实施方案中,在细胞内两个区域被剪接在一起以在细胞内产生靶向RNA。在靶核酸和核酸酶二者存在的情况下,靶向RNA充当将靶核酸和核酸酶聚集在一起的物质,从而促进通过核酸酶切割靶核酸。靶向RNA的靶向区段对应于由靶核酸转录的部分,因此,其与靶核酸(例如,基因组DNA)的一条链互补并且可与靶核酸结合(例如通过与靶DNA进行互补碱基配对)。在一些实施方案中,靶向RNA的核酸酶相互作用区段与核酸酶相互作用,从而促进了靶核酸的切割。然而,应理解,在一些实施方案中,可使用经修饰的核酸酶。经修饰的核酸酶可以保留其与靶向RNA的核酸酶相互作用区段结合的能力,但是其被修饰以除去其核酸切割活性和/或引入一个或更多个另外的效应物功能(例如,如本文更详细描述的调控和/或酶促)。
因此,在一些实施方案中,靶向RNA包含两个区域:i)与核酸靶标互补的区域,以及ii)与核酸酶相互作用的区域。当在细胞中与核酸酶一起提供时,靶向RNA与靶核酸结合(通过其互补的第一区域)并通过与核酸酶相互作用(通过与核酸酶相互作用的区域)促进靶核酸的切割。
在一些实施方案中,参照图1A和1B示出了本公开内容的一些方面。特别地,在图1A和1B中示出了生成靶向的基因组DNA切割系统的非限制性实施方案。在图1A中,提供了编码RNA的重组核酸,所述RNA包含剪接受体(SA)位点下游的核酸酶相互作用区段。在一些实施方案中,在核酸酶相互作用区段的下游编码转录终止序列(终止(stop))。在一些实施方案中,在核酸酶相互作用区段的下游编码聚腺苷酸化信号。
步骤100A描绘了将重组核酸插入两个外显子(外显子a和外显子b)之间的基因组基因座的内含子中,在第一外显子(外显子a)的剪接供体(SD)位点的下游。应理解,重组核酸的插入可由随机整合或靶向整合到基因组的位点(例如,内含子内的位点)中引起。在随机或靶向整合的情况下,可分离(例如,随机或者使用选择或筛选)具有不同整合位点的不同细胞并进一步进行评估。还应理解,可将重组核酸整合到基因中的任何内含子中。取决于特定的内含子,所得到的差别将是在不同的等位基因位置(例如,不同的外显子)出现切割(以及随后的误差校正,如果有的话)。还应理解,所公开的方法不限于其中插入发生在内含子之内的情况。在一些实施方案中,可在内含子、外显子、非翻译区或另外的位置内或邻近处发生插入,只要所需的剪接仍然有效。
在图1A和1B中,外显子a的剪接供体位点与核酸酶相互作用区段的剪接受体位点被重组核酸的基因组插入位点之前的内含子部分分开。在步骤101A中,从基因组基因座的启动子转录产生包含外显子a’的RNA转录物,其剪接供体位点在核酸酶相互作用区段的剪接受体位点的上游。RNA转录物的剪接产生经剪接的嵌合RNA分子,其包含紧接外显子a’下游的核酸酶相互作用区段,如在步骤101A中所示。图1A还示出了,在步骤101A中,由剪接反应产生的剪接副产物。所述剪接副产物包括剪接供体和受体位点以及一部分内含子。
在图1B中,编码包含剪接受体(SA)位点下游的核酸酶相互作用区段之RNA的重组核酸的侧翼为转座子末端重复(transposon terminal repeat,TR)。转座子末端重复促进重组核酸整合到基因组中。在图1B中,如步骤100B-101B所示,转座子构建体整合到基因组基因座的两个外显子(外显子a外显子和b)之间的内含子中。与图1A类似,如步骤101B中所示,RNA转录物的剪接产生剪接的嵌合RNA分子,所述RNA分子包含紧接外显子a下游的核酸酶相互作用区段。图1B还示出了,在步骤101B中,由剪接反应产生的剪接副产物。所述剪接副产物包括剪接供体和受体位点,一部分内含子以及第一转座子末端重复。
如本文所述,可通过由单个整合核酸表达的嵌合的剪接RNA分子来靶向基因组基因座的多个等位基因。图2A和2B示出了通过其中整合了重组核酸的仅一个等位基因所表达的嵌合剪接RNA分子来靶向基因组基因座的两个等位基因的非限制性实施方案。还应理解,图2A和2B中所示的过程可导致在细胞内基因组基因座的多个等位基因(例如,二倍体生物体中的两个等位基因)处产生基因组突变。
如在图2A中所描绘的,嵌合的剪接RNA分子(例如,如通过图1A或1B的步骤产生)可促进RNA指导的DNA核酸酶与基因组基因座的等位基因(其在内含子中不包含整合的核酸)靶向结合,如步骤200A中所示。在步骤200A中,嵌合的剪接RNA分子(剪接的RNA转录物)与编码外显子a的基因组基因座结合(通过在剪接的RNA上外显子a区段和在基因组基因座处外显子a互补链之间的碱基配对相互作用)。与基因组外显子a基因座结合的嵌合剪接RNA分子还募集在相同细胞中表达的RNA指导的DNA核酸酶(通过核酸酶和嵌合的剪接RNA分子的核酸酶相互作用区段之间的相互作用)。
如步骤201A中所示,通过嵌合的剪接RNA分子募集到基因组位点的核酸酶可切割基因组核酸。
可通过细胞内修复酶修复所得的经切割基因组区域。然而,在一些情况下,如步骤202A中所示,修复过程在切割位点处引入突变。因此,图2A中所示的过程可导致在切割位点处产生基因组突变。
如图2B中所描绘的,嵌合的剪接RNA分子可促进RNA指导的DNA核酸酶与基因组基因座的另一个等位基因(其在内含子中包含整合的核酸)靶向结合,如步骤200B中所示。嵌合的剪接RNA指导DNA核酸酶到外显子a的基因组基因座,如步骤200B中所示。募集到基因组位点的核酸酶可切割基因组核酸,如步骤201B中所示。随后,在修复过程中细胞内DNA修复酶可在断裂位点处引入突变以产生在外显子a中具有修复诱导的突变的基因组基因座,如步骤202B中所示。
因此,如图2A和2B中所示,通过如上所述的细胞DNA修复过程可将突变引入基因组基因座的多个等位基因中。
在一些实施方案中,整合的重组核酸(侧翼为转座子重复)被切除(例如,通过转座酶诱导的切除),从而在外显子a的基因组基因座处留下修复诱导的突变,但是从基因组中除去了重组核酸(连同核酸酶相互作用区段一起),如图3中所示。
在一些实施方案中,在被整合到宿主细胞基因组中的重组核酸(编码在剪接受体位点下游的核酸酶相互作用区段的重组核酸)上,转录终止序列位于核酸酶相互作用区段的下游。这终止了由重组核酸编码的序列内嵌合RNA的转录并防止转录持续通过基因组整合位点下游的任何其他内含子或外显子。
在一些实施方案中,插入到宿主基因组中的重组核酸不包含剪接受体位点上游的启动子序列。
在一些实施方案中,一个或更多个转座子末端重复序列(例如,同向或反向重复(indirect repeat),或其组合)存在于编码剪接受体位点下游的核酸酶相互作用区段的重组核酸的两端。这些转座子末端重复序列可促进重组核酸插入到宿主细胞的基因组中。
在一些实施方案中,在编码剪接受体位点下游的核酸酶相互作用区段的重组核酸上编码一个或更多个可选择标志物(例如,药物抗性标志物)。所述一个或更多个可选择标志物可用于选择其中重组核酸已经被整合到基因组中的宿主细胞。
在一些实施方案中,在整合到宿主细胞基因组中的重组核酸上编码促进转座子整合和/或切除的一种或更多种酶(例如,一种或更多种转座酶)。在一些实施方案中,在整合到宿主细胞基因组中的重组核酸上编码一种或更多种RNA指导的核酸酶(例如,Cas9)。然而,应理解,可在不同的核酸上(例如,另一些载体,例如自我复制的载体,或者在宿主细胞内的一种或更多种另一些基因座处)编码促进转座子整合和/或切除的一种或更多种酶和/或一种或更多种RNA指导的核酸酶。
核酸酶相互作用区段:
在一些实施方案中,本公开内容提供了编码具有核酸酶相互作用区段之RNA的重组核酸。在一些实施方案中,核酸酶相互作用区段包含可促进形成与RNA指导的核酸酶相互作用的二级结构的一个或更多个序列。在一些实施方案中,核酸酶相互作用区段包含可促进形成与RNA指导的核酸酶相互作用的基本上为双链RNA结构(例如,茎)的一个或更多个序列。在一些实施方案中,核酸酶相互作用区段具有与RNA指导的核酸酶相互作用的crRNA:tracrRNA复合体的自然结构特征。在一些实施方案中,核酸酶相互作用区段形成茎,其模拟在II型CRISPR系统中靶向crRNA和tracrRNA分子之间形成的碱基配对的结构。在一些实施方案中,核酸酶相互作用区段的茎包含具有表1中所示序列或其部分的一个或更多个碱基配对的结构。例如,在一些实施方案中,核酸酶相互作用区段的茎包含至少5个如表1中所示的碱基配对的结构或其部分(例如,表1的碱基配对的结构或其部分的一个茎或两个茎)的核苷酸(例如,5至10、10至15、15至20或更多个核苷酸)。在一些实施方案中,核酸酶相互作用区段的茎包含至少5个核苷酸(例如,5至10、10至15、15至20或更多个核苷酸),其具有与表1中所示的碱基配对结构的序列或其部分(例如,表1的碱基配对的结构或其部分的一个茎或两个茎)有90%、90%至95%、约95%、或95%至100%同一性的序列。
表1:RNA指导的核酸酶相互作用区域
可通过核酸酶相互作用区段形成且与RNA指导的核酸酶相互作用的碱基配对结构的另外的实例在2013年11月28日公开的,题为“METHODS AND COMPOSITIONS FOR RNA-DIRECTED TARGETDNA MODIFICATION AND FOR RNA-DIRECTED MODULATIONOF TRANSCRIPTION”的国际专利申请公开号WO/2013/176772中公开,其与碱基配对结构相关的内容(包括,例如,在公开的图8中所描绘的那些)通过引用以其整体并入本文。
在一些实施方案中,环与核酸酶相互作用区段茎部的链连接。在一些实施方案中,包含4碱基环。然而,应理解,可包含其他尺寸的环(例如,2、3、5、6、7、8、9、10或更多)。在一些实施方案中,所述环具有以下序列5’-GAAA-3’。然而,应理解,其他序列可用于所述环,本公开的各方面不限于此。
在一些实施方案中,核酸酶相互作用区段可包含表1中所示碱基配对茎的5至35个5’碱基(顶链)和5至35个3’碱基(底链),其中所述茎由环(例如,5’-GAAA-3’环)连接以形成RNA区段。在一些实施方案中,核酸酶相互作用区段可包含表1所示碱基配对茎的10至25个5’碱基(顶链)和10至25个3’碱基(底链),其中所述茎由环(例如,5’-GAAA-3’环)连接以形成RNA区段。在一些实施方案中,核酸酶相互作用区段可包含表1中所示碱基配对茎的15至20个5’碱基(顶链)和15至20个3’碱基(底链),其中所述茎由环(例如,5’-GAAA-3’环)连接以形成RNA区段。
可用于形成核酸酶相互作用区段之来自表1碱基配对结构的部分的非限制性实例包括来自表1中所示脑膜炎奈瑟氏球菌碱基配对茎的18个5’碱基(顶链)和18个3’碱基(底链),其中,所述茎由5’-GAAA-3’环连接以形成具有以下序列的RNA区段:
5’-GUUGUAGCUCCCUUUCUCGAAAGAGAACCGUUGCUACAAU-3’(SEQ IDNO:2,环加下划线)。
类似地,示于表1中的化脓链球菌茎的部分可由环(例如,5’-GAAA-3’环)连接以形成核酸酶相互作用区段。一个非限制性实例具有以下序列:
5’-GUUUUAGAGCUAGAAAUAGCAAGUUAAAAU-3’(SEQ ID NO:1,环加下划线)。
然而,应理解,如本文所述可使用具有能够与核酸酶相互作用的其他序列的其他茎环结构。
在一些实施方案中,紧接着核酸酶相互作用区域下游延伸(stretch)的3’包含尾部。在一些实施方案中,尾部具有不促进形成茎-环结构的序列。在一些实施方案中,尾部为至少5个核苷酸长(例如,5至10、10至15、15至20个核苷酸长)。然而,应理解,可包含更短或更长的尾部。此外,在一些实施方案中,提供了具有确实促进形成茎环结构之序列的尾部。
在一些实施方案中,紧接着促进RNA分子的稳定性(例如,体内稳定性)之核酸酶相互作用区域下游延伸的3’包含尾部。
图4A示出了包含RNA指导的核酸酶相互作用区域(即与来自脑膜炎奈瑟氏球菌的CRISPR相关核酸酶相互作用的碱基配对区)的核酸酶相互作用区段的非限制性实施方案。碱基配对的结构包含:i)第一链,其具有对应于来自脑膜炎奈瑟氏球菌的靶向crRNA序列之如5′GUUGUAGCUCCCUUUCUC 3′(SEQ ID NO:16)所示的序列,和ii)第二链,其具有对应于活化tracrRNA的序列之如5′GAGAACCGUUGCUACAAU 3′(SEQ ID NO:17)所示的序列,其中所述第一和第二链通过具有5’GAAA3’所示序列的环连接。图4B和4C示出了包含不同长度尾部的核酸酶相互作用区段的非限制性实施方案,每个尾部对应于来自脑膜炎奈瑟氏球菌的活化tracrRNA分子的3’序列。如图4C所描绘的尾部包含能够形成茎环结构的序列。
如图4D所示,来自脑膜炎奈瑟氏球菌的Cas9核酸酶优先在与嵌合剪接的RNA分子的互补靶向区段杂交的基因组基因座部分内切割紧接不与靶向RNA区段杂交的5’GTNNGNN 3’基序上游的几个碱基(3至4个碱基)。
图4E示出了包含多个内含子的基因(人肌养蛋白基因)的非限制性实施方案,其中一些含有对于来自脑膜炎奈瑟氏球菌的Cas9核酸酶之优选的核酸酶切割位点。图4E示出了人肌养蛋白基因的两个外显子/内含子边界,其在紧接与嵌合剪接RNA的靶向区段杂交的基因组外显子的下游将产生未杂交的5’GTNNGNN 3’基序,这将由本文所述的重组核酸整合(随后进行转录和剪接)到所示的内含子中引起。例如,将本文所述的重组核酸整合到内含子13至14(或内含子24至25)中,将导致产生包含作为靶向区段的外显子13RNA(或外显子24)和随后的核酸酶相互作用区段的嵌合的剪接RNA分子。当嵌合的剪接RNA与基因组外显子13(或外显子24)的互补链结合时,紧接外显子13(或外显子24)下游且不与嵌合剪接RNA的靶向区段互补或杂交的基因组序列对应于5’GTNNGNN 3’基序(对于内含子13-14为5’GTCAGAT 3’,对于内含子24-25为5’GTAAGAT 3’)。然而,应理解另一些序列可以帮助切割(例如,即使它们并不完全对应于切割基序),即使切割并不总是同样有效,本公开内容的各方面并不限于此。
在一些实施方案中,可在尾部的下游编码转录终止子。在一些实施方案中,转录终止子包含促进茎-环结构形成的序列。在一些实施方案中,在核酸酶相互作用区段的下游编码聚腺苷酸化信号。在一些实施方案中,聚腺苷酸化信号被一个或更多个因子(例如,酶,辅因子)识别,其切割由重组核酸编码的RNA3’部分并使该切割所产生的末端聚腺苷酸化。在一些实施方案中,聚腺苷酸化信号包含核苷酸序列:AAUAAA。在一些实施方案中,聚腺苷酸化信号是SV40早期、SV40晚期或BGH聚腺苷酸化信号。
RNA指导的核酸酶:
在一些实施方案中,RNA指导的核酸酶是CRISPR相关的核酸酶。在一些实施方案中,可使用来自一种或更多种以下生物体的Cas9核酸酶:脑膜炎奈瑟氏球菌、嗜热链球菌或齿垢密螺旋体。也可使用脑膜炎奈瑟氏球菌、嗜热链球菌或齿垢密螺旋体的直系同源物(orthologue)的Cas9核酸酶。可使用的CRISPR相关核酸酶的其他非限制性实例包括在2013年11月28日公布的题为“METHODS AND COMPOSITIONS FOR RNA-DIRECTED TARGET DNA MODIFICATION AND FORRNA-DIRECTED MODULATION OF TRANSCRIPTION,”的国际专利申请公开号WO/2013/176772中公开的那些,其有关RNA指导的核酸酶的内容通过引用以其整体并入本文。
如本文所述,不同的核酸酶对于指导RNA的不同相互作用区段和不同的靶序列显示不同的相对偏好。在一些实施方案中,指导RNA的相互作用区段与核酸酶结合,然后变为活化的并对与RNA的指导部分互补的基因组序列有特异性。RNA的指导部分的长度通常为20个核苷酸。然而,在一些实施方案中,指导部分的长度可以是10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30或更多个核苷酸。在一些实施方案中,指导部分的长度为5至25、10至30、15至25,或18至22个核苷酸。
在一些实施方案中,与指导RNA互补的基因组靶序列具有邻近其3’端的前间区序列邻近基序(PAM)。在一些实施方案中,PAM序列有助于核酸酶区别降解的基因组靶标。在本公开内容的一些方面中,通过与剪接供体位点5’位置上的外显子互补的(本文所述的嵌合剪接RNA的)指导序列将核酸酶靶向基因组位点。在这样的实施方案中,如果包含供体位点的序列是由靶向核酸酶识别的PAM序列,那么核酸酶将切割外显子内的基因组位点。因此,在一些实施方案中,选择对具有包含剪接供体位点之PAM序列(例如,PAM序列,NNNNGTNN,其被来自脑膜炎奈瑟氏球菌的Cas9酶所识别)的基因组靶标具有活性的核酸酶。
下表2列出了通过不同生物体的Cas9核酸酶识别的不同PAM序列。
表2:通过不同Cas9核酸酶识别的PAM序列
N=A、G、T或C
在一些实施方案中,通过特定的核酸酶识别的PAM序列(例如,通过化脓链球菌的天然核酸酶识别的PAM序列)可能不符合某共有序列剪接序列。然而,在某些情况下可使用识别这样序列的核酸酶,例如,在其中PAM序列包含作为剪接位点有效之序列的某些细胞类型中。
剪接受体位点:
在一些实施方案中,提供编码具有核酸酶相互作用区域5’剪接受体位点之RNA的重组核酸。在一些实施方案中,重组核酸插入到细胞中经转录的基因组位点的内含子内。在重组核酸的内源性剪接供体位点和剪接受体之间剪接所得转录物,产生嵌合的指导RNA,其包含与核酸酶相互作用区域融合的上游外显子序列并将RNA指导的核酸酶靶向编码外显子的基因组位点。
因此,本公开内容的一些方面利用RNA剪接从嵌合RNA转录物中除去内含子以产生将核酸酶靶向特定基因组位点的指导RNA。每个内含子在其5’端包含剪接供体位点,并在其3末端包含剪接受体位点。图5A描绘了在内含子的5’端具有序列GU(由GT编码)的剪接供体位点的共有序列的非限制性实施方案。然而,在一些实施方案中,剪接供体位点可以在内含子的5’端具有序列AU(由AT编码)或序列GC(由GC编码)。
图5A还描绘了在内含子的3’端具有序列AG的剪接受体位点的共有序列的非限制性实施方案。然而,在一些实施方案中,受体位点在内含子的3’端可具有序列AC。
在一些实施方案中,提供了分别包含GT和AG的剪接供体和受体位点对。在一些实施方案中,提供了分别包含AT和AC的剪接供体和受体位点对。在一些实施方案中,提供了分别包含GC和AG的剪接供体和受体位点对。在这样的实施方案中,通常在重组核酸构建体上提供剪接受体位点,而剪接供体位点在基因组中的天然位点(相对于以重组方式提供)。
图5B描绘了嵌合RNA部分的非限制性实施方案,其在内含子的3’端具有剪接受体位点,所述内含子与RNA相互作用区段(其与核酸酶相互作用)的3’端连接。
经修饰的RNA指导的核酸酶:
在一些实施方案中,通过本文所述的嵌合的剪接RNA分子可将经修饰的核酸酶指导到基因组靶位点。在一些实施方案中,经修饰的核酸酶可以是酶促无活性的(例如,其不切割DNA)。在一些实施方案中,酶促无活性的核酸酶与外显子(例如,在嵌合的剪接RNA分子中包含的外显子)的基因组基因座相关的嵌合剪接RNA分子结合,并且可充当转录障碍物(transcriptional block)以防止转录通过结合了经修饰核酸酶的位点或降低其效率。图9示出了本文所述的系统的非限制性实施方案,其中所述重组核酸的整合、转录和剪接与图1所示的那些相同。然而,存在于细胞中的核酸酶是经修饰的核酸酶,其与嵌合的剪接RNA结合但不切割相关的基因组序列。
应理解,能够结合并防止转录或降低转录效率的经修饰核酸酶在细胞中可对一个基因座的两个等位基因(或一个基因座的多个等位基因)均起作用。因此,本文所述的方法和组合物可用于沉默细胞中基因座的一个或更多个等位基因。
在一些实施方案中,可创建具有整合到不同基因组基因座(例如,不同基因的内含子,和/或一个或更多个基因的不同内含子)中的插入构建体的宿主细胞文库。根据每个宿主细胞内独立整合事件的数目和位置,文库中不同的宿主细胞可具有一个或更多个沉默的基因座(例如,2、3、4、5个或更多个)。在一些实施方案中,可筛选本文所述的宿主细胞的文库以鉴定与目的表型(例如,对一种或更多种治疗化合物响应或易感)相关的一个或更多个基因座。
在一些实施方案中,除了或代替酶促无活性,经修饰的核酸酶可具有一个或更多个新功能。在一些实施方案中,可对核酸酶进行修饰以使其包含可检测部分。在一些实施方案中,可对核酸酶进行修饰以使其包含另外的肽区段。可在核酸酶的N末端、C末端、和/或N-末端和C-末端位置之间连接另外的肽区段。在一些实施方案中,另外的肽区段是具有效应物功能的结构域。在一些实施方案中,另外的肽区段包含接头肽。在一些实施方案中,效应物功能是酶促功能和/或调节功能。效应物功能的非限制性实例包括:转录增强、转录抑制、甲基化(例如,DNA和/或DNA相关蛋白的甲基化)、脱甲基化(例如,DNA和/或DNA相关蛋白的脱甲基化)、其他DNA或RNA修饰活性、与一个或更多个调节蛋白结合、和/或其他功能,本公开内容的各方面不限于此。
因此,本文所述的方法和组合物还可用于产生宿主细胞的文库,其各自具有有效应物功能的经修饰核酸酶,其靶向不同基因座(例如,不同基因的内含子和/或一个或更多个基因的不同内含子)。应理解,如本文所述可筛选这些宿主细胞以鉴定具有目的性质的一个或更多个细胞。
在一些实施方案中,本文所述的组合物和方法可用于在单个细胞或在多个细胞中(例如,在细胞培养物中)的一个或更多个基因座处(例如,如本文所述的一个或更多个基因座的一个或更多个等位基因处)引入修饰(例如,突变)。在一些实施方案中,经修饰的细胞(例如如本文所述的经修饰的胚胎干细胞或其他干细胞)可用于产生具有原始细胞修饰(例如,一个或多个突变)的多细胞生物体。
在一些实施方案中,本文所述的组合物或方法可用于修饰多细胞生物体中的一个或更多个细胞。在一些实施方案中,可将本文所述的组合物引入(例如,通过注射或其他技术)到胚胎(或多细胞生物体的另一些多细胞发育阶段,例如胚泡)中。这可能导致修饰一个或更多个细胞(例如,所有细胞)以产生所有的细胞或细胞亚群均被修饰的成年多细胞生物体(例如,该多细胞生物体对于一个或更多个基因座处的一个或更多个修饰是嵌合的)。应理解,在本实施方案中,多细胞生物体中的不同细胞可具有不同修饰,原因是不同的修饰可能在早期发育阶段中已被引入不同的细胞中。
在一些实施方案中,本文所述的组合物和方法可用于修饰幼年或成年多细胞生物体的一个或更多个细胞。例如,可将本文所述的组合物引入(例如,通过注射或其他技术)幼年或成年多细胞生物体的一个或更多个位置。在每个位置,可如本文所述修饰一个或更多个细胞。
多细胞生物体的非限制性实例包括哺乳动物、鸟类、爬行动物。哺乳动物的非限制性实例包括人、小鼠、兔、大鼠、绵羊、山羊、牛和马。
通过以下实施例将更详细地描述本发明的一些示例性实施方案。这些实施方案是本发明的示例,本领域技术人员将认识到其不限于示例性实施方案。
实施例
实施例1:
图6示出了用于产生嵌合剪接RNA的实验系统的非限制性实施方案,所述实验系统包括i)RNA靶向区段,其对应于剪接至ii)核酸酶相互作用区段的外显子。图6A中所示的核酸构建体包含可驱动RNA分子转录的启动子(CMV启动子),所述RNA分子含有i)实验的靶区段(外显子),其紧接ii)剪接供体位点(SD)的上游,接着是iii)间插区段(包含转座子重复-PBR),下游是iv)剪接受体位点(SA),其下游是v)核酸酶相互作用区段,接着是vi)聚腺苷酸化位点(SV40pA)。在一些实施方案中,核酸构建体可包含一个或更多个另外的元件,包括但不限于:编码标签(例如,MYC表位)或标记的序列、编码蛋白质(例如,荧光蛋白)的序列、编码内部核糖体进入位点(internal ribosomal entry site,IRES)的序列,其被设置以表达来自核酸编码之转录物的一种或更多种蛋白质、等。在该经转录的RNA分子被剪接后,所得嵌合的剪接RNA包含剪接至核酸酶相互作用区段(剪接供体和剪接受体位点与间插RNA区段一起剪接掉)的外显子。可使用合适的测定评估该嵌合的剪接RNA靶向含有外显子(例如,在适当的切割位点的情况下,在剪接供体位点后)的DNA分子的能力。在一些实施方案中,测定可包括使用Cas9核酸酶来确定嵌合的剪接RNA是否可以促进含有外显子的DNA分子的切割。在一些实施方案中,可在包括图6A的测试构建体(例如在独立复制载体上或整合到基因组基因座中)和表达Cas9核酸酶的构建体二者的细胞中进行测定。图6B示出了可表达脑膜炎奈瑟氏球菌Cas9核酸酶的构建体的非限制性实施方案。图6B的构建体也可以在独立复制载体上,其整合到基因组基因座中。
应理解,一个或更多个可选择标志物可用于选择目的宿主细胞中图6A和图6B的构建体的存在。在图6A和图6B中所示的标志物分别是新霉素(Neo)和嘌呤霉素(Puro)抗性标志物。然而,应理解,可使用其他可选择标志物,本公开内容的各方面并不限于此。
应理解,例如图6A中所示的构建体可用于评估不同靶序列、不同切割序列、不同核酸酶相互作用序列和/或可变化的其他因素的效力。
实施例2:
在一些实施方案中,图6A中所示的构建体可用于将转座子末端(PBR和PBL)之间的区段整合到基因组基因座中(例如,内含子中)以评估被剪接至由基因组基因座转录的天然外显子3’端之核酸酶相互作用区段的能力。可通过转座酶(例如,PBase)促进转座子末端之间区段的基因组整合。应理解,这会导致图6A的构建体具有不同于实施例1中所述的用途。在实施例1中,剪接出现在构建体上之由CMV启动子转录的实验外显子(Exon)处。与此相反,在整合到基因组内含子中后,剪接在由基因组基因座转录的天然外显子处发生。因此,应理解整合不需要CMB外显子-SD部分。
图7示出了用于评估本文所述的系统在宿主细胞中一个或更多个基因组基因座处产生突变的效力之实验概况的非限制性实施方案。在1)中,将例如在图6A中所示的构建体(例如,在PBR和PBL之间且包含PBR和PBL的区段)与转座酶(PBase)一起共转染进宿主细胞中以促进其整合到宿主细胞的基因组基因座中。在2)中,可使用表达来自构建体之脑膜炎奈瑟氏球菌(NMCas9)的Cas9的宿主细胞,所述构建体还编码可选择标志物(Puro)。在3)中,各自包含整合的转座子区段(图6A的转座子重复之间的区段)的多个不同的单独宿主细胞克隆都可以使用在转座子区段上编码的可选择标志物(Neo)进行选择。在4)中,可提取来自不同宿主细胞克隆的基因组DNA(gDNA)。在5)中,可对gDNA进行测序以鉴定a)在不同宿主细胞克隆中的不同插入位点(PB插入位点),和b)紧接插入位点上游外显子中的潜在切割位点。在6)中,可通过确定在潜在切割位点处发现错误的频率来计算突变率(例如,由切割位点的切割和错误相关修复引起的)。应理解,可确定在基因组基因座的两个或更多个等位基因处的突变率。
应理解,在一些实施方案中,可通过转座酶(例如,PBase)的进一步作用切除转座子区段(例如,在外显子处引入突变之后)。在一些实施方案中,可通过具有在转座子区段上编码的其他标志物(例如6A图中所示的Kat标志物)来鉴定其中已经切除了转座子区段的细胞。Kat是指Katushka红色荧光蛋白,其由肌动蛋白启动子调控。应理解,在一些实施方案中,Kat转录物在细胞中相对不稳定,因为它缺乏聚腺苷酸化尾。因此,在一些实施方案中,当编码转录物的核酸被插入到聚腺苷酸化位点上游的内含子中时,转录物的稳定性将提高。这种构造有利于通过检测荧光蛋白的表达鉴定具有有用的转座子插入的细胞,仅在具有稳定的聚腺苷酸化转录物的细胞中其表达高于检测阈。在一些实施方案中,标志物的检测可用于对转座子插入到转录单位中的细胞进行鉴定和/或分选。在转座酶的进一步作用后,可进一步评估(例如,通过测序)无Kat的细胞以确认转座子区段已被切除。然而,应理解,其他标志物或技术可用于鉴定其中转座子区段已被移除的细胞,本公开内容的各方面并不限于此。
实施例3:
图9提供了插入重组核酸序列的非限制性实例。重组核酸在编码能够与RNA指导的核酸酶相互作用之RNA区段的核酸区域上游包含剪接受体位点。
图10提供了经改造以表达Cas9核酸酶的核酸序列的非限制性实例。
虽然本文描述并举例说明了本发明的几个实施方案,但是本领域普通技术人员将容易地想到用于执行所述功能和/或获得所述结果和/或本文所述的一个或更多个优点的多种其他手段和/或结构,并且每个这样的变化和/或修改都被视为在本发明的范围之内。更一般地,本领域技术人员将容易理解,本文所描述的所有参数、尺寸、材料和构造意为示例性的且实际的参数、尺寸、材料和/或构造将取决于具体的应用或使用本发明的教导的应用。本领域技术人员将认识到或能够仅仅使用常规实验以确定许多与本文所描述的本发明具体实施方案等同的方案。因此,可以理解的是,前述实施方案仅通过示例的方式给出,且在所附权利要求书及其等同方案的范围之内,可以以除了具体描述和要求保护的其他方式来实施本发明。本发明针对本文所述的每个单独的特征、系统、制品、材料和/或方法。此外,如果这些特征、系统、制品、材料和/或方法相互不矛盾,则两个或更多个这些特征、系统、制品、材料和/或方法的任意组合也包括在本发明的范围之内。
除非明确指出相反,否则如本文在说明书和权利要求书中使用的不定冠词“一”和“一个/种”,应被理解为意指“至少一个/种”。
如本文在说明书和权利要求书中使用的短语“和/或”应被理解为意指如此结合起来的要素,即,在一些情况下联合存在而在其他情况下分开存在的要素的“任一或两者”。除非明确有相反的指示,否则除了通过由“和/或”表述所具体确定的要素之外,其他要素也可任选地存在,不论与明确指出的那些要素相关或不相关。因此,作为一个非限制性实例,当与开放式语言如“包含/包括”联合使用时,关于“A和/或B”在一个实施方案中指的是A但没有B(任选地包括除了B之外的要素);在另一个实施方案中,指的是B但没有A(任选地包括除了A之外的要素);在另一个实施方案中,指的是A和B两者(任选地包括其他要素);等。
如本文在说明书和权利要求书中使用的“或”应被理解为具有与如上所定义“和/或”相同的含义。例如,当分离列表中的项目时,“或”或者“和/或”应被解释为包括性的,即包括多个要素或要素列表中的至少一个,但还包括了多于一个,并且任选地包括其他未列出的项目。只有明确表述示相反的术语,例如“仅仅之一”或“恰好之一”,或者,当在权利要求书中使用“由......组成”时,才指包括多个要素或要素列表中的恰好一个要素。一般而言,当前面有排他性的术语例如“任一”,“之一”,“仅有之一”或“恰好之一”时,本文所使用的术语“或”应该仅解释为表示排他性的替代选择(即“一个或另一个但不是两者”)。当在权利要求书中使用“基本由......组成”时,应具有其在专利法领域中所使用的通常含义。
关于一个或更多个要素的列表,如本文在说明书和权利要求书中使用的短语“至少一个/种”应理解为意指选自要素列表中任意一个/种或更多个要素中的至少一个/种要素,但是不一定包括要素列表内具体列出的各个/种要素和每个/种要素中的至少一个/种,并且不排除要素列表中的要素的任意组合。该定义还允许除了短语“至少一个/种”所指的要素列表内明确指出的要素之外,可任选存在其他要素,不论与那些明确指出的要素相关或不相关。因此,作为一个非限制性实例,“A和B中的至少一个/种”(或等同地,“A或B中的至少一个/种”或等同地,“A和/或B中的至少一个/种”)在一个实施方案中可指,至少一个/种A,任选地包括多于一个/种A,而不存在B(并任选地包括除了B之外的要素);在另一个实施方案中,指的是至少一个/种B,任选地包括多于一个/种B,而不存在A(且任选地包括除A之外的要素);在另一个实施方案中,指的是至少一个/种A,任选地包括多于一个/种A,和至少一个/种B,任选地包括多于一个/种B(且任选地包括其他要素);等。
在权利要求书以及在上述说明书中,所有的过渡短语例如“包含”,“包括”,“携带”,“具有”,“含有”,“涉及”,“持有”等应理解为开放式的,即意指包括但不限制于。仅过渡短语“由......组成”和“基本上由...组成”应分别是封闭的或半封闭的过渡短语,如美国专利局专利审查程序手册2111.03部分所述。
在权利要求中使用顺序术语例如“第一”,“第二”,“第三”等来修饰权利要求元素本身并不意味着一个权利要求要素相对于另一个权利要求要素的任何优先级、先后次序或顺序,或者执行方法的动作的时间顺序,而是仅用作将具有某一名称的一个权利要求要素与具有相同名称(除顺序术词的使用之外)的另一个要素区分开的标签以区分权利要求要素。
- 还没有人留言评论。精彩留言会获得点赞!