一种定向敲降斑马鱼基因组中多拷贝基因的方法与流程
本发明涉及生物技术领域,尤其涉及一种定向敲降斑马鱼基因组中多拷贝基因的方法。
背景技术:
在研究基因在胚胎早期发育中的功能时,我们通常在基因的某个区域设计吗啡啉(morpholino,MO)来敲降基因的表达,但由于多拷贝基因存在剪接的不一致性,无法设计针对同样剪接位点的MO来验证该基因的功能,而且MO毒性或者脱靶常导致非特异性的表型。CRISPR/Cas9是细菌和古细菌在长期演化过程中形成的一种适应性免疫防御,可用来对抗入侵的病毒及外源DNA,已成为一种适用于在培养细胞和整个生物体中实现定向诱变的基因组编辑工具。近年来,研究人员基于传统CRISPR/Cas9基因编辑系统构建出了一些新型的基因调控工具:用于下调基因的CRISPR干扰(CRISPRi)技术。
CRISPRi是指利用缺失核酸内切酶活性的Cas9(dCas9)与单条导向RNA共表达,来产生一种DNA识别复合物,利用这种复合物特异性干扰转录延伸,RNA聚合酶结合,或转录因子结合。该技术可以通过两条sgRNA的导入实现很强的基因沉默效果。不同于传统的RNA干扰技术,CRISPRi能够同时沉默任意数量的单个基因。并且,关闭非靶向基因的风险很小。此外,与RNA干扰阻止蛋白质生成不同,CRISPRi是通过阻止DNA信息被读写为RNA来发挥作用。已有研究人员证实将Krüppel associated box(KRAB)结构域与dCas9融 合,在线虫和斑马鱼中可以有效地抑制靶基因(Lijiang Long et al.,2015,Cell Research,25:638-641)。
但是KRAB结构域在斑马鱼中未找到同源基因,亟需一种dCas9融合系统,其抑制转录的结构域在斑马鱼中存在,通过靶向特异性的sgRNAs在内源基因表达位点上或附近改变基因表达。
技术实现要素:
本发明的目的是为了解决现有技术中存在的缺点,运用斑马鱼来源的Eve结构域,而提出的一种定向敲降斑马鱼基因组中多拷贝基因的方法,包括以下步骤:
步骤一:斑马鱼胚胎的制备;
步骤二:dCas9-Eve融合蛋白的表达载体构建,将编码dCas9的cDNA序列与编码Eve的cDNA序列重组时,在二者之间置入一个linker序列;
步骤三:进行sgRNA、dCas9-Eve、Cas9和基因的体外转录,再将体外转录合成的sgRNA、dCas9-Eve、Cas9mRNA和基因mRNA用RNeasy Mini Kit进行纯化;
步骤四:sgRNA的活性鉴定,将sgRNA和Cas9mRNA同时注射入1-细胞期斑马鱼胚胎,待胚胎发育至24hpf,收集5个胚胎,用金属镊子撕去壳膜,放入PCR管中,运用斑马鱼基因型鉴定试剂盒快速提取基因组DNA,再用可扩增出含sgRNA识别序列的基因启动子正向引物和反向引物为扩增引物、以上述提取的基因组DNA为模 板进行PCR扩增,之后验证PCR产物大小是否与目的片段一致,并将PCR产物进行测序,判定sgRNA是否具有活性;
步骤五:dCas9-Eve法敲降znfl1s的表达,将鉴定有活性的sgRNA以终浓度50ng/μl和250ng/μl dCas9-Eve进行混合,然后显微注射入1-细胞的斑马鱼胚胎,待胚胎发育至8hpf,用胚胎整体原位杂交法通过检测基因的表达,判定基因表达被敲降的情况。
优选的,所述斑马鱼胚胎的制备方法包括以下步骤:将斑马鱼饲养于循环水系统中,房间温度28.5℃,每天固定光照14小时,黑暗10小时,上、下午各喂食一次,收集胚胎时,提前一天将交配用的雌鱼和雄鱼分别置于交配盒的两端,中间以隔板隔开,待第二天早上光照时,将隔板抽出,雌雄交配,收集胚胎,并将胚胎置于28.5℃的恒温培养箱中培养备用。
优选的,所述所述步骤三中纯化包括如下步骤:首先向Buffer RPE加入4倍体积的无核酸酶无水乙醇,然后往体外转录的mRNA样本中加入DEPC处理过的超纯水,使得体积扩大至100μl,加入350μl的RLT,混匀,再将混合液加入到RNeasy Mini制备管中,将制备管放入2ml收集管中,12000g离心1分钟,丢掉滤液,加入500μl Buffer RPE,12000g离心1分钟,丢掉滤液,再次加入500μl Buffer RPE,12000g离心1分钟,丢掉滤液,再次12000g离心1分钟后,将制备管放入无核酸酶的EP管内,向制备管中央滴加30-50μl DEPC处理过的超纯水,12000g离心1分钟,最后用紫外分光光度计测定mRNA浓度,经1%琼脂糖凝胶电泳鉴定mRNA质量后,分装并保存 于-80℃。
优选的,步骤四中快速提取基因组DNA的过程为:向PCR管中加入10μl A液,然后将PCR管置于PCR仪器内,经65℃15分钟、95℃5分钟、16℃1分钟完成基因组DNA提取,提取的基因组DNA置于-20℃保存备用。
优选的,所述步骤五中胚胎整体原位杂交法的具体操作步骤为将胚胎用4%多聚甲醛固定,4℃过夜,第二天用尖头金属镊在解剖镜下撕去壳膜后,用25%、50%、无水乙醇梯度脱水,每次室温5分钟,脱水后的胚胎置于-20℃1小时,之后用25%PBST:75%乙醇、50%PBST:50乙醇、1×PBST梯度复水,复水后的胚胎加入预杂交液,于65℃杂交炉中放置5分钟,之后用加入酵母RNA和肝素以及RNA探针的杂交液65℃过夜,第三天,于65℃,用含50%甲酰胺、10%20×SSC和0.1%Tween的溶液洗两次,每次30分钟,之后用2×SSCT洗一次15分钟,再用0.2×SSCT洗两次,每次30分钟,再用pH7.5的MABT室温洗3次,每次5分钟,之后用封闭液室温封闭1小时后换入含有1/2000-1/5000稀释的地高辛抗体的封闭液,4℃过夜,第四天,用MABT洗八次,室温,每次30分钟,之后显色,并先加入平衡液,室温放置10分钟之后,吸出平衡液,换入显色液,避光,室温放置6-8小时,显色完全后,用PBST清洗一遍,室温5分钟,用无水乙醇清洗两遍,室温10分钟,加入包埋液(2:1混合的Bezylbenzoate和Benzylalcohol),原位杂交结果用莱卡MZ16F立体显微镜拍照记录,图像用Adobe Photoshop CS5Extended软件进行对比度和光强度 处理。
优选的,所述预杂交液为50%去离子甲酰胺、25%20×SSC和0.1%Tween的混合液。
优选的,所述封闭液为2%Blocking regent、10%绵羊血清,70%MAB和0.1%Tween的混合液。
优选的,所述平衡液为0.1M NaCl、0.1M Tris-HCl(PH=9.5)、0.05M MgCl2、0.1%Tween-20和0.5mg/ml Lavamisol的混合液。
优选的,所述包埋液为2:1混合的Bezylbenzoate和Benzylalcohol。
本发明提供的一种定向敲降斑马鱼基因组中多拷贝基因的方法,利用dCas9-Eve的方法特异敲降基因的转录,根据果蝇中的Eve抑制功能域,找到同源的斑马鱼Eve功能域,将dCas9和斑马鱼的Eve抑制功能域做融合蛋白,可以有效靶向识别基因启动子的sgRNA存在的情况,同时Eve和dCas9结合在一起后的dCas9-Eve可显著抑制任何斑马鱼基因的表达,适用范围广,而且避免了在研究基因在胚胎早期发育中受MO毒性或者脱靶导致的非特异性表型的影响。
附图说明
图1为按照本发明提出的一种定向敲降斑马鱼基因组中多拷贝基因的方法实施的实验显示图。
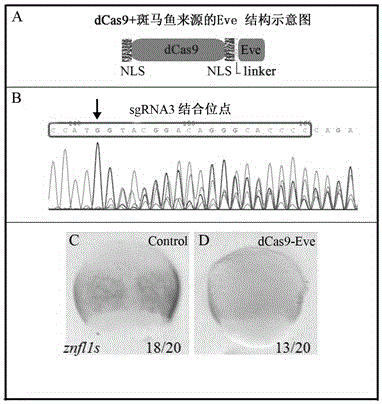
其中:A为dCas9与斑马鱼来源的Eve融合蛋白构建的结构示意图,NLS是指核定位序列(Nuclear localization sequence),B为注射过sgRNA1、sgRNA2、sgRNA3以及Cas9mRNA之后的胚胎,提取基因组DNA进行测序的结果图谱,方框内的序列为sgRNA3的结合 位点,箭头所指的地方为sgRNAs发生效果的起始位点,C为未加dCas9-Eve的znfl1s在原肠中期的表达情况,D为加入dCas9-Eve的znfl1s在原肠中期的表达情况。
具体实施方式
下面结合具体实施例对本发明作进一步解说。
参照图1,本发明提出的一种定向敲降斑马鱼基因组中多拷贝基因的方法,包括以下步骤:
步骤一:斑马鱼胚胎的准备,斑马鱼饲养于循环水系统中,房间温度28.5℃,每天固定光照14小时,黑暗10小时,上、下午各喂食一次,收集胚胎时,提前一天将交配用的雌鱼和雄鱼分别置于交配盒的两端,中间以隔板隔开,待第二天早上光照时,将隔板抽出,雌雄交配,所产胚胎由于重力会下沉到交配盒底部,收集胚胎,并将胚胎置于28.5℃的恒温培养箱中培养备用;
步骤二:dCas9-Eve融合蛋白的表达载体构建,将编码dCas9的cDNA序列与编码Eve的cDNA序列重组时,在二者之间置入一个linker序列,其中:dCas9表达载体由南京尧顺禹生物科技有限公司提供,编码该蛋白的序列为人源化的序列;
斑马鱼Eve序列为:
ATGGAAACCACAATAAAGGTTTGGTTTCAGAACCGTCGCATGAAGGACAAGAGACAGCGTCTGGCTATGACCTGGCCGCATCCTGCCGACCCCGCCTTTTACACCTATATGATGAGCCATGCTGCAGCAACGGGCAGTCTGCCCTATCCATTTCAATCTCATCTTCCCCTTCC TTACTATTCTCCACTAAGCAGTGTGACTGCAGGTTCAGCCACTGCCACTGCGGGTCCATTCTCAAATCCCCTGCGCTCGCTGGATAGTTTTCGGGTGCTTTCGCATCCATACCCGCGACCTGAACTGCTGTGCGCCTTCAGACACCCATCACTGTACCCCAGCCCGGGTCATGGGCTTGGTCCCGGTGGAAGTCCATGCTCCTGCCTTGCTTGCCACGCTTCCAGTCAAACAAACGGGCTCCAACATAGATCCAATAATGCAGAATTCTCGTGTTCGCCCACGACCAGGACTGAGGCCTTCCTCACTTTCTCGCCAGCAGTCATCAGCAAATCATCTTCGGTGTCTTTGGACCAGAGGGAGGAAGTGCCACTAACTAGA;
linker序列为:
AGCCCCAAGAAGAAGAGAAAGGTGGAGGCCAGCGGAGGTACGCGTTCTAGAACC;
步骤三:进行sgRNA、dCas9-Eve、Cas9和znfl1s的体外转录,设计3个识别znfl1s启动子区域的gRNA的序列分别为:
gRNA1(GCACTGTCCTGTACTTCCCATGG)、
gRNA2(GTTAGTAGCCAAATAAGATTTGG)、
gRNA3(ACAACATCAGAAAAACATGG),其中下划线序列为PAM序列,相应的sgRNA采用体外转录的方法合成,体外合成所用模板由PCR扩增得到,PCR反应的正向引物分别为:
gRNA1F(TAATACGACTCACTATAggcactgtcctgtacttcccaGTTTTAGAGCTAGAAATAGC)、
gRNA2F(TAATACGACTCACTATAggttagtagccaaataagattGTTTTA GAGCTAGAAATAGC)、
gRNA3F(TAATACGACTCACTATAggacaacatcagaaaaacaGTTTTAGAGCTAGAAATAGC-3’),该引物的前端大写序列为T7启动子序列,中间小写序列为原间隔,PCR反向引物序列为CTATTTCTAGCTCTAAAAC;扩增使用的模板为pMD 19-gRNA载体;该质粒由熊敬维实验室惠赠;PCR反应成分为:10μl2MasterMix、7μl超纯水、5μM正/反向引物各1μl以及pMD 19-gRNA载体1μl,反应条件为:94℃2分钟,35个循环(94℃15秒、58℃30秒和72℃20秒),72℃10分钟;PCR扩增后的产物经PCR Clean Up试剂盒纯化;体外转录sgRNA时,以纯化得到的PCR产物为模板,使用MAXIscript In Vitro Transcription Kit体外转录sgRNA,且在体外转录合成gRNA时,不加地高辛标记的UTP;体外转录mRNA的试剂盒为mMESSAGE mMACHINE T7,mRNA加尾的试剂盒为Poly(A)Tailing Kit;
体外转录Cas9和dCas9-Eve合成Cas9和dCas9-Eve mRNA时,利用XbaI和XhoI分别酶切质粒PXT7-cas9和pKS-dCas9-dmEVE使其线性化,用1%的琼脂糖凝胶电泳检测,将线性化完全的质粒用PCR Clean Up试剂盒回收模板,用DEPC水溶解,向含有DNA模板的EP管中加入10μl 2NTP/CAP,2μl 10Reaction Buffer和2μl T7enzyme Mix,轻弹EP管混匀,并离心后放于37℃反应2小时,加入1μl TURBO DNase后于37℃反应15分钟,进行加尾反应时,向20μl上述反应体系内加入36μl DEPC水,20μl 5E-PAP Buffer,10μl 25mM MnCl2,10μl ATP Solution,再加入4μl E-PAP,轻柔混匀,于37℃反应45分钟,向反应液中加入50μl LiCl,混匀后放于-80℃1小时,4℃离心,12000g 10分钟后,去上清,加入75%无酶乙醇后,12000g 4℃离心10分钟,去上清,收集mRNA,溶于DEPC水,经1%琼脂糖凝胶电泳鉴定mRNA质量后,分装并保存于-80℃;
体外转录znfl1s mRNA时,利用SmaI酶切质粒pXT7-znfl1s使其线性化,用1%的琼脂糖凝胶电泳检测确认线性化完全后,用PCR Clean Up试剂盒回收线性化模板,溶于DEPC水,体外转录步骤同sgRNA、dCas9-Eve和Cas9mRNA的体外转录;
体外转录合成的sgRNA、dCas9-Eve、Cas9mRNA和znfl1s mRNA用RNeasy Mini Kit进行纯化,纯化步骤如下:首先向Buffer RPE加入4倍体积的无核酸酶无水乙醇,然后往体外转录的mRNA样本中加入DEPC处理过的超纯水,使得体积扩大至100l,加入350l的RLT,混匀,再将混合液加入到RNeasy Mini制备管中,将制备管放入2ml收集管中,12000g离心1分钟,丢掉滤液,加入500l Buffer RPE,12000g离心1分钟,丢掉滤液,再次加入500l Buffer RPE,12000g离心1分钟,丢掉滤液,再次12000g离心1分钟后,将制备管放入无核酸酶的EP管内,向制备管中央滴加30-50l DEPC处理过的超纯水,12000g离心1分钟,最后用紫外分光光度计测定mRNA浓度,经1%琼脂糖凝胶电泳鉴定mRNA质量后,分装并保存于-80℃;
步骤四:sgRNA的活性鉴定,包括以下步骤:首先将50pg sgRNA和250pg Cas9mRNA同时注射入1-细胞期斑马鱼胚胎,待胚胎发育 至24hpf,收集5个胚胎,用金属镊子撕去壳膜,放入PCR管中,运用斑马鱼基因型鉴定试剂盒快速提取基因组DNA,其过程为:向PCR管中加入10μl A液,然后将PCR管置于PCR仪器内,经65℃15分钟、95℃5分钟、16℃1分钟完成基因组DNA提取,提取的基因组DNA置于-20℃保存备用,再用可扩增出含sgRNA识别序列的znfl1s启动子正向引物(GGCTTGATTCTTGCTTTG)和反向引物(GTGAGTGCTTGATGCTGT)为扩增引物、以上述提取的基因组DNA为模板,进行PCR扩增,扩增条件为:95℃3分钟,35个循环(95℃30秒、58℃30秒和72℃1分钟30秒),72℃10分钟,16℃10分钟,之后用电泳验证PCR产物大小是否与目的片段1004bp一致,将PCR产物直接送测序公司进行测序,测序引物为反向引物,根据测序结果显示的在PAM序列附件开始是否出现明显套峰,判定sgRNA是否具有活性;
步骤五:dCas9-Eve法敲降znfl1s的表达,将鉴定有活性的sgRNA以终浓度50ng/μl和250ng/μl dCas9-Eve进行混合,然后显微注射入1-细胞的斑马鱼胚胎,待胚胎发育至8hpf,用胚胎整体原位杂交法通过检测zfnl1s的表达,判定zfnl1s基因表达被敲降的情况;
本发明中,Znfl1s是含有一个锌指结构域的转录因子,在斑马鱼中znfl1s基因含有13个拷贝,把这13个拷贝的基因组序列(自翻译起始位点上游约2kbp起至翻译终止序列下游1kbp止)大约7k的序列进行比对分析,发现这些基因在基因组序列上的相同度非常高。
本发明中,胚胎整体原位杂交法的具体操作步骤为将胚胎用4% 多聚甲醛固定,4℃过夜;第二天用尖头金属镊在解剖镜下撕去壳膜后,用25%(1次)、50%(1次)、无水乙醇(2次)梯度脱水,每次室温5分钟,脱水后的胚胎置于-20℃1小时,之后用25%PBST:75%乙醇(1次)、50%PBST:50乙醇(1次)、1×PBST(130mM NaCl、7mM Na2HPO4和7mM NaH2PO4)梯度复水,其中T是指0.1%Tween;复水后的胚胎加入预杂交液(50%去离子甲酰胺、25%20×SSC和0.1%Tween),于65℃杂交炉中放置5分钟,之后用加入酵母RNA(500μg/ml)和肝素(50μg/ml)以及终浓度为1ng/μl的RNA探针的杂交液65℃过夜;第三天,于65℃,用含50%甲酰胺、10%20×SSC和0.1%Tween的溶液洗两次,每次30分钟,之后用2×SSCT洗一次15分钟,再用0.2×SSCT洗两次,每次30分钟,再用pH7.5的MABT(100mM马来酸,150mM氯化钠,pH=7.5,0.1%Tween-20)室温洗3次,每次5分钟,之后用封闭液(2%Blocking regent、10%绵羊血清,70%MAB和0.1%Tween)室温封闭1小时后换入含有1/2000-1/5000稀释的地高辛抗体(Anti-Digoxigenin-AP Fab fragment)的封闭液,4℃过夜;第四天,用MABT洗八次,室温,每次30分钟,之后显色,并先加入平衡液(0.1M NaCl、0.1M Tris-HCl(PH=9.5)、0.05M MgCl2、0.1%Tween-20,0.5mg/ml Lavamisol),室温放置10分钟之后,吸出平衡液,换入显色液(平衡液中加入1.2mg/ml Lavamisol,20μl的NBT/BCIP储备液),避光,室温放置6-8小时,显色完全后,用PBST清洗一遍,室温5分钟,用无水乙醇清洗两遍,室温10分钟,加入包埋液(2:1混合的Bezylbenzoate和Benzylalcohol),原位杂交结果用莱卡MZ16F立体显微镜拍照记录,图像用Adobe Photoshop CS5Extended软件进行对比度和光强度处理。
本实施例利用dCas9-Eve在sgRNA引导下通过结合在目标基因启动子序列,影响转录复合体对目标基因的转录功能,而且针对znfl1s的启动子序列上共合成了可识别不同序列的3个sgRNA,活性验证显示sgRNA1的活性明显,但sgRNA3没有活性或活性较低,而sgRNA2的活性由于sgRNA1活性的影响不好判断,为准确判断sgRNA的活性,我们在dCas9-Eve敲降实验中,利用这三种sgRNA混合后和dCas9-EvemRNA共同注射到1-2细胞期斑马鱼胚胎中,然后通过胚胎整体原位杂交观测znfl1s在原肠中期的表达情况。结果显示,znfl1s的表达受到明显的抑制,说明利用dCas9-Eve和sgRNA在很大程度上抑制了znfl1s的表达,从而实现了对znfl1s功能的敲降。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!