一种细胞核大小形态测量方法在生殖毒性评价中的应用与流程
本发明涉及一种在药物非临床研究(安全性评价)中,利用细胞核大小形态测量方法在犬睾丸粗线期、细线期和精子细胞中的鉴定及生殖毒性的评价,该技术根据测量睾丸生精细胞细胞核的面积和周长判定精母细胞处于细胞周期的不同阶段,继而根据精母细胞的各期细胞数目和比例判断精母细胞的发育情况,判断药物在雄性犬及其他雄性动物体内对生精细胞的影响。具有快速、准确、节省人力物力的巨大优势。本发明为非临床安全性评价中对犬及其他雄性动物的生殖系统的毒性评价提供重要的评价依据。
背景技术:
药物非临床生殖毒性试验是研究药物对雌雄生命生殖系统及其功能活动毒副现象和作用机制的具体方法和技术。它包括对动物的精卵形成、交配、排卵、射精、合子形成、着床、妊娠、分娩和哺乳过程,即从生殖细胞分化到整个细胞发育,从胚胎细胞发育到个体器官形成,从亲体繁殖能力到后代生殖功能,其间涉及的亲子代生殖系统器官结构、生理和生化功能、遗传和生殖特征,诸如此类方面的毒理学试验。
生殖系统除了包含在《药物生殖毒性研究技术指导原则》所提及的睾丸、附睾外,其他组织如输精管、阴茎、精囊腺、前列腺、提肛肌、提睾肌和肛门括约肌等雄性生殖器官。精子细胞发育过程也是药物常常能够影响机体的一部分,然而在长期毒性试验中一般不会被重点检查,甚至不检查。由于生殖器官概念扩大化,并且性器官的病理学检查及精子细胞的发育,在某种意义上,也是评价药物生殖发育毒性较为灵敏的指标。
分析国内外文献资料中药物致男性生殖系统损害的情况,探索药物性 男性生殖系统损害的发生规律。方法:通过检索PubMed、中国生物医学文献数据库和中国医院知识仓库期刊全文数据库,获得药物性男性生殖系统损害病例,对检索到的符合条件的药物性男性生殖系统损害资料进行计量统计学分析。结果:共检索出117例药物性男性生殖系统损害病例报告,致男性生殖系统损害居前3位的药物是心脑血管系统药物、抗感染药物和消化系统药物,共占68.38%;药物性男性生殖系统损害主要表现为性功能障碍、阴茎异常勃起、乳房发育和溢乳,共占60.68%。
精母细胞(spermatocyte)在睾丸的精子管内的二倍体细胞,经成熟分裂(减数分裂)形成单倍体精细胞。在精原细胞有丝分裂增殖过程中产生的某些能最终分化成成熟精子的细胞,分为初级精母细胞(Primary spermatocyte)和次级精母细胞(secondary spermatocyte)两种。各种精母细胞又处于细胞周期的不同阶段,因此在切片上可看到不同形态的精母细胞。
粗线期(pachytene stage):是指在减数第一次分裂前期中紧接偶线期的时期。在这一时期,已完成染色体联会的两条同源染色体互相紧靠,进而缠绕在一起,基质开始附着到染色丝上,成为一条短而粗的染色体。结果在这时期后外观上是染色体数目减半(即假减数)。不久,这些紧靠着的一对染色体各自明显地发生纵裂,各自由两条染色单体构成,成为四重结构。在同源染色单体之间常常发生交叉。在经过固定的分裂图像中,这个时期是所谓染色粒最常出现的时期。在着丝粒处发生的部分异常凝缩也可在这时期见到。这一时期的染色体称为粗线期(pachynema)。从这一时期到下一个双线期,可以看到灯刷染色体,而且可以非常清楚地看到核仁。
细线期(leptotene stage):减数分裂前期I的一个时期,又称凝集期(condensation stage)。此期在光学显微镜下可逐渐见到染色体,染色质在凝集前已复制,但仍呈单条细线状,看不到成双的染色体。但在电子显微镜下,可观察到此期的染色体是由两条染色单体构成的。对玉米细胞的减数分裂的研究发现,玉米细线染色体的端粒开始是分布在整个细胞核中,在邻近细线期结束时,端粒定位到核膜的内侧。由于很多细线染色体 的端粒与核膜结合,使染色体装配成花束状,所以细线期又称花束期。此期核的体积增大,核仁也较大,推测与RNA、蛋白质合成有关。
精子细胞(spermatid,ST):次级精母细胞完成第二次减数分裂后即形成精子细胞。早期精子细胞核呈圆形,染色质高度浓缩,胞质电子密度也很高。整个细胞成为电子密度极高的均匀球体。精子细胞各自分开,位于一个单独的小腔穴中发育。中期的精子细胞,胞质中出现大小的高尔基囊泡,并在核的一端相互融合形成泡状结构,即顶体囊,顶体形成的演变过程。顶体在形成过程中,电子密度逐渐增大。其中蛋白质水解酶逐渐在其中浓缩。顶体囊与核之间有明显的膜界限。晚期的精子细胞,顶体囊中的蛋白水解酶进一步沉积浓缩,电子密度增大。顶体囊也逐渐向前伸长,形成棘状突起。
现有的药物非临床研究中,涉及雄性动物生殖系统毒性的研究包括长期毒性研究,生殖毒性研究,以及体内外的精母细胞的染色体畸变研究。长期毒性研究中雄性动物的生殖毒性研究仅表现为对生殖器官的组织病理学检查,针对睾丸的也仅有极少的睾丸切片,缺少对睾丸及附睾整体的对精子细胞的发育和成熟的毒性评价。而生殖毒性研究仅研究雄性动物的交配力和精子的活力,缺少对精子细胞产生过程的评价。体内外的精母细胞的染色体畸变研究仅对药物对精子生成过程中对染色体复制等的评价。
常规的精母细胞的分类鉴定技术主要采用细胞核染色,观察细胞核染色质的形态,该种方法具有检测准确的技术优点,但是缺点亦相当明显:精母细胞数量相当庞大,人工对其分类,需要耗费大量的人力物力进行判定;耗时久且技术人员需要一定的知识水平及特定培训操作。
针对以上在生殖毒性毒性评价中的不足和技术缺陷,本发明为在药物安全性评价中对雄性动物生殖毒性评价的一种新的评价方法。利用长期毒性研究中使用的睾丸切片,使用显微图像分析技术快速大量的测量精母细胞细胞核的周长和面积,进而推断精母细胞的类型。该方法可代替人工进行精母细胞分类,其判断结果具有快速、准确、节省人力物力的巨大优势。
技术实现要素:
本发明为一种在雄性动物生殖系统毒性中的评价方法。
本发明为利用显微图像分析系统对雄性动物睾丸组织切片进行分析,快速自动化实现对精母细胞中细线期精母细胞、粗线期精母细胞及精子细胞的快速分类。
本发明所要解决的技术问题在于先期准确对精母细胞的不同时期的分类判断。将已判断的不同时期的精母细胞影像分类存放,并利用图像分析系统测量细胞核的周长和面积。确定了精母细胞中细线期精母细胞、粗线期精母细胞及精子细胞的细胞核面积及周长标准数值,根据标准数值利用图像分析系统自动化实现对精母细胞中细线期精母细胞、粗线期精母细胞及精子细胞的快速分类。
附图说明
图1是本发明是实验中细线期精母细胞细胞核面积分布图;
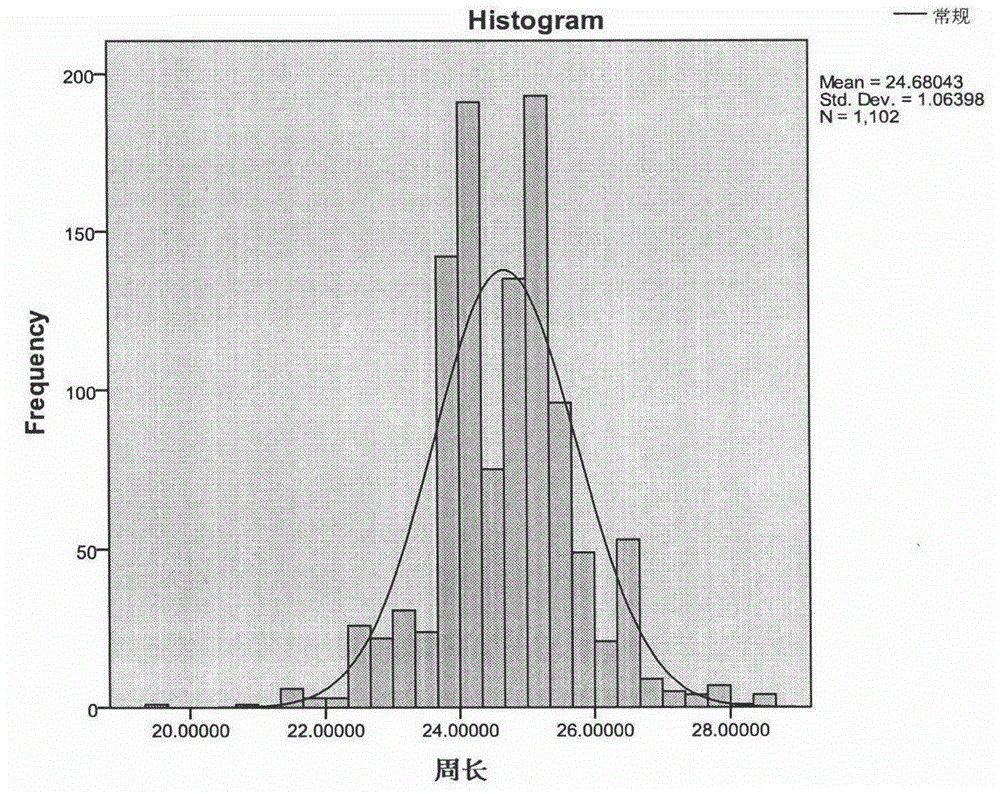
图2是本发明是实验中细线期精母细胞细胞核周长分布图;
图3是本发明是实验中粗线期精母细胞细胞核面积分布图;
图4是本发明是实验中粗线期精母细胞细胞核周长分布图;
图5是本发明是实验中精子细胞细胞核面积分布图;
图6是本发明是实验中精子细胞细胞核周长分布图。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体条件这,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
1 实验动物:比格犬60只,体重范围8-10kg,饲养条件:在普通环境动物室中饲养,符合GB14925-2010国家标准要求。
2 犬安乐处死,实验前按照30mg/kg体重肌肉注射30mg/ml的戊巴比妥钠溶液,待犬处于深麻醉状态后放血处死,取犬睾丸进行固定染色。
3 染色试剂的配制
3.1 0.5%高碘酸氧化液
配方:高碘酸 0.5g
纯净水 定容至100mL
配法:将高碘酸加入适量的纯净水中,搅拌使溶解,然后加纯净水定容至100mL即可,此溶液置于冰箱内冷藏保存。有效期为6个月。
3.2 0.5%偏重亚硫酸钠液
配方:偏重亚硫酸钠 0.5g
纯净水 定容至100mL
配法:将偏重亚硫酸钠加入适量的纯净水中,搅拌使溶解,然后加纯净水定容至100mL即可。有效期为6个月。
3.3 Schiff液
配方:碱性品红 1.0g
1mol/L盐酸 20mL
偏重亚硫酸钠 2.0g
纯净水 200mL
活性炭 2.0g
配法:先将纯净水煮沸,待温度降至90℃,加入碱性品红,搅拌均匀,再煮沸1min。待温度降至50℃时过滤,然后缓慢加入盐酸。降至25℃时加入偏重亚硫酸钠,密封放置暗处过夜后,加入活性炭,摇匀后过滤,此时液体呈无色或淡黄色,放在棕色磨口瓶内,置于冰箱内冷藏保存。有效期为6个月,如Schiff液变为红色即不能使用。
4 染色步骤
组织常规固定,采用10%中性缓冲福尔马林
4.1 石蜡切片,常规脱蜡,用纯净水洗10s。
4.2 用0.5%高碘酸氧化液氧化10min~20min,用纯净水洗2次,每次10s。
4.3 用Schiff液密闭染色10min~20min。
4.4 用0.5%偏重亚硫酸钠液滴洗2次,每次1min。
4.5 自来水冲洗2min。
4.6 用Harris苏木精染液染细胞核2min~3min。
4.7 1%盐酸乙醇分化1s,自来水冲洗返蓝5min。
4.8 梯度乙醇脱水,TO透明剂I、II透明,中性树胶或加拿大树胶封片。
5 细胞核大小形态测量
采用显微镜型号:OLYMPUS BX3-CBH。
所用软件:OLYMPUS自带软件cellSens Standard 1.7.1。
统计时使用的方法是:旋转椭圆,两点圆。
拍照时使用的倍数是1000倍。
6 结果
6.1 细线期
共检测1102个细线期精母细胞,其细胞核平均面积48.56534±4.19138μm2,其95%可信限为40.18258~56.9481μm2。经观察1102个细线期精母细胞共有14个低于可信限,29个高于可信限,最低值30.28μm2,最高值65.35μm2。其细胞核平均周长24.68043±1.06398μm,其95%可信限为22.55247~26.80839μm。经观察1102个细线期精母细胞共有14个低于可信限,29个高于可信限,最低值19.51μm,最高值28.66μm2。分布图见图1及图2。
6.2 粗线期
共检测1073个粗线期精母细胞,其细胞核平均面积18.00637±1.11821μm2,其95%可信限为15.76995~20.24279μm2。经观察1073个粗线期精母细胞共有32个低于可信限,16个高于可信限,最低值13.07μm2,最高值23.25μm2。其细胞核平均周长15.03414±0.487038μm,其95%可信限为14.09338~16.008216μm。经观察1073个粗线期精母细胞共有32个低于可信限,16个高于可信限,最低值12.82μm,最高值17.09μm。分布图见图3及图4。
6.3 精子细胞
共检测1006个精子细胞,其细胞核平均面积5.95829±1.72775μm2,其95%可信限为2.50279~9.41379μm2。经观察1006个精子细胞共有0个低于可信限,35个高于可信限,最低值13.07μm2,最高值14.98μm2。其细胞核平均周长8.56791±1.21269μm,其95%可信限为6.162538~10.99329μm。经观察1006个粗线期精母细胞共有0个低于可信限,35个高于可信限,最低值5.81μm,最高值13.72μm。分布图见图5及图6。
6.4 比较分析
根据6.1-6.3项的测量结果总结至下表1,从下表可以看出3中类型的细胞核面积及周长的均值及95%可信限均无交叉,从4.2及4.3项的测量结果来看个别精子细胞的细胞核面积及周长的最大值与粗线期细胞的细胞核面积及周长的最小值略有交叉,交叉数目较少且均属于95%可信限范围之外,可忽略不计。
表1不同类型的精母细胞细胞核面积及周长
6.5 结论
根据6.1~6.4项的结果及分析,将粗线期细胞、细线期细胞及精子细胞的细胞核面积及周长的95%可信限定位其参考范围值。
表2不同类型的精母细胞细胞核面积及周长参考范围
6.6 结论验证
随机选择60只犬(未曾测量过的标本),通过计算机图像处理系统测定细胞核面积及周长,根据参考范围判定其属于细线期、粗线期及精子细胞类型。验证结果见下表3。
表3根据细胞核面积及细胞核周长参考范围的验证结果
根据6.6的验证结果证明本方法在粗线期及细线期的判定准确率为100%,精子细胞的判断准确率为99.5%。该方法可代替人工进行精母细胞分类,其判断结果具有快速、准确、节省人力物力的巨大优势。
根据以上的验证结果,本发明利用显微图像分析系统对雄性动物睾丸组织切片进行分析,快速自动化实现对精母细胞中细线期精母细胞、粗线期精母细胞及精子细胞的快速分类。
本发明作为一种在雄性动物生殖系统毒性中的评价方法具有快速准确的判定药物在雄性动物的精母细胞的发育过程中的影响。可弥补当前在雄性动物生殖系统毒性评价方面的缺陷与不足。
- 还没有人留言评论。精彩留言会获得点赞!