一种检测器官移植患者巨细胞病毒感染的试剂盒的制作方法
本发明涉及疾病早期诊断技术领域,具体地,涉及一种检测器官移植患者巨细胞病毒感染的试剂盒。
背景技术:
巨细胞病毒是器官移植术后较为常见的条件致病病毒,严重感染者可导致移植器官失去功能甚至危及生命。器官移植受者在术中及术后需要使用大量免疫抑制剂,导致细胞免疫功能低下,巨细胞病毒特异性细胞毒T细胞和辅助T细胞免疫无应答,不能清除感染和产生免疫保护,易发生巨细胞病毒活动性感染。在没有使用预防性抗病毒治疗的情况下,器官移植术后患者巨细胞病毒的感染率为60~80%,而其中有17~28%患者将发展为巨细胞病毒病,如巨细胞病毒性肺炎、肝炎、胰腺炎、胃肠炎、脑膜脑炎等。
随着对器官移植术后预防性抗病毒治疗的重视和防治水平的不断提高,移植后巨细胞病毒感染的发生率呈现下降趋势。有报道显示:恰当使用更昔洛韦或缬更昔洛韦预防治疗能将巨细胞病毒病的发生率降低58~80%,将巨细胞病毒感染的发生率降低40%左右。但其对器官移植术后患者仍有巨大影响,它可以通过直接或间接作用增加排斥或其他感染的发生率、死亡率及降低移植物存活时间。因此,早期准确诊断巨细胞病毒感染显得至关重要。
目前可用于临床诊断巨细胞病毒感染的方法有:
1、检测外周血中巨细胞病毒特异性抗体:CMV-IgG和CMV-IgM常用于检测巨细胞病毒感染的情况。70%移植患者血清中CMV-IgG为阳性,其对诊断巨细胞病毒活动性感染特异性高,但敏感性低,实际诊断意义不大。而巨细胞病毒发生活动性感染1周后CMV-IgM方可检出,而且其特异性较CMV-IgG低,因此其对诊断巨细胞病毒早期感染意义不大。由于移植术后受体处于免疫抑制状态,CMV-IgG和CMV-IgM出现延迟或缺失,容易造成假阴性结果,影响阳性检出率,这些因素都限制了血清抗体检测在巨细胞病毒感染诊断中的作用,因此,这两种抗体检测可以作为供体和受体是否感染过巨细胞病毒的筛选指标,对诊断巨细胞病毒感染起辅助参考作用。
2、检测巨细胞病毒DNA拷贝数:定量核酸检测技术是对血清和白细胞中的CMV-DNA拷贝数进行定量分析,从而判断巨细胞病毒感染的状况。该方法还可以检测组织、肺泡灌洗液、尿液和脑脊液等标本中的CMV-DNA,其敏感度和检测速度均明显高于其它检测方法。该方法可操作性好,对于实验室条件要求低,便于推广开展。此外,若选用一个内参基因同步扩增, 获得标准曲线,则可计算病毒载量。但这种方法的缺点是变异度较大,不同实验室的检测最低值相差较远。而且,在感染早期,巨细胞病毒在局部复制、未扩散入血时,抽取外周血检测CMV-DNA的阳性率较低,影响了疾病的早期诊断。
3、抗原学检测:通过半定量荧光分析方法、标记链丝菌素-生物素结合法等方法检测巨细胞病毒-pp65抗原可提示体内活动性巨细胞病毒复制完成,其对诊断巨细胞病毒感染的准确率可达90%以上。但巨细胞病毒-pp65抗原检测是依靠抗原-抗体结合的原理,因此对标本的要求较高,新鲜的血液标本要求在8 h内送检,阳性检出率与标本新鲜程度直接相关。此外,该检测手段操作繁琐、技术要求高, 受实验人员主观经验影响多。因此,该检测方法未得到广泛推广与应用。
4、其他检测方法:病毒分离培养将标本接种于人成纤维母细胞后,通过观察细胞的病理变化来判断是否存在巨细胞病毒病毒,但因巨细胞病毒在人成纤维母细胞的增殖较为缓慢,对技术要求高,病毒敏感度低,培养周期大约4~6周,因此不适合在临床诊断中使用。移植物组织免疫组织化学检测可以明确诊断移植器官是否感染巨细胞病毒病,但该方法需要对移植物进行有创性检测,而且在国内尚无于临床诊断用的试剂盒,因此该方法仅用于科研。免疫学检测方法,通过流式细胞技术动态监测移植受者的外周血中的T淋巴细胞,分析巨细胞病毒特异性T细胞反应可以反映出巨细胞病毒感染的风险。但该方法技术要求高,尚未用于临床诊断中。
技术实现要素:
本发明的目的是为了克服现有技术的上述不足,提供一种检测器官移植患者巨细胞病毒感染标志物。
本发明的另一个目的是,提供一种检测器官移植患者巨细胞病毒感染的试剂盒。本发明专利由国家高技术研究发展计划(863计划)资助。
为了实现上述目的,本发明是通过以下技术方案予以实现的:
器官移植术后患者长期服用免疫抑制剂,机体对于巨细胞病毒感染的抵抗力薄弱,疾病进展迅速,而其早期诊断更加困难。在缺乏足够诊断依据的情况下,加用抗病毒药物不仅增加了患者的治疗成本和经济负担,也增加了不良反应的发生风险。因此,本发明通过建立巨细胞病毒感染的移植术后动物模型,将其感染早期的外周血标本保存,运用基因芯片方法筛选其差异表达的小RNA(miRNA),最后在临床感染患者外周血标本中进行确证,从而发现miR-29b-3p可以用于早期诊断器官移植患者是否感染巨细胞病毒。
因此,本发发明要求保护miR-29b-3p在制备检测器官移植患者巨细胞病毒感染试剂盒中的应用,miR-29b-3p的基因序列如SEQ ID NO:1所示。
miR-29b-3p在作为检测器官移植患者巨细胞病毒感染标志物中的应用。
一种检测器官移植患者巨细胞病毒感染的试剂盒,通过该试剂盒分别检测待测患者外周血单核细胞中的U6和miR-29b-3p的Cq值,U6和miR-29b-3p的Cq值至少测定3次,取平均值后按照下列公式和方法判断结果:
△CT值=AVERAGE(miR-29b-3p的Cq值)-AVERAGE(U6的Cq值)
结果判断:△CT值=AVERAGE(miR-29b-3p Cq值)-AVERAGE(U6 Cq值);△CT值大于或等于1时,考虑患者存在巨细胞病毒感染,结果为阳性;△CT值小于1时,考虑患者不存在巨细胞病毒感染,结果为阴性。
优选地,通过Q-PCR检测U6的Cq值,Q-PCR检测时的引物序列如SEQ ID NO:2~3所示。
优选地,通过Q-PCR检测miR-29b-3p的Cq值,Q-PCR检测时的引物序列如SEQ ID NO:4~5所示。
与现有技术相比,本发明具有如下有益效果:
本发明首次提出通过检测外周血单核细胞中miR-29b-3p的表达情况,来明确器官移植术后患者的巨细胞病毒感染情况,从而为早期诊断提供一种新思路。本发明的试剂盒能在感染早期(感染第1~3天)即可检测到miR-29b-3p的表达变化,而且不受免疫抑制状态的影响,对于早期诊断、早期治疗,具有重要意义。另外,本发明相较于常规的抗体检测或DNA拷贝数检测的阳性率高,检测样品为患者外周血,易于取材,创伤小,技术方便简单,便于推广应用。
附图说明
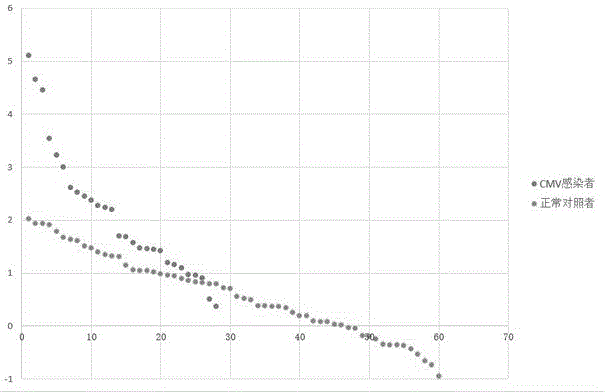
图1为器官移植术后患者外周血单核细胞中miR-29b-3p的△CT值。
具体实施方式
下面结合说明书附图和具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
实施例1
一种检测器官移植患者巨细胞病毒感染的试剂盒,该试剂盒以U6和miR-29b-3p为检测指标,试剂盒具体包括两对检测引物、q PCR检测用试剂、1份使用说明书。
两对检测引用的序列如下:
U6 Primer-F序列:5’- ATTGGAACGATACAGAGAAGATT -3’
U6 Primer-R序列:5’-GCTGTCAACGATACGCTACCT-3’
miR-29b-3p-F序列:5’- TAGCACCATTTGAAATCAGTGTT-3’
miR-29b-3p-R序列:5’-GCTGTCAACGATACGCTACCT-3’
该试剂盒的判断方法为:分别检测待测患者外周血单核细胞中的U6和miR-29b-3p的Cq值,U6和miR-29b-3p的Cq值至少测定3次,取平均值后按照下列公式和方法判断结果:
△CT值=AVERAGE(miR-29b-3p的Cq值)-AVERAGE(U6的Cq值)
结果判断:△CT值=AVERAGE(miR-29b-3p Cq值)-AVERAGE(U6 Cq值);△CT值大于或等于1时,考虑患者存在巨细胞病毒感染,结果为阳性;△CT值小于1时,考虑患者不存在巨细胞病毒感染,结果为阴性。
上述试剂盒的使用步骤如下:
用EDTA管收集待检测患者外周血2~4ml,可置于4℃冰箱中保存24小时;用巴氏吸管将外周血转移至15ml离心管中,于4℃以450g离心(加速4,减速7)5min,用巴氏吸管吸走上层液体,留下下层红色沉淀物;加入3~5倍体积红细胞裂解液,并用巴氏吸管轻轻吹打混匀,静置室温5分钟;将上述液体于4℃以450g离心(加速4,减速7)10min,用新的巴氏吸管吸走上层液体,留下下层白色沉淀物;用巴氏吸管将10ml PBS缓冲液加入到白色沉淀物上,于4℃以450g离心(加速4,减速7)10min,用新的巴氏吸管吸走上层液体,并再重复该步骤1次;得到白色沉淀物即为外周血单核细胞(PBMC)。采用本领域常规的方法提取外周血单核细胞的总RNA。然后使用紫外分光光度计检测RNA浓度和纯度。
将浓度和纯度较好的RNA样本进行反转录及Q-PCR扩增。反转录过程参照All-in-One™ miRNA First-Strand cDNA Synthesis Kit(Genecopoeia公司)反转录试剂盒说明书进行操作,将总RNA中的miRNAs反转录为cDNA。
利用Power SYBR PCR Master Mix(4367659,Genecopoeia)等试剂完成U6及miR-29b-3p表达情况的检测(Q-PCR检测U6的Cq值时使用的引物如SEQ ID NO:2~3所示;Q-PCR检测miR-29b-3p的Cq值时使用的引物如SEQ ID NO:4~5所示)。Q-PCR反应体系见表1,反应条件:95℃预变性5min,以95℃变性30sec、60℃退火30sec、60℃延伸30sec反应50个循环,结束前72℃延伸10min。
表1 Q-PCR反应体系
*的意思为cDNA按10倍稀释后再使用。
数据分析及判断:每位患者的样品通过技术复孔检测U6及miR-29b-3p各三次,2700 PCR system(Applied Biosystem公司)将计算出每次检测的Cq值,将miR-29b-3p的三次检测Cq值的平均值,减去U6三次检测Cq值的平均值,可计算出其△CT值。
公式:△CT值=AVERAGE(miR-29b-3p Cq值)-AVERAGE(U6 Cq值)
结果判断:△CT值=AVERAGE(miR-29b-3p Cq值)-AVERAGE(U6 Cq值);△CT值大于或等于1时,考虑患者存在巨细胞病毒感染,结果为阳性;△CT值小于1时,考虑患者不存在巨细胞病毒感染,结果为阴性。
实施例2
以实施例1的试剂盒检测了28例器官移植术后真菌感染患者外周血单核细胞中的miR-29b-3p的△CT值情况,其中包括3例肝移植术后患者,25例肾移植术后患者。同时,我们还检测了60位器官移植术后正常受试者外周血单核细胞中的miR-29b-3p的△CT值情况作为对照,其中包括34位肝移植术后患者,25位肾移植术后患者及1位胰肾联合移植术后患者。结果见图1和表2。
表2
该临床检测中,采用的金标准为利用Q-PCR技术检测外周血中CMV-DNA拷贝数。通过表2可知,该检测方法的真阳性率为82.14%,真阴性率为68.33%,假阳性率为31.67%,假阴性率为17.86%。
SEQUENCE LISTING
<110> 中山大学附属第一医院
<120> 一种检测器官移植患者巨细胞病毒感染的试剂盒
<130>
<160> 5
<170> PatentIn version 3.3
<210> 1
<211> 23
<212> DNA
<213> miR-29b-3p的基因序列
<400> 1
aacactgatt tcaaatggtg cta 23
<210> 2
<211> 23
<212> DNA
<213> U6 Primer-F
<400> 2
attggaacga tacagagaag att 23
<210> 3
<211> 21
<212> DNA
<213> U6 Primer-R
<400> 3
gctgtcaacg atacgctacc t 21
<210> 4
<211> 23
<212> DNA
<213> miR-29b-3p-F
<400> 4
tagcaccatt tgaaatcagt gtt 23
<210> 5
<211> 21
<212> DNA
<213> miR-29b-3p-R
<400> 5
gctgtcaacg atacgctacc t 21
- 还没有人留言评论。精彩留言会获得点赞!