检测巨细胞病毒UL54和UL97基因耐药突变的巢式PCR引物及方法与流程
本发明涉及病毒基因突变检测技术领域,具体涉及检测巨细胞病毒UL54和UL97基因耐药突变的巢式PCR引物及方法。
背景技术:
HCMV属于疱疹病毒科 ,β疱疹病毒亚科, 巨细胞病毒属, 人疱疹病毒 5 型。HCMV 基因组为线性双股 DNA 分子 , 长约 230 kb ,由长单一序列( UL)和短单一序列(US) 构成。HCMV 在自然界广泛存在,正常人群中自然感染普遍。
人巨细胞病毒(HCMV)是一种免疫缺陷或免疫不成熟人群的条件致病菌,大多数感染者无明显症状,但在先天感染的儿童中,或免疫功能受抑制的个体,如器官移植者,获得性免疫缺陷病综合征(艾滋病)患者中,容易激活感染,引发严重病变,危及生命。此外,巨细胞病毒宫内感染还是导致出生缺陷的主要原因之一。因此,巨细胞病毒的药物干预和治疗显得尤为重要。
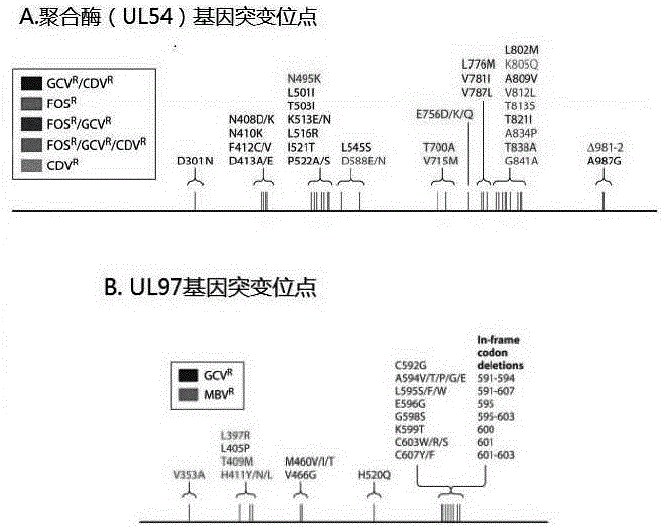
治疗HCMV感染的抗病毒药物为更昔洛韦(GCV),西多福韦(CDV)和膦甲酸(PFA)。巨细胞病毒耐药突变主要是由于UL97和UL54基因发生突变导致。UL97 基因全长 2124 个碱基 ,编码一种蛋白激酶相关的磷酸转移酶,含有保守的丝氨酸/苏氨酸激酶功能域。HCMV感染细胞内的磷酸化过程是UL97基因编码的产物所完成。GCV是第一个被开发及应用最普遍的治疗 HCMV 感染的高效药物, 必须在此酶作用下发生单磷酸化进一步三磷酸化发挥抗病毒作用, 因此,UL97基因的突变导致GCV不能发生磷酸化而获得活性,导致GCV耐药性的出现。GCV是目前预防和治疗 HCMV病的一线药物,长期治疗后,GCV首先可发生UL97突变,因此 UL97通常是临床检测耐药基因突变的首选基因。GCV耐药突变主要集中在460、520、590至607位点(图1),如M460V/I, H520Q, C592G, A594V, L595S和C603W出现在80%以上以GCV为首选药物的病人体内。UL54 基因全长3729个碱基, 编码由1242个氨基酸组成的 DNA 聚合酶。与UL97基因突变只能导致更昔洛韦(GCV)耐药不同,因为三种药物都是针对编码病毒DNA聚合酶的UL54基因的,因此该基因的突变可以导致这三种药物耐药。与UL97基因耐药位点较为集中不同,UL54基因突变位点更多,其耐药检测只能通过测序,至少需覆盖氨基酸300-1000位点(图1)。抗HCMV药物耐药是免疫功能缺陷患者的一个严重的问题, UL54和UL97基因突变引起的多药物耐药对于异源干细胞移植病人可危及生命。
目前,传统基因突变诊断方法包括限制性片段长度多态性分析(RFLP),基因芯片法,荧光定量PCR等,这些方法存在耗时费力或所需设备和耗材昂贵等缺点,导致不能在临床大规模推广,应用受到限制。同时,巨细胞病毒(HCMV)UL54和UL97基因耐药突变位点众多,上述方法根本无法全部涵盖这些位点。因此有必要建立一种高效率、使用方便的巨细胞病毒UL54和UL97基因耐药突变的方法,以实现临床快速检测和大规模人群筛查。用本专利申请的巢式PCR的方法进行检测可以完全覆盖所有的突变位点,且不需要贵重的专用仪器,对技术人员要求不高,只需要PCR实验室常规的设备即可,适用于在国内医院推广使用。
技术实现要素:
为了克服现有技术中存在的缺点和不足,本发明的目的在于提供一种检测巨细胞病毒UL54和UL97基因耐药突变的巢式PCR引物,该巢式PCR引物可以高特异、高灵敏度和高效的检测巨细胞病毒UL54和UL97基因。
本发明的另一目的在于提供一种检测巨细胞病毒UL54和UL97基因耐药突变的巢式PCR方法,该巢式PCR方法具有高度的特异性、灵敏度与准确性,所得到的PCR产物可直接送去测序,根据序列即可分析巨细胞病毒UL54和UL97基因耐药突变情况。
本发明的目的通过下述技术方案实现:一种检测巨细胞病毒UL54和UL97基因耐药突变的巢式PCR引物,该巢式PCR引物包括第一轮PCR扩增引物和第二轮PCR扩增引物(图2):
当检测巨细胞病毒UL54时,
第一轮PCR扩增引物为:
第一对引物:正向引物UL54-SF1和反向引物UL54-SR1;
第二轮PCR扩增引物为第二对引物和第三对引物:
第二对引物:正向引物UL54-SF2和反向引物UL54-SR2;
第三对引物:正向引物UL54-SF3和反向引物UL54-SR3;
当检测巨细胞病毒UL97时,
所述第一轮PCR扩增引物为:
第四对引物:正向引物UL97-SF1和反向引物UL97-SR1;
所述第二轮PCR扩增引物为:
第五对引物:正向引物UL97-SF2和反向引物UL97-SR2;
其中,UL54-SF1基因序列如SEQ ID No.1 所示,UL54-SR1基因序列如SEQ ID No.2所示,UL54-SF2基因序列如SEQ ID No.3 所示,UL54-SR2如SEQ ID No.4 所示,UL54-SF3基因序列如SEQ ID No.5所示,UL54-SR3如SEQ ID No.6 所示,UL97-SF1如 SEQ ID No.7 所示,UL97-SF1如 SEQ ID No.8 所示,UL97-SF2如SEQ ID No.9 所示,UL97-SR2如SEQ ID No.10 所示。
本发明提供的用于检测巨细胞病毒UL54和UL97基因耐药突变的引物,第一到第三对引物用来扩增UL54基因,第四到第五对引物用来扩增UL97基因。第一对引物中的正向引物(即上游引物)UL54-SF1选择巨细胞病毒UL54基因nt731-747保守区域;反向引物(即下游引物)UL54-SR1主要部分选择nt3223- 3239保守区域。第一对引物将扩增出2509bp大小的片段。第二对引物中的正向引物UL54-SF2选择巨细胞病毒UL54基因nt779-796位保守区域;反向引物UL54-SR2选择nt1924-1940位保守区域。第二对引物将扩增出1162bp大小的片段。第三对引物中的正向引物UL54-SF3选择巨细胞病毒UL54基因nt1795- 1818位保守区域;反向引物UL54-SR3选择nt3033-3048位保守区域。第三对引物将扩增出1254bp大小的片段。第四对引物中的正向引物UL97-SF1选择巨细胞病毒UL97基因nt821-842位保守区域,第四对引物中的反向引物UL97-SR1选择巨细胞病毒UL97基因nt1953-1972位保守区域,第四对引物将扩增出1152bp大小的片段。第五对引物中的正向引物UL97-SF2选择巨细胞病毒UL97基因nt868-886位保守区域,第五对引物中的反向引物UL97-SR2选择巨细胞病毒UL97基因nt1914-1933位保守区域,第五对引物将扩增出1066bp大小的片段。
本发明的另一目的通过下述技术方案实现:一种采用上述所述的巢式PCR引物检测巨细胞病毒UL54和UL97基因耐药突变的巢式PCR方法,其包括如下步骤:
(1)以第一轮PCR扩增引物对待检测DNA进行第一轮PCR,得到第一轮PCR产物,进行50-150倍稀释,得到第一轮PCR稀释产物;
(2)以第二轮PCR扩增引物对第一轮PCR稀释产物进行第二轮PCR,得到第二轮PCR产物;
(3)对第二轮PCR产物进行检测。
优选地,所述步骤(1)中,待检测DNA是从待检血清或血浆中提取DNA而得。
优选地,所述步骤(1)中,第一轮PCR反应体系的体积为10-25μL。
优选地,所述步骤(1)中,第一轮 PCR 的反应体系为:KOD FX 0.5U和dNTPs各0.4mM、2×PCR buffer for KOD FX 12.5μL、10pmol/μL的正向引物和反向引物各0.75μL和待检测DNA 1-2μL,双蒸水补齐至25μL。
优选地,所述步骤(1)中,第一轮PCR的反应程序为:1)、94℃预变性2min;2)、98℃变性10s,56℃退火30s,68℃延伸2min30s,共34个循环;3)、68℃后延伸5min。
优选地,所述步骤(2)中,第二轮PCR反应体系的体积为25-50μL。
优选地,所述步骤(2)中,第二轮 PCR的反应体系为:KOD FX 1U和dNTPs各0.4mM、2×PCR buffer for KOD FX 25μL、10pmol/μL的正向引物和反向引物各0.75μL和第一轮 PCR稀释产物 1-2μL,双蒸水补齐至50μL。
优选地,所述步骤(2)中,第二轮PCR的反应程序为:1)、94℃预变性2min;2)、98℃变性10s,56℃退火30s,68℃延伸1min10s,共34个循环;3)、68℃后延伸5min。
本发明还提供一种检测巨细胞病毒UL54和UL97基因耐药突变的试剂盒,该试剂盒包含权利要求1所述第一轮PCR扩增引物和第二轮PCR扩增引物。
本发明的有益效果在于:
本发明的巢式PCR引物可以高特异、高灵敏度和高效的检测巨细胞病毒UL54和UL97基因耐药突变。
本发明的巢式PCR方法具有高度的特异性、灵敏度与准确性,所得到的PCR产物可直接送去测序,根据序列即可分析巨细胞病毒UL54和UL97基因耐药突变的情况。
本发明限定了第一轮PCR的反应体系和反应程序,同时还限定了第二轮PCR的反应体系和反应程序,最终得到的条带清晰,结果稳定。
本发明通过选用特定的巢式PCR引物,采用巢式PCR方法,优化PCR反应体系和反应程序,扩增巨细胞病毒UL54和UL97基因具有高敏感性,与其它方法比较无非特异性扩增出现,显示高度扩增特异性,可以用于分析其耐药基因突变,实用性强,符合临床推广的要求。
本发明在长期进行病毒研究的基础上,对NCBI上巨细胞病毒序列进行比对分析,对相关引物、反应体系进行优化后,探索出一套特异、准确、操作简便的检测巨细胞病毒UL54和UL97基因耐药突变的巢式PCR方法。
附图说明
利用附图对发明作进一步说明,但附图中的实施例不构成对本发明的任何限制,对于本领域的普通技术人员,在不付出创造性劳动的前提下,还可以根据以下附图获得其它的附图。
图1为巨细胞病毒UL54和UL97基因耐药突变位点(Nell S. Lurain et al, Clinical Microbiology Reviews, Oct. 2010),其中A为聚合酶 UL54 基因突变位点示意图,B为UL97 基因的突变位点示意图。图2为巨细胞病毒UL54和UL97基因片段扩增示意图,其中A为UL54 基因的扩增片段示意图,B为UL97 基因的扩增片段示意图。
图3为本发明的电泳图,其中,泳道M为DNA marker,泳道1为UL97基因扩增产物,泳道2和3为UL54基因扩增产物。
具体实施方式
下面结合附图对本发明作进一步的说明,见附图1-3。实施例中未注明具体条件的,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商的,均为可以通过市售获得的常规产品。
实施例1
本实施例中,一种检测巨细胞病毒UL54基因耐药突变的巢式PCR引物,该巢式PCR引物包括第一轮PCR扩增引物和第二轮PCR扩增引物:
当检测巨细胞病毒UL54时,
第一轮PCR扩增引物为:
第一对引物:正向引物UL54-SF1和反向引物UL54-SR1;
第二轮PCR扩增引物为第二对引物和第三对引物:
第二对引物:正向引物UL54-SF2和反向引物UL54-SR2;
第三对引物:正向引物UL54-SF3和反向引物UL54-SR3;
本实施例, 第一对引物用于扩增UL54基因的第一轮,包括正向引物UL54-SF1 (SEQ ID No.1)和反向引物UL54-SR1(SEQ ID No.2);第二对引物用于扩增UL54基因的第二轮,包括正向引物UL54-SF2(SEQ ID No.3)和反向引物UL54-SR2(SEQ ID No.4);第三对引物用于扩增UL54基因的第二轮包括正向引物UL54-SF3(SEQ ID No.5)和反向引物UL54-SR3(SEQ ID No.6);第一至第三对引物序列分别为:
正向引物UL54-SF1:5'-TGGTCATCGATCGGCGG-3';
反向引物UL54-SR1:5'-ATGACGGCAATGTGCGG-3' ;
正向引物UL54-SF2:5'-GTTACGACTGGCGGCAGC-3';
反向引物UL54-SR2:5'-GCAGATTGCAAGGGCGG-3';
正向引物UL54-SF3:5'-AACCACTACAGCAAAGGTACGACG-3';
反向引物UL54-SR3:5'-CGACAGGCGCACGGCT-3';
每个模板DNA均采用以下PCR反应体系和PCR反应程序进行:
一种用于非治疗目的采用上述所述的巢式PCR引物检测巨细胞病毒UL54耐药突变的方法,包括如下步骤:
(1)以第一轮PCR扩增引物对待检测DNA进行第一轮PCR,得到第一轮PCR产物,进行100倍稀释,得到第一轮PCR稀释产物;所述第一轮PCR扩增引物为第一对引物;
(2)以第二轮PCR扩增引物对第一轮PCR稀释产物进行第二轮PCR,得到第二轮PCR产物;其中,当检测巨细胞病毒UL54基因耐药突变时,所述第二轮PCR扩增引物为第二对引物和第三对引物;
(3)对第二轮PCR产物进行检测。
如图2(A)所示,采用正向引物UL54-SF1和反向引物UL54-SR1进行第一轮PCR扩增,采用正向引物UL54-SF2和反向引物UL54-SR2进行第二轮PCR扩增,得UL54-1片段;采用正向引物UL54-SF1和反向引物UL54-SR1进行第一轮PCR扩增,采用正向引物UL54-SF3和反向引物UL54-SR3进行第二轮PCR扩增,得UL54-2片段。
所述步骤(1)中,待检测DNA均为从待检血清或血浆中提取DNA而得。
本实施例中,所述步骤(1)中,第一轮PCR反应体系的体积为25μL。具体地,第一轮PCR的反应体系为:KOD FX 0.5U和dNTPs各0.4mM、2×PCR buffer for KOD FX 12.5μL、10pmol/μL的正向引物和反向引物各0.75μL和待检测DNA 2μL,双蒸水补齐至25μL。
所述步骤(1)中,第一轮PCR的反应程序为:1)、94℃预变性2min;2)、98℃变性10s,56℃退火30s,68℃延伸2min30s,共34个循环;3)、68℃后延伸5min。
本实施例中,所述步骤(2)中,第二轮PCR的反应体系的体积为50μL。具体地,第二轮PCR的反应体系为:KOD FX 1U和dNTPs各0.4mM、2×PCR buffer for KOD FX 25μL、10pmol/μL的正向引物和反向引物各0.75μL和第一轮 PCR 稀释产物2μL,双蒸水补齐至50μL。
所述步骤(2)中,第二轮PCR的反应程序为:1)、94℃预变性2min;2)、98℃变性10s,56℃退火30s,68℃延伸1min10s,共34个循环;3)、68℃后延伸5min。
所述步骤(3)中,检测采用电泳检测,将第二轮PCR产物通过琼脂糖电泳配合凝胶成像系统观察结果。其中,检测的第二轮PCR产物加样量为3μL,其过程按照仪器标准操作程序进行。选择DL2,000marker(TAKARA公司)作为对照,电泳结束后分析电泳图像,第二轮PCR产物送去Invitrogen公司测序。
本实施例还提供一种检测巨细胞病毒UL54耐药突变的试剂盒,该试剂盒包括第一对引物,并且包括第二对引物或者第三对引物中的任一对引物。
实施例2
本实施例中,一种检测巨细胞病毒UL97基因耐药突变的巢式PCR引物,该巢式PCR引物包括第一轮PCR扩增引物和第二轮PCR扩增引物:
检测巨细胞病毒UL97时,
第一轮PCR扩增引物为:
第四对引物:正向引物UL97-SF1和反向引物UL97-SR1;
第二轮PCR扩增引物为:
第五对引物:正向引物UL97-SF2和反向引物UL97-SR2;
本实施例,第四对引物用于扩增UL97基因的第一轮,包括正向引物UL97-SF1(SEQ ID No.7)和反向引物UL97-SR1(SEQ ID No.8);第五对引物用于扩增UL97基因的第二轮,包括正向引物UL97-SF2(SEQ ID No.9)和反向引物UL97-SR2(SEQ ID No.10);第四至第五对引物序列分别为:
正向引物UL97-SF1:5'-GTTCCAACGACCAGATCATCAC-3';
反向引物UL97-SR1:5'-GCGAGCATTCGTGGTAGAAG-3';
正向引物UL97-SF2:5'-GACCCGCGTATGTTCTTGC-3';
反向引物UL97-SR2:5'-GACACGAGGACATCTTGGCC-3';
每个模板DNA均采用以下PCR反应体系和PCR反应程序进行:
一种用于非治疗目的采用上述所述的巢式PCR引物检测巨细胞病毒UL97耐药突变的方法,包括如下步骤:
(1)以第一轮PCR扩增引物对待检测DNA进行第一轮PCR,得到第一轮PCR产物,进行100倍稀释,得到第一轮PCR稀释产物;所述第一轮PCR扩增引物为第四对引物;
(2)以第二轮PCR扩增引物对第一轮PCR稀释产物进行第二轮PCR,得到第二轮PCR产物;其中,当检测巨细胞病毒UL54基因耐药突变时,所述第二轮PCR扩增引物为第五对引物;
(3)对第二轮PCR产物进行检测。
如图2(B)所示,采用正向引物UL97-SF1和反向引物UL97-SR1进行第一轮PCR扩增,采用正向引物UL97-SF2和反向引物UL97-SR2进行第二轮PCR扩增,得UL97片段。
所述步骤(1)中,待检测DNA均为从待检血清或血浆中提取DNA而得。
本实施例中,所述步骤(1)中,第一轮PCR反应体系的体积为25μL。具体地,第一轮PCR的反应体系为:KOD FX 0.5U和dNTPs各0.4mM、2×PCR buffer for KOD FX 12.5μL、10pmol/μL的正向引物和反向引物各0.75μL和待检测DNA 2μL,双蒸水补齐至25μL。
所述步骤(1)中,第一轮PCR的反应程序为:1)、94℃预变性2min;2)、98℃变性10s,56℃退火30s,68℃延伸2min30s,共34个循环;3)、68℃后延伸5min。
本实施例中,所述步骤(2)中,第二轮PCR的反应体系的体积为50μL。具体地,第二轮PCR的反应体系为:KOD FX 1U和dNTPs各0.4mM、2×PCR buffer for KOD FX 25μL、10pmol/μL的正向引物和反向引物各0.75μL和第一轮 PCR 稀释产物2μL,双蒸水补齐至50μL。
所述步骤(2)中,第二轮PCR的反应程序为:1)、94℃预变性2min;2)、98℃变性10s,56℃退火30s,68℃延伸1min10s,共34个循环;3)、68℃后延伸5min。
所述步骤(3)中,检测采用电泳检测,将第二轮PCR产物通过琼脂糖电泳配合凝胶成像系统观察结果。其中,检测的第二轮PCR产物加样量为3μL,其过程按照仪器标准操作程序进行。选择DL2,000marker(TAKARA公司)作为对照,电泳结束后分析电泳图像,第二轮PCR产物送去Invitrogen公司测序。
本实施例还提供一种检测巨细胞病毒UL97耐药突变的试剂盒,该试剂盒包括第四对引物和第五对引物。
实施例1-2的电泳图像如图3所示,泳道M为DNA marker,泳道1为UL97基因扩增产物,泳道2和3为UL54基因扩增产物。本实施例限定了第一轮PCR的反应体系和反应程序,同时还限定了第二轮PCR的反应体系和反应程序,最终得到的条带清晰,结果稳定。
实施例3
本实施例与实施例1的不同之处在于:
本实施例中,所述步骤(1)中,第一轮PCR反应体系的体积为25μL。具体地,第一轮PCR的反应体系为:KOD FX 0.5U和dNTPs各0.4mM、2×PCR buffer for KOD FX 12.5μL、10pmol/μL的正向引物和反向引物各0.75μL和待检测DNA 1μL,双蒸水补齐至25μL。其中,所述第一轮PCR产物,进行50倍稀释,得到第一轮PCR稀释产物。
本实施例中,所述步骤(2)中,第二轮PCR的反应体系的体积为50μL。具体地,第二轮PCR的反应体系为:KOD FX 1U和dNTPs各0.4mM、2×PCR buffer for KOD FX 25μL、10pmol/μL的正向引物和反向引物各0.75μL和第一轮 PCR 稀释产物1μL,双蒸水补齐至50μL。
实施例4
本实施例与实施例1的不同之处在于:
本实施例中,所述步骤(1)中,第一轮PCR反应体系的体积为10μL。具体地,第一轮PCR的反应体系为:KOD FX 0.5U和dNTPs各0.4mM、2×PCR buffer for KOD FX 12.5μL、10pmol/μL的正向引物和反向引物各0.75μL和待检测DNA 1μL,双蒸水补齐至10μL。其中,所述第一轮PCR产物,进行150倍稀释,得到第一轮PCR稀释产物。
本实施例中,所述步骤(2)中,第二轮PCR反应体系的体积为25μL。具体地,第二轮PCR的反应体系为:KOD FX 1U和dNTPs各0.4mM、2×PCR buffer for KOD FX 25μL、10pmol/μL的正向引物和反向引物各0.75μL和第一轮 PCR 稀释产物 1μL,双蒸水补齐至25μL。
实施例5
本实施例与实施例2的不同之处在于:
本实施例中,所述步骤(1)中,第一轮PCR反应体系的体积为25μL。具体地,第一轮PCR的反应体系为:KOD FX 0.5U和dNTPs各0.4mM、2×PCR buffer for KOD FX 12.5μL、10pmol/μL的正向引物和反向引物各0.75μL和待检测DNA 1μL,双蒸水补齐至25μL。其中,所述第一轮PCR产物,进行50倍稀释,得到第一轮PCR稀释产物。
本实施例中,所述步骤(2)中,第二轮PCR的反应体系的体积为50μL。具体地,第二轮PCR的反应体系为:KOD FX 1U和dNTPs各0.4mM、2×PCR buffer for KOD FX 25μL、10pmol/μL的正向引物和反向引物各0.75μL和第一轮 PCR 稀释产物1μL,双蒸水补齐至50μL。
实施例6
本实施例与实施例2的不同之处在于:
本实施例中,所述步骤(1)中,第一轮PCR反应体系的体积为10μL。具体地,第一轮PCR的反应体系为:KOD FX 0.5U和dNTPs各0.4mM、2×PCR buffer for KOD FX 12.5μL、10pmol/μL的正向引物和反向引物各0.75μL和待检测DNA 1μL,双蒸水补齐至10μL。其中,所述第一轮PCR产物,进行150倍稀释,得到第一轮PCR稀释产物。
本实施例中,所述步骤(2)中,第二轮PCR反应体系的体积为25μL。具体地,第二轮PCR的反应体系为:KOD FX 1U和dNTPs各0.4mM、2×PCR buffer for KOD FX 25μL、10pmol/μL的正向引物和反向引物各0.75μL和第一轮 PCR 稀释产物 1μL,双蒸水补齐至25μL。
本发明通过选用特定的巢式PCR引物,采用巢式PCR方法,优化PCR反应体系和反应程序,扩增巨细胞病毒UL54和UL97基因具有高敏感性,与其它方法比较无非特异性扩增出现,显示高度扩增特异性。
本发明限定了第一轮PCR的反应体系和反应程序,同时还限定了第二轮PCR的反应体系和反应程序,最终得到的条带清晰,结果稳定。
本发明在长期进行病毒研究的基础上,对NCBI上巨细胞病毒序列进行比对分析,对相关引物、反应体系进行优化后,探索出一套特异、准确、操作简便的检测巨细胞病毒UL54和UL97基因耐药突变的巢式PCR方法,可以用于分析其耐药基因突变,实用性强,符合临床推广的要求。
最后应当说明的是,以上实施例仅用以说明本发明的技术方案,而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细地说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
<110>东莞市第八人民医院东莞市儿童医院 东莞市儿科研究所
<120>检测巨细胞病毒UL54和UL97基因耐药突变的巢式PCR引物及方法
<160>10
<210>1
<211>17
<212>DNA
<213>人工序列
<400>1
tggtcatcga tcggcgg 17
<210>2
<211>17
<212>DNA
<213>人工序列
<400>2
atgacggcaa tgtgcgg 17
<210>3
<211>18
<212>DNA
<213>人工序列
<400>3
gttacgactg gcggcagc 18
<210>4
<211>17
<212>DNA
<213>人工序列
<400>4
gcagattgca agggcgg 17
<210>5
<211>24
<212>DNA
<213>人工序列
<400>5
aaccactaca gcaaaggtac gacg 24
<210>6
<211>16
<212>DNA
<213>人工序列
<400>6
cgacaggcgc acggct 16
<210>7
<211>22
<212>DNA
<213>人工序列
<400>7
gttccaacga ccagatcatc ac 22
<210>8
<211>20
<212>DNA
<213>人工序列
<400>8
gcgagcattc gtggtagaag 20
<210>9
<211>19
<212>DNA
<213>人工序列
<400>9
gacccgcgta tgttcttgc 19
<210>10
<211>20
<212>DNA
<213>人工序列
<400>10
gacacgagga catcttggcc 20
- 还没有人留言评论。精彩留言会获得点赞!
- 逆转肿瘤多药耐药的基因组合物h‑R3/PAMAM G5/MDR1 siRNA及其应用的制作方法与工艺
- 盐生草耐盐基因HgS2及其应用的制造方法与工艺
- 一种快速核酸检测肺炎支原体及耐药突变的方法和试剂盒与流程
- 一种用于检测巴氏杆菌氯霉素类药物耐药基因的分子标记及其应用的制造方法与工艺
- 一种用于检测B族链球菌四环素耐药基因的分子标记及其应用的制造方法与工艺
- 一种用于检测粪肠球菌庆大霉素耐药基因的分子标记及其应用的制造方法与工艺
- 一种用于检测葡萄球菌磺胺类药物耐药基因的分子标记及其应用的制造方法与工艺
- 一种用于检测肉鸡沙门氏菌环丙沙星耐药基因的分子标记及其应用的制造方法与工艺
- 检测巨细胞病毒UL54和UL97基因耐药突变的巢式PCR引物及方法与制造工艺
- 一种检测幽门螺杆菌耐药突变位点的试剂盒和方法与制造工艺
- 一种封闭式病原体检测卡盒的制作方法与工艺
- 检测16种呼吸道病原体的基因芯片检测用试剂盒及方法与流程
- 一种同时检测多种病原体的五重PCR检测方法与流程
- 逆转肿瘤多药耐药的基因组合物h‑R3/PAMAM G5/MDR1 siRNA及其应用的制作方法与工艺
- 用于对肉类、植物或植物部分进行病原体检测和病害治理的方法与流程
- 一种用于检测治疗恶性肿瘤的一线药物耐药基因表达量的试剂盒的制造方法与工艺
- 用于检测植物病原体的装置和方法与流程
- 用于检测多种病原体的荧光实时检测方法及应用与流程
- 一种用于检测手足口病相关病原体的LAMP引物组合物及其相关应用的制造方法与工艺
- 一种用于检测巴氏杆菌氯霉素类药物耐药基因的分子标记及其应用的制造方法与工艺