一种超分子复合物的结晶的制作方法
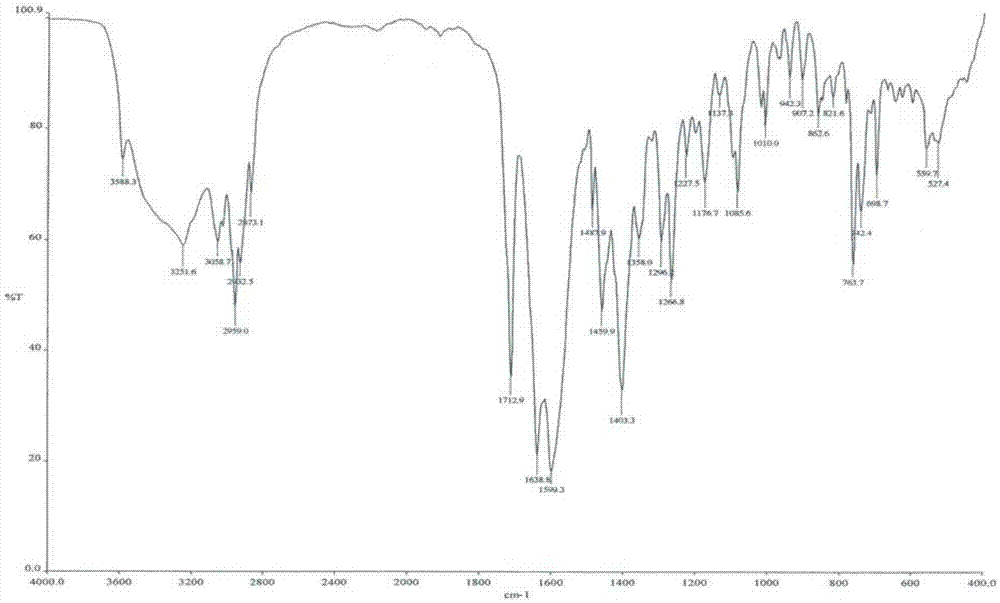
本发明属于医药化学领域,具体而言,涉及超分子复合物[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基)联苯-4'-基甲基}氨基)丁酸]三钠三水合物的结晶、该结晶的制备方法、包含该结晶的结晶组合物、包含该结晶和其结晶组合物的药物组合物以及该结晶的医药用途。
背景技术:
:LCZ696是由诺华开发的中性肽链内切酶抑制剂Sacubitril和血管紧张素Ⅱ受体拮抗剂缬沙坦的超分子复合物。该药于2015年7月首次在美国上市,商品名为EntrestoTM,用于降低伴有射血分数降低的慢性心衰患者(心功能Ⅱ-Ⅳ级)的致死率和住院率。WO2007056546公开了结构如下式所示的超分子复合物及其结晶,Sacubitril和缬沙坦以1:1的比例组成,以三钠半五水合物的形式存在,化学名称是:[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基)联苯-4'-基甲基}氨基)丁酸]三钠半五水合物。技术实现要素:本发明的目的是提供Sacubitril和缬沙坦超分子复合物的新的结晶形式及其制备方法,本发明的结晶具有优良的稳定性和粉体流动性,特别适用于制剂生产。本发明一方面提供了式Ⅰ所示化合物的结晶:其特征在于,在X-射线衍射(XRD)图谱中,具有2θ=4.2°、5.2°、12.6°±0.2°的衍射峰,典型地具有2θ=4.2°、5.2°、8.4°、12.6°、17.0°±0.2°的衍射峰。本发明所述的式Ⅰ所示化合物化学名为[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基)联苯-4'-基甲基}氨基)丁酸]三钠三水合物。在本发明的部分实施方式中,所述式Ⅰ所示化合物的结晶的X-射线衍射图谱中衍射峰具有如下特征:序号2θ(°)相对强度(%)14.2100.025.210.038.41.8412.620.4517.02.5在本发明的部分实施方式中,所述式Ⅰ所示化合物的结晶的X-射线衍射图谱如图1所示。本发明的式Ⅰ所示化合物的结晶也可以用差热分析(DSC)进行表征,所述DSC在40~260℃的升温范围内有三个吸收峰,第一个峰的起始温度为79.9℃,第一个峰的峰值温度为106.3℃;第二个峰的起始温度为139.5℃,第二个峰的峰值温度为145.2℃;第三个峰的起始温度为216.9℃,第三个峰的峰值温度为231.0℃。在本发明的部分实施方式中,所述式Ⅰ所示化合物的红外光谱具有下列特征吸收带,以波长倒数表示为(cm-1):3588(w)、3252(m)、3059(m)、2959(st)、2932(m)、2873(m)、1713(st)、1639(st)、1599(st)、1488(m)、1460(st)、1403(st)、1358(m)、1296(m)、1267(m)、1228(w)、1177(m)、1137(w)、1086(m)、1010(w)、942(w)、907(w)、863(w)、821(w)、764(m)、742(m)、699(m)、560(w)、527(w)。红外峰强度表示如下:(w)=弱;(m)=中;(st)=强。在本发明的部分实施方式中,所述式Ⅰ所示化合物的红外光谱如图2所示。本发明的式Ⅰ所示化合物的结晶也可以用固态核磁(SSNMR)表征,所述SSNMR是13C-SSNMR,具有如下特征峰(ppm):180.0、179.4、178.9、178.2、177.7、177.0、162.4、141.5、140.9、140.3、139.7、138.5、137.5、131.6、130.8、129.9、129.3、126.9、125.6、64.4、61.7、60.9、50.3、47.0、38.9、34.4、29.8、29.0、22.5、20.5、20.0、19.3、18.1、17.3、13.2、12.5、11.5。在本发明的部分实施方式中,所述式Ⅰ所示化合物的结晶的13C-SSNMR如图3所示。本发明另一方面提供了包括式Ⅰ所示化合物的结晶的结晶组合物。在本发明的部分实施方式中,式Ⅰ所示化合物的结晶占结晶组合物重量50%以上,较好的是80%以上,更好的是90%以上,最好的是95%以上。本发明的另一方面提供了包括式Ⅰ所示化合物的结晶的药物组合物,该药物组合物中包括有效量式Ⅰ所示化合物的结晶、或者包括式Ⅰ所示化合物的结晶的结晶组合物,此外,该药物组合物还可以含有或不含有药学上可接受的载体、赋形剂和/或介质。本发明的另一方面提供了式Ⅰ所示化合物的结晶或其结晶组合物在制备治疗或预防疾病或病症的药物中的用途,所述疾病或病症选自高血压、心衰、心绞痛、左心室功能不全、肥厚型心肌病、糖尿病性心肌病、室上型和心室型心律失常、房颤、心房扑动、有害的血管重塑、心肌梗塞及其后遗症、动脉硬化症、不稳定或稳定型绞痛、继发性醛甾酮过多症、原发性和继发性肺高血压、糖尿病性肾病、血管球性肾炎、硬皮病、肾小球硬化、原发性肾病蛋白尿、肾血管高血压、糖尿病性视网膜病、偏头痛、外周血管疾病、雷诺氏病、腔增生、认知障碍、青光眼或中风;优选自急性或慢性心衰、充血性心衰或心绞痛。本发明另一方面提供了式Ⅰ所示化合物的结晶的制备方法,该方法使式Ⅰ所示化合物的结晶从包含丙酮和水的溶剂中析出。在本发明的部分实施方式中,式Ⅰ所示化合物的结晶的制备方法包括如下步骤:1)Sacubitril钙盐溶解于包括乙酸异丙酯和HCl水溶液的混合溶剂中,搅拌;2)分离步骤1)中所得有机相,用水相溶液洗涤,浓缩,加入丙酮回流;3)加入缬沙坦、丙酮和氢氧化钠的水溶液,搅拌,析出固体。在本发明的部分实施方式中,所述Sacubitril钙盐:缬沙坦:NaOH的物质的量之比选自1.0:1.0~3.0:4.0~8.0,优选自1.0:1.0~3.0:6.0,更优选自1.0:2.0:6.0。在本发明的部分实施方式中,所述步骤3)中,加入的丙酮的体积量与缬沙坦的重量之比(v/w)选自25~35:1,优选自30:1。在本发明的部分实施方式中,在所述步骤3)之后,还包括步骤4):用丙酮/水的混合溶剂精制。在本发明的部分实施方式中,所述步骤4)中,所述丙酮/水的混合溶剂的丙酮:水的体积比选自40~80:1,优选自50~70:1,更优选自60:1。在本发明的部分实施方式中,所述步骤4)中,加入的丙酮/水的混合溶剂的体积量与步骤3)所得固体的重量之比(v/w)选自5~15:1,优选自8~12:1,更优选自10:1。在本发明所述的式Ⅰ所示化合物的结晶的制备方法中,不包括使用超声或者加入晶种协助析晶的步骤。本发明中,X-射线粉末衍射光谱采用下述方法测定:仪器:BrukerD2X-射线衍射仪;测试条件:30kv10mA;狭缝:0.6/3/Ni/8;步长:0.02°;靶型:Cu;Range:5.00-40.00Degtime[s]:0.1。本发明中,DSC采用下述方法测定:仪器:PerKinElmerDiamondDSC型差热分析仪温度范围:25-300℃;升温速率:10℃/min。本发明中,红外光谱采用下述方法测定:PerkinElmerSpectrum100型红外光谱仪,KBr压片法。本发明中,在BRUKERAVANCEⅢ-400型固体核磁共振仪上获得固态核磁光谱学(SSNMR)光谱,外标:金刚烷,温度:303K。需要说明的是,DSC测定当晶体由于其晶体结构发生变化或晶体熔融而吸收或释放热时的转变温度。对于同种化合物的同种晶型,在连续的分析中,热转变温度和熔点误差典型的在约5℃之内,通常在约3℃之内,当我们说一个化合物具有某一给定的DSC峰或熔点时,这是指该DSC峰或熔点±5℃。DSC提供了一种辨别不同晶型的辅助方法。不同的晶体形态可根据其不同的转变温度特征而加以识别。本发明中,术语“药物组合物”是指一种或多种本发明的化合物与在本领域中通常接受的用于将生物活性化合物输送至有机体,例如人,的载体、赋形剂和/或介质的制剂。药物组合物的目的是有利于对有机体给予本发明的化合物。本发明中,术语“药学上可接受的载体”是指对有机体无明显刺激作用,而且不会损害该活性化合物的生物活性及性能的载体和稀释剂。“药学上可接受的赋形剂和/或介质”是指与活性成分一同给药的、有利于活性成分的给药的惰性物质。“药学上可接受的载体、赋形剂和/ 或介质”包括但不限于可用于人或家畜动物的任何载体、赋形剂、介质、助流剂、增甜剂、稀释剂、防腐剂、染料/着色剂、矫味增强剂、表面活性剂、润湿剂、分散剂、崩解剂、助悬剂、稳定剂、等渗剂、溶剂或乳化剂。所述赋形剂的非限制性实例包括碳酸钙、磷酸钙、各种糖和各类淀粉、纤维素衍生物、明胶、植物油和聚乙二醇等等。以纯的形式或以适宜的药物组合物形式的本发明化合物的给药可通过提供类似用途的药剂的任何可接受给药模式来进行。本发明的药物组合物可通过将本发明的化合物与适宜的药学上可接受的载剂、稀释剂或赋形剂组合而制备,且可配制成固态、半固态、液态或气态制剂,如片剂、丸剂、胶囊剂、粉剂、颗粒剂、膏剂、乳剂、悬浮剂、溶液剂、栓剂、注射剂、吸入剂、凝胶剂、微球及气溶胶等等。给予本发明化合物或其药物组合物的典型途径包括但不限于口服、直肠、透黏膜、经肠给药,或者局部、经皮、吸入、肠胃外、舌下、阴道内、鼻内、眼内、腹膜内、肌内、皮下、静脉内给药。本发明的药物组合物可以采用本领域众所周知的方法制造,如常规的混合法、溶解法、制粒法、制糖衣药丸法、磨细法、乳化法、冷冻干燥法等等。在优选的实施方案中,药物组合物是口服形式。对于口服给药,可以通过将活性化合物与本领域熟知的药物可接受的载体、赋形剂和/或介质混合,来配制该药物组合物。这些载体、赋形剂和介质能使本发明的化合物被配制成片剂、丸剂、锭剂、糖衣剂、胶囊剂、液体、凝胶剂、浆剂、悬浮剂等,用于对患者的口服给药。可以通过常规的混合、填充或压片方法来制备固体口服组合物。例如,可通过下述方法获得:将所述的活性化合物与固体赋形剂混合,任选地碾磨所得的混合物,如果需要则加入其它合适的辅剂,然后将该混合物加工成颗粒,得到了片剂或糖衣剂的核心。适合的赋形剂包括但不限于:填充剂,如糖,包括乳糖、蔗糖、甘露醇或山梨糖醇;纤维素制剂例如微晶纤维素、玉米淀粉、小麦淀粉、大米淀粉和马铃薯淀粉;以及其它物质,如硅胶、明胶、黄芪胶、甲基纤维素、羟丙基甲基纤维素、羟甲基纤维素钠和/或聚乙烯吡咯烷酮;崩解剂,如羧甲淀粉钠、交联羧甲基纤维素钠、交联聚乙烯吡咯烷酮、琼脂或藻酸,也可以使用盐,如藻酸钠。可以根据通常药物实践中公知的方法任选地对糖衣剂的核心进行包衣,尤其使用肠溶包衣。本发明所使用的所有溶剂是市售的,无需进一步纯化即可使用。反应一般是在惰性氮气下、无水溶剂中进行的。本发明化合物经手工或者软件命名,市售化合物采用供应商目录名称。本发明提供的式Ⅰ所示化合物的结晶是[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基)联苯-4'-基甲基}氨基)丁酸]的三钠三水合物的结晶,该结晶具有良好的稳定性,结晶中的结晶水可以稳定存在,晶体结构稳定。本发明提供的式Ⅰ所示化合物的结晶为白色结晶性粉末,具有良好的粉体流动性质,有助于固体口服制剂(例如颗粒剂、胶囊剂、片剂)的制备。附图说明图1式Ⅰ所示化合物的结晶的XRD谱图。图2式Ⅰ所示化合物的结晶的红外光谱。图3式Ⅰ所示化合物的结晶的13C-SSNMR谱图。具体实施方式为了更好理解本发明的内容,下面结合具体实施例来做进一步的说明,但具体的实施方式并不是对本发明的内容所做的限制。实施例1式Ⅰ所示化合物的结晶将Sacubitril钙盐(2.80kg,3.25mol,1.0eq),用28L乙酸异丙酯(10.0v/w),和2NHCl水溶液(6.5L,13.00mol,4.0eq),室温搅拌30min,分出有机相,有机相用饱和食盐水洗涤,盐水洗后减压浓缩,用丙酮回流两次,往其中加入缬沙坦(2.84kg,6.50mol,2.0eq),丙酮(84L,30.0v/w)搅拌澄清,加入氢氧化钠46%的水溶液(780.00g,19.50mol,6.0eq;溶于1.7L),室温搅拌约10min后,有固体析出,继续搅拌2小时后过滤。滤饼用10.0(v/w)丙酮/水(60/1)打浆1小时,过滤,干燥,得白色固体4.80kg,收率76.4%。实施例2式Ⅰ所示化合物的结晶的稳定性测试将实施例1制备的样品分别置于光照1(5000Lx±500Lx)、光照2(5000Lx±500Lx,近 紫外0.85w/m2)和高温1(40℃)条件下进行稳定性测试,分别于第5、10或30天取样检测,结果与初始结果进行比较,检测结果如下表所示:实施例3式Ⅰ所示化合物的结晶的粉末流动性测试将托盘放在底座固定卡位上,将直径100mm的测量盘固定于大底盘内的卡位上,将数显高度计垂直置于底座侧面,调整使高度计至100mm的测量盘表面并归零。在不锈钢漏斗底部装上直径10mm的漏孔,并将漏斗置于铁圈上,调整下部的挡板使与漏孔下缘贴合。预试验在漏斗中加入测试粉末,移开挡板,使粉末自由流出,堆积在测试盘中,形成锥体直至粉末完全从底盘溢出,用高度计测定高度,由此预估出锥体可能高度及试验所需的粉末量(通常100g左右)。根据预估的锥体高度,调整挡板和漏斗的高度使漏孔下缘在锥体顶端约2-4cm处,并按预估的量准备测试粉末。在漏斗中加入适量测试粉末,移开挡板,使粉末自由流出,堆积在测试盘中,形成完整锥体,测定锥体高度。由高度和测试盘半径50mm计算休止角。如有必要刻意搅动漏斗内的粉末以帮助粉末落下。实施例1的结晶:38.1度;WO2007056546公开的[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基)联苯-4'-基甲基}氨基)丁酸]三钠半五水合物:44.0度。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1