用于治疗HER2/NEU过表达肿瘤的组合物和方法与流程
本发明提供用于诱导人和犬科动物受试者的对HER2/neu抗原表达肿瘤的免疫应答以及用于治疗该肿瘤和接种该肿瘤的疫苗的组合物和方法。在另一个实施例中,人受试者是儿童或青少年。
背景技术:
单核细胞增多性李斯特菌(Listeria monocytogenes)是主要感染抗原呈递细胞并且已适应在这些细胞的细胞质中生活的细胞内病原体。宿主细胞诸如巨噬细胞、主动吞噬细胞单核细胞增多性李斯特菌和大部分细菌在吞噬溶酶体中降解。一些细菌通过溶血素、李斯特菌溶血素O(LLO)的作用刺穿噬菌溶酶体膜而逃入宿主胞质溶胶。一旦处于胞质溶胶中,单核细胞增多性李斯特菌即可使宿主肌动蛋白聚合,并且直接从细胞传递到细胞,从而进一步入侵宿主免疫系统并产生可忽略的对单核细胞增多性李斯特菌的抗体应答。
HER2/neu(在本文中也称为“Her-2”)是185kDa的糖蛋白,它是酪氨酸激酶的表皮生长因子受体(EGFR)家族成员,并由胞外域、跨膜域和胞内域(已知涉及细胞信号转导)组成。在人中,Her2抗原在所有乳腺癌的25至40%中过表达,并且也在很多骨(骨肉瘤–OSA)、卵巢、肺、胰腺、脑和胃肠道癌中过表达。Her-2的过表达与不受控制的细胞生长和信号转导相关,它们二者均有助于肿瘤的发展。过表达Her-2的癌症患者表现出耐受性,即使存在可检测的直接对Her-2的体液、CD8+T细胞和CD4+T细胞应答。
大型养殖狗自发发展成OSA,再现了小儿OSA的多个方面,包括组织学异质性、侵袭性局部疾病和早期转移。在狗中,OSA可出现于任何骨骼中,但肢骨仅占所有受影响骨骼的75%-85%,并且在其中,OSA被称为“肢体骨肉瘤”。其余的OSA影响中轴骨骼,包括上颌骨、下颌骨、脊骨、头盖骨、肋骨、鼻腔骨、鼻旁窦骨和骨盆。在诊断中,95%的狗患有微转移性疾病,并且尽管进行了截肢和化疗,但中值存活时间也只有10个月,大部分狗由于进行性转移性疾病而被实施安乐死。肺转移性疾病是两个物种发病和死亡的主要原因。
小儿至年轻成年人群体的原发性恶性骨肿瘤相对不常见,在不到20岁的群体中占所有癌症的约6%,并且在年龄范围为15至29岁的青少年和年轻成年人(AYA)中占所有癌症的3%。每年在美国骨肉瘤影响了约400名儿童和青少年,这代表了在几十年里几乎无治疗改进的小但高需求的领域。虽然骨肉瘤(OS)是罕见的恶性肿瘤,但在小儿年龄组中它被列为癌症相关性死亡的主要原因。现代、多药剂、剂量密集化疗与手术结合在60-70%局限于肢体的非转移性疾病中实现了5年无事件存活期。然而,主要的、但未解决的问题是转移性复发或再次出现以及中轴疾病患者的预后差。此外,在美国尚无批准用于骨肉瘤的产品,表明对治疗该疾病的新型疗法具有强烈需求。
本发明通过提供使用LmddA疫苗载体生成的重组李斯特菌(Listeria)-HER2/neu疫苗株满足了此需求,该载体具有明确的减毒机制且不含抗生素选择标记,并且据发现该载体在治疗犬科动物骨肉瘤中有效。
技术实现要素:
在一个方面,本文提供的发明涉及包含融合多肽的免疫原性组合物,其中所述融合多肽包含融合至另外的多肽的HER2/neu嵌合抗原,并且其中将融合蛋白施用于患有HER2/neu表达肿瘤的受试者绕开肿瘤引起的突变回避(mutation avoidance)。在另一个实施例中,绕开突变回避是由于表位扩展。在又一个实施例中,绕开突变回避是由于抗原的嵌合性质。
在另一个实施例中,本文提供的发明涉及包含核酸分子的重组李斯特菌疫苗株,其中并且在另一个实施例中,核酸分子包含编码多肽的第一开放阅读框,其中该多肽包含HER2/neu嵌合抗原,其中该核酸分子还包含编码代谢酶的第二开放阅读框,并且其中该代谢酶互补重组李斯特菌菌株的染色体中突变的内源性基因。
在一个实施例中,本文提供的发明涉及治疗受试者的HER2/neu表达肿瘤生长或癌症的方法,该方法包括施用包含编码融合多肽的核酸的重组减毒李斯特菌的步骤,其中所述融合多肽包含融合至另外的多肽的HER2/neu嵌合抗原,其中所述核酸分子包含编码所述融合多肽的第一开放阅读框,其中所述核酸分子还包含编码代谢酶的第二开放阅读框,并且其中所述代谢酶互补所述重组李斯特菌疫苗株的染色体中突变的内源性基因。在另一个实施例中,受试者是人。在另一个实施例中,人受试者可以是成人或儿童。在另一个实施例中,受试者是犬科动物。在另一个实施例中,嵌合HER2是犬科动物嵌合HER2。在另一个实施例中,嵌合HER2是人嵌合HER2。在另一个实施例中,将所述融合多肽施用于所述受试者防止所述肿瘤内的逃逸突变。在另一个实施例中,所述人HER2/neu嵌合抗原包含至少5、9、13、14或17个标绘的人MHC I类表位。
在另一个实施例中,本文提供的发明涉及防止HER2/neu表达肿瘤生长或癌症的方法。
在一个实施例中,治疗HER2/neu表达肿瘤生长或癌症的方法使所述受试者的总体存活期增加。在另一个实施例中,治疗HER2/neu表达肿瘤生长或癌症的方法使受试者的转移性疾病延缓。在另一个实施例中,治疗使HER2/neu特异性T细胞应答增强。
在一个实施例中,本发明提供引起受试者的对HER2/neu表达肿瘤生长或癌症的增强免疫应答的方法,该方法包括施用包含编码融合多肽的核酸的重组减毒李斯特菌的步骤,其中所述融合多肽包含融合至另外的多肽的HER2/neu嵌合抗原,其中所述核酸分子包含编码所述融合多肽的第一开放阅读框,其中所述核酸分子还包含编码代谢酶的第二开放阅读框,并且其中所述代谢酶互补所述重组李斯特菌疫苗株的染色体中缺乏的内源性基因。在另一个实施例中,所述引起增强免疫应答的方法使所述受试者的总体存活期增加。在另一个实施例中,所述引起增强免疫应答的方法使受试者的转移性疾病延缓。在另一个实施例中,所述引起增强免疫应答的方法使HER2/neu特异性T细胞应答增强。
在一个实施例中,本发明提供延长患有HER2/neu表达肿瘤生长或癌症的受试者的存活期的方法,该方法包括施用包含编码融合多肽的核酸的重组减毒李斯特菌的步骤,其中所述融合多肽包含融合至另外的多肽的HER2/neu嵌合抗原,其中所述核酸分子包含编码所述融合多肽的第一开放阅读框,其中所述核酸分子还包含编码代谢酶的第二开放阅读框,并且其中所述代谢酶互补所述重组李斯特菌疫苗株的染色体缺乏的内源性基因。在另一个实施例中,受试者是人。在另一个实施例中,人受试者可以是成人或儿童。在另一个实施例中,受试者是犬科动物。在一个实施例中,所述方法还包括在所述受试者中复发或转移后施用所述重组减毒李斯特菌。
在一个实施例中,本文提供的发明涉及延缓患有HER2/neu表达肿瘤生长或癌症的受试者的转移性疾病的方法,该方法包括施用包含编码融合多肽的核酸的重组减毒李斯特菌的步骤,其中所述融合多肽包含融合至另外的多肽的HER2/neu嵌合抗原,其中所述核酸分子包含编码所述融合多肽的第一开放阅读框,其中所述核酸分子还包含编码代谢酶的第二开放阅读框,并且其中所述代谢酶互补所述重组李斯特菌疫苗株的染色体中缺乏的内源性基因。在另一个实施例中,受试者是人。在另一个实施例中,人受试者可以是成人或儿童。在另一个实施例中,受试者是犬科动物。
附图说明
被视为本发明的主题在说明书的结论部分特别指出并明确要求进行保护。然而,在结合附图阅读时,通过参考以下具体实施方式,可以最好地理解本发明(对组织和操作方法来说皆是如此)及其目的、特征和优点,在附图中:
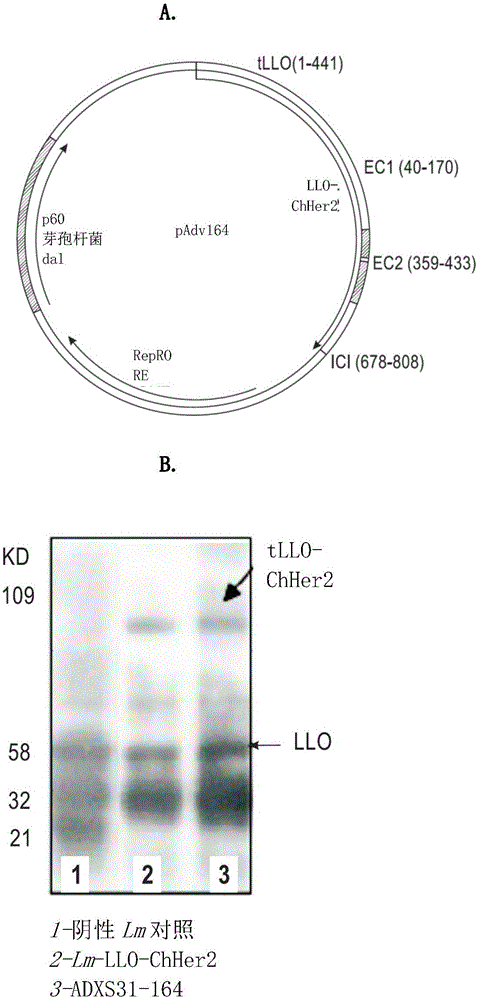
图1.ADXS31-164的构建。(A)pAdv164的质粒图谱,其具有在组成型李斯特菌p60启动子控制下的枯草芽孢杆菌(Bacillus subtilis)dal基因,用于互补LmddA菌株的染色体dal-dat缺失。它还包含截短的LLO(1-441)与嵌合人HER2/neu基因的融合体,该融合体通过3个HER2/neu片段:EC1(aa 40-170)、EC2(aa 359-518)和ICI(aa 679-808)的直接融合而构建。右侧的载体示意图详细示出,pAdv164表达由融合至截短的LLO的人HER2/neu的2个胞外域和一个胞内域组成的嵌合HER2/neu融合蛋白。质粒借助于dal基因的营养缺陷型互补而维持在重组dal/dat/actA-李斯特菌菌株(LmddA)内(参见实例)。(B)通过对用抗LLO抗体印迹的TCA沉淀细胞培养上清液进行的Western印迹分析检测了Lm-LLO-ChHer2(Lm-LLO-138)和LmddA-LLO-ChHer2(ADXS31-164)中tLLO-ChHer2的表达和分泌。~104KD的差异条带对应于tLLO-ChHer2。检测到内源性LLO为58KD条带。李斯特菌对照缺乏ChHer2表达。
图2.ADXS31-164的免疫原性(A)基于HER2/neu李斯特菌的疫苗在免疫小鼠的脾细胞中引起的细胞毒性T细胞应答使用NT-2细胞作为刺激因子、3T3/neu细胞作为靶标进行测试。Lm-对照基于在各个方面相同但表达不相关抗原(HPV16-E7)的LmddA背景。(B)免疫FVB/N小鼠的脾细胞分泌进细胞培养基中的IFN-γ在使用丝裂霉素C处理的NT-2细胞体外刺激24小时后通过ELISA测定。(C)嵌合疫苗免疫的HLA-A2转基因小鼠的脾细胞响应于来自蛋白不同区域的肽的体外温育而分泌IFN-γ。重组ChHer2蛋白用作阳性对照,不相关肽或无肽组构成阴性对照,如图例中所列出。使用72小时共温育后收集的细胞培养上清液进行ELISA分析,以测定IFN-γ分泌。每个数据点为一式三份数据的平均值+/-标准误差。*P值<0.001。
图3.李斯特菌-ChHER2/neu疫苗的肿瘤预防研究使用每种重组李斯特菌-ChHer2或对照李斯特菌疫苗注射HER2/neu转基因小鼠六次。免疫在6周龄开始,每三周一次延续直到第21周。每周监测肿瘤的外观并以无肿瘤小鼠的百分比表示。*p<0.05,N=9只每组。
图4.ADXS31-164免疫对脾脏中%Treg的作用。给FVB/N小鼠皮下接种1×106个NT-2细胞,并且使用每种疫苗以一周为间隔免疫三次。在第二次免疫后7天收集脾脏。在分离免疫细胞后,对其进行染色,以通过抗CD3、CD4、CD25和FoxP3抗体检测Treg。来自代表性实验的Treg的点图示出CD25+/FoxP3+T细胞的频率,以不同治疗组之间总CD3+或CD3+CD4+T细胞的百分比表示。
图5.ADXS31-164免疫对NT-2肿瘤中%肿瘤浸润Treg的作用。给FVB/N小鼠皮下接种1×106个NT-2细胞,并且使用每种疫苗以一周为间隔免疫三次。在第二次免疫后7天收集肿瘤。在分离免疫细胞后,对其进行染色,以通过抗CD3、CD4、CD25和FoxP3抗体检测Treg。(A).来自代表性实验的Treg的点图。(B).CD25+/FoxP3+T细胞的频率,以不同治疗组之间总CD3+或CD3+CD4+T细胞的百分比(左插图)和肿瘤内CD8/Treg比率(右插图)表示。数据以2个独立实验获得的平均值±SEM表示。
图6.ADXS31-164疫苗接种可延缓脑中乳腺癌细胞系的生长。Balb/c小鼠使用ADXS31-164或对照李斯特菌疫苗免疫三次。给麻醉小鼠颅内注射EMT6-Luc细胞(5,000个)。(A)小鼠的离体成像使用Xenogen X-100CCD照相机在指定的天数进行。(B)像素强度以光子数/秒/cm2表面积绘图;这以平均发光度表示。(C)EMT6-Luc细胞、4T1-Luc和NT-2细胞系的HER2/neu表达通过使用抗HER2/neu抗体的Western印迹检测。鼠科动物巨噬细胞样细胞系J774.A2细胞用作阴性对照。
图7.示出ADXS31-164接种的前18名患者。
图8.示出ADXS31-164施用不会导致早期或晚期心脏损伤。A)心脏的超声心动图示出心脏外观正常。B)在研究的过程中评估的连续心脏肌钙蛋白I水平示出水平是正常的(另见图26D)。
图9.示出A)体温和B)收缩压的ADXS31-164相关变化。在基线和ADXS31-164施用后每2小时记录体温和收缩压。示出每只狗每次疫苗接种时的参数。水平条表示每个剂量组、每个时间点所有狗的中值。p<0.05,p<0.005
图10.示出ADXS31-164和姑息性放疗(RT)联合治疗原发性疾病的计划表。
图11.放射照片未示出狗肱骨近端骨折后出现转移性疾病的证据,并且还示出存在骨痂,表明骨折愈合。
图12.前期I期临床试验的时间线,其评估重组表达ADXS31-164的单核细胞增多性李斯特菌引起患有肢体骨肉瘤的狗的治疗有效性抗肿瘤免疫的安全性和功效。
图13.ADXS-31-164施用后的治疗相关不良事件和存活期曲线。A)治疗相关不良事件。B)在试验入选时所有狗均无转移性疾病。对照组的狗接受了截肢,然后单独施用卡铂或卡铂加上阿霉素。审查疫苗组的2只狗,因为它们死于不相关的原因(1只狗死于吸入性肺炎,另一只死于肾胚细胞瘤)。疫苗接种组:红线;对照组:黑线。
图14.人(A)和犬科动物(B)患者的原发性和转移性骨肉瘤(OSA)的放射图像。在两个物种中,原发性病灶的特征在于骨干骺端(A中箭头)的显著增生和溶解区域。
图15.I期3+3临床试验的示意图,其在患有HER2+骨肉瘤(OSA)的狗中评估ADXS31-164的安全性和功效。患有自发性HER2+肢体OSA的私有狗接受了护理标准截肢和随访卡铂化疗。在最终卡铂剂量三周后,给狗静脉内接种2×108、5×108、1×109或3×109CFU的ADXS31-164(相隔三周进行三次疫苗接种)。每2个月给狗进行再分期直到死亡,以确定疫苗防止转移性疾病的功效。
图16.犬科动物原发性骨肉瘤中的HER2/neu表达。(A)狗原发性OSA的H&E染色示出恶性成骨细胞的巢和类骨质沉积。(B)犬科动物原发性OSA的免疫组织化学评估示出HER2/neu在恶性成骨细胞中的表达。(C)5只私有狗的原发性OSA样品的Western印迹示出HER2/neu表达是可变的。阳性对照为:MCF-7人乳腺癌细胞系和CAMAC2犬科动物乳腺癌细胞系。
图17.基线和ADXS31-164施用后24小时的血液指标值。对每个剂量组内所有狗每次疫苗接种时的前值和后值取平均值。p<0.05,p<0.005。示出在ADXS31-164施用后24小时,白细胞和中性粒细胞计数(A-B)的瞬时、但统计学上显著的增加,并且伴有血小板和淋巴细胞(C-D)瞬时减少。
图18.ADXS31-164诱导的白细胞(WBC)、中性粒细胞和单核细胞计数增加与存活期相关。WBC、中性粒细胞和单核细胞计数在基线和疫苗接种后24小时测定。在每次疫苗接种后计算增加的百分比,并且对每只狗取平均值。(A)结果根据存活(死亡或活着)显示。(B)结果根据所接受的ADXS31-164剂量显示。水平条表示该组的中值。
图19.示出ADXS31-164诱导的Her-2特异性T细胞应答的IFN-γELISpot评估结果。
图20.示出重复“加强”疫苗接种刺激了Her-2特异性免疫。(A)示出患者289-003的结果。(B)示出患者289-004的结果。EC1、EC2和IC1表示HER2/neu多肽的肽片段。
图21.(A)转移时间(TTM)和(B)OSA特异性存活期的Kaplan Meier估计。
图22.示出ADXS31-164防止转移性疾病的发展。(A和B)在卡铂治疗后3周(A)和第三次ADXS31-164疫苗接种后3周(B)采集的胸部放射显影照片示出右颅侧肺叶预先存在的转移性结节大小增加,但在其余的肺叶中转移性疾病不会进一步发展。(C和D)在ICG施用后,肺结节的胸腔镜检查发现在近红外光下发荧光(C)。在转移灶切除时移除的外观总体正常的肺组织示出在近红外光下的荧光(插图)(D)。(E和F)(E)肺结节和(F)发荧光正常肺组织的H&E染色组织病理学示出包裹性肺结节(E)和外观总体正常的肺组织炎症的局灶性区域(F)的显著出血和坏死。(G和H)在低倍(G)和高倍(H)放大率下肺结节的免疫组织化学示出围绕肺结节的CD3+T细胞以及肿瘤组织内的微量CD3+T细胞。(I和J)在低倍(G)和高倍(H)放大率下外观正常的肺组织的免疫组织化学显示CD3+T细胞的局灶性积聚。(K)局灶性肺炎的高倍放大率H&E染色示出大异常细胞,其中有丝分裂象被淋巴细胞围绕。(L)肺炎区域的波形蛋白染色示出大细胞,其中有丝分裂象被单核细胞围绕。
图23.ADXS31‐164延缓/防止转移性疾病并且延长患有自发性HER2+骨肉瘤的狗的总体存活期。示出疫苗接种狗与历史对照组相比的Kaplan‐Meier存活期曲线。对照组由患有HER2+肢体OSA的狗、截肢处理的狗和随访化疗但未接受ADXS31-164的狗组成。P<0.0001。疫苗接种组:红线;对照组:黑线。
图24.示出ADXS31‐164破坏了对HER2/neu的耐受性。在基线、第3次疫苗接种后3周(9周)和2个月后(17周)收集PBMC,并通过IFN-γELISpot分析对HER2/neu的高度保守IC1域的应答。所示的结果将狗分为早期应答者、晚期应答者和表观无应答者。NA表示这些狗的17周样品未经评估。
图25A-D.示出ADXS31-164未对心脏功能造成不利影响。评估每只狗的基线、疫苗接种时和其后每2个月的心脏参数LVID(舒张期)(图25A)、LVID(收缩期)(图25B)和缩短分数(图25C)。在相同的时间点评估心脏肌钙蛋白I水平(图25D)。
图26.示出ADXS31-164破坏了对HER2/neu的高度保守胞内域的免疫耐受性。
应当理解,为了说明的简洁和清晰起见,图中示出的元件未必按比例绘制。例如,为清晰起见,一些元件的尺寸可相对于其他元件放大。另外,在适当情况下,附图标号可在图中重复用于表示对应的或类似的元件。
具体实施方式
在以下具体实施方式中,陈述了多个具体细节,以提供对本发明的透彻理解。然而,本领域的技术人员将理解可在不具有这些具体细节的情况下实施本发明。在其他情况中,为避免使本发明复杂化,未对熟知的方法、工序和组分进行详细描述。
在一个实施例中,本文提供了用于防止、治疗Her2-neu抗原表达肿瘤和接种所述肿瘤的疫苗,并且诱导对Her2-neu抗原的次优势表位的免疫应答,同时绕开突变回避的组合物和方法。在另一个实施例中,绕开突变回避是由于表位扩展。在又一个实施例中,绕开突变回避是由于抗原的嵌合性质。
在另一个实施例中,本文提供了包含融合多肽的免疫原性组合物,其中所述融合多肽包含融合至另外的多肽的HER2/neu嵌合抗原,并且其中将融合蛋白施用于患有HER2/neu表达肿瘤的受试者防止所述肿瘤内的逃逸突变。在另一个实施例中,本文提供了包含免疫原性组合物的重组李斯特菌疫苗株。
在一个实施例中,受试者是人受试者。在另一个实施例中,人受试者是成人或儿童。在另一个实施例中,人受试者是儿童。在另一个实施例中,受试者是犬科动物受试者。在另一个实施例中,犬科动物是狗。
在一个实施例中,本文提供了引起受试者的对HER2/neu表达肿瘤生长或癌症的增强免疫应答的方法,该方法包括施用包含编码融合多肽的核酸的重组李斯特菌的步骤,其中所述融合多肽包含融合至另外的多肽的HER2/neu嵌合抗原。
在一个实施例中,本文提供了防止受试者的HER2/neu表达肿瘤生长或癌症的方法,该方法包括施用包含编码融合多肽的核酸的重组李斯特菌的步骤,其中所述融合多肽包含融合至另外的多肽的HER2/neu嵌合抗原。
在另一个实施例中,本文提供了治疗受试者的HER2/neu表达肿瘤生长或癌症的方法,该方法包括施用包含编码融合多肽的核酸的重组李斯特菌的步骤,其中所述融合多肽包含融合至另外的多肽的HER2/neu嵌合抗原。
在一个实施例中,本文提供了延长患有HER2/neu表达肿瘤生长或癌症的受试者的存活期的方法,该方法包括施用包含编码融合多肽的核酸的重组李斯特菌的步骤,其中所述融合多肽包含融合至另外的多肽的HER2/neu嵌合抗原。在一个实施例中,受试者是人。在另一个实施例中,受试者是犬科动物。
在一个实施例中,本文提供了延缓患有HER2/neu表达肿瘤生长或癌症的受试者的转移性疾病的方法,该方法包括施用包含编码融合多肽的核酸的重组李斯特菌的步骤,其中所述融合多肽包含融合至另外的多肽的HER2/neu嵌合抗原。在一个实施例中,受试者是人。在另一个实施例中,受试者是犬科动物。
在一个实施例中,本文提供了治疗受试者的HER2/neu表达肿瘤生长或癌症的方法,该方法包括施用包含编码融合多肽的核酸的重组减毒李斯特菌的步骤,其中所述融合多肽包含融合至另外的多肽的HER2/neu嵌合抗原,其中所述核酸分子包含编码所述融合多肽的第一开放阅读框,其中所述核酸分子还包含编码代谢酶的第二开放阅读框,并且其中所述代谢酶互补所述重组李斯特菌疫苗株的染色体中突变的内源性基因。在另一个实施例中,受试者是人。在另一个实施例中,人受试者可以是成人或儿童。在另一个实施例中,受试者是犬科动物。在另一个实施例中,嵌合HER2是犬科动物嵌合HER2。在另一个实施例中,嵌合HER2是人嵌合HER2。在另一个实施例中,将所述融合多肽施用于所述受试者防止所述肿瘤内的逃逸突变。在另一个实施例中,所述人HER2/neu嵌合抗原包含至少5、9、13、14或17个标绘的人MHC I类表位。
在一个实施例中,本文提供了包含核酸分子的重组李斯特菌疫苗株,其中该核酸分子包含编码多肽的第一开放阅读框,其中该多肽包含HER2/neu嵌合抗原,其中该核酸分子还包含编码代谢酶的第二开放阅读框,并且其中该代谢酶互补重组李斯特菌菌株的染色体中缺乏的内源性基因。在另一个实施例中,重组李斯特菌疫苗株还包含包括编码代谢酶的第三开放阅读框的核酸分子,并且其中该代谢酶互补重组李斯特菌菌株的染色体中缺乏的内源性基因。
在一个实施例中,核酸分子整合进李斯特菌基因组。在另一个实施例中,核酸分子在重组李斯特菌疫苗株的质粒中。在又一个实施例中,质粒在不存在抗生素选择的情况下稳定维持在重组李斯特菌疫苗株中。在另一个实施例中,质粒不赋予重组李斯特菌抗生素抗性。在另一个实施例中,重组李斯特菌菌株是减毒的。在另一个实施例中,重组李斯特菌是减毒营养缺陷型菌株。在另一个实施例中,外源抗原表达对细菌诸如本发明的一种细菌施加的高代谢负担也是减毒的重要机制。
在一个实施例中,减毒菌株是LmddA。在另一个实施例中,该菌株施加强佐剂效应,该效应是基于李斯特菌的疫苗的固有性质。该佐剂效应的一个表现是表达除嵌合HER2/neu之外的抗原的李斯特菌或ADXS-31-164(表达嵌合HER2/neu)疫苗导致的肿瘤内Treg数量下降5倍(参见本文的图5)。在另一个实施例中,表达不同抗原(HPV16E7)的LmddA载体还与肿瘤中Treg的频率显著下降相关,很可能是由于先天免疫应答的结果。
在一个实施例中,本文提供的减毒营养缺陷型李斯特菌疫苗株是ADXS-31-164菌株。ADXADXS-31-164基于李斯特菌疫苗载体,该载体由于毒性基因actA的缺失而减毒,并且由于dal基因的互补而维持用于HER2/neu的体内和体外表达的质粒。在一个实施例中,ADXS31-164表达和分泌融合至李斯特菌溶血素O(LLO)的前441个氨基酸的嵌合HER2/neu蛋白,在另一个实施例中,李斯特菌溶血素O是截短的非溶血LLO。在另一个实施例中,ADXS31-164发挥强烈的和抗原特异性的抗肿瘤应答,在转基因动物中能够破坏对HER2/neu的耐受性(参见实例,图24)。在另一个实施例中,ADXS31-164菌株是高度减毒的,并且具有比前一代李斯特菌疫苗更高的安全谱,因为它能更迅速地从免疫小鼠的脾脏清除。在另一个实施例中,ADXS31-164使转基因动物中的肿瘤发病延缓期比Lm-LLO-ChHer2(该疫苗的抗生素抗性和毒性更强的形式)更长(参见图3)。在另一个实施例中,ADXS31-164菌株具有高度免疫原性,能够破坏对HER2/neu自体抗原的耐受性,并且防止HER2/neu转基因动物中的肿瘤形成。在另一个实施例中,ADXS31-164使肿瘤内调节性T细胞(Treg)显著减少。在另一个实施例中,LmddA疫苗处理的肿瘤中Treg频率的下降使肿瘤内CD8/Treg比率升高,暗示在LmddA疫苗免疫后可获得更有利的肿瘤微环境。在另一个实施例中,该嵌合抗原的使用不产生逃逸突变,表明肿瘤的突变不会远离对使用该新型抗原进行治疗的治疗有效应答(参见实例6)。在另一个实施例中,ADXS31-164的外周免疫延缓了脑中转移性乳腺癌细胞系的生长(参见实例7)。在另一个实施例中,与未接受ADXS31-164疫苗接种的对照受试者相比,将包括截肢、化疗和ADXS31-164疫苗接种的治疗提供给患有骨肉瘤犬科动物受试者延长了存活期(参见实例9和10)。在另一个实施例中,与未接受ADXS31-164疫苗接种的对照受试者相比,将包括截肢、化疗和ADXS31-164疫苗接种的治疗提供给患有骨肉瘤的犬科动物受试者显示出转移减少(参见实例10)。在另一个实施例中,与未接受ADXS31-164疫苗接种的对照受试者相比,将包括截肢、化疗和ADXS31-164疫苗接种的治疗提供给患有骨肉瘤的犬科动物受试者显示出所诱导的特异性T细胞应答增强(参见实例10)。
在一个实施例中,Lm-LLO-ChHer2菌株是Lm-LLO-138,并且包含从质粒表达的抗生素抗性基因和prfA基因。
在一个实施例中,将重组减毒的表达嵌合抗原的无抗生素李斯特菌用于防止和治疗癌症或实体肿瘤,如本文所举例说明。在另一个实施例中,肿瘤是HER2/neu阳性肿瘤。在另一个实施例中,癌症是HER2/neu表达癌症。在另一个实施例中,癌症是乳腺癌、中枢神经系统(CNS)癌症、头颈癌、骨肉瘤(OSA)、犬科动物骨肉瘤、尤因氏肉瘤(ES)或本领域已知的任何HER2/neu表达癌症。在另一个实施例中,犬科动物骨肉瘤是肢体骨肉瘤。在另一个实施例中,肿瘤是骨肉瘤、乳腺肿瘤、头颈部肿瘤或本领域已知的任何其他抗原表达肿瘤。在另一个实施例中,本文所述的癌症或实体肿瘤是复发或转移性疾病的结果。
在另一个实施例中,表达嵌合HER2/neu的重组李斯特菌可用作治疗HER2/neu过表达实体肿瘤的治疗性疫苗。在另一个实施例中,本文提供的HER2/neu嵌合抗原可用于治疗HER2/neu表达肿瘤和防止该肿瘤的逃逸突变。在另一个实施例中,术语“逃逸突变”是指远离对治疗的治疗有效应答的肿瘤突变。
在一个实施例中,本文提供了包含编码本文提供的重组多肽的第一开放阅读框的核酸分子,其中核酸分子驻留在重组李斯特菌疫苗株内。在另一个实施例中,将本文提供的核酸分子用于转化李斯特菌,以获得重组李斯特菌。在另一个实施例中,本文提供的核酸缺乏毒性基因。在另一个实施例中,整合进李斯特菌基因组的核酸分子携带无功能的毒性基因。在另一个实施例中,毒性基因在重组李斯特菌的基因组中是突变的。在又一个实施例中,核酸分子用于使李斯特菌基因组中存在的内源性基因失活。在又一个实施例中,毒性基因是actA基因。在另一个实施例中,毒性基因是prfA基因。技术人员将会理解,毒性基因可以是本领域已知的与重组李斯特菌中的毒性相关的任何基因。
在一个实施例中,本文提供的代谢基因、毒性基因等是李斯特菌菌株的染色体缺乏的。在另一个实施例中,本文提供的代谢基因、毒性基因等是李斯特菌菌株的染色体和任何游离体遗传因子缺乏的。技术人员将会理解,术语“游离体”、“游离体的”等是指不整合进本文提供的李斯特菌的染色体中的质粒载体或其用途。在另一个实施例中,该术语是指整合进本文提供的李斯特菌的染色体中的质粒载体。在另一个实施例中,代谢基因、毒性基因等是毒性菌株的基因组缺乏的。在一个实施例中,毒性基因在染色体中是突变的。在另一个实施例中,毒性基因是染色体缺失的。
在另一个实施例中,本文提供的核酸和质粒不赋予本文提供的重组李斯特菌抗生素抗性。
在一个实施例中,本文提供的核酸分子包括质粒。在另一个实施例中,本文提供的核酸分子是质粒。在另一个实施例中,本文提供的质粒是整合载体。在另一个实施例中,质粒是非整合载体。在另一个实施例中,质粒包括整合载体。在另一个实施例中,整合载体是位点特异性整合载体。在另一个实施例中,本发明的方法和组合物的核酸分子由本领域已知的任何类型的核苷酸构成。
技术人员将会理解,术语“代谢酶”可涵盖宿主细菌所需的营养物质的合成中涉及的酶。在另一个实施例中,该术语是指宿主细菌所需的营养物质的合成所需的酶。在另一个实施例中,该术语是指宿主细菌利用的营养物质的合成中涉及的酶。在另一个实施例中,该术语是指宿主细菌的持续生长所需的营养物质的合成中涉及的酶。在另一个实施例中,酶是营养物质的合成所需的。每种可能性表示本发明的单独实施例。
技术人员将会理解,术语“稳定维持”可涵盖在不存在选择(如,抗生素选择)的情况下使核酸分子或质粒维持在宿主细胞或细菌中10代而不产生可检测的损失。在另一个实施例中,该周期是15代。在另一个实施例中,该周期是20代。在另一个实施例中,该周期是25代。在另一个实施例中,该周期是30代。在另一个实施例中,该周期是40代。在另一个实施例中,该周期是50代。在另一个实施例中,该周期是60代。在另一个实施例中,该周期是80代。在另一个实施例中,该周期是100代。在另一个实施例中,该周期是150代。在另一个实施例中,该周期是200代。在另一个实施例中,该周期是300代。在另一个实施例中,该周期是500代。在另一个实施例中,该周期是更多代。在另一个实施例中,核酸分子或质粒在体外(如,在培养中)稳定维持。在另一个实施例中,核酸分子或质粒在体内稳定维持。在另一个实施例中,核酸分子或质粒既在体外也在体内稳定维持。
在一个实施例中,本发明提供表达该抗原的重组李斯特菌菌株。本发明还提供包含融合至HER2嵌合蛋白或其片段的李斯特菌溶血素(LLO)蛋白片段的重组多肽,包含该重组多肽的疫苗和免疫原性组合物,以及诱导抗HER2免疫应答和治疗HER2表达肿瘤及接种包含该重组多肽的疫苗的方法。
在另一个实施例中,本发明的重组李斯特菌菌株已在动物宿主中传代。在另一个实施例中,该传代使作为疫苗载体的菌株的功效最大化。在另一个实施例中,该传代稳定李斯特菌菌株的免疫原性。在另一个实施例中,该传代稳定李斯特菌菌株的毒性。在另一个实施例中,该传代增加李斯特菌菌株的免疫原性。在另一个实施例中,该传代增加李斯特菌菌株的毒性。在另一个实施例中,该传代移除李斯特菌菌株的不稳定亚株。在另一个实施例中,该传代减少李斯特菌菌株的不稳定亚株的流行。在另一个实施例中,李斯特菌菌株包含编码含抗原重组肽的基因的基因组插入。在另一个实施例中,李斯特菌菌株携带包含编码含抗原重组肽的基因的质粒。在另一个实施例中,该传代通过本领域已知的任何其他方法进行。
在一个实施例中,本文提供的重组多肽包含本文提供的融合蛋白。在另一个实施例中,重组多肽是融合蛋白。在另一个实施例中,本文提供的融合蛋白包含嵌合HER2抗原和选自:a)非溶血LLO蛋白或N-末端片段、b)PEST序列或c)ActA片段的另外的多肽,另外其中所述另外的多肽融合至HER2/neu嵌合抗原。在另一个实施例中,另外的多肽是有功能的。在另一个实施例中,另外的多肽的片段具有免疫原性。在另一个实施例中,另外的多肽具有免疫原性。
在另一个实施例中,本文提供的融合蛋白包含融合至本文提供的HER2/neu嵌合抗原的非溶血LLO蛋白或N-末端片段。在另一个实施例中,本发明的方法和组合物的融合蛋白包含来自李斯特菌生物体的ActA序列。ActA蛋白及其片段以类似于LLO的方式增强抗原呈递和免疫。
在另一个实施例中,本发明的方法和组合物的融合蛋白包含来自李斯特菌生物体的截短的ActA序列。在另一个实施例中,截短的ActA由野生型ActA蛋白的前390个氨基酸组成,如美国专利No.7,655,238中所述,该专利全文以引用的方式并入本文。在另一个实施例中,截短的ActA是ActA-N100或其修饰型式(称为ActA-N100*),其中PEST基序缺失,并且包含非保守的QDNKR置换,如美国专利公布No.2014/0186387中所述。ActA蛋白及其片段以类似于LLO的方式增强抗原呈递和免疫。
在本发明的方法和组合物的另一个实施例中,本文提供的融合蛋白包含HER2/neu抗原和另外的多肽。在一个实施例中,另外的多肽是非溶血LLO蛋白或其片段(本文的实例)。在另一个实施例中,另外的多肽是PEST序列。在另一个实施例中,另外的多肽是ActA蛋白或其片段。ActA蛋白及其片段以类似于LLO的方式增强抗原呈递和免疫。
在另一个实施例中,本发明的方法和组合物的另外的多肽是李斯特菌溶血素(LLO)肽。在另一个实施例中,另外的多肽是ActA肽。在另一个实施例中,另外的多肽是PEST序列肽。在另一个实施例中,另外的多肽是能够增强抗原肽的免疫原性的任何其他肽。每种可能性表示本发明的单独实施例。
包含HER2/neu嵌合抗原的融合蛋白可通过任何合适的方法制备,包括例如克隆和适当序列的限制或通过下文讨论的方法直接化学合成。或者,可克隆子序列并使用适当的限制性酶切割适当的子序列。然后可连接片段以制备所需的DNA序列。在一个实施例中,编码本文提供的抗原的DNA可使用DNA扩增法例如聚合酶链式反应(PCR)制备。首先,在天然DNA片段的新末端的任一侧单独扩增。一个扩增的序列的5'末端编码肽接头,而另一个扩增的序列的3'末端也编码肽接头。由于第一片段的5'末端与第二片段的3'末端互补,两个片段(在部分纯化后,如在LMP琼脂糖上)可在第三PCR反应中用作重叠模板。扩增的序列将包含密码子、开口位点羧基侧上的片段(现在形成氨基序列)、接头和开口位点氨基侧上的序列(现在形成羧基序列)。在另一个实施例中,将抗原连接至质粒。每种方法表示本发明的单独实施例。
本发明的结果表明,本发明的组合物的施用可用于诱导识别和杀死肿瘤细胞的抗原特异性T细胞(如,细胞毒性T细胞)的形成(本文的实例)。
在一个实施例中,本发明提供包含融合至HER2嵌合蛋白或融合至其片段的LLO蛋白的N-末端片段的重组多肽。在一个实施例中,本发明提供由融合至HER2嵌合蛋白或融合至其片段的LLO蛋白的N-末端片段组成的重组多肽。
在另一个实施例中,本发明的方法和组合物的HER2嵌合蛋白是人HER2嵌合蛋白。在另一个实施例中,HER2嵌合蛋白是小鼠HER2嵌合蛋白。在另一个实施例中,HER2嵌合蛋白是大鼠HER2嵌合蛋白。在另一个实施例中,HER2嵌合蛋白是灵长类HER2嵌合蛋白。在另一个实施例中,HER2嵌合蛋白是犬科动物HER2嵌合蛋白。在另一个实施例中,Her-2蛋白是本领域已知的人或任何其他动物物种的HER2嵌合蛋白或它们的组合。每种可能性表示本发明的单独实施例。
在另一个实施例中,Her-2蛋白是称为“HER2/neu”、“Erbb2”、“v-erb-b2”、“c-erb-b2”、“neu”或“cNeu”的蛋白。在另一个实施例中,HER2/neu在本文中也称为“Her-2”、“Her-2蛋白”、“HER2蛋白”或“HER2”。
在一个实施例中,本文提供的Her2-neu嵌合蛋白具有HER2/neu抗原的两个胞外片段和一个胞内片段,该抗原示出癌基因的MHC I类表位簇,而在另一个实施例中,嵌合蛋白具有3个H2Dq和至少17个HER2/neu抗原的标绘的人MHC I类表位(片段EC1、EC2和IC1)(参见图1A)。在另一个实施例中,嵌合蛋白具有至少13个标绘的人MHC I类表位(片段EC2和IC1)。在另一个实施例中,嵌合蛋白具有至少14个标绘的人MHC I类表位(片段EC1和IC1)。在另一个实施例中,嵌合蛋白具有至少9个标绘的人MHC I类表位(片段EC1和IC2)。在另一个实施例中,Her2-neu嵌合蛋白融合至非溶血李斯特菌溶血素O(LLO)。在另一个实施例中,Her2-neu嵌合蛋白融合至截短的李斯特菌溶血素O(tLLO)。在另一个实施例中,Her2-neu嵌合蛋白融合至单核细胞增多性李斯特菌李斯特菌溶血素O(LLO)蛋白的前441个氨基酸,并且由单核细胞增多性李斯特菌减毒营养缺陷型菌株LmddA表达和分泌。在另一个实施例中,来自本文提供的减毒营养缺陷型菌株(表达嵌合HER2/neu抗原/LLO融合蛋白)的融合蛋白tLLO-ChHer2的表达和分泌与体外生长8小时后TCA沉淀细胞培养上清液中Lm-LLO-ChHer2的表达和分泌相当(参见图1B)。
在一个实施例中,在未暴露的动物(animal)或不相关李斯特菌疫苗注射的小鼠中未检测到CTL活性(参见图2A)。而在另一个实施例中,本文提供的减毒营养缺陷型菌株(ADXS31-164)能够通过野生型FVB/N小鼠的脾细胞刺激IFN-γ的分泌(图2B)。
在另一个实施例中,本文提供的方法和组合物的代谢酶是氨基酸代谢酶,而在另一个实施例中,代谢酶是丙氨酸消旋酶。在另一个实施例中,代谢酶是D-氨基酸转移酶。在另一个实施例中,代谢酶催化用于重组李斯特菌菌株中的细胞壁合成的氨基酸的形成,而在另一个实施例中,代谢酶是丙氨酸消旋酶。
在另一个实施例中,编码该代谢酶的基因在李斯特菌p60启动子的控制下表达。在另一个实施例中,使用inlA(编码内化素)启动子。在另一个实施例中,使用hly启动子。在另一个实施例中,使用ActA启动子。在另一个实施例中,整合酶基因在任何其他革兰氏阳性启动子的控制下表达。在另一个实施例中,编码代谢酶的基因在李斯特菌中发挥功能的任何其他启动子的控制下表达。技术人员将会知道,其他启动子或多顺反子表达盒可用于驱动基因的表达。每种可能性表示本发明的单独实施例。
在另一个实施例中,HER2/neu嵌合蛋白由以下SEQ ID NO:1示出的核酸序列编码
gagacccacctggacatgctccgccacctctaccagggctgccaggtggtgcagggaaacctggaactcacctacctgcccaccaatgccagcctgtccttcctgcaggatatccaggaggtgcagggctacgtgctcatcgctcacaaccaagtgaggcaggtcccactgcagaggctgcggattgtgcgaggcacccagctctttgaggacaactatgccctggccgtgctagacaatggagacccgctgaacaataccacccctgtcacaggggcctccccaggaggcctgcgggagctgcagcttcgaagcctcacagagatcttgaaaggaggggtcttgatccagcggaacccccagctctgctaccaggacacgattttgtggaagaatatccaggagtttgctggctgcaagaagatctttgggagcctggcatttctgccggagagctttgatggggacccagcctccaacactgccccgctccagccagagcagctccaagtgtttgagactctggaagagatcacaggttacctatacatctcagcatggccggacagcctgcctgacctcagcgtcttccagaacctgcaagtaatccggggacgaattctgcacaatggcgcctactcgctgaccctgcaagggctgggcatcagctggctggggctgcgctcactgagggaactgggcagtggactggccctcatccaccataacacccacctctgcttcgtgcacacggtgccctgggaccagctctttcggaacccgcaccaagctctgctccacactgccaaccggccagaggacgagtgtgtgggcgagggcctggcctgccaccagctgtgcgcccgagggcagcagaagatccggaagtacacgatgcggagactgctgcaggaaacggagctggtggagccgctgacacctagcggagcgatgcccaaccaggcgcagatgcggatcctgaaagagacggagctgaggaaggtgaaggtgcttggatctggcgcttttggcacagtctacaagggcatctggatccctgatggggagaatgtgaaaattccagtggccatcaaagtgttgagggaaaacacatcccccaaagccaacaaagaaatcttagacgaagcatacgtgatggctggtgtgggctccccatatgtctcccgccttctgggcatctgcctgacatccacggtgcagctggtgacacagcttatgccctatggctgcctcttagactaa(SEQ ID NO:1)。
在另一个实施例中,HER2/neu嵌合蛋白包含SEQ ID NO:2的序列:
E T H L D M L R H L Y Q G C Q V V Q G N L E L T Y L P T N A S L S F L Q D I Q E V Q G Y V L I A H N Q V R Q V P L Q R L R I V R G T Q L F E D N Y A L A V L D N G D P L N N T T P V T G A S P G G L R E L Q L R S L T E I L K G G V L I Q R N P Q L C Y Q D T I L W K N I Q E F A G C K K I F G S L A F L P E S F D G D P A S N T AP L Q P E Q L Q V F E T L E E I T G Y L Y I S AW P D S L P D L S V F Q N L Q V I R G R I L H N G A Y S L T L Q G L G I S W L G L R S L R E L G S G L A L I H H N T H L C F V H T V P W D Q L F R N P H Q A L L H T A N R P E D E C V G E G L A C H Q L C A R G Q Q K I R K Y T M R R L L Q E T E L V E P L T P S G A M P N Q A Q M R I L K E T E L R K V K V L G S G A F G T V Y K G I W I P D G E N V K I P V A I K V L R E N T S P K A N K E I L D E A Y V M A G V G S P Y V S R L L G I C L T S T V Q L V T Q L M P Y G C L L D(SEQ ID NO:2)。
下表1分别示出人和犬科动物Her-2EC和IC片段的氨基酸序列之间的百分比(%)同一性。
表1
在另一个实施例中,编码人HER2/EC1片段的氨基酸序列在(SEQ ID NO:69):SLSFLQDIQEVQGYVLIAHNQVRQVPLQRLRIVRGTQLFEDNYALAVLDNGDPLNNTTPVTGASPGGLRELQLRSLTEILKGGVLIQRNPQLCYQDTILWKDIFHKNNQLALTLIDTNRSRACHPCSPMCK(SEQ ID NO:69)中示出。
在另一个实施例中,编码犬科动物her2/neu EC1片段的氨基酸序列在(SEQ ID NO:70):
SLSFLQDIQEVQGYVLIAHSQVRQIPLQRLRIVRGTQLFEDNYALAVLDNGDPLEGGIPAPGAAPGGLRELQLRSLTEILKGGVLIQRSPQLCHQDTILWKDVFHKNNQLALTLIDTNRSRACPPCSPACK(SEQ ID NO:70)中示出。
在另一个实施例中,编码人HER2/neu EC2片段的氨基酸序列在(SEQ ID NO:71):
TAPLQPEQLQVFETLEEITGYLYISAWPDSLPDLSVFQNLQVIRGRILHNGAYSLTLQGLGISWLGLRSLRELGS(SEQ ID NO:71)中示出。
在另一个实施例中,编码犬科动物her2/neu EC2片段的氨基酸序列在(SEQ ID NO:72):
TAPLQPEQLRVFEALEEITGYLYISAWPDSLPNLSVFQNLRVIRGRVLHDGAYSLTLQGLGISWLGLRSLRELGS(SEQ ID NO:72)中示出。
在另一个实施例中,编码人HER2/neu IC1片段的氨基酸序列在(SEQ ID NO:73):
NQAQMRILKETELRKVKVLGSGAFGTVYKGIWIPDGENVKIPVAIKVLRENTSPKANKEILDEAYVMAGVGSPYVSRLLGICLTSTVQLVTQLMPYGCLLDHVRENRGRLGSQDLLNWCMQIAKGMSYLED(SEQ ID NO:73)中示出。
在另一个实施例中,编码犬科动物her2/neu IC1片段的氨基酸序列在(SEQ ID NO:74):
NQAQMRILKETELRKVKVLGSGAFGTVYKGIWIPDGENVKIPVAIKVLRENTSPKANKEILDEAYVMAGVGSPYVSRLLGICLTSTVQLVTQLMPYGCLLDHVRENRGRLGSQDLLNWCMQIAKGMSYLED(SEQ ID NO:74)中示出。在一个实施例中,人HER2EC1片段的氨基酸序列(SEQ ID NO:69)与犬科动物HER2EC1片段的氨基酸序列(SEQ ID NO:70)具有89%的同一性。在另一个实施例中,人HER2EC2片段的氨基酸序列(SEQ ID NO:71)与犬科动物HER2EC2片段的氨基酸序列(SEQ ID NO:72)具有93%的同一性。在另一个实施例中,人HER2IC1片段的氨基酸序列(SEQ ID NO:73)与犬科动物HER2IC1片段的氨基酸序列(SEQ ID NO:74)具有98%的同一性。
在一个实施例中,本文提供的方法和组合物的HER2嵌合蛋白或其片段不包括其信号序列。在另一个实施例中,由于信号序列的高疏水性,信号序列的省去使HER2片段能够在李斯特菌中成功表达。每种可能性表示本发明的单独实施例。
在另一个实施例中,本发明的方法和组合物的HER2嵌合蛋白的片段不包括其跨膜域(TM)。在一个实施例中,由于TM的高疏水性,TM的省去使HER2片段能够在李斯特菌中成功表达。每种可能性表示本发明的单独实施例。
在一个实施例中,编码大鼠HER2/neu基因的核酸序列包含SEQ ID NO:45:CCGGAATCGCGGGCACCCAAGTGTGTACCGGCACAGACATGAAGTTGCGGCTCCCTGCCAGTCCTGAGACCCACCTGGACATGCTCCGCCACCTGTACCAGGGCTGTCAGGTAGTGCAGGGCAACTTGGAGCTTACCTACGTGCCTGCCAATGCCAGCCTCTCATTCCTGCAGGACATCCAGGAAGTTCAGGGTTACATGCTCATCGCTCACAACCAGGTGAAGCGCGTCCCACTGCAAAGGCTGCGCATCGTGAGAGGGACCCAGCTCTTTGAGGACAAGTATGCCCTGGCTGTGCTAGACAACCGAGATCCTCAGGACAATGTCGCCGCCTCCACCCCAGGCAGAACCCCAGAGGGGCTGCGGGAGCTGCAGCTTCGAAGTCTCACAGAGATCCTGAAGGGAGGAGTTTTGATCCGTGGGAACCCTCAGCTCTGCTACCAGGACATGGTTTTGTGGAAGGACGTCTTCCGCAAGAATAACCAACTGGCTCCTGTCGATATAGACACCAATCGTTCCCGGGCCTGTCCACCTTGTGCCCCCGCCTGCAAAGACAATCACTGTTGGGGTGAGAGTCCGGAAGACTGTCAGATCTTGACTGGCACCATCTGTACCAGTGGTTGTGCCCGGTGCAAGGGCCGGCTGCCCACTGACTGCTGCCATGAGCAGTGTGCCGCAGGCTGCACGGGCCCCAAGCATTCTGACTGCCTGGCCTGCCTCCACTTCAATCATAGTGGTATCTGTGAGCTGCACTGCCCAGCCCTCGTCACCTACAACACAGACACCTTTGAGTCCATGCACAACCCTGAGGGTCGCTACACCTTTGGTGCCAGCTGCGTGACCACCTGCCCCTACAACTACCTGTCTACGGAAGTGGGATCCTGCACTCTGGTGTGTCCCCCGAATAACCAAGAGGTCACAGCTGAGGACGGAACACAGCGTTGTGAGAAATGCAGCAAGCCCTGTGCTCGAGTGTGCTATGGTCTGGGCATGGAGCACCTTCGAGGGGCGAGGGCCATCACCAGTGACAATGTCCAGGAGTTTGATGGCTGCAAGAAGATCTTTGGGAGCCTGGCATTTTTGCCGGAGAGCTTTGATGGGGACCCCTCCTCCGGCATTGCTCCGCTGAGGCCTGAGCAGCTCCAAGTGTTCGAAACCCTGGAGGAGATCACAGGTTACCTGTACATCTCAGCATGGCCAGACAGTCTCCGTGACCTCAGTGTCTTCCAGAACCTTCGAATCATTCGGGGACGGATTCTCCACGATGGCGCGTACTCATTGACACTGCAAGGCCTGGGGATCCACTCGCTGGGGCTGCGCTCACTGCGGGAGCTGGGCAGTGGATTGGCTCTGATTCACCGCAACGCCCATCTCTGCTTTGTACACACTGTACCTTGGGACCAGCTCTTCCGGAACCCACATCAGGCCCTGCTCCACAGTGGGAACCGGCCGGAAGAGGATTGTGGTCTCGAGGGCTTGGTCTGTAACTCACTGTGTGCCCACGGGCACTGCTGGGGGCCAGGGCCCACCCAGTGTGTCAACTGCAGTCATTTCCTTCGGGGCCAGGAGTGTGTGGAGGAGTGCCGAGTATGGAAGGGGCTCCCCCGGGAGTATGTGAGTGACAAGCGCTGTCTGCCGTGTCACCCCGAGTGTCAGCCTCAAAACAGCTCAGAGACCTGCTTTGGATCGGAGGCTGATCAGTGTGCAGCCTGCGCCCACTACAAGGACTCGTCCTCCTGTGTGGCTCGCTGCCCCAGTGGTGTGAAACCGGACCTCTCCTACATGCCCATCTGGAAGTACCCGGATGAGGAGGGCATATGCCAGCCGTGCCCCATCAACTGCACCCACTCCTGTGTGGATCTGGATGAACGAGGCTGCCCAGCAGAGCAGAGAGCCAGCCCGGTGACATTCATCATTGCAACTGTAGTGGGCGTCCTGCTGTTCCTGATCTTAGTGGTGGTCGTTGGAATCCTAATCAAACGAAGGAGACAGAAGATCCGGAAGTATACGATGCGTAGGCTGCTGCAGGAAACTGAGTTAGTGGAGCCGCTGACGCCCAGCGGAGCAATGCCCAACCAGGCTCAGATGCGGATCCTAAAAGAGACGGAGCTAAGGAAGGTGAAGGTGCTTGGATCAGGAGCTTTTGGCACTGTCTACAAGGGCATCTGGATCCCAGATGGGGAGAATGTGAAAATCCCCGTGGCTATCAAGGTGTTGAGAGAAAACACATCTCCTAAAGCCAACAAAGAAATTCTAGATGAAGCGTATGTGATGGCTGGTGTGGGTTCTCCGTATGTGTCCCGCCTCCTGGGCATCTGCCTGACATCCACAGTACAGCTGGTGACACAGCTTATGCCCTACGGCTGCCTTCTGGACCATGTCCGAGAACACCGAGGTCGCCTAGGCTCCCAGGACCTGCTCAACTGGTGTGTTCAGATTGCCAAGGGGATGAGCTACCTGGAGGACGTGCGGCTTGTACACAGGGACCTGGCTGCCCGGAATGTGCTAGTCAAGAGTCCCAACCACGTCAAGATTACAGATTTCGGGCTGGCTCGGCTGCTGGACATTGATGAGACAGAGTACCATGCAGATGGGGGCAAGGTGCCCATCAAATGGATGGCATTGGAATCTATTCTCAGACGCCGGTTCACCCATCAGAGTGATGTGTGGAGCTATGGAGTGACTGTGTGGGAGCTGATGACTTTTGGGGCCAAACCTTACGATGGAATCCCAGCCCGGGAGATCCCTGATTTGCTGGAGAAGGGAGAACGCCTACCTCAGCCTCCAATCTGCACCATTGATGTCTACATGATTATGGTCAAATGTTGGATGATTGACTCTGAATGTCGCCCGAGATTCCGGGAGTTGGTGTCAGAATTTTCACGTATGGCGAGGGACCCCCAGCGTTTTGTGGTCATCCAGAACGAGGACTTGGGCCCATCCAGCCCCATGGACAGTACCTTCTACCGTTCACTGCTGGAAGATGATGACATGGGTGACCTGGTAGACGCTGAAGAGTATCTGGTGCCCCAGCAGGGATTCTTCTCCCCGGACCCTACCCCAGGCACTGGGAGCACAGCCCATAGAAGGCACCGCAGCTCGTCCACCAGGAGTGGAGGTGGTGAGCTGACACTGGGCCTGGAGCCCTCGGAAGAAGGGCCCCCCAGATCTCCACTGGCTCCCTCGGAAGGGGCTGGCTCCGATGTGTTTGATGGTGACCTGGCAATGGGGGTAACCAAAGGGCTGCAGAGCCTCTCTCCACATGACCTCAGCCCTCTACAGCGGTACAGCGAGGACCCCACATTACCTCTGCCCCCCGAGACTGATGGCTATGTTGCTCCCCTGGCCTGCAGCCCCCAGCCCGAGTATGTGAACCAATCAGAGGTTCAGCCTCAGCCTCCTTTAACCCCAGAGGGTCCTCTGCCTCCTGTCCGGCCTGCTGGTGCTACTCTAGAAAGACCCAAGACTCTCTCTCCTGGGAAGAATGGGGTTGTCAAAGACGTTTTTGCCTTCGGGGGTGCTGTGGAGAACCCTGAATACTTAGTACCGAGAGAAGGCACTGCCTCTCCGCCCCACCCTTCTCCTGCCTTCAGCCCAGCCTTTGACAACCTCTATTACTGGGACCAGAACTCATCGGAGCAGGGGCCTCCACCAAGTAACTTTGAAGGGACCCCCACTGCAGAGAACCCTGAGTACCTAGGCCTGGATGTACCTGTA(SEQ ID NO:45)。
在一个实施例中,编码大鼠HER2/neu EC1片段的核酸序列包含SEQ ID NO:46:
CCCAGGCAGAACCCCAGAGGGGCTGCGGGAGCTGCAGCTTCGAAGTCTCACAGAGATCCTGAAGGGAGGAGTTTTGATCCGTGGGAACCCTCAGCTCTGCTACCAGGACATGGTTTTGTGGAAGGACGTCTTCCGCAAGAATAACCAACTGGCTCCTGTCGATATAGACACCAATCGTTCCCGGGCCTGTCCACCTTGTGCCCCCGCCTGCAAAGACAATCACTGTTGGGGTGAGAGTCCGGAAGACTGTCAGATCTTGACTGGCACCATCTGTACCAGTGGTTGTGCCCGGTGCAAGGGCCGGCTGCCCACTGACTGCTGCCATGAGCAGTGTGCCGCAGGCTGCACGGGCCCCAAGCA(SEQ ID NO:46)。
在另一个实施例中,编码大鼠HER2/neu EC2片段的核酸序列包含SEQ ID NO:47:
GGTCACAGCTGAGGACGGAACACAGCGTTGTGAGAAATGCAGCAAGCCCTGTGCTCGAGTGTGCTATGGTCTGGGCATGGAGCACCTTCGAGGGGCGAGGGCCATCACCAGTGACAATGTCCAGGAGTTTGATGGCTGCAAGAAGATCTTTGGGAGCCTGGCATTTTTGCCGGAGAGCTTTGATGGGGACCCCTCCTCCGGCATTGCTCCGCTGAGGCCTGAGCAGCTCCAAGTGTTCGAAACCCTGGAGGAGATCACAGGTTACCTGTACATCTCAGCATGGCCAGACAGTCTCCGTGACCTCAGTGTCTTCCAGAACCTTCGAATCATTCGGGGACGGATTCTCCACGATGGCGCGTACTCATTGACACTGCAAGGCCTGGGGATCCACTCGCTGGGGCTGCGCTCACTGCGGGAGCTGGGCAGTGGATTGGCTCTGATTCACCGCAACGCCCATCTCTGCTTTGTACACACTGTACCTTGGGACCAGCTCTTCCGGAACCCACATCAGGCCCTGCTCCACAGTGGGAACCGGCCGGAAGAGGATTGTGGTCTCGAGGGCTTGGTCTGTAACTCACTGTGTGCCCACGGGCACTGCTGGGGGCCAGGGCCCACCCA(SEQ ID NO:47)。
在另一个实施例中,编码大鼠HER2/neu IC1片段的核酸序列包含SEQ ID NO:48:
CGCCCAGCGGAGCAATGCCCAACCAGGCTCAGATGCGGATCCTAAAAGAGACGGAGCTAAGGAAGGTGAAGGTGCTTGGATCAGGAGCTTTTGGCACTGTCTACAAGGGCATCTGGATCCCAGATGGGGAGAATGTGAAAATCCCCGTGGCTATCAAGGTGTTGAGAGAAAACACATCTCCTAAAGCCAACAAAGAAATTCTAGATGAAGCGTATGTGATGGCTGGTGTGGGTTCTCCGTATGTGTCCCGCCTCCTGGGCATCTGCCTGACATCCACAGTACAGCTGGTGACACAGCTTATGCCCTACGGCTGCCTTCTGGACCATGTCCGAGAACACCGAGGTCGCCTAGGCTCCCAGGACCTGCTCAACTGGTGTGTTCAGATTGCCAAGGGGATGAGCTACCTGGAGGACGTGCGGCTTGTACACAGGGACCTGGCTGCCCGGAATGTGCTAGTCAAGAGTCCCAACCACGTCAAGATTACAGATTTCGGGCTGGCTCGGCTGCTGGACATTGATGAGACAGAGTACCATGCAGATGGGGGCAAGGTGCCCATCAAATGGATGGCATTGGAATCTATTCTCAGACGCCGGTTCACCCATCAGAGTGATGTGTGGAGCTATGGAGTGACTGTGTGGGAGCTGATGACTTTTGGGGCCAAACCTTACGATGGAATCCCAGCCCGGGAGATCCCTGATTTGCTGGAGAAGGGAGAACGCCTACCTCAGCCTCCAATCTGCACCATTGATGTCTACATGATTATGGTCAAATGTTGGATGATTGACTCTGAATGTCGCCCGAGATTCCGGGAGTTGGTGTCAGAATTTTCACGTATGGCGAGGGACCCCCAGCGTTTTGTGGTCATCCAGAACGAGGACTTGGGCCCATCCAGCCCCATGGACAGTACCTTCTACCGTTCACTGCTGGAA(SEQ ID NO:48)。
在一个实施例中,人HER2/neu基因的核酸序列包含SEQ ID NO:49:
ATGGAGCTGGCGGCCTTGTGCCGCTGGGGGCTCCTCCTCGCCCTCTTGCCCCCCGGAGCCGCGAGCACCCAAGTGTGCACCGGCACAGACATGAAGCTGCGGCTCCCTGCCAGTCCCGAGACCCACCTGGACATGCTCCGCCACCTCTACCAGGGCTGCCAGGTGGTGCAGGGAAACCTGGAACTCACCTACCTGCCCACCAATGCCAGCCTGTCCTTCCTGCAGGATATCCAGGAGGTGCAGGGCTACGTGCTCATCGCTCACAACCAAGTGAGGCAGGTCCCACTGCAGAGGCTGCGGATTGTGCGAGGCACCCAGCTCTTTGAGGACAACTATGCCCTGGCCGTGCTAGACAATGGAGACCCGCTGAACAATACCACCCCTGTCACAGGGGCCTCCCCAGGAGGCCTGCGGGAGCTGCAGCTTCGAAGCCTCACAGAGATCTTGAAAGGAGGGGTCTTGATCCAGCGGAACCCCCAGCTCTGCTACCAGGACACGATTTTGTGGAAGGACATCTTCCACAAGAACAACCAGCTGGCTCTCACACTGATAGACACCAACCGCTCTCGGGCCTGCCACCCCTGTTCTCCGATGTGTAAGGGCTCCCGCTGCTGGGGAGAGAGTTCTGAGGATTGTCAGAGCCTGACGCGCACTGTCTGTGCCGGTGGCTGTGCCCGCTGCAAGGGGCCACTGCCCACTGACTGCTGCCATGAGCAGTGTGCTGCCGGCTGCACGGGCCCCAAGCACTCTGACTGCCTGGCCTGCCTCCACTTCAACCACAGTGGCATCTGTGAGCTGCACTGCCCAGCCCTGGTCACCTACAACACAGACACGTTTGAGTCCATGCCCAATCCCGAGGGCCGGTATACATTCGGCGCCAGCTGTGTGACTGCCTGTCCCTACAACTACCTTTCTACGGACGTGGGATCCTGCACCCTCGTCTGCCCCCTGCACAACCAAGAGGTGACAGCAGAGGATGGAACACAGCGGTGTGAGAAGTGCAGCAAGCCCTGTGCCCGAGTGTGCTATGGTCTGGGCATGGAGCACTTGCGAGAGGTGAGGGCAGTTACCAGTGCCAATATCCAGGAGTTTGCTGGCTGCAAGAAGATCTTTGGGAGCCTGGCATTTCTGCCGGAGAGCTTTGATGGGGACCCAGCCTCCAACACTGCCCCGCTCCAGCCAGAGCAGCTCCAAGTGTTTGAGACTCTGGAAGAGATCACAGGTTACCTATACATCTCAGCATGGCCGGACAGCCTGCCTGACCTCAGCGTCTTCCAGAACCTGCAAGTAATCCGGGGACGAATTCTGCACAATGGCGCCTACTCGCTGACCCTGCAAGGGCTGGGCATCAGCTGGCTGGGGCTGCGCTCACTGAGGGAACTGGGCAGTGGACTGGCCCTCATCCACCATAACACCCACCTCTGCTTCGTGCACACGGTGCCCTGGGACCAGCTCTTTCGGAACCCGCACCAAGCTCTGCTCCACACTGCCAACCGGCCAGAGGACGAGTGTGTGGGCGAGGGCCTGGCCTGCCACCAGCTGTGCGCCCGAGGGCACTGCTGGGGTCCAGGGCCCACCCAGTGTGTCAACTGCAGCCAGTTCCTTCGGGGCCAGGAGTGCGTGGAGGAATGCCGAGTACTGCAGGGGCTCCCCAGGGAGTATGTGAATGCCAGGCACTGTTTGCCGTGCCACCCTGAGTGTCAGCCCCAGAATGGCTCAGTGACCTGTTTTGGACCGGAGGCTGACCAGTGTGTGGCCTGTGCCCACTATAAGGACCCTCCCTTCTGCGTGGCCCGCTGCCCCAGCGGTGTGAAACCTGACCTCTCCTACATGCCCATCTGGAAGTTTCCAGATGAGGAGGGCGCATGCCAGCCTTGCCCCATCAACTGCACCCACTCCTGTGTGGACCTGGATGACAAGGGCTGCCCCGCCGAGCAGAGAGCCAGCCCTCTGACGTCCATCGTCTCTGCGGTGGTTGGCATTCTGCTGGTCGTGGTCTTGGGGGTGGTCTTTGGGATCCTCATCAAGCGACGGCAGCAGAAGATCCGGAAGTACACGATGCGGAGACTGCTGCAGGAAACGGAGCTGGTGGAGCCGCTGACACCTAGCGGAGCGATGCCCAACCAGGCGCAGATGCGGATCCTGAAAGAGACGGAGCTGAGGAAGGTGAAGGTGCTTGGATCTGGCGCTTTTGGCACAGTCTACAAGGGCATCTGGATCCCTGATGGGGAGAATGTGAAAATTCCAGTGGCCATCAAAGTGTTGAGGGAAAACACATCCCCCAAAGCCAACAAAGAAATCTTAGACGAAGCATACGTGATGGCTGGTGTGGGCTCCCCATATGTCTCCCGCCTTCTGGGCATCTGCCTGACATCCACGGTGCAGCTGGTGACACAGCTTATGCCCTATGGCTGCCTCTTAGACCATGTCCGGGAAAACCGCGGACGCCTGGGCTCCCAGGACCTGCTGAACTGGTGTATGCAGATTGCCAAGGGGATGAGCTACCTGGAGGATGTGCGGCTCGTACACAGGGACTTGGCCGCTCGGAACGTGCTGGTCAAGAGTCCCAACCATGTCAAAATTACAGACTTCGGGCTGGCTCGGCTGCTGGACATTGACGAGACAGAGTACCATGCAGATGGGGGCAAGGTGCCCATCAAGTGGATGGCGCTGGAGTCCATTCTCCGCCGGCGGTTCACCCACCAGAGTGATGTGTGGAGTTATGGTGTGACTGTGTGGGAGCTGATGACTTTTGGGGCCAAACCTTACGATGGGATCCCAGCCCGGGAGATCCCTGACCTGCTGGAAAAGGGGGAGCGGCTGCCCCAGCCCCCCATCTGCACCATTGATGTCTACATGATCATGGTCAAATGTTGGATGATTGACTCTGAATGTCGGCCAAGATTCCGGGAGTTGGTGTCTGAATTCTCCCGCATGGCCAGGGACCCCCAGCGCTTTGTGGTCATCCAGAATGAGGACTTGGGCCCAGCCAGTCCCTTGGACAGCACCTTCTACCGCTCACTGCTGGAGGACGATGACATGGGGGACCTGGTGGATGCTGAGGAGTATCTGGTACCCCAGCAGGGCTTCTTCTGTCCAGACCCTGCCCCGGGCGCTGGGGGCATGGTCCACCACAGGCACCGCAGCTCATCTACCAGGAGTGGCGGTGGGGACCTGACACTAGGGCTGGAGCCCTCTGAAGAGGAGGCCCCCAGGTCTCCACTGGCACCCTCCGAAGGGGCTGGCTCCGATGTATTTGATGGTGACCTGGGAATGGGGGCAGCCAAGGGGCTGCAAAGCCTCCCCACACATGACCCCAGCCCTCTACAGCGGTACAGTGAGGACCCCACAGTACCCCTGCCCTCTGAGACTGATGGCTACGTTGCCCCCCTGACCTGCAGCCCCCAGCCTGAATATGTGAACCAGCCAGATGTTCGGCCCCAGCCCCCTTCGCCCCGAGAGGGCCCTCTGCCTGCTGCCCGACCTGCTGGTGCCACTCTGGAAAGGGCCAAGACTCTCTCCCCAGGGAAGAATGGGGTCGTCAAAGACGTTTTTGCCTTTGGGGGTGCCGTGGAGAACCCCGAGTACTTGACACCCCAGGGAGGAGCTGCCCCTCAGCCCCACCCTCCTCCTGCCTTCAGCCCAGCCTTCGACAACCTCTATTACTGGGACCAGGACCCACCAGAGCGGGGGGCTCCACCCAGCACCTTCAAAGGGACACCTACGGCAGAGAACCCAGAGTACCTGGGTCTGGACGTGCCAGTGTGAACCAGAAGGCCAAGTCCGCAGAAGCCCTGA(SEQ ID NO:49)。
在另一个实施例中,以嵌合体实施的编码人HER2/neu EC1片段的核酸序列跨越人EC1区域的120-510bp,并且包含SEQ ID NO:50:
GAGACCCACCTGGACATGCTCCGCCACCTCTACCAGGGCTGCCAGGTGGTGCAGGGAAACCTGGAACTCACCTACCTGCCCACCAATGCCAGCCTGTCCTTCCTGCAGGATATCCAGGAGGTGCAGGGCTACGTGCTCATCGCTCACAACCAAGTGAGGCAGGTCCCACTGCAGAGGCTGCGGATTGTGCGAGGCACCCAGCTCTTTGAGGACAACTATGCCCTGGCCGTGCTAGACAATGGAGACCCGCTGAACAATACCACCCCTGTCACAGGGGCCTCCCCAGGAGGCCTGCGGGAGCTGCAGCTTCGAAGCCTCACAGAGATCTTGAAAGGAGGGGTCTTGATCCAGCGGAACCCCCAGCTCTGCTACCAGGACACGATTTTGTGGAAG(SEQID NO:50)。
在一个实施例中,完整的EC1人HER2/neu片段跨越(人HER2/neu基因的58-979bp),并且由包含SEQ ID NO:54的核酸序列编码:
GCCGCGAGCACCCAAGTGTGCACCGGCACAGACATGAAGCTGCGGCTCCCTGCCAGTCCCGAGACCCACCTGGACATGCTCCGCCACCTCTACCAGGGCTGCCAGGTGGTGCAGGGAAACCTGGAACTCACCTACCTGCCCACCAATGCCAGCCTGTCCTTCCTGCAGGATATCCAGGAGGTGCAGGGCTACGTGCTCATCGCTCACAACCAAGTGAGGCAGGTCCCACTGCAGAGGCTGCGGATTGTGCGAGGCACCCAGCTCTTTGAGGACAACTATGCCCTGGCCGTGCTAGACAATGGAGACCCGCTGAACAATACCACCCCTGTCACAGGGGCCTCCCCAGGAGGCCTGCGGGAGCTGCAGCTTCGAAGCCTCACAGAGATCTTGAAAGGAGGGGTCTTGATCCAGCGGAACCCCCAGCTCTGCTACCAGGACACGATTTTGTGGAAGGACATCTTCCACAAGAACAACCAGCTGGCTCTCACACTGATAGACACCAACCGCTCTCGGGCCTGCCACCCCTGTTCTCCGATGTGTAAGGGCTCCCGCTGCTGGGGAGAGAGTTCTGAGGATTGTCAGAGCCTGACGCGCACTGTCTGTGCCGGTGGCTGTGCCCGCTGCAAGGGGCCACTGCCCACTGACTGCTGCCATGAGCAGTGTGCTGCCGGCTGCACGGGCCCCAAGCACTCTGACTGCCTGGCCTGCCTCCACTTCAACCACAGTGGCATCTGTGAGCTGCACTGCCCAGCCCTGGTCACCTACAACACAGACACGTTTGAGTCCATGCCCAATCCCGAGGGCCGGTATACATTCGGCGCCAGCTGTGTGACTGCCTGTCCCTACAACTACCTTTCTACGGACGTGGGATCCTGCACCCTCGTCTGCCCCCTGCACAACCAAGAGGTGACAGCAGAGGAT(SEQ ID NO:54)。
在另一个实施例中,以嵌合体实施的编码人HER2/neu EC2片段的核酸序列跨越人HER2/neu EC2片段的1077-1554bp,并且包括50bp延伸,且包含SEQ ID NO:51:
AATATCCAGGAGTTTGCTGGCTGCAAGAAGATCTTTGGGAGCCTGGCATTTCTGCCGGAGAGCTTTGATGGGGACCCAGCCTCCAACACTGCCCCGCTCCAGCCAGAGCAGCTCCAAGTGTTTGAGACTCTGGAAGAGATCACAGGTTACCTATACATCTCAGCATGGCCGGACAGCCTGCCTGACCTCAGCGTCTTCCAGAACCTGCAAGTAATCCGGGGACGAATTCTGCACAATGGCGCCTACTCGCTGACCCTGCAAGGGCTGGGCATCAGCTGGCTGGGGCTGCGCTCACTGAGGGAACTGGGCAGTGGACTGGCCCTCATCCACCATAACACCCACCTCTGCTTCGTGCACACGGTGCCCTGGGACCAGCTCTTTCGGAACCCGCACCAAGCTCTGCTCCACACTGCCAACCGGCCAGAGGACGAGTGTGTGGGCGAGGGCCTGGCCTGCCACCAGCTGTGCGCCCGAGGG(SEQ ID NO:51)。
在一个实施例中,完整的EC2人HER2/neu片段跨越人HER2/neu基因的907-1504bp,并且由包含SEQ ID NO:55的核酸序列编码:
TACCTTTCTACGGACGTGGGATCCTGCACCCTCGTCTGCCCCCTGCACAACCAAGAGGTGACAGCAGAGGATGGAACACAGCGGTGTGAGAAGTGCAGCAAGCCCTGTGCCCGAGTGTGCTATGGTCTGGGCATGGAGCACTTGCGAGAGGTGAGGGCAGTTACCAGTGCCAATATCCAGGAGTTTGCTGGCTGCAAGAAGATCTTTGGGAGCCTGGCATTTCTGCCGGAGAGCTTTGATGGGGACCCAGCCTCCAACACTGCCCCGCTCCAGCCAGAGCAGCTCCAAGTGTTTGAGACTCTGGAAGAGATCACAGGTTACCTATACATCTCAGCATGGCCGGACAGCCTGCCTGACCTCAGCGTCTTCCAGAACCTGCAAGTAATCCGGGGACGAATTCTGCACAATGGCGCCTACTCGCTGACCCTGCAAGGGCTGGGCATCAGCTGGCTGGGGCTGCGCTCACTGAGGGAACTGGGCAGTGGACTGGCCCTCATCCACCATAACACCCACCTCTGCTTCGTGCACACGGTGCCCTGGGACCAGCTCTTTCGGAACCCGCACCAAGCTCTGCTCCACACTGCCAACCGGCCAGAG(SEQ ID NO:55)。
在另一个实施例中,以嵌合体实施的编码人HER2/neu IC1片段的核酸序列包含SEQ ID NO:52:
CAGCAGAAGATCCGGAAGTACACGATGCGGAGACTGCTGCAGGAAACGGAGCTGGTGGAGCCGCTGACACCTAGCGGAGCGATGCCCAACCAGGCGCAGATGCGGATCCTGAAAGAGACGGAGCTGAGGAAGGTGAAGGTGCTTGGATCTGGCGCTTTTGGCACAGTCTACAAGGGCATCTGGATCCCTGATGGGGAGAATGTGAAAATTCCAGTGGCCATCAAAGTGTTGAGGGAAAACACATCCCCCAAAGCCAACAAAGAAATCTTAGACGAAGCATACGTGATGGCTGGTGTGGGCTCCCCATATGTCTCCCGCCTTCTGGGCATCTGCCTGACATCCACGGTGCAGCTGGTGACACAGCTTATGCCCTATGGCTGCCTCTTAGACT(SEQ ID NO:52)。
在另一个实施例中,编码完整的人HER2/neu IC1片段的核酸序列跨越人HER2/neu基因的2034-3243,并且包含SEQ ID NO:56:
CAGCAGAAGATCCGGAAGTACACGATGCGGAGACTGCTGCAGGAAACGGAGCTGGTGGAGCCGCTGACACCTAGCGGAGCGATGCCCAACCAGGCGCAGATGCGGATCCTGAAAGAGACGGAGCTGAGGAAGGTGAAGGTGCTTGGATCTGGCGCTTTTGGCACAGTCTACAAGGGCATCTGGATCCCTGATGGGGAGAATGTGAAAATTCCAGTGGCCATCAAAGTGTTGAGGGAAAACACATCCCCCAAAGCCAACAAAGAAATCTTAGACGAAGCATACGTGATGGCTGGTGTGGGCTCCCCATATGTCTCCCGCCTTCTGGGCATCTGCCTGACATCCACGGTGCAGCTGGTGACACAGCTTATGCCCTATGGCTGCCTCTTAGACCATGTCCGGGAAAACCGCGGACGCCTGGGCTCCCAGGACCTGCTGAACTGGTGTATGCAGATTGCCAAGGGGATGAGCTACCTGGAGGATGTGCGGCTCGTACACAGGGACTTGGCCGCTCGGAACGTGCTGGTCAAGAGTCCCAACCATGTCAAAATTACAGACTTCGGGCTGGCTCGGCTGCTGGACATTGACGAGACAGAGTACCATGCAGATGGGGGCAAGGTGCCCATCAAGTGGATGGCGCTGGAGTCCATTCTCCGCCGGCGGTTCACCCACCAGAGTGATGTGTGGAGTTATGGTGTGACTGTGTGGGAGCTGATGACTTTTGGGGCCAAACCTTACGATGGGATCCCAGCCCGGGAGATCCCTGACCTGCTGGAAAAGGGGGAGCGGCTGCCCCAGCCCCCCATCTGCACCATTGATGTCTACATGATCATGGTCAAATGTTGGATGATTGACTCTGAATGTCGGCCAAGATTCCGGGAGTTGGTGTCTGAATTCTCCCGCATGGCCAGGGACCCCCAGCGCTTTGTGGTCATCCAGAATGAGGACTTGGGCCCAGCCAGTCCCTTGGACAGCACCTTCTACCGCTCACTGCTGGAGGACGATGACATGGGGGACCTGGTGGATGCTGAGGAGTATCTGGTACCCCAGCAGGGCTTCTTCTGTCCAGACCCTGCCCCGGGCGCTGGGGGCATGGTCCACCACAGGCACCGCAGCTCATCTACCAGGAGTGGCGGTGGGGACCTGACACTAGGGCTGGAGCCCTCTGAAGAGGAGGCCCCCAGGTCTCCACTGGCACCCTCCGAAGGGGCT(SEQ ID NO:56)。
在一个实施例中,用于本文提供的方法和组合物的LLO是李斯特菌LLO。在一个实施例中,LLO来自的李斯特菌是单核细胞增多性李斯特菌(LM)。在另一个实施例中,李斯特菌是伊万诺夫李斯特菌(Listeria ivanovii)。在另一个实施例中,李斯特菌是威耳逊李斯特菌(Listeria welshimeri)。在另一个实施例中,李斯特菌是西尔李斯特菌(Listeria seeligeri)。在另一个实施例中,LLO蛋白是非李斯特菌LLO蛋白。在另一个实施例中,LLO蛋白是合成LLO蛋白。在另一个实施例中,它是重组LLO蛋白。
在一个实施例中,LLO蛋白由包含SEQ ID NO:3的核酸序列编码:
atgaaaaaaataatgctagtttttattacacttatattagttagtctaccaattgcgcaacaaactgaagcaaaggatgcatctgcattcaataaagaaaattcaatttcatccatggcaccaccagcatctccgcctgcaagtcctaagacgccaatcgaaaagaaacacgcggatgaaatcgataagtatatacaaggattggattacaataaaaacaatgtattagtataccacggagatgcagtgacaaatgtgccgccaagaaaaggttacaaagatggaaatgaatatattgttgtggagaaaaagaagaaatccatcaatcaaaataatgcagacattcaagttgtgaatgcaatttcgagcctaacctatccaggtgctctcgtaaaagcgaattcggaattagtagaaaatcaaccagatgttctccctgtaaaacgtgattcattaacactcagcattgatttgccaggtatgactaatcaagacaataaaatagttgtaaaaaatgccactaaatcaaacgttaacaacgcagtaaatacattagtggaaagatggaatgaaaaatatgctcaagcttatccaaatgtaagtgcaaaaattgattatgatgacgaaatggcttacagtgaatcacaattaattgcgaaatttggtacagcatttaaagctgtaaataatagcttgaatgtaaacttcggcgcaatcagtgaagggaaaatgcaagaagaagtcattagttttaaacaaatttactataacgtgaatgttaatgaacctacaagaccttccagatttttcggcaaagctgttactaaagagcagttgcaagcgcttggagtgaatgcagaaaatcctcctgcatatatctcaagtgtggcgtatggccgtcaagtttatttgaaattatcaactaattcccatagtactaaagtaaaagctgcttttgatgctgccgtaagcggaaaatctgtctcaggtgatgtagaactaacaaatatcatcaaaaattcttccttcaaagccgtaatttacggaggttccgcaaaagatgaagttcaaatcatcgacggcaacctcggagacttacgcgatattttgaaaaaaggcgctacttttaatcgagaaacaccaggagttcccattgcttatacaacaaacttcctaaaagacaatgaattagctgttattaaaaacaactcagaatatattgaaacaacttcaaaagcttatacagatggaaaaattaacatcgatcactctggaggatacgttgctcaattcaacatttcttgggatgaagtaaattatgat(SEQID NO:3)。
在另一个实施例中,LLO蛋白包含序列SEQ ID NO:4:
M K K I M L V F I T L I L V S L P I A Q Q T E A K D A S A F N K E N S I S S M A P P A S P P A S P K T P I E K K H A D E I D K Y I Q G L D Y N K N N V L V Y H G D A V T N V P P R K G Y K D G N E Y I V V E K K K K S I N Q N N A D I Q V V N A I S S L T Y P G A L V K A N S E L V E N Q P D V L P V K R D S L T L S I D L P G M T N Q D N K I V V K N A T K S N V N N A V N T L V E R W N E K Y A Q A Y P N V S A K I D Y D D E M A Y S E S Q L I A K F G T A F K A V N N S L N V N F G A I S E G K M Q E E V I S F K Q I Y Y N V N V N E P T R P S R F F G K A V T K E Q L Q A L G V N A E N P P A Y I S S V A Y G R Q V Y L K L S T N S H S T K V K A A F D A A V S G K S V S G D V E L T N I I K N S S F K A V I Y G G S A K D E V Q I I D G N L G D L R D I L K K G A T F N R E T P G V P I A Y T T N F L K D N E L A V I K N N S E Y I E T T S K A Y T D G K I N I D H S G G Y V A Q F N I S W D E V N Y D(SEQ ID NO:4)
对应于该序列的前蛋白的前25个氨基酸为信号序列,并且在细菌分泌时从LLO切割。因此,在该实施例中,全长活性LLO蛋白的长度为504个残基。在另一个实施例中,LLO蛋白具有GenBank登录号DQ054588、DQ054589、AY878649、U25452或U25452示出的序列。在另一个实施例中,LLO蛋白是LLO蛋白的变体。在另一个实施例中,LLO蛋白是LLO蛋白的同源物。每种可能性表示本发明的单独实施例。
在另一个实施例中,“截短的LLO”或“tLLO”是指包含PEST域的LLO片段。在另一个实施例中,该术语是指不包含氨基末端的活化域并且不包含胱氨酸484的LLO片段。在另一个实施例中,LLO片段由PEST序列组成。在另一个实施例中,LLO片段包含PEST序列。在另一个实施例中,LLO片段由529个氨基酸全长LLO蛋白的约前400至441个氨基酸组成。在另一个实施例中,LLO片段是LLO蛋白的非溶血形式。
在本发明的方法和组合物的另一个实施例中,本发明的方法和组合物的核酸序列编码的重组多肽是包含嵌合HER2/neu抗原和另外的多肽的融合蛋白,而在另一个实施例中,融合蛋白尤其包含LLO片段,该LLO片段在一个实施例中是LM非溶血LLO蛋白,或在另一个实施例中是截短的LLO(本文的实例)。
在一个实施例中,LLO片段由大约残基1-25组成。在另一个实施例中,LLO片段由大约残基1-50组成。在另一个实施例中,LLO片段由大约残基1-75组成。在另一个实施例中,LLO片段由大约残基1-100组成。在另一个实施例中,LLO片段由大约残基1-125组成。在另一个实施例中,LLO片段由大约残基1-150组成。在另一个实施例中,LLO片段由大约残基1175组成。在另一个实施例中,LLO片段由大约残基1-200组成。在另一个实施例中,LLO片段由大约残基1-225组成。在另一个实施例中,LLO片段由大约残基1-250组成。在另一个实施例中,LLO片段由大约残基1-275组成。在另一个实施例中,LLO片段由大约残基1-300组成。在另一个实施例中,LLO片段由大约残基1-325组成。在另一个实施例中,LLO片段由大约残基1-350组成。在另一个实施例中,LLO片段由大约残基1-375组成。在另一个实施例中,LLO片段由大约残基1-400组成。在另一个实施例中,LLO片段由大约残基1-425组成。每种可能性表示本发明的单独实施例。
在另一个实施例中,本发明的方法和组合物的融合蛋白包含来自LLO蛋白或来自另一种生物体如原核生物体的PEST序列。
在另一个实施例中,PEST氨基酸(AA)序列包含选自SEQ ID NO:5-9的序列。在另一个实施例中,PEST序列是单核细胞增多性李斯特菌(Lm)ActA蛋白的PEST序列。在另一个实施例中,PEST序列包含KTEEQPSEVNTGPR(SEQ ID NO:5)、KASVTDTSEGDLDSSMQSADESTPQPLK(SEQ ID NO:6)、KNEEVNASDFPPPPTDEELR(SEQ ID NO:7)或RGGIPTSEEFSSLNSGDFTDDENSETTEEEIDR(SEQ ID NO:8)。在另一个实施例中,PEST序列来自链球菌属(Streptococcus sp)的链球菌溶血素O蛋白。在另一个实施例中,PEST序列来自酿脓链球菌(Streptococcus pyogenes)链球菌溶血素O,如AA 35-51的KQNTASTETTTTNEQPK(SEQ ID NO:9)。在另一个实施例中,PEST序列来自类马链球菌(Streptococcus equisimilis)链球菌溶血素O,如AA38-54的KQNTANTETTTTNEQPK(SEQ ID NO:10)。在另一个实施例中,PEST样序列是来源于原核生物体的另一个PEST AA序列。在另一个实施例中,PEST序列是本领域已知的任何其他PEST序列。每种可能性表示本发明的单独实施例。
抗原融合至Lm的PEST序列增强了抗原的细胞介导免疫和抗肿瘤免疫。因此,抗原融合至来源于其他原核生物体的其他PEST序列也将增强抗原的免疫原性。可根据诸如由例如Rechsteiner和Rogers(1996,Trends Biochem.Sci.21:267-271)针对Lm所述的方法鉴定其他原核生物体的PEST序列。或者,来自其他原核生物体的PEST AA序列可也根据此方法鉴定。其中预期存在PEST AA序列的其他原核生物体包括但不限于其他李斯特菌属物种。在另一个实施例中,PEST序列嵌入抗原蛋白内。因此,在另一个实施例中,“融合”是指既包含抗原也包含连接至抗原的一端或嵌入抗原内的PEST氨基酸序列的抗原蛋白。
在另一个实施例中,本文提供了包含本发明的重组多肽的疫苗。在另一个实施例中,本文提供了包含本发明的重组多肽的组合物。在另一个实施例中,本文提供了由本发明的重组多肽组成的疫苗。在另一个实施例中,本文提供了由本发明的重组多肽组成的组合物。在另一个实施例中,组合物是免疫原性组合物。
在另一个实施例中,本文提供了编码本发明的重组多肽的核苷酸分子。在另一个实施例中,本文提供了包含核苷酸分子的疫苗。在另一个实施例中,本文提供了包含核苷酸分子的组合物。
在另一个实施例中,本文提供了编码本发明的重组多肽的核苷酸分子。
在另一个实施例中,本文提供了本发明的核苷酸分子编码的重组多肽。
在另一个实施例中,本文提供了包含本发明的核苷酸分子或重组多肽的疫苗。
在另一个实施例中,本文提供了包含本发明的核苷酸分子或重组多肽的免疫原性组合物。
在另一个实施例中,本文提供了包含本发明的核苷酸分子或重组多肽的载体。
在另一个实施例中,本文提供了包含本发明的核苷酸分子的李斯特菌的重组形式。
在另一个实施例中,本文提供了包含本发明的李斯特菌的重组形式的疫苗。
在另一个实施例中,本文提供了包含本发明的李斯特菌的重组形式的免疫原性组合物。
在另一个实施例中,本文提供了本发明的李斯特菌的重组形式的培养物。
在一个实施例中,用于本发明的方法的疫苗或组合物包含本文所述的任何形式或实施例的重组单核细胞增多性李斯特菌。在一个实施例中,用于本发明的疫苗或组合物由本文所述的任何形式或实施例的本发明的重组单核细胞增多性李斯特菌组成。在另一个实施例中,用于本发明的方法的疫苗或组合物基本上由本文所述的任何形式或实施例的本发明的重组单核细胞增多性李斯特菌组成。
在一个实施例中,术语“包含”是指疫苗或组合物中包含重组单核细胞增多性李斯特菌,以及包括可为本领域已知的其他疫苗、组合物或处理。在另一个实施例中,术语“基本上由...组成”是指功能组分为重组单核细胞增多性李斯特菌的疫苗,然而可包括不直接涉及疫苗的治疗效果的其他疫苗或组合物组分,并且可以例如指有利于重组单核细胞增多性李斯特菌的效果(如,稳定、维持等)的组分。在另一个实施例中,术语“组成”是指包含重组单核细胞增多性李斯特菌的疫苗。
在另一个实施例中,本发明的方法包括施用本文所述的任何形式或实施例的重组单核细胞增多性李斯特菌的步骤。在一个实施例中,本发明的方法由施用本文所述的任何形式或实施例的本发明的重组单核细胞增多性李斯特菌的步骤组成。在另一个实施例中,本发明的方法基本上由施用本文所述的任何形式或实施例的本发明的重组单核细胞增多性李斯特菌的步骤组成。在一个实施例中,术语“包括”是指方法包括施用重组单核细胞增多性李斯特菌的步骤,以及包括可为本领域已知的其他方法或处理。在另一个实施例中,术语“基本上由...组成”是指功能组成部分为施用重组单核细胞增多性李斯特菌的方法,然而可包括不直接涉及方法的治疗效果的其他方法步骤,并且可以例如指有利于重组单核细胞增多性李斯特菌的施用效果的步骤。在一个实施例中,术语“组成”是指无另外的步骤的施用重组单核细胞增多性李斯特菌的方法。
在另一个实施例中,本发明的方法和组合物的李斯特菌是单核细胞增多性李斯特菌。在另一个实施例中,李斯特菌是伊万诺夫李斯特菌(Listeria ivanovii)。在另一个实施例中,李斯特菌是威耳逊李斯特菌。在另一个实施例中,李斯特菌是西尔李斯特菌。每种类型的李斯特菌表示本发明的单独实施例。
在一个实施例中,本发明的方法和组合物的李斯特菌菌株是ADXS31-164菌株。在另一个实施例中,ADXS31-164刺激野生型FVB/N小鼠的脾细胞分泌IFN-γ。另外,本文提供的数据显示,ADXS31-164能够引起对位于靶抗原的不同域的人表位的抗HER2/neu特异性免疫应答。
在另一个实施例中,本发明提供包含编码HER2嵌合蛋白或其片段的核苷酸分子的李斯特菌的重组形式。
在一个实施例中,本发明提供诱导受试者的抗HER2免疫应答的方法,该方法包括将包含融合至HER2嵌合蛋白或融合至其片段的LLO蛋白的N-末端片段的重组多肽施用于受试者,从而诱导受试者的抗HER2免疫应答。
在一个实施例中,融合蛋白的两个分子(LLO、ActA片段或PEST序列和抗原)直接连接。在另一个实施例中,两个分子通过由一个或多个氨基酸组成的短间隔肽连接。在一个实施例中,间隔肽除连接蛋白或维持一定的最小距离或它们之间的其他空间关系之外无特定生物学活性。在另一个实施例中,选择间隔肽的组成氨基酸以影响分子的一些性质,诸如折叠、净电荷或疏水性。在另一个实施例中,两个蛋白分子(LLO片段和抗原)是单独合成的或不融合的。在另一个实施例中,两个蛋白分子从相同的核酸单独合成。在又一个实施例中,两个分子从单独的核酸各自合成。每种可能性表示本发明的单独实施例。
在一个实施例中,编码本文提供的重组多肽的核酸还编码信号肽或序列。在另一个实施例中,本发明的方法和组合物的融合蛋白包含来自LLO的LLO信号序列。在一个实施例中,异源抗原可通过使用信号序列诸如李斯特菌信号序列例如溶血素信号序列或actA信号序列表达。或者,例如,外源基因可在单核细胞增多性李斯特菌启动子下游表达,而不形成融合蛋白。在另一个实施例中,信号肽是细菌的(李斯特菌的或非李斯特菌的)。在一个实施例中,信号肽是细菌天然的。在另一个实施例中,信号肽是细菌外源的。在另一个实施例中,信号肽是单核细胞增多性李斯特菌的信号肽,诸如secA1信号肽。在另一个实施例中,信号肽是乳乳球菌(Lactococcus lactis)的Usp45信号肽或炭疽芽孢杆菌(Bacillus anthracis)的保护抗原信号肽。在另一个实施例中,信号肽是secA2信号肽,例如单核细胞增多性李斯特菌的p60信号肽。此外,重组核酸分子任选地包含编码p60或其片段的第三多核苷酸序列。在另一个实施例中,信号肽是Tat信号肽,诸如枯草芽孢杆菌Tat信号肽(如,PhoD)。在一个实施例中,信号肽在编码重组多肽的相同翻译阅读框中。
在另一个实施例中,本文提供了诱导受试者的抗HER2免疫应答的方法,该方法包括将编码包含融合至HER2嵌合蛋白或融合至其片段的LLO蛋白的N-末端片段的重组多肽的重组核苷酸施用于受试者,从而诱导受试者的抗HER2免疫应答。
在一个实施例中,本文提供了引起受试者的对HER2/neu表达肿瘤的增强免疫应答的方法,而在另一个实施例中,该方法包括将包含本文提供的重组李斯特菌疫苗株的组合物施用于受试者。在另一个实施例中,对HER2表达肿瘤的免疫应答包括对HER2蛋白的次优势表位的免疫应答。在另一个实施例中,对HER2表达肿瘤的免疫应答包括对HER2蛋白的多个次优势表位的免疫应答。在另一个实施例中,对HER2表达肿瘤的免疫应答包括对HER2蛋白的至少1-5个次优势表位的免疫应答。在另一个实施例中,对HER2表达肿瘤的免疫应答包括对HER2蛋白的至少1-10个次优势表位的免疫应答。在另一个实施例中,对HER2表达肿瘤的免疫应答包括对HER2蛋白的至少1-17个次优势表位的免疫应答。在另一个实施例中,对HER2表达肿瘤的免疫应答包括对HER2蛋白的至少17个次优势表位的免疫应答。
据报告,当基于小片段李斯特菌的疫苗或曲妥单抗(针对位于HER2/neu抗原的胞外域的表位的单克隆抗体)靶向这些肿瘤时,致癌蛋白HER2/neu的点突变或氨基酸缺失介导了耐药肿瘤细胞的治疗。本文描述了基于嵌合HER2/neu的组合物,该组合物具有HER2/neu抗原的两个胞外片段和一个胞内片段,该抗原示出癌基因的MHC I类表位簇。该嵌合蛋白具有3个H2Dq和至少17个HER2/neu抗原的标绘的人MHC I类表位,并且融合至单核细胞增多性李斯特菌李斯特菌溶血素O蛋白的前441个氨基酸,由单核细胞增多性李斯特菌减毒菌株LmddA表达和分泌。
前述报告示出,当使用分别表达和分泌HER2/neu抗原的小片段的基于李斯特菌的疫苗(每种疫苗仅具有HER2/neu癌基因的一个H2Dq表位)免疫HER2/neu转基因小鼠时,由于每种疫苗靶向的HER2/neu抗原的那些表位的突变,HER2/neu过表达肿瘤可逃逸(参见Singh R,Paterson Y.Immunoediting sculpts tumor epitopes during immunotherapy.Cancer Res 2007;67:1887-92)。本文示出了出乎意料的结果,当HER2/neu蛋白的三个或更多个表位并入嵌合疫苗时,可通过逃逸突变消除这些肿瘤的选择和逃逸。使用新型HER2/neu嵌合李斯特菌疫苗免疫不会导致可能与HER2/neu抗原的点突变或氨基酸缺失相关的任何逃逸突变(参见本文的实例4)。
在一个实施例中,本文提供了将李斯特菌疫苗株工程化为表达HER2嵌合蛋白或表达嵌合蛋白的重组多肽的方法,该方法包括用核酸分子转化李斯特菌菌株。在另一个实施例中,核酸分子包含编码多肽的第一开放阅读框,其中该多肽包含HER2/neu嵌合抗原。在另一个实施例中,核酸分子还包含编码代谢酶的第二开放阅读框,并且其中所述代谢酶互补重组李斯特菌菌株的染色体中缺乏的内源性基因,从而将李斯特菌疫苗株工程化为表达HER2嵌合蛋白。
在一个实施例中,本文提供的方法和组合物还包含佐剂,而在另一个实施例中,佐剂包括粒细胞/巨噬细胞集落刺激因子(GM-CSF)蛋白、编码GM-CSF蛋白的核苷酸分子、皂草苷QS21、单磷酰脂质A、未经甲基化的含CpG寡核苷酸或本领域已知的任何佐剂。
在一个实施例中,本发明使用减毒李斯特菌菌株,诸如LMδ-actA突变体(Brundage et al,1993,Proc.Natl.Acad.Sci.,USA,90:11890-11894)、单核细胞增多性李斯特菌δ-plcA(Camilli et al,1991,J.Exp.Med.,173:751-754)或δ-ActA、δINL-b(Brockstedt et 5al,2004,PNAS,101:13832–13837)。在另一个实施例中,减毒李斯特菌菌株通过引入一个或多个减毒突变构建,如本领域的普通技术人员了解本文的公开内容时所理解。此类菌株的例子包括但不限于芳族氨基酸营养缺陷型李斯特菌菌株(Alexander et al,1993,Infection and Immunity 1061:2245-2248)和形成脂磷壁酸的突变体(Abachin et al,2002,Mol.Microbiol.43:1-14)和由于缺乏毒性基因而减毒的那些菌株(参见本文的实例)。
在另一个实施例中,本发明的方法和组合物的核酸分子可操作地连接至启动子/调控序列。在另一个实施例中,本发明的方法和组合物的第一开放阅读框可操作地连接至启动子/调控序列。在另一个实施例中,核酸分子包含可操作地连接至启动子/调控序列的第二开放阅读框。在另一个实施例中,每个开放阅读框可操作地连接至启动子/调控序列。每种可能性表示本发明的单独实施例。
技术人员在了解本文提供的本公开内容和方法时,将易于理解不同的转录启动子、终止子、载体或特定基因序列(如,市售的克隆载体中的那些)可成功地用于本发明的方法和组合物。如本发明所设想,这些功能在例如称为pUC系列的市售载体中提供。在另一个实施例中,移除非必需DNA序列(如,抗生素抗性基因)。每种可能性表示本发明的单独实施例。在另一个实施例中,本发明使用市售的质粒。此类质粒可从多个来源获得,例如Invitrogen(La Jolla,CA)、Stratagene(La Jolla,CA)、Clontech(Palo Alto,CA),或可使用本领域熟知的方法构建。
另一个实施例是诸如pCR2.1(Invitrogen,La Jolla,CA)的质粒,该质粒是具有原核复制起点和启动子/调控元件以便有利于在原核生物体中表达的原核表达载体。在另一个实施例中,移除外源性核苷酸序列以减小质粒的大小并增加可置于其中的盒的大小。
此类方法是本领域熟知的,并且在例如Sambrook et al.(1989,Molecular Cloning:A Laboratory Manual,Cold Spring Harbor Laboratory Press,New York)和Ausubei et al.(1997,Current Protocols in Molecular Biology,Green&Wiley,New York)中有所描述。
将抗生素抗性基因用于分子生物学和疫苗制备通常使用的常规选择和克隆工艺。本发明设想的抗生素抗性基因包括但不限于赋予氨苄青霉素、青霉素、甲氧西林、链霉素、红霉素、卡那霉素、四环素、氯霉素(CAT)、新霉素、潮霉素、庆大霉素以及本领域熟知的其他抗生素抗性的基因产物。每个基因表示本发明的单独实施例。
转化细菌的方法是本领域熟知的,并且包括基于氯化钙感受态细胞的方法、电穿孔法、噬菌体介导的转导、化学和物理转化技术(de Boer et al,1989,Cell 56:641-649;Miller et al,1995,FASEB J.,9:190-199;Sambrook et al.1989,Molecular Cloning:A Laboratory Manual,Cold Spring Harbor Laboratory,New York;Ausubel et al.,1997,Current Protocols in Molecular Biology,John Wiley&Sons,New York;Gerhardt et al.,eds.,1994,Methods for General and Molecular Bacteriology,American Society for Microbiology,Washington,DC;Miller,1992,A Short Course in Bacterial Genetics,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.)。在另一个实施例中,本发明的李斯特菌疫苗株通过电穿孔转化。每种方法表示本发明的单独实施例。
在另一个实施例中,将接合用于将遗传物质和/或质粒引入细菌。接合的方法是本领域熟知的,并且例如在Nikodinovic J et al.(A second generation snp-derived Escherichia coli-Streptomyces shuttle expression vector that is generally transferable by conjugation.Plasmid.2006Nov;56(3):223-7)和Auchtung JM et al (Regulation of a Bacillus subtilis mobile genetic element by intercellular signaling and the global DNA damage response.Proc Natl Acad Sci U S A.2005Aug 30;102(35):12554-9)中有所描述。每种方法表示本发明的单独实施例。
在一个实施例中,“转化”与术语“转染”等同使用,是指将细菌细胞工程化为吸收质粒或其他异源性DNA分子。在另一个实施例中,“转化”是指将细菌细胞工程化为表达质粒的基因或其他异源性DNA分子。每种可能性表示本发明的单独实施例。
本发明可用的质粒和其他表达载体在本文别处有所描述,并且可包括例如启动子/调控序列、革兰氏阴性菌和革兰氏阳性菌的复制起点、编码融合蛋白的分离的核酸以及编码氨基酸代谢基因的分离的核酸等特征。另外,编码融合蛋白和氨基酸代谢基因的分离的核酸将具有适用于驱动此类分离的核酸的表达的启动子。用于驱动在细菌系统中表达的启动子是本领域熟知的,并且包括噬菌体λ、pBR322的β-内酰胺酶基因的bla启动子和pBR325的氯霉素乙酰转移酶基因的CAT启动子。原核启动子的另外例子包括5噬菌体λ的主要右和左启动子(PL和PR),大肠杆菌的trp、recA、lacZ、lad和gal启动子,α-淀粉酶(Ulmanen et al,1985.J.Bacteriol.162:176-182)和枯草芽孢杆菌的S28特异性启动子(Gilman et al,1984Gene 32:11-20)、芽孢杆菌(Bacillus)的噬菌体的启动子(Gryczan,1982,In:The Molecular Biology of the Bacilli,Academic Press,Inc.,New York)以及链霉菌启动子(Ward et al,1986,Mol.Gen.Genet.203:468-478)。本发明设想的另外的原核启动子在例如Glick(1987,J.Ind.Microbiol.1:277-282);Cenatiempo,(1986,Biochimie,68:505-516)和Gottesman,(1984,Ann.Rev.Genet.18:415-442中进行了综述。本发明设想的启动子/调控元件的另外例子包括但不限于李斯特菌prfA启动子、李斯特菌hly启动子、李斯特菌p60启动子和李斯特菌actA启动子(GenBank登录号NC_003210)或其片段。
在另一个实施例中,本发明的方法和组合物的质粒包含编码融合蛋白的基因。在另一个实施例中,克隆子序列并使用适当的限制性酶切割适当的子序列。在另一个实施例中,然后连接片段生成所需的DNA序列。在另一个实施例中,编码抗原的DNA使用DNA扩增法例如聚合酶链式反应(PCR)制备。首先,在天然DNA片段的新末端的任一侧单独扩增。一个扩增的序列的5'末端编码肽接头,而另一个扩增的序列的3'末端也编码肽接头。由于第一片段的5'末端与第二片段的3'末端互补,两个片段(在部分纯化后,如在LMP琼脂糖上)可在第三PCR反应中用作重叠模板。扩增的序列将包含密码子、开口位点羧基侧上的片段(现在形成氨基序列)、接头和开口位点氨基侧上的序列(现在形成羧基序列)。将抗原连接至质粒。每种方法表示本发明的单独实施例。
在另一个实施例中,本发明还包括用于临床应用的基于噬菌体的染色体整合系统。使用必需酶(包括但不限于D-丙氨酸消旋酶)营养缺陷型宿主菌株,例如Lmdal(-)dat(-)。在另一个实施例中,为避免“噬菌体治愈步骤”(phage curing step),使用基于PSA的噬菌体整合系统(Lauer,et al.,2002J Bacteriol,184:4177-4186)。在另一个实施例中,这需要抗生素的连续选择来维持整合基因。因此,在另一个实施例中,本发明允许建立不需要抗生素选择的基于噬菌体的染色体整合系统。相反,营养缺陷型宿主菌株将是互补的。
在另一个实施例中,使用重组DNA方法合成本发明的重组蛋白。在一个实施例中,这涉及形成编码融合蛋白的DNA序列,将DNA置于具体启动子/调控元件的控制下的表达盒(诸如本发明的质粒)中,以及表达蛋白。在另一个实施例中,通过任何合适的方法,包括例如适当序列的克隆和限制或通过诸如Narang et al.(1979,Meth.Enzymol.68:90-99)的磷酸三酯法、Brown et al.(1979,Meth.Enzymol 68:109-151)的磷酸二酯法、Beaucage et al.(1981,Tetra.Lett.,22:15 1859-1862)的二乙基亚磷酰胺法和美国专利No.4,458,066的固相载体法的方法直接化学合成来制备编码本发明的融合蛋白(如,非溶血LLO/抗原)的DNA。
在另一个实施例中,使用化学合成制备单链寡核苷酸。在各种实施例中,该单链寡核苷酸通过与互补序列杂交或使用单链作为模板通过DNA聚合酶聚合转换为双链DNA。本领域的技术人员将认识到,虽然DNA的化学合成仅限于约100个碱基的序列,但较长的序列可通过较短的序列的连接获得。在另一个实施例中,克隆子序列并使用适当的限制性酶切割适当的子序列。然后连接片段以制备所需的DNA序列。
在另一个实施例中,使用DNA扩增法诸如聚合酶链式反应(PCR)克隆编码本发明的融合蛋白或重组蛋白的DNA。因此,使用包含合适的限制性位点的正义引物和包含另一个限制性位点(如,不相同的限制性位点以有利于克隆)的反义引物PCR扩增非溶血LLO的基因。重复相同的步骤扩增编码抗原的分离的核酸。连接非溶血LLO和抗原序列并插入质粒或载体,以生成编码连接至抗原末端的非溶血LLO的载体。两个分子直接或通过限制性位点引入的短间隔肽连接。
在另一个实施例中,分子通过由一个或多个氨基酸组成的间隔肽隔离,通常间隔肽除连接蛋白或维持一定的最小距离或它们之间的其他空间关系之外无特定生物学活性。在另一个实施例中,选择间隔肽的组成AA以影响分子的一些性质,诸如折叠、净电荷或疏水性。在另一个实施例中,将编码融合或重组蛋白的核酸序列转化至多种宿主细胞,包括大肠杆菌、其他细菌宿主诸如李斯特菌、酵母和各种高等真核细胞诸如COS、CHO和HeLa细胞系以及骨髓瘤细胞系。重组融合蛋白基因将可操作地连接至每个宿主的适当表达控制序列。启动子/调控序列在本文别处详细描述。在另一个实施例中,质粒还包含另外的启动子调控元件,以及核糖体结合位点和转录终止信号。对于真核细胞,调控序列将包括启动子和来源于如免疫球蛋白基因、SV40、细胞巨化病毒等的增强子,以及聚腺苷酸化序列。在另一个实施例中,序列包括剪接供体和受体序列。
在一个实施例中,术语“可操作地连接”是指其中这样描述的组成部分处于允许其以预期方式发挥功能的关系的并置。“可操作地连接”至编码序列的控制序列的连接方式使得编码序列的表达在与控制序列相容的条件下实现。
在另一个实施例中,为了选择包含质粒的营养缺陷型细菌,使转化的营养缺陷型细菌在将选择氨基酸代谢基因表达的培养基上生长。在另一个实施例中,使用包含用于D-谷氨酸合成的基因的质粒转化D-谷氨酸合成营养缺陷型细菌,并且该营养缺陷型细菌在不存在D-谷氨酸的情况下生长,而未使用该质粒转化或不表达编码用于D-谷氨酸合成的蛋白的质粒的营养缺陷型细菌则不能生长。在另一个实施例中,当转化和表达本发明的质粒时,如果质粒包含编码用于D-丙氨酸合成的氨基酸代谢酶的分离的核酸,则D-丙氨酸合成营养缺陷型细菌将在不存在D-丙氨酸的情况下生长。此类用于制备包含或缺乏必要生长因子、补充剂、氨基酸、维生素、抗生素等等的适当培养基的方法是本领域熟知的,并且可商购获得(Becton-Dickinson,Franklin Lakes,NJ)。每种方法表示本发明的单独实施例。
在另一个实施例中,一旦在适当培养基上选择包含本发明的质粒的营养缺陷型细菌后,细菌即可在存在选择压力的情况下增殖。此类增殖包括使细菌在无营养缺陷型因子的培养基中生长。营养缺陷型细菌中存在表达氨基酸代谢酶的质粒确保质粒将与细菌一起复制,从而连续选择具有质粒的细菌。技术人员在了解本文的本公开内容和方法时,将易于通过调整包含质粒的营养缺陷型细菌生长所处的培养基的量来扩大李斯特菌疫苗载体的制备。
技术人员将会知道,在另一个实施例中,采用其他营养缺陷型菌株和互补系统与本发明一起使用。
在一个实施例中,本文提供了阻碍受试者的HER2表达肿瘤生长的方法,其中并且在另一个实施例中,该方法包括将包含本文所述的重组李斯特菌疫苗株的组合物施用于受试者的步骤。
在另一个实施例中,本文提供了阻碍或延缓来源于受试者的HER2表达肿瘤的转移性疾病的方法,其中并且在另一个实施例中,该方法包括将包含本文所述的重组李斯特菌疫苗株的组合物施用于受试者的步骤。
在另一个实施例中,本文提供了引起受试者的对HER2/neu表达肿瘤的增强免疫应答的方法,其中并且在另一个实施例中,该方法包括将包含本文所述的重组李斯特菌疫苗株的组合物施用于受试者的步骤。在又一个实施例中,对HER2/neu表达肿瘤的免疫应答包括对HER2/neu蛋白的至少一个次优势表位的免疫应答。
在一个实施例中,本文提供了防止HER2/neu表达肿瘤治疗中的逃逸突变的方法,其中并且在另一个实施例中,该方法包括将包含本文提供的重组李斯特菌疫苗株的组合物施用于所述受试者的步骤。
在另一个实施例中,本文提供了防止受试者的HER2/neu抗原表达肿瘤发病的方法,其中并且在另一个实施例中,该方法包括将包含本文提供的重组李斯特菌疫苗株的组合物施用于受试者的步骤。
在一个实施例中,本文提供了降低肿瘤内调节性T细胞的频率的方法,其中并且在另一个实施例中,该方法包括将包含本文提供的重组李斯特菌疫苗株的组合物施用于受试者的步骤。
在另一个实施例中,本文提供了降低肿瘤内调节性T细胞的频率的方法,其中并且在另一个实施例中,该方法包括将包含本文提供的重组李斯特菌疫苗株的组合物施用于受试者的步骤。
在一个实施例中,本文提供了降低肿瘤内骨髓来源的抑制性细胞的频率的方法,其中并且在另一个实施例中,该方法包括将包含本文提供的重组李斯特菌疫苗株的组合物施用于受试者的步骤。
在另一个实施例中,本文提供了降低骨髓来源的抑制性细胞的频率的方法,其中并且在另一个实施例中,该方法包括将包含本文提供的重组李斯特菌疫苗株的组合物施用于受试者的步骤。
在一个实施例中,本文提供了防止受试者中形成HER2/neu表达肿瘤的方法,其中并且在另一个实施例中,该方法包括将包含本文提供的重组李斯特菌疫苗株的组合物施用于受试者的步骤。在另一个实施例中,本文提供了防止受试者中形成来源于HER2/neu表达肿瘤的转移性疾病的方法,其中并且在另一个实施例中,该方法包括将包含本文提供的重组李斯特菌疫苗株的组合物施用于受试者的步骤。在一个实施例中,本文提供了治疗受试者的HER2/neu表达肿瘤的方法,其中并且在另一个实施例中,该方法包括将包含本文提供的重组李斯特菌疫苗株的组合物施用于受试者的步骤。在另一个实施例中,本文提供了治疗受试者的来源于HER2/neu表达肿瘤的转移性疾病的方法,其中并且在另一个实施例中,该方法包括将包含本文提供的重组李斯特菌疫苗株的组合物施用于受试者的步骤。在一个实施例中,本文提供了施用本发明的组合物的方法。在另一个实施例中,本文提供了施用本发明的疫苗的方法。在另一个实施例中,本文提供了施用本发明的重组多肽或重组核苷酸的方法。在另一个实施例中,施用本发明的组合物、疫苗、重组多肽或重组核苷酸的步骤通过各自本身为分立的实施例的李斯特菌的减毒重组形式进行,该李斯特菌包括组合物、疫苗、重组核苷酸或表达重组多肽。在另一个实施例中,施用通过不同的减毒细菌载体进行。在另一个实施例中,施用通过DNA疫苗(如,裸DNA疫苗)进行。在另一个实施例中,本发明的重组多肽的施用通过重组生成蛋白,然后将重组蛋白施用于受试者来进行。每种可能性表示本发明的单独实施例。
在一个实施例中,本发明的组合物的重复施用(加强剂量)可在治疗的第一疗程后立即进行或在几天、几周或几个月的间隔后进行,以实现肿瘤消退。在另一个实施例中,重复剂量可在治疗的第一疗程后立即进行或在几天、几周或几个月的间隔后进行,以实现肿瘤生长的抑制。评估可通过本领域已知的任何技术确定,包括诊断方法诸如成像技术、血清肿瘤标志物分析、活组织检查、肿瘤相关症状的存在、不存在或改善。
在另一个实施例中,本发明的方法和组合物引起的免疫应答包括CD8+T细胞介导的应答。在另一个实施例中,免疫应答主要由CD8+T细胞介导的应答组成。在另一个实施例中,免疫应答的仅有可检测组成部分是CD8+T细胞介导的应答。
在另一个实施例中,本文提供的方法和组合物引起的免疫应答包括CD4+T细胞介导的应答。在另一个实施例中,免疫应答主要由CD4+T细胞介导的应答组成。在另一个实施例中,免疫应答的仅有可检测组成部分是CD4+T细胞介导的应答。在另一个实施例中,CD4+T细胞介导的应答伴有对抗原的可测定抗体应答。在另一个实施例中,CD4+T细胞介导的应答不伴有对抗原的可测定抗体应答。
在另一个实施例中,本发明提供诱导受试者的对抗原的次优势CD8+T细胞表位的CD8+T细胞介导的免疫应答的方法,该方法包括以下步骤:(a)使编码Her2-neu嵌合抗原或其片段的核苷酸分子融合至编码LLO蛋白的N-末端片段的核苷酸分子,从而形成编码LLO-抗原融合蛋白的重组核苷酸;以及(b)将重组核苷酸或LLO-抗原融合体施用于受试者;从而诱导对抗原的次优势CD8+T细胞表位的CD8+T细胞介导的免疫应答。
在一个实施例中,本文提供了提高肿瘤内CD8+/调节性T细胞比率的方法,其中并且在另一个实施例中,该方法包括将包含本发明的重组多肽、重组李斯特菌或重组载体的组合物施用于受试者的步骤。
在另一个实施例中,本文提供了提高肿瘤内CD8+/调节性T细胞比率的方法,其中并且在另一个实施例中,该方法包括将包含本发明的重组多肽、重组李斯特菌或重组载体的组合物施用于受试者的步骤。
在另一个实施例中,本文提供的方法和组合物引起的免疫应答包括对抗原的至少一个次优势表位的免疫应答。在另一个实施例中,免疫应答不包括对次优势表位的免疫应答。在另一个实施例中,免疫应答主要由对至少一个次优势表位的免疫应答组成。在另一个实施例中,免疫应答的仅有可测定组成部分是对至少一个次优势表位的免疫应答。每种类型的免疫应答表示本发明的单独实施例。
在一个实施例中,本发明的方法破坏了受试者对HER2/表达肿瘤或所述受试者的癌症的耐受性,其中并且在另一个实施例中,该方法包括将包含本文提供的重组李斯特菌疫苗株的组合物施用于受试者的步骤。
测定免疫应答的方法是本领域熟知的,并且包括如测定肿瘤生长的抑制、流式细胞术、靶细胞裂解分析(如,铬释放分析)、四聚物的使用等等。每种方法表示本发明的单独实施例。
在另一个实施例中,本发明提供延缓或抑制受试者的来源于Her-2表达肿瘤的转移性疾病的方法,其中并且在另一个实施例中,该方法包括将包含融合至HER2嵌合蛋白或其片段的LLO蛋白的N-末端片段的重组多肽或编码重组多肽的重组核苷酸施用于受试者,其中该受试者产生对HER2表达肿瘤的免疫应答,从而延缓或抑制受试者的来源于HER2表达肿瘤的转移性疾病。
在另一个实施例中,本发明提供改善HER2嵌合蛋白的抗原性的方法,其中并且在另一个实施例中,该方法包括使编码LLO蛋白的N-末端片段的核苷酸融合至编码Her-2蛋白或其片段的核苷酸,以形成重组多肽的步骤,从而改善HER2嵌合蛋白的抗原性。
在另一个实施例中,本文提供了改善HER2嵌合蛋白的抗原性的方法,其中并且在另一个实施例中,该方法包括将李斯特菌菌株工程化为表达重组核苷酸。在另一个实施例中,使用不同的细菌载体表达重组核苷酸。在另一个实施例中,细菌载体是减毒的。在另一个实施例中,使用DNA疫苗(如,裸DNA疫苗)表达重组核苷酸。在另一个实施例中,核苷酸编码的LLO-HER2嵌合体融合肽的施用通过重组生成蛋白,然后将重组蛋白施用于受试者来进行。每种可能性表示本发明的单独实施例。
在一个实施例中,本发明提供用于肿瘤的“表位扩展”的方法。在另一个实施例中,使用本文提供的组合物和方法的免疫诱导具有除本发明的疫苗携带的抗原之外的抗原的其他肿瘤上的表位扩展。
在另一个实施例中,优势表位或次优势表位在进行治疗的受试者中分别是优势的或次优势的。在另一个实施例中,优势表位或次优势表位在进行治疗的群体中是优势的或次优势的。
在一个实施例中,本文提供了通过表位扩展治疗、阻遏或抑制受试者的癌症或肿瘤生长的方法,其中并且在另一个实施例中,所述癌症与本发明的组合物中包含的抗原或其片段的表达相关。在另一个实施例中,方法包括将包含本发明的重组多肽、重组李斯特菌或重组载体的组合物施用于所述受试者。在又一个实施例中,受试者产生对抗原表达癌症或抗原表达肿瘤的免疫应答,从而治疗、阻遏或抑制受试者的癌症或肿瘤生长。
在一个实施例中,“优势CD8+T细胞表位”是指蛋白或包含蛋白的病原体或癌细胞的疫苗接种、感染或恶性生长引起的超过30%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指由此引起的超过35%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指超过40%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指超过45%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指超过50%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指超过55%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指超过60%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指超过65%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指超过70%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指超过75%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指超过80%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指超过85%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指超过90%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指超过95%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指超过96%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指超过97%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指超过98%的抗原特异性CD8+T细胞识别的表位。
在一个实施例中,“次优势CD8+T细胞表位”是指蛋白或包含蛋白的病原体或癌细胞的疫苗接种、感染或恶性生长引起的少于30%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指少于28%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指超过26%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指少于24%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指超过22%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指少于20%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指超过18%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指少于16%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指超过14%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指超过12%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指少于10%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指超过8%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指少于6%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指少于5%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指超过4%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指少于3%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指少于2%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指少于1%的抗原特异性CD8+T细胞识别的表位。在另一个实施例中,该术语是指少于0.5%的抗原特异性CD8+T细胞识别的表位。
每种类型的优势表位和次优势表位表示本发明的单独实施例。
在一个实施例中,本发明的方法和组合物中的抗原以可检测水平在受试者非肿瘤细胞上表达。在另一个实施例中,抗原以可检测水平在至少某一百分比(如,0.01%、0.03%、0.1%、0.3%、1%、2%、3%或5%)的受试者非肿瘤细胞上表达。在一个实施例中,“非肿瘤细胞”是指肿瘤体外的细胞。在另一个实施例中,“非肿瘤细胞”是指非恶性细胞。在另一个实施例中,“非肿瘤细胞”是指未转化的细胞。在另一个实施例中,非肿瘤细胞是体细胞。在另一个实施例中,非肿瘤细胞是生殖细胞。每种可能性表示本发明的单独实施例。
在一个实施例中,“可检测水平”是指可使用标准分析检测的水平。在一个实施例中,分析是免疫分析。在一个实施例中,分析是酶联免疫分析(ELISA)。在另一个实施例中,分析是Western印迹。在另一个实施例中,分析是FACS。技术人员将会知道,本文提供的方法可使用本领域可用的任何其他分析。在另一个实施例中,可检测水平相对于具体分析的背景水平确定。用于执行每种这些技术的方法是本领域技术人员熟知的,并且每种技术表示本发明的单独实施例。
在一个实施例中,使用重组抗原表达LM进行疫苗接种诱导了表位扩展。在另一个实施例中,即使在Her2的范围外,使用LLO-抗原融合体的疫苗接种也诱导了表位扩展。每种可能性表示本发明的单独实施例。
在另一个实施例中,本发明提供阻碍受试者中HER2表达肿瘤的生长的方法,该方法包括将包含融合至HER2嵌合抗原的LLO蛋白的N-末端片段的重组多肽施用于受试者,其中抗原具有一个或多个次优势CD8+T细胞表位,其中受试者产生对抗原表达肿瘤的免疫应答,从而阻碍受试者中HER2表达肿瘤的生长。在另一个实施例中,抗原不包含任何优势CD8+T细胞表位。在另一个实施例中,本文提供了阻碍受试者中HER2表达肿瘤生长的方法,该方法包括将包含编码本文提供的重组多肽的重组核苷酸的李斯特菌的重组形式施用于受试者。
在另一个实施例中,本发明提供诱导在患有癌症的宿主中形成细胞毒性T细胞的方法,该方法包括将本发明的组合物施用于宿主,从而诱导在患有癌症的宿主中形成细胞毒性T细胞。
在另一个实施例中,本发明提供减少癌症发生的方法,该方法包括施用本发明的组合物。在另一个实施例中,本发明提供改善癌症的方法,该方法包括施用本发明的组合物。每种可能性表示本发明的单独实施例。
在一个实施例中,将组合物离体施用于受试者的细胞;在另一个实施例中,将组合物离体施用于供体的细胞;在另一个实施例中,将组合物体内施用于供体的细胞,然后转移到受试者。每种可能性表示本发明的单独实施例。
在一个实施例中,本发明的方法治疗的癌症是乳腺癌。在另一个实施例中,癌症是含Her2癌症。在另一个实施例中,癌症是黑素瘤。在另一个实施例中,癌症是胰腺癌。在另一个实施例中,癌症是卵巢癌。在另一个实施例中,癌症是胃癌。在另一个实施例中,癌症是胰腺的癌性灶。在另一个实施例中,癌症是肺腺癌。在另一个实施例中,癌症是结肠直肠腺癌。在另一个实施例中,癌症是肺鳞状腺癌。在另一个实施例中,癌症是胃腺癌。在另一个实施例中,癌症是卵巢表面上皮瘤(如,它们的良性、增生性或恶性形式)。在另一个实施例中,癌症是口腔鳞状上皮细胞癌。在另一个实施例中,癌症是非小细胞肺癌。在另一个实施例中,癌症是CNS癌症。在另一个实施例中,癌症是子宫内膜癌。在另一个实施例中,癌症是膀胱癌。在另一个实施例中,癌症是间皮瘤。在另一个实施例中,癌症是恶性间皮瘤(MM)。在另一个实施例中,癌症是头颈癌。在另一个实施例中,癌症是前列腺癌。在另一个实施例中,癌症是骨肉瘤。在另一个实施例中,癌症是HER2/neu表达骨肉瘤。在另一个实施例中,骨肉瘤是犬科动物骨肉瘤。在另一个实施例中,骨肉瘤是局部骨肉瘤。在另一个实施例中,骨肉瘤是转移性骨肉瘤。在另一个实施例中,骨肉瘤是高度骨肉瘤。在另一个实施例中,骨肉瘤是犬科动物肢体骨肉瘤。
在本发明的方法的另一个实施例中,受试者产生对抗原表达肿瘤或靶抗原的免疫应答,从而介导抗肿瘤效应。
在另一个实施例中,本发明提供用于治疗癌症的免疫原性组合物,该组合物包含截短的LLO与HER2嵌合蛋白的融合体。在另一个实施例中,免疫原性组合物还包含表达该融合体的李斯特菌菌株。
在另一个实施例中,本发明提供用于治疗癌症的免疫原性组合物,该组合物包含表达HER2嵌合蛋白的李斯特菌菌株。
在一个实施例中,本发明的治疗方案是治疗性的。在另一个实施例中,方案是预防性的。在另一个实施例中,本发明的疫苗或组合物用于保护由于家族遗传或使其倾向于患有这些类型疾病的其他情况而存在癌症(诸如乳腺癌或其他类型的含HER2肿瘤)风险的人,如技术人员所理解。在另一个实施例中,疫苗在通过手术、常规化疗或放疗摧毁肿瘤生长后用作癌症免疫疗法。在此类治疗后,本发明的疫苗的施用使得对疫苗的肿瘤抗原的CTL应答破坏了其余的转移并且延长了癌症的缓解。在另一个实施例中,疫苗与手术、常规化疗或放疗联合用作癌症免疫疗法。在另一个实施例中,此类联合治疗用于不能经受截肢的受试者。在另一个实施例中,此类联合治疗用于患有原发性骨肉瘤的不能经受截肢的受试者。在另一个实施例中,本发明的疫苗用于影响此前建立的肿瘤的生长和杀死现有的肿瘤细胞。
在一个实施例中,“肿瘤抗原或其片段”、“肿瘤相关抗原或其片段”、“异源性抗原或其片段”或“抗原肽或其片段”在本文中可互换使用,并且包括本领域已知的任何抗原,包括肿瘤抗原、血管新生抗原或感染性疾病抗原。在另一个实施例中,抗原是自体抗原。
在一个实施例中,本文提供的抗原来源于肿瘤相关抗原,在一个实施例中,它是以下肿瘤抗原中的一者:生存素、MAGE(黑素瘤相关抗原E)蛋白如MAGE1、MAGE 2、MAGE 3、MAGE 4、酪氨酸酶;突变ras蛋白;突变p53蛋白;p97黑素瘤抗原、晚期癌症相关的ras肽或p53肽;子宫颈癌相关的HPV 16/18抗原、乳腺癌相关的KLH抗原、结肠直肠癌相关的CEA(癌胚抗原)、gp100、黑素瘤相关的MART1抗原或前列腺癌相关的PSA抗原。在另一个实施例中,用于本文提供的组合物和方法的抗原是黑素瘤相关抗原,在一个实施例中,它是TRP-2、MAGE-1、MAGE-3、gp-100、酪氨酸酶、HSP-70、β-HCG或它们的组合。本发明还设想了本领域已知的其他肿瘤相关抗原。
在另一个实施例中,抗原或其片段来源于选自HPV-E7(来自HPV16或HPV18菌株)、HPV-E6(来自HPV16或HPV18菌株)、Her-2/neu、NY-ESO-1、端粒酶(TERT)、SCCE、CEA、LMP-1、p53、碳酸酐酶IX(CAIX)、PSMA、前列腺干细胞抗原(PSCA)、HMW-MAA、WT-1、HIV-1Gag、蛋白酶3、酪氨酸酶相关蛋白2、PSA(前列腺特异性抗原)、EGFR-III、生存素、凋亡重复序列包含棒状病毒抑制因子5(BIRC5)、LMP-1、p53、PSMA、PSCA、Muc1、PSA(前列腺特异性抗原)或它们的组合的抗原。
在另一个实施例中,本发明的组合物和方法用于针对肿瘤或癌症的疫苗接种。
在一个实施例中,本发明的治疗方案是治疗性的。在另一个实施例中,方案是预防性的。在另一个实施例中,本发明的疫苗或组合物用于保护由于家族遗传或使其倾向于患有这些类型疾病的其他情况而存在癌症(诸如乳腺癌或其他类型的含HER2肿瘤)风险的人,如技术人员所理解。在另一个实施例中,疫苗在通过手术、常规化疗或放疗摧毁肿瘤生长后用作癌症免疫疗法。在此类治疗后,本发明的疫苗的施用使得对疫苗的肿瘤抗原的CTL应答破坏了其余的转移并且延长了癌症的缓解。在另一个实施例中,疫苗与手术或常规化疗联合用作癌症免疫疗法。在另一个实施例中,此类联合治疗用于不能经受截肢的受试者。在另一个实施例中,此类联合治疗用于患有原发性骨肉瘤的不能经受截肢的受试者。在另一个实施例中,本发明的疫苗用于影响此前建立的肿瘤的生长和杀死现有的肿瘤细胞。
在另一个实施例中,上述任何方法所用的疫苗和免疫原性组合物具有本发明的疫苗和免疫原性组合物的任何特性。每种特性表示本发明的单独实施例。
本发明设想了剂量范围的各种实施例。在一个实施例中,就疫苗载体而言,剂量在0.4LD50/剂的范围内。在另一个实施例中,剂量为约0.4-4.9LD50/剂。在另一个实施例中,剂量为约0.5-0.59LD50/剂。在另一个实施例中,剂量为约0.6-0.69LD50/剂。在另一个实施例中,剂量为约0.7-0.79LD50/剂。在另一个实施例中,剂量为约0.8LD50/剂。在另一个实施例中,剂量为0.4LD50/剂至0.8LD50/剂。
在另一个实施例中,剂量为107个细菌/剂。在另一个实施例中,剂量为1.5×107个细菌/剂。在另一个实施例中,剂量为2×107个细菌/剂。在另一个实施例中,剂量为3×107个细菌/剂。在另一个实施例中,剂量为4×107个细菌/剂。在另一个实施例中,剂量为6×107个细菌/剂。在另一个实施例中,剂量为8×107个细菌/剂。在另一个实施例中,剂量为1×108个细菌/剂。在另一个实施例中,剂量为1.5×108个细菌/剂。在另一个实施例中,剂量为2×108个细菌/剂。在另一个实施例中,剂量为3×108个细菌/剂。在另一个实施例中,剂量为4×108个细菌/剂。在另一个实施例中,剂量为6×108个细菌/剂。在另一个实施例中,剂量为8×108个细菌/剂。在另一个实施例中,剂量为1×109个细菌/剂。在另一个实施例中,剂量为1.5×109个细菌/剂。在另一个实施例中,剂量为2×109个细菌/剂。在另一个实施例中,剂量为3×109个细菌/剂。在另一个实施例中,剂量为5×109个细菌/剂。在另一个实施例中,剂量为6×109个细菌/剂。在另一个实施例中,剂量为8×109个细菌/剂。在另一个实施例中,剂量为1×1010个细菌/剂。在另一个实施例中,剂量为1.5×1010个细菌/剂。在另一个实施例中,剂量为2×1010个细菌/剂。在另一个实施例中,剂量为3×1010个细菌/剂。在另一个实施例中,剂量为5×1010个细菌/剂。在另一个实施例中,剂量为6×1010个细菌/剂。在另一个实施例中,剂量为8×1010个细菌/剂。在另一个实施例中,剂量为8×109个细菌/剂。在另一个实施例中,剂量为1×1011个细菌/剂。在另一个实施例中,剂量为1.5×1011个细菌/剂。在另一个实施例中,剂量为2×1011个细菌/剂。在另一个实施例中,剂量为3×1011个细菌/剂。在另一个实施例中,剂量为5×1011个细菌/剂。在另一个实施例中,剂量为6×1011个细菌/剂。在另一个实施例中,剂量为8×1011个细菌/剂。在另一个实施例中,剂量为5.0×108个细菌/剂。在另一个实施例中,剂量为3.3×109个细菌/剂。在另一个实施例中,用于本文提供的方法的组合物包含3.3×109个李斯特菌/剂。每种可能性表示本发明的单独实施例。
在一个实施例中,将本发明的疫苗或免疫原性组合物单独施用于受试者。在另一个实施例中,疫苗或免疫原性组合物与另一种癌症疗法一起施用。每种可能性表示本发明的单独实施例。
在一个实施例中,本发明的方法和组合物的重组李斯特菌与编码HER2嵌合抗原或LLO-HER2嵌合抗原融合体的构建体一起稳定转化。在一个实施例中,构建体包含多接头以有利于另外的亚克隆。制备重组李斯特菌的多种技术是已知的。
在一个实施例中,使用同源重组将构建体或核酸分子整合进李斯特菌染色体。同源重组技术是本领域熟知的,并且例如在Baloglu S,Boyle SM,et al.(Immune responses of mice to vaccinia virus recombinants expressing either Listeriamonocytogenes partial listeriolysin or Brucella abortus ribosomal L7/L12protein.Vet Microbiol 2005,109(1-2):11-7)和Jiang LL,Song HH,et al.,(Characterization of a mutant Listeriamonocytogenes strain expressing green fluorescent protein.Acta Biochim Biophys Sin(Shanghai)2005,37(1):19-24)中有所描述。在另一个实施例中,同源重组如美国专利No.6,855,320中所述进行。在这种情况下,表达E7的重组LM菌株通过E7基因(在hly启动子控制下,并且包括hly信号序列,以确保基因产物的分泌)的染色体整合来制备,从而得到称为Lm-AZ/E7的重组体。在另一个实施例中,使用温敏型质粒选择重组体。每种技术表示本发明的单独实施例。
在另一个实施例中,使用转座子插入将构建体或核酸分子整合进李斯特菌染色体。转座子插入技术是本领域熟知的,并且特别是由Sun et al.(Infection and Immunity 1990,58:3770-3778)在DP-L967的构建中进行了描述。在另一个实施例中,转座子诱变具有可形成稳定基因组插入突变体的优点,但也具有外源基因插入基因组的位置未知的缺点。
在另一个实施例中,使用噬菌体整合位点将构建体或核酸分子整合进李斯特菌染色体(Lauer P,Chow MY et al,Construction,characterization,and use of two Listeriamonocytogenes site-specific phage integration vectors.J Bacteriol 2002;184(15):4177-86)。在此方法的某些实施例中,使用噬菌体的整合酶基因和连接位点(如,U153或PSA李斯特菌噬菌体)将异源性基因插入对应的连接位点,该连接位点可以是基因组中的任何适当位点(如,comK或arg tRNA基因的3’末端)。在另一个实施例中,在构建体或异源性基因的整合之前从所用的连接位点治愈内源性原噬菌体。在另一个实施例中,此方法形成单拷贝整合子。每种可能性表示本发明的单独实施例。
在另一个实施例中,使用各种启动子中的一者表达抗原或包含该抗原的融合蛋白。在一个实施例中,使用Lm启动子,如基因hly、actA、plca、plcB和mpl的启动子,这些基因分别编码李斯特菌蛋白溶血素、actA、磷脂酰肌醇特异性磷脂酶、磷脂酶C和金属蛋白酶。每种可能性表示本发明的单独实施例。
在另一个实施例中,本发明的方法和组合物采用HER2嵌合蛋白的同源物或本发明的LLO序列。在另一个实施例中,本发明的方法和组合物采用非人类哺乳动物的HER2嵌合蛋白。在一个实施例中,当术语“同源性”、“同源的”等涉及任何蛋白或肽时,是指在对齐序列和引入空位(如有必要),以实现最大同源性百分比,并且不考虑作为序列同一性的一部分的任何保守置换之后,候选序列中与对应天然多肽的残基相同的氨基酸残基的百分比。用于比对的方法和计算机程序是本领域熟知的。
在另一个实施例中,类似地,当术语“同源性”涉及任何核酸序列时,表示候选序列中与对应天然核酸序列的核苷酸相同的核苷酸的百分比。
在另一个实施例中,本发明提供编码信号肽或本发明的重组多肽或融合蛋白的分离的核酸。在一个实施例中,分离的核酸包含与编码信号肽或本发明的重组多肽或融合蛋白的核酸共有至少65%同源性的序列。在另一个实施例中,分离的核酸包含与编码信号肽或本发明的重组多肽或融合蛋白的核酸共有至少75%同源性的序列。在另一个实施例中,分离的核酸包含与编码信号肽或本发明的重组多肽或融合蛋白的核酸共有至少85%同源性的序列。在另一个实施例中,分离的核酸包含与编码信号肽或本发明的重组多肽或融合蛋白的核酸共有至少90%同源性的序列。在另一个实施例中,分离的核酸包含与编码信号肽或本发明的重组多肽或融合蛋白的核酸共有至少95%同源性的序列。在另一个实施例中,分离的核酸包含与编码信号肽或本发明的重组多肽或融合蛋白的核酸共有至少97%同源性的序列。在另一个实施例中,分离的核酸包含与编码信号肽或本发明的重组多肽或融合蛋白的核酸共有至少99%同源性的序列。
在一个实施例中,同源性通过本领域详细描述的方法由序列比对的计算机算法确定。例如,核酸序列同源性的计算机算法分析可包括采用可得自诸如BLAST、DOMAIN、BEAUTY(BLAST Enhanced Alignment Utility)、GENPEPT和TREMBL软件包的多个软件包。
在另一个实施例中,“同源性”是指与选自本文提供的序列(核酸或氨基酸序列)的序列的同一性大于65%。在另一个实施例中,“同源性”是指与选自本文提供的序列的序列的同一性大于70%。在另一个实施例中,同一性大于75%。在另一个实施例中,同一性大于78%。在另一个实施例中,同一性大于80%。在另一个实施例中,同一性大于82%。在另一个实施例中,同一性大于83%。在另一个实施例中,同一性大于85%。在另一个实施例中,同一性大于87%。在另一个实施例中,同一性大于88%。在另一个实施例中,同一性大于90%。在另一个实施例中,同一性大于92%。在另一个实施例中,同一性大于93%。在另一个实施例中,同一性大于95%。在另一个实施例中,同一性大于96%。在另一个实施例中,同一性大于97%。在另一个实施例中,同一性大于98%。在另一个实施例中,同一性大于99%。在另一个实施例中,同一性为100%。每种可能性表示本发明的单独实施例。
在另一个实施例中,同源性通过候选序列杂交测定来确定,其方法是本领域熟知的(参见例如“Nucleic Acid Hybridization"Hames,B.D.,and Higgins S.J.,Eds.(1985);Sambrook et al.,2001,Molecular Cloning,ALaboratory Manual,Cold Spring Harbor Press,N.Y.;and Ausubel et al.,1989,Current Protocols in Molecular Biology,Green Publishing Associates and Wiley Interscience,N.Y)。例如,与编码天然半胱天冬酶肽的DNA的互补序列杂交的方法可在中度至严格条件下进行。杂交条件为例如在溶液中42℃下温育过夜,该溶液包含:10-20%甲酰胺、5×SSC(150mM NaCl、15mM柠檬酸三钠)、50mM磷酸钠(pH 7.6)、5×Denhardt溶液、10%硫酸葡聚糖和20μg/ml变性剪切鲑精DNA。
在本发明的一个实施例中,“核酸”是指一串至少两个碱基-糖-磷酸组合。在一个实施例中,该术语包括DNA和RNA。在一个实施例中,“核苷酸”是指核酸聚合物的单体单元。在一个实施例中,RNA可为tRNA(转运RNA)、snRNA(小核RNA)、rRNA(核糖体RNA)、mRNA(信使RNA)、反义RNA、小干扰RNA(siRNA)、微RNA(miRNA)和核糖酶的形式。siRNA和miRNA的使用已有所描述(Caudy AA et al,Genes&Devel 16:2491-96和其中引用的参考文献)。DNA可以是质粒DNA、病毒DNA、线性DNA或染色体DNA或这些分组的衍生物的形式。此外,这些形式的DNA和RNA可以是单链、双链、三链或四链的。在另一个实施例中,该术语还包括可包含其他类型的主链但具有相同碱基的人工核酸。在一个实施例中,人工核酸是PNA(肽核酸)。PNA包含肽主链和核苷酸碱基,并且在一个实施例中能够结合DNA和RNA两种分子。在另一个实施例中,核苷酸是氧杂环丁烷修饰的。在另一个实施例中,核苷酸通过用硫代磷酸键代替一个或多个磷酸二酯键来修饰。在另一个实施例中,人工核酸包含本领域已知的天然核酸的磷酸主链的任何其他变体。硫代磷酸核酸和PNA的使用是本领域的技术人员已知的,并且在例如Neilsen PE,Curr Opin Struct Biol 9:353-57和Raz NK et al Biochem Biophys Res Commun.297:1075-84中有所描述。核酸的制备和使用是本领域的技术人员已知的,并且在例如Molecular Cloning,(2001),Sambrook and Russell,eds.和Methods in Enzymology:Methods for molecular cloning in eukaryotic cells(2003)Purchio and G.C.Fareed中有所描述。每种核酸衍生物表示本发明的单独实施例。
在一个实施例中,通过本领域熟知的方法,包括免疫印迹分析,或采用任何多种可用的软件包通过氨基酸序列的计算机算法分析,通过已建立的方法确定本文列出的任何氨基酸序列的蛋白和/或肽同源性。这些软件包中的一些可包括FASTA、BLAST、MPsrch或Scanps软件包,并且可采用例如Smith和Waterman算法和/或分析的全局/局部或BLOCKS比对。每种确定同源性的方法表示本发明的单独实施例。
在另一个实施例中,本发明提供包括用于执行本发明的方法的试剂的试剂盒。在另一个实施例中,本发明提供包括本发明的组合物、工具或仪器的试剂盒。
在一个实施例中,术语“接触”或“施用”是指使本发明的组合物直接接触癌细胞或肿瘤。在另一个实施例中,该术语是指使本发明的组合物间接接触癌细胞或肿瘤。在另一个实施例中,本发明的方法包括其中受试者接触本发明的组合物,然后组合物通过扩散或本领域已知的任何其他主动运输或被动运输过程(化合物通过该过程在体内循环)接触癌细胞或肿瘤的方法。在另一个实施例中,本发明的方法可包括至少单次施用本发明的组合物,其中在另一个实施例中,本发明的方法可包括多次施用本发明的组合物。每种可能性表示本发明的单独实施例。
在另一个实施例中,术语“基因”和“重组基因”是指包含编码本发明的多肽的开放阅读框的核酸分子。此类天然等位基因变异通常可导致给定基因的核苷酸序列的1-5%变化。可通过多个不同个体或生物体中所关注的基因的测序鉴定替代等位基因。这易于通过使用杂交探针鉴定多个个体或生物体中相同的遗传基因座来进行。作为天然等位基因变异的结果并且不改变功能活性的任何和所有此类核苷酸变异和所得的氨基酸多态性或变异均旨在在本发明的范围之内。
药物组合物
在另一个实施例中,通过本领域的技术人员已知的任何方法,诸如肠胃外、癌旁侧、经粘膜、鼻内、肌内、静脉内、皮内、皮下、腹腔内、心室内、颅内、阴道内或肿瘤内将包含本发明的疫苗和组合物的药物组合物施用于受试者。
在本文提供的方法和组合物的另一个实施例中,疫苗或组合物口服施用,因此配制为适用于口服施用的形式,即固体或液体制剂。合适的固体口服制剂包括片剂、胶囊剂、丸剂、颗粒剂、小丸剂等等。合适的液体口服制剂包括溶液、悬浮液、分散体、乳剂、油剂等等。在本发明的另一个实施例中,活性成分配制为胶囊剂。根据该实施例,除活性化合物和惰性载体或稀释剂之外,本发明的组合物还包括硬明胶胶囊。
在另一个实施例中,疫苗或组合物通过液体制剂的静脉内、动脉内或肌肉内注射施用。合适的液体制剂包括溶液、悬浮液、分散体、乳剂、油剂等等。在一个实施例中,药物组合物静脉内施用,因此配制为适用于静脉内施用的形式。在另一个实施例中,药物组合物动脉内施用,因此配制为适用于动脉内施用的形式。在另一个实施例中,药物组合物肌肉内施用,因此配制为适用于肌肉内施用的形式。
在一个实施例中,术语“治疗”是指治愈疾病。在另一个实施例中,“治疗”是指防止疾病。在另一个实施例中,“治疗”是指减少疾病的发生。在另一个实施例中,“治疗”是指改善疾病的症状。在另一个实施例中,“治疗”是指提高患者的无进展存活期或总体存活期。在另一个实施例中,“治疗”是指稳定疾病的进展。在另一个实施例中,“治疗”是指诱导缓解。在另一个实施例中,“治疗”是指减缓疾病的进展。在另一个实施例中,术语“减少”、“阻遏”和“抑制”是指减轻或降低。每种可能性表示本发明的单独实施例。
如本文所用,术语“约”是数量术语,意指加或减5%,或在另一个实施例中,加或减10%,或在另一个实施例中,加或减15%,或在另一个实施例中,加或减20%。
技术人员理解,术语“受试者”可涵盖哺乳动物,包括需要治疗病症或其后遗症或易受其影响的人类成人或儿童、少年或青少年,并且还可包括非人类哺乳动物,诸如狗、猫、猪、乳牛、绵羊、山羊、马、大鼠和小鼠。还将认识到,该术语可涵盖牲畜。无论如何,术语“受试者”都不排除正常个体。
在一个实施例中,术语“受试者”还涵盖宠物狗和猫,包括不能经受截肢的狗和猫。在另一个实施例中,术语“受试者”还涵盖不能经受手术的人。在另一个实施例中,术语“受试者”还涵盖不能经受截肢的人。在另一个实施例中,术语“受试者”还涵盖人类儿童。
技术人员将会知道,出于治疗目的,术语“哺乳动物”是指被归为哺乳动物的任何动物,包括但不限于人、家畜和农畜以及动物园、比赛动物或宠物,诸如包括狗的犬科动物和马、猫、黄牛、猪、绵羊等。
涉及肿瘤治疗的“治疗有效量”是指能够产生一种或多种以下效应的量:(1)在一定程度上抑制肿瘤生长,包括减缓和完全生长停滞;(2)减少肿瘤细胞的数量;(3)减小肿瘤的大小;(4)抑制(即,减少、缓解或完全阻止)肿瘤细胞浸润外周器官;(5)抑制(即,减少、缓解或完全阻止)转移;(6)增强抗肿瘤免疫应答,这可以(但不一定)导致肿瘤消退或排斥;和/或(7)在一定程度上减轻与失调相关的一个或多个症状。出于肿瘤治疗的目的,本文提供的疫苗的“治疗有效量”可凭经验以及以惯例方式确定。
提供以下实例以更完整地示出本发明的优选实施例。然而,它们无论如何都不应被解释为限制本发明的广泛范围。
实例
材料和方法
寡核苷酸由Invitrogen(Carlsbad,CA)合成,DNA测序由Genewiz Inc,South Plainfield,NJ进行。流式细胞术试剂购自Becton Dickinson Biosciences(BD,San Diego,CA)。除非另外指明,否则细胞培养基、补充剂和所有其他试剂均购自Sigma(St.Louise,MO)。HER2/neu HLA-A2肽由EZbiolabs(Westfield,IN)合成。完全RPMI 1640(C-RPMI)培养基包含2mM谷氨酰胺、0.1mM非必需氨基酸和1mM丙酮酸钠、10%胎牛血清、青霉素/链霉素、Hepes(25mM)。多克隆抗LLO抗体如上文所述,并且抗HER2/neu抗体购自Sigma。
小鼠和细胞系
所有动物实验均根据University of Pennsylvania或Rutgers University的IACUC批准的方案进行。FVB/N小鼠购自Jackson laboratories(Bar Harbor,ME)。过表达大鼠HER2/neu癌蛋白的FVB/N HER2/neu转基因小鼠关在University of Pennsylvania的动物饲养中心(animal core facility)并繁殖。表达高水平的大鼠HER2/neu蛋白的NT-2肿瘤细胞系来源于这些小鼠的自发性乳腺肿瘤,并且如上文所述生长。DHFR-G8(3T3/neu)细胞得自ATCC并且根据ATCC推荐方案生长。EMT6-Luc细胞系由John Ohlfest博士(University of Minnesota,MN)慷慨赠送,并在完全C-RPMI培养基中生长。生物荧光工作在University of Pennsylvania(Philadelphia,PA)的Small Animal Imaging Facility(SAIF)的指导下进行。
李斯特菌构建体和抗原表达
HER2/neu-pGEM7Z由University of Pennsylvania的Mark Greene博士友情提供,并且包含克隆至pGEM7Z质粒(Promega,Madison WI)的全长人HER2/neu(hHer2)基因。该质粒用作扩增三个hHER2/neu片段的模板,即EC1、EC2和IC1,该扩增使用pfx DNA聚合酶(Invitrogen)和表1示出的寡核苷酸通过PCR进行。
表1:人HER2-嵌合体的克隆引物
HER2/neu嵌合构建体通过SOEing PCR法直接融合生成,每个单独的hHER2/neu片段作为模板。引物在表2中示出。
用于扩增不同片段人Her2区域的引物序列
使用XhoI和SpeI限制性酶从pAdv138切下ChHer2基因,并与Lmdd穿梭载体pAdv134中截短的LLO非溶血片段在同一阅读框内克隆。插入序列LLO和hly启动子通过DNA测序分析确认。将该质粒电穿孔转化至电感受态actA、dal、dat突变单核细胞增多性李斯特菌菌株,在包含链霉素(250μg/ml)的脑心浸液(BHI)琼脂平板上选择LmddA和阳性克隆。在一些实验中,表达hHER2/neu(Lm-hHER2)片段的类似李斯特菌菌株用于比较目的。这些内容在上文有所描述。在所有研究中,包括不相关李斯特菌构建体(Lm-对照),以考虑到李斯特菌对免疫系统的抗原非依赖性效应。Lm-对照基于与ADXS31-164相同的李斯特菌平台,但表达不同的抗原,诸如HPV16-E7或NY-ESO-1。测试李斯特菌的融合蛋白的表达和分泌。每个构建体体内传代两次。
细胞毒性分析
以3-5只FVB/N小鼠为一组,使用1×108个集落形成单位(CFU)的Lm-LLO-ChHer2、ADXS31-164、Lm-hHer2ICI或Lm-对照(表达不相关抗原)以一周为间隔免疫三次或保持未暴露的。使NT-2细胞体外生长,通过胰蛋白酶脱壁,并用丝裂霉素C(250μg/ml,溶于无血清C-RPMI培养基)在37°℃下处理45分钟。在洗涤5次后,将其与从免疫或未暴露的动物收集的脾细胞以1:5(刺激因子:应答者)的比率在37°℃和5%CO2下共温育5天。标准细胞毒性分析使用铕标记的3T3/neu(DHFR-G8)细胞作为靶标根据前述方法进行。在4小时温育后使用分光光度计(Perkin Elmer,Victor2)在590nm下测定从杀死的靶细胞释放的铕。特异性裂解的百分比定义为(实验组的裂解-自发性裂解)/(最大裂解-自发性裂解)。
免疫小鼠的脾细胞分泌的干扰素-γ
以3-5只FVB/N或HLA-A2转基因小鼠为一组,使用1×108个CFU的阴性李斯特菌对照ADXS31-164(表达不相关抗原)以一周为间隔免疫三次或保持未暴露的。在最后免疫后一周分离FVB/N小鼠的脾细胞,并以5×106个细胞/孔在24孔板中的C-RPMI培养基中在存在丝裂霉素C处理的NT-2细胞的情况下共培养。HLA-A2转基因小鼠的脾细胞在存在1μM HLA-A2特异性肽或1μg/ml重组His标记ChHer2蛋白(在大肠杆菌中制备,通过基于镍的亲和色谱系统纯化)的情况下温育。在24或72小时后从上清液获得样品,使用小鼠IFN-γ酶联免疫吸附分析(ELISA)试剂盒根据制造商的推荐方案测试干扰素-γ(IFN-γ)的存在。
INF-γELISpot分析
在每个指定的时间点解冻冷藏的PBMC,在37℃下放置过夜,然后计数。细胞用2.5μM重叠人HER2/Neu肽库(11个单位重叠5个氨基酸)(表示嵌合疫苗中存在的HER2/Neu的EC1、EC2和IC1域)和重组人IL-2(Invitrogen,Fredrick,MD)刺激5天。收集细胞,在1×PBS中洗涤两次并计数。IFN-γELISpot分析使用商业化犬科动物IFN-γELISpot分析试剂盒(R&D Systems,Minneapolis,MN)根据制造商的方案进行。简而言之,将0.8-2×105个经刺激的细胞与2.5μM EC1、EC2或IC1肽库加上IL-2或单独的IL-2(以测定背景计数)一起温育。所有分析一式两份地进行。根据制造商的说明对平板显色。使用CTL-Immunospot分析仪(C.T.L,Shaker Heights,OH)对斑点进行计数。斑点的数量通过减去未刺激孔中的斑点数量的两倍进行归一化。
Her2转基因动物中的肿瘤研究
六周龄FVB/N大鼠HER2/neu转基因小鼠(9-14只/组)使用5×108个CFU的Lm-LLO-ChHer2、ADXS31-164或Lm-对照免疫6次。每周观察自发性乳腺肿瘤的出现两次,使用电子卡尺测量肿瘤,最多52周。当平均直径大小达到1cm2时切下逃逸的肿瘤,在-20℃下保存于RNAlater中°。为确定HER2/neu蛋白中的突变对这些肿瘤逃逸的影响,使用基因组DNA分离试剂盒提取基因组DNA,并测序。
ADXS31-164对脾脏和肿瘤中调节性T细胞的作用
给小鼠皮下(s.c.)植入1×106个NT-2细胞。在第7、14和21天,使用1×108个CFU的ADXS31-164、LmddA-对照对它们进行免疫或保持未暴露的。在第28天提取肿瘤和脾脏并通过FACS分析测试CD3+/CD4+/FoxP3+Treg的存在。简而言之,通过在C-RPMI培养基中匀化两个载玻片之间的脾脏而分离脾细胞。使用无菌刀片切碎肿瘤,并用包含DNA酶(12U/ml)和溶于PBS的胶原酶(2mg/ml)的缓冲液消化。在室温下搅拌温育60min后,通过猛烈吹打而分离细胞。用RBC裂解缓冲液裂解红细胞,然后用包含10%FBS的完全RPMI-1640培养基洗涤多次。在通过尼龙网过滤后,将肿瘤细胞和脾细胞重悬于FACS缓冲液(2%FBS/PBS)中,用抗CD3-PerCP-Cy5.5、CD4-FITC、CD25-APC抗体染色,然后进行透化和抗Foxp3-PE染色。使用4色FACS calibur(BD)进行流式细胞分析,使用cell quest软件(BD)分析数据。
统计学分析
将对数秩卡方检验用于存活期数据,并将学生t-检验用于CTL和ELISA分析,所述分析一式三份地进行。在这些分析中,小于0.05的p-值(以*标记)被视为具有统计学上的显著性。所有统计学分析均使用Prism软件V.4.0a(2006)或SPSS软件V.15.0(2006)进行。对于所有FVB/N大鼠HER2/neu转基因研究,我们使用了8-14只小鼠/组,对于所有野生型FVB/N研究,我们使用了至少8只小鼠/组,除非另外指明。除HER2/neu转基因小鼠模型中的长期肿瘤研究外,所有研究重复至少一次。
实例1
产生分泌融合至Her-2片段的LLO片段的单核细胞增多性李斯特菌菌株:ADXS31-164的构建。
嵌合HER2/neu基因(ChHer2)的构建如上文所述。简而言之,ChHer2基因通过SOEing PCR法直接融合HER2/neu蛋白的两个胞外片段(aa 40-170和aa359-433)和一个胞内片段(aa 678-808)来制备。嵌合蛋白具有蛋白的大部分已知的人MHC I类表位。从质粒pAdv138(其用于构建Lm-LLO-ChHer2)切下ChHer2基因并克隆至LmddA穿梭质粒中,得到质粒pAdv164(图1A)。这两个质粒骨架之间有两个主要差异。1)pAdv138使用氯霉素抗性标记(cat)进行重组细菌的体外选择,而pAdv164具有枯草芽孢杆菌的D-丙氨酸消旋酶基因(dal),它使用缺乏dal-dat基因的LmddA菌株中的体外选择和体内质粒保持的代谢互补途径。此疫苗平台被设计和开发成解决FDA对工程化李斯特菌疫苗株的抗生素抗性的关注。2)与pAdv138不同,pAdv164不具有质粒中的prfA基因拷贝(参见以下序列和图1A),因为这不是Lmdd菌株的体内互补必需的。LmddA疫苗株还缺乏actA基因(负责李斯特菌的胞内移动和细胞间播散),因此来源于此骨架的重组疫苗株的毒性比来源于其亲代菌株Lmdd的那些小100倍。基于LmddA的疫苗从免疫小鼠脾脏的清除也比基于Lmdd的疫苗快(在不到48小时内)。来自此菌株的融合蛋白tLLO-ChHer2的表达和分泌与在体外生长8小时后TCA沉淀细胞培养上清液中的Lm-LLO-ChHer2相当(图1B),因为使用Western印迹分析通过抗LLO抗体检测到~104KD的条带。仅表达tLLO的李斯特菌骨架菌株用作阴性对照。
pAdv164序列(7075个碱基对)(参见图1):
cggagtgtatactggcttactatgttggcactgatgagggtgtcagtgaagtgcttcatgtggcaggagaaaaaaggctgcaccggtgcgtcagcagaatatgtgatacaggatatattccgcttcctcgctcactgactcgctacgctcggtcgttcgactgcggcgagcggaaatggcttacgaacggggcggagatttcctggaagatgccaggaagatacttaacagggaagtgagagggccgcggcaaagccgtttttccataggctccgcccccctgacaagcatcacgaaatctgacgctcaaatcagtggtggcgaaacccgacaggactataaagataccaggcgtttccccctggcggctccctcgtgcgctctcctgttcctgcctttcggtttaccggtgtcattccgctgttatggccgcgtttgtctcattccacgcctgacactcagttccgggtaggcagttcgctccaagctggactgtatgcacgaaccccccgttcagtccgaccgctgcgccttatccggtaactatcgtcttgagtccaacccggaaagacatgcaaaagcaccactggcagcagccactggtaattgatttagaggagttagtcttgaagtcatgcgccggttaaggctaaactgaaaggacaagttttggtgactgcgctcctccaagccagttacctcggttcaaagagttggtagctcagagaaccttcgaaaaaccgccctgcaaggcggttttttcgttttcagagcaagagattacgcgcagaccaaaacgatctcaagaagatcatcttattaatcagataaaatatttctagccctcctttgattagtatattcctatcttaaagttacttttatgtggaggcattaacatttgttaatgacgtcaaaaggatagcaagactagaataaagctataaagcaagcatataatattgcgtttcatctttagaagcgaatttcgccaatattataattatcaaaagagaggggtggcaaacggtatttggcattattaggttaaaaaatgtagaaggagagtgaaacccatgaaaaaaataatgctagtttttattacacttatattagttagtctaccaattgcgcaacaaactgaagcaaaggatgcatctgcattcaataaagaaaattcaatttcatccatggcaccaccagcatctccgcctgcaagtcctaagacgccaatcgaaaagaaacacgcggatgaaatcgataagtatatacaaggattggattacaataaaaacaatgtattagtataccacggagatgcagtgacaaatgtgccgccaagaaaaggttacaaagatggaaatgaatatattgttgtggagaaaaagaagaaatccatcaatcaaaataatgcagacattcaagttgtgaatgcaatttcgagcctaacctatccaggtgctctcgtaaaagcgaattcggaattagtagaaaatcaaccagatgttctccctgtaaaacgtgattcattaacactcagcattgatttgccaggtatgactaatcaagacaataaaatagttgtaaaaaatgccactaaatcaaacgttaacaacgcagtaaatacattagtggaaagatggaatgaaaaatatgctcaagcttatccaaatgtaagtgcaaaaattgattatgatgacgaaatggcttacagtgaatcacaattaattgcgaaatttggtacagcatttaaagctgtaaataatagcttgaatgtaaacttcggcgcaatcagtgaagggaaaatgcaagaagaagtcattagttttaaacaaatttactataacgtgaatgttaatgaacctacaagaccttccagatttttcggcaaagctgttactaaagagcagttgcaagcgcttggagtgaatgcagaaaatcctcctgcatatatctcaagtgtggcgtatggccgtcaagtttatttgaaattatcaactaattcccatagtactaaagtaaaagctgcttttgatgctgccgtaagcggaaaatctgtctcaggtgatgtagaactaacaaatatcatcaaaaattcttccttcaaagccgtaatttacggaggttccgcaaaagatgaagttcaaatcatcgacggcaacctcggagacttacgcgatattttgaaaaaaggcgctacttttaatcgagaaacaccaggagttcccattgcttatacaacaaacttcctaaaagacaatgaattagctgttattaaaaacaactcagaatatattgaaacaacttcaaaagcttatacagatggaaaaattaacatcgatcactctggaggatacgttgctcaattcaacatttcttgggatgaagtaaattatgatctcgagacccacctggacatgctccgccacctctaccagggctgccaggtggtgcagggaaacctggaactcacctacctgcccaccaatgccagcctgtccttcctgcaggatatccaggaggtgcagggctacgtgctcatcgctcacaaccaagtgaggcaggtcccactgcagaggctgcggattgtgcgaggcacccagctctttgaggacaactatgccctggccgtgctagacaatggagacccgctgaacaataccacccctgtcacaggggcctccccaggaggcctgcgggagctgcagcttcgaagcctcacagagatcttgaaaggaggggtcttgatccagcggaacccccagctctgctaccaggacacgattttgtggaagaatatccaggagtttgctggctgcaagaagatctttgggagcctggcatttctgccggagagctttgatggggacccagcctccaacactgccccgctccagccagagcagctccaagtgtttgagactctggaagagatcacaggttacctatacatctcagcatggccggacagcctgcctgacctcagcgtcttccagaacctgcaagtaatccggggacgaattctgcacaatggcgcctactcgctgaccctgcaagggctgggcatcagctggctggggctgcgctcactgagggaactgggcagtggactggccctcatccaccataacacccacctctgcttcgtgcacacggtgccctgggaccagctctttcggaacccgcaccaagctctgctccacactgccaaccggccagaggacgagtgtgtgggcgagggcctggcctgccaccagctgtgcgcccgagggcagcagaagatccggaagtacacgatgcggagactgctgcaggaaacggagctggtggagccgctgacacctagcggagcgatgcccaaccaggcgcagatgcggatcctgaaagagacggagctgaggaaggtgaaggtgcttggatctggcgcttttggcacagtctacaagggcatctggatccctgatggggagaatgtgaaaattccagtggccatcaaagtgttgagggaaaacacatcccccaaagccaacaaagaaatcttagacgaagcatacgtgatggctggtgtgggctccccatatgtctcccgccttctgggcatctgcctgacatccacggtgcagctggtgacacagcttatgccctatggctgcctcttagactaatctagacccgggccactaactcaacgctagtagtggatttaatcccaaatgagccaacagaaccagaaccagaaacagaacaagtaacattggagttagaaatggaagaagaaaaaagcaatgatttcgtgtgaataatgcacgaaatcattgcttatttttttaaaaagcgatatactagatataacgaaacaacgaactgaataaagaatacaaaaaaagagccacgaccagttaaagcctgagaaactttaactgcgagccttaattgattaccaccaatcaattaaagaagtcgagacccaaaatttggtaaagtatttaattactttattaatcagatacttaaatatctgtaaacccattatatcgggtttttgaggggatttcaagtctttaagaagataccaggcaatcaattaagaaaaacttagttgattgccttttttgttgtgattcaactttgatcgtagcttctaactaattaattttcgtaagaaaggagaacagctgaatgaatatcccttttgttgtagaaactgtgcttcatgacggcttgttaaagtacaaatttaaaaatagtaaaattcgctcaatcactaccaagccaggtaaaagtaaaggggctatttttgcgtatcgctcaaaaaaaagcatgattggcggacgtggcgttgttctgacttccgaagaagcgattcacgaaaatcaagatacatttacgcattggacaccaaacgtttatcgttatggtacgtatgcagacgaaaaccgttcatacactaaaggacattctgaaaacaatttaagacaaatcaataccttctttattgattttgatattcacacggaaaaagaaactatttcagcaagcgatattttaacaacagctattgatttaggttttatgcctacgttaattatcaaatctgataaaggttatcaagcatattttgttttagaaacgccagtctatgtgacttcaaaatcagaatttaaatctgtcaaagcagccaaaataatctcgcaaaatatccgagaatattttggaaagtctttgccagttgatctaacgtgcaatcattttgggattgctcgtataccaagaacggacaatgtagaattttttgatcccaattaccgttattctttcaaagaatggcaagattggtctttcaaacaaacagataataagggctttactcgttcaagtctaacggttttaagcggtacagaaggcaaaaaacaagtagatgaaccctggtttaatctcttattgcacgaaacgaaattttcaggagaaaagggtttagtagggcgcaatagcgttatgtttaccctctctttagcctactttagttcaggctattcaatcgaaacgtgcgaatataatatgtttgagtttaataatcgattagatcaacccttagaagaaaaagaagtaatcaaaattgttagaagtgcctattcagaaaactatcaaggggctaatagggaatacattaccattctttgcaaagcttgggtatcaagtgatttaaccagtaaagatttatttgtccgtcaagggtggtttaaattcaagaaaaaaagaagcgaacgtcaacgtgttcatttgtcagaatggaaagaagatttaatggcttatattagcgaaaaaagcgatgtatacaagccttatttagcgacgaccaaaaaagagattagagaagtgctaggcattcctgaacggacattagataaattgctgaaggtactgaaggcgaatcaggaaattttctttaagattaaaccaggaagaaatggtggcattcaacttgctagtgttaaatcattgttgctatcgatcattaaattaaaaaaagaagaacgagaaagctatataaaggcgctgacagcttcgtttaatttagaacgtacatttattcaagaaactctaaacaaattggcagaacgccccaaaacggacccacaactcgatttgtttagctacgatacaggctgaaaataaaacccgcactatgccattacatttatatctatgatacgtgtttgtttttctttgctggctagcttaattgcttatatttacctgcaataaaggatttcttacttccattatactcccattttccaaaaacatacggggaacacgggaacttattgtacaggccacctcatagttaatggtttcgagccttcctgcaatctcatccatggaaatatattcatccccctgccggcctattaatgtgacttttgtgcccggcggatattcctgatccagctccaccataaattggtccatgcaaattcggccggcaattttcaggcgttttcccttcacaaggatgtcggtccctttcaattttcggagccagccgtccgcatagcctacaggcaccgtcccgatccatgtgtctttttccgctgtgtactcggctccgtagctgacgctctcgccttttctgatcagtttgacatgtgacagtgtcgaatgcagggtaaatgccggacgcagctgaaacggtatctcgtccgacatgtcagcagacgggcgaaggccatacatgccgatgccgaatctgactgcattaaaaaagccttttttcagccggagtccagcggcgctgttcgcgcagtggaccattagattctttaacggcagcggagcaatcagctctttaaagcgctcaaactgcattaagaaatagcctctttctttttcatccgctgtcgcaaaatgggtaaatacccctttgcactttaaacgagggttgcggtcaagaattgccatcacgttctgaacttcttcctctgtttttacaccaagtctgttcatccccgtatcgaccttcagatgaaaatgaagagaaccttttttcgtgtggcgggctgcctcctgaagccattcaacagaataacctgttaaggtcacgtcatactcagcagcgattgccacatactccgggggaaccgcgccaagcaccaatataggcgccttcaatccctttttgcgcagtgaaatcgcttcatccaaaatggccacggccaagcatgaagcacctgcgtcaagagcagcctttgctgtttctgcatcaccatgcccgtaggcgtttgctttcacaactgccatcaagtggacatgttcaccgatatgttttttcatattgctgacattttcctttatcgcggacaagtcaatttccgcccacgtatctctgtaaaaaggttttgtgctcatggaaaactcctctcttttttcagaaaatcccagtacgtaattaagtatttgagaattaattttatattgattaatactaagtttacccagttttcacctaaaaaacaaatgatgagataatagctccaaaggctaaagaggactataccaactatttgttaattaa(SED ID NO:53)
实例2:ADXS31-164的免疫原性与LM-LLO-ChHER2一样。
在标准CTL分析中将ADXS31-164产生抗HER2/neu特异性细胞毒性T细胞的免疫原性与Lm-LLO-ChHer2疫苗进行比较。两种疫苗均引起对3T3/neu靶细胞表达的HER2/neu抗原的强烈但类似的细胞毒性T细胞应答。因此,使用仅表达融合至LLO的Her2胞内片段的李斯特菌免疫的小鼠显示出比包含多个MHC I类表位的嵌合体更低的裂解活性。在未暴露的动物或不相关李斯特菌疫苗注射的小鼠中未检测到CTL活性(图2A)。ADXS31-164也能够刺激野生型FVB/N小鼠的脾细胞分泌IFN-γ(图2B)。这在与丝裂霉素C处理的NT-2细胞(表达高水平的HER2/neu抗原)共培养的这些细胞的培养上清液中检测到(图5C)。
在HLA-A2小鼠中测试了ADXS31-164免疫后人MHC I类表位的适当处理和呈递。经免疫的HLA-A2转基因动物的脾细胞与位于HER2/neu分子的胞外(HLYQGCQVV SEQ ID NO:11或KIFGSLAFL SEQ ID NO:12)或胞内(RLLQETELV SEQ ID NO:13)域的标绘的HLA-A2限制表位对应的肽共温育72小时(图2C)。重组ChHer2蛋白用作阳性对照,不相关肽或无肽作为阴性对照。该实验的数据显示,ADXS31-164能够引起对位于靶抗原的不同域的人表位的抗HER2/neu特异性免疫应答。
实例3:ADXS31-164抑制自发性乳腺肿瘤的发病比LM-LLO-ChHER2更有效。
将ADXS31-164的抗肿瘤效应与HER2/neu转基因动物中的Lm-LLO-ChHer2比较,该HER2/neu转基因动物在20-25周龄患上缓慢生长的自发性乳腺肿瘤。所有使用不相关李斯特菌对照疫苗免疫的动物在21-25周内患上乳腺肿瘤并且在第33周前处死。相比之下,李斯特菌-HER2/neu重组疫苗使乳腺肿瘤的形成显著延缓。在第45周,超过50%的ADXS31-164疫苗接种的小鼠(9只中的5只)仍无肿瘤,相比之下,使用Lm-LLO-ChHer2免疫的小鼠只有25%。在第52周,使用ADXS31-164免疫的8只小鼠中的2只仍无肿瘤,而其他实验组的所有小鼠已死于疾病(图3)。这些结果表明,尽管是减毒程度更高的,但ADXS31-164防止HER2/neu转基因动物的自发性乳腺肿瘤的发病比Lm-LLO-ChHer2更有效。
实例4:ADXS31-164免疫时HER2/NEU基因的突变。
HER2/neu的MHC I类表位的突变已被视为在小片段疫苗或曲妥单抗(Herceptin)(一种靶向HER2/neu的胞外域中的表位的单克隆抗体)免疫时负责肿瘤逃逸。为评估该作用,从转基因动物中的逃逸肿瘤提取基因组物质,并对嵌合或对照疫苗免疫的肿瘤中neu基因的对应片段进行测序。任何疫苗接种的肿瘤样品的HER2/neu基因内均未观察到突变,暗示存在替代逃逸机制(数据未示出)。
实例5:ADXS31-164使肿瘤内调节性T细胞显著减少。
为阐明ADXS31-164对脾脏和肿瘤中调节性T细胞频率的影响,将NT-2肿瘤细胞植入小鼠。在三次免疫后分离脾细胞和肿瘤内淋巴细胞并对Treg染色,Treg定义为CD3+/CD4+/CD25+/FoxP3+细胞,但是当单独分析时,FoxP3或CD25标记获得了类似的结果。结果表明,与不相关李斯特菌疫苗或未暴露的动物相比,ADXS31-164免疫对脾脏中Treg的频率无影响(参见图4)。相比之下,李斯特菌疫苗免疫对肿瘤中Treg的存在产生很大的影响(图5A)。而未治疗的肿瘤中平均而言所有CD3+T细胞的19.0%为Treg,对于不相关疫苗该频率降低至4.2%,对于ADXS31-164降低至3.4%,肿瘤内Treg的频率降低5倍(图5B)。任一LmddA疫苗治疗的小鼠中肿瘤内Treg的频率降低不能归因于肿瘤大小的差异。在代表性实验中,ADXS31-164免疫的小鼠的肿瘤显著小于[平均直径(mm)±SD,6.71±0.43,n=5]未治疗的小鼠(8.69±0.98,n=5,p<0.01)或不相关疫苗治疗的小鼠(8.41±1.47,n=5,p=0.04)的肿瘤,而最后两组的比较未显示出肿瘤大小的统计学上的显著差异(p=0.73)。LmddA疫苗处理的肿瘤中Treg频率的下降使肿瘤内CD8/Treg比率升高,暗示在LmddA疫苗免疫后可获得更有利的肿瘤微环境。然而,只有表达靶抗原HER2/neu的疫苗(ADXS31-164)能够减缓肿瘤生长,表明Treg的减少仅在肿瘤中存在抗原特异性应答的情况下具有作用。
实例6:表达HER-2嵌合体的李斯特菌疫苗未引入逃逸突变
收集不同疫苗诸如Lm-LLO-138、LmddA164和不相关疫苗Lm-LLO-NY免疫的小鼠的肿瘤样品。从这些样品纯化DNA,扩增HER2/neu区域IC1、EC1和EC2对应的DNA片段,并测序以确定是否存在任何免疫逃逸突变。使用CLUSTALW进行每个DNA的序列比对。分析结果表明,从肿瘤收集的DNA序列中无突变。这些序列的详细分析如下所示。
EC2的比对(HER2/neu的975-1029bp)
参考
GGTCACAGCTGAGGACGGAACACAGCGTTGTGAGAAATGCAGCAAGCCCTGTGCT(SEQ ID NO:14)
Lm-LLO-138-2
GGTCACAGCTGAGGACGGAACACAGCGTTGTGAGAAATGCAGCAAGCCCTGTGCT
Lm-LLO-138-3
GGTCACAGCTGAGGACGGAACACAGCGTTGTGAGAAATGCAGCAAGCCCTGTGCT
Lm-ddA-164-1
GGTCACAGCTGAGGACGGAACACAGCGTTGTGAGAAATGCAGCAAGCCCTGTGCT
LmddA164-2
GGTCACAGCTGAGGACGGAACACAGCGTTGTGAGAAATGCAGCAAGCCCTGTGCT
Lm-ddA-164-3
GGTCACAGCTGAGGACGGAACACAGCGTTGTGAGAAATGCAGCAAGCCCTGTGCT
LmddA164-4
GGTCACAGCTGAGGACGGAACACAGCGTTGTGAGAAATGCAGCAAGCCCTGTGCT
Lm-ddA-164-5
GGTCACAGCTGAGGACGGAACACAGCGTTGTGAGAAATGCAGCAAGCCCTGTGCT
LmddA-164-6
GGTCACAGCTGAGGACGGAACACAGCGTTCTGAGAAATGCAGCAAGCCCTGTGCT
参考
CGAGTGTGCTATGGTCTGGGCATGGAGCACCTTCGAGGGGCGAGGGCCATCACCAGTGAC(SEQ ID NO:15)
Lm-LLO-138-2
CGAGTGTGCTATGGTCTGGGCATGGAGCACCTTCGAGGGGCGAGGGCCATCACCAGTGAC
Lm-LLO-138-3
CGAGTGTGCTATGGTCTGGGCATGGAGCACCTTCGAGGGGCGAGGGCCATCACCAGTGAC
Lm-ddA-164-1
CGAGTGTGCTATGGTCTGGGCATGGAGCACCTTCGAGGGGCGAGGGCCATCACCAGTGAC
LmddA164-2
CGAGTGTGCTATGGTCTGGGCATGGAGCACCTTCGAGGGGCGAGGGCCATCACCAGTGAC
Lm-ddA-164-3
CGAGTGTGCTATGGTCTGGGCATGGAGCACCTTCGAGGGGCGAGGGCCATCACCAGTGAC
LmddA164-4
CGAGTGTGCTATGGTCTGGGCATGGAGCACCTTCGAGGGGCGAGGGCCATCACCAGTGAC
Lm-ddA-164-5
CGAGTGTGCTATGGTCTGGGCATGGAGCACCTTCGAGGGGCGAGGGCCATCACCAGTGAC
LmddA-164-6
CGAGTGTGCTATGGTCTGGGCATGGAGCACCTTCGAGGGGCGAGGGCCATCACCAGTGAC
参考
AATGTCCAGGAGTTTGATGGCTGCAAGAAGATCTTTGGGAGCCTGGCATTTTTGCCGGAG(SEQ ID No:16)
Lm-LLO-138-2
AATGTCCAGGAGTTTGATGGCTGCAAGAAGATCTTTGGGAGCCTGGCATTTTTGCCGGAG
Lm-LLO-138-3
AATGTCCAGGAGTTTGATGGCTGCAAGAAGATCTTTGGGAGCCTGGCATTTTTGCCGGAG
Lm-ddA-164-1
AATGTCCAGGAGTTTGATGGCTGCAAGAAGATCTTTGGGAGCCTGGCATTTTTGCCGGAG
LmddA164-2
AATGTCCAGGAGTTTGATGGCTGCAAGAAGATCTTTGGGAGCCTGGCATTTTTGCCGGAG
Lm-ddA-164-3
AATGTCCAGGAGTTTGATGGCTGCAAGAAGATCTTTGGGAGCCTGGCATTTTTGCCGGAG
LmddA164-4
AATGTCCAGGAGTTTGATGGCTGCAAGAAGATCTTTGGGAGCCTGGCATTTTTGCCGGAG
Lm-ddA-164-5
AATGTCCAGGAGTTTGATGGCTGCAAGAAGATCTTTGGGAGCCTGGCATTTTTGCCGGAG
LmddA-164-6
AATGTCCAGGAGTTTGATGGCTGCAAGAAGATCTTTGGGAGCCTGGCATTTTTGCCGGAG
参考
AGCTTTGATGGGGACCCCTCCTCCGGCATTGCTCCGCTGAGGCCTGAGCAGCTCCAAGTG(SEQ ID No:17)
Lm-LLO-138-2
AGCTTTGATGGGGACCCCTCCTCCGGCATTGCTCCGCTGAGGCCTGAGCAGCTCCAAGTG
Lm-LLO-138-3
AGCTTTGATGGGGACCCCTCCTCCGGCATTGCTCCGCTGAGGCCTGAGCAGCTCCAAGTG
Lm-ddA-164-1
AGCTTTGATGGGGACCCCTCCTCCGGCATTGCTCCGCTGAGGCCTGAGCAGCTCCAAGTG
LmddA164-2
AGCTTTGATGGGGACCCCTCCTCCGGCATTGCTCCGCTGAGGCCTGAGCAGCTCCAAGTG
Lm-ddA-164-3
AGCTTTGATGGGGACCCCTCCTCCGGCATTGCTCCGCTGAGGCCTGAGCAGCTCCAAGTG
LmddA164-4
AGCTTTGATGGGGACCCCTCCTCCGGCATTGCTCCGCTGAGGCCTGAGCAGCTCCAAGTG
Lm-ddA-164-5
AGCTTTGATGGGGACCCCTCCTCCGGCATTGCTCCGCTGAGGCCTGAGCAGCTCCAAGTG
LmddA-164-6
AGCTTTGATGGGGACCCCTCCTCCGGCATTGCTCCGCTGAGGCCTGAGCAGCTCCAAGTG
参考
TTCGAAACCCTGGAGGAGATCACAGGTTACCTGTACATCTCAGCATGGCCAGACAGTCTC(SEQ ID NO:18)
Lm-LLO-138-2
TTCGAAACCCTGGAGGAGATCACAGGTTACCTGTACATCTCAGCATGGCCAGACAGTCTC
Lm-LLO-138-3
TTCGAAACCCTGGAGGAGATCACAGGTTACCTGTACATCTCAGCATGGCCAGACAGTCTC
Lm-ddA-164-1
TTCGAAACCCTGGAGGAGATCACAGGTTACCTGTACATCTCAGCATGGCCAGACAGTCTC
LmddA164-2
TTCGAAACCCTGGAGGAGATCACAGGTTACCTGTACATCTCAGCATGGCCAGACAGTCTC
Lm-ddA-164-3
TTCGAAACCCTGGAGGAGATCACAGGTTACCTGTACATCTCAGCATGGCCAGACAGTCTC
LmddA164-4
TTCGAAACCCTGGAGGAGATCACAGGTTACCTGTACATCTCAGCATGGCCAGACAGTCTC
Lm-ddA-164-5
TTCGAAACCCTGGAGGAGATCACAGGTTACCTGTACATCTCAGCATGGCCANACAGTCTC
LmddA-164-6
TTCGAAACCCTGGAGGAGATCACAGGTTACCTGTACATCTCAGCATGGCCAGACAGTCT
参考
CGTGACCTCAGTGTCTTCCAGAACCTTCGAATCATTCGGGGACGGATTCTCCACGATGGC(SEQ ID NO:19)
Lm-LLO-138-2
CGTGACCTCAGTGTCTTCCAGAACCTTCGAATCATTCGGGGACGGATTCTCCACGATGGC
Lm-LLO-138-3
CGTGACCTCAGTGTCTTCCAGAACCTTCGAATCATTCGGGGACGGATTCTCCACGATGGC
Lm-ddA-164-1
CGTGACCTCAGTGTCTTCCAGAACCTTCGAATCATTCGGGGACGGATTCTCCACGATGGC
LmddA164-2
CGTGACCTCAGTGTCTTCCAGAACCTTCGAATCATTCGGGGACGGATTCTCCACGATGGC
Lm-ddA-164-3
CGTGACCTCAGTGTCTTCCAGAACCTTCGAATCATTCGGGGACGGATTCTCCACGATGGC
LmddA164-4
CGTGACCTCAGTGTCTTCCAAAACCTTCGAATCATTCGGGGACGGATTCTCCACGATGGC
Lm-ddA-164-5
CGTGACCTCAGTGTCTTCCAAAACCTTCGAATCATTCGGGGACGGATTCTCCACGATGGC
LmddA-164-6
CGTGACCTCAGTGTCTTCCAAAACCTTCGAATCATTCGGGGACGGATTCTCCACGATGGC
参考
GCGTACTCATTGACACTGCAAGGCCTGGGGATCCACTCGCTGGGGCTGCGCTCACTGCGG(SEQ ID NO:20)
Lm-LLO-138-2
GCGTACTCATTGACACTGCAAGGCCTGGGGATCCACTCGCTGGGGCTGCGCTCACTGCGG
Lm-LLO-138-3
GCGTACTCATTGACACTGCAAGGCCTGGGGATCCACTCGCTGGGGCTGCGCTCACTGCGG
Lm-ddA-164-1
GCGTACTCATTGACACTGCAAGGCCTGGGGATCCACTCGCTGGGGCTGCGCTCACTGCGG
LmddA164-3
GCGTACTCATTGACACTGCAAGGCCTGGGGATCCACTCGCTGGGGCTGCGCTCACTGCGG
Lm-ddA-164-5
GCGTACTCATTGACACTGCAAGGCCTGGGGATCCACTCGCTGGGGCTGCGCTCACTGCGG
Lm-ddA-164-6
GCGTACTCATTGACACTGCAAGGCCTGGGGATCCACTCGCTGGGGCTGCGCTCACTGCGG
参考
GAGCTGGGCAGTGGATTGGCTCTGATTCACCGCAACGCCCATCTCTGCTTTGTACACACT(SEQ ID NO:21)
Lm-LLO-138-2
GAGCTGGGCAGTGGATTGGCTCTGATTCACCGCAACGCCCATCTCTGCTTTGTACACACT
Lm-LLO-138-3
GAGCTGGGCAGTGGATTGGCTCTGATTCACCGCAACGCCCATCTCTGCTTTGTACACACT
Lm-ddA-164-1
GAGCTGGGCAGTGGATTGGCTCTGATTCACCGCAACGCCCATCTCTGCTTTGTACACACT
LmddA164-3
GAGCTGGGCAGTGGATTGGCTCTGATTCACCGCAACGCCCATCTCTGCTTTGTACACACT
Lm-ddA-164-5
GAGCTGGGCAGTGGATTGGCTCTGATTCACCGCAACGCCCATCTCTGCTTTGTACACACT
Lm-ddA-164-6
GAGCTGGGCAGTGGATTGGCTCTGATTCACCGCAACGCCCATCTCTGCTTTGTACACACT
参考
GTACCTTGGGACCAGCTCTTCCGGAACCCACATCAGGCCCTGCTCCACAGTGGGAACCGG(SEQ ID NO:22)
Lm-LLO-138-2
GTACCTTGGGACCAGCTCTTCCGGAACCCACATCAGGCCCTGCTCCACAGTGGGAACCGG
Lm-LLO-138-3
GTACCTTGGGACCAGCTCTTCCGGAACCCACATCAGGCCCTGCTCCACAGTGGGAACCGG
Lm-ddA-164-1
GTACCTTGGGACCAGCTCTTCCGGAACCCACATCAGGCCCTGCTCCACAGTGGGAACCGG
LmddA164-3
GTACCTTGGGACCAGCTCTTCCGGAACCCACATCAGGCCCTGCTCCACAGTGGGAACCGG
Lm-ddA-164-5
GTACCTTGGGACCANCTCTTCCGGAACCCACATCAGGCCCTGCTCCACAGTGGGAACCGG
Lm-ddA-164-6
GTACCTTGGGACCAGCTCTTCCGGAACCCACATCAGGCCCTGCTCCACAGTGGGAACCGG
参考
CCGGAAGAGGATTGTGGTCTCGAGGGCTTGGTCTGTAACTCACTGTGTGCCCACGGGCAC(SEQ ID NO:23)
Lm-LLO-138-2
CCGGAAGAGGATTGTGGTCTCGAGGGCTTGGTCTGTAACTCACTGTGTGCCCACGGGCAC
Lm-LLO-138-3
CCGGAAGAGGATTGTGGTCTCGAGGGCTTGGTCTGTAACTCACTGTGTGCCCACGGGCAC
Lm-ddA-164-1
CCGGAAGAGGATTGTGGTCTCGAGGGCTTGGTCTGTAACTCACTGTGTGCCCACGGGCAC
LmddA164-3
CCGGAAGAGGATTGTGGTCTCGAGGGCTTGGTCTGTAACTCACTGTGTGCCCACGGGCAC
Lm-ddA-164-6
CCGGAAGAGGATTGTGGTCTCGAGGGCTTGGTCTGTAACTCACTGTGTGCCCACGGGCAC
参考
TGCTGGGGGCCAGGGCCCACCCAGTGTGTCAACTGCAGTCATTTCCTTCGGGGCCAGGAG(SEQ ID NO:24)
Lm-LLO-138-2
TGCTGGGGGCCAGGGCCCACCCAGTGTGTCAACTGCAGTCATTTCCTTCGGGGCCAGGAG
Lm-LLO-138-3
TGCTGGGGGCCAGGGCCCACCCAGTGTGTCAACTGCAGTCATTTCCTTCGGGGCCAGGAG
Lm-ddA-164-1
TGCTGGGGGCCAGGGCCCACCCAGTGTGTCAACTGCAGTCATTTCCTTCGGGGCCAGGAG
LmddA164-3
TGCTGGGGGCCAGGGCCCACCCAGTGTGTCAACTGCAGTCATTTCCTTCGGGGCCAGGAG
Lm-ddA-164-6
TGCTGGGGGCCAGGGCCCACCCA-------------------------------------
IC1的比对(HER2/neu的2114-3042bp)
参考
CGCCCAGCGGAGCAATGCCCAACCAGGCTCAGATGCGGATCCTAAAAGAGACGGAGC(SEQ ID NO:25)
Lm-LLO-NY-2
CGCCCAGCGGAGCAATGCCCAACCAGGCTCAGATGCGGATCCTAAAAGAGACGGAGC
Lm-LLO-138-4
CGCCCAGCGGAGCAATGCCCAACCAGGCTCAGATGCGGATCCTAAAAGAGACGGAGC
Lm-ddA-164-2
CGCCCAGCGGAGCAATGCCCAACCAGGCTCAGATGCGGATCCTAAAAGAGACGGAGC
Lm-ddA-164-3
CGCCCAGCGGAGCAATGCCCAACCAGGCTCAGATGCGGATCCTAAAAGAGACGGAGC
Lm-ddA164-6
CGCCCAGCGGAGCAATGCCCAACCAGGCTCAGATGCGGATCCTAAAAGAGACGGAGC
参考
TAAGGAAGGTGAAGGTGCTTGGATCAGGAGCTTTTGGCACTGTCTACAAGGGCATCTGGA(SEQ ID NO:26)
Lm-LLO-NY-1
TAAGGAAGGTGAAGGTGCTTGGATCAGGAGCTTTTGGCACTGTCTACAAGGGCATCTGGA
Lm-LLO-NY-2
TAAGGAAGGTGAAGGTGCTTGGATCAGGAGCTTTTGGCACTGTCTACAAGGGCATCTGGA
Lm-LLO-138-1
TAAGGAAGGTGAACGTGCTTGGATCAGGAGCTTTTGGCACTGTCTACAAGGGCATCTGGA
Lm-LLO-138-2
TAAGGAAGGTGAAGGTGCTTGGATCAGGAGCTTTTGGCACTGTCTACAAGGGCATCTGGA
Lm-LLO-138-3
TAAGGAAGGTGAAGGTGCTTGGATCAGGAGCTTTTGGCACTGTCTACAAGGGCATCTGGA
Lm-LLO-138-4
TAAGGAAGGTGAAGGTGCTTGGATCAGGAGCTTTTGGCACTGTCTACAAGGGCATCTGGA
Lm-ddA-164-1
TAAGGAAGGTGAAGGTGCTTGGATCAGGAGCTTTTGGCACTGTCTACAAGGGCATCTGGA
Lm-ddA-164-2
TAAGGAAGGTGAAGGTGCTTGGATCAGGAGCTTTTGGCACTGTCTACAAGGGCATCTGGA
Lm-ddA-164-3
TAAGGAAGGTGAAGGTGCTTGGATCAGGAGCTTTTGGCACTGTCTACAAGGGCATCTGGA
Lm-ddA-164-4
TAAGGAAGGTGAAGGTGCTTGGATCAGGAGCTTTTGGCACTGTCTACAAGGGCATCTGGA
Lm-ddA-164-5
TAAGGAAGGTGAAGGTGCTTGGATCAGGAGCTTTTGGCACTGTCTACAAGGGCATCTGGA
Lm-ddA164-6
TAAGGAAGGTGAAGGTGCTTGGATCAGGAGCTTTTGGCACTGTCTACAAGGGCATCTGGA
参考
TCCCAGATGGGGAGAATGTGAAAATCCCCGTGGCTATCAAGGTGTTGAGAGAAAACACAT(SEQ ID NO:27)
Lm-LLO-NY-1
TCCCAGATGGGGAGAATGTGAAAATCCCCGTGGCTATCAAGGTGTTGAGAGAAAACACAT
Lm-LLO-NY-2
TCCCAGATGGGGAGAATGTGAAAATCCCCGTGGCTATCAAGGTGTTGAGAGAAAACACAT
Lm-LLO-138-1
TCCCAGATGGGGAGAATGTGAAAATCCCCGTGGCTATCAAGGTGTTGAGAGAAAACACAT
Lm-LLO-138-2
TCCCAGATGGGGAGAATGTGAAAATCCCCGTGGCTATCAAGGTGTTGAGAGAAAACACAT
Lm-LLO-138-3
TCCCAGATGGGGAGAATGTGAAAATCCCCGTGGCTATCAAGGTGTTGAGAGAAAACACAT
Lm-LLO-138-4
TCCCAGATGGGGAGAATGTGAAAATCCCCGTGGCTATCAAGGTGTTGAGAGAAAACACAT
Lm-ddA-164-1
TCCCAGATGGGGAGAATGTGAAAATCCCCGTGGCTATCAAGGTGTTGAGAGAAAACACAT
Lm-ddA-164-2
TCCCAGATGGGGAGAATGTGAAAATCCCCGTGGCTATCAAGGTGTTGAGAGAAAACACAT
Lm-ddA-164-3
TCCCAGATGGGGAGAATGTGAAAATCCCCGTGGCTATCAAGGTGTTGAGAGAAAACACAT
Lm-ddA-164-4
TCCCAGATGGGGAGAATGTGAAAATCCCCGTGGCTATCAAGGTGTTGAGAGAAAACACAT
Lm-ddA-164-5
TCCCAGATGGGGAGAATGTGAAAATCCCCGTGGCTATCAAGGTGTTGAGAGAAAACACAT
Lm-ddA164-6
TCCCAGATGGGGAGAATGTGAAAATCCCCGTGGCTATCAAGGTGTTGAGAGAAAACACAT
参考CTCCTAAAGCCAACAAAGAAATTCTAGATGAAGCGTATGTGATGGCTGGTGTGGGTTCTC(SEQ ID NO:28)
Lm-LLO-NY-1
CTCCTAAAGCCAACAAAGAAATTCTAGATGAAGCGTATGTGATGGCTGGTGTGGGTTCTC
Lm-LLO-NY-2
CTCCTAAAGCCAACAAAGAAATTCTAGATGAAGCGTATGTGATGGCTGGTGTGGGTTCTC
Lm-LLO-138-1
CTCCTAAAGCCAACAAAGAAATTCTAGATGAAGCGTATGTGATGGCTGGTGTGGGTTCTC
Lm-LLO-138-2
CTCCTAAAGCCAACAAAGAAATTCTAGATGAAGCGTATGTGATGGCTGGTGTGGGTTCTC
Lm-LLO-138-3
CTCCTAAAGCCAACAAAGAAATTCTAGATGAAGCGTATGTGATGGCTGGTGTGGGTTCTC
lm-LLO-138-4
CTCCTAAAGCCAACAAAGAAATTCTAGATGAAGCGTATGTGATGGCTGGTGTGGGTTCTC
Lm-ddA-164-1
CTCCTAAAGCCAACAAAGAAATTCTAGATGAAGCGTATGTGATGGCTGGTGTGGGTTCTC
Lm-ddA-164-2
CTCCTAAAGCCAACAAAGAAATTCTAGATGAAGCGTATGTGATGGCTGGTGTGGGTTCTC
Lm-ddA-164-3
CTCCTAAAGCCAACAAAGAAATTCTAGATGAAGCGTATGTGATGGCTGGTGTGGGTTCTC
Lm-ddA-164-4
CTCCTAAAGCCAACAAAGAAATTCTAGATGAAGCGTATGTGATGGCTGGTGTGGGTTCTC
Lm-ddA-164-5
CTCCTAAAGCCAACAAAGAAATTCTAGATGAAGCGTATGTGATGGCTGGTGTGGGTTCTC
Lm-ddA164-6
CTCCTAAAGCCAACAAAGAAATTCTAGATGAAGCGTATGTGATGGCTGGTGTGGGTTCTC
参考
CGTATGTGTCCCGCCTCCTGGGCATCTGCCTGACATCCACAGTACAGCTGGTGACACAGC(SEQ ID NO:29)
Lm-LLO-NY-1
CGTATGTGTCCCGCCTCCTGGGCATCTGCCTGACATCCACAGTACAGCTGGTGACACAGC
Lm-LLO-NY-2
CGTATGTGTCCCGCCTCCTGGGCATCTGCCTGACATCCACAGTACAGCTGGTGACACAGC
Lm-LLO-138-1
CGTATGTGTCCCGCCTCCTGGGCATCTGCCTGACATCCACAGTACAGCTGGTGACACAGC
Lm-LLO-138-2
CGTATGTGTCCCGCCTCCTGGGCATCTGCCTGACATCCACAGTACAGCTGGTGACACAGC
Lm-LLO-138-3
CGTATGTGTCCCGCCTCCTGGGCATCTGCCTGACATCCACAGTACAGCTGGTGACACAGC
Lm-LLO-138-4
CGTATGTGTCCCGCCTCCTGGGCATCTGCCTGACATCCACAGTACAGCTGGTGACACAGC
Lm-ddA-164-1
CGTATGTGTCCCGCCTCCTGGGCATCTGCCTGACATCCACAGTACAGCTGGTGACACAGC
Lm-ddA-164-2
CGTATGTGTCCCGCCTCCTGGGCATCTGCCTGACATCCACAGTACAGCTGGTGACACAGC
Lm-ddA-164-3
CGTATGTGTCCCGCCTCCTGGGCATCTGCCTGACATCCACAGTACAGCTGGTGACACAGC
Lm-ddA-164-4
CGTATGTGTCCCGCCTCCTGGGCATCTGCCTGACATCCACAGTACAGCTGGTGACACAGC
Lm-ddA-164-5
CGTATGTGTCCCGCCTCCTGGGCATCTGCCTGACATCCACAGTACAGCTGGTGACACAGC
Lm-ddA164-6
CGTATGTGTCCCGCCTCCTGGGCATCTGCCTGACATCCACAGTACAGCTGGTGACACAGC
参考
TTATGCCCTACGGCTGCCTTCTGGACCATGTCCGAGAACACCGAGGTCGCCTAGGCTCCC(SEQ ID NO:30)
Lm-LLO-NY-1
TTATGCCCTACGGCTGCCTTCTGGACCATGTCCGAGAACACCGAGGTCGCCTAGGCTCCC
Lm-LLO-NY-2
TTATGCCCTACGGCTGCCTTCTGGACCATGTCCGAGAACACCGAGGTCGCCTAGGCTCCC
Lm-LLO-138-1
TTATGCCCTACGGCTGCCTTCTGGACCATGTCCGAGAACACCGAGGTCGCCTAGGCTCCC
Lm-LLO-138-2
TTATGCCCTACGGCTGCCTTCTGGACCATGTCCGAGAACACCGAGGTCGCCTAGGCTCCC
Lm-LLO-138-3
TTATGCCCTACGGCTGCCTTCTGGACCATGTCCGAGAACACCGAGGTCGCCTAGGCTCCC
Lm-LLO-138-4
TTATGCCCTACGGCTGCCTTCTGGACCATGTCCGAGAACACCGAGGTCGCCTAGGCTCCC
Lm-ddA-164-1
TTATGCCCTACGGCTGCCTTCTGGACCATGTCCGAGAACACCGAGGTCGCCTAGGCTCCC
Lm-ddA-164-2
TTATGCCCTACGGCTGCCTTCTGGACCATGTCCGAGAACACCGAGGTCGCCTAGGCTCCC
Lm-ddA-164-3
TTATGCCCTACGGCTGCCTTCTGGACCATGTCCGAGAACACCGAGGTCGCCTAGGCTCCC
Lm-ddA-164-4
TTATGCCCTACGGCTGCCTTCTGGACCATGTCCGAGAACACCGAGGTCGCCTAGGCTCCC
Lm-ddA-164-5
TTATGCCCTACGGCTGCCTTCTGGACCATGTCCGAGAACACCGAGGTCGCCTAGGCTCCC
Lm-ddA164-6
TTATGCCCTACGGCTGCCTTCTGGACCATGTCCGAGAACACCGAGGTCGCCTAGGCTCCC
参考
AGGACCTGCTCAACTGGTGTGTTCAGATTGCCAAGGGGATGAGCTACCTGGAGGACGTGC(SEQ ID NO:31)
Lm-LLO-NY-1
AGGACCTGCTCAACTGGTGTGTTCAGATTGCCAAGGGGATGAGCTACCTGGAGGACGTGC
Lm-LLO-NY-2
AGGACCTGCTCAACTGGTGTGTTCAGATTGCCAAGGGGATGAGCTACCTGGAGGACGTGC
Lm-LLO-138-1
AGGACCTGCTCAACTGGTGTGTTCAGATTGCCAAGGGGATGAGCTACCTGGAGGACGTGC
Lm-LLO-138-2
AGGACCTGCTCAACTGGTGTGTTCAGATTGCCAAGGGGATGAGCTACCTGGAGGACGTGC
Lm-LLO-138-3
AGGACCTGCTCAACTGGTGTGTTCAGATTGCCAAGGGGATGAGCTACCTGGAGGACGTGC
Lm-LLO-138-4
AGGACCTGCTCAACTGGTGTGTTCAGATTGCCAAGGGGATGAGCTACCTGGAGGACGTGC
Lm-ddA-164-1
AGGACCTGCTCAACTGGTGTGTTCAGATTGCCAAGGGGATGAGCTACCTGGAGGACGTGC
Lm-ddA-164-2
AGGACCTGCTCAACTGGTGTGTTCAGATTGCCAAGGGGATGAGCTACCTGGAGGACGTGC
Lm-ddA-164-3
AGGACCTGCTCAACTGGTGTGTTCAGATTGCCAAGGGGATGAGCTACCTGGAGGACGTGC
Lm-ddA-164-4
AGGACCTGCTCAACTGGTGTGTTCAGATTGCCAAGGGGATGAGCTACCTGGAGGACGTGC
Lm-ddA-164-5
AGGACCTGCTCAACTGGTGTGTTCAGATTGCCAAGGGGATGAGCTACCTGGAGGACGTGC
Lm-ddA164-6
AGGACCTGCTCAACTGGTGTGTTCAGATTGCCAAGGGGATGAGCTACCTGGAGGACGTGC
参考
GGCTTGTACACAGGGACCTGGCTGCCCGGAATGTGCTAGTCAAGAGTCCCAACCACGTCA(SEQ ID NO:32)
Lm-LLO-NY-1
GGCTTGTACACAGGGACCTGGCTGCCCGGAATGTGCTAGTCAAGAGTCCCAACCACGTCA
Lm-LLO-NY-2
GGCTTGTACACAGGGACCTGGCTGCCCGGAATGTGCTAGTCAAGAGTCCCAACCACGTCA
Lm-LLO-138-1
GGCTTGTACACAGGGACCTGGCTGCCCGGAATGTGCTAGTCAAGAGTCCCAACCACGTCA
Lm-LLO-138-2
GGCTTGTACACAGGGACCTGGCTGCCCGGAATGTGCTAGTCAAGAGTCCCAACCACGTCA
Lm-LLO-138-3
GGCTTGTACACAGGGACCTGGCTGCCCGGAATGTGCTAGTCAAGAGTCCCAACCACGTCA
Lm-LLO-138-4
GGCTTGTACACAGGGACCTGGCTGCCCGGAATGTGCTAGTCAAGAGTCCCAACCACGTCA
Lm-ddA-164-1
GGCTTGTACACAGGGACCTGGCTGCCCGGAATGTGCTAGTCAAGAGTCCCAACCACGTCA
Lm-ddA-164-2
GGCTTGTACACAGGGACCTGGCTGCCCGGAATGTGCTAGTCAAGAGTCCCAACCACGTCA
Lm-ddA-164-4
GGCTTGTACACAGGGACCTGGCTGCCCGGAATGTGCTAGTCAAGAGTCCCAACCACGTCA
Lm-ddA-164-3
GGCTTGTACACAGGGACCTGGCTGCCCGGAATGTGCTAGTCAAGAGTCCCAACCACGTCA
Lm-ddA-164-5
GGCTTGTACACAGGGACCTGGCTGCCCGGAATGTGCTAGTCAAGAGTCCCAACCACGTCA
Lm-ddA164-6
GGCTTGTACACAGGGACCTGGCTGCCCGGAATGTGCTAGTCAAGAGTCCCAACCACGTCA
参考
AGATTACAGATTTCGGGCTGGCTCGGCTGCTGGACATTGATGAGACAGAGTACCATGCAG(SEQ ID NO:33)
Lm-LLO-NY-1
AGATTACAGATTTCGGGCTGGCTCGGCTGCTGGACATTGATGAGACAGAGTACCATGCAG
Lm-LLO-NY-2
AGATTACAGATTTCGGGCTGGCTCGGCTGCTGGACATTGATGAGACAGAGTACCATGCAG
Lm-LLO-138-1
AGATTACAGATTTCGGGCTGGCTCGGCTGCTGGACATTGATGAGACAGAGTACCATGCAG
Lm-LLO-138-2
AGATTACAGATTTCGGGCTGGCTCGGCTGCTGGACATTGATGAGACAGAGTACCATGCAG
Lm-LLO-138-3
AGATTACAGATTTCGGGCTGGCTCGGCTGCTGGACATTGATGAGACAGAGTACCATGCAG
Lm-LLO-138-4
AGATTACAGATTTCGGGCTGGCTCGGCTGCTGGACATTGATGAGACAGAGTACCATGCAG
Lm-ddA-164-1
AGATTACAGATTTCGGGCTGGCTCGGCTGCTGGACATTGATGAGACAGAGTACCATGCAG
Lm-ddA-164-2
AGATTACAGATTTCGGGCTGGCTCGGCTGCTGGACATTGATGAGACAGAGTACCATGCAG
Lm-ddA-164-3
AGATTACAGATTTCGGGCTGGCTCGGCTGCTGGACATTGATGAGACAGAGTACCATGCAG
Lm-ddA-164-4
AGATTACAGATTTCGGGCTGGCTCGGCTGCTGGACATTGATGAGACAGAGTACCATGCAG
Lm-ddA-164-5
AGATTACAGATTTCGGGCTGGCTCGGCTGCTGGACATTGATGAGACAGAGTACCATGCAG
Lm-ddA164-6
AGATTACAGATTTCGGGCTGGCTCGGCTGCTGGACATTGATGAGACAGAGTACCATGCAG
参考
ATGGGGGCAAGGTGCCCATCAAATGGATGGCATTGGAATCTATTCTCAGACGCCGGTTCA(SEQ ID NO:34)
Lm-LLO-NY-1
ATGGGGGCAAGGTGCCCATCAAATGGATGGCATTGGAATCTATTCTCAGACGCCGGTTCA
Lm-LLO-NY-2
ATGGGGGCAAGGTGCCCATCAAATGGATGGCATTGGAATCTATTCTCAGACGCCGGTTCA
Lm-LLO-138-1
ATGGGGGCAAGGTGCCCATCAAATGGATGGCATTGGAATCTATTCTCAGACGCCGGTTCA
Lm-LLO-138-2
ATGGGGGCAAGGTGCCCATCAAATGGATGGCATTGGAATCTATTCTCAGACGCCGGTTCA
Lm-LLO-138-3
ATGGGGGCAAGGTGCCCATCAAATGGATGGCATTGGAATCTATTCTCAGACGCCGGTTCA
Lm-LLO-138-4
ATGGGGGCAAGGTGCCCATCAAATGGATGGCATTGGAATCTATTCTCAGACGCCGGTTCA
Lm-ddA-164-1
ATGGGGGCAAGGTGCCCATCAAATGGATGGCATTGGAATCTATTCTCAGACGCCGGTTCA
Lm-ddA-164-2
ATGGGGGCAAGGTGCCCATCAAATGGATGGCATTGGAATCTATTCTCAGACGCCGGTTCA
Lm-ddA-164-3
ATGGGGGCAAGGTGCCCATCAAATGGATGGCATTGGAATCTATTCTCAGACGCCGGTTCA
Lm-ddA-164-4
ATGGGGGCAAGGTGCCCATCAAATGGATGGCATTGGAATCTATTCTCAGACGCCGGTTCA
Lm-ddA-164-5
ATGGGGGCAAGGTGCCCATCAAATGGATGGCATTGGAATCTATTCTCAGACGCCGGTTCA
Lm-ddA-164-6
ATGGGGGCAAGGTGCCCATCAAATGGATGGCATTGGAATCTATTCTCAGACGCCGGTTCA
参考
CCCATCAGAGTGATGTGTGGAGCTATGGAGTGACTGTGTGGGAGCTGATGACTTTTGGGG(SEQ ID NO:35)
Lm-LLO-NY-1
CCCATCAGAGTGATGTGTGGAGCTATGGAGTGACTGTGTGGGAGCTGATGACTTTTGGGG
Lm-LLO-NY-2
CCCATCAGAGTGATGTGTGGAGCTATGGAGTGACTGTGTGGGAGCTGATGACTTTTGGGG
Lm-LLO-138-1
CCCATCAGAGTGATGTGTGGAGCTATGGAGTGACTGTGTGGGAGCTGATGACTTTTGGGG
Lm-LLO-138-2
CCCATCAGAGTGATGTGTGGAGCTATGGAGTGACTGTGTGGGAGCTGATGACTTTTGGGG
Lm-LLO-138-3
CCCATCAGAGTGATGTGTGGAGCTATGGAGTGACTGTGTGGGAGCTGATGACTTTTGGGG
Lm-LLO-138-4
CCCATCAGAGTGATGTGTGGAGCTATGGAGTGACTGTGTGGGAGCTGATGACTTTTGGGG
Lm-ddA-164-1
CCCATCAGAGTGATGTGTGGAGCTATGGAGTGACTGTGTGGGAGCTGATGACTTTTGGGG
Lm-ddA-164-2
CCCATCAGAGTGATGTGTGGAGCTATGGAGTGACTGTGTGGGAGCTGATGACTTTTGGGG
Lm-ddA-164-3
CCCATCAGAGTGATGTGTGGAGCTATGGAGTGACTGTGTGGGAGCTGATGACTTTTGGGG
Lm-ddA-164-4
CCCATCAGAGTGATGTGTGGAGCTATGGAGTGACTGTGTGGGAGCTGATGACTTTTGGGG
Lm-ddA-164-5
CCCATCAGAGTGATGTGTGGAGCTATGGAGTGACTGTGTGGGAGCTGATGACTTTTGGGG
Lm-ddA164-6
CCCATCAGAGTGATGTGTGGAGCTATGGAGTGACTGTGTGGGAGCTGATGACTTTTGGGG
参考
CCAAACCTTACGATGGAATCCCAGCCCGGGAGATCCCTGATTTGCTGGAGAAGGGAGAA(SEQ ID NO:36)
Lm-LLO-NY-1
CCAAACCTTACGATGGAATCCCAGCCCGGGAGATCCCTGATTTGCTGGAGAAGGGAGAA
Lm-LLO-NY-2
CCAAACCTTACGATGGAATCCCAGCCCGGGAGATCCCTGATTTGCTGGAGAAGGGAGAA
Lm-LLO-138-1
CCAAACCTTACGATGGAATCCCAGCCCGGGAGATCCCTGATTTGCTGGAGAAGGGAGAA
Lm-LLO-138-3
CCAAACCTTACGATGGAATCCCAGCCCGGGAGATCCCTGATTTGCTGGAGAAGGGAGAA
Lm-LLO-138-4
CCAAACCTTACGATGNAATCCCAGCCCGGGAGATCCCTGATTTGCTGGAGAAGGGAGAA
Lm-ddA164-6
CCAAACCTTACGATGGAATCCCAGCCCGGGAGATCCCTGATTTGCTGGAGAAGGGAGAA
Lm-ddA-164-2
CCAAACCTTACGATGGAATCCCAGCCCGGGAGATCCCTGATTTGCTGGAGAAGGGAGAA
Lm-LLO-138-2
CCAAACCTTACGATGGAATCCCAGCCCGGGAGATCCCTGATTTGCTGGAGAAGGGAGAA
Lm-ddA-164-3
CCAAACCTTACGATGGAATCCCAGCCCGGGAGATCCCTGATTTGCTGGAGAAGGGAGAA
Lm-ddA-164-5
CCAAACCTTACGATGGAATCCCAGCCCGGGAGATCCCTGATTTGCTGGAGAAGGGAGAA
Lm-ddA-164-1
CCAAACCTTACGATGGAATCCCAGCCCGGGAGATCCCTGATTTGCTGGAGAAGGGAGAA
Lm-ddA-164-4
CCAAACCTTACGATGGAATCCCAGCCCGGGAGATCCCTGATTTGCTGGAGAAGGGAGAA
参考
CGCCTACCTCAGCCTCCAATCTGCACCATTGATGTCTACATGATTATGGTCAAATGTT(SEQ ID NO:37)
Lm-LLO-NY-1
CGCCTACCTCAGCCTCCAATCTGCACCATTGATGTCTACATGATTATGGTCAAATGTT
Lm-LLO-NY-2
CGCCTACCTCAGCCTCCAATCTGCACCATTGATGTCTACATGATTATGGTCAAATGTT
Lm-LLO-138-1
CGCCTACCTCAGCCTCCAATCTGCACCATTGATGTCTACATGATTATGGTCAAATGTT
Lm-LLO-138-2
CGCCTACCTCAGCCTCCAATCTGCACCATTGATGTCTACATGATTATGGTCAAATGTT
Lm-LLO-138-3
CGCCTACCTCAGCCTCCAATCTGCACCATTGATGTCTACATGATTATGGTCAAATGTT
Lm-LLO-138-4
CGCCTACCTCAGCCTCCAATCTGCACCATTGATGTCTACATGATTATGGTCAAATGTT
Lm-ddA-164-1
CGCCTACCTCAGCCTCCAATCTGCACCATTGATGTCTACATGATTATGGTCAAATGTT
Lm-ddA-164-2
CGCCTACCTCAGCCTCCAATCTGCACCATTGATGTCTACATGATTATGGTCAAATGTT
Lm-ddA-164-3
CGCCTACCTCAGCCTCCAATCTGCACCATTGATGTCTACATGATTATGGTCAAATGTT
Lm-ddA-164-4
CGCCTACCTCAGCCTCCAATCTGCACCATTGATGTCTACATGATTATGGTCAAATGTT
Lm-ddA-164-5
CGCCTACCTCAGCCTCCAATCTGCACCATTGATGTCTACATGATTATGGTCAAATGTT
Lm-ddA164-6
CGCCTACCTCAGCCTCCAATCTGCACCATTGATGTCTACATGATTATGGTCAAATGTT
参考
GGATGATTGACTCTGAATGTCGCCCGAGATTCCGGGAGTTGGTGTCAGAATTTT(SEQ ID NO:38)
Lm-LLO-NY-1
GGATGATTGACTCTGAATGTCGCCCGAGATTCCGGGAGTTGGTGTCAGAATTTT
Lm-LLO-NY-2
GGATGATTGACTCTGAATGTCGCCCGAGATTCCGGGAGTTGGTGTCAGAATTTT
Lm-LLO-138-2
GGATGATTGACTCTGAATGTCCCCCGAGATTCCGGGAGTTGGTGTCAAAATTTT
Lm-LLO-138-3
GGATGATTGACTCTGAATGTCGCCCGAGATTCCGGGAGTTGGTGTCAGAATTTT
Lm-LLO-138-4
GGATGATTGACTCTGAATGTCGCCCGAGATTCCGGGAGTTGGTGTCAGAATTTT
Lm-ddA-164-1
GGATGATTGACTCTGAATGTCGCCCGAGATTCCGGGAGTTGGTGTCAGAATTTT
Lm-ddA-164-2
GGATGATTGACTCTGAATGTCGCCCGAGATTCCGGGAGTTGGTGTCAGAATTTT
Lm-ddA-164-3
GGATGATTGACTCTGAATGTCGCCCGAGATTCCGGGAGTTGGTGTCAGAATTTT
Lm-ddA-164-5
GGATGATTGACTCTGAATGTCGCCCGAGATTCCGGGAGTTGGTGTCAGAATTTT
Lm-ddA-164-4
GGATGATTGACTCTGAATGTCGCCCGAGATTCCGGGAGTTGGTGTCAGAATTTT
Lm-ddA164-6
GGATGATTGACTCTGAATGTCGCCCGAGATTCCGGGAGTTGGTGTCAGAATTTT
参考
CACGTATGGCGAGGGACCCCCAGCGTTTTGTGGTCATCCAGAACGAGGACTT(SEQ ID NO:39)
Lm-LLO-NY-1
CACGTATGGCGAGGGACCCCCAGCGTTTTGTGGTCATCCAGAACGAGGACTT
Lm-LLO-NY-2
CACGTATGGCGAGGGACCCCCAGCGTTTTGTGGTCATCCAGAACGAGGACTT
Lm-LLO-138-2
CACGTATGGCGAGGGACCCCCAGCGTTTTGTGGTCATCCAGAACGAGGACTT
Lm-LLO-138-3
CACGTATGGCGAGGGACCCCCAGCGTTTTGTGGTCATCCAGAACGAGGACTT
Lm-LLO-138-4
CACGTATGGCGAGGGACCCCCAGCGTTTTGTGGTCATCCAGAACGAGGACTT
Lm-ddA-164-1
CACGTATGGCGAGGGACCCCCAGCGTTTTGTGGTCATCCAGAACGAGGACTT
Lm-ddA-164-2
CACGTATGGCGAGGGACCCCCAGCGTTTTGTGGTCATCCAGAACGAGGACTT
Lm-ddA-164-3
CACGTATGGCGAGGGACCCCCAGCGTTTTGTGGTCATCCAGAACGAGGACTT
Lm-ddA-164-5
CACGTATGGCGAGGGACCCCCAGCGTTTTGTGGTCATCCAGAACGAGGACTT
Lm-ddA-164-6
CACGTATGGCGAGGGACCCCCAGCGTTTTGTGGTCATCCAGAACGAGGACTT
EC1的比对(HER2/neu的399-758bp)
参考
CCCAGGCAGAACCCCAGAGGGGCTGCGGGAGCTGCAGCTTCGAAGTCTCACAGAGATCCT(SEQ ID NO:40)
Lm-LLO-138-1
CCCAGGCAGAACCCCAGAGGGGCTGCGGGAGCTGCAGCTTCGAAGTCTCACAGAGATCCT
Lm-LLO-138-2
CCCAGGCAGAACCCCAGAGGGGCTGCGGGAGCTGCAGCTTCGAAGTCTCACAGAGATCCT
Lm-ddA-164-1
CCCAGGCAGAACCCCAGAGGGGCTGCGGGAGCTGCAGCTTCGAAGTCTCACAGAGATCCT
LmddA-164-2
CCCAGGCAGAACCCCAGAGGGGCTGCGGGAGCTGCAGCTTCGAAGTCTCACAGAGATCCT
LmddA-164-3
CCCAGGCAGAACCCCAGAGGGGCTGCGGGAGCTGCAGCTTCGAAGTCTCACAGAGATCCT
LmddA164-4
CCCAGGCAGAACCCCAGAGGGGCTGCGGGAGCTGCAGCTTCGAAGTCTCACAGAGATCCT
参考
GAAGGGAGGAGTTTTGATCCGTGGGAACCCTCAGCTCTGCTACCAGGACATGGTTTTGTG(SEQ ID NO:41)
Lm-LLO-138-1
GAAGGGAGGAGTTTTGATCCGTGGGAACCCTCAGCTCTGCTACCAGGACATGGTTTTGTG
Lm-LLO-138-2
GAAGGGAGGAGTTTTGATCCGTGGGAACCCTCAGCTCTGCTACCAGGACATGGTTTTGTG
Lm-ddA-164-1
GAAGGGAGGAGTTTTGATCCGTGGGAACCCTCAGCTCTGCTACCAGGACATGGTTTTGTG
LmddA-164-2
GAAGGGAGGAGTTTTGATCCGTGGGAACCCTCAGCTCTGCTACCAGGACATGGTTTTGTG
LmddA-164-3
GAAGGGAGGAGTTTTGATCCGTGGGAACCCTCAGCTCTGCTACCAGGACATGGTTTTGTG
LmddA164-4
GAAGGGAGGAGTTTTGATCCGTGGGAACCCTCAGCTCTGCTACCAGGACATGGTTTTGTG
参考
CCGGGCCTGTCCACCTTGTGCCCCCGCCTGCAAAGACAATCACTGTTGGGGTGAGAGTCC(SEQ ID NO:42)
Lm-LLO-138-1
CCGGGCCTGTCCACCTTGTGCCCCCGCCTGCAAAGACAATCACTGTTGGGGTGAGAGTCC
Lm-LLO-138-2
CCGGGCCTGTCCACCTTGTGCCCCCGCCTGCAAAGACAATCACTGTTGGGGTGAGAGTCC
Lm-ddA-164-1
CCGGGCCTGTCCACCTTGTGCCCCCGCCTGCAAAGACAATCACTGTTGGGGTGAGAGTCC
LmddA-164-2
CCGGGCCTGTCCACCTTGTGCCCCCGCCTGCAAAGACAATCACTGTTGGGGTGAGAGTCC
LmddA-164-3
CCGGGCCTGTCCACCTTGTGCCCCCGCCTGCAAAGACAATCACTGTTGGGGTGAGAGTCC
LmddA164-4
CCGGGCCTGTCCACCTTGTGCCCCCGCCTGCAAAGACAATCACTGTTGGGGTGAGAGTCC
参考
GGAAGACTGTCAGATCTTGACTGGCACCATCTGTACCAGTGGTTGTGCCCGGTGCAAGGG(SEQ ID NO:43)
Lm-LLO-138-1
GGAAGACTGTCAGATCTTGACTGGCACCATCTGTACCAGTGGTTGTGCCCGGTGCAAGGG
Lm-LLO-138-2
GGAAGACTGTCAGATCTTGACTGGCACCATCTGTACCAGTGGTTGTGCCCGGTGCAAGGG
Lm-ddA-164-1
GGAAGACTGTCAGATCTTGACTGGCACCATCTGTACCAGTGGTTGTGCCCGGTGCAAGGG
LmddA-164-2
GGAAGACTGTCAGATCTTGACTGGCACCATCTGTACCAGTGGTTGTGCCCGGTGCAAGGG
LmddA-164-3
GGAAGACTGTCAGATCTTGACTGGCACCATCTGTACCAGTGGTTGTGCCCGGTGCAAGGG
LmddA164-4
GGAAGACTGTCAGATCTTGACTGGCACCATCTGTACCAGTGGTTGTGCCCGGTGCAAGGG
参考
CCGGCTGCCCACTGACTGCTGCCATGAGCAGTGTGCCGCAGGCTGCACGGGCCCCAAGCA(SEQ ID NO:44)
Lm-LLO-138-1
CCGGCTGCCCACTGACTGCTGCCATGAGCAGTGTGCCGCAGGCTGCACGGGCCCCAAGCA
Lm-LLO-138-2
CCGGCTGCCCACTGACTGCTGCCATGAGCAGTGTGCCGCAGGCTGCACGGGCCCCAAGCA
Lm-ddA-164-1
CCGGCTGCCCACTGACTGCTGCCATGAGCAGTGTGCCGCAGGCTGCACGGGCCCCAAGCA
LmddA-164-2
CCGGCTGCCCACTGACTGCTGCCATGAGCAGTGTGCCGCAGGCTGCACGGGCCCCAAGTA
LmddA-164-3
CCGGCTGCCCACTGACTGCTGCCATGAGCAGTGTGCCGCAGGCTGCACGGGCCCCAAGTA
LmddA164-4
CCGGCTGCCCACTGACTGCTGCCATGAGCAGTGTGCCGCAGGCTGCACGGGCCCCAAGTA
实例7:ADXS31-164的外周免疫可延缓脑中转移性乳腺癌细胞系的生长。
使用ADXS31-164或不相关Lm-对照疫苗IP免疫小鼠,然后颅内植入5,000个表达荧光素酶和低水平HER2/neu的EMT6-Luc肿瘤细胞(图6C)。在接种后的不同时间通过麻醉小鼠的离体成像监测肿瘤。在肿瘤接种后第8天,检测所有对照动物中的肿瘤,但ADXS31-164中的小鼠均未显示出任何可检测的肿瘤(图6A和B)。ADXS31-164可明显延缓这些肿瘤的发病,因为在肿瘤接种后第11天阴性对照组中的所有小鼠已死于肿瘤,但ADXS31-164组中的所有小鼠仍然存活,并且仅显示出少量肿瘤生长的迹象。这些结果强烈暗示,ADXS31-164的外周施用得到的免疫应答可能到达中枢神经系统,并且基于LmddA的疫苗可具有治疗CNS肿瘤的潜在用途。
实例8:通过ADXS31-164免疫治疗犬科动物骨肉瘤。
犬科动物骨肉瘤是长(腿)骨的癌症,是年龄超过10岁的大狗的主要杀手。标准治疗是在诊断后立即截肢,然后化疗。然而,不变的是癌症转移到肺。与未治疗的6-12个月存活期相比,通过化疗可使狗存活约18个月。据信,HER2抗原存在于多达50%的骨肉瘤中。ADXS31-164对表达此抗原的细胞形成免疫攻击,并且已开发用于治疗人乳腺癌。
组织学诊断为骨肉瘤并且具有恶性细胞表达HER2/neu的证据的狗符合入选资格。
犬科动物骨肉瘤试验
在第一队中,进行截肢,然后接受几轮化疗治疗。随后施用3剂Her-2疫苗,6个月间隔期后加强或不加强。
所有狗接受4周的卡铂治疗。在最后卡铂给药后四周,狗每三周接受一次ADXS-HER2,总共给药3次。第1组(3只狗)接受1×108个CFU/剂,第2组(3只狗)每只接受5×108个CFU/剂,第3组(3只狗)接受1×109个CFU/剂。如果观察到潜在的剂量限制毒性,则向组中加入另外的狗以收集更多的数据。因此,在初步研究中可治疗9-18只狗。
在第二队中,与第一队相同重复治疗,不同的是在化疗前(1个月前)仅施用单剂疫苗,总共给药4次。
另外,在化疗后一个月给两队施用单剂。
实例9:评估ADXS-cHER2在患有HER2/NEU过表达的犬科动物骨肉瘤的伴侣狗中的安全性的1期剂量递增研究
进行前期I期剂量递增研究以确定可安全和有效地刺激患有骨肉瘤的狗的肿瘤特异性免疫的表达人HER2/neu重组疫苗的单核细胞增多性李斯特菌的剂量。例行收集由于怀疑或确认患有OSA而提供给PennVet进行截肢的所有狗的肿瘤,并进行组织病理学评估以确认OSA的诊断。此外,通过IHC和Western印迹分析来评估所有狗的肿瘤切片,以确定肿瘤是否表达HER2/neu。只有组织学诊断为OSA并且具有恶性细胞表达HER2/neu的证据的狗才符合入选资格。冷藏在手术时采集的肿瘤组织的单细胞悬液,并在铬释放分析中用作自体肿瘤靶标,以确定抗肿瘤免疫。
入选了最多18只患有肢体OSA并确认表达Her2-neu的私有狗(图7)。在入选时(最后卡铂治疗后3周),所有狗接受了基本临床实验室测试,包括全血细胞计数(CBC)、化学筛选(CS)和尿分析(UA)以及通过超声心动描记法进行心脏功能的基线评估和测定心脏特异性肌钙蛋白I(cTnI)水平。通过胸部放射显影确定是否存在肺转移。只有无肺转移证据的狗才符合研究入选资格。在入选时,收集外周血单核细胞(PBMC)以评估抗肿瘤免疫的基线水平(参见抗肿瘤免疫的评估)。此外,采血评估基线免疫功能,以确保它们不再受卡铂免疫抑制。只有具有功能完整的免疫系统的狗才符合接受李斯特菌疫苗的资格。
Lm重组给药和数据采集
使用单个ADXS31-164ADXS31-164重组疫苗给所有狗接种。在最后卡铂给药后三周给予第一次Lm-huHer2-neu疫苗,此后每三周给予一次,总共给药3次(图7)。
第1组(3只狗)接受1×108个CFU/剂的ADXS31-164(Lm-人嵌合HER2/neu)疫苗,第2组(3只狗)每只接受5×108个CFU/剂,第3组(3只狗)接受1×109个CFU/剂和3.3×109个CFU/剂(1只狗)。重组Lm经30分钟以缓慢静脉内输注而施用。第1组所选的剂量为小鼠中嵌合ADXS31-164重组体的确定安全剂量。在人中,Lovaxin C的无毒剂量仅比小鼠中确定的剂量高一个数量级,并且该剂量为该前期试验中第3组评估的剂量。
在Lm施用时,监测狗的全身性不利影响的证据。在输注期间,通过ECG监测心搏率和心律并记录呼吸率。另外,使用超声波并通过测定肌钙蛋白I水平来监测心脏损伤(图8)。在输注后,密切监测狗48小时。在输注后使用MiniMitterRespironics制造的Vital Sense连续体温监控系统(兽医临床试验中心(VCIC)常用仪器)连续监控核心体温<12小时。在前6小时的每小时和其后的每4小时监测并记录脉搏率、脉搏节律和脉象、呼吸率和呼吸努力,以及血压和体温(图9)。记录所有符合免疫刺激的症状,根据需要使用流体、止痛剂、止吐剂和抗组胺剂控制严重反应。所有狗每天观察六次,记录重组体的任何毒性效应的迹象,包括不适、嗜睡、恶心、呕吐和腹泻。在第一次ADXS31-164疫苗接种后24、48和72小时采集血样进行培养,以评估全身施用后Lm的清除。
抗肿瘤免疫的评估
在最后卡铂给药后三周,狗接受常规临床检查和基线血液工作,包括CBC、CS、UA和cTnI水平。在该时间采集PBMC进行抗肿瘤免疫的基线评估。在每次疫苗接种时和最后疫苗接种后三周进行重复的免疫评估。通过CFSE增殖、细胞因子生成(ELISpot和qRT-PCR)和CTL分析法来分析PBMC对自体肿瘤靶标的HER2/neu特异性T细胞应答,如下文所概述(图12)。
结果
迄今为止,我们在16只狗中进行了总共41次ADXS31-164输注。
ADXS31-164剂量的范围为1×108、5×108、1×109和3.3×109个CFU。
疫苗施用的标准操作规程
开发ADXS31-164施用的标准操作规程。在疫苗接种前一小时,患者通过肌内注射接受2mg/kg苯海拉明,以及缓慢静脉推注0.2mg/kg昂丹司琼。疫苗保持在-80℃下,在给患者施用时解冻。它溶于200ml 0.9%NaCl中经30分钟施用。然后用30ml Plasmalyte冲洗输注管线。将狗送回笼舍,三天一个疗程施用阿莫西林(疫苗接种后72小时开始),7天一个疗程施用肝脏补充剂(S-腺苷-甲硫氨酸),以帮助细胞生长和修复。
研究的主要终点是确定ADXS31-164的最大耐受剂量。
体重在25kg至67kg范围内的狗能很好地耐受高达3.3×109的剂量。所有报告的副作用均为I级毒性,最大耐受剂量尚未达到。通常在疫苗施用的2-4小时内出现副作用。高热通常以维持速率(4ml/kg/小时)静脉内递送等渗流体2-4小时而消退。在其中发热达到104.7和更高的两种情况下,单次皮下注射卡洛芬在1-2小时内使体温恢复正常。恶心和呕吐通常是自限性的,但在其中记录到多次发作的情况下,施用1mg/kg Cerenia,这对预防进一步的恶心和呕吐非常有效。在疫苗施用的48小时内,总共5只狗的肝脏酶出现轻度、I级升高,这在疫苗接种一周后消退。
李斯特菌的清除
在对迄今为止接种疫苗的所有16只狗进行血液培养后,疫苗接种后24小时任何一只狗的外周循环中均未检测到李斯特菌。未评估疫苗接种狗的尿液和粪便中李斯特菌的流出。
研究的次要终点是无进展存活期和总体存活期。在截肢和4剂卡铂后施用ADXS31-164时已观察到患有骨肉瘤的狗具有统计学上的显著性的总体存活期优势。前两剂组(6只狗)的早期结果显示,与其主人选择不参与试验但跟踪存活期的6只狗相比,接受ADXS31-164的狗具有显著的存活期优势(p=0.003)(图13)。未接种疫苗的狗的平均存活时间为239.5天。未到达接种疫苗的狗的平均存活时间。当分析包括意向治疗组中的所有狗时,这也成立。
因此,没有证据显示对心血管、造血、肝脏或肾脏系统造成显著的短期或长期副作用。此外,在存在微小残留病的情况下,ADXS31-164的施用可延缓/防止转移性疾病,并延长患有HER2/neu阳性骨肉瘤的狗的总体存活期。
实例10:
在骨肉瘤(OSA)的自发性犬科动物模型中评估ADXS31-164的1期临床试验
材料和方法
疫苗制造
ADXS31-164的设计和产生。简而言之,用携带嵌合人HER2/neu构建体的pADV质粒转染单核细胞增多性李斯特菌(Lm)的dal dat actA突变体菌株。该构建体包含人HER2/neu分子的2个胞外域(EC1和EC2)和一个胞内域(IC1),人HER2/neu分子包含大部分融合至截短的李斯特菌溶血素O构建体的HLA-A2限制免疫优势表位。转移质粒还包含芽孢杆菌p60dal基因,并且通过营养缺陷型互补而维持在突变体Lm内。不存在细菌抗性盒。疫苗由Vibalogics GmbH(Cuxhaven,Germany)制造,在使用之前保存在-80℃。
组织病理学、分期和免疫组织化学
所有原发性肢体骨肉瘤肿瘤的组织病理学评估由委员会认证的兽医病理学家(J.E.)进行。根据组织学特征将肿瘤描述为成骨细胞肿瘤、软骨母细胞肿瘤、纤维母细胞肿瘤和血管扩张性肿瘤。根据有丝分裂指数、核多形性以及基质和坏死的存在量对原发性肿瘤进行评分。将组织学评分转换为级别(I、II或III)。
对于HER2/neu染色,将福尔马林固定、脱钙、石蜡包埋组织的5微米厚连续切片安装到带负电的载玻片上。切片在80℃下加热20分钟,浸入Pro Par(clearant)中,在乙醇中再水化。通过在柠檬酸钠缓冲液(pH~9.0)中煮沸切片进行抗原修复。使用3%过氧化氢封闭内源性过氧化物酶。使用兔抗人HER2/neu抗体(Neu(c-18):sc-284,Santa Cruz Biotecnology)或兔IgG同种型(通用阴性对照血清(Universal Negative Control serum),NC498,Biocare Medical)进行染色。使用通用链亲和素-生物素2系统(Universal Streptavadin-Biotin2System)(DAKO/LSAB2,HRP)检测结合的抗体。组织用3,3'-二氨基联苯胺溶液(DAKO)染色,并用苏木精复染色。使用Nikon E600infinity经校正的正立显微镜观察玻片。使用Nikon Digital Sight DS-Fi1彩色照相机获取亮视野图像,并使用NIS-Element BR3.0进行图像分析。由委员会认证的病理学家(J.E.)根据赘生性细胞的HER2/neu染色百分比(<10%=1,10%-50%=2,>50%=3)和HER2/neu染色强度(弱=1、中=2、强=3)对组织切片的HER2/neu阳性进行评估和评分。每个组织切片的得分基于10hpf内分析的细胞。合并的HER2/neu得分通过HER2/neu染色阳性的肿瘤细胞百分比和HER2/neu染色强度给出的两个单独的得分相乘得到。只有HER2/neu染色阳性的肿瘤细胞大于10%的狗才符合试验入选资格。
合格标准和临床试验设计
组织病理学和免疫组织化学诊断为HER2/neu阳性OSA的狗接受了通过截肢或保肢手术进行的原发性肿瘤摘除,并接受了4剂300mg/m2的卡铂作为辅助性化疗,卡铂每3周给予一次(或如果出现骨髓抑制,则每4周一次),此类狗符合筛选资格。在最后卡铂治疗后三周对狗进行筛选。进行全面体检、全血细胞计数(CBC)、化学筛选(CS)和尿分析(UA)以确定一般健康状态。分别使用流式细胞中性粒细胞氧化爆发分析和有丝分裂原诱导的淋巴细胞增殖分析来测试基本先天性和适应性免疫功能。通过心电描记法、超声心动描记法和血清心脏肌钙蛋白I水平评估基线心脏状态。进行胸部放射显影以确定肺转移性疾病的存在(参见图14B)。只有经发现全身健康、先天性和适应性免疫功能完整、无潜在心脏疾病证据并且无肺转移性疾病证据的那些狗才符合入选资格。在研究的过程中死亡的狗接受尸检。记录转移性疾病的存在和位置,进行组织病理学和免疫组织化学分析,以评估转移性病灶中的HER2/neu表达。
免疫分析
中性粒细胞氧化爆发分析。使用0.83%NH4Cl裂解肝素钠抗凝血中的红细胞,其余的白细胞在1×PBS中洗涤两次。用15μg/ml二氢若丹明123(DHR-123;Molecular Probes,Grand Island,NY)标记细胞,并用3nM佛波醇-12-十四烷酰-13-乙酸酯(PMA,Sigma,St.Louis,MO)在37℃下活化30分钟。将细胞置于冰上15分钟,然后进行流式细胞分析。在FACS Canto细胞计数器(BD Biosciences,San Jose,CA)上获取细胞,并使用FloJo软件(Treestar,San Carlos,CA)进行分析。
淋巴细胞增殖分析。通过密度离心从肝素钠抗凝全血分离外周血单核细胞(PBMC)。PBMC在1×PBS中洗涤两次并计数。用5μM CFSE标记细胞,并用1.25μM伴刀豆球蛋白A在37℃下刺激5天。收集细胞,在FACS缓冲液中洗涤两次,用APC缀合的大鼠抗犬科动物CD4和PE缀合的大鼠抗犬科动物CD8抗体Serotec,Raleigh,NC)标记,并通过流式细胞术分析。对于免疫功能分析,使用从健康集落狗(IACUC#804197)采集的外周血作为阳性对照。
T细胞亚群分析。在基线、每次疫苗接种之前、再分期时以及其后每2个月采集PBMC,进行CD4和CD8T细胞亚群分析。简而言之,解冻冷藏的细胞,在FACS缓冲液(1×PBS、0.2%BSA组分V和4mM叠氮化钠)中洗涤两次,然后用小鼠抗犬科动物CD3、PE标记的大鼠抗狗CD8或Alexa标记的大鼠抗狗CD4(Serotec,Raleigh,NC)进行表面染色。在流式细胞采集之前立即用活体染料7-ADD温育细胞。由使用Cell Dyn 3700CS血液分析仪测定的流式细胞百分比和总淋巴细胞计数来计算CD4+和CD8+T细胞总数。
疫苗施用
在疫苗接种之前,狗接受静脉内施用5HT3拮抗剂昂丹司琼(0.2mg/kg)和肌内施用H1受体阻断剂苯海拉明(2mg/kg),分别用于预防恶心和过敏。利用标准3+3临床试验设计。ADXS31-164按以下剂量施用;第1组(2×108个CFU)、第2组(5×108个CFU)、第3组(1×109个CFU)以及第4组(3.3×109个CFU)。在100ml 0.9%NaCl(第1和2组)和200ml 0.9%NaCl(第3和4组)中稀释ADXS31-164,并经30分钟静脉内施用。在输注后每小时监测体温、脉搏、呼吸率、心率和心律(通过EKG)以及血压。在其中体温超过103℉的情况下,给狗静脉内施用4ml/kg/h Plasmalyte,直到体温降至103℉之下。每小时监测狗的嗜睡、恶心或呕吐迹象。在24小时和疫苗接种后一周采集血样,以评估血液学或生物化学参数的任何变化,并且在疫苗接种后24小时进行血液培养,以确定血流中活细菌的持续存在性。在疫苗接种后72小时,所有狗接受短疗程的阿莫西林和S-腺苷甲硫氨酸(SAMe),以杀死任何残留的李斯特菌,以及为肝脏提供抗氧化剂支持。
在接受初始系列中的最后疫苗后至少5个月无转移性疾病的狗的主人可选择接受1×109个CFU的标准剂量的加强疫苗。如上文所述施用加强疫苗,并且如上文所述在输注后对狗进行监测。
毒性
根据Veterinary Co-operative Oncology Group-Common Terminology Criteria for Adverse Events(VCOG-CTCAE)(兽医合作肿瘤学组-不良事件的常用术语标准)对毒性进行分级。在基线、每次疫苗接种时、最后疫苗接种后3周以及其后每2个月通过连续心电图、超声心动图和血清心脏肌钙蛋白I水平进行心脏毒性的评估,直到死亡。所评估的参数包括左室缩短分数(LVFS)和左室舒张末期内径(LVIDd)以及左室收缩末期内径(LVIDs)。将LVIDd和LVIDs归一化为体重,以考虑狗中宽范围的体格大小。
ELISpot分析
在每个指定的时间点解冻冷藏的PBMC,在37℃下放置过夜,然后计数。细胞用2.5μM重叠人HER2/Neu肽库(11个单位重叠5个氨基酸)(表示嵌合疫苗中存在的HER2/Neu的EC1、EC2和IC1域)和重组人IL-2(Invitrogen,Fredrick,MD)刺激5天。收集细胞,在1×PBS中洗涤两次并计数。IFN-γELISpot分析使用商业化犬科动物IFN-γELISpot分析试剂盒(R&D Systems,Minneapolis,MN)根据制造商的方案进行。简而言之,将0.8-2×105个经刺激的细胞与2.5μM EC1、EC2或IC1肽库加上IL-2或单独的IL-2(以测定背景计数)一起温育。所有分析一式两份地进行。根据制造商的说明对平板显色。使用CTL-Immunospot分析仪(C.T.L,ShakerHeights,OH)对斑点进行计数。
主要和次要结局测定
转移时间(TTM)以截肢和发生转移性疾病之间的时间计算。OSA特异性存活期以截肢和死亡之间的时间计算。对死于不相关原因的患者在死亡时进行审查。
结果
达到合格标准的十八只狗入选该I期临床试验。记录年龄、品种、性别、肿瘤位置、亚类、等级和HER2/neu状态(表4)。利用标准3+3临床试验设计。ADXS31-164按以下剂量施用;第1组:2×108个CFU(n=3)、第2组:5×108个CFU(n=3)、第3组:1×109个CFU(n=9)以及第4组:3×109个CFU(n=3)。出于关怀护理,五只另外的在筛选时鉴定为患有预先存在的肺转移性疾病的狗也接受ADXS31-164(表4)。这些狗中的四只在>50%的来自原发性肿瘤的赘生性细胞中具有强HER2/neu染色。在筛选时,这些狗中的三只具有多个肺转移性结节,两只狗具有单个转移性结节。具有多个肺结节的狗每只在疾病进展前接受一剂疫苗,并退出研究进行替代治疗。具有单个结节的两只狗每只接受全程三剂疫苗。患有预先存在的转移性疾病的狗接受1×109个CFU(n=3)或3×109个CFU(n=2)ADXS31-164(表5)。
图15示出了1期临床试验的时间线示意图,其中三次疫苗接种在截肢和随访化疗后施用。
表4:入选的狗的特征描述和肿瘤特征
表5:出于关怀护理而治疗的患有预先存在的转移性疾病的狗的特征描述和肿瘤特征
结果
安全性和毒性=评估所有23只疫苗接种狗的安全性。所有狗能很好地耐受ADXS31-164施用,仅在疫苗接种日观察到瞬时低级别毒性(表6)。在所有组中,ADXS31-164施用后4小时出现具有统计学上的显著性的体温升高,与剂量无关(图9A)。在任何时间点或任何剂量下均未观察到低血压(图9B)。8/18只狗(未患预先存在的转移性疾病)和3/5只狗(患有预先存在的转移性疾病)在疫苗接种的4小时内出现>103℉的发热,此时给予静脉补液。三只狗接受单剂量的非甾体抗炎药,以降低体温。在所有情况下,发热的消退无需另外干预。在疫苗接种的4小时内出现不需要治疗干预的瞬时嗜睡、恶心和呕吐,与剂量无关。在疫苗接种后不久,在两只狗中鉴定到瞬时单或二联室性早搏。在疫苗接种的2小时内,一只患有预先存在的转移性疾病的狗出现室性心动过速。然而,利多卡因、普鲁卡因胺、索他洛尔和皮质类固醇的治疗没有效果,心律失常在72小时内消退。在ADXS31-164施用24小时后出现瞬时、但具有统计学上的显著性的白细胞和中性粒细胞计数增加,并且伴有血小板和淋巴细胞瞬时减少(图17)。虽然ADXS31-164剂量和血液学变化幅度之间无相关性,但存活的狗和死亡的狗之间的白细胞、中性粒细胞和单核细胞应答幅度存在显著的差异(图18A-F)。大约一半的狗的肝脏酶血清浓度出现轻度、瞬时升高,与亲肝李斯特菌引起的轻度炎症一致(表6)。外周血中鉴定的所有变化均为无症状的,并且在ADXS31-164施用的一周内消退。在任何狗中均未记录到肾功能的显著变化。19/23只狗在ADXS31-164施用后24小时进行了血液培养,并且均为阴性的,与高度减毒LmddA菌株的快速清除一致。
鉴于HER2/neu靶向单克隆抗体会引起心脏毒性,我们在基线、每次疫苗接种之前以及其后每2个月评估了心脏损伤的生物标志物和机能障碍的超声心动描记计测量,包括心脏肌钙蛋白I、缩短分数(%)、LVIDd和LVIDs。在任何疫苗接种狗中均未鉴定到心脏肌钙蛋白I、缩短分数、LVIDd或LVIDs的显著、持续变化(图26A-D)。然而,第3组的一只狗在每次疫苗接种时显示出血清心脏肌钙蛋白I的阶跃升高,不伴有超声心动描记的机能障碍迹象。值在最后疫苗接种后返回基线,并且在重复评估时未升高。
在整个临床试验中,测定心脏肌钙蛋白I水平,以及缩短分数、左室收缩末期内径(LVIDs)和左室舒张末期内径(LVIDd),如图25(A-D)所示,在ADXS31-164的施用后,不存在长期或短期心脏毒性的证据。
下表6提供的数据示出,在临床试验期间报告了极少的治疗相关不良事件。
表6:在ADXS31-164疫苗接种时或48小时内出现的治疗相关不良事件。
结论:ADSX31-164毒性是低级别的并且是瞬时的。
对ADXS31-164的免疫应答
图18提供的结果证实,在接受疫苗的狗中,对ADXS31-164的早期免疫应答预测了狗的存活期。图18显示,ADXS31-164诱导了与存活期相关的WBC、中性粒细胞和单核细胞计数增加,并且伴有血小板和淋巴细胞的瞬时减少(图17)。
在临床试验期间评估了ADXS31-164诱导和维持免疫应答,具体地讲诱导HER2/neu特异性T细胞免疫的能力。为了评估免疫应答以及确定ADXS31-164是否诱导了HER2/neu特异性T细胞应答,通过IFN-γELISpot评估了HER2/neu特异性T细胞数量。在基线(卡铂施用后3周)、每次疫苗接种时以及其后每2个月采集样品。图19示出了ELISpot分析的结果。
HER2/neu特异性免疫应答。在基线分别对4/18、6/18和1/18只狗检测对人HER2/neu的EC1、EC2和IC1域(分别与犬科动物HER2/neu共有89%、93%和98%同一性)的免疫应答。在第三次ADXS31-164疫苗接种后3周对7只狗检测对一个或多个HER2/neu域的诱导的IFN-γ应答(表7)。这些狗中的五只出现对高度保守的IC1域的免疫应答。在2个月后五只另外的狗出现对IC1域的IFN-γ应答。在复发时,三只另外的狗出现对单独的EC2、EC2和IC1或EC1、EC2和EC3的IFN-γ应答(狗001、002和017)。通过IFN-γELISpot评估在初始疫苗接种系列期间出现对HER2/neu的免疫应答的3只狗15至17个月。然而,并未维持HER2/neu特异性IFN-γ应答,在此期间狗仍无转移性疾病。10只狗接受另外的加强疫苗接种,其中6只可评估,在加强疫苗接种后2个月,2只狗检测到HER2/neu特异性IFN-γ应答增加。在ADXS31-164施用后3周,复发的8只狗中,5只的HER2/neu特异性IFN-γ应答不增加。
表7
加强疫苗接种。在18只入选时无转移性疾病的狗中,十只在初始疫苗系列后5和10个月之间施用单剂加强疫苗。这些狗中的四只接受在首次加强疫苗后4和15个月之间给予的另外加强疫苗。在加强疫苗接种时,与初始疫苗接种系列一样,记录到了类似的低级别、瞬时副作用。
图20(A和B)示出,重复加强疫苗接种还刺激了HER2特异性免疫。在6和10个月对动物289-003施用重复加强疫苗接种,在8个月对动物289-004施用。临床结局。疫苗接种组中8/18只狗复发,4只患有肺转移性疾病,4只出现骨转移。两只骨转移的狗进展到肺转移。一只骶骨具有骨病灶的狗死于吸入性肺炎,一只具有单个肺结节的狗死于肾胚细胞瘤,然而,分别来自骨和肺病灶的尸检样本不适于转移性骨肉瘤的组织病理学确认。通过OSA特异性存活期分析,对这两只狗进行审查。复发的狗在初诊判断时接受不同的挽救化疗和放疗。4只骨转移的狗仅用止痛剂治疗(1只狗)、单独的姑息性放疗(1只狗)或与化疗联合(2只狗)。两只狗接受阿霉素,1只狗接受Palladia,以治疗肺转移性疾病。未达到疫苗接种狗的中值OSA特异性存活期。TTM的Kaplan-Meier存活期曲线和OSA特异性存活期如图21所示。疫苗接种狗的1年和2年总体存活率分别为71.4%和57%。在疫苗接种的2个月内出现HER2/neu特异性IFN-γ应答的12只狗中,9只仍然存活(3只狗>900天,1只狗>700天,3只狗>400天,2只狗>300天,并且7只目前仍无肿瘤(表7))。图24提供的结果显示,ADXS31-164破坏了对HER2/Neu的耐受性。这对OSA以及其他HER2/neu肿瘤和/或癌症的治疗是重要的。
尸检结果。6/18只狗在研究期间死亡,对这些狗中的4只进行尸检。三只狗被发现患有多灶性II和III级转移性骨肉瘤,涉及肺(3只狗)、骨(2只狗)、纵隔(1只狗)和肾(1只狗)。一只狗由于大型进行性肾脏肿块而被实施安乐死,被发现患有肾胚细胞瘤。这只狗还具有单个肺结节,但遗憾的是未通过组织病理学评估。
ADXS31-164施用后的存活期、长存活期、肿瘤进展
在筛选时三只具有多个转移性肺结节的狗,出于关怀护理,在疾病进行前每只接受一剂疫苗治疗,并从研究中移除。在筛选时两只存在孤立性转移性肺结节的狗接受全部三剂疫苗(参见表5的特征描述和肿瘤特征)。尽管进行了疫苗接种,这些狗中的一只仍出现进行性肺转移性疾病。在第二只狗中,尽管预先存在的肺结节每3周大小加倍,但未出现另外的肺病灶(图22A和B)。在最后疫苗接种后一周,CT扫描确认不存在另外的转移性病灶,并且狗接受转移灶切除。在手术前,静脉内施用用于检测肿瘤边缘和炎症区域的染料吲哚菁绿(ICG),在手术时,在近红外光下观察到肺结节中以及孤立性结节附近的多个其他外观健康的肺实质区域中的荧光(图22C和D)。肺结节的组织病理学揭示,转移性OSA具有被厚纤维囊围绕的很大的出血和坏死区域(图22E)。IHC显示CD3+T细胞在纤维囊周围积聚,结节本身内的T细胞很少(图22G和H)。近红外荧光识别的其他区域示出了T细胞浸润的局灶性区域(图22F、22I和22J)。在具有显著的有丝分裂象的异常大的波形蛋白阳性细胞周围观察到T细胞(图22K和22L)。这些发现暗示,单个转移性肉瘤细胞可被肺内的肿瘤特异性T细胞有效地靶向,并且提供ADXS31-164防止转移性肺疾病的可能机制。狗能很好地从手术恢复,并且保持无肺转移性疾病5个月,随后在皮下组织(成骨细胞肿瘤,II级;和软骨母细胞肿瘤,III级)、纵隔(成骨细胞肿瘤,II级)和隔膜(成骨细胞肿瘤,III级)中出现广泛的侵袭性HER2/neu+转移性疾病。结果显示,尽管诱导了HER2/neu特异性T细胞应答,但未鉴定到脱肿瘤副作用,因此HER2/neu特异性T细胞的诱导负责消除HER2/neu阳性转移性细胞,以及长期防止疾病复发。这可由以下方面支持:HER2/Neu-特异性T细胞扩增的时间(在5只狗中出现在诊断后大约8个月,当时很多狗将出现转移性疾病),以及疫苗接种和转移灶切除后一只狗的肺实质内局灶性T细胞应答的组织病理学发现。
图22和图23提供的结果证实,ADXS31-164的施用延缓了和/或防止了转移性疾病,并且延长了患有自发性HER2+骨肉瘤的狗的总体存活期。从两张图中可以看出,接受疫苗的狗的存活时间显著延长,而其他的则未达到那些接受疫苗的狗的中值存活期。
虽然我们的研究证实了此方法防止转移性疾病的有效性,但在出于关怀护理治疗的5只狗中,ADXS31-164疫苗接种不能诱导预先存在的严重肺转移性疾病的消退。在一只狗中,这似乎与T细胞不能穿透围绕转移性病灶的纤维囊或那些细胞不能在已建立的肿瘤微环境中存活相关(图22C)。然而,在相同的狗中,总体正常的肺实质中观察到大型、活跃分裂的旨在成为转移性OSA细胞的间充质细胞周围的T细胞浸润的局灶性区域,出乎意料的是,在转移灶切除后,该狗未发生进一步的肺转移性疾病。这些数据共同暗示,ADXS31-164通过其诱导强大先天性免疫应答和适应性免疫应答的能力防止了肺转移性疾病,该先天性免疫应答可敏化转移性OSA细胞发生FAS/FASL介导的细胞凋亡,该适应性免疫应答为消除微转移性肺疾病的HER2/neu特异性T细胞的形式。
结论:
在提交本申请时,12/18只狗未发生肺转移性疾病,证实了在微小残留病的背景中施用时,ADXS31-164防止了患有自发性HER2+骨肉瘤的受试者的转移性疾病。与历史HER2/Neu+对照组相比,疫苗接种狗显示出具有统计学上的显著性的总体存活期增加。HER2/Neu+对照狗(n=11)的中值存活期为316天(p=0.032),其中未达到ADSX31-164治疗狗的中值存活期。另外,结果表明,ADXS31-164破坏了对HER2/neu的高度保守IC1域的外周耐受性(图26)。在ADXS31-164施用24小时内白细胞增加的幅度(图18)与存活期相关,暗示结局部分取决于狗的免疫系统对疫苗作出应答的能力。重要的是,本研究显示将高达3×109个CFU的ADXS31-164施用于患有自发性OSA的狗是安全的,并且在施用时仅引起瞬时、低级别的副作用。此外,防止肺转移性疾病可能部分地与肺中CD3+T细胞介导的微观转移性疾病消除相关。本研究对于表达HER2/Neu的小儿OSA和其他人类癌症具有重要意义。
此外,我们在这里示出,在狗中剂量高达3.3×10^9个CFU的ADXS31-164的施用是安全的,尽管诱导了HER2/neu特异性免疫但不会导致短期或长期心脏毒性。包括心脏毒性的在靶、脱肿瘤副作用与大量HER2/neu特异性T细胞的施用相关,或当曲妥单抗与蒽环类同时使用时出现。我们利用无多柔比星的标准化疗方案减小心脏毒性的任何潜在风险。
我们的研究证实,ADXS31-164可防止患有OSA的狗的肺转移性疾病。这些结果证实了患有OSA的狗的安全性和史无前例的存活时间,并且为研究ADXS31-164防止患有HER2/neu表达肿瘤(包括小儿骨肉瘤和乳腺癌)的患者的转移性疾病的能力铺平了道路。
虽然本文已示出和描述了本发明的某些特征,但现在本领域的普通技术人员将想到许多修改、置换、变化和等同形式。因此,应当理解,所附权利要求书旨在涵盖落在本发明的真实精神范围内的所有此类修改和变化。
- 还没有人留言评论。精彩留言会获得点赞!