微流体装置的制作方法
本实施方案一般来说涉及微流体装置,且具体来说涉及被配置用于培养和监测细胞的这类微流体装置。
背景
最近单细胞生物学的发展已表明,同基因细胞在相同的条件下生长时在基因表达以及行为方面可以显示较大差异。因此需要新的装置来表征随着时间过去而出现的细胞间的表型的差异。这类装置需要满足某些准则以便成为培养和监测单细胞的有效工具。举例来说,这些装置应该易于装载细胞,使得可以在装载之后立即监测表型特性。此外,许多不同的个别细胞需要并行地生长以表征细胞间的差异。装置应被设计使得能够在较长时间段内在恒定且受良好控制的生长条件下培养细胞以监测例如谱系依赖性动态。如果装置能够改变培养条件以监测响应于新的培养基或测试剂的动态改变则为进一步优选的。举例来说,对同基因细胞并行地测试不同培养基或对不同细胞株并行地监测对培养基改变的响应可以是有利的。
微流体装置的所要应用是在已将细菌细胞装载于微流体装置中之后立即迅速地且并行地监测细菌样品对一组抗生素或其它测试剂的表型响应。在这个应用中,能够使微流体装置直接装载例如具有细菌或混有血细胞的细菌的尿液样品以增加分析速度将为有利的。
可以与抗生素敏感性测试(AST)结合的另一个所要应用将为通过首先监测表型特性且接着确定基因型特性来探查细胞样品的遗传变异性。
Wang等人的Current Biology 2010,20:1099-1103中公开了现有技术的微流体装置,名称为“Mother Machine”。母机器(Mother Machine)允许并行地监测许多不同细胞通道中的细胞。然而,这个现有技术的微流体装置具有若干缺点。举例来说,细胞装载是复杂的而且难以迅速地改变微流体装置中的培养条件。
因此需要一种克服现有技术的微流体装置的缺点中的一些或全部的改进的微流体装置。
概要
实施方案的目标是提供一种改进的微流体装置。
本文中公开的实施方案满足这个和其它目标。
实施方案的一方面涉及一种微流体装置,所述微流体装置包括对于成像透明的且具有多个在空间上界定且分开的细胞通道的衬底,所述细胞通道具有容纳呈单层的细胞的尺寸。所述多个在空间上界定且分开的细胞通道的相应的第一端与流量输入通道流体连通,所述流量输入通道具有与第一流体端口流体连通的第一端和与第二流体端口流体连通的第二端。所述多个在空间上界定且分开的细胞通道的相应的第二端与相应的第一洗涤通道的第一端流体连通,所述第一洗涤通道具有与流量输出通道流体连通的第二端。所述流量输出通道与第三流体端口流体连通。所述第一洗涤通道的尺寸太小而不能容纳所述细胞。
实施方案的另一方面涉及一种装载根据上文所述的微流体装置的方法。所述方法包括在所述微流体装置的第一流体端口和第二流体端口中的一者中输入细胞和培养基以允许所述细胞和培养基流动通过所述微流体装置的流量输入通道且流入至多个在空间上界定且分开的细胞通道中。所述多个在空间上界定且分开的细胞通道的相应的第一端与所述流量输入通道流体连通,所述流量输入通道具有与所述第一流体端口流体连通的第一端和与所述第二流体端口流体连通的第二端。所述方法还包括通过所述第一流体端口和所述第二流体端口中的另一者输出过量细胞以及通过所述第一流体端口和所述第二流体端口中的另一者和通过与流量输出通道流体连通的第三端口输出培养基。所述多个在空间上界定且分开的细胞通道的相应的第二端与相应的第一洗涤通道的第一端流体连通,所述第一洗涤通道具有与所述流量输出通道流体连通的第二端。所述第一洗涤通道的尺寸太小而不能容纳所述细胞。
实施方案的另一方面涉及一种用于抗生素敏感性测试的方法。所述方法包括将细菌细胞装载至根据上文所述的微流体装置的多个在空间上界定且分开的细胞通道中。所述方法还包括将所述多个在空间上界定且分开的细胞通道的不同的在空间上界定且分开的细胞通道中的细菌细胞暴露于不同的抗生素和/或不同浓度的抗生素。所述方法进一步包括基于所述细菌细胞在所述多个在空间上界定且分开的细胞通道中的相应的表型特性,优选地为相应生长速率、相应的类核紧缩程度、相应的代谢活动程度和相应的薄膜完整性程度中的至少一者来确定所述细菌细胞的抗生素敏感性。
实施方案的又一方面涉及一种用于对细胞进行原位基因分型的方法。所述方法包括将细胞装载至根据上文所述的微流体装置的多个在空间上界定且分开的细胞通道中。所述方法还包括使所述细胞固定在所述多个在空间上界定且分开的细胞通道中以及对所述多个所述在空间上界定且分开的细胞通道中的所述细胞进行原位基因分型。
实施方案的另一方面涉及一种用于细胞的表型表征的方法。所述方法包括将细胞装载至根据上文所述的微流体装置的多个在空间上界定且分开的细胞通道中。所述方法还包括使所述细胞在所述多个在空间上界定且分开的细胞通道中生长以及实时地监测所述细胞在所述多个在空间上界定且分开的细胞通道中的表型特性。
实施方案的微流体装置易于装载细胞且使得能够在恒定或可变的条件下培养细胞。所述微流体装置使得能够迅速地切换培养条件或施加化学品、试剂或其它制剂。
附图简述
可以通过参考与附图一起进行的以下描述来最佳地理解实施方案以及其进一步目标和优点,附图中:
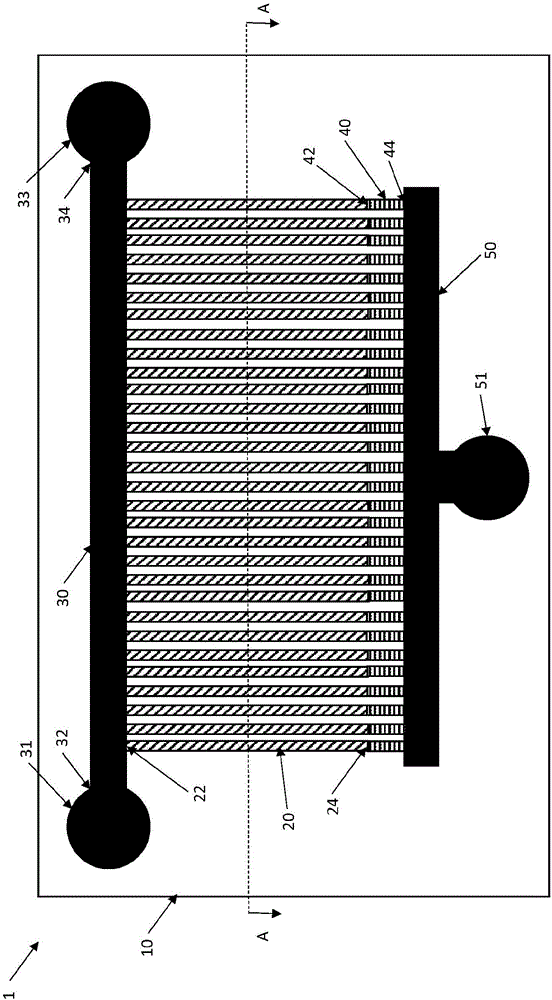
图1是根据一实施方案的微流体装置的图示;
图2是图1所示的微流体装置沿着线A-A的截面图;
图3是根据另一实施方案的微流体装置的图示;
图4是图3所示的微流体装置沿着线A-A的截面图;
图5是根据另一实施方案的微流体装置的图示;
图6是根据又一实施方案的微流体装置的图示;
图7是图6所示的微流体装置的装载和操作的图示;
图8示意性地图示了微流体装置中的细胞通道和参考通道的放大;
图9示意性地图示了微流体装置中的具有通道标识符的细胞通道的放大;
图10是根据另一实施方案的微流体装置的图示;
图11示意性地图示了图10所示的微流体装置的框A中的部分的放大;
图12示意性地图示了图11所示的微流体装置的框B中的部分的放大;
图13是用于铸造根据一实施方案的微流体装置的模具的扫描电子显微镜(SEM)图像;
图14图示了在根据一实施方案的微流体装置中生长的大肠杆菌细胞的相差图像;
图15图示了在根据一实施方案的微流体装置中生长的氯霉素敏感(MIC≈4μg/ml)氯霉素抗性(MIC>12μg/ml)大肠杆菌菌株的相差图像;
图16为图示根据一实施方案的装载微流体装置的方法流程图;
图17示出了一个红霉素抗性和两个红霉素敏感大肠杆菌菌株在暴露于120μg/ml的红霉素时在时间=0分钟时的平均生长速率响应;以及
图18示出了环丙沙星抗性大肠杆菌菌株在暴露于(1)无药物(用“x”标记),(2)红霉素(120μg/ml,用菱形标记)或(3)环丙沙星(10μg/ml,用圆圈标记)时在时间=0分钟时的平均生长速率响应。
详细描述
在所有图式中,相同参考数字用于类似的或对应的元件。
本实施方案一般来说涉及微流体装置,且具体来说涉及被配置用于培养和监测细胞的这类微流体装置。
实施方案的微流体装置便于在恒定或可变的条件下进行长期细胞培养。微流体装置易于装载细胞且使得能够迅速地切换生长条件并添加或交换生物制剂或化学制剂。
实施方案的微流体装置可以用于单细胞培养和实验。在这类应用中,将个别细胞保持与输入样品中的其它细胞分开。举例来说,微流体装置可以用以将多个细胞株的文库中的相应细胞株的细胞与其它细胞株的细胞分开地保存和培养。因此,每一细胞株在微流体装置中则具有相应地在空间上界定且分开的细胞通道,细胞可以在所述微流体装置中生长和被研究。
实施方案的一方面涉及微流体装置,也称作培养装置。所述微流体装置包括对于成像透明的且具有多个在空间上界定且分开的细胞通道的衬底,所述细胞通道具有容纳呈单层的细胞的尺寸。多个在空间上界定且分开的细胞通道的相应的第一端与流量输入通道(也称作流量通道)流体连通。流量输入通道具有与第一流体端口(也称作流体源)流体连通的第一端,和与第二流体端口(也称作流体槽)流体连通的第二端。多个在空间上界定且分开的细胞通道的相应的第二端与相应的第一洗涤通道的第一端流体连通,第一洗涤通道具有与流量输出通道(也称作槽通道)流体连通的第二端。流量输出通道与第三流体端口(也称作洗涤槽)流体连通。第一洗涤通道的尺寸太小而不能容纳细胞。
现在将参照附图进一步描述微流体装置的各种实现方式实施方案。
在一实施方案中,见图1,微流体装置1包括对于成像透明的且具有多个在空间上界定且分开的细胞通道20的衬底10。细胞通道20具有容纳呈单层的细胞的尺寸。细胞通道20的相应的第一端22与流量输入通道30流体连通,流量输入通道30具有在第一端32的第一流体端口31和在第二端34的第二流体端口33。第一洗涤通道40优选地存在且从细胞通道20的相应的第二端24延伸至流量输出通道50。因此,第一洗涤通道40具有与细胞通道20的第二端24流体连通的第一端42以及与流量输出通道50流体连通的相对的第二端44。流量输出通道50与第三流体端口51流体连通。
衬底10具有多个细胞通道20,细胞在细胞通道20中被培养。细胞通道20可以并列地布置,如图1所示并在如图2所示的沿着图1中的线A-A截取的截面图中进一步示出。在这种情况下,细胞通道20的相应的第一端22与流量输入通道30流体连通且从这个流量输入通道30延伸。为了增加细胞通道20的总数目,细胞通道20可以从流量通道30的任一纵向侧延伸,进而与仅仅在流量通道30的一侧具有细胞通道20相比使细胞通道20的数目基本上加倍,见图5。
在图5中,微流体装置1的衬底10具有两组2A、2B细胞通道20。每一个这类组2A、2B的细胞通道20具有与共同的流体输入通道30流体连通的相应的第一端,其中第一流体端口31和第二流体端口33在流体输入通道30的两端32、34。然而,每一组2A、2B具有相应的流量输出通道50A、50B,如图5所示。因此,第一组2A中的第一洗涤通道40的第二端与第一流量输出通道50A流体连通,而第二组2B中的第一洗涤通道40的第二端与第二流量输出通道50B流体连通。这两个流量输出通道50A、50B优选地共享共同的第三输出端口51。
图5的微流体装置1基本上如图1所示多路使用两组2A、2B。这意味着两组2A、2B细胞通道20和第一洗涤通道40共享共同的流量输入通道30,流量输入通道30在第一端32与第一流体端口31连通且在第二端34与第二流体端口33连通。每一组2A、2B细胞通道20和第一洗涤通道40终止于相应的流量输出通道50A、50B,相应的流量输出通道50A、50B互连且与共同的第三流体端口51连通。
在图式左侧的第一组2A中的细胞通道20中存在的细胞与右侧的第二组2B中的细胞通道20中存在的细胞将暴露于在第一流体端口31处输入的相同的培养基以及试剂和化学品。
而且,细胞通道20和流量输入通道30的更复杂的布置在衬底10中是可能的,如本文中将结合图6至图7和图10进一步描述。重要特性在于每一细胞通道20的一端22与流量输入通道30流体连通且细胞通道20被分开以防止细胞从一个细胞通道20逃逸并进入另一细胞通道20。
细胞通道20被设计尺寸以容纳呈单层的细胞。这意味着选择细胞通道20的高度或直径以使其大约为或稍大于将被监测的细胞的直径。举例来说,细胞通道20在如图2所示的截面中可以是基本上正方形的,其中通道侧面基本上与细胞的细胞直径匹配。或者,细胞通道20可以具有直径基本上与细胞直径匹配的圆形或U形截面。而且,其它截面配置是可能的,只要细胞可以在细胞通道20中优选地按单层被可存活地培养。这意味着细胞通道20可以有几个细胞宽,但优选地只能有一个细胞高。在这种情况下,细胞可以在细胞通道中生长,从而形成2D单层,2D单层可以比一个细胞宽,但优选地仍为单层。
流量输入通道30优选地具有显著大于将被监测的细胞的直径的尺寸。这意味着,通过培养基从第一流体端口31优选地持续流动通过流量通道30且朝着第二流量端口33持续流动,进入流量输入通道30的任何细胞将通常朝着第二流体端口33被冲刷通过流量输入通道30。因此,在一实施方案中,流量输入通道30具有大得足以允许细胞流动通过流量输入通道30的尺寸。
流量输入通道30与细胞通道20的截面尺寸的差异可以进一步用以将施加至微流体装置1的生物样品中的细胞彼此分开。举例来说,生物样品可以含有大小小得足以允许细胞在流动通过流体输入通道30时进入细胞通道20的所关注细胞。生物样品可以另外包括太大而不能进入细胞通道20但仍小得足以流动通过流量输入通道30的较大细胞。当诸如通过第一输入端口31将生物样品输入至微流体装置1时,获得大小分离,其中大细胞在流量输入通道30中从第一流体端口31朝第二流体端口33流动经过细胞通道20。然而,较小的靶细胞将陷在细胞通道20中。
如果生物样品另外或替代地包括大小小得足以进入第一洗涤通道40的非常小的细胞,那么获得额外的或替代的大小分离。因此,靶细胞进入细胞通道20但因为太大的大小而不能进入第一洗涤通道40,而非常小的细胞将进入细胞通道20且进一步流入至第一洗涤通道40中且流动至流量输出通道50。这些小细胞接着将通过第三流量端口51离开微流体装置1。
因此,大细胞将绝不会进入细胞通道20,而是被冲刷通过流量输入通道30且通过第二流量端口33出去。小细胞将不会保留在细胞通道20中,而是流动通过细胞通道和第一洗涤通道40并进一步通过流量输出通道50和第三输出端口51。因此,只有具有正确大小和尺寸的靶细胞将进入并陷在细胞通道20中。
可以基于应在微流体装置1中生长和被监测的特定类型的细胞来选择和设计细胞通道20和第一洗涤通道40的实际尺寸。
一般来说,通过在每一细胞通道20中添加细胞(诸如相应细胞株的细胞)来接种诸如细胞株文库的细胞。因而允许细胞沿着细胞通道20的长度按单层生长。在一实施方案中,每一细胞通道20因而含有单一细胞株和基因型的细胞。如果细胞通道20为一个细胞宽,那么细胞通道20中的细胞可以看作一串上的珍珠。如果细胞通道20较宽,那么细胞将在细胞通道20中形成2D层。
生长且迁移经过细胞通道20的第一端22的细胞将进入流量输入通道30且因而被冲走。细胞通道20的相对的第二端24与第一洗涤通道40连通,第一洗涤通道40被设计尺寸以防止细胞从细胞通道20的第二端24逃逸并进入第一洗涤通道40中。
在一实施方案中,第一洗涤通道40沿着其整个长度(即,从与细胞通道20的第二端24连通的第一端42至与流量输出通道50连通的第二端44)可以具有小尺寸。在替代实施方案中,第一洗涤通道40包括通道限制,通道限制具有对于细胞通道20中存在的细胞来说太小或太窄而使其不能生长或流动经过通道限制并进入第一洗涤通道40中的尺寸。这个通道限制则存在于第一洗涤通道40的第一端42处。在这个实施方案中,第一洗涤通道40的剩余部分可以具有与细胞通道20基本上相同的尺寸。因此,通道限制对细胞来说是有效阻塞或堵塞,但允许培养基和任何化学品、试剂或制剂流动通过通道堵塞并进一步进入第一洗涤通道40和流量输出通道50中。
这些实例实施方案都实现了防止细胞通道20中存在的具有目标大小的细胞生长或流动经过细胞通道20的第二端24并进入第一洗涤通道40中的所要效应。
在一实施方案中,见图3,多个在空间上界定且分开的细胞通道20的每一细胞通道20沿着其纵向侧26、28中的至少一者与相应的第二洗涤通道60侧接,第二洗涤通道60具有与流量输入通道30流体连通的第一端62和与流量输出通道50流体连通的第二端64。第二洗涤通道60的尺寸太小而不能容纳细胞。
在这个实施方案中,每一细胞通道20具有至少一个第二洗涤通道60,第二洗涤通道60与细胞通道20流体连通且沿着其纵向侧26、28中的一者布置。如图3所示的实施方案具有沿着每一细胞通道20的两个纵向侧26、28布置的第二洗涤通道60。
在一实施方案中,第一洗涤通道40和第二洗涤通道60可以互连,进而在细胞通道20周围形成连续的洗涤层,如图3所示。因此,第二洗涤通道60的从细胞通道20的第二端24到第二洗涤通道60的第二端64的一部分可以与相邻的第一洗涤通道40互连。
第二洗涤通道60(或洗涤层)的尺寸(诸如深度或高度)太小而不能容纳细胞。这意味着细胞通道20中存在的细胞不能进入相邻的第二洗涤通道60中,而是将保留在细胞通道20中。
图4是图3中的微流体装置1沿着线A-A的截面图。这个图清楚地图示了第二洗涤通道60与细胞通道20相比的比较小的深度。第二洗涤通道60可以具有任何截面配置,诸如正方形、矩形、圆形、U形等。
在特定实施方案中,第一洗涤通道40和洗涤通道60在衬底10中具有相同的深度。
细胞通道20在从流量输入通道30处的第一端22行进至其第二端24时优选地具有基本上相同的深度。这个深度优选地对应于或稍大于细胞直径以允许细胞在细胞通道20中呈单层。在细胞通道20的第二端24处,当进入从细胞通道20的第二端24延伸至流量输出通道50的第一洗涤通道40时,深度将较浅。优选地小于细胞直径的这个较浅的深度防止细胞通道20中存在的细胞进入第一洗涤通道40。
在如图3和图4所示的实施方案中,衬底10优选地包括延伸穿过衬底10的整个厚度以便增加其稳定性的结构或部分15。图3和图4图示了呈柱子形式的这类结构15,其沿着细胞通道20的纵向长度提供于第二洗涤通道60中的一些之间。这些柱子15可以具有任何形状,只要它们支撑洗涤层且允许流体流动。它们可以例如是矩形的、星形的、圆形的或三角形的且规则地或不规则地定位。这些结构15可以是如图中所示的单独结构以促进流体流动通过整个洗涤层,即第二洗涤通道60之间。在替代方法中,图中所示的每一列柱子形成在流量输入通道30与流量输出通道50之间的整个长度上方延伸的单一结构。这种解决方案可以得到更稳定的衬底10,但是却以较低效的流体流动为代价。
细胞通道20以及第一洗涤通道40和第二洗涤通道60优选地为开放通道,如图2和图4所示。这意味着盖板70优选地位于衬底10上以形成细胞通道20以及第一洗涤通道40和第二洗涤通道60的盖子并密封细胞通道20以及第一洗涤通道40和第二洗涤通道60。盖板70因而布置在衬底10的主表面12上。
下文是对微流体装置1的操作的简短描述。
在细胞装载期间,细胞与培养基进入第一流体端口31或第二流体端口33且流入至流量输入通道30中。在优选实施方案中,所有流体端口31、33、51都是开放的以允许培养基和细胞被推进细胞通道20中。过量细胞或太大而不能适应细胞通道20的细胞通过第二流体端口33或第一流体端口31被冲出,这是因为细胞通道20和第二洗涤通道60(如果存在的话)的深度太浅而不允许细胞到达流量输出通道50并到达第三流体端口51。培养基从第二流体端口33或第一流体端口31和第三流体端口51两者离开微流体装置1。微流体装置1的大小选择能力可以用以在细胞通道20中接种例如与例如显著较大的血细胞分开的细菌。
在微流体装置1的操作期间,培养基如上文所描述进入第一流体端口31。在第一实施方案中,第二流体端口33和第三流体端口51是开放的。这意味着培养基将不仅通过第二流体端口33而且还通过第三流体端口51离开。这意味着培养基、测试剂和试剂将有效地到达细胞通道20内的所有细胞。过量细胞将流入至流量输入通道30中且从第二流体端口33进一步流出,而培养基流过所有细胞且流入至流量输出通道50中且从第三流体端口51流出以保持向所有细胞供应新鲜的培养基或试剂。
在第二实施方案中,第三流体端口51是封闭的,使得培养基和过量细胞都通过第二流体端口33离开。这个实施方案与第一实施方案相比大体上实现细胞培养基较低效地流过细胞通道20中的细胞。
在生长、洗涤和反应步骤中,第三流体端口51优选地是开放的。这意味着培养基、洗涤流体或液体和具有反应试剂的溶液进入第一流体端口31且朝流量输出通道50和第三流体端口51流动通过流量输入通道30、细胞通道20和第一洗涤通道40(和任选的第二洗涤通道60)。在另一实施方案中,第二流体端口33在生长、洗涤和步骤期间是开放的。在这种情况下,培养基、洗涤流体或液体和具有反应试剂的溶液可以通过第三流体端口51或第二流体端口33离开。
图6图示了具有多组(即,至少两组)2A、2B、2C、2D细胞通道20和第一洗涤通道40的微流体装置1的实施方案,所述多组细胞通道20和第一洗涤通道40共享共同的第二流体端口33和第三流体端口51,但具有单独的(即,个别的)第一流体端口31A、31B、31C、31D。这意味着与另一组2B、2C、2D细胞通道20中存在的细胞相比,可以将不同的培养基和/或试剂或化学品输入至其中一组2A细胞通道20中存在的细胞。
因此,在一实施方案中,微流体装置1的衬底10具有多组2A、2B、2C、2D多个在空间上界定且分开的细胞通道20、多个流量输入通道30A、30B、30C、30D和多个流量输出通道50A、50B、50C、50D。多个组2A、2B、2C、2D中的每一组2A、2B、2C、2D中的多个在空间上界定且分开的细胞通道20的相应的第一端22与多个流量输入通道30A、30B、30C、30D的相应的流量输入通道30A、30B、30C、30D流体连通。多个组2A、2B、2C、2D中的每一组2A、2B、2C、2D中的第一洗涤通道40的相应的第二端44与多个流量输出通道50A、50B、50C、50D的相应的流量输出通道50A、50B、50C、50D流体连通。
多个流量输入通道30A、30B、30C、30D的每一流量输入通道30A、30B、30C、30D的相应的第一端32A、32B、32C、32D与相应的第一流体端口31A、31B、31C、31D流体连通。对应地,多个流量输入通道30A、30B、30C、30D的每一流量输入通道30A、30B、30C、30D的相应的第二端34A、34B、34C、34D与共同的第二流体端口33流体连通。此外,多个流量输出通道50A、50B、50C、50D的每一流量输出通道50A、50B、50C、50D与共同的第三流体端口51流体连通。
图6的微流体装置1仅仅应看作具有多组(即,至少两组)2A、2B、2C、2D细胞通道20的实例实施方案。这意味着微流体装置1的变型可以具有拥有M个这种组的衬底,且其中M是大于或等于2的整数值。
图7示意性地图示了使用图6的微流体装置1的实施方案。在一实施方案中,在装载期间,细胞和培养基进入第二流体端口33,其中培养基通过第三流体端口51和通过不同的第一流体端口31A、31B、31C、31D流出。过量细胞通过第一流体端口31A、31B、31C、31D流出。在另一实施方案中,细胞通过个别的第一流体端口31A、31B、31C、31D进入,其中过量细胞通过共同的第二端口33离开且培养基通过共同的第二流体端口33和共同的第三流体端口51离开。
在微流体装置1的操作期间,培养基优选地进入单独的第一流体端口31A、31B、31C、31D,因而允许不同的培养基到达不同组2A、2B、2C、2D的细胞通道20和第一洗涤通道40。过量细胞通过共同的第二流体端口33被冲出,且培养基从共同的第三流体端口51而且也通过共同的第二流体端口33流出。
如果相同的培养基将用于所有组2A、2B、2C、2D的细胞通道20且无需将化学品、试剂或其它制剂个别地添加至不同组2A、2B、2C、2D,那么培养基可以替代地从共同的第二流体端口33且朝共同的第三流体端口51和单独的第一流体端口31A、31B、31C、31D流动。
图10示意性地图示了上文结合图6和图7描述的微流体装置1的变型。在这个实施方案中,多个流量输入通道30A、30B、30C的每一流量输入通道30A、30B、30C的相应的第一端32A、32B、32C与多个相应的第一流体端口31A、31A'、31B、31B'、31C、31C'流体连通。多个流量输入通道30A、30B、30C的每一流量输入通道30A、30B、30C的相应的第二端34A、34B、34C与多个共同的第二流体端口33A、33B、33C流体连通。
这意味着在这个实施方案中,每一流量输入通道30A、30B、30C与多个单独的第一流体端口31A、31A'、31B、31B'、31C、31C'和多个共同的第二流体端口33A、33B、33C流体连通。多个共同的第二流体端口33A、33B、33C因而被所有组2A、2B、2C的细胞通道共享,而细胞通道的每一个这类组2A、2B、2C具有其自己的多个第一流体端口群组31A、31A';31B、31B';31C、31C'。
每一组2A、2B、2C细胞通道使用多个第一流体端口31A、31A'、31B、31B'、31C、31C'且使用多个共同的第二流体端口33A、33B、33C使得同一个微流体装置1能够在不同模式下操作。
第一个这类操作模式涉及使用多个特定的细胞株。在这种情况下,在微流体装置1中第一流体端口31A、31B、31C(或31A'、31B'、31C')中装载不同的细胞株,其中共同的第二流体端口33A、33B、33C中的至少一者作为过量细胞的出口,而培养基通过共同的第三流体端口51和开放的共同的第二流体端口33A、33B、33C离开微流体装置1。在操作期间,培养基和任何试剂、化学品或制剂在装载期间从共同的第二流体端口33A、33B、33C中的不用于废细胞的至少一者流入,且通过共同的第三流体端口51和第一流体端口31A'、31B'、31C'(或31A、31B、31C)离开微流体装置1。
在特定优选实施方案中,使用每一第一流体端口对31A、31A'、31B、31B'、31C、31C'中的一个第一流体端口31A、31B、31C作为装载期间的细胞和培养基输入端口且将每一第一流体端口对31A、31A'、31B、31B'、31C、31C'中的另一流体端口31A'、31B'、31C'作为操作期间的培养基输出端口是优选的。对应地,使用多个共同的第二流体端口33A、33B、33C中的一个共同的第二流体端口33A作为装载期间的细胞和培养基输出端口且将另一共同的第二流体端口33C作为操作期间的培养基和试剂、化学品或制剂输入端口是优选的。这种方法降低了污染各个流体端口的风险,且具体地说降低了使操作期间使用的培养基和试剂、化学品或制剂被装载期间添加的培养基和细胞污染的风险。
第二种操作模式涉及使用单一细胞株或细胞株文库。在这种情况下,使用相应的第一流体端口31A'、31B'、31C'(或31A、31B、31C)作为过量细胞和培养基的输出端口且使用共同的第三流体端口51作为培养基的输出端口通过至少一个(优选地一个)共同的第二流体端口33A装载细胞株或细胞株文库的细胞。在操作期间,可以在另一相应的第一流体端口31A、31B、31C(或31A'、31B'、31C')处输入不同的培养基和/或不同的试剂、化学品或制剂。接着将共同的第二流体端口33B、33C中的至少一者和共同的第三流体端口51用作不同的培养基和/或不同的试剂、化学品或制剂的输出端口。
在特定实施方案中,多个流量输入通道30A、30B、30C的每一流量输入通道30A、30B、30C的相应的第二端34A、34B、34C通过相应的互连通道36A、36B、36C与共同的第二流体端口33A、33B、33C流体连通。在一实施方案中,每一相应的互连通道36A、36B、36C具有基本上相同的通常长度。
因此,在一实施方案中,从流量输入通道30A、30B、30C的每一相应的第二端34A、34B、34C到共同的第二流体端口33(见图6)或端口33A、33B、33C(见图10)的通道距离优选地对于每一组2A、2B、2C细胞通道都相同。这意味着互连通道36A、36B、36C用以补偿相应的流体输入通道30A、30B、30C与共同的第二流体端口33A、33B、33C之间的在衬底10上的物理距离的差异,如图10所示。这个相同的距离针对每一组2A、2B、2C细胞通道将流量上的压力保持相同。
图11示意性地图示了图10所示的微流体装置的存在于框A中的部分的放大。对应地,图12示意性地图示了图11所示的微流体装置的存在于框B中的部分的放大。这个图12图示了微流体装置的两个任选的但优选的特征。
首先,每一细胞通道20优选地具有相应的通道标识符11。图12将通道标识符11图示为各个细胞通道20的相应的通道编号。举例来说,对于具有10,000(或9,999)个细胞通道20的微流体装置1,可以将细胞通道20从0000(或0001)编号至9999。除了编号之外的其它标识符号可以用作通道标识符11。
因此,在一实施方案中,见图9和图12,微流体装置的衬底10包括用于多个在空间上界定且分开的细胞通道20中的每一在空间上界定且分开的细胞通道20的相应的通道标识符11。相应的通道标识符11通过成像可见。
每一细胞通道20具有相应的通道标识符11不是绝对必要的。因此,在一实施方案中,衬底10包括用于多个在空间上界定且分开的细胞通道20中的至少每第N个在空间上界定且分开的细胞通道20的相应的通道标识符11。参数N可以具有等于或大于1的任何整数值,诸如1、2、5、10、20、25、30、40、50、60、70、80、90或100作为非限制性而是说明性的实例。
因此,通道标识符11优选地使用例如显微镜或成像装置在视觉上可读,所述成像装置拍摄微流体装置1的细胞通道20中存在的细胞的照片或记录所述细胞的视频。这意味着给定细胞通道20中存在的细胞可以通过通道标识符11来识别。
第二,微流体装置优选地包括参考通道21,见图8和图12。举例来说,对于某一定义的整数值n,衬底10中的每第n个细胞通道20可以被参考通道21取代。或者,第一个和/或最后一个细胞通道20可以呈参考通道21的形式。进一步变型是在衬底10中某一(某些)其它选定的细胞通道位置具有一个或多个参考通道21。
参考通道21被设计用来防止细胞进入参考通道21并在参考通道21内生长。这可以通过使参考通道21的尺寸对细胞来说太小而使其不能进入参考通道21来实现。或者,在参考通道21的端部处或附近可以存在通道限制。这类通道限制因而防止细胞进入参考通道21,但仍允许培养基和任何化学品、试剂或制剂进入并流动通过参考通道21。
可以使用参考通道21以便获得诸如在微流体装置和其中存在的细胞的成像期间的背景、控制或参考数据。举例来说,可以将具有特定荧光性质或吸收性质的化学品添加至细胞以便确定或监测细胞的特定特性。在这种情况下,从参考通道21获得的荧光性或吸收性记录可以在确定不同细胞通道20中的荧光性或吸收性时用作背景或控制参考。因此,参考通道21可以用于背景减除目的。另一实例是当使用相差显微镜监测细胞时,在这种情况下参考通道的特性相差图像可以用来解释非细胞背景。
图8图示了这类参考通道21的实施方案。在这个实施方案中,衬底10具有布置在多个在空间上界定且分开的细胞通道20中的两个相邻的在空间上界定且分开的细胞通道20之间且与所述两个相邻的在空间上界定且分开的细胞通道20基本上平行的至少一个参考通道21。至少一个参考通道21的相应的第一端23与流量输入通道30流体连通且包括细胞阻塞物27,细胞阻塞物27被布置用来防止细胞从相应的第一端23进入至少一个参考通道21。至少一个参考通道21的相应的第二端25与相应的第一洗涤通道40的第一端42流体连通,第一洗涤通道40具有与流量输出通道50流体连通的第二端44。
在这个实施方案中,参考通道21关于延伸部分和尺寸与细胞通道20基本上相同,但有一个主要差异。参考通道21在其相应的第一端23包括细胞阻塞物27。这个细胞阻塞物27可以呈通道限制或尺寸比参考通道21的其余部分小的通道部分的形式。将通道限制或较小尺寸部分选择为对于本可进入细胞通道20的细胞来说太小或太窄。因此,这些细胞不能从第一端23进入参考通道21。参考通道21的第二端25与细胞通道20一样与相应的第一洗涤通道40连通。这意味着细胞因为第一洗涤通道40的选定尺寸或大小而不能从第二端25进入参考通道21。
图12图示了参考通道21的另一实施方案。在这个实施方案中,衬底10具有布置在多个在空间上界定且分开的细胞通道20中的两个相邻的在空间上界定且分开的细胞通道20之间且与所述两个相邻的在空间上界定且分开的细胞通道20基本上平行的至少一个参考通道21。至少一个参考通道21的相应的第一端23与流量输入通道30A流体连通且包括通道限制29,通道限制29被布置用来防止细胞从相应的第一端23进入至少一个参考通道21。至少一个参考通道21的相应的第二端25与流量输出通道50A流体连通且包括通道限制29,通道限制29被布置用来防止细胞从相应的第二端25进入至少一个参考通道21。
在这个实施方案中,每一参考通道21因而包括两个通道限制29,在参考通道21的每一端23、25处或附近有一个通道限制29。参考通道21的剩余部分的尺寸因此可以与细胞通道20的尺寸基本上相同。
在上述实施方案中,将参考通道21描述为布置在两个相邻的细胞通道20之间。在另一实施方案中,参考通道21可以存在于一组2A细胞通道20的任一端,使得其沿着其两个纵向侧中的一者没有细胞通道20。使两个参考通道21布置成彼此相邻也是可能的。
然而,一般来说,诸如通过使参考通道21处于衬底10中每第n个通道位置处来使参考通道21均匀地分布在一组2A细胞通道内是优选的。
图13是可以用于铸造实施方案的微流体装置的模具的SEM图像。图式将通道标识符示出为通道编号且示出了用以界定参考通道的通道限制和细胞通道与对应的第一洗涤通道之间的界面。
图14图示在两个不同的时间点拍摄的在根据实施方案的微流体装置中生长的大肠杆菌细胞的相差图像。第一洗涤通道的较小尺寸(诸如呈第一洗涤通道与细胞通道之间的界面处的通道限制的形式)有效地防止大肠杆菌细胞生长至图中左侧,即,进入第一洗涤通道。图式底部处的通道是空的参考通道。在参考通道任一端的双限制防止任何大肠杆菌细胞进入参考通道。通道标识符在相差图像中可见,因而使得能够识别个别细胞通道和在其中生长的大肠杆菌细胞。
微流体装置的衬底可以由任何透明材料(诸如塑料材料)制成,其中可以界定构成细胞通道、第一洗涤通道、第一流体端口、第二流体端口、流量输入通道、流量输出通道和第三流体端口的结构。合适的材料的非限制性实例包括和(它们是由ZEON Chemicals L.P.销售的环烯烃聚合物(COP))和(它们是由Topas Advanced Polymers销售的环烯烃共聚物(COC))。这些材料在透射性和背景荧光性方面具有极佳的光学特性。它们在加热时还具有良好的流动特性且因此可以复制小的结构,从而允许形成微流体装置的衬底。
衬底的合适的材料的其它实例包括玻璃、聚二甲基硅氧烷(PDMS)、聚甲基丙烯酸甲酯(PMMA)、聚碳酸酯(PC)、聚丙烯(PP)、聚四氟乙烯(PTFE)、聚对苯二甲酸乙二酯(PET)和聚对亚苯硫醚(PPS)。
图2和图4中图示的盖板可以用优选地为透明的以允许成像的各种材料制造。非限制性实例包括玻璃和塑料材料。
在操作中,微流体装置优选地连接至流体歧管以形成包括微流体装置和流体歧管的培养系统。流体歧管被配置用来使用至少一个计算机控制的泵将培养基和任何试剂、化学品或制剂分配至细胞通道。流体歧管优选地被配置用来使用计算机控制的和预编程的泵来实现培养基的改变,试剂、化学品或制剂的分配。在特定实施方案中,试剂、化学品或制剂和细胞培养基在整个实验中可以维持于不同温度。
图16是图示根据一实施方案的装载微流体装置的方法流程图。所述方法包括在步骤S1中在微流体装置的第一流体端口和第二流体端口中的一者中输入细胞和培养基以允许细胞和培养基流动通过微流体装置的流量输入通道且流入至多个在空间上界定且分开的细胞通道中。多个在空间上界定且分开的细胞通道的相应的第一端与流量输入通道流体连通,流量输入通道具有与第一流体端口流体连通的第一端和与第二流体端口流体连通的第二端。下一步骤S2包括通过第一流体端口和第二流体端口中的另一者输出过量细胞且步骤S3包括通过第一流体端口和第二流体端口中的另一者和通过与流量输出通道流体连通的第三端口输出培养基。多个在空间上界定且分开的细胞通道的相应的第二端与相应的第一洗涤通道的第一端流体连通,第一洗涤通道具有与流量输出通道流体连通的第二端。第一洗涤通道的尺寸太小而不能容纳细胞。
步骤S2和S3大体上在输入的细胞和培养基进入微流体装置和其各个通道的同时发生。
实施方案的微流体装置可以用于各种应用。这类应用的实例是抗生素敏感性测试(AST)。举例来说,图10所示的微流体装置1可以用于这个目的。在这种情况下,可以使用第一流体端口31A'、31B'、31C'作为过量细胞和培养基的输出端口且使用共同的第三流体端口51作为培养基的输出端口且用于将细胞吸入至细胞通道中从例如共同的第二流体端口33A装载样品株。在一实例中,在装载期间,使培养基从共同的第二流体端口33C流动至共同的第二流体端口33B以防止污染共同的第二流体端口33C。在细胞装载之后,培养基优选地使用第一流体端口31A'、31B'、31C'和共同的第三流体端口51作为输出端口从共同的第二流体端口33C流动。在这个阶段,可以在某一时间(0分钟至几天)内监测细胞通道中的细胞的生长,同时对不同细胞通道中的细胞成像。AST测试通过使用第一流体端口31A、31B、31C作为输入端口,同时使用共同的第二流体端口33A、33B、33C和共同的第三流体端口51作为输出端口来使不同的抗生素或相同的抗生素但以不同浓度流入至不同组2A、2B、2C的细胞通道中而开始。通过对不同细胞通道中的抗生素的表型响应来监测敏感性。举例来说,仅仅通过使用自动图像分析例程监测相差中的长度延伸来确定平均生长速率和细胞间的生长速率分布是可能的。可以对许多细胞通道中的细胞取这些测量结果的平均值,使得有可能在几分钟内确定细微的表型改变。表型改变也可以是形态改变,诸如DNA的紧缩或薄膜结构或在完整性方面的改变。一些表型改变通过添加可在荧光通道中被监测的测试剂,诸如4',6-二脒基-2-苯基吲哚(DAPI)和荧光染色剂而被最佳地研究。
表型AST之后可以是原位基因分型测试,其中通过例如荧光原位杂交(FISH)、原位测序或恒温扩增使用例如环介导恒温扩增(LAMP)或一个或多个特定锁式探针的杂交或连接,后接滚环扩增(RCA)来确定显著基因的存在、不存在或充裕、DNA序列或RNA物种。
图15是在AST测试期间拍摄的微流体装置的相差图像,在AST测试中在对应于图10的微流体装置的不同的细胞通道中装载了氯霉素敏感(最小抑菌浓度(MIC)≈4μg/ml)和氯霉素抗性(MIC>12μg/ml)大肠杆菌菌株。在细胞装载之后,两种菌株都暴露于6μg/ml的氯霉素。隔开15分钟拍摄的图像清楚地示出氯霉素敏感菌株与氯霉素抗性菌株相比生长得少得多。
图17显示当将三种不同的大肠杆菌菌株装载至对应于图10的微流体装置1中的相应的一组2A、2B、2C细胞通道20中时,所述三种菌株在暴露于120μg/ml的红霉素时在时间0分钟时的平均生长速率。由“x”指示的抗性菌株具有256μg/ml的MIC,而由圆圈和菱形指示的非抗性菌株具有MIC~12μg/ml。图式清楚地示出可以在20分钟内将抗性菌株与敏感菌株区别开来。
图18显示如通过对大肠杆菌菌株的相差延时成像确定的平均生长速率响应,所述大肠杆菌菌株对装载至对应于图1的微流体装置1中的相应的几组2A、2B、2C细胞通道20中的环丙沙星具有抗性(DA20859Eco gyrA1-S83L gyrA2-D87N parC-S80I MIC~30μg/ml)。大肠杆菌菌株暴露于(1)用“x”标记的无药物,(2)用菱形标记的120μg/ml的红霉素,或(3)用圆圈标记的10μg/ml的环丙沙星。时间点0分钟对应于处理的开始。可以在10分钟内将与借助菌株敏感的药物(红霉素)进行的处理对应的曲线和无处理的曲线区别开来。可以在15分钟内将与借助菌株敏感的药物进行的处理对应的曲线和与菌株有抗性的药物(环丙沙星)对应的曲线区别开来。
因此,实施方案涉及一种用于抗生素敏感性测试的方法。所述方法包括将细菌细胞装载至根据实施方案的微流体装置的多个在空间上界定且分开的细胞通道中。所述方法还包括将所述多个在空间上界定且分开的细胞通道的不同的在空间上界定且分开的细胞通道中的细菌细胞暴露于不同的抗生素和/或不同浓度的抗生素。所述方法进一步包括基于细菌细胞在多个在空间上界定且分开的细胞通道中的相应的表型特性来确定细菌细胞的抗生素敏感性。
因此,监测和确定细菌细胞的相应表型特性且其中这个表型特性代表细菌细胞的抗生素敏感性。在优选实施方案中,表型特性优选地为细菌细胞在多个在空间上界定且分开的细胞通道中的相应生长速率、相应的类核紧缩程度、相应的代谢活动程度和相应的薄膜完整性程度中的至少一者。
实施方案的微流体装置可以用于培养和监测各种类型的细胞,包括但不限于细菌细胞、古细菌细胞、真核细胞(诸如酵母细胞)、哺乳动物细胞、人类细胞等。
实施方案的微流体装置可以用于表征细胞,诸如细胞株的文库。表征可以是确定细胞株的至少一个表型特性和/或对细胞株的遗传物质进行原位基因分型的形式。共同待决的专利申请第PCT/SE2015/050227号中公开了细胞株的文库的表型表征和原位基因分型的实例。具体地说,微流体装置接着允许将所监测的表型特性与经原位确定的基因型用高度并行的方式相联系。这意味着可以在微流体装置中并行地处理具有不同基因型的细胞株的大型文库,以便将所监测的表型特性与细胞株的不同基因型相联系。
可以根据基因组工程内的各种技术获得细胞株的文库。举例来说,多元自动化基因组工程(MAGE)可以用以每天产生几十亿个不同的突变基因组(Wang等人,Nature,2009,460:894-898)。可以用以创建细胞文库的其它技术包括成簇的规律间隔短回文重复序列(CRISPR)相关蛋白9(Cas9)(Wang等人,Science,2014,343:80-84;Koike-Yusa等人,Nature Biotechnology,2014,32:309–312;Zhou等人,Nature,2014,509:487–491)或大规模RNA干扰(Berns等人,Nature,2004,428:431-437)。
微流体装置接着允许将文库中的每一细胞株的细胞与其它细胞株或其它基因型的细胞分开地保存和培养。因此,每一细胞株在微流体装置中具有相应地在空间上界定且分开的细胞通道,细胞可以在所述微流体装置中生长和被研究。
在微流体装置中的在空间上界定且分开的细胞通道中培养的细胞可以优选地暴露于各种物理和/或化学刺激物或制剂而不会被涤除,以便监测细胞对物理和/或化学刺激物或制剂的响应。举例来说,各种化学测试剂(诸如营养物质、药物、抗生素、基因表达诱导物或阻遏物)可以添加至培养基中且因而与细胞接触。可以例如使用显微术确定细胞株在不同细胞株的细胞对各种测试剂的响应方面的表型特性。对应地,可以改变细胞所暴露于的温度、pH、压力、流量、气体、曝光量或机械应力且可以例如使用显微术确定不同细胞株的细胞对这类改变的物理条件的响应。
细胞株具有不同的基因型,如由在其遗传物质的至少一部分中具有不同的可变区所表示。可变区通常存在于细胞株的基因组中。或者,可变区存在于可移动的遗传因子(诸如质粒或载体)中,且因此不一定必须稳定地结合至细胞的基因组中。在以下内容中,主要讨论了关于基因组中存在的可变区的实施方案。然而,替代实施方案是可能的,其中本文中提到的可变区和其它DNA因子替代地存在于细胞株的质粒或其它可移动的遗传因子中。可变区或可变区的部分也可存在于不稳定的遗传因子(诸如转座子、病毒或噬菌体)中。这类编码有时将在固定细胞以用于原位测序之前扩增可变序列方面具有优点,例如通过在固定细胞之前从dsDNA基因组中特异性地切除或环化可变区的部分。
在一实施方案中,方法还包括在微流体装置的在空间上界定且分开的细胞通道中随机地接种细胞株的细胞。优选地执行细胞的随机接种,使得每一细胞通道仅仅包括同一基因型(即,同一细胞株)的细胞。
实施方案的优点在于无需在微流体装置中接种细胞之前确定和知道细胞的遗传同一性(即,基因型)。因此,就必须知道每一细胞株的遗传同一性和在整个方法中持续地监测每一基因型的位置来说,无需在接种之前对细胞文库中的细胞进行分类。这意味着本实施方案在清晰的对比下首先在不知道基因型的情况下并行地分析表型特性且接着确定基因型并将基因型与表型特性相联系。
针对文库中的每一细胞株确定的表型特性优选地是对应于文库中的每一基因型的表型特性。因此,文库中的细胞是具有不同基因型的遗传上不同的细胞,即,每个细胞株有相应的基因型。基因型的差异意味着细胞将具有对应于每一相应基因型的不同的表型特性。
在一实施方案中,使用显微术确定细胞的表型特性。用于监测和确定表型的显微术与现有技术相比具有若干优点。举例来说,荧光显微术允许多世代的细胞谱系的广泛延时、单分子检测灵敏度以及以任何方式监测对改变的生长条件的时间响应的可能性。
可以根据实施方案使用显微术监测和确定的表型特性的非限制性而是说明性的实例包括细胞形态、各种分子的空间和/或时间表达模式(诸如核糖核酸(RNA)或蛋白质)、特定代谢产物的水平、诸如响应于不同的物理或化学刺激物或制剂的添加的寿命或生长速率变化、细胞间的基因表达水平的变化、胚胎发育、报告蛋白或RNA适体的亮度等。
因此,如果需要,可以长时间在显微镜下并行地执行细胞株的表型表征。此外,表型表征是在不知道文库中的各种细胞株的基因型的情况下执行的。在清晰的对比下,表型表征替代地确定微流体装置中的每一在空间上界定且分开的细胞通道的相应表型特性。举例来说,假设将针对细胞株确定的相关表型特性是在添加测试剂之后对具有可变基因调节区或编码序列的荧光报告蛋白的靶基因的基因表达。在这种情况下,显微镜可以用以拍摄微流体装置的图像,在所述图像中可以在视觉上确定相应的基因表达水平。接着可以将每一个别基因表达水平量化,以获得微流体装置中的每一细胞通道的相应值。因此,表型表征的确定的输出可以是微流体装置中的每一细胞通道的一个或多个相应值的列表或矩阵。如果如本文中先前所描述为每一细胞通道分配相应的通道标识符,那么可以接着使针对细胞通道中的细胞测量的表型特性与分配给细胞通道的通道标识符相关联。
在一实施方案中,确定表型特性包括在微流体装置的细胞的培养期间使用显微术确定每一细胞株的表型特性。可以用于实施方案中的显微技术的实例包括例如亮视野显微术、相差显微术、荧光显微术、光片显微术或任何类型的超分辨率成像模式,诸如受激发射损耗(STED)显微术、光激活定位显微术(PALM)、近场扫描光学显微术(NSOM)、4Pi显微术、结构照明显微术(SIM)、基态损耗(GSD)显微术、光学间距精密显微术(SPDM)、随机光学重建显微术(STORM)。此外,还可以使用细胞内单粒子追踪(SPT)或荧光相关光谱(FCS)。显微镜分析可以在固定时间点或使用延时成像进行。
其它表型测量法也是可能的,诸如使用原子力显微术测量机械性质,使用指示剂染料或微电极测量薄膜电位,使用质谱成像或指定生物传感器阵列测量小分子分泌。将近场光学阵列检测器直接连接至培养装置也是可能的。
一旦已经确定了细胞株的表型特性,优选地将细胞固定在微流体装置的细胞通道中。可以根据本领域中熟知的技术执行细胞固定。举例来说,甲醛、甲醇或乙醇可以用于细胞固定。在非限制性实例中,将细胞用4%的甲醛固定大约15分钟或用3%(w/v)的多聚甲醛的磷酸盐缓冲盐水(PBS)固定大约30分钟。
在一实施方案中,将固定的细胞透化,然后再进行原位基因分型。可以根据实施方案使用传统上用于细胞透化的各种方案。举例来说,可以使用曲拉通X-100(诸如0.25%的曲拉通X-100)或另一表面活性剂,诸如非离子表面活性剂。或者,可以使用乙醇(诸如70%的乙醇)来进行细胞透化。其它实例包括盐酸,诸如(0.1M盐酸)任选地与蛋白酶(诸如胃蛋白酶,例如0.01%的胃蛋白酶)或溶菌酶组合来降解细菌细胞壁。
原位基因分型包括对微流体装置中的细胞通道中的每一细胞株的可变区的至少一部分进行原位基因分型。因此,对每一细胞株的整个可变区进行原位基因分型不是绝对必要的。因此,如本文中所使用的原位测序包括对可变区的至少一部分或实际上对整个可变区进行原位测序。原位测序优选地输出展示不同细胞株之间的可变区的任何核苷酸差异以及在何处这些核苷酸差异导致不同表型的信息。
在一实施方案中,原位基因分型是基于例如在Science,2014,343(6177):1360–1363中描述的荧光原位测序(FISSEQ)技术。简短地说,在FISSEQ中,在逆转录(RT)期间通过使用逆转录酶和结合氨基烯丙基脱氧尿苷5'-三磷酸盐(dUTP)来在固定的细胞中产生细胞内的cDNA扩增子。使用BS(PEG)9重新固定cDNA,BS(PEG)9是具有4nm间隔区的胺反应性连接物。接着将cDNA片段环化,之后进行滚环扩增(RCA)。接着使用BA(PEG)9来交联含有氨基烯丙基dUTP的RCA扩增子。接着可以使用SOLiD连接法测序来对RCA扩增子中的相关序列进行测序以获得可变区的核苷酸序列。
在一实施方案中,对可变区进行原位基因分型优选地包括对微流体装置中的细胞通道中的可变区或可变区的至少一部分进行原位连接法测序。连接法测序依赖于脱氧核糖核酸(DNA)连接酶对碱基对错配的敏感性。一般来说,将要测序的可变区优选地为单链DNA序列的形式,其在至少一端与将用作锚定引物结合序列的已知序列侧接。使与已知序列互补的锚定引物与已知序列结合。
接着根据将测序的位置引入、通常用荧光染料标记通常为八至九个碱基长的探针寡核苷酸的混合池。使这些标记的寡核苷酸与和锚定引物相邻的可变区杂交,并且当锚定引物的核苷酸序列与未知的可变区匹配时,DNA连接酶优选地将寡核苷酸连接到锚定引物。基于由分子产生的荧光,可以推断在可变区的这个位置处的碱基的同一性。
寡核苷酸探针还可以用可裂解的键来构建,可以在识别标记之后裂解所述可裂解的键。这将去除标记并在所连接探针的末端重新产生5'-磷酸根,从而使新一轮连接成为可能。此连接和裂解循环可以重复若干次以读取更长的序列。此技术对可变区中的每第Q个碱基进行测序,其中Q是裂解后留下的探针的长度。为了对可变区中的跳过位置进行测序,可以从可变区中去除锚定引物和连接的寡核苷酸,并用缩短一个或多个碱基的锚定引物开始另一轮连接法测序。
另一种技术是进行重复轮次的单一连接,其中标记对应于探针中的不同位置,随后去除锚定引物和连接的探针。
连接法测序可以在任一方向(5'-3'或3'-5')上进行,这取决于寡核苷酸探针的哪一端用标记封闭。
在一实施方案中,所测序的序列优选地是通过从可变区获得的RNA转录物的逆转录而获得的cDNA序列。在这个实施方案中,可变区侧接有锚定引物将结合至的至少一个已知序列。
可以对固定的细胞进行连接法测序以实现微流体装置中的细胞通道中的可变区或可变区的至少一部分的原位连接法测序,参见例如Science 2014,343:1360-1363和Nature Methods 2013,10:857-860,所述文献关于执行原位连接法测序的教导特此以引用方式并入。
简短地说,在一种变型中,通过在逆转录之后使用核糖核酸酶降解mRNA链,来将从可变区获得的RNA或条形码复制至cDNA。在第一实施方案中,锁式探针结合至cDNA,其中探针末端之间的缺口位于靶向用于连接法测序的碱基上。这个缺口通过DNA聚合和DNA连接填充以产生DNA环。在第二实施方案中,仅通过ssDNA连接进行cDNA环化。在第三实施方案中,用例如限制性内切酶或转座酶从周围DNA中切除包括可变序列的至少一部分和相邻DNA的dsDNA。接着可以用内切核酸酶将切除的dsDNA消化成ssDNA,以便自杂交并连接形成环状DNA。
在一变型中,从dsDNA(染色体的或可移动的遗传因子中的)直接扩增将要测序的可变区。在这种情况下,可以用靠近可变区的限制性内切酶来切割dsDNA且通过核酸外切酶使dsDNA为单链的。可以通过通常对cDNA起作用的方法来扩增这个ssDNA而无需表达RNA。这种方法减轻了设计可变区附近的DNA区的约束。举例来说,可以用缺口填充锁式反应来填充可变区。
作为缺口填充的替代方案,有可能使用相对长的可变区(10-25bp)且使一组ssDNA寡核苷酸与可变区杂交。选择寡核苷酸的结合能量,使得只有特定寡核苷酸在所选择的杂交和连接温度下结合。例如说文库含有编码在15bp的可变区中的4000个变体,15bp的可变区将允许415~109个变体,有可能挑出4000个变体使得不存在交叉杂交的探针。在寡核苷酸和锁式探针的杂交之后,将探针连接至可以扩增的环中。
在任一情况下,通过靶引导的滚环扩增(RCA)来扩增所形成的DNA环,从而产生滚环产物(RCP),所述RCP经受连接法测序。将锚定引物杂交在靶序列紧邻处,接着连接寡核苷酸探针。在一实施方案中,寡核苷酸探针由具有八个随机位置(N)和一个固定位置(A、C、G或T)的9聚体的四个文库组成。每个文库用四种荧光染料中的一种标记。将在固定位置具有最佳匹配的寡核苷酸探针与其荧光标记一起通过连接并入。对样品成像,并且每个RCP显示出对应于匹配碱基的颜色。涤除所述寡核苷酸探针,接着施加用于下一碱基的寡核苷酸探针。重复连接、洗涤、成像以及去除的步骤,直到已经读取了所需数目的碱基。
在另一实施方案中,原位基因分型包括对微流体装置中的细胞通道中的可变区或可变区的至少一部分进行原位合成法测序。
举例来说,添加含有阻碍进一步聚合的终止物的四种类型的经修饰dNTP。终止物还含有可以用相机检测到的荧光标记。涤除未并入的核苷酸并拍摄荧光标记的核苷酸的图像。从DNA中化学去除荧光标记以及终止物,以允许进行下一测序循环。
原位基因分型的结果优选地是每个细胞株的可变区或可变区的至少一部分的核苷酸序列。此外,每个核苷酸序列诸如通过使用通道标识符与微流体装置中的相应细胞通道相联系。这是可能的,因为基因分型是作为原位基因分型进行的,诸如原位连接法或合成法测序。原位在本文中意味着在原地或在适当位置处(即,在微流体装置中的细胞通道中)执行基因分型。
先前描述的表型分型的输出是微流体装置中的每一细胞通道的相应的确定的表型特性,诸如以列表或矩阵的形式列出针对由通道标识符识别的每一细胞通道确定的表型特性。原位基因分型的输出是针对微流体装置中的每一细胞通道处的可变区确定的核苷酸序列。这个输出还可以是列出针对由通道标识符识别的每一细胞通道确定的核苷酸序列的列表或矩阵的形式。
接着,可以基于微流体装置中的细胞通道使每一相应的表型特性与每一相应的基因型相联系或相关联。例如,针对细胞通道编号P处的细胞株的细胞确定的表型特性是这个细胞株的细胞的基因型的结果,并且这个基因型是从针对细胞通道编号P确定的核苷酸序列获得的。因此,表型和基因型的联系可以简单地通过将针对微流体装置中的每一细胞通道确定的表型特性和基因型进行匹配来实现。
在上述应用中,实施方案的微流体装置用于细胞株的文库的组合的表型和原位基因型确定。或者,微流体装置可以仅用于表型确定或仅用于原位基因型确定。因此,对装载至微流体装置中的细胞执行表型和原位基因型确定不是绝对必要的。
因此,实施方案的一方面涉及一种用于对细胞进行原位基因分型的方法。所述方法包括将细胞装载至根据实施方案的微流体装置的多个在空间上界定且分开的细胞通道中。所述方法还包括将细胞固定在多个在空间上界定且分开的细胞通道中。所述方法进一步包括对多个在空间上界定且分开的细胞通道中的细胞进行原位基因分型。
实施方案的另一方面涉及一种用于细胞的表型表征的方法。所述方法包括将细胞装载至根据实施方案的微流体装置的多个在空间上界定且分开的细胞通道中。所述方法还包括使细胞在多个在空间上界定且分开的细胞通道中生长或在多个在空间上界定且分开的细胞通道中培养细胞。所述方法进一步包括实时地监测细胞在多个在空间上界定且分开的细胞通道中的表型特性。
实施方案的另一方面涉及一种表征多个细胞株的文库的方法,所述多个细胞株在细胞株的遗传物质的至少一个部分中具有不同的可变区。所述方法包括将文库的细胞株的细胞装载至根据实施方案的微流体装置的多个在空间上界定且分开的细胞通道中。所述方法还包括使细胞株的细胞在多个在空间上界定且分开的细胞通道中生长或在多个在空间上界定且分开的细胞通道中培养细胞株的细胞。所述方法进一步包括优选地通过实时地监测细胞株的细胞在多个在空间上界定且分开的细胞通道中的相应的表型特性来确定微流体装置中的每一细胞株的表型特性。所述方法另外包括将细胞株的细胞固定在微流体装置的在空间上界定且分开的细胞通道中。所述方法进一步包括对微流体装置中的在空间上界定且分开的细胞通道中的每一细胞株的可变区进行原位基因分型。最后,所述方法包括基于微流体装置中的在空间上界定且分开的细胞通道,优选地基于微流体装置的衬底中的在空间上界定且分开的细胞通道的相应通道标识符或相应位置将每一相应的表型特性与每一相应的基因型相联系。
上述实施方案应理解为本发明的一些说明性实例。本领域技术人员将理解,可在不脱离本发明的范围的情况下对实施方案做出各种修改、组合和变化。具体地说,在技术上可能的情况下,不同实施方案中的不同部分解决方案可以组合在其它配置中。然而,本发明的范围由所附权利要求书界定。
- 还没有人留言评论。精彩留言会获得点赞!