工程化肾组织、其阵列及其制备方法与流程
相关申请的交叉引用
本申请要求于2014年10月6日提交的美国专利申请62/060,416和2015年3月30日提交的美国专利申请62/140,285的优先权,将其全部公开内容通过引用并入本文。
背景技术:
将新药推向市场的全部成本-从发现到临床试验到批准-通常是数亿甚至数十亿美元。这部分是因为研究的95%的实验药物在人类中不能有效和安全。肾毒性是临床试验阶段药物消耗的主要原因,该毒性的主要部位在近端小管内。
技术实现要素:
目前的体外肾毒性模型如单层上皮细胞和体内模型如活的啮齿动物(liverodents),不能有效预测药物在人体中的作用、毒性或代谢。例如,常规的肾细胞培养模型缺乏天然组织的复杂性,因此具有有限的预测组织水平反应的能力。此外,临床前动物试验的预测潜力受限于人与动物肾功能之间的物种特异性差异,包括对损伤的敏感性差异。需要的是具有天然样组织结构的工程化肾组织模型;具体为,具有空间组织的细胞以重现小管间质组织界面的层状结构的组织模型。这种工程化的肾组织模型将更能预测人的体内反应,并且可用于建模肾毒性,建模肾脏疾病(例如多囊肾病、感染性疾病、自身免疫性疾病、纤维化和由高血压或糖尿病引起的慢性肾脏疾病),和建模运输(例如,大分子的分泌和/或摄取)。
本文描述的工程化组织代表肾小管间质界面的模型,其中人肾间质组织支持人肾近端小管上皮细胞以促进其最佳形态和功能。创建三维小管间质界面有助于代谢所需的药物转运蛋白和受体的正确定位,以便准确地研究小分子、化学物质、污染物或生物制剂是如何影响肾近端小管的。这代表二维单层的人或犬肾上皮细胞的更生理学相关的替代物,并且用作(或在某些情况下)替代其中肾功能的物种差异阻碍结果的解释的动物研究的辅助物。
本文所述的工程化组织提供了精确研究化合物如何影响肾近端小管的机会,以及建模涉及小管运输,细胞-细胞相互作用,和例如可能发生在慢性肾脏疾病、多囊性肾脏疾病或ii型糖尿病的肾小管间质纤维化发展的致病过程。
本文提供三维工程化生物学肾小管模型,其包括:肾间质组织层,所述肾间质组织包含肾成纤维细胞和内皮细胞;和肾上皮组织层,所述肾上皮组织包含肾小管上皮细胞,所述肾上皮组织与所述肾间质组织层接触形成三维工程化生物学肾小管模型;条件是所述间质组织包含间质生物墨(bio-ink),所述上皮组织包含上皮生物墨,并形成三维工程化生物学肾小管模型。在某些实施方案中,所述肾间质组织层具有顶端表面和基底外侧表面。在某些实施方案中,所述肾上皮组织层与所述肾间质组织层的顶端表面接触。在某些实施方案中,所述肾上皮组织层基本上由肾小管上皮细胞组成。在某些实施方案中,所述肾上皮组织层基本上由原代肾小管上皮细胞组成。在某些实施方案中,所述原代肾小管上皮细胞分离自患有影响肾功能的疾病的受试者。在某些实施方案中,所述原代肾小管上皮细胞分离自患有多囊性肾病的受试者。在某些实施方案中,所述原代肾小管细胞分离自患有ii型糖尿病的受试者。在某些实施方案中,所述肾上皮组织层包含肾细胞癌细胞。在某些实施方案中,所述肾上皮组织层实质上是单层。在某些实施方案中,所述肾间质组织层实质上是单层。在某些实施方案中,所述肾上皮组织层与所述肾间质组织层连续接触。在某些实施方案中,所述肾上皮组织层与所述肾间质组织层的顶端表面接触并覆盖50%以上。在某些实施方案中,所述肾上皮组织层与所述肾间质组织层的顶端表面接触并覆盖70%以上。在某些实施方案中,所述肾上皮组织层与所述肾间质组织层的顶端表面接触并覆盖90%以上。在某些实施方案中,所述肾上皮组织层中细胞的至少50%与所述肾上皮组织层的另一个细胞形成紧密连接。在某些实施方案中,所述肾上皮组织层中细胞的至少70%与所述肾上皮组织层的另一个细胞形成紧密连接。在某些实施方案中,所述肾上皮组织层中细胞的至少90%与所述肾上皮组织层的另一个细胞形成紧密连接。在某些实施方案中,所述肾小管模型的厚度在50和500μm之间。在某些实施方案中,所述肾小管模型为约100μm厚。在某些实施方案中,所述肾上皮组织层还包含挤出化合物。在某些实施方案中,所述成纤维细胞和内皮细胞以约95:5至约5:95的成纤维细胞与内皮细胞之比存在于所述肾间质组织层中。在某些实施方案中,所述成纤维细胞和内皮细胞以约75:25至约25:75的成纤维细胞与内皮细胞之比存在于所述肾间质组织层中。在某些实施方案中,所述成纤维细胞和内皮细胞以约60:40至约40:60的成纤维细胞与内皮细胞之比存在于所述肾间质组织层中。在某些实施方案中,所述成纤维细胞和内皮细胞以约50:50的成纤维细胞与内皮细胞之比存在于所述肾间质组织层中。在某些实施方案中,所述肾间质组织层还包含分泌细胞。在某些实施方案中,所述肾间质组织层还包含免疫细胞。在某些实施方案中,所述肾间质组织层还包含挤出化合物。在某些实施方案中,所述肾间质组织层包含肾小球细胞。在某些实施方案中,所述模型在使用时基本上不含预先形成的支架。在某些实施方案中,所述肾成纤维细胞、内皮细胞和肾小管上皮细胞是哺乳动物细胞。在某些实施方案中,所述肾间质组织层或肾上皮组织层中的任一者为至少30体积%的活细胞。在某些实施方案中,所述肾间质组织层或肾上皮组织层中的任一者为至少70体积%的活细胞。在某些实施方案中,所述肾间质组织层或肾上皮组织层中的任一者为至少90体积%的活细胞。在某些实施方案中,所述肾小管模型实质上是平面的。在某些实施方案中,所述肾小管模型具有基本上均匀的厚度。在某些实施方案中,所述肾小管模型包括至少一种生物打印的组分。在某些实施方案中,所述肾小管模型包括至少一种通过挤出生物打印的组分。在某些实施方案中,所述肾小管模型还包括生物相容性膜。在某些实施方案中,所述肾小管模型还包括孔径大于约0.4μm的生物相容性膜。在某些实施方案中,所述肾小管模型还包括孔径为约1μm的生物相容性膜。在某些实施方案中,多个肾小管模型被配置为形成阵列。在某些实施方案中,多个肾小管模型被配置为允许每个肾小管模型之间的间隔在约20μm和约100μm之间。在某些实施方案中,间质或上皮生物墨还包含治疗性分子或物质。
本文还提供了制造三维工程化化生物学肾小管模型的方法,所述方法包括:制备肾间质生物墨,所述间质生物墨包含多种间质细胞类型,所述间质细胞类型包含肾成纤维细胞和内皮细胞;制备肾上皮生物墨,所述上皮生物墨包含肾小管上皮细胞;沉积所述肾间质生物墨和所述肾上皮生物墨,使得所述肾上皮生物墨在所述肾间质生物墨的层的至少一个表面上形成层;和使沉积的生物墨在细胞培养基中成熟以使细胞粘附来形成三维工程化生物学肾小管模型。在某些实施方案中,沉积所述肾间质组织生物墨形成具有顶端表面和基底外侧表面的肾间质组织层。在某些实施方案中,所述肾上皮生物墨与所述肾间质组织层的顶端表面接触沉积。在某些实施方案中,所述肾上皮生物墨基本上由肾小管上皮细胞组成。在某些实施方案中,所述肾上皮生物墨基本上由原代肾小管上皮细胞组成。在某些实施方案中,所述原代肾小管上皮细胞分离自患有影响肾功能的疾病的受试者。在某些实施方案中,所述原代肾小管上皮细胞分离自患有多囊性肾病的受试者。在某些实施方案中,所述原代肾小管上皮细胞分离自患有ii型糖尿病的受试者。在某些实施方案中,所述肾上皮生物墨包含肾细胞癌细胞。在某些实施方案中,所述肾上皮生物墨以单层沉积。在某些实施方案中,所述肾间质组织生物墨以单层沉积。在某些实施方案中,所述肾上皮组织层与肾间质组织层连续接触沉积。在某些实施方案中,所述肾上皮生物墨形成覆盖所述肾间质组织层的顶端表面的50%以上的层。在某些实施方案中,所述肾上皮生物墨形成覆盖所述肾间质组织层的顶端表面的70%以上的层。在某些实施方案中,所述肾上皮生物墨形成覆盖所述肾间质组织层的顶端表面的90%以上的层。在某些实施方案中,肾上皮层的肾上皮细胞的至少50%与其它肾上皮细胞形成紧密连接。在某些实施方案中,肾上皮层的肾上皮细胞的至少70%与其它肾上皮细胞形成紧密连接。在某些实施方案中,肾上皮层的肾上皮细胞的至少90%与其它肾上皮细胞形成紧密连接。在某些实施方案中,所述肾小管模型的厚度在50和500μm之间。在某些实施方案中,所述肾小管模型为约100μm厚。在某些实施方案中,所述肾上皮生物墨还包含挤出化合物。在某些实施方案中,所述成纤维细胞和内皮细胞以约95:5至约5:95的成纤维细胞与内皮细胞之比存在于所述肾间质生物墨中。在某些实施方案中,所述成纤维细胞和内皮细胞以约75:25至约25:75的成纤维细胞与内皮细胞之比存在于所述肾间质生物墨中。在某些实施方案中,所述成纤维细胞和内皮细胞以约60:40至约40:60的成纤维细胞与内皮细胞之比存在于所述肾间质生物墨中。在某些实施方案中,成纤维细胞和内皮细胞以约50:50的成纤维细胞与内皮细胞之比存在于所述肾间质生物墨中。在某些实施方案中,所述肾间质生物墨还包含分泌细胞。在某些实施方案中,所述肾间质生物墨还包含免疫细胞。在某些实施方案中,所述肾间质生物墨还包含挤出化合物。在某些实施方案中,所述肾间质生物墨包含肾小球细胞。在某些实施方案中,所述模型被制造为基本上不含预先形成的支架。在某些实施方案中,所述肾成纤维细胞、内皮细胞和肾小管上皮细胞是哺乳动物细胞。在某些实施方案中,所述肾间质生物墨或肾上皮生物墨中任一者在沉积后形成平面层。在某些实施方案中,所述肾小管模型具有基本上均匀的厚度。在某些实施方案中,所述方法还包括将所述肾间质生物墨沉积到生物相容性膜上。在某些实施方案中,所述方法还包括将所述肾间质生物墨沉积到孔径大于0.4μm的生物相容性膜上。在某些实施方案中,所述方法还包括将所述肾间质生物墨沉积到孔径为约1μm的生物相容性膜上。在某些实施方案中,所述方法包括三维工程化生物学肾小管模型沉积以形成阵列。在某些实施方案中,所述方法包括三维工程化生物学肾小管模型沉积以形成阵列,所述阵列被配置为允许每个肾小管模型之间的间隔在约20μm和约100μm之间。在某些实施方案中,所述肾间质生物墨为至少30体积%的活细胞。在某些实施方案中,所述肾间质生物墨为至少70体积%的活细胞。在某些实施方案中,所述肾间质生物墨为至少90体积%的活细胞。在某些实施方案中,所述肾间质生物墨通过挤出生物打印来沉积。在某些实施方案中,所述肾上皮生物墨通过喷墨生物打印来沉积。在某些实施方案中,所述肾小管模型的任何层在体外培养3天后的培养物中是具有活力的。在某些实施方案中,所述肾小管模型的任何层在体外培养10天后的培养物中是具有活力的。在某些实施方案中,间质或上皮生物墨还包含治疗性分子或物质。
本文还提供了评估治疗剂的肾毒性的方法,所述方法包括:制备肾间质生物墨,所述间质生物墨包含多种间质细胞类型,所述间质细胞类型包括肾成纤维细胞和内皮细胞;制备肾上皮生物墨,所述上皮生物墨包含肾小管上皮细胞;沉积所述间质生物墨和所述上皮生物墨,使得所述上皮生物墨在所述间质生物墨的至少一个表面上形成层;和使沉积的生物墨在细胞培养基中成熟以使细胞粘附来形成三维工程化生物学肾小管模型;使治疗剂与构建体接触;测量肾小管上皮细胞的活力或功能;和基于测量的肾小管上皮细胞的活力或功能评估治疗剂的肾毒性。在某些实施方案中,所述间质生物墨通过挤出生物打印来沉积。在某些实施方案中,所述上皮生物墨通过喷墨生物打印来沉积。在某些实施方案中,间质或上皮生物墨还包含治疗性分子或物质。
附图说明
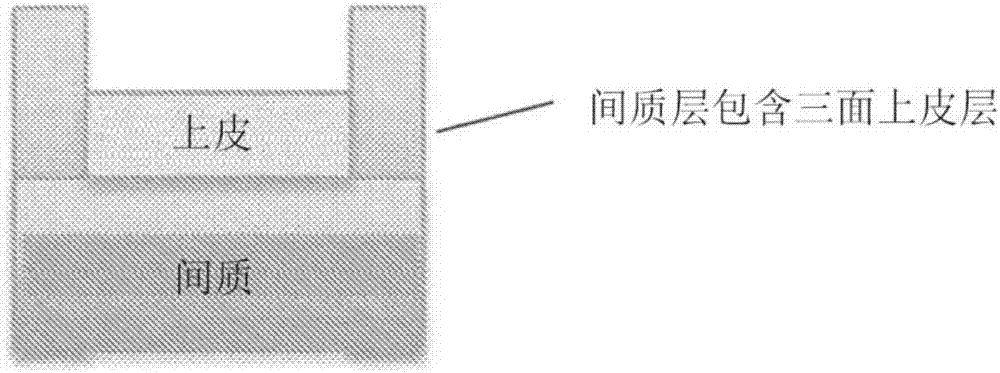
图1示出了示意性概念图的非限制性实例;在这种情况下,为示出了顶部为极化上皮单层的间质层的示意性概念图。
图2a和2b示出了示意性结构图的非限制性实例;在这种情况下,示出了实施例1的结构1的构造的示意性结构图(图2a);以及组织融合后48小时生物打印的肾小管模型的非限制性实例(图2b)。
图3a和3b示出了描述实施例1的结构1的显微照片的非限制性实例;在这种情况下,h&e染色(图3a:100x总放大倍率;图3b:200x总放大倍率)。
图4示出了实施例1的结构1的显微照片的非限制性实例;在这种情况下,用抗cd31(410)的抗体和显示huvec网络(430)的te7(420)染色。
图5示出了实施例1的结构1的低放大倍率下的显微照片的非限制性实例;染色是用针对围绕小管结构的e-钙粘蛋白(540)的抗体;和te7(520)。
图6a和6b示出了示意性结构图的非限制性实例;在这种情况下,示出了实施例2的结构2的构造的示意性结构图。
图7a和7b示出了描述实施例2的结构2的显微照片的非限制性实例;在这种情况下,h&e染色(黑色箭头表示上皮细胞)。
图8a和8b示出了描述实施例2的结构2的显微照片的非限制性实例;在这种情况下,显示内皮细胞的组织的显微照片(图8a)。显示了810,huvecs的cd31染色;和820,成纤维细胞的te7染色。在该实施例中,通过e-钙粘蛋白染色的组织的表面上检测到上皮细胞(图8b,840)。
图9显示了来自实施例3的构建体的显微照片,并描绘了呈现极化特征的3d肾组织中的近端小管上皮细胞(rptec)。在rptec之间的侧膜上观察到e-钙粘蛋白(940和亮染色),其对应于在紧密连接处的定位。还显示针对成纤维细胞的te7920染色。显示为低(图9a)、中(图9b)和高(图9c)放大倍数。
图10a和10b示出了来自实施例3的生物打印的肾组织构建体的h&e(图10a)和三色(图10b)染色。
图11a和11b示出了具有刷状缘(图11a,箭头)的图11的构建体,并且突出显示了胶原沉积(图11b,箭头)。
图12示出了来自实施例3的3d生物打印肾组织构建体中观察到广泛的内皮细胞网络。显示了cd31(内皮细胞,亮染色)和te7(成纤维细胞,1220)的染色。两旁是内皮细胞的假想内腔用(*)标记。
图13示出了与2dhtert-rptec和间质细胞单独相比,实施例3的3d生物打印肾组织中的ggt活性。图13显示与2d共培养物相比,培养中的3d肾小管模型的持续活力。
图14a、14b和14c示出了用包含不同比例的成纤维细胞与内皮细胞的间质层生物打印的肾小管模型的宏观视图。图14a显示90:10成纤维细胞与内皮细胞之比。图14b显示75:25成纤维细胞与内皮细胞之比。图14c显示50:50成纤维细胞与内皮细胞之比。
图15a,15b和15c示出了用包含不同比例的成纤维细胞与内皮细胞的间质层生物打印的肾小管模型的组织学。图15a显示90:10成纤维细胞与内皮细胞之比。图15b显示75:25成纤维细胞与内皮细胞的比例。图15c显示50:50成纤维细胞与内皮细胞之比。
图16a和16b示出了生物打印的肾小管模型的表面积和厚度均匀度数据。图16a示出了生物打印的肾小管模型的宏观视图。图16b显示了keyence表面映射数据。
图17a,17b,17c和17d显示了用不同量的内皮细胞和不同血清浓度生物打印的肾小管模型的组织学。图17a显示在无血清培养基中浓度为1.25×105个细胞/孔的上皮细胞。图17b显示在2%血清中浓度为1.25×105个细胞/孔的上皮细胞。图17c显示在2%血清中浓度为2.5×105个细胞/孔的上皮细胞。图17d显示在2%血清中浓度为5.0×105个细胞/孔的上皮细胞。
图18示出了使用两性霉素b的毒性试验比较了3d肾小管模型与标准2d共培养物模型的反应。
图19a和19b示出了使用3d肾小管模型的两性霉素b(ampb)毒性试验的实例。图19a显示了乳酸脱氢酶(ldh)释放测定。图19b显示了γ-谷氨酰转移酶(ggt)活性。
图20a,20b和20c描绘了对应于图19的来自用载体(图20a)、10μmampb(图20b)或50μmampb(图20c)处理的3d肾小管模型的组织学。箭头表示上皮层。
图21a,21b和21c示出了使用3d肾小管模型的顺铂毒性试验的实例。图。21a显示了活力的alamarblue测定。图21b显示γ-谷氨酰转移酶(ggt)活性。图21c显示乳酸脱氢酶(ldh)释放测定。
图22a,22b,22c和22d示出了对应于图21的来自用载体(图22a)、10μm顺铂(图22b)、50μm顺铂(图22c)和50ng/mltgfβ(图22d)处理的肾小管模型的masson的三色染色组织学。
图23a,23b和23c示出了使用3d肾小管模型比较原代和永生化内皮细胞的顺铂毒性试验的实例。图23a显示了活力的alamarblue测定。图23b显示γ-谷氨酰转移酶(ggt)活性。图23c显示乳酸脱氢酶(ldh)释放测定。
图24a和24b示出了孔径对生物打印的间质组织的影响。图24a示出了以0.4μm的孔径打印的间质组织。图24b示出了以1.0μm的孔径打印的间质组织。
图25a,25b和25c示出了组织学h&e染色培养中的3d肾小管模型的长期活力。图25a显示培养6天后的肾小管模型。图25b显示培养10天后的肾小管模型。图25c24b显示培养27天后的肾小管模型。
具体实施方式
本文提供三维工程化生物学肾小管模型,其包括:肾间质组织层,所述肾间质组织包含肾成纤维细胞和内皮细胞;和肾上皮组织层,所述肾上皮组织包含肾小管上皮细胞,所述肾上皮组织与所述肾间质组织层接触形成三维工程化生物学肾小管模型;条件是所述间质组织包含间质生物墨,所述上皮组织包含上皮生物墨,并形成三维工程化生物学肾小管模型。
本文还提供了制造三维工程化化生物学肾小管模型的方法,所述方法包括:制备肾间质生物墨,所述间质生物墨包含多种间质细胞类型,所述间质细胞类型包含肾成纤维细胞和内皮细胞;制备肾上皮生物墨,所述上皮生物墨包含肾小管上皮细胞;沉积所述肾间质生物墨和所述肾上皮生物墨,使得所述肾上皮生物墨在所述肾间质生物墨的层的至少一个表面上形成层;和使沉积的生物墨在细胞培养基中成熟以使细胞粘附来形成三维工程化生物学肾小管模型。
本文还提供了评估治疗剂的肾毒性的方法,所述方法包括:制备肾间质生物墨,所述间质生物墨包含多种间质细胞类型,所述间质细胞类型包括肾成纤维细胞和内皮细胞;制备肾上皮生物墨,所述上皮生物墨包含肾小管上皮细胞;沉积所述间质生物墨和所述上皮生物墨,使得所述上皮生物墨在所述间质生物墨的至少一个表面上形成层;和使沉积的生物墨在细胞培养基中成熟以使细胞粘附来形成三维工程化生物学肾小管模型;使治疗剂与构建体接触;测量肾小管上皮细胞的活力或功能;和基于测量的肾小管上皮细胞的活力或功能评估治疗剂的肾毒性。
某些定义
除非另有定义,本文使用的所有技术术语具有与本发明所属领域的普通技术人员通常理解的相同的含义。如在本说明书和所附权利要求中所使用的,单数形式“一个”、“一种”和“所述”包括复数形式,除非上下文另有明确规定。本文中任何所涉及的“或”旨在包括“和/或”,除非另有说明。
如本文所使用的,“阵列”意指包括空间排列以允许对一个样本进行多个测试、对多个样本执行一个或多个测试、或二者的多个元件的关联的科学工具。
如本文所使用的,“测定”意指用于测试或测量有机或生物样品(例如,细胞聚集体、组织、器官、生物体等)中物质(例如化学品、分子、生物化学品、蛋白质、激素或药物等)的存在或活性的程序。
如本文所使用的,“层”意指x和y平面中的细胞以一个或多个细胞厚度的缔合。在一些实施方案中,本文所述的肾小管包括一层。在其它实施方案中,本文所述的肾小管包括多层。在各种实施方案中,层形成连续的、基本上连续的、或不连续的细胞片。在一些实施方案中,本文所述的每层肾小管包含x、y和z轴中的多个细胞。
如本文所使用的,“组织”意指细胞的聚集体。
如本文所使用的,“生物墨”意指用于生物打印的液体、半固体或固体组合物。在一些实施方案中,生物墨包含细胞溶液、细胞聚集体、含细胞的凝胶、多细胞体或组织。在一些实施方案中,生物墨还包括提供能够进行生物打印的特定生物力学性质的非细胞材料。在一些实施方案中,生物墨包含挤出化合物。在一些情况下,将挤出化合物工程化为在生物打印过程之后被去除。在其它实施方案中,挤出化合物的至少一些部分保持夹带有打印后的细胞并且不被去除。间质生物墨包含至少一种间质来源的细胞,例如成纤维细胞、间充质细胞或被诱导具有间质特征的多能细胞。上皮生物墨包括至少一种上皮细胞类型,包括近端小管的细胞。
如本文所使用的,“生物打印”意指通过与自动化或半自动化的计算机辅助三维原型设计设备(如生物打印机)相兼容的方法来利用细胞(例如,细胞溶液、含细胞的凝胶、细胞悬浮液、细胞浓缩液、多细胞聚集体、多细胞体等)的三维精确沉积。合适的生物打印机包括来自organovo,inc.(sandiego,ca)的novogen
如本文所使用的,“支架”意指合成支架,例如聚合物支架和多孔水凝胶,非合成支架如预先形成的细胞外基质层、死细胞层和脱细胞组织,以及任何其它类型的预先形成的支架,其与工程化组织的物理结构一体化,并且不能在不损坏/破坏组织下从所述组织移除。在进一步的实施方案中,脱细胞组织支架包括脱细胞化的天然组织或由培养细胞以任何方式产生的脱细胞化细胞材料;例如,允许死亡或脱细胞化的细胞层,留下他们存活时产生的ecm。因此,术语“无支架”意在意味着预先形成的支架不是使用时的工程化组织的不可分割的部分,或已被去除或作为工程化组织的惰性组分保留。“无支架”与“不含支架”和“不含预先形成的支架”互换使用。
如本文所使用的,“受试者”是任何哺乳动物物种的生物体,包括但不限于人,灵长类动物,猿,猴,狗,猫,小鼠,大鼠,兔,猪,马等。受试者可以是活的或死亡的任何哺乳动物物种。受试者包括最近死亡的受试者或取自活受试者的活检样本。
本文所用的“治疗性物质”意指被批准用于治疗疾病(根据对治疗疾病的调查)或者引起生物反应如dna、rna、肽、多肽或蛋白质变化的任何分子、生物学、化合物或组合物。
如本文所使用的,“活力”意指由至少一种活力试验确定的生物墨或组织层中的至少50%、60%、70%、80%、90%、95%、97%以上的细胞是活的。活力试验是本领域已知的,并且包括但不限于活体染料,凋亡标记染色,tunel染色,dna断裂分析,alamarblue染色,功能测定等。
肾小管模型的组成
在一些实施方案中,组织内的细胞在空间上组织以重现小管-间质组织界面的层状结构;在包括基于内皮细胞的微血管网络的肾间质组织层的顶部上存在极化的小管上皮。特化的细胞,如epo产生细胞,任选地包括在管周间隙内。在一些实施方案中,上皮具有或产生刷状缘。
在特定的非限制性实施方案中,本文所述的工程化肾组织包括两个主要部分:1)由成年肾成纤维细胞和人脐静脉内皮细胞(huvec)组成的间质层;和2)由正常人肾近端小管上皮细胞(rptec)、madin-darby犬肾细胞(mdck)、大鼠原代rptec细胞和/或永生化rptec细胞组成的极化上皮单层,其中永生化任选地通过遗传操纵htert以形成htert永生化的rptec细胞来实现。使用novogenmmxbioprinter以使得上皮层在间质层顶部的方式沉积细胞(参见图1)。结构是通过与随时间降解的热响应性水凝胶(
参考图1,在特定实施方案中,三维工程化肾小管模型包括间质层和上皮层。在该实施方案中,两层共同建模肾远端小管的壁。这种配置对于体内组织的建模和预测天然组织反应至关重要。上皮层的反应是天然组织对药物、化学品或生物制剂的反应的前兆,并且可以提供与毒性或效力有关的信息。间质层对于上皮的正常运行至关重要,并且用作天然组织纤维化的模型,特别是肾小管间质性纤维化。
参考图2a,在特定实施方案中,使用连续沉积技术对间质层进行生物打印。在该实施方案中,生物打印间质片,随后是间质的边缘以形成三侧容器。然后将一层上皮再次使用连续沉积技术生物打印到间质的容器中。该实施方案提供了间质层和上皮层之间的必要接触。图2b描绘了在组织聚结(coalesce)后48小时显示的实际生物打印的肾小管模型。在一些实施方案中,组织在4、6、8、12或24小时内聚结。
参考图6a和6b,在特定实施方案中,使用连续沉积技术对间质层进行生物打印。在该实施方案中,使用喷墨沉积技术将上皮层生物打印到间质层上。基本上连续的上皮层与体内组织一致,并且对复制生理学相关的结构至关重要。喷墨沉积技术提供将一个或多个上层细胞薄层沉积到间质层的潜在不规则表面上的能力。在这样的实施方案中,任选地在间质层的生物打印之后或在已经允许间质层成熟后立即进行上皮层的喷墨沉积。
在一些实施方案中,细胞被生物打印。在另外的实施方案中,生物打印的细胞粘附以形成工程化的肾小管模型。还在另外的实施方案中,工程化的肾小管模型在制造时或使用时没有或基本上没有预先形成的支架。在某些情况下,生物打印允许制造模拟天然组织的适当细胞性的组织。
在一些实施方案中,本文描述的三维工程化肾小管模型与通过现有技术制造的组织的区别在于:它们是三维的,不含预先形成的支架,基本上由细胞组成,和/或具有高细胞密度(例如,大于30%细胞,大于40%细胞,大于50%细胞,大于60%细胞,大于70%细胞,大于80%细胞,大于90%细胞,或大于95%细胞)。
在一些实施方案中,本文所述的三维工程化肾小管模型与天然(例如非工程化)组织的区别在于:它们是非神经支配的(例如,基本上不含神经组织),基本上不含成熟脉管系统,和/或基本上不含血液成分。例如,在各种实施方案中,三维工程化肾小管模型不含血浆、红细胞、血小板等,和/或内源产生的血浆、红细胞、血小板等。在某些实施方案中,工程化的肾小管模型缺乏免疫细胞,例如t细胞、b细胞、巨噬细胞、树突细胞、嗜碱性粒细胞、肥大细胞或嗜酸性粒细胞。在一些实施方案中,模型不像天然存在的肾近端小管呈管状,而是呈平面或片状的,这有利地允许体外测定和分析。在一些实施方案中,成纤维细胞不是肾源性的。在一些实施方案中,内皮细胞不是肾源性的。在一些实施方案中,上皮细胞不是人源性的。在某些实施方案中,工程化的肾小管模型缺乏未分化的细胞。在某些实施方案中,工程化的肾小管模型缺乏未分化的肾细胞。在一些实施方案中,本文所述的三维工程化肾小管模型与天然肾小管组织的区别在于它们是平坦的或基本上平坦的。在某些实施方案中,本文所述的三维工程化肾小管模型具有超过天然肾小管组织的功能改进;一个例子是培养至少7、10或27天的持续培养时间后的高活力。在一些实施方案中,用于肾小管模型中的细胞是转化的或永生化的。在一些实施方案中,在肾小管模型中使用的细胞是转基因的,并且含有与荧光蛋白如egfp、gfp、rfp、yfp或cfp的蛋白质融合。在一些实施方案中,在肾小管模型中使用的细胞是转基因的,并含有具有荧光蛋白如egfp、gfp、rfp、yfp、gfp的报道子构建体;或荧光蛋白如萤火虫或海肾荧光素酶。在某些实施方案中,任何细胞含有1、2、3、4、5、6、7、8、9、10个或更多个基因的缺失或插入。在一些实施方案中,3d肾小管模型是嵌合体,其中至少一种细胞来自与3d肾小管模型的任何其它细胞不同的哺乳动物物种。在一些实施方案中,3d肾小管模型是嵌合体,其中至少一种细胞来自与3d肾小管模型的任何其它细胞不同的人供体(donar)。
细胞输入
在一些实施方案中,本文所述的工程化组织、阵列和方法包括多种细胞类型。在一些实施方案中,肾小管模型包括包含哺乳动物成纤维细胞和哺乳动物内皮细胞的间质组织层。在各种实施方案中,合适的内皮细胞衍生自人脐静脉(huvec)、人原代、人肾、或衍生自诱导多能干细胞(ips)或人胚胎干细胞(hes)的定向分化。在一些实施方案中,成纤维细胞是肾间质成纤维细胞。在各种实施方案中,合适的肾间质成纤维细胞衍生自从人肾分离的原代细胞。在一些实施方案中,成纤维细胞起源于真皮或血管。在一些实施方案中,一种或多种细胞组分衍生自非人哺乳动物。在一些实施方案中,间质组织包含肿瘤细胞或癌细胞。在一些实施方案中,间质组织层基本上是单层。在一些实施方案中,间质组织层包含其表面积的95%以上的单层。在一些实施方案中,间质组织层包含其表面积的90%以上的单层。在一些实施方案中,间质组织层包含其表面积的80%以上的单层。在一些实施方案中,间质组织层大于1个细胞厚度。在一些实施方案中,间质组织层大于2个细胞厚度。在一些实施方案中,间质组织层大于3个细胞厚度。在一些实施方案中,间质组织层大于4个细胞厚度。在一些实施方案中,间质组织层大于5个细胞厚度。在一些实施方案中,间质组织层大于10个细胞厚度。在一些实施方案中,间质组织层大于20个细胞厚度。在一些实施方案中,间质组织层大于50细胞厚度。在一些实施方案中,间质组织层大于100个细胞厚度。在一些实施方案中,间质组织层大于20μm厚。在一些实施方案中,间质组织层大于30μm厚。在一些实施方案中,间质组织层大于40μm厚。在一些实施方案中,间质组织层大于50μm厚。在一些实施方案中,间质组织层大于100μm厚。在一些实施方案中,间质组织层大于200μm厚。在一些实施方案中,间质组织层大于500μm厚。在一些实施方案中,间质组织层大于600μm厚。在一些实施方案中,间隙组织层大于1000μm厚。在一些实施方案中,间质组织层小于20μm厚。在一些实施方案中,间质组织层小于30μm厚。在一些实施方案中,间质组织层小于40μm厚。在一些实施方案中,间质组织层小于50μm厚。在一些实施方案中,间质组织层小于100μm厚。在一些实施方案中,间质组织层小于200μm厚。在一些实施方案中,间质组织层小于500μm厚。在一些实施方案中,间质组织层小于600μm厚。在一些实施方案中,间质组织层小于1000μm厚。
在一些实施方案中,肾小管模型包括包含哺乳动物上皮细胞的上皮组织层。在另外的实施方案中,上皮细胞是肾小管上皮细胞(例如近端小管上皮细胞)。在另外的实施方案中,合适的肾小管上皮细胞是衍生自干细胞(诱导的多能干细胞(ips)衍生的和/或人胚胎干细胞(hes)衍生的)的定向分化衍生的的原代分离物或细胞。在一些实施方案中,肾小管上皮细胞是madin-darby犬肾(mdck)细胞。在一些实施方案中,肾小管上皮细胞是永生化的人细胞。在其他实施方案中,肾小管上皮细胞是永生化细胞,例如htert-rptec细胞、hk-2细胞、llc-pk1细胞或ok细胞。在一些实施方案中,上皮细胞衍生自非人哺乳动物,例如大鼠、小鼠、猪或灵长类动物。在一些实施方案中,上皮组织层基本上由肾小管上皮细胞组成。在一些实施方案中,上皮组织层基本上由原代肾小管上皮细胞组成。在一些实施方案中,上皮组织层基本上由肾近端小管上皮细胞组成。在一些实施方案中,上皮组织层基本上由原代肾近端小管上皮细胞组成。在一些实施方案中,上皮组织层基本上是单层。在一些实施方案中,上皮组织层包含肿瘤细胞。在一些实施方案中,上皮组织层包含肾细胞癌细胞。在一些实施方案中,上皮组织层包含其表面积的95%以上的单层。在一些实施方案中,上皮组织层包含其表面积的90%以上的单层。在一些实施方案中,上皮组织层包含其表面积的80%以上的单层。在一些实施方案中,上皮组织层大于1个细胞厚度。在一些实施方案中,上皮组织层大于2个细胞厚度。在一些实施方案中,上皮组织层大于3个细胞厚度。在一些实施方案中,上皮组织层大于4个细胞厚度。在一些实施方案中,上皮组织层大于5个细胞厚度。在一些实施方案中,上皮组织层大于10个细胞厚度。在一些实施方案中,上皮组织层大于20个细胞厚度。在一些实施方案中,上皮组织层大于50个细胞厚度。在一些实施方案中,上皮组织层大于100个细胞厚度。在一些实施方案中,上皮组织层大于20μm厚。在一些实施方案中,上皮组织层大于30μm厚。在一些实施方案中,上皮组织层大于40μm厚。在一些实施方案中,上皮组织层大于50μm厚。在一些实施方案中,上皮组织层大于100μm厚。在一些实施方案中,上皮组织层大于200μm厚。在一些实施方案中,上皮组织层大于500μm厚。在一些实施方案中,间质组织层大于600μm厚。在一些实施方案中,上皮组织层大于1000μm厚。在一些实施方案中,上皮组织层小于1000μm厚。在一些实施方案中,间质组织层小于600μm厚。在一些实施方案中,上皮组织层小于500μm厚。在一些实施方案中,上皮组织层小于200μm厚。在一些实施方案中,上皮组织层小于100μm厚。在一些实施方案中,上皮组织层小于50μm厚。在一些实施方案中,上皮组织层小于40μm厚。在一些实施方案中,上皮组织层小于30μm厚。在一些实施方案中,上皮组织层小于20μm厚。
任选地,肾小管模型包含其他细胞类型(例如,epo产生细胞、免疫细胞等)。在一些实施方案中,免疫细胞是t细胞。在一些实施方案中,免疫细胞是b细胞。在一些实施方案中,免疫细胞是nk细胞。在一些实施方案中,免疫细胞是树突细胞。在一些实施方案中,免疫细胞是巨噬细胞。
范围广泛的细胞比例是合适的。在一些实施方案中,上皮层包括近端小管上皮细胞,由其组成,或基本上由其组成。在一些实施方案中,间质层包含特定比例的成纤维细胞和内皮细胞,由其组成,或基本上由其组成。作为非限制性实例,成纤维细胞的合适比例包括约5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90和95%的成纤维细胞,包括其中的增量。作为非限制性实例,内皮细胞的合适比例包括约5、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90和95%的内皮细胞,包括其中的增量。在某些实施方案中,间质层包括特定比的成纤维细胞与内皮细胞,由其组成,或基本上由其组成。在某些实施方案中,成纤维细胞与内皮细胞之比为至少5:95、10:90、15:85、20:80、25:75、30:70、35:65、40:60、45:65,50:50、55:45、60:40、65:35、70:30、75:25、80:20、85:15、90:10或95:5,包括其中的增量。在某些实施方案中,成纤维细胞与内皮细胞之比不超过5:95、10:90、15:85、20:80、25:75、30:70、35:65、40:60、45:65、50:50、55:45、60:40、65:35、70:30、75:25、80:20、85:15、90:10或95:5,包括其中的增量。在某些实施方案中,成纤维细胞与内皮细胞之比为约50:50。在某些实施方案中,成纤维细胞与内皮细胞之比为约60:40至约40:60。
范围广泛的细胞浓度适用于生物墨。生物墨适合为连续沉积生物打印技术制备,其中作为非限制性实例,细胞的浓度包括约1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190、200、225、250、275、300或更多百万个细胞/毫升生物墨。在一个特定实施方案中,为连续沉积生物打印制备的生物墨包含约1-2亿个细胞/ml。生物墨适合为喷墨沉积生物打印技术制备,其中作为非限制性实例,细胞的浓度包括约0.25、0.5、1、2、3、5、10、15或更多百万个细胞/毫升生物墨。在一个特定实施方案中,为喷墨沉积生物打印制备的生物墨包含约1-5百万个细胞/ml。在一个特定实施方案中,为喷墨沉积生物打印制备的生物墨包含约1-4百万个细胞/ml。在一个特定实施方案中,为喷墨沉积生物打印制备的生物墨包含约1-3百万个细胞/ml。在一个特定实施方案中,为喷墨沉积生物打印制备的生物墨包含约1-2百万个细胞/ml。
在某些实施方案中,肾间质生物墨包含5000万至10亿个细胞/毫升。在某些实施方案中,肾间质生物墨包含5000万至9亿个细胞/毫升。在某些实施方案中,肾间质生物墨包含5000万至8亿个细胞/毫升。在某些实施方案中,肾间质生物墨包含5000万至7亿个细胞/毫升。在某些实施方案中,肾间质生物墨包含5000万至6亿个细胞/毫升。在某些实施方案中,肾间质生物墨包含5000万至5亿个细胞/毫升。在某些实施方案中,肾间质生物墨包含5000万至4亿个细胞/毫升。在某些实施方案中,肾间质生物墨包含5000万至3亿个细胞/毫升。在某些实施方案中,肾间质生物墨包含5000万至2亿个细胞/毫升。在某些实施方案中,肾间质生物墨包含7500万至6亿个细胞/毫升。在某些实施方案中,肾间质生物墨包含1亿至6亿个细胞/毫升。在某些实施方案中,肾间质生物墨包含1亿至5亿个细胞/毫升。在某些实施方案中,肾间质生物墨包含1亿至4亿个细胞/毫升。在某些实施方案中,肾间质生物墨包含1亿至3亿个细胞/毫升。在某些实施方案中,肾间质生物墨包含1亿至2亿个细胞/毫升。在某些实施方案中,肾间质生物墨包含1亿至1.5亿个细胞/毫升。
在某些实施方案中,肾上皮生物墨包含25万至500万个细胞/毫升。在某些实施方案中,肾上皮生物墨包含25万至400万个细胞/毫升。在某些实施方案中,肾上皮生物墨包含25万至300万个细胞/毫升。在某些实施方案中,肾上皮生物墨包含25万至200万个细胞/毫升。在某些实施方案中,肾上皮生物墨包含25万至100万个细胞/毫升。在某些实施方案中,肾上皮生物墨包含50万至500万个细胞/毫升。在某些实施方案中,肾上皮生物墨包含50万至400万个细胞/毫升。在某些实施方案中,肾上皮生物墨包含50万至300万个细胞/毫升。在某些实施方案中,肾上皮生物墨包含50万至200万个细胞/毫升。在某些实施方案中,肾上皮生物墨包含50万至100万个细胞/毫升。在某些实施方案中,肾上皮生物墨包含100万至500万个细胞/毫升。在某些实施方案中,肾上皮生物墨包含100万至400万个细胞/毫升。在某些实施方案中,肾上皮生物墨包含100万至300万个细胞/毫升。在某些实施方案中,肾上皮生物墨包含100万至200万个细胞/毫升。
在某些实施方案中,上皮生物墨的密度小于间质生物墨的密度。在某些实施方案中,间质生物墨的密度与上皮生物墨的密度之比为约300:1;约275:1;约250:1;约225:1;约200:1;约175:1;约150:1,约125:1;约100:1,约75:1或约50:1。在某些实施方案中,间质生物墨的密度与上皮生物墨的密度的比值为约300:1至约50:1。在某些实施方案中,间质生物墨的密度与上皮生物墨的密度的比率为约250:1至约75:1。在某些实施方案中,间质生物墨的密度与上皮生物墨的密度的比率为约200:1至约75:1。在某些实施方案中,间质生物墨的密度与上皮生物墨的密度的比值为约150:1至约75:1。在某些实施方案中,间质生物墨的密度与上皮生物墨的密度的比值为约125:1至约75:1。
在某些实施方案中,生物墨是粘性液体。在某些实施方案中,生物墨是半固体。在某些实施方案中,生物墨是固体。在某些实施方案中,生物墨的粘度大于100厘泊。在某些实施方案中,生物墨的粘度大于200厘泊。在某些实施方案中,生物墨的粘度大于500厘泊。在某些实施方案中,生物墨的粘度大于1,000厘泊。在某些实施方案中,生物墨的粘度大于2,000厘泊。在某些实施方案中,生物墨的粘度大于5,000厘泊。在某些实施方案中,生物墨的粘度大于10,000厘泊。在某些实施方案中,生物墨的粘度大于20,000厘泊。在某些实施方案中,生物墨的粘度大于50,000厘泊。在某些实施方案中,生物墨的粘度大于100,000厘泊。在某些实施方案中,生物墨的粘度小于100厘泊。在某些实施方案中,生物墨的粘度小于200厘泊。在某些实施方案中,生物墨的粘度小于500厘泊。在某些实施方案中,生物墨的粘度小于1,000厘泊。在某些实施方案中,生物墨的粘度小于2,000厘泊。在某些实施方案中,生物墨的粘度小于5,000厘泊。在某些实施方案中,生物墨的粘度小于10,000厘泊。在某些实施方案中,生物墨的粘度小于20,000厘泊。在某些实施方案中,生物墨的粘度小于50,000厘泊。在某些实施方案中,生物墨的粘度小于100,000厘泊。
在一些实施方案中,肾小管模型的平均厚度为至少50μm。在一些实施方案中,肾小管模型的平均厚度为至少100μm。在一些实施方案中,肾小管模型的平均厚度为至少200μm。在一些实施方案中,肾小管模型的平均厚度为至少300μm。在一些实施方案中,肾小管模型的平均厚度为至少400μm。在一些实施方案中,肾小管模型的平均厚度为至少500μm。在一些实施方案中,肾小管模型的平均厚度为至少600μm。在一些实施方案中,肾小管模型的平均厚度为至少700μm。在一些实施方案中,肾小管模型的平均厚度为至少800μm。在一些实施方案中,肾小管模型的平均厚度为至少900μm。在一些实施方案中,肾小管模型的平均厚度为至少1000μm。在一些实施方案中,肾小管模型的平均厚度在50μm和1000μm之间。在一些实施方案中,肾小管模型的平均厚度在75μm和1000μm之间。在一些实施方案中,肾小管模型的平均厚度在100μm和1000μm之间。在一些实施方案中,肾小管模型的平均厚度在200μm和1000μm之间。在一些实施方案中,肾小管模型的平均厚度在500μm和1000μm之间。在一些实施方案中,肾小管模型的平均厚度在50μm和500μm之间。在一些实施方案中,肾小管模型的平均厚度在50μm和300μm之间。在一些实施方案中,肾小管模型的平均厚度在50μm和200μm之间。在一些实施方案中,肾小管模型的平均厚度在50μm和150μm之间。在一些实施方案中,肾小管模型的平均厚度在50μm和125μm之间。在一些实施方案中,肾小管模型的平均厚度在75μm和100μm之间。
在一些实施方案中,肾小管模型的表面积至少为0.01cm2。在一些实施方案中,肾小管模型的表面积至少为0.02cm2。在一些实施方案中,肾小管模型的表面积至少为0.03cm2。在一些实施方案中,肾小管模型的表面积至少为0.04cm2。在一些实施方案中,肾小管模型的表面积至少为0.05cm2。在一些实施方案中,肾小管模型的表面积至少为0.06cm2。在一些实施方案中,肾小管模型的表面积至少为0.07cm2。在一些实施方案中,肾小管模型的表面积至少为0.08cm2。在一些实施方案中,肾小管模型的表面积至少为0.09cm2。在一些实施方案中,肾小管模型的表面积至少为0.10cm2。在一些实施方案中,肾小管模型的表面积至少为0.11cm2。在一些实施方案中,肾小管模型的表面积至少为0.12cm2。在一些实施方案中,肾小管模型的表面积小于0.5cm2。在一些实施方案中,肾小管模型的表面积小于0.4cm2。在一些实施方案中,肾小管模型的表面积小于0.3cm2。在一些实施方案中,肾小管模型的表面积小于0.2cm2。在一些实施方案中,肾小管模型的表面积小于0.1cm2。
肾小管模型的结构特征
本公开的肾小管模型可以以许多配置进行结构安排。在某些实施方案中,上皮组织层和间质组织层是独立的结构上不同的层,二者直接接触或间隔1、2、3、4、5、6、7、8、9、10、15、20μm或更多,包括其中的增量。在某些实施方案中,间隔是由于在两层之间的细胞外基质的分泌和沉积,为了本公开的目的将其视为接触。在正常生理组织细胞和细胞层被极化以具有面向其他细胞或组织基质的顶端(面朝内腔)表面和基底外侧表面。为了本文公开的肾小管模型的目的,基底外侧表面是指面向另一细胞、细胞外基质或生物相容性膜或培养容器表面的表面。为了本文公开的肾小管模型的目的,顶端表面是指远离生物相容性膜或培养容器表面的表面。在某些实施方案中,间质组织层的基底外侧表面是连接到生物相容性膜或培养容器的表面;并且间质组织层的顶端表面是未连接到生物相容性膜或培养容器的表面。在某些实施方案中,上皮组织层沉积在间质组织层的顶端表面上并形成层,从而形成两个结构不同的层。在某些实施方案中,上皮组织层和间质组织层是连续接触的。在某些实施方案中,至少99%的上皮组织层与间质组织层连续接触。在某些实施方案中,至少95%的上皮组织层与间质组织层连续接触。在某些实施方案中,至少90%的上皮组织层与间质组织层连续接触。在某些实施方案中,至少80%的上皮组织层与间质组织层连续接触。在某些实施方案中,至少70%的上皮组织层与间质组织层连续接触。在某些实施方案中,至少60%的上皮组织层与间质组织层连续接触。在某些实施方案中,至少50%的上皮组织层与间质组织层连续接触。在某些实施方案中,小于99%的上皮组织层与间质组织层连续接触。在某些实施方案中,少于98%的上皮组织层与间质组织层连续接触。在某些实施方案中,小于97%的上皮组织层与间质组织层连续接触。在某些实施方案中,小于95%的上皮组织层与间质组织层连续接触。在某些实施方案中,少于90%的上皮组织层与间质组织层连续接触。在某些实施方案中,小于80%的上皮组织层与间质组织层连续接触。在某些实施方案中,上皮组织层完全覆盖间质组织层的顶端表面。在某些实施方案中,上皮组织层覆盖间质组织层的顶端表面的至少99%。在某些实施方案中,上皮组织层覆盖间质组织层的顶端表面的至少95%。在某些实施方案中,上皮组织层覆盖间隙组织层顶端表面的至少90%。在某些实施方案中,上皮组织层覆盖间质组织层的顶端表面的至少80%。在某些实施方案中,上皮组织层覆盖间质组织层的顶端表面的至少70%。在某些实施方案中,上皮组织层覆盖间质组织层的顶端表面的至少60%。在某些实施方案中,上皮组织层覆盖间质组织层的顶端表面的至少50%。在某些实施方案中,上皮组织层覆盖间质组织层的顶端表面的小于99%。在某些实施方案中,上皮组织层覆盖间质组织层的顶端表面的小于98%。在某些实施方案中,上皮组织层覆盖了间质组织层的顶端表面的小于97%。在某些实施方案中,上皮组织层覆盖间质组织层的顶端表面的小于95%。在某些实施方案中,上皮组织层覆盖间质组织层顶端表面的小于90%。在某些实施方案中,上皮组织层覆盖间质组织层的顶端表面的小于80%。在某些实施方案中,上皮组织层覆盖间隙组织层的顶端表面的小于70%。
上皮组织层的结构
通常,上皮组织细胞与相邻细胞形成紧密连接。紧密连接的标志是跨膜蛋白家族钙粘蛋白。其中之一,e-钙粘蛋白,在肾组织的紧密连接处特别突出,并标志着其形成。在某些实施方案中,上皮组织层由形成紧密连接的细胞组成。在某些实施方案中,上皮组织层中的基本上所有细胞与至少一个相邻细胞形成紧密连接。在某些实施方案中,上皮组织层中至少99%的细胞与至少一个其它细胞形成紧密连接。在某些实施方案中,上皮组织层中至少95%的细胞与至少一个其它细胞形成紧密连接。在某些实施方案中,上皮组织层中至少90%的细胞与至少一个其它细胞形成紧密连接。在某些实施方案中,上皮组织层中至少80%的细胞与至少一个其它细胞形成紧密连接。在某些实施方案中,上皮组织层中至少70%的细胞与至少一个其它细胞形成紧密连接。在某些实施方案中,上皮组织层中至少60%的细胞与至少一个其它细胞形成紧密连接。在某些实施方案中,上皮组织层中至少50%的细胞与至少一个其它细胞形成紧密连接。
细胞层的活力和密度
通过本公开的方法生物打印的优点在于细胞可以以高密度和高活力打印。在某些实施方案中,间质细胞层的密度为至少1×106个细胞/ml。在某些实施方案中,间质细胞层的密度为至少5×106个细胞/ml。在某些实施方案中,间质细胞层的密度为至少10×106个细胞/ml。在某些实施方案中,间质细胞层的密度为至少20×106个细胞/ml。在某些实施方案中,间质细胞层的密度为至少50×106个细胞/ml。在某些实施方案中,间质细胞层的密度为至少100×106个细胞/ml。在某些实施方案中,间质细胞层的密度为至少200×106个细胞/ml。在某些实施方案中,间质细胞层的密度为至少500×106个细胞/ml。在某些实施方案中,间质细胞层的密度在约100×106个细胞/ml和约900×106个细胞之间。在某些实施方案中,间质细胞层的密度在约100×106个细胞/ml和约700×106个细胞之间。在某些实施方案中,间质细胞层的密度在约100×106个细胞/ml和约600×106个细胞之间。在某些实施方案中,间质细胞层的密度在约100×106个细胞/ml和约500×106个细胞之间。在某些实施方案中,间质细胞层的密度在约100×106个细胞/ml和约300×106个细胞之间。在某些实施方案中,间质细胞层的密度在约100×106个细胞/ml和约200×106个细胞之间。在某些实施方案中,间质组织层的活力大于99体积%的活细胞。在某些实施方案中,间质组织层的活力大于体积的95体积%的活细胞。在某些实施方案中,间质组织层的活力大于90体积%的活细胞。在某些实施方案中,间质组织层的活力大于80体积%活细胞。在某些实施方案中,间质组织层的活力大于70体积%活细胞。在某些实施方案中,间质组织层的活力大于60体积%活细胞。在某些实施方案中,间质组织层的活力大于50体积%活细胞。在某些实施方案中,这种活力在打印后保持至少8、12、24、48、72、96或更多个小时。在某些实施方案中,该活力在打印后保持至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、21或更多天。在某些实施方案中,上皮细胞层的密度至少为1×105个细胞/ml。在某些实施方案中,上皮细胞层的密度至少为2×105个细胞/ml。在某些实施方案中,上皮细胞层的密度为至少5×105个细胞/ml。在某些实施方案中,上皮细胞层的密度至少为1×106个细胞/ml。在某些实施方案中,上皮细胞层的密度为至少5×106个细胞/ml。在某些实施方案中,上皮细胞层的密度为至少10×106个细胞/ml。在某些实施方案中,上皮细胞层的密度为至少20×106个细胞/ml。在某些实施方案中,上皮细胞层的密度为至少50×106个细胞/ml。在某些实施方案中,上皮细胞层的密度为至少100×106个细胞/ml。在某些实施方案中,上皮细胞层的密度至少为200×106个细胞/ml。在某些实施方案中,上皮细胞层的密度为至少500×106个细胞/ml。在某些实施方案中,上皮细胞层的密度小于1×105个细胞/ml。在某些实施方案中,上皮细胞层的密度小于2×105个细胞/ml。在某些实施方案中,上皮细胞层的密度小于5×105个细胞/ml。在某些实施方案中,上皮细胞层的密度小于1×106个细胞/ml。在某些实施方案中,上皮细胞层的密度小于5×106个细胞/ml。在某些实施方案中,上皮细胞层的密度小于10×106个细胞/ml。在某些实施方案中,上皮组织层的活力大于99体积%的活细胞。在某些实施方案中,上皮组织层的活力大于95体积%活细胞。在某些实施方案中,上皮组织层的活力大于90体积%活细胞。在某些实施方案中,上皮组织层的活力大于80体积%活细胞。在某些实施方案中,上皮组织层的活力大于70体积%活细胞。在某些实施方案中,上皮组织层的活力大于60体积%活细胞。在某些实施方案中,上皮组织层的活力大于50体积%活细胞。在某些实施方案中,该活力在打印后保持至少8、12、24、48、72或96小时。在某些实施方案中,该活力在打印后保持至少1、2、3、4、5、6、7、8、9、10、11、12、13或14天。
组织结构的均匀性
使用本公开的方法生物打印的一个优点是通过反映在相应组织中的工艺获得高度的均匀性。在某些实施方案中,肾小管模型的厚度基本上是均匀的。在某些实施方案中,大于99%的肾小管模型在肾小管模型的总体平均厚度的+/-10%内。在某些实施方案中,大于95%的肾小管模型在肾小管模型的总体平均厚度的+/-10%内。在某些实施方案中,大于90%的肾小管模型在肾小管模型的总体平均厚度的+/-10%内。在某些实施方案中,大于80%的肾小管模型在肾小管模型的总体平均厚度的+/-10%内。在某些实施方案中,大于70%的肾小管模型在肾小管模型的总体平均厚度的+/-10%内。在某些实施方案中,大于99%的肾小管模型在肾小管模型的总体平均厚度的+/-20%内。在某些实施方案中,大于95%的肾小管模型在肾小管模型的总体平均厚度的+/-20%内。在某些实施方案中,大于90%的肾小管模型在肾小管模型的总体平均厚度的+/-20%内。在某些实施方案中,大于80%的肾小管模型在肾小管模型的总体平均厚度的+/-20%内。在某些实施方案中,大于70%的肾小管模型在肾小管模型的总体平均厚度的+/-20%内。
生物墨和细胞层的非细胞组分
通常,生物打印的细胞或生物墨含有改善其对于生物打印的适用性的赋形剂或挤出化合物。挤出化合物的实例包括但不限于凝胶,水凝胶,肽水凝胶,基于氨基酸的凝胶,表面活性剂多元醇(例如,pluronicf-127或pf-127),热响应性聚合物,透明质酸盐,藻酸盐,细胞外基质组分(及其衍生物),胶原,明胶,其他生物相容性天然或合成聚合物,纳米纤维,和自组装纳米纤维。在一些实施方案中,挤出化合物含有合成聚合物。在一些实施方案中,挤出化合物含有通常不与哺乳动物组织结合的非合成聚合物,其通常与哺乳动物组织不相关。在一些实施方案中,通过物理,化学或酶学手段在生物打印之后除去挤出化合物。在一些实施方案中,本公开的生物墨含有按重量计超过1%的挤出化合物。在一些实施方案中,本公开的肾小管模型包含按重量计超过1%的挤出化合物。在一些实施方案中,本公开的生物墨含有按重量计小于5%的挤出化合物。在一些实施方案中,本公开的生物墨含有按重量计小于2%的挤出化合物。在一些实施方案中,本公开的生物墨含有按重量计小于1%的挤出化合物。在一些实施方案中,本公开的肾小管模型包含按重量计小于5%的挤出化合物。在一些实施方案中,本公开的肾小管模型包含按重量计小于2%的挤出化合物。在一些实施方案中,本公开的肾小管模型包含按重量计小于1%的挤出化合物。在一些实施方案中,上皮生物墨不含水凝胶。在一些实施方案中,上皮生物墨不含挤出化合物。在一些实施方案中,上皮生物墨不含用作化合物中的赋形剂或挤出化合物(estrus)的合成聚合物。在一些实施方案中,肾小管模型不含用作赋形剂或挤出化合物的合成聚合物。在一些实施方案中,上皮细胞层不含用作赋形剂或挤出化合物的合成聚合物。在一些实施方案中,间质细胞层不含用作赋形剂或挤出化合物的合成聚合物。
打印曲面
本文提供了连接到生物相容表面的肾小管模型。在某些实施方案中,将间质组织层打印到生物相容性表面上。在某些实施方案中,生物相容性表面是孔径大于0.4μm的膜。在某些实施方案中,生物相容性表面的孔径为约1μm。在某些实施方案中,生物相容性表面涂覆有组合物以改善细胞粘附或活力。在某些实施方案中,将肾小管模块(modules)打印到6孔、12孔、24孔、48孔,96孔或384孔板中。在某些实施方案中,将肾小管模块打印到直径为60、100或150mm或更大的组织培养板中。在某些实施方案中,将肾小管模块打印到组织培养瓶中或微流体芯片上。在某些实施方案中,肾小管模块打印到transwell插入物中/上。
肾小管模型的生产工艺
本公开支持用于制造肾小管模型的方法和工艺。在某些实施方案中,三维工程化生物学肾小管模型的产品通过生物打印的工艺产生。在某些实施方案中,三维工程化生物学肾小管模型的产品的至少一种成分通过生物打印的工艺产生。在某些实施方案中,三维工程化生物学肾小管模型的制造工艺包括:制备肾间质生物墨,所述间质生物墨包含多种间质细胞类型,所述间质细胞类型包含肾成纤维细胞和内皮细胞;制备肾上皮生物墨,所述上皮生物墨包含肾小管上皮细胞;沉积所述肾间质生物墨和所述肾上皮生物墨,使得所述肾上皮生物墨在所述肾间质生物墨的层的至少一个表面上形成层;和使沉积的生物墨在细胞培养基中成熟以使细胞粘附来形成三维工程化生物学肾小管模型。在某些实施方案中,所述肾间质组织生物墨形成具有顶端和基底外侧表面的肾间质组织层。在某些实施方案中,所述肾上皮生物墨与所述肾间质组织层的顶端表面接触沉积。在某些实施方案中,所述肾上皮生物墨基本上由肾小管上皮细胞组成。在某些实施方案中,所述肾上皮生物墨基本上由原代肾小管上皮细胞组成。在某些实施方案中,所述原代肾小管上皮细胞分离自患有影响肾功能的疾病的受试者。在某些实施方案中,所述原代肾小管上皮细胞分离自患有多囊性肾病的受试者。在某些实施方案中,所述原代肾小管上皮细胞分离自患有ii型糖尿病的受试者。在某些实施方案中,所述肾上皮生物墨包含肾细胞癌细胞。在某些实施方案中,所述肾上皮生物墨以单层沉积。在某些实施方案中,所述肾间质组织生物墨以单层沉积。在某些实施方案中,所述肾上皮组织层与肾间质组织层连续接触沉积。在某些实施方案中,所述肾上皮生物墨形成覆盖所述肾间质组织层的顶端表面的50%以上的层。在某些实施方案中,所述肾上皮生物墨形成覆盖所述肾间质组织层的顶端表面的70%以上的层。在某些实施方案中,所述肾上皮生物墨形成覆盖所述肾间质组织层的顶端表面的90%以上的层。在某些实施方案中,肾上皮层的肾上皮细胞的至少50%与其它肾上皮细胞形成紧密连接。在某些实施方案中,肾上皮层的肾上皮细胞的至少70%与其它肾上皮细胞形成紧密连接。在某些实施方案中,肾上皮层的肾上皮细胞的至少90%与其它肾上皮细胞形成紧密连接。在某些实施方案中,所述肾小管模型的厚度在50和500μm之间。在某些实施方案中,所述肾小管模型为约100μm厚。在某些实施方案中,所述肾上皮生物墨还包含挤出化合物。在某些实施方案中,所述成纤维细胞和内皮细胞以约95:5至约5:95的成纤维细胞与内皮细胞之比存在于所述肾间质生物墨中。在某些实施方案中,所述成纤维细胞和内皮细胞以约75:25至约25:75的成纤维细胞与内皮细胞之比存在于所述肾间质生物墨中。在某些实施方案中,所述成纤维细胞和内皮细胞以约60:40至约40:60的成纤维细胞与内皮细胞之比存在于所述肾间质生物墨中。在某些实施方案中,成纤维细胞和内皮细胞以约50:50的成纤维细胞与内皮细胞之比存在于所述肾间质生物墨中。在某些实施方案中,所述肾间质生物墨还包含分泌细胞。在某些实施方案中,所述肾间质生物墨还包含免疫细胞。在某些实施方案中,所述肾间质生物墨还包含挤出化合物。在某些实施方案中,所述肾间质生物墨包含肾小球细胞。在某些实施方案中,所述模型基本上不含预先形成的支架。在某些实施方案中,所述肾成纤维细胞、内皮细胞和肾小管上皮细胞是哺乳动物细胞。在某些实施方案中,所述肾间质生物墨或肾上皮生物墨中任一者在沉积后形成平面层。在某些实施方案中,所述肾小管模型具有均匀的厚度。在某些实施方案中,所述肾间质生物墨沉积到生物相容性膜上。在某些实施方案中,所述肾间质生物墨沉积到孔径大于0.4μm的生物相容性膜上。在某些实施方案中,所述肾间质生物墨沉积到孔径为约1μm的生物相容性膜上。在某些实施方案中,所述三维工程化生物学肾小管模型沉积以形成阵列。在某些实施方案中,所述三维工程化生物学肾小管模型沉积以形成这样的阵列,所述阵列被配置为允许每个肾小管模型之间的间隔在约20μm和约100μm之间。在某些实施方案中,所述肾间质生物墨为至少30体积%的活细胞。在某些实施方案中,所述肾间质生物墨为至少70体积%的活细胞。在某些实施方案中,所述肾间质生物墨为至少90体积%的活细胞。在某些实施方案中,所述肾间质生物墨通过挤出生物打印来沉积。在某些实施方案中,所述肾上皮生物墨通过喷墨生物打印来沉积。在某些实施方案中,所述肾小管模型的任何层在体外培养3天后的培养物中是具有活力的。在某些实施方案中,所述肾小管模型的任何层在体外培养10天后的培养物中是具有活力的。
在某些实施方案中,本文公开的3d肾小管模型通过附加制造工艺(additivemanufacturingprocess)生产。用于本文的3d肾小管模型的附加制造工艺允许定制制造用于体外目的的3d肾小管模型。其重要性在于组织是由于用户指定的设计制造的。在某些实施方案中,3d肾小管模型仅包含用户指定的细胞。在某些实施方案中,3d肾小管模型仅包含用户指定的细胞类型。在某些实施方案中,3d肾小管模型仅包含用户指定的细胞数量或细胞浓度。在某些实施方案中,3d肾小管模型包含在制造之前或期间用小分子、治疗性分子或治疗性物质处理的细胞。治疗性分子或物质是旨在治疗疾病或引发生物反应的任何分子。在某些实施方案中,3d肾小管模型包含生物相容性或组织培养塑料、生物相容性合成聚合物、可交联凝胶、可逆交联凝胶和其它非细胞成分。
肾小管模型的成熟
在某些实施方案中,本公开的肾小管模型在生物打印后成熟一定量的时间。在某些实施方案中,模型在使用前成熟至少1、2、3、4、5、6、7、8、9、10、11、12、16、18、24小时或更长时间。在某些实施方案中,模型在使用前成熟至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、30天或更久。在一些实施方案中,组织的运输或转运是一种使用。在某些实施方案中,本公开的肾小管模型的间质层在加入上皮层之前生物打印之后成熟一定量的时间。在某些实施方案中,间质层在使用前成熟至少1、2、3、4、5、6、7、8、9、10、11、12、16、18、24小时或更久。在某些实施方案中,间质层在使用前成熟至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30天或更久。在一些实施方案中,组织的运输或转运是一种使用。在一些实施方案中,在间质层的生物打印之后的1、2、3、4、5、6、7、8、9、10、11、12、16、18、24小时内将上皮层生物打印到间质层上。在一些实施方案中,组织的运输或转运是一种使用。在一些实施方案中,在间质层的生物打印后的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30天内将上皮层生物打印到间质层上。
体外测定
在一些实施方案中,本文公开的肾小管和阵列用于体外测定。在一些实施方案中,“测定”是用于测试或测量有机或生物样品(例如,细胞聚集体、组织、器官、生物体等)中物质(例如化学品、分子、生物化学品、药物等)的存在或活性的程序。在另外的实施方案中,测定包括定性测定和定量测定。还在另外的实施方案中,定量测定测量样品中的物质例如化学或生物分子的量。
在各种实施方案中,作为非限制性实例,肾小管和阵列用于基于图像的测定、分泌蛋白质的测量、标志物的表达以及蛋白质或mrna的产生。在各种其它实施方案中,肾小管和阵列用于测定以检测或测量以下中的一种或多种:分子结合(包括放射性配体结合),分子摄取,活性(例如酶活性和受体活性等),基因表达,蛋白质表达,蛋白质修饰(非限制性实例包括:磷酸化,泛素化,乙酰化,糖基化,脂化等),受体激动作用,受体拮抗作用,细胞信号传导,凋亡,化学敏感性,转染,细胞迁移,趋化性,细胞活力,细胞增殖,安全性,功效,代谢,毒性,感染性和滥用倾向。在各种实施方案中,肾小管用于毒理学、药物或毒性测试。
在一些实施方案中,肾小管和阵列用于免疫测定。免疫测定包括例如流式细胞术,高通量或低通量图像分析,免疫沉淀,放射免疫测定(ria),酶联免疫吸附测定(elisa),蛋白质印迹,同源测定,例如alphalisatm和依赖于时间分辨荧光或荧光共振能量转移(fret)的相关技术。在另外的实施方案中,免疫测定是竞争性免疫测定或非竞争性免疫测定。在竞争性免疫测定中,例如,样品中的抗原与标记的抗原竞争与抗体结合,然后测量与抗体位点结合的标记抗原的量。在非竞争性免疫测定(也称为“夹心测定”)中,例如,样品中的抗原与抗体位点结合;随后,标记的抗体与抗原结合,然后测量该位点上的标记抗体的量。
在一些实施方案中,肾小管和阵列用于elisa。在另外的实施方案中,elisa是用于检测样品中抗体或抗原存在的生物化学技术。在elisa中,例如,使用至少一种对特定抗原具有特异性的抗体。作为进一步的实例,将具有未知量抗原的样品非特异性地(通过吸附到表面)或特异性地(通过由“夹心”elisa中另一种特异于该抗原的抗体捕获)固定在固体支持物(例如,聚苯乙烯微量滴定板)上。还作为另一个实例,在抗原固定化之后,加入检测抗体,与抗原形成复合物。检测抗体例如与酶共价连接,或者本身由通过生物缀合与酶连接的第二抗体检测。
例如,在一些实施方案中,细胞、多细胞聚集体或组织的阵列、微阵列或芯片用于药物筛选或药物发现。在另外的实施方案中,组织的阵列、微阵列或芯片被用作用于药物筛选或药物发现的试剂盒的一部分。在一些实施方案中,每个肾小管存在于生物相容性多孔容器的孔内,其中所述容器与一种或多种自动化药物筛选程序和/或装置兼容。在另外的实施方案中,自动化药物筛选程序和/或装置包括计算机或机器人辅助的任何合适的程序或装置。
在另外的实施方案中,用于药物筛选测定或药物发现测定的阵列用于研究或开发潜在地在任何治疗领域中有用的药物。还在另外的实施方案中,作为非限制性实例,合适的治疗领域包括感染性疾病,血液学,肿瘤学,儿科,心脏病学,中枢神经系统疾病,神经病学,胃肠病学,肝脏病学,泌尿学,不育症,眼科学,肾脏学,矫形外科学,疼痛控制,精神病学,肺学,疫苗,伤口愈合,生理学,药理学,皮肤病学,基因治疗,毒理学,毒性和免疫学。
在一些实施方案中,肾小管和阵列用于基于细胞的筛选。在另外的实施方案中,基于细胞的筛选用于一种或多种感染性疾病,例如病毒、真菌、细菌或寄生虫感染。在另外的实施方案中,基于细胞的筛选用于肾癌,包括肾细胞癌,近肾小球细胞肿瘤(肾素瘤),血管平滑肌脂肪瘤,肾大嗜酸粒细胞瘤,贝利尼导管癌,肾脏透明细胞肉瘤,中胚层肾瘤,威尔姆斯氏肿瘤,混合上皮间质肿瘤和肾盂移行细胞癌。在另外的实施方案中,基于细胞的筛选是用于肾炎,包括肾小球性肾炎,间质性肾炎或肾小管间质性肾炎,肾盂肾炎,狼疮性肾炎和运动性肾炎。在另外的实施方案中,基于细胞的筛选用于高血压。在进一步的实施方案中,基于细胞的筛选用于糖尿病,i型、ii型和mody。在另外的实施方案中,基于细胞的筛选用于肾病,包括iga肾病、镇痛药性肾病(analgesicnephropathy)或肿瘤肾病(onconephropathy)。在一些实施方案中,基于细胞的筛选用于多囊肾病或黄嘌呤氧化酶缺陷。在其他实施方案中,肾小管和阵列用于研究癌症起始、进展或转移。在另外的实施方案中,肾小管和阵列用于研究其他细胞类型,例如癌细胞、病原体携带细胞、致病细胞、免疫细胞、血源细胞或干/祖细胞的相互作用。
在一些实施方案中,其构建体或其阵列用于评估包括抗体、哺乳动物细胞、细菌、生物活性蛋白质、激素等生物制品的性能。在其他实施方案中,肾小管或其阵列可用于研究包含构建体和一种或多种另外的细胞类型的哺乳动物肾小管之间的细胞-细胞和细胞-组织相互作用,所述另外的细胞类型包括但不限于病原体携带细胞、活的致病细胞、癌细胞、免疫细胞、血细胞、干/祖细胞或遗传操纵细胞。
在一些实施方案中,阵列包括肾小管和另外的组织构建体。在另外的实施方案中,肾小管构建体与一个或多个表面上的另外的组织构建体直接接触。在另外的实施方案中,肾小管经由流路或共同的储液器连接到一个或多个另外的组织构建体或细胞。还在另外的实施方案中,与工程化的肾小管构建体接触的液体培养基含有活的哺乳动物细胞,例如免疫细胞、血源细胞或肿瘤来源的细胞。在其它实施方案中,接触肾小管的液体培养基含有细菌、真菌、病毒、寄生虫或其它病原体。
本公开包括商业方法。在一些实施方案中,本文公开的技术和方法的速度和可扩展性用于设计、构建和操作用于生产用于移植或用于生成基于细胞的工具的肾小管和/或器官的工业和/或商业设施用于研究和开发,如体外测定。在另外的实施方案中,肾小管和/或其器官及其阵列生产、储存、分布、销售、广告和出售为例如用于生物测定和高通量药物筛选的细胞阵列(例如微阵列或芯片)、组织阵列(例如,微阵列或芯片)和试剂盒。在其它实施方案中,制备并利用工程化的肾小管和/或其器官和阵列进行生物测定和/或药物筛选作为服务。
验证
理想的工程肾组织完全是人和多细胞的,包括肾小管上皮细胞、肾间质成纤维细胞和内皮细胞。此外,理想的工程化肾组织显示出特定功能,包括但不限于cyp1a2、cyp2c9和cyp3a4活性,白蛋白转运,和维生素d羟基化,γ-谷氨酰转移酶活性。此外,理想的工程化肾脏组织的特征在于紧密连接,钙粘蛋白,转运蛋白极性和cd31表达,并通过包括白蛋白转运,cyp450活性,组织学和活力等特异性测定来验证。在一些实施方案中,本公开的肾小管模型与维持在培养物中长于1、2、3、4、5、6、7、8、9、10或更多天的2d共培养物或组织外植体相比,显示了特定功能增加。在一些实施方案中,本公开的肾小管模型与维持在培养物中长于1、2、3、4、5、6、7、8、9、10或更多天的2d共培养物或组织外植体相比,显示2倍增加的特定功能。在一些实施方案中,本公开的肾小管模型与维持在培养物中长于1、2、3、4、5、6、7、8、9、10或更多天的2d共培养物或组织外植体相比,显示5倍增加的特定功能。在一些实施方案中,本公开的肾小管模型与维持在培养物中长于21天以上的2d共培养物或组织外植体相比,显示出2倍以上增加的特定功能。在一些实施方案中,本公开的肾小管模型与维持在培养物中长于27天以上的2d共培养物或组织外植体相比,显示出5倍以上增加的特定功能。在一些实施方案中,本公开的肾小管模型与维持在培养物中长于27天以上的培养物相比,显示出2倍以上增加的特定功能。在一些实施方案中,本公开的肾小管模型与维持在培养物中长于21天以上的2d共培养物或组织外植体相比,显示出5倍以上增加的特定功能。在某些实施方案中,特定功能是γ-谷氨酰转移酶活性。在某些实施方案中,特定功能是维生素d羟基化。
在一些实施方案中,本文所述的工程化的组织具有与体内人肾组织相关的关键结构和功能属性,包括组织学特征和肾小管特异性功能,包括但不限于:
●肾小管上皮细胞的极化w/细胞内紧密连接(e-cad,zo-1和密蛋白)的形成和转运蛋白(顶端:oat4,urat1)和整合素(基底外侧)的正确的细胞内定位。
●在小管细胞层和下面的间质之间形成基底层。
●在间质内建立广泛的微血管网络,包括形成组织样小管细胞:微血管空间关系。
●表达区室特异性标志物,包括小管上皮转运蛋白(cubilin,megalin,水通道蛋白),oat,urat),血管标志物(cd31,vwf),证实epo蛋白产生(如适用)。
●通过25-(oh)1羟化酶(1ohase)的维生素d合成。
●生产血管紧张素ii。
●白蛋白从管状腔经由cubilin主动转运。
●西咪替丁自基底外侧表面的运输/积累。
●参与代谢的cyp450和ugt表达(例如分别为cyp2b6,3a5,4a11和ugt1a9,2b7)。
实施例
以下说明性示例是本文所述的软件应用、系统和方法的实施方案的代表,并不意味着以任何方式进行限制。
实施例1-生物打印的三维肾小管细胞模型
将尺寸为3mm×3mm×0.75mm的3层杯形状打印在12孔组织培养板中的transwell膜上(图2a和2b)。底片和两层化的壁由75%的成年肾成纤维细胞(arf)和25%的人脐静脉内皮细胞(huvec)组成。在
通过组织学染色对细胞类型特异性标志物进行结构1的评估。结构1的代表性h&e染色如图3a和3b所示。针对cd31410和te7420进行构建体染色,以分别评估huvec细胞和成纤维细胞的相对位置(图4)。两种细胞类型分布在整个间质层中,其表现出高细胞密度。在所有分析的构建体中发现了cd31+细胞的粗网络,其中一些区域可能表现出微血管形成的证据(图4,430)。为了可视化上皮细胞,将组织用抗e-钙粘蛋白的抗体(图5,540)和te7(图5,520)染色。上皮细胞集中在间质层附近并形成小管样结构。该结构具有与人类肾近端小管模型相关的许多有吸引力的特征,包括支持极化上皮细胞生长和组织的血管化间质层。
实施例2-生物打印的三维肾小管细胞模型
将尺寸为3mm×3mm×250μm的片材生物打印在12孔板中的transwell膜上。组织片由75%成年肾成纤维细胞和25%huvec组成,所述细胞在
通过组织学染色细胞类型特异性标志物进行结构2的评估。结构2的代表性h&e染色示于图7a和7b。组织表现出高细胞密度,并且可以观察到上皮细胞薄层(图7a和7b中的黑色箭头)。令人惊奇的是,喷墨模块促进上皮细胞附着到间质层的表面并导致组织表面上的细胞密度低得多,这是形成极化单层所必需的。喷墨喷涂后,细胞保留高活力:如通过台盼蓝排除法所测量的,mdck细胞大于97%,htert-rptec细胞大于94%。通过cd31染色810检测到微血管组织的证据,并通过e-钙粘蛋白染色840验证了上皮细胞的组织(图8a和8b)。
实施例3-生物打印的三维肾小管细胞模型
为了减少间质层的厚度和细胞性,细胞比例变为50%成纤维细胞/50%huvec,细胞浓度为1.25×108个细胞/ml。肾近端小管模型的间质层由
实施例4-以不同比例的肾成纤维细胞与内皮细胞生物打印的三维肾小管模型
进行实验以确定成纤维细胞对内皮细胞比例对组织形态的影响。使用以90:10;75:25;和50:50(成纤维细胞与内皮细胞)的比例包含肾成纤维细胞和huvec细胞的生物墨生物打印肾小管模型。图14和15显示了该实验的结果。图14显示了打印的肾小管模型的宏观视图;而图15显示了用masson三色染色的相应组织学。在打印后6天,包含50:50比例的肾小管模型基本上是平面或平坦的(图14c和15c)。以90:10(图14a和15a)和72:25(图14b和15b)打印的肾小管模型在打印后6天表现出卷曲。
实施例5-三维肾小管模型的均匀厚度
进行实验以确定肾小管模型的厚度的均匀性和表面拓扑。将肾小管模型生物打印到12孔板的孔中(图16a),并使用keyence技术进行分析(图16b)。将生物打印的肾小管模型培养14天,并使用keyencevhx-700数字显微镜分析其表面积和厚度。novogel3.0边缘内的区域(见实施例3)估计为0.068cm2。跨越边缘内的组织,发现平均厚度约为106.8um,厚度相对均匀度如示出的热图所示(极薄区域为1650)。将组织用甲基蓝染色以增加颜色对比度并且促进组织表面的映射。两个不连续的区域处于热图1650的蓝色范围内,表明这些区域为非常薄的“凹陷(dimple)”,大约为20μm厚。该构建体平均100μm厚。依据小凹陷,数据显示出高度均匀、平坦和平滑的表面形态。
实施例6-用不同浓度的原代肾上皮细胞制备的三维肾小管模型
将包含50:50比例的成纤维细胞与内皮细胞的间质层生物打印到24孔板的每个孔中。在存在(图17b,c和d)或不存在(图17a)含有2%fbs的培养基的情况下,将构建体与1.25×105(图17a和b)、2.5×105(图17c)或5.0×105(图17d)个rptec细胞一起孵育。组织学在第11天进行并h&e染色。
实施例7-使用肾小管模型的毒性测定
为了确定肾小管模型在体外毒性测定中的适用性,使用常见的细胞毒性剂两性霉素b、顺铂和tgfβ进行实验(图18-图23)。根据前述实施例的方法打印肾小管模型。
图18显示了通过alamarblue测定在包含间质组织和上皮组织层的生物打印的3d肾小管模型中(圆圈)、htertrptec的标准2d共培养物(正方形)中;和单独的间质组织(三角形)中的两性霉素b(ampb)毒性。单独的间质组织对ampb处理具有抗性,而3d肾小管模型显示剂量依赖性细胞毒性。
3d肾小管模型显示ampb对上皮细胞功能的剂量抑制。图19a显示作为来自用不同浓度的ampb处理的3d肾小管模型的细胞毒性指标的乳酸脱氢酶(ldh)释放的时间过程。低剂量的ampb导致在第3天ldh释放升高,而高剂量导致在第1天释放高水平的ampb。图19b显示响应于ampb处理的ggt活性的剂量依赖性降低。图20描绘了来自图19b的3d肾小管模型的组织学,其示出与未处理的对照相比(图20a),10μm(图20b)和50μm(图20c)的ampb的上皮特异性细胞死亡。
3d肾小管模型显示顺铂对上皮细胞功能的剂量依赖性抑制。图21a显示通过alamarblue测定在3d肾管模型中增加的细胞毒性。图21b显示ggt活性的剂量依赖性降低。图21c显示在第3天用50μm顺铂处理的肾小管模型和在第5天用10μm顺铂处理的肾小管模型的ldh释放增加。图22显示用载体(图22a)、10μm顺铂(图22b)、50μm顺铂(图22c)和50ng/mltgfp(图22d)处理的肾小管模型的masson三色染色。特别是,用tgfp处理显示纤维化增加而没有顺铂处理组织的明显细胞死亡。
图23显示了汇集自比较包含原代细胞(070615-rptec)的上皮层与包含永生化细胞系(htert-rptec)的上皮层的作用的实验的数据。通过alamarblue测定(图23a)、ggt活性(图23b)和ldh释放(图23c),两种类型的细胞表现出用顺铂处理后的毒性剂量依赖性增加。值得注意的是,原代细胞在ggt测定中显示对顺铂的敏感性增加。
实施例8-打印表面对组织形态的影响
实施例8描述了仅用水凝胶边缘novogel3.0生成的生物打印小管组织;当使用0.4μm孔径的transwell插入物作为培养表面时,需要该边缘或novogel1.0堑(moat)以促进组织附着到transwell膜。在不同的表面上制备50:50肾成纤维细胞比huvec的小管模型的生物打印肾间质部分,并评估其与transwell膜的附着。图24a显示生物打印组织在没有边缘或堑的情况下在培养3天后漂浮。为了评估完整的屏障和转运蛋白功能,需要覆盖整个培养物表面的组织。为了促进生物打印的小管组织的附着和长出(outgrowth)并且改善生物打印小管模型的表面积覆盖率,期望使用在没有边缘或堑的情况下激励组织附着的培养表面。如图24b所示,优选实施方案的生物打印肾间质组织(50:50肾成纤维细胞比huvec)在没有任何堑或水凝胶边缘的情况下在1μm孔径的膜上附着和铺展。
实施例9-培养中肾小管模型的长期活力
本公开的3d肾小管模型的一个优点是在培养中是持续存活的。在许多情况下,活力比正常的2d培养物或组织外植体的活力持续长得多的时间。图25显示在培养6天(图25a)、10天(图25b)和27天(图25c)的3d肾小管模型。
虽然本文已经示出和描述了本发明的优选实施方案,但是对于本领域技术人员显而易见的是,这些实施方案仅以示例的方式提供。在不脱离本发明的情况下,本领域技术人员将会想到许多变化、更改和替换。应当理解的是,本文所述的本发明的实施方案的各种替代方案可用于实施本发明。
- 还没有人留言评论。精彩留言会获得点赞!