用于促进生长的短双歧杆菌CBTBR3菌株和用于促进生长的含有该菌株的营养组合物的制作方法
本发明概括而言涉及一种用于促进生长的短双歧杆菌(bifidobacteriumbreve)cbtbr3菌株以及用于促进生长的含有该菌株的营养组合物,并且更具体地涉及一种能够通过促进人乳的消化并合成维生素而促进新生儿、婴儿和成长儿童的生长的短双歧杆菌cbtbr3菌株,并且涉及一种用于促进生长的营养组合物,该营养组合物含有所述短双歧杆菌cbtbr3菌株。
背景技术:
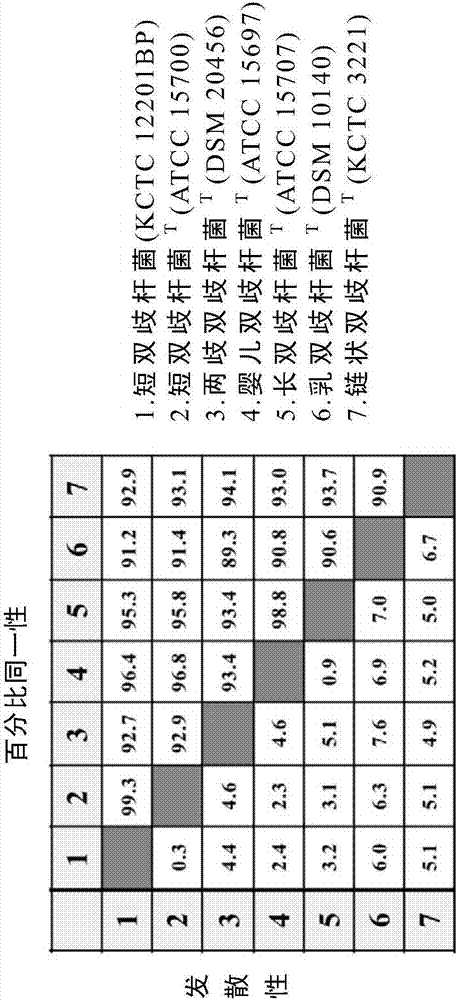
:人类生长发生在直到青春期的时期,其中大多数生长板仍然是开放的。生长在医学上可以被定义为伴随成熟的大小的变化,并且具体地,术语“儿童生长”意在不仅包括身高的增加,而且还包括身体的每个器官的大小和功能的增加。人们普遍认为人类的生长受遗传因素的影响最大。然而,事实上,遗传因素对人类生长的影响只有23%左右,其余77%由出生后因素决定。近年来,由于经济持续增长、西化饮食习惯、改善营养状况等,大大增加了儿童和青少年的生长和发育。另外,在社会氛围重视(其中外部外观和身高被认为是重要的)的情况下,生长越来越受到人们的关注。迄今为止,已知的促进生长的方法包括施用生长激素剂的方法。然而,使用生长激素非常昂贵并且可能引起不良作用,包括各种症状如注射部位的瘙痒、病发作、脂肪萎缩、高血压、葡萄糖不耐受、胰腺炎、全身过敏反应、生长激素抗体阳性反应、癌症发展和男性中的男性乳房发育。因此,迫切需要开发能够基本上有助于生长的安全且有效的食品材料。韩国专利no.0887377(名称为“婴儿和青少年的健康补充食品(healthsupplementfoodforbabiesandteenagers)”)、韩国专利no.10530211(名称为“用于改善学习能力的功能保健食品组合物及其制备方法(functionalhealthfoodcompositionforimprovinglearningabilityandpreparationmethodthereof)”)、韩国专利no.0561286(名称为“用于促进生长发育的含有干酵母,天然提取物粉末和营养成分混合粉末的健康功能组合物(healthfunctionalcompositionforpromotionofgrowthanddevelopmentcontainingdriedyeast,naturalextractpowderandmixedpowderofnutritivecomponents)”)等提议了用于促进生长的食物。然而,这些食物对生长促进的效果不充分。技术实现要素:技术问题本发明人进行了广泛的努力以发现具有优异的生长促进效果的益生菌,并因此在实验上发现了短双歧杆菌cbtbr3菌株作为生长促进产品的适用性,由此完成了本发明。本发明的一个目的是提供一种短双歧杆菌cbtbr3菌株,其适用于促进新生儿、婴儿、幼儿和成长儿童的生长。本发明的另一个目的是提供一种营养组合物,其通过促进人乳寡糖的消化、促进维生素合成和抑制有害细菌的增殖而能够促进婴儿、儿童和青少年的生长。技术方案为了实现上述目的,本发明的一个方面涉及提供用于促进生长的短双歧杆菌cbtbr3双歧杆菌,其国际保藏于韩国生物科学和生物技术研究所的韩国典型培养物保藏中心(kctc),保藏号为kctc12201bp。本发明的另一方面涉及提供能够促进婴儿、儿童和青少年生长的营养组合物,其含有本发明的短双歧杆菌cbtbr3菌株。有益效果本发明的短双歧杆菌cbtbr3菌株通过消化和供应人乳寡糖而展示出优异的生长促进作用,所述人乳寡糖难以在工业上大量产生并且不被人类酶消化,其也促进维生素生物合成、抑制有害肠细菌的增殖和调节免疫系统。根据本发明所述的促进生长的营养组合物通过激活代谢平衡和调节免疫系统而可以促进新生儿、婴儿、儿童和青少年的生长和发育,并且其还可以促进大脑发育。另外,根据本发明所述的促进生长的营养组合物可以减轻生长迟缓、发育迟缓、体力降低和低体重。附图说明图1a显示了根据本发明所述的短双歧杆菌cbtbr3菌株(kctc12201bp)的16srrna序列;图1b和图1c显示了本发明的短双歧杆菌cbtbr3菌株与相关物种之间的16srrna序列同源性和系统发育关系的比较;图2显示了根据本发明所述的短双歧杆菌cbtbr3菌株的基因组dna的rapd(随机扩增多态性dna)分析的结果;图3显示了根据本发明所述的短双歧杆菌cbtbr3菌株(kctc12201bp)的基因组dna的pfge(脉冲场凝胶电泳)分析的结果;图4显示了分析根据本发明所述的短双歧杆菌cbtbr3菌株(kctc12201bp)的溶血活性的结果;图5显示了本发明的短双歧杆菌cbtbr3菌株和相关的双歧杆菌属物种的系统发育树;图6显示了根据本发明所述的短双歧杆菌cbtbr3菌株的人乳低聚糖代谢相关基因的数量;和图7是表示本发明的短双歧杆菌cbtbr3菌株对小鼠生长的生长促进效果的图谱。具体实施方式在下文中,将更详细地描述本发明。本发明的一个方面涉及短双歧杆菌cbtbr3双歧杆菌,其具有优异的生长促进效果,并且国际保藏于韩国生物科学和生物技术研究所的韩国典型培养物保藏中心(kctc),保藏号为kctc12201bp。根据本发明所述的短双歧杆菌cbtbr3菌株可以通过消化人乳寡糖(hmos)——所述人乳寡糖由于结构非常复杂而不被人类酶消化并且难以大量工业化生产——并且通过向接受该菌株的婴儿或幼儿供应人乳寡糖来促进生长。已知人乳含有200种以上具有有用功能的寡糖。已知人乳低聚糖促进有益肠微生物菌群的增殖和繁殖、抑制有害细菌的增殖、作为细胞反应的调节剂、调节免疫系统,并且通过提供作为新生儿和婴儿脑部生长发育所必需成分的脑活动能量而有助于新生儿和婴儿的大脑发育。人乳寡糖在上胃肠道和小肠中具有抗酶消化的能力,并因此到达结肠而不被损坏并且在结肠中用作发酵的底物。据认为,人乳含有几种因子,其促进抑制病原微生物增殖的有益肠微生物菌群的增殖。一种使得人乳寡糖能够增加有益细菌的数量并减少潜在病原菌的数量的方法,其通过竞争细胞表面受体、竞争必需营养素、产生抗菌剂、以及产生抑制化合物如单链脂肪酸(scfas)而发生,所述单链脂肪酸可以降低排泄物的ph并抑制潜在的病原菌。人乳寡糖被发酵以产生scfas,例如乙酸、丙酸和丁酸。据认为,这种scfas有助于卡路里、作为肠上皮的主要能量来源、刺激结肠中的钠和水的吸收、并且增强小肠中的消化和吸收。另外,scfas通过调节胃肠道发育和免疫功能来促进一般胃肠道健康。人乳寡糖(hmos)由各种寡糖组成,主要有五种单糖:d-葡萄糖(glc)、d-半乳糖(gal)、n-乙酰氨基葡萄糖(glcnac)、l-岩藻糖(fuc)和唾液酸(sia;n-乙酰神经氨酸[neu5ac])。根据本发明所述的短双歧杆菌cbtbr3菌株的基因组包括编码消化人乳寡糖(hmos)的酶的各种基因。根据本发明所述的短双歧杆菌cbtbr3菌株的基因组包括编码α-甘露糖苷酶、β-甘露糖苷酶、内切-β-n-乙酰葡糖胺糖苷酶、唾液酸酶和α-岩藻糖苷酶的基因。根据本发明所述的短双歧杆菌cbtbr3菌株包括编码脱乙酰基酶、糖苷水解酶,家族1、β-葡糖苷酶、β-1,3-外切葡聚糖酶、耐热性β-葡糖苷酶b、d-阿卢糖-6-磷酸酯3-差向异构酶、唾液酸酶a、udp-n-乙酰氨基葡萄糖二磷酸化酶、1,6-α-葡糖苷酶、核苷-二磷酸-糖差向异构酶和淀粉-α-1,6-葡糖苷酶的基因。另外,根据本发明所述的短双歧杆菌cbtbr3菌株的基因组具有合成维生素(特别是b族维生素)的基因。在根据本发明所述的短双歧杆菌cbtbr3菌株的基因组中,存在能够合成两种维生素的基因。从分支酸可以合成叶酸(b9),并且从l-天冬氨酸合成烟酸(b3)。如图7所示的,根据本发明所述的短双歧杆菌cbtbr3菌株具有用于细菌素生物合成的基因。根据本发明的另一方面,本发明的短双歧杆菌cbtbr3菌株可用作益生菌双歧杆菌或可用于各种乳制品和其他发酵产物中。本发明的另一方面涉及用于促进生长的营养组合物,其含有本发明的短双歧杆菌cbtbr3菌株。目前,人乳寡糖(hmos)不能大量生产也不可商购,因此不被包含在大多数配方奶或配方食品中。虽然人乳寡糖(hmos)是婴儿的必需营养源,但是这些寡糖不被人类酶消化,并且如果这些寡糖不被消化,则被作为粪便排泄出。根据本发明所述的促进生长的营养组合物可以通过消化和供应人乳寡糖来促进新生儿和婴儿的大脑发育和生长。食品组合物是食品、营养品、补充剂、益生菌或共生体。本文使用的术语“益生菌”是指当以合适量提供时有益于宿主生物体健康的活微生物。本文使用的术语“共生体”是指含有益生元(prebiotic)和益生菌的混合物的食品。在一些实施方式中,除了短双歧杆菌cbtbr3菌株之外,本发明的组合物还可以含有一种或多种乳酸菌或双歧杆菌菌株,它们选自于由唾液乳杆菌(lactobacillussalivarius)、短乳杆菌(lactobacillusbrevis)、瑞士乳杆菌(lactobacillushelveticus)、发酵乳杆菌(lactobacillusfermentum)、副干酪乳杆菌(lactobacillusparacasei)、干酪乳杆菌(lactobacilluscasei)、德氏乳杆菌(lactobacillusdelbrueckii)、罗伊氏乳杆菌(lactobacillusreuteri)、布氏乳杆菌(lactobacillusbuchneri)、加氏乳杆菌(lactobacillusgasseri)、约氏乳杆菌(lactobacillusjohonsonii)、高加索酸奶乳杆菌(lactobacilluskefir)、乳酸乳球菌(lactococcuslactis)、两歧双歧杆菌(bifidobacteriumbifidum)、假长双歧杆菌(bifidobacteriumpseudolongum)、嗜热双歧杆菌(bifidobacteriumthemophilum)和青春双歧杆菌(bifidobacteriumadolescentis)组成的组。根据本发明所述的短双歧杆菌cbtbr3菌株可以通过在通常用于双歧杆菌培养的培养基中培养而增殖,并且可以从培养物中回收。培养后得到的培养物可以原封不动地使用,如果需要,可以进行使用离心的粗纯化和/或进行使用过滤或灭菌操作的固液分离。优选地,仅通过离心回收双歧杆菌细胞。此外,用于本发明的双歧杆菌可以是湿细胞或干细胞。例如,可以通过冻干将双歧杆菌配制为益生菌并在该状态下使用。除了短双歧杆菌cbtbr3菌株外,本发明的组合物还可以含有常规载体或赋形剂。另外,本发明的组合物可以与各种添加剂诸如粘合剂、崩解剂、包衣剂、润滑剂等一起配制。本发明的组合物可以通过将短双歧杆菌cbtbr3菌株与合适的载体、赋形剂、其它活性成分等混合而配制为粉末、颗粒、片剂或液体的形式。此外,本发明的菌株可以使用已知的方法进行肠溶包衣,使得活性成分双歧杆菌在通过胃肠道后到达结肠,并且将在肠中快速释放。可用于本发明的赋形剂包括糖类如蔗糖、乳糖、甘露糖醇或葡萄糖,以及淀粉如玉米淀粉、马铃薯淀粉或部分预胶化淀粉。可用于本发明的粘合剂包括多糖,诸如糊精、海藻酸钠、角叉菜胶、瓜尔胶、阿拉伯树胶、琼脂等;天然存在的大分子物质,诸如黄蓍胶、明胶、谷蛋白等;纤维素衍生物,诸如羟丙基纤维素、甲基纤维素、羟丙基甲基纤维素、乙基纤维素、羟丙基乙基纤维素、羧甲基纤维素等;和聚合物,诸如聚乙烯吡咯烷酮、聚乙烯醇、聚乙酸乙烯酯、聚乙二醇、聚丙烯酸、聚甲基丙烯酸和乙酸乙烯酯树脂。可用于本发明的崩解剂包括纤维素衍生物,诸如羧甲基纤维素、羧甲基纤维素钙、低取代羟丙基纤维素等;和淀粉,诸如羧甲基淀粉钠、羟丙基淀粉、玉米淀粉、马铃薯淀粉、米淀粉和部分预胶化淀粉。可用于本发明的润滑剂的实例包括滑石粉、硬脂酸、硬脂酸钙、硬脂酸镁、胶体二氧化硅、含水二氧化硅、各种蜡和油等。可用于本发明的包衣剂包括水不溶性聚合物,诸如甲基丙烯酸二甲氨基乙酯-甲基丙烯酸共聚物、聚乙烯缩乙醛二乙基氨基乙酸酯、丙烯酸乙酯-甲基丙烯酸共聚物、丙烯酸乙酯-甲基丙烯酸甲酯-甲基丙烯酸氯代三甲基铵乙基酯共聚物、乙基纤维素等;肠溶聚合物,诸如甲基丙烯酸-丙烯酸乙酯共聚物、羟丙基甲基纤维素邻苯二甲酸酯、羟丙基甲基纤维素乙酸琥珀酸酯等;和水溶性聚合物,诸如甲基纤维素、羟丙基甲基纤维素、聚乙烯吡咯烷酮、聚乙二醇等,但不必限于此。根据本发明所述的促进生长用的组合物中,活性成分短双歧杆菌cbtbr3菌株的含量可以根据受试者的体重、年龄或性别来适当确定。例如,本发明的组合物相对于该组合物的总重量以营养有效浓度含有作为活性成分的短双歧杆菌cbtbr3菌株。优选地,所述组合物含有量为108~1012cfu/g的短双歧杆菌cbtbr3菌株或含有具有相同数量活细菌的培养物产品。通常,对于成人,可以根据需要施用一次或多次1×106个以上活细菌,优选1×108至1×1012个活细菌。在另一方面,根据本发明所述的用于促进生长的营养组合物可以进一步包含从由长双歧杆菌bv.婴儿bt1(kctc11859bp)、两歧双歧杆菌bf3(kctc12199bp)和长双歧杆菌bg7(kctc12200bp)组成的组中选择的一种或多种其它益生元。该组合物可以以相同的百分比含有每种双歧杆菌菌株。在下文中,将参考实施例描述本发明。然而,应当理解的是,这些实施例仅用于说明性目的,而不意图限制本发明的范围。实施例实施例1:短双歧杆菌cbtbr3菌株的分离和鉴定1-1:菌株的选择将1g人粪便连续稀释在无菌无氧水中,并将1ml每种稀释液倒在man-rogosa-sharpe(mrs.bd.usa)固体培养基上,并在厌氧条件下培养3天。将产生的菌落转移到通过将bcp(溴甲酚紫,0.17g/l)加入到mrs中获得的乳酸菌选择培养基(bl固体培养基),然后在相同条件下培养3天。当乳酸菌形成乳酸以降低周围的ph时,bcp指示剂从紫色变为黄色。选择周围的颜色变为黄色的菌落,然后对所选择的菌落进行生物化学和分子生物学鉴定。此后,选择具有最佳功能和稳定性的一种菌株。1-2:选定菌株的鉴定1)使用api试剂盒的生化鉴定为了检查所选择的菌株的糖利用,使用了api50chl碳水化合物检测试剂盒(biomerieuxco.,france)。将菌株在10mlmrs(man-rogosa-sharpe)液体培养基中在37℃培养17小时,然后回收1ml培养物并用chl溶液洗涤两次。接着,通过离心(micro-17,hanil,korea)收集细胞,并重悬于9mlchl溶液中。将150μl菌株悬浮液置于api50chl试剂盒的每个孔中,然后将高压灭菌的石蜡油分配到每个孔中的菌株悬浮液上。在37℃下培养3天后,分析每种糖的利用。通过观察颜色是否被微生物增殖而改变,确定菌株是否利用49种碳源中的每一种。使用用于鉴定的程序api网络对鉴定结果进行分析,并且分析的结果示于下表1和2中:表1表22)通过16srrna基因测序的鉴定从分离的菌株中提取基因组dna并进行16srrna测序。通过使用accuprep基因组提取试剂盒(bioneer,korea)从1ml菌株(从粪便中分离)的纯培养物中提取基因组dna。以提取的dna为模板,使用引物f(5’-aaggaggtgatccagcc-3’)3和引物r(5’-aaggaggtgatccagcc-3’)3,通过pcr(mycycler,bio-rad,usa)扩增16srrna区域。将pcr产物连接到pgem-teasy载体(promega,usa)上并且转化到大肠杆菌dh5α菌株中,之后将其接种在lb/x-gal/amp平板上,并在37℃下培养过夜。通过筛选从转化体中分离含有插入片段的重组质粒,随后进行dna测序。在dna测序中,使用dna星程序的簇v方法,分析所分离菌株与短双歧杆菌t(atcc15700)的同源性。如图1所示,分离菌株的16srrna序列显示出与短双歧杆菌t(atcc15700)99.3%的同源性。3)通过rapd(随机扩增多态性dna)的dna指纹分析为了rapd分析,从分离自粪便的菌株中提取基因组dna。使用分离的dna作为模板,使用(gtg)5(5’-gtggtggtggtggtg-3’)引物进行pcr-rapd(mycycler,bio-rad,usa)。使用etbr(溴化乙锭)将所得pcr产物染色,然后使用g:box(syngene,uk)观察。从图2中可以看出,rapd的结果表明,分离的菌株显示出与短双歧杆菌t(atcc15700)不同的条带模式。因此,从上述结果发现,从粪便中分离的菌株是与短双歧杆菌t(atcc15700)不同的菌株。在图2中,泳道1表示短双歧杆菌t(atcc15700)的结果,且泳道2表示短双歧杆菌cbtbr3菌株(kctc12201bp)的结果。4)通过pfge(脉冲场凝胶电泳)的dna指纹分析测量了纯培养在mrs肉汤中的短双歧杆菌cbtbr3和短双歧杆菌t(atcc15700)各自的o.d.(光学密度),然后使用2%低熔点琼脂糖将各个菌种调节至最终的o.d.,o.d600=4,从而构成胶块(plug)。将构建的胶块置于1ml溶菌酶缓冲液(2mg/ml溶菌酶(sigma),0.05%n-十二烷基肌氨酸(sigma))中,并向其中加入10μl4mg/ml溶葡萄球菌素(sigma),随后在37℃温育过夜。小心地取出胶块并且加入到4mlnds缓冲液(1ml1mtris-hcl(ph=8.0),10ml100%sds,89ml0.5medta(ph=8.5))中,随后在50℃温育过夜。接下来,轻微振荡,用10ml50mmedta(ph8.5)将胶块洗涤6次,然后小心地转移到400μl待处理的酶缓冲液中,随后在室温下温育30分钟。将胶块转移到400μl新鲜的酶缓冲液中并且向其中加入限制酶(20u),随后在37℃温育过夜。作为限制酶,使用noti。使用chef系统(bio-rad,usa)在0.5xtbe中以5.3cm/v和脉冲时间1s至15s进行电泳20小时。电泳完成后,每个胶块用etbr溶液染色,并用g:box(syngene,uk)观察其带状图案。使用noti进行的pfge的结果表明,从粪便中分离的短双歧杆菌cbtbr3菌株是新菌株,其显示出与短双歧杆菌t(atcc15700)不同的带状图案。在图3中,泳道1表示短双歧杆菌t(atcc15700)的结果,且泳道2表示短双歧杆菌cbtbr3菌株(kctc12201bp)的结果。5)其他真菌学特征根据本发明所述的短双歧杆菌cbtbr3菌株的特征如下:表3基于上述结果,将分离的菌株命名为“短双歧杆菌cbtbr3”菌株,于2012年5月7日保藏于韩国典型培养物保藏中心(kctc),该保藏中心是国际保藏机构,保藏号为kctc12201bp。1-3:功能性和稳定性1)抗生素耐药性试验为了验证分离的短双歧杆菌cbtbr3菌株(kctc12201bp)的安全性,分析了分离菌株的抗生素耐药性。抗生素耐药性测试使用由欧洲食品安全局(efsa)推荐的微量稀释法进行,并且在测试中使用10种抗生素,包括氨苄青霉素(amp)、万古霉素(van)、庆大霉素(gen)、卡那霉素(kan)、链霉素(stm)、红霉素(erm)、奎奴普丁/达福普汀(q/d)、克林霉素(clm),四环素(tet)和氯霉素(cp)。对于不包括克林霉素的抗生素,将每种抗生素以256、128、64、32、16、8、4、2、1、0.5μg/ml的浓度加入到10%iso-敏检肉汤和90%mrs肉汤的混合物中。克林霉素以16、8、4、2、1、0.5、0.25、0.125、0.0625和0.03125μg/ml的浓度添加,因为乳杆菌群的efsa转效点值为0.25μg/ml或更少。此外,使用e测试条(biomeriux)进行奎奴普丁/达福普汀(q/d)的测试。将微板在37℃下在厌氧条件下温育48小时,然后测量mic作为没有观察到可见生长的最小抗生素浓度。分析短双歧杆菌cbtbr3是否对每种抗生素具有耐药性,并且分析的结果示于下表4中:表4显示出分离的短双歧杆菌cbtbr3菌株对所有在测试中使用的抗生素的耐药性均低于efsa抗生素耐药性标准,表明分离的菌株满足efsa抗生素的稳定性标准。由于据报道双歧杆菌因为不存在细胞色素介导的药物转运系统而对氨基糖苷类如卡那霉素具有耐药性,所以efsa不要求双歧杆菌的药物的mic值。2)肠道定殖测试在来自人结肠上皮细胞的ht-29细胞系中进行了短双歧杆菌cbtbr3的肠道定殖的测量,同时将短双歧杆菌t(atcc15700)用作对照。将ht-29细胞系用每种菌株处理1小时,并进行革兰氏染色和活细胞计数以比较菌株之间的肠道定殖能力。测量结果示于下表5中:表5短双歧杆菌cbtbr3短双歧杆菌t肠道定殖率(%)91.2577.24肠道定殖的测量结果表明,短双歧杆菌cbtbr3菌株与短双歧杆菌t(atcc15700)菌株相比显示出优异的肠道定殖能力。这些结果表明本发明的菌株可以附着于肠上皮细胞以改善肠环境。3)溶血测试进行溶血测试以证实双歧杆菌在人体中没有溶血毒性,并且在本发明中,检查红细胞是否被破坏或降解(溶血)。根据baumgartneretal.的方法,测试菌株在5%马血补充的mrs培养基中生长,并在37℃下在厌氧条件下温育48小时。根据在细胞周围是否产生透明环来确定菌株是否溶血。图4显示了检查本发明的菌株是否是溶血性的结果。从图4可以看出,短双歧杆菌cbtbr3菌株对马血没有溶血作用,表明该菌株对人体无害。4)急性毒性测试为了验证本发明的短双歧杆菌cbtbr3菌株的安全性,对试验动物进行急性毒性测试。以1.0×1011cfu/kg的量将本发明的冻干菌株口服施用于6周龄的雄性和雌性sprague-dawley(sd)大鼠。对于对照组,胃内施用0.85%盐水。每天观察一次所有试验动物中的临床症状,持续14天(从样品施用后1天到解剖日期的一段时间)。观察结果示于下表5中。施用短双歧杆菌cbtbr3菌株后,在所有对照组和施用组中均未观察到死亡,并且没有发现显示特定临床症状的动物。另外,在施用后14天观察饲料和水的摄取和体温,结果未发现施用组和对照组之间统计学上的显著性差异。表6实施例2:短双歧杆菌cbtbr3菌株的基因分析使用pacbiorsii系统(dnalink,republicofkorea)进行短双歧杆菌cbtbr3菌株(kctc12201bp)的基因组测序。对于菌株的基因组,构建10-kb文库,并使用具有c2-p4化学的smrt细胞之一进行基因组测序。通过基因组测序,获得长度为337,655,282bp的序列。使用smrtpipehgap进行从头装配,并使用smrtpipeaha进行支架和间隙填充。使用glimmer3进行结构基因的预测,并使用通过blastp获得的用于pfam、uniref100、kegg、cog和genbanknr数据库的结果,通过autofact(koskietal.2005)进行基因注释。分别使用trnascan-se(lowe和eddy1997)和rnammer(lagesenetal.2007)进行转运rna和核糖体rna。使用rps-blast在小于1e-2的e值截止值下进行直系同源群组(cog)类别的成簇对基因的功能分类(mavromatisetal.2009).对于收集的数据集,使用blastp以序列同源性≥50%的参数确定基因组上特定基因的存在。使用kegg自动注释服务器进行基因组的代谢路径分析(moriyaetal.2007)。使用antismash版本3.0.0进行次生代谢物生物合成基因的分析(blinetal.2013;blinetal.2014)(http://antismash.secondarymetabolites.org/)。2-1:hmo(人乳寡糖)代谢相关基因分析了根据本发明所述的短双歧杆菌cbtbr3菌株的基因组的基因内容。结果,发现菌株的基因组含有人乳寡糖代谢相关基因中编码α-甘露糖苷酶、β-甘露糖苷酶、内桥-β-n-乙酰葡糖胺糖苷酶、唾液酸酶和α-岩藻糖苷酶的基因。这表明本发明的菌株可以消化和供应不被人酶消化的人乳寡糖。表7菌株酶登录号短双歧杆菌cbtbr3β-半乳糖苷酶ry69_1497短双歧杆菌cbtbr3β-半乳糖苷酶ry69_1608短双歧杆菌cbtbr3β-半乳糖苷酶ry69_2157短双歧杆菌cbtbr3α-甘露糖苷酶ry69_689短双歧杆菌cbtbr3α-甘露糖苷酶ry69_690短双歧杆菌cbtbr3唾液酸酶ry69_1874短双歧杆菌cbtbr3α-岩藻糖苷酶ry69_5182-2维生素生物合成基因基因分析结果表明,本发明的短双歧杆菌cbtbr3菌株具有用于生物合成维生素(特别是b族维生素)的所有基因。在本发明的短双歧杆菌cbtbr3菌株的基因组中,存在能够合成两种维生素的基因。发现菌株的基因组具有从分支酸合成叶酸(b9)和从l-天冬氨酸合成烟酸(b3)的基因。表8下表9比较了与本发明相关的菌株的维生素生物合成基因表9叶酸(b9)a叶酸(b9)b烟酸(b3)核黄素(b2)短双歧杆菌jcm7019-○○-短双歧杆菌cbtbr3-○○-短双歧杆菌jcm7017--○-短双歧杆菌ucc2003--○-短双歧杆菌12l--○-短双歧杆菌acs-071-v-sch8b-○○-短双歧杆菌689b--○-短双歧杆菌ncfb2258-○○-短双歧杆菌s27--○-2-3:缺乏致病基因使用pai数据库的pai查找器进行pai(致病性岛)和rei(抗菌性抗性岛)的分析(yoonetal.2007;yoonetal.2015)。分析结果表明,本发明的短双歧杆菌cbtbr3菌株的基因组中不存在pai(致病性岛)和pai样区域。实施例3:短双歧杆菌cbtbr3菌株的生长促进效果下面的实施例说明了本发明的菌株的特征和生长促进效果。在实施例中获得的所有实验结果均表示为平均值±sd,并使用graphpadprismtm6.0进行实验结果的统计处理。此外,通过单因素anova确定测试组之间平均值差异的显著性,然后使用tukey的多范围测试进行posthoc测试。3-1:本发明的菌株的培养物和包含其的组合物的制备在37℃下将短双歧杆菌cbtbr3菌株(kctc12201bp)在bl肉汤(bddiagnostics,sparks,md)中培养24小时,并且在磷酸盐缓冲盐水(pbs,10mm磷酸钠,130mm氯化钠,ph7.4)中稀释至1011cfu/ml。将稀释物超声处理并离心以分离上清液,随后通过孔径为0.45μm的过滤器过滤。将滤液冷冻干燥,然后储存在-20℃下直到用于体内实验。3-2:肥胖动物模型和取样根据机构动物护理和使用委员会(iacuc)的动物使用和护理方案进行动物试验。作为试验动物,使购自saeronbioinc.(uiwang,korea)的6周龄sd大鼠(每组10只,由5只雄性大鼠和5只雌性大鼠组成)适应24小时。然后,在24±2℃的温度和55±15%的湿度下,以12小时光/12小时黑暗循环,将大鼠养育17天。对于基本饮食,允许大鼠服用大麦饲料(a04,uar,vilemoisson-sur-orge,france)17天,并还允许自由地饮用单独的饮用水或饮用含有短双歧杆菌cbtbr3(107cfu/头/天)的饮用水。3-3:本发明菌株的生长促进效果为了观察本发明的短双歧杆菌cbtbr3菌株的生长促进效果,用大麦饲料喂养大鼠17天以诱导基本饮食,并且每天测量体重以及饮用水和饲料的摄入量直到实验开始后的第17天。通过从测量当天的体重减去实验开始日的体重来计算体重的增加。通过测量每笼的摄入量,然后计算每只大鼠的摄入量,计算饮用水和饲料中每一种的摄入量,作为直到第17天的总摄入量。通过将体重的增加除以饲料的总摄入量来计算体重增加的效率。观察到,在喂养含有短双歧杆菌cbtbr3的饮用水的组(cbtbr3)的情况下,与正常喂养普通食用水的组(nc)相比,体重自第12天显著增加(12天;p<0.05,13至17天;p<0.01)(图7(a))。然而,17天的饲料总摄入量(fi)和17天的饮用水的总摄入量(wi)在两组之间没有显着差异(图7(b))。可以看出,施用本发明的菌株不影响采食量,并且体重增加(wg)不能归因于采食量(fi)的差异。与正常组相比,短双歧杆菌cbtbr3喂养组中的体重增加与体重增加的比值(wg/fi)更显著,表明通过施用本发明的短双歧杆菌cbtbr3菌株促进了大鼠的生长。已经以本发明的优选实施方式为重点描述了本发明。具有本发明所属领域普通知识的人员能够理解,在不脱离本发明的本质特征的情况下,本发明可以以各种修改或改变的形式实施。因此,本发明的真正保护范围应当由所附权利要求及其等同范围来限定,而不是由上述实施方式限定。关于国际承认用于专利程序的微生物保藏的布达佩斯条约国际保藏机构根据细则第7.1条出具的原始保藏的收据致:myung-jun,jung134,gaegok-ri,wolgot-myeon,gimpo-sigyeonggi-do415-872,republicofkorea关于国际承认用于专利程序的微生物保藏的布达佩斯条约根据细则第8.2条关于科学说明和/或建议的分类名称的后来载明或修正的证明致:myung-jun,jung134,gaegok-ri,wolgot-myeon,gimpo-sigyeonggi-do415-872,republicofkorea附件:根据细则第8.1条关于科学说明或分类名称的后来载明或修正的通信。关于国际承认用于专利程序的微生物保藏的布达佩斯条约国际保藏机构根据细则第7.1条出具的原始保藏的收据致:myung-jun,jung134,gaegok-ri,wolgot-myeon,gimpo-si,gyeonggi-do415-872,republicofkorea关于国际承认用于专利程序的微生物保藏的布达佩斯条约根据细则第8.2条关于科学说明和/或建议的分类名称的后来载明或修正的证明致:myung-jun,jung134,gaegok-ri,wolgot-myeon,gimpo-sigyeonggi-do415-872,republicofkorea附件:根据细则第8.1条关于科学说明或分类名称的后来载明或修正的通信。关于国际承认用于专利程序的微生物保藏的布达佩斯条约国际保藏机构根据细则第7.1条出具的原始保藏的收据致:myung-jun,jung134,gaegok-ri,wolgot-myeon,gimpo-sigyeonggi-do415-872,republicofkorea关于国际承认用于专利程序的微生物保藏的布达佩斯条约根据细则第8.2条关于科学说明和/或建议的分类名称的后来载明或修正的证明致:myung-jun,jung134,gaegok-ri,wolgot-myeon,gimpo-sigyeonggi-do415-872,republicofkorea附件:根据细则第8.1条关于科学说明和/或分类名称的后来载明或修正的通信。关于国际承认用于专利程序的微生物保藏的布达佩斯条约国际保藏机构根据细则第7.1条出具的原始保藏的收据致:myung-jun,jung134,gaegok-ri,wolgot-myeon,gimpo-sigyeonggi-do415-872,republicofkorea关于国际承认用于专利程序的微生物保藏的布达佩斯条约根据细则第8.2条关于科学说明和/或建议的分类名称的后来载明或修正的证明致:myung-jun,jung134,gaegok-ri,wolgot-myeon,gimpo-sigyeonggi-do415-872,republicofkorea附件:根据细则第8.1条关于科学说明和/或分类名称的后来载明或修正的通信。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1